Aciphex 10mg, 20mg Rabeprazole Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Aciphex 10mg e como é usado?
Aciphex 10mg é um medicamento de prescrição usado para tratar os sintomas da Doença do Refluxo Gastroesofágico (DRGE), Helicobacter Pylori e úlceras intestinais. Aciphex 10mg pode ser usado sozinho ou com outros medicamentos.
Aciphex é um inibidor da bomba de prótons.
Não se sabe se Aciphex 20mg comprimido de liberação retardada é seguro e eficaz em crianças menores de 12 anos de idade. Não se sabe se Aciphex 10mg comprimido de liberação retardada (polvilha) é seguro e eficaz em crianças menores de 1 ano de idade.
Quais são os possíveis efeitos colaterais do Aciphex 10mg?
Aciphex pode causar efeitos colaterais graves, incluindo:
- dor de estômago severa,
- diarreia sanguinolenta,
- dor súbita ou dificuldade em mover o quadril, punho ou costas,
- convulsão (convulsões),
- urinar menos do que o habitual,
- sangue na urina,
- inchaço,
- ganho de peso rápido,
- dores nas articulações,
- erupção cutânea nas bochechas ou braços agravada pela luz solar,
- tontura,
- frequência cardíaca rápida ou irregular,
- tremores ou movimentos musculares bruscos (tremores),
- sentindo-se nervoso,
- cãibras musculares ou espasmos nas mãos ou pés,
- tosse,
- dificuldade em engolir ou engasgar,
- dor de cabeça,
- fraqueza,
- contusões,
- sangramento incomum (sangramento nasal, gengivas),
- urina vermelha ou rosa,
- fluxo menstrual intenso,
- fezes com sangue ou alcatrão,
- tossir sangue ou vômito que parece borra de café,
- sangramento difícil de controlar,
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Aciphex incluem:
- dor de cabeça,
- náusea,
- vômito,
- diarréia,
- constipação,
- dor de estômago,
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Aciphex. Para mais informações, consulte seu médico ou farmacêutico.
DESCRIÇÃO
O ingrediente ativo dos comprimidos de liberação retardada ACIPHEX 20mg é o rabeprazol sódico, que é um inibidor da bomba de prótons. É um benzimidazol substituído conhecido quimicamente como sal de sódio 2-[[[4-(3metoxipropoxi)-3-metil-2-piridinil]-metil]sulfinil]-1H-benzimidazol. Tem uma fórmula empírica de C18H20N3NaO3S e um peso molecular de 381,42. O rabeprazol sódico é um sólido branco a levemente amarelado. É muito solúvel em água e metanol, livremente solúvel em etanol, clorofórmio e acetato de etila e insolúvel em éter e n-hexano. A estabilidade do rabeprazol sódico é função do pH; é rapidamente degradado em meio ácido e é mais estável em condições alcalinas. A figura estrutural é:
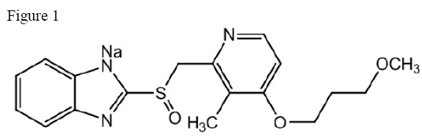
ACIPHEX está disponível para administração oral na forma de comprimidos com revestimento entérico de liberação retardada contendo 20 mg de rabeprazol sódico.
Os ingredientes inativos do comprimido de 20 mg são cera de carnaúba, crospovidona, monoglicerídeos diacetilados, etilcelulose, hidroxipropilcelulose, ftalato de hipromelose, estearato de magnésio, manitol, propilenoglicol, hidróxido de sódio, estearil fumarato de sódio, talco e dióxido de titânio. O óxido de ferro amarelo é o agente corante para o revestimento do comprimido. O óxido de ferro vermelho é o pigmento da tinta.
INDICAÇÕES
Cicatrização da DRGE erosiva ou ulcerativa em adultos
ACIPHEX 20mg comprimidos de liberação retardada é indicado para tratamento de curto prazo (4 a 8 semanas) na cicatrização e alívio sintomático da doença do refluxo gastroesofágico (DRGE) erosiva ou ulcerativa. Para aqueles pacientes que não cicatrizaram após 8 semanas de tratamento, um curso adicional de 8 semanas de ACIPHEX pode ser considerado.
Manutenção da cicatrização da DRGE erosiva ou ulcerativa em adultos
ACIPHEX comprimidos de liberação retardada é indicado para manter a cicatrização e reduzir as taxas de recaída dos sintomas de azia em pacientes com doença do refluxo gastroesofágico erosiva ou ulcerativa (manutenção da DRGE). Os estudos controlados não se estendem além de 12 meses.
Tratamento da DRGE sintomática em adultos
ACIPHEX 20mg comprimidos de liberação retardada é indicado para o tratamento da azia diurna e noturna e outros sintomas associados à DRGE em adultos por até 4 semanas.
Cicatrização de úlceras duodenais em adultos
ACIPHEX 20mg comprimidos de liberação retardada é indicado para tratamento de curto prazo (até quatro semanas) na cicatrização e alívio sintomático de úlceras duodenais. A maioria dos pacientes cura dentro de quatro semanas.
Erradicação do Helicobacter Pylori para reduzir o risco de recorrência de úlcera duodenal em adultos
ACIPHEX 10mg comprimidos de liberação retardada, em combinação com amoxicilina e claritromicina como esquema de três drogas, é indicado para o tratamento de pacientes com infecção por H. pylori e úlcera duodenal (ativo ou histórico nos últimos 5 anos) para erradicar o H. pylori . A erradicação do H. pylori demonstrou reduzir o risco de recorrência da úlcera duodenal.
Em pacientes que falham na terapia, o teste de suscetibilidade deve ser feito. Se a resistência à claritromicina for demonstrada ou o teste de sensibilidade não for possível, terapia antimicrobiana alternativa deve ser instituída [ver FARMACOLOGIA CLÍNICA e as informações completas de prescrição da claritromicina].
Tratamento de condições hipersecretórias patológicas, incluindo síndrome de Zollinger-Ellison em adultos
ACIPHEX comprimidos de liberação retardada é indicado para o tratamento a longo prazo de condições hipersecretoras patológicas, incluindo a síndrome de Zollinger-Ellison.
Tratamento da DRGE sintomática em pacientes adolescentes com idade igual ou superior a 12 anos
ACIPHEX 20mg comprimidos de liberação retardada é indicado para o tratamento da DRGE sintomática em adolescentes com idade igual ou superior a 12 anos por até 8 semanas.
DOSAGEM E ADMINISTRAÇÃO
A Tabela 1 mostra a dosagem recomendada de ACIPHEX comprimidos de liberação retardada em pacientes adultos e adolescentes com 12 anos de idade ou mais. O uso de ACIPHEX comprimidos de liberação retardada não é recomendado para uso em pacientes pediátricos de 1 ano a menos de 12 anos de idade porque a dosagem mais baixa disponível do comprimido (20 mg) excede a dose recomendada para esses pacientes. Use outra formulação de rabeprazol para pacientes pediátricos de 1 ano a menos de 12 anos de idade.
Instruções de administração
- Engula os comprimidos de liberação retardada ACIPHEX 20mg inteiros. Não mastigue, esmague ou divida os comprimidos.
- Para o tratamento de úlceras duodenais, tome ACIPHEX comprimidos de libertação retardada após uma refeição.
- Para a erradicação do Helicobacter pylori, tome ACIPHEX 20mg comprimidos de liberação retardada com alimentos.
- Para todas as outras indicações, os comprimidos de liberação retardada de ACIPHEX podem ser tomados com ou sem alimentos.
- Tome uma dose esquecida o mais rápido possível. Se estiver quase na hora da próxima dose, pule a dose esquecida e volte ao horário normal. Não tome duas doses ao mesmo tempo.
COMO FORNECIDO
Formas de dosagem e pontos fortes
Os comprimidos de liberação retardada ACIPHEX 10mg são fornecidos em uma dosagem, 20 mg. Os comprimidos são redondos, amarelos claros, com revestimento entérico, biconvexos. “ACIPHEX 20” está impresso em vermelho em um lado do comprimido.
Armazenamento e manuseio
ACIPHEX 20 mg é fornecido sob a forma de comprimidos com revestimento entérico amarelo claro de libertação retardada. O nome e a dosagem, em mg, (ACIPHEX 20) estão impressos em um lado.
Garrafas de 30 ( NDC 69784-243-30)
Armazenar a 25°C (77°F); excursões permitidas para 15-30°C (59-86°F) [ver Temperatura ambiente controlada USP ]. Proteger da umidade.
Distribuído pela Eisai Inc., Woodcliff Lake, NJ 07677. Revisado: março de 2022
EFEITOS COLATERAIS
As seguintes reações adversas graves estão descritas abaixo e em outras partes da bula:
- Nefrite Tubulointersticial Aguda [ver AVISOS E PRECAUÇÕES ]
- Diarreia Associada a Clostridium difficile [ver AVISOS E PRECAUÇÕES ]
- Fratura Óssea [ver AVISOS E PRECAUÇÕES ]
- Reações Adversas Cutâneas Graves [ver AVISOS E PRECAUÇÕES ]
- Lúpus Eritematoso Cutâneo e Sistêmico [ver AVISOS E PRECAUÇÕES ]
- Deficiência de cianocobalamina (vitamina B-12) [ver AVISOS E PRECAUÇÕES ]
- Hipomagnesemia e Metabolismo Mineral [ver AVISOS E PRECAUÇÕES ]
- Pólipos da glândula fúndica [ver AVISOS E PRECAUÇÕES ]
Experiência em Estudos Clínicos
Como os ensaios clínicos são conduzidos em condições variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser comparadas diretamente com as taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
Adultos
Os dados descritos abaixo refletem a exposição aos comprimidos de liberação retardada de ACIPHEX em 1.064 pacientes adultos expostos por até 8 semanas. Os estudos foram principalmente ensaios controlados por placebo e ativo em pacientes adultos com Doença do Refluxo Gastroesofágico Erosiva ou Ulcerativa (DRGE), Úlceras Duodenais e Úlceras Gástricas. A população tinha uma média de idade de 53 anos (variação de 18-89 anos) e uma proporção de aproximadamente 60% do sexo masculino: 40% do sexo feminino. A distribuição racial foi 86% caucasiana, 8% afro-americana, 2% asiática e 5% outras. A maioria dos pacientes recebeu 10 mg, 20 mg ou 40 mg por dia de comprimidos de liberação retardada ACIPHEX 20 mg.
Uma análise das reações adversas que aparecem em ≥2% dos pacientes tratados com ACIPHEX 10mg comprimidos de liberação retardada (n=1064) e com maior frequência do que placebo (n=89) em estudos controlados de tratamento agudo na América do Norte e na Europa, revelou o seguinte reações adversas: dor (3% vs. 1%), faringite (3% vs. 2%), flatulência (3% vs. 1%), infecção (2% vs. 1%) e constipação (2% vs. 1%).
Três estudos de manutenção de longo prazo consistiram em um total de 740 pacientes adultos; pelo menos 54% dos pacientes adultos foram expostos a ACIPHEX 20mg comprimidos de liberação retardada por 6 meses e pelo menos 33% foram expostos por 12 meses. Dos 740 pacientes adultos, 247 (33%) e 241 (33%) pacientes receberam 10 mg e 20 mg de ACIPHEX 20 mg comprimidos de liberação retardada, respectivamente, enquanto 169 (23%) pacientes receberam placebo e 83 (11%) receberam omeprazol.
O perfil de segurança do rabeprazol nos estudos de manutenção em adultos foi consistente com o observado nos estudos agudos.
As reações adversas menos comuns observadas em ensaios clínicos controlados (
Tratamento combinado com amoxicilina e claritromicina
Em ensaios clínicos usando terapia combinada com rabeprazol mais amoxicilina e claritromicina (RAC), não foram observadas reações adversas exclusivas a esta combinação de medicamentos. No estudo multicêntrico dos EUA, as reações adversas relacionadas a medicamentos relatadas com mais frequência para pacientes que receberam terapia RAC por 7 ou 10 dias foram diarreia (8% e 7%) e alteração do paladar (6% e 10%), respectivamente.
Não foram observadas anormalidades laboratoriais clinicamente significativas específicas para as combinações de drogas.
Para obter mais informações sobre reações adversas ou alterações laboratoriais com amoxicilina ou claritromicina, consulte suas respectivas informações de prescrição, seção Reações Adversas.
Pediatria
Em um estudo multicêntrico, aberto, com pacientes adolescentes de 12 a 16 anos de idade com diagnóstico clínico de DRGE sintomática ou DRGE comprovada por endoscopia, o perfil de eventos adversos foi semelhante ao dos adultos. As reações adversas relatadas independentemente da relação com ACIPHEX 20mg comprimidos de liberação retardada que ocorreram em ≥2% de 111 pacientes foram cefaleia (9,9%), diarreia (4,5%), náusea (4,5%), vômito (3,6%) e dor abdominal (3,6%). As reações adversas relatadas que ocorreram em ≥2% dos pacientes foram cefaleia (5,4%) e náusea (1,8%). Não houve reações adversas relatadas neste estudo que não tenham sido observadas anteriormente em adultos.
Experiência pós-marketing
As seguintes reações adversas foram identificadas durante o uso pós-aprovação de rabeprazol. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento:
Distúrbios do Sangue e do Sistema Linfático: agranulocitose, anemia hemolítica, leucopenia, pancitopenia, trombocitopenia
Distúrbios do ouvido e labirinto: vertigem
Distúrbios oculares: visão embaçada
Problemas gastrointestinais: pólipos de glândulas fúndicas
Distúrbios Gerais e Condições do Local de Administração: morte súbita
Distúrbios hepatobiliares: icterícia
Distúrbios do sistema imunológico: anafilaxia, angioedema, lúpus eritematoso sistêmico, síndrome de Stevens-Johnson, necrólise epidérmica tóxica (algumas fatais), DRESS, AGEP
Infecções e Infestações: Diarreia associada ao Clostridium difficile
Investigações: Aumentos no tempo de protrombina/INR (em pacientes tratados com varfarina concomitante), elevações de TSH
Distúrbios do Metabolismo e Nutrição: hiperamonemia, hipomagnesemia, hipocalcemia, hipocalemia [Advertências e precauções 5.8], hiponatremia
Distúrbios do sistema musculoesquelético: fratura óssea, rabdomiólise
Distúrbios do sistema nervoso: coma
Distúrbios psiquiátricos: delírio, desorientação
Distúrbios Renais e Urinários: nefrite intersticial
Distúrbios respiratórios, torácicos e mediastinais: pneumonia intersticial
Distúrbios da Pele e Tecidos Subcutâneos: reações dermatológicas graves, incluindo erupções cutâneas bolhosas e outras drogas, lúpus eritematoso cutâneo, eritema multiforme
INTERAÇÕES MEDICAMENTOSAS
A Tabela 2 inclui medicamentos com interações medicamentosas clinicamente importantes e interação com diagnóstico quando administrados concomitantemente com ACIPHEX 10mg comprimidos de liberação retardada e instruções para preveni-los ou administrá-los.
Consulte a bula dos medicamentos usados concomitantemente para obter mais informações sobre interações com IBPs.
AVISOS
Incluído como parte do PRECAUÇÕES seção.
PRECAUÇÕES
Presença de malignidade gástrica
Em adultos, a resposta sintomática à terapia com ACIPHEX 10mg não exclui a presença de malignidade gástrica. Considerar acompanhamento adicional e testes diagnósticos em pacientes adultos que tenham uma resposta abaixo do ideal ou uma recaída sintomática precoce após completar o tratamento com um IBP.
Interação com Varfarina
As interações de estado estacionário de rabeprazol e varfarina não foram adequadamente avaliadas em pacientes. Houve relatos de aumento do INR e do tempo de protrombina em pacientes recebendo concomitantemente um inibidor da bomba de prótons e varfarina. Aumentos no INR e no tempo de protrombina podem levar a sangramento anormal e até morte. Pacientes tratados concomitantemente com ACIPHEX 10mg comprimidos de liberação retardada e varfarina podem precisar ser monitorados quanto a aumentos no INR e no tempo de protrombina [ver INTERAÇÕES MEDICAMENTOSAS ].
Nefrite Tubulointersticial Aguda
A nefrite tubulointersticial aguda (TIN) foi observada em pacientes em uso de IBPs e pode ocorrer em qualquer momento durante a terapia com IBPs. Os pacientes podem apresentar sinais e sintomas variados, desde reações de hipersensibilidade sintomática até sintomas inespecíficos de diminuição da função renal (por exemplo, mal-estar, náusea, anorexia). Na série de casos relatados, alguns pacientes foram diagnosticados por biópsia e na ausência de manifestações extra-renais (por exemplo, febre, erupção cutânea ou artralgia).
Interrompa o ACIPHEX e avalie os pacientes com suspeita de NIF aguda [ver CONTRA-INDICAÇÃO ].
Diarreia Associada ao Clostridium Difficile
Estudos observacionais publicados sugerem que a terapia com IBP como o ACIPHEX pode estar associada a um risco aumentado de diarreia associada ao Clostridium difficile, especialmente em pacientes hospitalizados. Este diagnóstico deve ser considerado para diarreia que não melhora [ver REAÇÕES ADVERSAS ].
Os pacientes devem usar a dose mais baixa e a menor duração da terapia com IBP apropriada para a condição a ser tratada.
Diarreia associada ao Clostridium difficile (CDAD) foi relatada com o uso de quase todos os agentes antibacterianos. Para obter mais informações específicas sobre agentes antibacterianos (claritromicina e amoxicilina) indicados para uso em combinação com ACIPHEX, consulte as seções de Advertências e Precauções das informações de prescrição correspondentes.
Fratura óssea
Vários estudos observacionais publicados em adultos sugerem que a terapia com IBP pode estar associada a um risco aumentado de fraturas do quadril, punho ou coluna relacionadas à osteoporose. O risco de fratura foi aumentado em pacientes que receberam altas doses, definidas como múltiplas doses diárias, e terapia de longo prazo com IBP (um ano ou mais). Os pacientes devem usar a dose mais baixa e a menor duração da terapia com IBP apropriada para a condição a ser tratada. Pacientes com risco de fraturas relacionadas à osteoporose devem ser tratados de acordo com as diretrizes de tratamento estabelecidas [ver DOSAGEM E ADMINISTRAÇÃO , REAÇÕES ADVERSAS ].
Reações Adversas Cutâneas Graves
Reações adversas cutâneas graves, incluindo síndrome de Stevens-Johnson (SSJ) e necrólise epidérmica tóxica (NET), reação medicamentosa com eosinofilia e sintomas sistêmicos (DRESS) e pustulose exantemática generalizada aguda (PEGA) foram relatadas em associação com o uso de IBPs [Vejo REAÇÕES ADVERSAS ]. Descontinuar ACIPHEX aos primeiros sinais ou sintomas de reações adversas cutâneas graves ou outros sinais de hipersensibilidade e considerar uma avaliação adicional.
Lúpus Eritematoso Cutâneo e Sistêmico
Lúpus eritematoso cutâneo (LEC) e lúpus eritematoso sistêmico (LES) foram relatados em pacientes tomando IBPs, incluindo rabeprazol. Esses eventos ocorreram como um novo início e uma exacerbação de doença autoimune existente. A maioria dos casos de lúpus eritematoso induzido por IBP foram CLE.
A forma mais comum de LEC relatada em pacientes tratados com IBPs foi a LEC subaguda (SCLE) e ocorreu dentro de semanas a anos após a terapia medicamentosa contínua em pacientes que variam de lactentes a idosos. Geralmente, os achados histológicos foram observados sem envolvimento de órgãos.
lúpus eritematoso sistêmico (LES) é menos comumente relatado do que o LEC em pacientes que recebem IBPs. O LES associado a IBP é geralmente mais leve do que o LES não induzido por medicamentos. O início do LES normalmente ocorreu dentro de dias a anos após o início do tratamento, principalmente em pacientes que variam de adultos jovens a idosos. A maioria dos pacientes apresentou erupção cutânea; entretanto, artralgia e citopenia também foram relatadas.
Evite a administração de IBPs por mais tempo do que o indicado clinicamente. Se forem observados sinais ou sintomas consistentes com LEC ou LES em pacientes recebendo ACIPHEX, descontinue o medicamento e encaminhe o paciente ao especialista apropriado para avaliação. A maioria dos pacientes melhora com a descontinuação do IBP isolado em 4 a 12 semanas. Testes sorológicos (por exemplo, ANA) podem ser positivos e resultados de testes sorológicos elevados podem levar mais tempo para serem resolvidos do que as manifestações clínicas.
Deficiência de cianocobalamina (vitamina B-12)
tratamento diário com qualquer medicamento supressor de ácido por um longo período de tempo (por exemplo, mais de 3 anos) pode levar à má absorção de cianocobalamina (vitamina B-12) causada por hipo ou acloridria. Relatos raros de deficiência de cianocobalamina ocorrendo com terapia supressora de ácido foram relatados na literatura. Este diagnóstico deve ser considerado se forem observados sintomas clínicos consistentes com deficiência de cianocobalamina em pacientes tratados com ACIPHEX.
Hipomagnesemia e Metabolismo Mineral
Hipomagnesemia, sintomática e assintomática, foi relatada raramente em pacientes tratados com IBPs por pelo menos três meses, na maioria dos casos após um ano de terapia. Eventos adversos graves incluem tetania, arritmias e convulsões. A hipomagnesemia pode levar à hipocalcemia e/ou hipocalemia e pode exacerbar a hipocalcemia subjacente em pacientes de risco. Na maioria dos pacientes, o tratamento da hipomagnesemia exigiu reposição de magnésio e descontinuação do IBP.
Para pacientes que devem estar em tratamento prolongado ou que tomam IBPs com medicamentos como digoxina ou medicamentos que podem causar hipomagnesemia (por exemplo, diuréticos), os profissionais de saúde podem considerar o monitoramento dos níveis de magnésio antes do início do tratamento com IBP e periodicamente [ver REAÇÕES ADVERSAS ].
Considere monitorar os níveis de magnésio e cálcio antes do início de ACIPHEX e periodicamente durante o tratamento em pacientes com risco preexistente de hipocalcemia (por exemplo, hipoparatireoidismo). Suplemento com magnésio e/ou cálcio conforme necessário. Se a hipocalcemia for refratária ao tratamento, considerar a descontinuação do IBP.
Interação com Metotrexato
literatura sugere que o uso concomitante de IBPs com metotrexato (principalmente em altas doses; ver informações de prescrição de metotrexato) pode elevar e prolongar as concentrações séricas de metotrexato e/ou seu metabólito, possivelmente levando a toxicidade do metotrexato. Na administração de altas doses de metotrexato, a suspensão temporária do IBP pode ser considerada em alguns pacientes [ver INTERAÇÕES MEDICAMENTOSAS ].
Pólipos da Glândula Fúndica
O uso de IBP está associado a um risco aumentado de pólipos da glândula fúndica que aumenta com o uso a longo prazo, especialmente após um ano. A maioria dos usuários de IBP que desenvolveu pólipos de glândula fúndica era assintomática e pólipos de glândula fúndica foram identificados incidentalmente na endoscopia. Use a duração mais curta da terapia com IBP apropriada para a condição a ser tratada.
Informações de Aconselhamento do Paciente
Aconselhe o paciente a ler o rótulo do paciente aprovado pela FDA ( Guia de Medicação ).
Nefrite Tubulointersticial Aguda
Aconselhe o paciente ou cuidador a ligar imediatamente para o profissional de saúde do paciente se apresentar sinais e/ou sintomas associados à nefrite tubulointersticial aguda [ver AVISOS E PRECAUÇÕES ].
Diarreia Associada ao Clostridium Difficile
Aconselhe o paciente ou cuidador a ligar imediatamente para o profissional de saúde do paciente se apresentar diarreia que não melhora [ver AVISOS E PRECAUÇÕES ].
Fratura óssea
Aconselhe o paciente ou cuidador a relatar quaisquer fraturas, especialmente do quadril, punho ou coluna, ao profissional de saúde do paciente [ver AVISOS E PRECAUÇÕES ].
Reações Adversas Cutâneas Graves
Aconselhe o paciente ou cuidador a descontinuar ACIPHEX 20mg e relatar quaisquer sinais e sintomas de uma reação adversa cutânea grave ou outro sinal de hipersensibilidade ao profissional de saúde [ver AVISOS E PRECAUÇÕES ].
Lúpus Eritematoso Cutâneo e Sistêmico
Aconselhe o paciente ou cuidador a ligar imediatamente para o profissional de saúde do paciente para qualquer novo ou agravamento dos sintomas associados ao lúpus eritematoso cutâneo ou sistêmico [ver AVISOS E PRECAUÇÕES ].
Deficiência de cianocobalamina (vitamina B-12)
Aconselhe o paciente ou cuidador a relatar quaisquer sintomas clínicos que possam estar associados à deficiência de cianocobalamina ao profissional de saúde do paciente se estiver recebendo ACIPHEX 20mg por mais de 3 anos [ver AVISOS E PRECAUÇÕES ].
Hipomagnesemia e Metabolismo Mineral
Aconselhe o paciente ou cuidador a relatar quaisquer sintomas clínicos que possam estar associados a hipomagnesemia, hipocalcemia, hipocalemia e hiponatremia ao profissional de saúde do paciente, se estiver recebendo ACIPHEX por pelo menos 3 meses [ver AVISOS E PRECAUÇÕES ].
Interações medicamentosas
Aconselhe os pacientes a relatar ao seu médico se estiverem tomando produtos contendo rilpivirina [ver CONTRA-INDICAÇÕES ], varfarina, digoxina ou metotrexato em altas doses [ver AVISOS E PRECAUÇÕES ].
Administração
- Engula os comprimidos de liberação retardada ACIPHEX 10mg inteiros. Não mastigue, esmague ou divida os comprimidos.
- Para o tratamento de úlceras duodenais, tome ACIPHEX comprimidos de libertação retardada após uma refeição.
- Para a erradicação do Helicobacter pylori, tome ACIPHEX 20mg comprimidos de liberação retardada com alimentos.
- Para todas as outras indicações ACIPHEX 10mg comprimidos de liberação retardada pode ser tomado com ou sem alimentos.
- Tome uma dose esquecida o mais rápido possível. Se estiver quase na hora da próxima dose, pule a dose esquecida e volte ao horário normal. Não tome duas doses ao mesmo tempo.
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Em um estudo de carcinogenicidade de 88/104 semanas em camundongos CD-1, o rabeprazol em doses orais de até 100 mg/kg/dia não produziu nenhum aumento na ocorrência de tumor. A dose mais alta testada produziu uma exposição sistêmica ao rabeprazol (AUC) de 1,40 μg•h/mL, que é 1,6 vezes a exposição humana (AUC0-∞ plasmática = 0,88 μg•h/mL) na dose recomendada para DRGE (20 mg/ dia). Em um estudo de carcinogenicidade de 28 semanas em camundongos transgênicos p53+/-, o rabeprazol em doses orais de 20, 60 e 200 mg/kg/dia não causou aumento nas taxas de incidência de tumores, mas produziu hiperplasia da mucosa gástrica em todas as doses. A exposição sistêmica ao rabeprazol na dose de 200 mg/kg/dia é cerca de 17 a 24 vezes a exposição humana na dose recomendada para DRGE. Em um estudo de carcinogenicidade de 104 semanas em ratos Sprague-Dawley, os machos foram tratados com doses orais de 5, 15, 30 e 60 mg/kg/dia e as fêmeas com 5, 15, 30, 60 e 120 mg/kg/dia . O rabeprazol produziu hiperplasia de células do tipo enterocromafina gástrica (ECL) em ratos machos e fêmeas e tumores carcinoides de células ECL em ratos fêmeas em todas as doses, incluindo a menor dose testada. A dose mais baixa (5 mg/kg/dia) produziu uma exposição sistêmica ao rabeprazol (AUC) de cerca de 0,1 μg•hr/mL, que é cerca de 0,1 vezes a exposição humana na dose recomendada para DRGE. Em ratos machos, nenhum tumor relacionado ao tratamento foi observado em doses de até 60 mg/kg/dia, produzindo uma exposição plasmática ao rabeprazol (AUC) de cerca de 0,2 μg•hr/mL (0,2 vezes a exposição humana na dose recomendada para DRGE).
rabeprazol foi positivo no teste de Ames, no teste de mutação genética direta de células de ovário de hamster chinês (CHO/HGPRT) e no teste de mutação genética direta em células de linfoma de camundongo (L5178Y/TK+/–). Seu metabólito desmetilado também foi positivo no teste de Ames. O rabeprazol foi negativo no teste de aberração cromossômica de células pulmonares de hamster chinês in vitro, no teste de micronúcleo em camundongo in vivo e nos testes de síntese de DNA não programada (UDS) de hepatócitos de rato in vivo e ex vivo.
Rabeprazol em doses intravenosas de até 30 mg/kg/dia (AUC plasmática de 8,8 μg•hr/mL, cerca de 10 vezes a exposição humana na dose recomendada para DRGE) não teve efeito sobre a fertilidade e desempenho reprodutivo de machos e ratas fêmeas.
Uso em populações específicas
Gravidez
Resumo do risco
Não há dados humanos disponíveis sobre o uso de ACIPHEX 10mg em mulheres grávidas para informar o risco associado ao medicamento. O risco de fundo de defeitos congênitos graves e aborto para as populações indicadas são desconhecidos. No entanto, o risco de fundo na população geral dos EUA de grandes defeitos congênitos é de 2 a 4% e de aborto espontâneo é de 15 a 20% das gestações clinicamente reconhecidas. Nenhuma evidência de efeitos adversos no desenvolvimento foi observada em estudos de reprodução animal com rabeprazol administrado durante a organogênese em 13 e 8 vezes a área humana sob a curva de concentração plasmática-tempo (AUC) na dose recomendada para DRGE, em ratos e coelhos, respectivamente [ver Dados ].
Alterações na morfologia óssea foram observadas na prole de ratos tratados com doses orais de um IBP diferente durante a maior parte da gestação e lactação. Quando a administração materna foi confinada apenas à gestação, não houve efeitos na morfologia da fise óssea na prole em qualquer idade [ver Dados ].
Dados
Dados de animais
Estudos de desenvolvimento embriofetal foram realizados em ratos durante a organogênese em doses intravenosas de rabeprazol de até 50 mg/kg/dia (AUC plasmática de 11,8 μg•hr/mL, cerca de 13 vezes a exposição humana na dose oral recomendada para DRGE) e coelhos em doses intravenosas de até 30 mg/kg/dia (AUC plasmática de 7,3 μg•hr/mL, cerca de 8 vezes a exposição humana na dose oral recomendada para DRGE) e não revelaram evidências de danos ao feto devido a rabeprazol.
A administração de rabeprazol a ratas no final da gestação e durante a lactação em uma dose oral de 400 mg/kg/dia (cerca de 195 vezes a dose oral humana baseada em mg/m²) resultou em diminuição no ganho de peso corporal dos filhotes.
Um estudo de toxicidade de desenvolvimento pré e pós-natal em ratos com parâmetros adicionais para avaliar o desenvolvimento ósseo foi realizado com um IBP diferente em cerca de 3,4 a 57 vezes uma dose oral humana com base na área de superfície corporal. Diminuição do comprimento do fêmur, largura e espessura do osso cortical, diminuição da espessura da placa de crescimento tibial e hipocelularidade mínima a leve da medula óssea foram observadas em doses deste IBP iguais ou superiores a 3,4 vezes uma dose oral humana com base na área de superfície corporal . A displasia fisária no fêmur também foi observada na prole após exposição in utero e lactacional ao IBP em doses iguais ou superiores a 33,6 vezes uma dose oral humana com base na área de superfície corporal. Efeitos no osso materno foram observados em ratas grávidas e lactantes em um estudo de toxicidade pré e pós-natal quando o IBP foi administrado em doses orais de 3,4 a 57 vezes uma dose oral humana com base na área de superfície corporal. Quando os ratos foram administrados desde o 7º dia gestacional até o desmame no 21º dia pós-natal, uma diminuição estatisticamente significativa no peso do fêmur materno de até 14% (em comparação com o tratamento com placebo) foi observada em doses iguais ou superiores a 33,6 vezes uma dose oral humana com base na área de superfície corporal.
Um estudo de toxicidade de desenvolvimento de acompanhamento em ratos com pontos de tempo adicionais para avaliar o desenvolvimento ósseo do filhote desde o dia 2 pós-natal até a idade adulta foi realizado com um IBP diferente em doses orais de 280 mg/kg/dia (cerca de 68 vezes uma dose oral humana em um com base na área de superfície corporal) onde a administração do fármaco foi do 7º dia gestacional ou do 16º dia gestacional até o parto. Quando a administração materna foi confinada apenas à gestação, não houve efeitos na morfologia da fise óssea na prole em qualquer idade.
Lactação
Resumo do risco
Não foram realizados estudos de lactação para avaliar a presença de rabeprazol no leite humano, os efeitos do rabeprazol no lactente ou os efeitos do rabeprazol na produção de leite. Rabeprazol está presente no leite de rato. O desenvolvimento e os benefícios da amamentação para a saúde devem ser considerados juntamente com a necessidade clínica da mãe de ACIPHEX e quaisquer potenciais efeitos adversos no lactente amamentado por ACIPHEX ou da condição materna subjacente.
Uso Pediátrico
segurança e eficácia de ACIPHEX 20mg comprimidos de liberação retardada foram estabelecidas em pacientes pediátricos para pacientes adolescentes com 12 anos de idade ou mais para o tratamento de DRGE sintomática. O uso de ACIPHEX 20mg comprimidos de liberação retardada nesta faixa etária é apoiado por estudos adequados e bem controlados em adultos e um estudo multicêntrico, randomizado, aberto, de grupos paralelos em 111 pacientes adolescentes de 12 a 16 anos de idade. Os pacientes tinham diagnóstico clínico de DRGE sintomática, DRGE suspeita ou comprovada endoscopicamente e foram randomizados para 10 mg ou 20 mg uma vez ao dia por até 8 semanas para avaliação de segurança e eficácia. O perfil de reações adversas em pacientes adolescentes foi semelhante ao dos adultos. As reações adversas relatadas que ocorreram em ≥2% dos pacientes foram cefaleia (5%) e náusea (2%). Não houve reações adversas relatadas nestes estudos que não tenham sido previamente observadas em adultos.
segurança e eficácia de ACIPHEX 10mg comprimidos de liberação retardada não foram estabelecidas em pacientes pediátricos para:
- Cicatrização da DRGE erosiva ou ulcerativa
- Manutenção da cicatrização da DRGE erosiva ou ulcerativa
- Tratamento da DRGE sintomática
- Cicatrização de úlceras duodenais
- Erradicação do Helicobacter pylori para reduzir o risco de recorrência da úlcera duodenal
- Tratamento de condições hipersecretórias patológicas, incluindo síndrome de Zollinger-Ellison
Os comprimidos de liberação retardada de 20 mg de ACIPHEX não são recomendados para uso em pacientes pediátricos com menos de 12 anos de idade porque a dosagem do comprimido excede a dose recomendada para esses pacientes [ver DOSAGEM E ADMINISTRAÇÃO ]. Para pacientes pediátricos de 1 ano a menos de 12 anos de idade, considere outra formulação de rabeprazol. A segurança e a eficácia de uma forma farmacêutica e dosagem diferentes de rabeprazol foram estabelecidas em pacientes pediátricos de 1 a 11 anos para o tratamento da DRGE.
Dados de animais juvenis
Foram realizados estudos em ratos e cães juvenis e adultos jovens. Em estudos com animais juvenis, o rabeprazol sódico foi administrado oralmente a ratos por até 5 semanas e a cães por até 13 semanas, cada um começando no dia 7 pós-parto e seguido por um período de recuperação de 13 semanas. Os ratos receberam doses de 5, 25 ou 150 mg/kg/dia e os cães receberam doses de 3, 10 ou 30 mg/kg/dia. Os dados desses estudos foram comparáveis aos relatados para animais adultos jovens. Alterações farmacologicamente mediadas, incluindo aumento dos níveis séricos de gastrina e alterações estomacais, foram observadas em todos os níveis de dose em ratos e cães. Essas observações foram reversíveis ao longo dos períodos de recuperação de 13 semanas. Embora os pesos corporais e/ou comprimentos cabeça-nádegas tenham diminuído minimamente durante a dosagem, não foram observados efeitos nos parâmetros de desenvolvimento em ratos ou cães juvenis.
Quando animais juvenis foram tratados por 28 dias com um IBP diferente em doses iguais ou superiores a 34 vezes a dose oral humana diária com base na área de superfície corporal, o crescimento geral foi afetado e diminuições relacionadas ao tratamento no peso corporal (aproximadamente 14%) e ganho de peso corporal, e foram observadas diminuições no peso do fêmur e no comprimento do fêmur.
Uso Geriátrico
Do número total de indivíduos (n=2009) em estudos clínicos de ACIPHEX 20mg comprimidos de liberação retardada, 19% tinham 65 anos ou mais, enquanto 4% tinham 75 anos ou mais. Não foram observadas diferenças gerais na segurança ou eficácia entre esses indivíduos e indivíduos mais jovens, e outras experiências clínicas relatadas não identificaram diferenças nas respostas entre os pacientes idosos e os pacientes mais jovens, mas a maior sensibilidade de alguns indivíduos mais velhos não pode ser descartada.
Insuficiência hepática
administração de ACIPHEX comprimidos de liberação retardada a pacientes com insuficiência hepática leve a moderada (Classe A e B de Child-Pugh, respectivamente) resultou em aumento da exposição e diminuição da eliminação [ver FARMACOLOGIA CLÍNICA ]. Não é necessário ajuste de dose em pacientes com insuficiência hepática leve a moderada. Não há informações em pacientes com insuficiência hepática grave (Classe C de Child-Pugh). Evite o uso de ACIPHEX comprimidos de liberação retardada em pacientes com insuficiência hepática grave; no entanto, se o tratamento for necessário, monitore os pacientes quanto a reações adversas [ver AVISOS E PRECAUÇÕES , REAÇÕES ADVERSAS ].
SOBREDOSAGEM
Sete relatos de superdosagem acidental com rabeprazol foram recebidos. A sobredosagem máxima notificada foi de 80 mg. Não houve sinais ou sintomas clínicos associados a qualquer sobredosagem notificada. Pacientes com síndrome de Zollinger-Ellison foram tratados com até 120 mg de rabeprazol uma vez ao dia. Nenhum antídoto específico para o rabeprazol é conhecido. O rabeprazol liga-se extensivamente às proteínas e não é facilmente dialisável.
Em caso de sobredosagem, o tratamento deve ser sintomático e de suporte.
Se ocorrer superexposição, ligue para o Centro de Controle de Intoxicações pelo telefone 1-800-222-1222 para obter informações atualizadas sobre o gerenciamento de envenenamento ou superdosagem.
CONTRA-INDICAÇÕES
- ACIPHEX 10mg é contraindicado em pacientes com hipersensibilidade conhecida ao rabeprazol, benzimidazóis substituídos ou a qualquer componente da formulação. As reações de hipersensibilidade podem incluir anafilaxia, choque anafilático, angioedema, broncoespasmo, nefrite tubulointersticial aguda e urticária. AVISOS E PRECAUÇÕES , REAÇÕES ADVERSAS ].
- IBPs, incluindo ACIPHEX, são contraindicados com produtos contendo rilpivirina [ver INTERAÇÕES MEDICAMENTOSAS ].
- Para obter informações sobre as contraindicações de agentes antibacterianos (claritromicina e amoxicilina) indicados em combinação com ACIPHEX 20mg comprimidos de liberação retardada, consulte a seção Contraindicações de suas bulas.
FARMACOLOGIA CLÍNICA
Mecanismo de ação
rabeprazol pertence a uma classe de compostos antissecretores (inibidores da bomba de prótons benzimidazol substituídos) que não exibem propriedades anticolinérgicas ou antagonistas dos receptores H2 da histamina, mas suprimem a secreção de ácido gástrico pela inibição da H+, K+ATPase gástrica na superfície secretora do estômago. célula parietal. Como essa enzima é considerada a bomba de ácido (prótons) dentro da célula parietal, o rabeprazol tem sido caracterizado como um inibidor da bomba de prótons gástrica. Rabeprazol bloqueia a etapa final da secreção de ácido gástrico.
Nas células parietais gástricas, o rabeprazol é protonado, acumulado e transformado em uma sulfenamida ativa. Quando estudado in vitro, o rabeprazol é quimicamente ativado em pH 1,2 com meia-vida de 78 segundos. Inibe o transporte de ácido em vesículas gástricas suínas com meia-vida de 90 segundos.
Farmacodinâmica
Atividade antisecretora
efeito antissecretor começa dentro de uma hora após a administração oral de 20 mg de ACIPHEX 20 mg comprimidos de liberação retardada. O efeito inibidor mediano do rabeprazol na acidez gástrica de 24 horas é 88% do máximo após a primeira dose. Uma dose de 20 mg de ACIPHEX comprimidos de liberação retardada inibe a secreção ácida estimulada pela refeição basal e peptonada versus placebo em 86% e 95%, respectivamente, e aumenta a porcentagem de um período de 24 horas em que o pH gástrico>3 de 10% para 65% (ver tabela abaixo). Essa ação farmacodinâmica relativamente prolongada em comparação com a meia-vida farmacocinética curta (1 a 2 horas) reflete a inativação sustentada da H+, K+ATPase.
Comparado ao placebo, 10 mg, 20 mg e 40 mg de ACIPHEX comprimidos de liberação retardada, administrados uma vez ao dia por 7 dias, diminuíram significativamente a acidez intragástrica com todas as doses para cada um dos quatro intervalos relacionados às refeições e o período geral de 24 horas. Neste estudo, não houve diferenças estatisticamente significativas entre as doses; no entanto, houve uma diminuição significativa relacionada à dose na acidez intragástrica. A capacidade do rabeprazol para causar uma diminuição relacionada com a dose na acidez intragástrica média é ilustrada abaixo.

Após a administração de 20 mg de ACIPHEX 20 mg comprimidos de liberação retardada uma vez ao dia durante oito dias, a porcentagem média de tempo que o pH gástrico maior que 3 ou pH gástrico maior que 4 após uma dose única (Dia 1) e doses múltiplas (Dia 8) foi significativamente maior do que o placebo (ver tabela abaixo). A diminuição da acidez gástrica e o aumento do pH gástrico observados com 20 mg de ACIPHEX 10 mg comprimidos de liberação retardada administrados uma vez ao dia durante oito dias foram comparados com os mesmos parâmetros para placebo, conforme ilustrado abaixo:
Efeitos sobre a exposição ao ácido esofágico
Em pacientes com DRGE e exposição moderada a grave ao ácido esofágico, uma dose de 20 mg e 40 mg por dia de ACIPHEX 20 mg comprimidos de liberação retardada diminuiu a exposição ao ácido esofágico em 24 horas. Após sete dias de tratamento, a porcentagem de tempo em que o pH esofágico foi menor que 4 diminuiu de 24,7% para 20 mg e 23,7% para 40 mg, para 5,1% e 2,0%, respectivamente. A normalização da exposição ácida intraesofágica de 24 horas foi correlacionada ao pH gástrico maior que 4 por pelo menos 35% do período de 24 horas; este nível foi alcançado em 90% dos indivíduos que receberam ACIPHEX 20 mg e em 100% dos indivíduos que receberam ACIPHEX 40 mg. Com ACIPHEX 20 mg e 40 mg por dia, efeitos significativos no pH gástrico e esofágico foram observados após um dia de tratamento e mais pronunciados após sete dias de tratamento.
Efeitos sobre a gastrina sérica
nível médio de gastrina em jejum aumentou de forma dose-dependente em pacientes tratados uma vez ao dia com ACIPHEX 10mg comprimidos de liberação retardada por até oito semanas para esofagite ulcerativa ou erosiva e em pacientes tratados por até 52 semanas para prevenir a recorrência da doença. Os valores medianos do grupo ficaram dentro da normalidade.
Em um grupo de indivíduos tratados com 20 mg de comprimidos de liberação retardada de ACIPHEX por 4 semanas, foi observada uma duplicação das concentrações médias de gastrina sérica. Aproximadamente 35% destes indivíduos tratados desenvolveram concentrações séricas de gastrina acima do limite superior do normal.
Efeitos em células semelhantes a enterocromafins (ECL)
O aumento da gastrina sérica secundária a agentes antissecretores estimula a proliferação de células ECL gástricas que, ao longo do tempo, pode resultar em hiperplasia das células ECL em ratos e camundongos e carcinóides gástricos em ratos, especialmente em fêmeas [ver Toxicologia não clínica ].
Em mais de 400 pacientes tratados com ACIPHEX comprimidos de liberação retardada (10 ou 20 mg) uma vez ao dia por até um ano, a incidência de hiperplasia de células ECL aumentou com o tempo e a dose, o que é consistente com a ação farmacológica do inibidor da bomba de prótons. Nenhum paciente desenvolveu as alterações adenomatóides, displásicas ou neoplásicas das células ECL na mucosa gástrica. Nenhum paciente desenvolveu os tumores carcinoides observados em ratos.
Efeitos Endócrinos
Estudos em humanos por até um ano não revelaram efeitos clinicamente significativos no sistema endócrino. Em indivíduos saudáveis do sexo masculino tratados com ACIPHEX comprimidos de libertação retardada durante 13 dias, não foram detectadas alterações clinicamente relevantes nos seguintes parâmetros endócrinos examinados: 17 β-estradiol, hormona estimulante da tiróide, tri-iodotironina, tiroxina, proteína de ligação à tiroxina, paratiróide hormônio, insulina, glucagon, renina, aldosterona, hormônio folículo-estimulante, hormônio luteotrófico, prolactina, hormônio somatotrófico, desidroepiandrosterona, globulina de ligação ao cortisol e 6β-hidroxicortisol urinário, testosterona sérica e perfil circadiano de cortisol.
Outros efeitos
Em humanos tratados com ACIPHEX 10mg comprimidos de liberação retardada por até um ano, não foram observados efeitos sistêmicos nos sistemas nervoso central, linfoide, hematopoiético, renal, hepático, cardiovascular ou respiratório. Não há dados disponíveis sobre o tratamento a longo prazo com ACIPHEX 10mg comprimidos de liberação retardada e efeitos oculares.
Farmacocinética
Após a administração oral de 20 mg de ACIPHEX 10 mg comprimidos de libertação retardada, as concentrações plasmáticas máximas (Cmax) de rabeprazol ocorrem num intervalo de 2 a 5 horas (Tmax). A Cmax e AUC do rabeprazol são lineares em uma faixa de dose oral de 10 mg a 40 mg. Não há acúmulo apreciável quando são administradas doses de 10 mg a 40 mg a cada 24 horas; a farmacocinética do rabeprazol não é alterada por doses múltiplas.
Absorção
biodisponibilidade absoluta para um comprimido oral de 20 mg de rabeprazol (em comparação com a administração intravenosa) é de aproximadamente 52%. Quando os comprimidos de liberação retardada ACIPHEX 10mg são administrados com uma refeição rica em gordura, o Tmax é variável; cuja ingestão concomitante de alimentos pode atrasar a absorção em até 4 horas ou mais. No entanto, a Cmax e a extensão da absorção do rabeprazol (AUC) não são significativamente alteradas. Assim, os comprimidos de liberação retardada de ACIPHEX podem ser tomados independentemente do horário das refeições.
Distribuição
O rabeprazol liga-se em 96,3% às proteínas plasmáticas humanas.
Eliminação
Metabolismo
rabeprazol é extensivamente metabolizado. Uma porção significativa de rabeprazol é metabolizada via redução não enzimática sistêmica a um composto de tioéter. O rabeprazol também é metabolizado em compostos de sulfona e desmetila via citocromo P450 no fígado. O tioéter e a sulfona são os metabólitos primários medidos no plasma humano. Esses metabólitos não foram observados como tendo atividade antissecretora significativa. Estudos in vitro demonstraram que o rabeprazol é metabolizado no fígado principalmente pelos citocromos P450 3A (CYP3A) em um metabólito sulfona e pelo citocromo P450 2C19 (CYP2C19) em desmetil rabeprazol. O CYP2C19 exibe um polimorfismo genético conhecido devido à sua deficiência em algumas subpopulações (por exemplo, 3 a 5% dos caucasianos e 17 a 20% dos asiáticos). O metabolismo do rabeprazol é lento nestas subpopulações, portanto, são referidos como metabolizadores fracos do fármaco.
Excreção
Após uma dose oral única de 20 mg de rabeprazol marcado com 14C, aproximadamente 90% da droga foi eliminada na urina, principalmente como ácido tioéter carboxílico; seu glicuronídeo e metabólitos do ácido mercaptúrico. O restante da dose foi recuperado nas fezes. A recuperação total da radioatividade foi de 99,8%. Nenhum rabeprazol inalterado foi recuperado na urina ou nas fezes.
Populações Específicas
Pacientes Geriátricos
Em 20 indivíduos idosos saudáveis administrados 20 mg de ACIPHEX comprimidos de libertação retardada uma vez por dia durante sete dias, os valores de AUC duplicaram aproximadamente e a Cmax aumentou 60% em comparação com os valores de um grupo de controlo paralelo mais jovem. Não houve evidência de acúmulo do fármaco após a administração uma vez ao dia [ver Uso em população específica ].
Pacientes pediátricos
farmacocinética do rabeprazol foi estudada em 12 pacientes adolescentes com DRGE de 12 a 16 anos de idade, em um estudo multicêntrico. Os pacientes receberam comprimidos de liberação retardada de 20 mg de ACIPHEX uma vez ao dia por cinco ou sete dias. Um aumento aproximado de 40% na exposição ao rabeprazol foi observado após 5 a 7 dias de administração em comparação com a exposição após 1 dia de administração. Os parâmetros farmacocinéticos em pacientes adolescentes com DRGE de 12 a 16 anos de idade estavam dentro da faixa observada em indivíduos adultos saudáveis.
Pacientes do sexo masculino e feminino e grupos raciais ou étnicos
Em análises ajustadas para massa corporal e altura, a farmacocinética do rabeprazol não mostrou diferenças clinicamente significativas entre indivíduos do sexo masculino e feminino. Em estudos que usaram diferentes formulações de rabeprazol, os valores de AUC0-∞ para homens japoneses saudáveis foram aproximadamente 50 a 60% maiores do que os valores derivados de dados agrupados de homens saudáveis nos Estados Unidos.
Pacientes com Insuficiência Renal
Em 10 pacientes com doença renal em estágio terminal estável necessitando de hemodiálise de manutenção (clearance de creatinina ≤ 5 mL/min/1,73 m²), não foram observadas diferenças clinicamente significativas na farmacocinética do rabeprazol após uma dose única de 20 mg de ACIPHEX 20 mg comprimidos de liberação retardada quando comparado a 10 indivíduos saudáveis.
Pacientes com Insuficiência Hepática
Em um estudo de dose única de 10 pacientes com insuficiência hepática leve a moderada (Child-Pugh Classe A e B, respectivamente) que receberam uma dose única de 20 mg de ACIPHEX 10 mg comprimidos de liberação retardada, a AUC0-24 foi aproximadamente dobrada, a eliminação a meia-vida foi 2 a 3 vezes maior e a depuração corporal total foi reduzida para menos da metade em comparação com os valores em homens saudáveis.
Em um estudo de dose múltipla de 12 pacientes com insuficiência hepática leve a moderada administrados 20 mg de ACIPHEX 10 mg comprimidos de liberação retardada uma vez ao dia por oito dias, os valores de AUC0-∞ e Cmax aumentaram aproximadamente 20% em comparação com valores em indivíduos saudáveis de idade e sexo assuntos. Esses aumentos não foram estatisticamente significativos.
Não existe informação sobre a disposição do rabeprazol em pacientes com insuficiência hepática grave (Classe C de Child-Pugh) [ver Uso em populações específicas ].
Estudos de interação medicamentosa
Administração Combinada Com Antimicrobianos
Dezesseis indivíduos saudáveis genotipados como metabolizadores extensos em relação ao CYP2C19 receberam comprimidos de liberação retardada de 20 mg de ACIPHEX, 1000 mg de amoxicilina, 500 mg de claritromicina ou todos os 3 medicamentos em um estudo cruzado de quatro vias. Cada um dos quatro regimes foi administrado duas vezes por dia durante 6 dias. A AUC e Cmax para claritromicina e amoxicilina não foram diferentes após a administração combinada em comparação com os valores após administração única. No entanto, a AUC e Cmax do rabeprazol aumentaram 11% e 34%, respectivamente, após a administração combinada. A AUC e Cmax da 14-hidroxiclaritromicina (metabólito ativo da claritromicina) também aumentaram 42% e 46%, respectivamente. Não se espera que este aumento na exposição ao rabeprazol e 14-hidroxiclaritromicina produza preocupações de segurança.
Efeitos de outras drogas no rabeprazol
Antiácidos
A coadministração de ACIPHEX 20mg comprimidos de liberação retardada e antiácidos não produziu alterações clinicamente relevantes nas concentrações plasmáticas de rabeprazol.
Efeitos do Rabeprazol em outras drogas
Estudos em indivíduos saudáveis mostraram que o rabeprazol não tem interações clinicamente significativas com outros medicamentos metabolizados pelo sistema CYP450, como teofilina (CYP1A2) administrada em doses orais únicas, diazepam (CYP2C9 e CYP3A4) em dose única intravenosa e fenitoína ( CYP2C9 e CYP2C19) administrados como uma dose intravenosa única (com dosagem oral suplementar). Interações de estado estacionário de rabeprazol e outras drogas metabolizadas por este sistema enzimático não foram estudadas em pacientes.
Clopidogrel
clopidogrel é metabolizado em seu metabólito ativo em parte pelo CYP2C19. Foi realizado um estudo de indivíduos saudáveis incluindo metabolizadores extensos e intermediários de CYP2C19 recebendo administração de clopidogrel 75 mg uma vez ao dia concomitantemente com placebo ou com 20 mg de ACIPHEX 20 mg comprimidos de liberação retardada (n=36), por 7 dias. A AUC média do metabólito ativo do clopidogrel foi reduzida em aproximadamente 12% (a razão AUC média foi de 88%, com IC de 90% de 81,7 a 95,5%) quando ACIPHEX comprimidos de liberação retardada foi coadministrado em comparação com a administração de clopidogrel com placebo [ver INTERAÇÕES MEDICAMENTOSAS ].
Digoxina
Em indivíduos adultos saudáveis (n=16), a coadministração de 20 mg de rabeprazol sódico comprimidos de liberação retardada com 2,5 mg de digoxina uma vez ao dia no estado de equilíbrio resultou em aproximadamente 29% e 19% de aumento na Cmax e AUC médias (0- 24) de digoxina [ver INTERAÇÕES MEDICAMENTOSAS ].
Cetoconazol
Em indivíduos adultos saudáveis (n=19), a coadministração de 20 mg de rabeprazol sódico comprimidos de liberação retardada em estado de equilíbrio com uma dose oral única de 400 mg de cetoconazol resultou em aproximadamente uma redução média de 31% na Cmax e AUC(0- inf) de cetoconazol [ver INTERAÇÕES MEDICAMENTOSAS ].
Ciclosporina
Incubações in vitro empregando microssomas de fígado humano indicaram que o rabeprazol inibiu o metabolismo da ciclosporina com uma IC50 de 62 micromolar, uma concentração que é mais de 50 vezes maior que a Cmax em voluntários saudáveis após 14 dias de administração com 20 mg de ACIPHEX 10 mg comprimidos de liberação retardada. Este grau de inibição é semelhante ao do omeprazol em concentrações equivalentes.
Microbiologia
Os seguintes dados in vitro estão disponíveis, mas o significado clínico é desconhecido.
Rabeprazol sódico, amoxicilina e claritromicina, como esquema de três drogas, mostrou-se ativo contra a maioria das cepas de Helicobacter pylori in vitro e em infecções clínicas. INDICAÇÕES E USO , Estudos clínicos ].
Helicobacter pylori
teste de suscetibilidade de isolados de H. pylori foi realizado para amoxicilina e claritromicina usando a metodologia de diluição em ágar1, e as concentrações inibitórias mínimas (CIMs) foram determinadas.
Procedimentos padronizados de teste de sensibilidade requerem o uso de microrganismos de controle de laboratório para controlar os aspectos técnicos dos procedimentos laboratoriais.
Incidência de Organismos Resistentes a Antibióticos Entre Isolados Clínicos
Resistência ao pré-tratamento
A taxa de resistência pré-tratamento com claritromicina (CIM ≥1 mcg/mL) para H. pylori foi de 9% (51/560) na linha de base em todos os grupos de tratamento combinados. Mais de 99% (558/560) dos pacientes tinham isolados de H. pylori que foram considerados suscetíveis (CIM ≤0,25 mcg/mL) à amoxicilina no início do estudo. Dois pacientes tinham isolados de H. pylori basais com uma CIM de amoxicilina de 0,5 mcg/mL.
Para obter informações sobre testes de sensibilidade sobre Helicobacter pylori, consulte a seção Microbiologia nas informações de prescrição de claritromicina e amoxicilina.
Pacientes com infecção persistente por H. pylori após terapia com rabeprazol, amoxicilina e claritromicina provavelmente terão isolados clínicos resistentes à claritromicina. Portanto, o teste de sensibilidade à claritromicina deve ser feito quando possível. Se for demonstrada resistência à claritromicina ou se o teste de sensibilidade não for possível, uma terapia antimicrobiana alternativa deve ser instituída.
Resultados do Teste de Suscetibilidade à Amoxicilina e Resultados Clínicos/Bacteriológicos
No estudo multicêntrico dos EUA, mais de 99% (558/560) dos pacientes tinham isolados de H. pylori que foram considerados suscetíveis (CIM ≤0,25 mcg/mL) à amoxicilina no início do estudo. Os outros 2 pacientes tinham isolados de H. pylori na linha de base com uma CIM de amoxicilina de 0,5 mcg/mL, e ambos os isolados eram resistentes à claritromicina na linha de base; em um caso o H. pylori foi erradicado. Nos grupos de tratamento de 7 e 10 dias, 75% (107/145) e 79% (112/142), respectivamente, dos pacientes que tiveram CIMs pré-tratamento suscetíveis à amoxicilina (≤0,25 mcg/mL) foram erradicados de H. pylori . Nenhum paciente desenvolveu H. pylori resistente à amoxicilina durante a terapia.
Farmacogenômica
Em um estudo clínico avaliando os comprimidos de liberação retardada de ACIPHEX em pacientes adultos japoneses categorizados pelo genótipo CYP2C19 (n=6 por categoria de genótipo), a supressão do ácido gástrico foi maior em metabolizadores fracos em comparação com metabolizadores extensos. Isso pode ser devido a níveis plasmáticos mais altos de rabeprazol em metabolizadores fracos. A relevância clínica disso não é conhecida. Se as interações do rabeprazol sódico com outras drogas metabolizadas pelo CYP2C19 seriam ou não diferentes entre metabolizadores extensos e metabolizadores fracos não foi estudado.
Estudos clínicos
Cicatrização da DRGE erosiva ou ulcerativa em adultos
Em um estudo americano, multicêntrico, randomizado, duplo-cego, controlado por placebo, 103 pacientes foram tratados por até oito semanas com placebo, comprimidos de liberação retardada de 10 mg, 20 mg ou 40 mg de ACIPHEX uma vez ao dia. Para este e todos os estudos de cura da DRGE, apenas pacientes com sintomas de DRGE e pelo menos esofagite grau 2 (escala de classificação de Hetzel-Dent modificada) eram elegíveis para entrada. A cicatrização endoscópica foi definida como grau 0 ou 1. Cada dose de rabeprazol foi significativamente superior ao placebo na produção de cicatrização endoscópica após quatro e oito semanas de tratamento. A porcentagem de pacientes que demonstraram cicatrização endoscópica foi a seguinte:
Além disso, houve uma diferença estatisticamente significativa a favor das doses de ACIPHEX 10 mg, 20 mg e 40 mg em comparação com placebo nas semanas 4 e 8 em relação à resolução completa da frequência de pirose da DRGE (p≤0,026). Todos os grupos ACIPHEX relataram taxas significativamente maiores de resolução completa da gravidade da pirose diurna da DRGE em comparação com placebo nas semanas 4 e 8 (p≤0,036). As reduções médias da linha de base na dose diária de antiácido foram estatisticamente significativas para todos os grupos ACIPHEX quando comparados ao placebo nas semanas 4 e 8 (p≤0,007).
Em um estudo multicêntrico norte-americano, randomizado, duplo-cego, com controle ativo de 336 pacientes, a porcentagem de pacientes curados na endoscopia após quatro e oito semanas de tratamento foi estatisticamente superior nos pacientes tratados com ACIPHEX comprimidos de liberação retardada em comparação com ranitidina :
Uma dose de 20 mg uma vez ao dia de comprimidos de liberação retardada de ACIPHEX foi significativamente mais eficaz do que 150 mg de ranitidina quatro vezes ao dia na porcentagem de pacientes com resolução completa da azia nas semanas 4 e 8 (p
A dosagem recomendada de ACIPHEX 10mg comprimidos de liberação retardada é de 20mg uma vez ao dia por 4 a 8 semanas.
Manutenção a longo prazo da cicatrização da DRGE erosiva ou ulcerativa em adultos
manutenção a longo prazo da cicatrização em pacientes com DRGE erosiva ou ulcerativa previamente curada com terapia antissecretora gástrica foi avaliada em dois estudos norte-americanos, multicêntricos, randomizados, duplo-cegos, controlados por placebo de desenho idêntico com duração de 52 semanas. Os dois estudos randomizaram 209 e 285 pacientes, respectivamente, para receber 10 mg ou 20 mg de ACIPHEX comprimidos de liberação retardada uma vez ao dia ou placebo. Conforme demonstrado nas Tabelas 10 e 11 abaixo, os pacientes tratados com ACIPHEX comprimidos de liberação retardada foram significativamente superiores ao placebo em ambos os estudos em relação à manutenção da cura da DRGE e às proporções de pacientes que permaneceram livres de sintomas de pirose em 52 semanas. A dosagem recomendada de ACIPHEX 20mg comprimidos de liberação retardada é de 20mg uma vez ao dia.
Tratamento da DRGE sintomática em adultos
Dois estudos norte-americanos, multicêntricos, duplo-cegos, controlados por placebo foram conduzidos em 316 pacientes adultos com azia diurna e noturna. Os pacientes relataram 5 ou mais períodos de azia moderada a muito grave durante a fase de tratamento com placebo na semana anterior à randomização. Os pacientes foram confirmados por endoscopia para não ter erosões esofágicas.
A porcentagem de períodos diurnos e/ou noturnos sem azia foi maior com 20 mg de ACIPHEX 20 mg comprimidos de liberação retardada em comparação com placebo durante as 4 semanas de estudo no Estudo RABUSA-2 (47% vs. 23%) e no Estudo RAB-USA- 3 (52% vs. 28%). As diminuições médias da linha de base nos escores médios de azia diurna e noturna foram significativamente maiores para ACIPHEX 20 mg em comparação com placebo na semana 4. Exibições gráficas representando as pontuações diurnas e noturnas médias diárias são fornecidas nas Figuras 2 a 5.
Figura 2: Pontuações médias de azia diurna RAB-USA-2
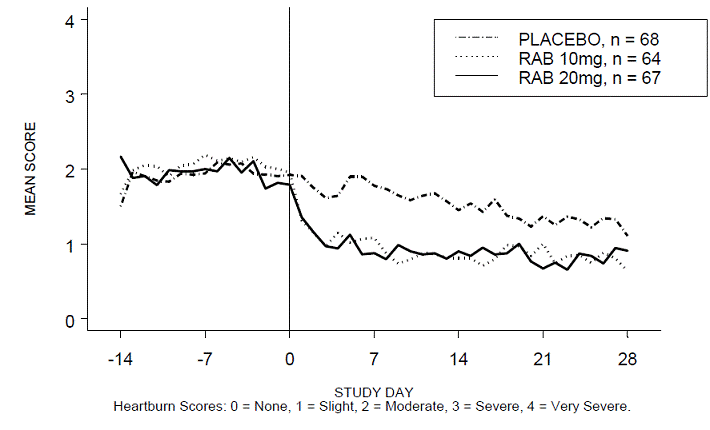
Figura 3: Pontuações médias de azia noturna RAB-USA-2
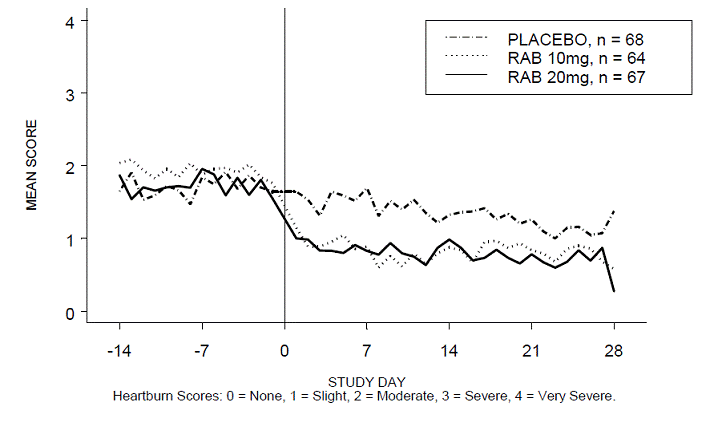
Figura 4: Pontuações médias de azia diurna RAB-USA-3 Figura 3: Pontuações médias de azia diurna RAB - EUA –3
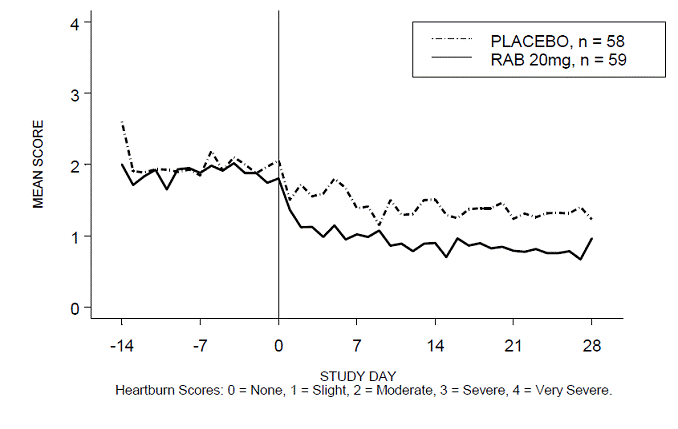
Figura 5: Pontuações médias de azia noturna RAB-USA-3
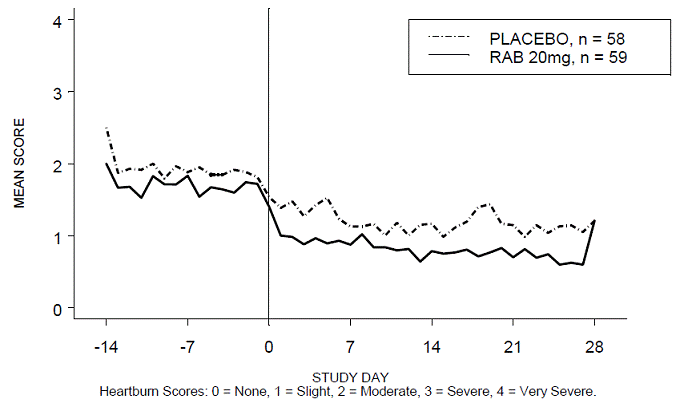
Além disso, a análise combinada desses dois estudos mostrou que 20 mg de ACIPHEX 10 mg comprimidos de liberação retardada melhoraram significativamente outros sintomas associados à DRGE (regurgitação, arrotos e saciedade precoce) na semana 4 em comparação com placebo (todos os valores de p
Uma dose de 20 mg de ACIPHEX 20 mg comprimidos de liberação retardada também reduziu significativamente o consumo diário de antiácido versus placebo durante 4 semanas (p
A dosagem recomendada de ACIPHEX comprimidos de liberação retardada é de 20 mg uma vez ao dia por 4 semanas.
Cicatrização de úlceras duodenais em adultos
Em um estudo multicêntrico, randomizado, duplo-cego, nos Estados Unidos, avaliando a eficácia de 20 mg e 40 mg de ACIPHEX 10 mg comprimidos de liberação retardada uma vez ao dia versus placebo para cicatrização de úlceras duodenais definidas endoscopicamente, 100 pacientes foram tratados por até quatro semanas. ACIPHEX foi significativamente superior ao placebo na cicatrização de úlceras duodenais. As porcentagens de pacientes com cicatrização endoscópica são apresentadas abaixo:
Nas semanas 2 e 4, significativamente mais pacientes nos grupos ACIPHEX 20 e 40 mg relataram resolução completa da frequência da dor da úlcera (p≤0,018), intensidade da dor diurna (p≤0,023) e intensidade da dor noturna (p≤0,035) em comparação com pacientes placebo. A única exceção foi o grupo de 40 mg versus placebo na Semana 2 para frequência de dor na úlcera duodenal (p = 0,094). Diferenças significativas na resolução da dor diurna e noturna foram observadas em ambos os grupos ACIPHEX em relação ao placebo até o final da primeira semana do estudo. Reduções significativas no uso diário de antiácidos também foram observadas em ambos os grupos ACIPHEX em comparação com placebo nas semanas 2 e 4 (p
Um estudo internacional randomizado, duplo-cego, controlado por ativos foi realizado em 205 pacientes comparando 20 mg de ACIPHEX comprimidos de liberação retardada uma vez ao dia com 20 mg de omeprazol uma vez ao dia. O estudo foi projetado para fornecer pelo menos 80% de poder para excluir uma diferença de pelo menos 10% entre ACIPHEX 10mg e omeprazol, assumindo taxas de resposta de cura de quatro semanas de 93% para ambos os grupos. Em pacientes com úlceras duodenais definidas endoscopicamente tratados por até quatro semanas, ACIPHEX foi comparável ao omeprazol na produção de cicatrização de úlceras duodenais. As porcentagens de pacientes com cicatrização endoscópica em duas e quatro semanas são apresentadas abaixo:
ACIPHEX 20mg e omeprazol foram comparáveis na resolução completa dos sintomas.
A dosagem recomendada de ACIPHEX 20mg comprimidos de liberação retardada é de 20mg uma vez ao dia por 4 semanas.
Erradicação do Helicobacter pylori em pacientes com úlcera péptica ou doença não ulcerosa sintomática em adultos
estudo multicêntrico dos EUA foi uma comparação duplo-cego de grupos paralelos de comprimidos de liberação retardada de ACIPHEX, amoxicilina e claritromicina por 3, 7 ou 10 dias versus omeprazol, amoxicilina e claritromicina por 10 dias. A terapia consistiu em rabeprazol 20 mg duas vezes ao dia, amoxicilina 1000 mg duas vezes ao dia e claritromicina 500 mg duas vezes ao dia (RAC) ou omeprazol 20 mg duas vezes ao dia, amoxicilina 1000 mg duas vezes ao dia e claritromicina 500 mg duas vezes ao dia (OAC). Os pacientes com infecção por H. pylori foram estratificados na proporção de 1:1 para aqueles com úlcera péptica (ativa ou com história de úlcera nos últimos cinco anos) [PUD] e aqueles que eram sintomáticos, mas sem úlcera péptica [NPUD], determinado por endoscopia digestiva alta. As taxas globais de erradicação de H. pylori, definidas como 13C-UBT negativo para H. pylori ≥6 semanas a partir do final do tratamento, são mostradas na tabela a seguir. As taxas de erradicação nos regimes RAC de 7 e 10 dias foram semelhantes às do regime OAC de 10 dias usando as populações Intent-to-Treat (ITT) ou Per-Protocol (PP). As taxas de erradicação no regime RAC de 3 dias foram inferiores às dos outros regimes.
dosagem recomendada de ACIPHEX 20mg comprimidos de liberação retardada é de 20mg duas vezes ao dia com amoxicilina e claritromicina por 7 dias.
Condições Patológicas Hipersecretórias, Incluindo Síndrome de Zollinger-Ellison em Adultos
Doze pacientes com hipersecreção gástrica idiopática ou síndrome de Zollinger-Ellison foram tratados com sucesso com ACIPHEX 10mg comprimidos de liberação retardada em doses de 20 a 120mg por até 12 meses. ACIPHEX 10mg produziu inibição satisfatória da secreção de ácido gástrico em todos os pacientes e resolução completa dos sinais e sintomas de doença ácido-péptica quando presente. ACIPHEX 20mg também preveniu a recorrência de hipersecreção gástrica e manifestações de doença ácido-péptica em todos os pacientes. As altas doses de ACIPHEX usadas para tratar esta pequena coorte de pacientes com hipersecreção gástrica foram bem toleradas.
A dose inicial recomendada de ACIPHEX comprimidos de liberação retardada é de 60 mg uma vez ao dia.
REFERÊNCIAS
1. Instituto de Padrões Clínicos e Laboratoriais (CLSI). Métodos para Testes de Susceptibilidade Antimicrobiana de Diluição para Bactérias que Crescem Aerobicamente; Padrão Aprovado - Décima Edição. Documento CLSI M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pensilvânia, 19087, EUA 2015.
INFORMAÇÃO DO PACIENTE
ACIPHEX® (a-se-feks) (rabeprazol sódico) comprimidos de liberação retardada
Qual é a informação mais importante que devo saber sobre ACIPHEX 10mg?
Você deve tomar ACIPHEX 20mg exatamente como prescrito, na dose mais baixa possível e pelo menor tempo necessário.
ACIPHEX 20mg pode ajudar seus sintomas relacionados ao ácido, mas você ainda pode ter sérios problemas estomacais. Converse com seu médico.
ACIPHEX 20mg pode causar efeitos colaterais graves, incluindo:
- Um tipo de problema renal (nefrite tubulointersticial aguda). Algumas pessoas que tomam medicamentos inibidores da bomba de prótons (IBP), incluindo ACIPHEX, podem desenvolver um problema renal chamado nefrite tubulointersticial aguda que pode ocorrer a qualquer momento durante o tratamento com ACIPHEX. Ligue para o seu médico imediatamente se tiver uma diminuição na quantidade de urina ou se tiver sangue na urina.
- Diarréia causada por uma infecção (Clostridium difficile) em seus intestinos. Ligue para o seu médico imediatamente se tiver fezes aquosas ou dor de estômago que não desaparece. Você pode ou não ter febre.
- Fraturas ósseas (quadril, punho ou coluna). Fraturas ósseas no quadril, punho ou coluna podem ocorrer em pessoas que tomam várias doses diárias de medicamentos IBP e por um longo período de tempo (um ano ou mais). Informe o seu médico se tiver uma fratura óssea, especialmente na anca, pulso ou coluna vertebral.
- Certos tipos de lúpus eritematoso. lúpus eritematoso é uma doença autoimune (as células imunes do corpo atacam outras células ou órgãos do corpo). Algumas pessoas que tomam medicamentos IBP, incluindo ACIPHEX, podem desenvolver certos tipos de lúpus eritematoso ou piorar o lúpus que já têm. Ligue para o seu médico imediatamente se tiver dores nas articulações novas ou agravadas ou uma erupção cutânea nas bochechas ou braços que piora ao sol.
Converse com seu médico sobre o risco desses efeitos colaterais graves.
ACIPHEX 10mg pode ter outros efeitos colaterais graves. Consulte “Quais são os possíveis efeitos colaterais do ACIPHEX 10mg?”
O que é ACIPHEX 20mg?
ACIPHEX 10mg é um medicamento de prescrição chamado inibidor da bomba de prótons (PPI).
ACIPHEX 20mg reduz a quantidade de ácido no estômago.
Em adultos, ACIPHEX é usado para:
- 8 semanas até 16 semanas para curar danos relacionados ao ácido no revestimento do esôfago (chamado esofagite erosiva ou EE) e para aliviar sintomas, como dor de azia.
- manutenção da cicatrização do esôfago e alívio dos sintomas relacionados à EE. Não se sabe se ACIPHEX 20mg é seguro e eficaz se usado por mais de 12 meses (1 ano).
- até 4 semanas para tratar azia diurna e noturna e outros sintomas que ocorrem com a doença do refluxo gastroesofágico (DRGE).
- até 4 semanas para a cicatrização e alívio dos sintomas de úlceras duodenais.
- 7 dias com certos medicamentos antibióticos para tratar uma infecção e úlceras estomacais (duodenais) causadas por uma bactéria chamada H. pylori.
- o tratamento a longo prazo de condições em que seu estômago produz muito ácido. Isso inclui uma condição rara chamada síndrome de Zollinger-Ellison.
Em adolescentes com 12 anos ou mais, ACIPHEX 10mg é usado por até 8 semanas para tratar os sintomas da DRGE.
Não se sabe se ACIPHEX é seguro e eficaz em crianças com menos de 12 anos de idade para outros usos.
ACIPHEX comprimidos de libertação retardada não deve ser utilizado em crianças com menos de 12 anos de idade.
Não tome ACIPHEX 10mg se:
- alérgico ao rabeprazol, a qualquer outro medicamento IBP ou a qualquer um dos ingredientes de ACIPHEX. Consulte o final deste Guia de Medicação para obter uma lista completa de ingredientes.
- tomar um medicamento que contém rilpivirina (EDURANT, COMPLERA, ODEFSEY) usado para tratar o HIV-1 (vírus da imunodeficiência humana).
Antes de tomar ACIPHEX, informe o seu médico sobre todas as suas condições médicas, incluindo se você:
- tem baixos níveis de magnésio, baixos níveis de cálcio e baixos níveis de potássio no sangue.
- tem problemas de fígado.
- estão grávidas ou planejam engravidar. Não se sabe se ACIPHEX 20mg pode prejudicar o feto.
- está amamentando ou planeja amamentar. Não se sabe se ACIPHEX 10mg passa para o leite materno. Fale com o seu médico sobre a melhor forma de alimentar o seu bebé se estiver a tomar ACIPHEX.
Informe o seu médico sobre todos os medicamentos que toma, incluindo medicamentos prescritos e de venda livre, vitaminas e suplementos de ervas. Informe especialmente o seu médico se toma um antibiótico que contém claritromicina ou amoxicilina ou se toma varfarina (COUMADIN, JANTOVEN), metotrexato (OTREXUP, RASUVO, TREXALL, XATMEP), digoxina (LANOXIN) ou um comprimido de água (diurético).
Como devo tomar ACIPHEX?
- Tome ACIPHEX exatamente como prescrito.
- ACIPHEX é geralmente tomado 1 vez por dia. Seu médico lhe dirá a hora do dia para tomar ACIPHEX, com base em sua condição médica.
- ACIPHEX 10mg pode ser tomado com ou sem alimentos. O seu médico dir-lhe-á se deve tomar este medicamento com ou sem alimentos com base na sua condição médica.
- Engula cada comprimido de ACIPHEX 20mg inteiro. Não mastigue, esmague ou divida os comprimidos de ACIPHEX 10mg. Informe o seu médico se não conseguir engolir os comprimidos inteiros.
- Se você perder uma dose de ACIPHEX 10mg, tome-a o mais rápido possível. Se estiver quase na hora da próxima dose, você não deve tomar a dose esquecida. Deve tomar a sua próxima dose à hora habitual. Não tome 2 doses ao mesmo tempo.
- Se você tomar muito ACIPHEX 20mg, ligue para seu médico ou seu centro de controle de envenenamento em 1-800-222-1222 imediatamente, ou vá para a sala de emergência mais próxima.
- Se o seu médico prescrever medicamentos antibióticos com ACIPHEX, leia as informações do paciente que acompanham os medicamentos antibióticos antes de tomá-los.
Quais são os possíveis efeitos colaterais do ACIPHEX 20mg?
ACIPHEX 10mg pode causar efeitos colaterais graves, incluindo:
- Consulte “Qual é a informação mais importante que devo saber sobre ACIPHEX 20mg?”
- Interação com a varfarina. Tomar varfarina com um medicamento IBP pode levar a um risco aumentado de sangramento e morte. Se você tomar varfarina, seu médico pode verificar seu sangue para ver se você tem um risco aumentado de sangramento. Se tomar varfarina durante o tratamento com ACIPHEX 20mg, informe o seu médico imediatamente se tiver quaisquer sinais ou sintomas de hemorragia, incluindo:
- dor, inchaço ou desconforto
- dores de cabeça, tonturas ou fraqueza
- contusões incomuns (contusões que acontecem sem causa conhecida ou que crescem em tamanho)
- hemorragias nasais
- sangramento nas gengivas
- sangramento de cortes demora muito para parar
- sangramento menstrual mais pesado que o normal
- urina rosa ou marrom
- fezes vermelhas ou pretas
- tossindo sangue
- vômito de sangue ou vômito que se parece com borra de café
- Baixos níveis de vitamina B-12 no corpo pode acontecer em pessoas que tomaram ACIPHEX 10mg por um longo tempo (mais de 3 anos). Informe o seu médico se tiver sintomas de níveis baixos de vitamina B-12, incluindo falta de ar, tonturas, batimentos cardíacos irregulares, fraqueza muscular, pele pálida, sensação de cansaço, alterações de humor e formigueiro ou dormência nos braços e pernas.
- Baixos níveis de magnésio no corpo pode acontecer em pessoas que tomaram ACIPHEX 20mg por pelo menos 3 meses. Informe o seu médico se tiver sintomas de níveis baixos de magnésio, incluindo convulsões, tonturas, batimentos cardíacos irregulares, nervosismo, dores musculares ou fraqueza e espasmos nas mãos, pés ou voz.
- Crescimentos do estômago (pólipos da glândula fúndica). As pessoas que tomam medicamentos IBP por muito tempo têm um risco aumentado de desenvolver um certo tipo de crescimento do estômago chamado pólipos da glândula fúndica, especialmente após tomar medicamentos IBP por mais de 1 ano.
- Reações cutâneas graves. ACIPHEX pode causar reações cutâneas raras, mas graves, que podem afetar qualquer parte do seu corpo. Essas reações cutâneas graves podem precisar ser tratadas em um hospital e podem ser fatais:
- Erupção cutânea que pode apresentar bolhas, descamação ou sangramento em qualquer parte da pele (incluindo lábios, olhos, boca, nariz, genitais, mãos ou pés).
- Você também pode ter febre, calafrios, dores no corpo, falta de ar ou aumento dos gânglios linfáticos.
Pare de tomar ACIPHEX 20mg e chame seu médico imediatamente. Estes sintomas podem ser o primeiro sinal de uma reação cutânea grave.
Os efeitos colaterais mais comuns de ACIPHEX 20mg em adultos incluem: dor, dor de garganta, gases, infecção e constipação.
Os efeitos colaterais mais comuns de ACIPHEX em adolescentes com 12 anos de idade ou mais incluem: dor de cabeça, diarréia, náusea, vômito e dor na região do estômago (abdômen).
Estes não são todos os possíveis efeitos colaterais do ACIPHEX. Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
Como devo armazenar o ACIPHEX?
Armazene os comprimidos de ACIPHEX em local seco em temperatura ambiente entre 20°C e 25°C (68°F a 77°F).
Mantenha ACIPHEX 20mg e todos os medicamentos fora do alcance das crianças.
Informações gerais sobre o uso seguro e eficaz de ACIPHEX.
Os medicamentos às vezes são prescritos para outros fins que não os listados em um Guia de Medicamentos. Não use ACIPHEX para uma condição para a qual não foi prescrito. Não dê ACIPHEX a outras pessoas, mesmo que tenham os mesmos sintomas que você. Pode prejudicá-los.
Você pode pedir ao seu médico ou farmacêutico informações sobre ACIPHEX escritas para profissionais de saúde.
Quais são os ingredientes de ACIPHEX 10mg?
Ingrediente ativo: rabeprazol sódico
Ingredientes inativos: cera de carnaúba, crospovidona, monoglicerídeos diacetilados, etilcelulose, hidroxipropilcelulose, ftalato de hipromelose, estearato de magnésio, manitol, hidróxido de sódio, estearil fumarato de sódio, talco e dióxido de titânio. O óxido de ferro amarelo é o agente corante para o revestimento do comprimido. O óxido de ferro vermelho é o pigmento da tinta.
Este Guia de Medicação foi aprovado pela Food and Drug Administration dos EUA. Revisado: 03/2022
