Arimidex 1mg Anastrozole Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Arimidex e como é usado?
Arimidex 1mg é um medicamento de prescrição usado para tratar os sintomas do câncer de mama em mulheres na pós-menopausa. Arimidex pode ser usado sozinho ou com outros medicamentos.
Arimidex pertence a uma classe de medicamentos chamados Antineoplásicos, Inibidores da Aromatase.
Não se sabe se Arimidex é seguro e eficaz em crianças.
Quais são os possíveis efeitos colaterais do Arimidex?
Arimidex pode causar efeitos colaterais graves, incluindo:
- falta de ar,
- fratura óssea,
- glândulas inchadas,
- náusea,
- dor de estômago superior,
- coceira,
- cansaço,
- perda de apetite,
- urina escura,
- fezes cor de barro,
- amarelecimento da pele ou dos olhos (icterícia),
- dormência ou fraqueza repentina (especialmente em um lado do corpo),
- dor de cabeça súbita e intensa,
- fala arrastada,
- problemas de visão ou equilíbrio,
- febre,
- dor de garganta,
- inchaço no rosto ou na língua,
- queimando em seus olhos,
- dor na pele e
- erupção cutânea vermelha ou roxa que se espalha (especialmente no rosto ou na parte superior do corpo) com bolhas e descamação
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Arimidex incluem:
- fraqueza,
- ondas de calor,
- dormência ou sensação de formigamento na pele,
- inchaço nos tornozelos ou pés,
- dor nas articulações ou rigidez,
- problemas com os dedos ao segurar,
- dor de garganta,
- dor de cabeça,
- dor nas costas,
- dor no osso,
- depressão,
- mudanca de humor,
- problemas de sono (insônia),
- pressão alta,
- dor de cabeça severa,
- visão embaçada,
- batendo em seu pescoço ou ouvidos,
- náusea,
- vômito, e
- erupção cutânea leve
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Arimidex. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
DESCRIÇÃO
Os comprimidos de ARIMIDEX (anastrozol) para administração oral contêm 1 mg de anastrozol, um inibidor não esteróide da aromatase. É quimicamente descrito como 1,3-Benzenodiacetonitrila, a, a, a', a'-tetrametil-5-(1H-1,2,4-triazol-1-ilmetil). Sua fórmula molecular é C17H19N5 e sua fórmula estrutural é:
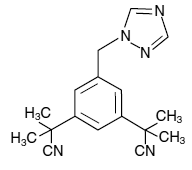
Anastrozol é um pó esbranquiçado com um peso molecular de 293,4. O anastrozol tem solubilidade aquosa moderada (0,5 mg/mL a 25°C); solubilidade é independente do pH na faixa fisiológica. O anastrozol é livremente solúvel em metanol, acetona, etanol e tetrahidrofurano e muito solúvel em acetonitrila.
Cada comprimido contém como ingredientes inativos: lactose, estearato de magnésio, hidroxipropilmetilcelulose, polietilenoglicol, povidona, amidoglicolato de sódio e dióxido de titânio.
INDICAÇÕES
Tratamento Adjuvante
ARIMIDEX é indicado para o tratamento adjuvante de mulheres na pós-menopausa com câncer de mama inicial positivo para receptores hormonais.
Tratamento de primeira linha
ARIMIDEX 1mg é indicado para o tratamento de primeira linha de mulheres na pós-menopausa com câncer de mama com receptor hormonal positivo ou receptor hormonal desconhecido localmente avançado ou metastático.
Tratamento de segunda linha
ARIMIDEX 1mg é indicado para o tratamento de câncer de mama avançado em mulheres na pós-menopausa com progressão da doença após terapia com tamoxifeno. Pacientes com doença ER-negativa e pacientes que não responderam à terapia anterior com tamoxifeno raramente responderam ao ARIMIDEX.
DOSAGEM E ADMINISTRAÇÃO
Dose Recomendada
A dose de ARIMIDEX é um comprimido de 1 mg tomado uma vez ao dia. Para pacientes com câncer de mama avançado, ARIMIDEX 1mg deve ser continuado até a progressão do tumor. ARIMIDEX pode ser tomado com ou sem alimentos.
Para o tratamento adjuvante do câncer de mama inicial em mulheres na pós-menopausa, a duração ideal da terapia é desconhecida. No estudo ATAC, ARIMIDEX 1mg foi administrado por cinco anos [ver Estudos clínicos ].
Nenhum ajuste de dose é necessário para pacientes com insuficiência renal ou para pacientes idosos [ver Uso em populações específicas ].
Pacientes com Insuficiência Hepática
Nenhuma alteração na dose é recomendada para pacientes com insuficiência hepática leve a moderada. ARIMIDEX não foi estudado em pacientes com insuficiência hepática grave [ver Uso em populações específicas ].
COMO FORNECIDO
Formas de dosagem e pontos fortes
Os comprimidos são brancos, biconvexos, revestidos por película contendo 1 mg de anastrozol. Os comprimidos são impressos em um lado com um logotipo composto por uma letra “A” (maiúscula) com uma ponta de seta presa ao pé da perna direita estendida do “A” e no verso com a marcação de força do comprimido “Adx 1 ”.
Armazenamento e manuseio
Estes comprimidos são fornecidos em frascos de 30 comprimidos ( NDC 0310-0201-30).
Armazenar
Armazenar em temperatura ambiente controlada, 20-25°C (68-77°F) [consulte USP ].
Distribuído por: AstraZeneca Pharmaceuticals LP Wilmington, DE 19850. Revisado: maio de 2014
EFEITOS COLATERAIS
As reações adversas graves com ARIMIDEX que ocorrem em menos de 1 em 10.000 pacientes são: 1) reações cutâneas como lesões, úlceras ou bolhas; 2) reações alérgicas com inchaço da face, lábios, língua e/ou garganta. Isso pode causar dificuldade em engolir e/ou respirar; e 3) alterações nos exames de sangue da função hepática, incluindo inflamação do fígado com sintomas que podem incluir uma sensação geral de mal-estar, com ou sem icterícia, dor no fígado ou inchaço do fígado.
Reações adversas comuns (ocorrendo com incidência ≥ 10%) em mulheres tomando ARIMIDEX 1mg incluíram: ondas de calor, astenia, artrite, dor, artralgia, hipertensão, depressão, náusea e vômito, erupção cutânea, osteoporose, fraturas, dor nas costas, insônia, cefaleia, dor óssea, edema periférico, aumento da tosse, dispneia, faringite e linfedema.
No estudo ATAC, a reação adversa relatada mais comum (> 0,1%) levando à descontinuação da terapia para ambos os grupos de tratamento foram ondas de calor, embora houvesse menos pacientes que descontinuaram a terapia como resultado de ondas de calor no grupo ARIMIDEX 1mg.
Como os ensaios clínicos são conduzidos em condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparadas às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
Experiência de Ensaios Clínicos
Terapia adjuvante
Os dados de reações adversas para terapia adjuvante são baseados no estudo ATAC [ver Estudos clínicos ]. A duração mediana do tratamento adjuvante para avaliação de segurança foi de 59,8 meses e 59,6 meses para pacientes recebendo ARIMIDEX 1 mg e tamoxifeno 20 mg, respectivamente.
As reações adversas que ocorrem com incidência de pelo menos 5% em qualquer grupo de tratamento durante o tratamento ou dentro de 14 dias após o término do tratamento são apresentadas na Tabela 1.
Certas reações adversas e combinações de reações adversas foram especificadas prospectivamente para análise, com base nas propriedades farmacológicas conhecidas e perfis de efeitos colaterais dos dois medicamentos (ver Tabela 2).
Eventos Cardiovasculares Isquêmicos
Entre os braços de tratamento na população geral de 6.186 pacientes, não houve diferença estatística nos eventos cardiovasculares isquêmicos (4% de ARIMIDEX versus 3% de tamoxifeno).
Na população geral, angina pectoris foi relatada em 71/3.092 (2,3%) pacientes no braço de ARIMIDEX 1mg e 51/3.094 (1,6%) pacientes no braço de tamoxifeno; infarto do miocárdio foi relatado em 37/3.092 (1,2%) pacientes no braço de ARIMIDEX 1mg e 34/3.094 (1,1%) pacientes no braço de tamoxifeno.
Em mulheres com doença cardíaca isquêmica pré-existente 465/6186 (7,5%), a incidência de eventos cardiovasculares isquêmicos foi de 17% em pacientes em uso de ARIMIDEX e 10% em pacientes em uso de tamoxifeno. Nesta população de pacientes, angina pectoris foi relatada em 25/216 (11,6%) pacientes que receberam ARIMIDEX e 13/249 (5,2%) pacientes que receberam tamoxifeno; infarto do miocárdio foi relatado em 2/216 (0,9%) pacientes que receberam ARIMIDEX e 8/249 (3,2%) pacientes que receberam tamoxifeno.
Achados de Densidade Mineral Óssea
Os resultados do subestudo ósseo do estudo ATAC aos 12 e 24 meses demonstraram que os pacientes que receberam ARIMIDEX 1mg tiveram uma diminuição média na coluna lombar e na densidade mineral óssea total do quadril (DMO) em comparação com a linha de base. Os pacientes que receberam tamoxifeno tiveram um aumento médio na coluna lombar e na DMO total do quadril em comparação com a linha de base.
Como ARIMIDEX reduz os níveis circulantes de estrogênio, pode causar uma redução na densidade mineral óssea.
Um estudo pós-comercialização avaliou os efeitos combinados de ARIMIDEX 1mg e do bisfosfonato risedronato nas alterações da linha de base na DMO e marcadores de reabsorção e formação óssea em mulheres na pós-menopausa com câncer de mama inicial positivo para receptores hormonais. Todos os pacientes receberam suplementação de cálcio e vitamina D. Aos 12 meses, pequenas reduções na densidade mineral óssea da coluna lombar foram observadas em pacientes que não receberam bisfosfonatos. O tratamento com bisfosfonatos preservou a densidade óssea na maioria dos pacientes com risco de fratura.
Mulheres na pós-menopausa com câncer de mama inicial programado para serem tratadas com ARIMIDEX 1mg devem ter seu estado ósseo controlado de acordo com as diretrizes de tratamento já disponíveis para mulheres na pós-menopausa com risco semelhante de fratura por fragilidade.
Colesterol
Durante o estudo ATAC, mais pacientes que receberam ARIMIDEX 1mg apresentaram colesterol sérico elevado em comparação com os pacientes que receberam tamoxifeno (9% versus 3,5%, respectivamente).
Um estudo pós-comercialização também avaliou quaisquer efeitos potenciais de ARIMIDEX no perfil lipídico. Na população de análise primária para lipídios (ARIMIDEX 1mg sozinho), não houve alteração clinicamente significativa no LDL-C desde a linha de base até 12 meses e HDL-C desde a linha de base até 12 meses.
Na população secundária para lipídios (ARIMIDEX + risedronato), também não houve alteração clinicamente significativa no LDL-C e HDL-C desde o início até 12 meses.
Em ambas as populações para lipídios, não houve diferença clinicamente significativa no colesterol total (CT) ou triglicerídeos séricos (TG) em 12 meses em comparação com o valor basal.
Neste estudo, o tratamento por 12 meses apenas com ARIMIDEX 1mg teve um efeito neutro no perfil lipídico. O tratamento combinado com ARIMIDEX e risedronato também teve um efeito neutro no perfil lipídico.
O estudo fornece evidências de que mulheres na pós-menopausa com câncer de mama inicial programado para serem tratadas com ARIMIDEX 1mg devem ser tratadas usando as diretrizes atuais do Programa Nacional de Educação sobre o Colesterol para o gerenciamento baseado em risco cardiovascular de pacientes individuais com elevações de LDL.
Outras reações adversas
Os pacientes que receberam ARIMIDEX tiveram um aumento nos distúrbios articulares (incluindo artrite, artrose e artralgia) em comparação com os pacientes que receberam tamoxifeno. Os pacientes que receberam ARIMIDEX tiveram um aumento na incidência de todas as fraturas (especificamente fraturas da coluna, quadril e punho) [315 (10%)] em comparação com os pacientes que receberam tamoxifeno [209 (7%)].
Os pacientes que receberam ARIMIDEX 1mg tiveram uma maior incidência de síndrome do túnel do carpo [78 (2,5%)] em comparação com os pacientes que receberam tamoxifeno [22 (0,7%)].
Sangramento vaginal ocorreu mais frequentemente nas pacientes tratadas com tamoxifeno versus pacientes tratadas com ARIMIDEX 317 (10%) versus 167 (5%), respectivamente.
As pacientes que receberam ARIMIDEX tiveram uma incidência menor de ondas de calor, sangramento vaginal, corrimento vaginal, câncer de endométrio, eventos tromboembólicos venosos e eventos cerebrovasculares isquêmicos em comparação com pacientes que receberam tamoxifeno.
Resultados de segurança de acompanhamento médio de 10 anos do estudo ATAC
Os resultados são consistentes com as análises anteriores.
As reações adversas graves foram semelhantes entre ARIMIDEX (50%) e tamoxifeno (51%).
- Os eventos cardiovasculares foram consistentes com os perfis de segurança conhecidos de ARIMIDEX e tamoxifeno.
- A incidência cumulativa de todas as primeiras fraturas (graves e não graves, ocorrendo durante ou após o tratamento) foi maior no grupo ARIMIDEX (15%) em comparação com o grupo tamoxifeno (11%). Este aumento da primeira taxa de fratura durante o tratamento não continuou no período de acompanhamento pós-tratamento.
- A incidência cumulativa de novos cânceres primários foi semelhante no grupo ARIMIDEX 1mg (13,7%) em comparação com o grupo tamoxifeno (13,9%). Consistente com as análises anteriores, o câncer endometrial foi maior no grupo tamoxifeno (0,8%) em comparação com o grupo ARIMIDEX (0,2%).
- número total de mortes (durante ou fora do estudo) foi semelhante entre os grupos de tratamento. Houve mais mortes relacionadas ao câncer de mama no grupo de tratamento com tamoxifeno do que no ARIMIDEX 1mg.
Terapia de primeira linha
As reações adversas que ocorrem com uma incidência de pelo menos 5% em qualquer grupo de tratamento dos ensaios 0030 e 0027 durante ou dentro de 2 semanas após o final do tratamento são mostradas na Tabela 3.
Experiências adversas menos frequentes relatadas em pacientes que receberam ARIMIDEX 1mg l mg no Ensaio 0030 ou no Ensaio 0027 foram semelhantes às relatadas para a terapia de segunda linha.
Com base nos resultados da terapia de segunda linha e no perfil de segurança estabelecido do tamoxifeno, as incidências de 9 categorias de eventos adversos pré-especificadas potencialmente relacionadas a uma ou ambas as terapias devido à sua farmacologia foram analisadas estatisticamente. Não foram observadas diferenças significativas entre os grupos de tratamento.
Terapia de segunda linha
ARIMIDEX 1mg foi tolerado em dois ensaios clínicos controlados (ou seja, Ensaios 0004 e 0005), com menos de 3,3% dos pacientes tratados com ARIMIDEX e 4,0% dos pacientes tratados com acetato de megestrol descontinuando devido a uma reação adversa.
A principal reação adversa mais comum com ARIMIDEX do que com acetato de megestrol foi diarreia. As reações adversas relatadas em mais de 5% dos pacientes em qualquer um dos grupos de tratamento nesses dois ensaios clínicos controlados, independentemente da causalidade, são apresentadas abaixo:
Corpo como um todo: síndrome gripal; febre; dor de pescoço; Mal-estar; lesão acidental; infecção
Cardiovascular: Hipertensão; tromboflebite
Hepático: Gama GT aumentada; SGOT aumentado; SGPT aumentado Hematológico: Anemia; leucopenia
Metabólico e Nutricional: Fosfatase alcalina aumentada; perda de peso
Os níveis séricos médios de colesterol total aumentaram 0,5 mmol/L entre os pacientes que receberam ARIMIDEX. Foi demonstrado que o aumento do colesterol LDL contribui para essas alterações.
Musculoesquelético: Mialgia; artralgia; fratura patológica
Nervoso: Sonolência; confusão; insônia; ansiedade; nervosismo
Respiratório: Sinusite; bronquite; rinite
Pele e anexos: Queda de cabelo (alopecia); prurido
Urogenital: Infecção do trato urinário; Dor no peito
As incidências dos seguintes grupos de reações adversas potencialmente relacionadas com uma ou ambas as terapias por causa de sua farmacologia foram estatisticamente analisadas: ganho de peso, edema, doença tromboembólica, distúrbios gastrointestinais, ondas de calor e secura vaginal. Esses seis grupos e as reações adversas capturadas nos grupos foram definidos prospectivamente. Os resultados são mostrados na tabela abaixo.
Experiência pós-marketing
Essas reações adversas são relatadas voluntariamente por uma população de tamanho incerto. Portanto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento. O seguinte foi relatado no uso pós-aprovação de Arimidex:
- Eventos hepatobiliares incluindo aumentos na fosfatase alcalina, alanina aminotransferase, aspartato aminotransferase, gama-GT e bilirrubina; hepatite
- Erupção cutânea incluindo casos de distúrbios mucocutâneos, como eritema multiforme e síndrome de Stevens-Johnson
- Casos de reações alérgicas incluindo angioedema, urticária e anafilaxia [ver CONTRA-INDICAÇÕES ]
- Mialgia, dedo em gatilho e hipercalcemia (com ou sem aumento do hormônio da paratireoide)
INTERAÇÕES MEDICAMENTOSAS
Tamoxifeno
coadministração de anastrozol e tamoxifeno em pacientes com câncer de mama reduziu a concentração plasmática de anastrozol em 27%. No entanto, a coadministração de anastrozol e tamoxifeno não afetou a farmacocinética do tamoxifeno ou do N-desmetiltamoxifeno. Em um acompanhamento médio de 33 meses, a combinação de ARIMIDEX e tamoxifeno não demonstrou nenhum benefício de eficácia quando comparado ao tamoxifeno em todos os pacientes, bem como na subpopulação positiva para receptores hormonais. Este braço de tratamento foi descontinuado do estudo [ver Estudos clínicos ]. Com base nos resultados clínicos e farmacocinéticos do estudo ATAC, o tamoxifeno não deve ser administrado com anastrozol.
Estrogênio
Terapias contendo estrogênio não devem ser usadas com ARIMIDEX 1mg, pois podem diminuir sua ação farmacológica.
Varfarina
Em um estudo realizado em 16 voluntários do sexo masculino, o anastrozol não alterou a exposição (medida por Cmax e AUC) e atividade anticoagulante (medida pelo tempo de protrombina, tempo de tromboplastina parcial ativada e tempo de trombina) de R- e S- varfarina.
Citocromo P450 Com base nos resultados in vitro e in vivo, é improvável que a coadministração de ARIMIDEX 1 mg afete outros medicamentos como resultado da inibição do citocromo P450 [ver FARMACOLOGIA CLÍNICA ].
AVISOS
Incluído como parte do PRECAUÇÕES seção.
PRECAUÇÕES
Eventos Cardiovasculares Isquêmicos
Em mulheres com doença cardíaca isquêmica pré-existente, foi observada uma incidência aumentada de eventos cardiovasculares isquêmicos com ARIMIDEX no estudo ATAC (17% dos pacientes em uso de ARIMIDEX 1mg e 10% dos pacientes em uso de tamoxifeno). Considerar o risco e os benefícios da terapia com ARIMIDEX em pacientes com doença cardíaca isquêmica pré-existente [ver REAÇÕES ADVERSAS ]
Efeitos ósseos
Os resultados do subestudo ósseo do estudo ATAC aos 12 e 24 meses demonstraram que os pacientes que receberam ARIMIDEX tiveram uma diminuição média na coluna lombar e na densidade mineral óssea total do quadril (DMO) em comparação com a linha de base. Os pacientes que receberam tamoxifeno tiveram um aumento médio na coluna lombar e na DMO total do quadril em comparação com a linha de base. Considere o monitoramento da densidade mineral óssea em pacientes tratados com ARIMIDEX [ver REAÇÕES ADVERSAS ].
Colesterol
Durante o estudo ATAC, mais pacientes que receberam ARIMIDEX 1mg apresentaram colesterol sérico elevado em comparação com pacientes que receberam tamoxifeno (9% versus 3,5%, respectivamente) [ver REAÇÕES ADVERSAS ].
Informações de Aconselhamento do Paciente
Ver Rotulagem do paciente aprovada pela FDA (INFORMAÇÕES DO PACIENTE).
Gravidez
As pacientes devem ser informadas de que ARIMIDEX 1mg pode causar danos ao feto. Eles também devem ser informados de que ARIMIDEX 1mg não é para uso em mulheres na pré-menopausa; portanto, se engravidarem, devem parar de tomar ARIMIDEX e contatar imediatamente seu médico.
Reações alérgicas (hipersensibilidade)
Os doentes devem ser informados da possibilidade de reações alérgicas graves com inchaço da face, lábios, língua e/ou garganta (angioedema) que podem causar dificuldade em engolir e/ou respirar e devem procurar assistência médica imediatamente.
Eventos Cardiovasculares Isquêmicos
Pacientes com doença cardíaca isquêmica pré-existente devem ser informados de que um aumento na incidência de eventos cardiovasculares foi observado com o uso de ARIMIDEX 1mg em comparação ao uso de tamoxifeno. Se os pacientes apresentarem dor torácica nova ou agravada ou falta de ar, devem procurar atendimento médico imediatamente.
Efeitos ósseos
Os pacientes devem ser informados de que ARIMIDEX reduz o nível de estrogênio. Isso pode levar a uma perda do conteúdo mineral dos ossos, o que pode diminuir a resistência óssea. Uma possível consequência da diminuição do conteúdo mineral dos ossos é o aumento do risco de fraturas.
Colesterol
Os pacientes devem ser informados de que um aumento do nível de colesterol pode ser observado durante o tratamento com ARIMIDEX.
Cócegas, formigamento ou dormência
Os pacientes devem ser informados de que, se sentirem cócegas, formigamento ou dormência, devem notificar seu médico.
Tamoxifeno
Os pacientes devem ser aconselhados a não tomar ARIMIDEX com Tamoxifeno.
Doses Perdidas
Informe os pacientes que, se esquecerem de uma dose, tome-a assim que se lembrarem. Se estiver quase na hora da próxima dose, pule a dose esquecida e tome a próxima dose programada regularmente. Os pacientes não devem tomar duas doses ao mesmo tempo.
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Um estudo convencional de carcinogênese em ratos com doses de 1,0 a 25 mg/kg/dia (cerca de 10 a 243 vezes a dose máxima diária recomendada em humanos com base em mg/m²) administrada por gavagem oral por até 2 anos revelou um aumento na incidência de adenoma e carcinoma hepatocelular e pólipos estromais uterinos em mulheres e adenoma de tireoide em homens na dose alta. Foi observado um aumento relacionado com a dose na incidência de hiperplasia ovariana e uterina em mulheres. Na dose de 25 mg/kg/dia, os níveis plasmáticos de AUC0-24 h em ratos foram 110 a 125 vezes maiores do que o nível exibido em voluntárias na pós-menopausa na dose recomendada. Um estudo separado de carcinogenicidade em camundongos com doses orais de 5 a 50 mg/kg/dia (cerca de 24 a 243 vezes a dose máxima diária recomendada em humanos com base em mg/m²) por até 2 anos produziu um aumento na incidência de doenças benignas tumores do estroma ovariano, células epiteliais e da granulosa em todos os níveis de dose. Um aumento relacionado à dose na incidência de hiperplasia ovariana também foi observado em camundongos fêmeas. Essas alterações ovarianas são consideradas efeitos específicos de roedores da inibição da aromatase e são de significância questionável para os seres humanos. A incidência de linfossarcoma foi aumentada em homens e mulheres na dose alta. Na dose de 50 mg/kg/dia, os níveis plasmáticos de AUC em camundongos foram 35 a 40 vezes maiores do que o nível exibido em voluntárias na pós-menopausa na dose recomendada.
ARIMIDEX 1mg não demonstrou ser mutagênico em testes in vitro (testes bacterianos de Ames e E. coli, ensaio de mutação do gene CHO-K1) ou clastogênico in vitro (aberrações cromossômicas em linfócitos humanos) ou in vivo (teste de micronúcleo em ratos) .
A administração oral de anastrozol a ratas (desde 2 semanas antes do acasalamento até o 7º dia de gestação) produziu incidência significativa de infertilidade e redução do número de gestações viáveis na dose de 1 mg/kg/dia (cerca de 10 vezes a dose humana recomendada na base de mg/m²). e 9 vezes maior do que a AUC0-24 h encontrada em voluntárias na pós-menopausa na dose recomendada). A perda pré-implantação de óvulos ou fetos foi aumentada em doses iguais ou superiores a 0,02 mg/kg/dia (cerca de um quinto da dose humana recomendada com base em mg/m²). A recuperação da fertilidade foi observada após um período sem administração de 5 semanas que se seguiu a 3 semanas de administração. Não se sabe se estes efeitos observados em ratos fêmeas são indicativos de diminuição da fertilidade em humanos.
Estudos de dose múltipla em ratos administrados com anastrozol por 6 meses em doses iguais ou superiores a 1 mg/kg/dia (que produziram anastrozol Cssmax e AUC 0-24 h que foram 19 e 9 vezes maiores do que os respectivos valores encontrados na pós-menopausa voluntárias na dose recomendada) resultou em hipertrofia dos ovários e presença de cistos foliculares. Além disso, úteros hiperplásicos foram observados em estudos de 6 meses em cadelas administradas com doses iguais ou superiores a 1 mg/kg/dia (que produziram Cssmax e AUC0-24 h do anastrozol plasmático que foram 22 vezes e 16 vezes maiores do que os respectivos valores encontrados em mulheres na pós-menopausa na dose recomendada). Não se sabe se esses efeitos nos órgãos reprodutivos de animais estão associados a diminuição da fertilidade em mulheres na pré-menopausa.
Uso em populações específicas
Gravidez
Gravidez Categoria X [Vejo CONTRA-INDICAÇÕES ]
ARIMIDEX pode causar danos ao feto quando administrado a mulheres grávidas e não oferece benefício clínico para mulheres na pré-menopausa com câncer de mama. ARIMIDEX é contraindicado em mulheres grávidas ou que possam engravidar. Em estudos com animais, o anastrozol causou falha na gravidez, aumento da perda de gravidez e sinais de atraso no desenvolvimento fetal. Não há estudos de uso de ARIMIDEX 1mg em mulheres grávidas. Se ARIMIDEX 1mg for usado durante a gravidez, ou se a paciente engravidar enquanto estiver recebendo este medicamento, a paciente deve ser informada sobre o risco potencial para o feto e o risco potencial de perda da gravidez.
Em estudos de reprodução animal, ratas e coelhas grávidas receberam anastrozol durante a organogênese em doses iguais ou superiores a 1 (ratos) e 1/3 (coelhos) da dose humana recomendada em mg/m². Em ambas as espécies, o anastrozol atravessou a placenta e houve aumento da perda gestacional (aumento da perda pré e/ou pós-implantação, aumento da reabsorção e diminuição do número de fetos vivos). Em ratos, esses efeitos foram relacionados à dose e os pesos placentários aumentaram significativamente. Fetotoxicidade, incluindo atraso no desenvolvimento fetal (ou seja, ossificação incompleta e peso corporal fetal reduzido), ocorreu em ratos em doses de anastrozol que produziram níveis plasmáticos de pico 19 vezes maiores do que os níveis séricos em humanos na dose terapêutica (AUC 0-24h 9 vezes maior) . Em coelhas, o anastrozol causou falha na gravidez em doses iguais ou superiores a 16 vezes a dose humana recomendada em mg/m² [ver Toxicologia e/ou Farmacologia Animal ].
Mães que amamentam
Não se sabe se o anastrozol é excretado no leite humano. Como muitos medicamentos são excretados no leite humano e por causa da tumorigenicidade demonstrada para o anastrozol em estudos com animais, ou o potencial de reações adversas graves em lactentes, deve-se decidir entre descontinuar a amamentação ou descontinuar o medicamento, levando em consideração os importância do medicamento para a mãe.
Uso Pediátrico
Os estudos clínicos em pacientes pediátricos incluíram um estudo controlado por placebo em meninos púberes de idade adolescente com ginecomastia e um estudo de braço único em meninas com síndrome de McCune-Albright e puberdade precoce progressiva. A eficácia de ARIMIDEX 1mg no tratamento da ginecomastia puberal em meninos adolescentes e no tratamento da puberdade precoce em meninas com Síndrome de McCune-Albright não foi demonstrada.
Estudo de ginecomastia
Um estudo multicêntrico, randomizado, duplo-cego, controlado por placebo, envolveu 80 meninos com ginecomastia puberal com idades entre 11 e 18 anos. Os pacientes foram randomizados para um regime diário de ARIMIDEX 1 mg ou placebo. Após 6 meses de tratamento, não houve diferença estatisticamente significativa na porcentagem de pacientes que apresentaram uma redução ≥ 50% na ginecomastia (análise de eficácia primária). As análises secundárias de eficácia (mudança absoluta no volume mamário, a porcentagem de pacientes que tiveram qualquer redução no volume calculado de ginecomastia, resolução da dor mamária) foram consistentes com a análise primária de eficácia. As concentrações séricas de estradiol no mês 6 de tratamento foram reduzidas em 15,4% no grupo ARIMIDEX e 4,5% no grupo placebo.
As reações adversas que foram avaliadas como relacionadas ao tratamento pelos investigadores ocorreram em 16,3% dos pacientes tratados com ARIMIDEX e 8,1% dos pacientes tratados com placebo, sendo as mais frequentes acne (7% ARIMIDEX e 2,7% placebo) e cefaleia (7 % ARIMIDEX 1mg e 0% placebo); todas as outras reações adversas mostraram pequenas diferenças entre os grupos de tratamento. Um paciente tratado com ARIMIDEX 1mg descontinuou o estudo devido ao aumento testicular. A alteração média subtraída da linha de base no volume testicular após 6 meses de tratamento foi de + 6,6 ± 7,9 cm³ nos pacientes tratados com ARIMIDEX e + 5,2 ± 8,0 cm³ no grupo placebo.
Estudo da Síndrome de McCune-Albright
Um estudo multicêntrico, de braço único e aberto foi realizado em 28 meninas com síndrome de McCune-Albright e puberdade precoce progressiva com idade entre 2 e
Cinco pacientes (18%) apresentaram reações adversas que foram consideradas possivelmente relacionadas ao ARIMIDEX. Estes foram náuseas, acne, dor em uma extremidade, aumento da alanina transaminase e aspartato transaminase e dermatite alérgica.
Farmacocinética em Pacientes Pediátricos
Após administração múltipla de 1 mg uma vez ao dia em pacientes pediátricos, o tempo médio para atingir a concentração máxima de anastrozol foi de 1 hora. Os parâmetros médios (intervalo) de disposição do anastrozol em pacientes pediátricos foram descritos por CL/F de 1,54 L/h (0,77-4,53 L/h) e V/F de 98,4 L (50,7-330,0 L). A meia-vida de eliminação terminal foi de 46,8 h, semelhante à observada em mulheres na pós-menopausa tratadas com anastrozol para câncer de mama. Com base em uma análise farmacocinética populacional, a farmacocinética do anastrozol foi semelhante em meninos com ginecomastia puberal e meninas com síndrome de McCune-Albright.
Uso Geriátrico
Nos estudos 0030 e 0027, cerca de 50% dos pacientes tinham 65 anos ou mais. Pacientes ≥ 65 anos de idade tiveram resposta tumoral moderadamente melhor e tempo de progressão tumoral do que pacientes
No estudo ATAC, 45% dos pacientes tinham 65 anos de idade ou mais. Foi menor que a eficácia observada em pacientes com menos de 65 anos de idade (N=1712 para ARIMIDEX e N=1706 para tamoxifeno, a razão de risco para sobrevida livre de doença foi de 0,79 [IC 95%: 0,67, 0,94]).
A farmacocinética do anastrozol não é afetada pela idade.
Insuficiência renal
Uma vez que apenas cerca de 10% do anastrozol é excretado inalterado na urina, a insuficiência renal não influencia a depuração corporal total. Não é necessário ajuste de dose em pacientes com insuficiência renal [ver DOSAGEM E ADMINISTRAÇÃO e FARMACOLOGIA CLÍNICA ].
Insuficiência hepática
As concentrações plasmáticas de anastrozol nos indivíduos com cirrose hepática estavam dentro do intervalo de concentrações observado em indivíduos normais em todos os ensaios clínicos. Portanto, o ajuste de dose também não é necessário em pacientes com cirrose hepática estável. ARIMIDEX não foi estudado em pacientes com insuficiência hepática grave [ver DOSAGEM E ADMINISTRAÇÃO e FARMACOLOGIA CLÍNICA ].
SOBREDOSAGEM
Ensaios clínicos foram conduzidos com ARIMIDEX, até 60 mg em dose única administrados a voluntários saudáveis do sexo masculino e até 10 mg diários administrados a mulheres na pós-menopausa com câncer de mama avançado; estas dosagens foram toleradas. Uma dose única de ARIMIDEX 1mg que resulte em sintomas de risco de vida não foi estabelecida. Não há antídoto específico para superdosagem e o tratamento deve ser sintomático. No manejo de uma superdosagem, considere que vários agentes podem ter sido usados. O vômito pode ser induzido se o paciente estiver alerta. A diálise pode ser útil porque ARIMIDEX não é altamente ligado às proteínas. São indicados cuidados gerais de suporte, incluindo monitoramento frequente dos sinais vitais e observação cuidadosa do paciente.
CONTRA-INDICAÇÕES
Gravidez e mulheres na pré-menopausa
ARIMIDEX 1mg pode causar dano fetal quando administrado a mulheres grávidas e não oferece benefício clínico para mulheres na pré-menopausa com câncer de mama. ARIMIDEX 1mg é contraindicado em mulheres grávidas ou que possam engravidar. Não existem estudos adequados e bem controlados em mulheres grávidas usando ARIMIDEX. Se ARIMIDEX 1mg for usado durante a gravidez, ou se a paciente engravidar enquanto estiver tomando este medicamento, a paciente deve ser informada do risco potencial para o feto ou risco potencial de perda da gravidez [ver Uso em populações específicas ].
Hipersensibilidade
ARIMIDEX 1mg é contraindicado em qualquer paciente que tenha apresentado reação de hipersensibilidade ao medicamento ou a qualquer um dos excipientes. As reações observadas incluem anafilaxia, angioedema e urticária. REAÇÕES ADVERSAS ]
FARMACOLOGIA CLÍNICA
Mecanismo de ação
O crescimento de muitos cânceres de mama é estimulado ou mantido por estrogênios.
Em mulheres na pós-menopausa, os estrogênios são derivados principalmente da ação da enzima aromatase, que converte andrógenos adrenais (principalmente androstenediona e testosterona) em estrona e estradiol. A supressão da biossíntese de estrogênio nos tecidos periféricos e no próprio tecido canceroso pode, portanto, ser alcançada inibindo especificamente a enzima aromatase.
O anastrozol é um inibidor seletivo da aromatase não esteroidal. Reduz significativamente as concentrações séricas de estradiol e não tem efeito detectável na formação de corticosteróides adrenais ou aldosterona.
Farmacodinâmica
Efeito no Estradiol
As concentrações séricas médias de estradiol foram avaliadas em vários ensaios de dosagem diária com 0,5, 1, 3, 5 e 10 mg de ARIMIDEX em mulheres na pós-menopausa com câncer de mama avançado. Supressão clinicamente significativa do estradiol sérico foi observada com todas as doses. Doses de 1 mg e superiores resultaram na supressão das concentrações séricas médias de estradiol até o limite inferior de detecção (3,7 pmol/L). A dose diária recomendada, ARIMIDEX 1 mg, reduziu o estradiol em aproximadamente 70% em 24 horas e em aproximadamente 80% após 14 dias de administração diária. A supressão do estradiol sérico foi mantida por até 6 dias após a interrupção da dosagem diária com ARIMIDEX 1 mg.
O efeito de ARIMIDEX 1mg em mulheres na pré-menopausa com câncer de mama inicial ou avançado não foi estudado. Como a aromatização de andrógenos adrenais não é uma fonte significativa de estradiol em mulheres na pré-menopausa, não se espera que ARIMIDEX reduza os níveis de estradiol em mulheres na pré-menopausa.
Efeito sobre os corticosteróides
Em vários ensaios de dosagem diária com 3, 5 e 10 mg, a seletividade do anastrozol foi avaliada examinando os efeitos na síntese de corticosteroides. Para todas as doses, o anastrozol não afetou a secreção de cortisol ou aldosterona na linha de base ou em resposta ao ACTH. Nenhuma terapia de reposição de glicocorticóides ou mineralocorticóides é necessária com anastrozol.
Outros efeitos endócrinos
Em vários ensaios de dosagem diária com 5 e 10 mg, o hormônio estimulante da tireóide (TSH) foi medido; não houve aumento do TSH durante a administração de ARIMIDEX. ARIMIDEX não possui atividade progestogênica, androgênica ou estrogênica direta em animais, mas perturba os níveis circulantes de progesterona, andrógenos e estrogênios.
Farmacocinética
Absorção
inibição da atividade da aromatase deve-se principalmente ao anastrozol, o fármaco original. A absorção do anastrozol é rápida e as concentrações plasmáticas máximas ocorrem tipicamente dentro de 2 horas após a administração em jejum. Estudos com drogas radiomarcadas demonstraram que o anastrozol administrado por via oral é bem absorvido na circulação sistêmica. Os alimentos reduzem a taxa, mas não a extensão total da absorção do anastrozol. A Cmax média do anastrozol diminuiu 16% e a Tmax mediana foi adiada de 2 para 5 horas quando o anastrozol foi administrado 30 minutos após a alimentação. A farmacocinética do anastrozol é linear no intervalo de dose de 1 a 20 mg e não se altera com doses repetidas. A farmacocinética do anastrozol foi semelhante em pacientes e voluntários saudáveis.
Distribuição
Os níveis plasmáticos em estado estacionário são aproximadamente 3 a 4 vezes maiores do que os níveis observados após uma dose única de ARIMIDEX. As concentrações plasmáticas aproximam-se dos níveis de estado estacionário em cerca de 7 dias de administração única diária. O anastrozol liga-se 40% às proteínas plasmáticas no intervalo terapêutico.
Metabolismo
O metabolismo do anastrozol ocorre por N-desalquilação, hidroxilação e glucuronidação. Três metabólitos do anastrozol (triazol, um conjugado glicuronídeo do hidroxi-anastrozol e um conjugado glicuronídeo do próprio anastrozol) foram identificados no plasma e na urina humanos. O principal metabólito circulante do anastrozol, o triazol, não possui atividade farmacológica.
Anastrozol inibiu as reações catalisadas pelo citocromo P450 1A2, 2C8/9 e 3A4 in vitro com valores de Ki que foram aproximadamente 30 vezes maiores do que os valores médios de Cmax no estado de equilíbrio observados após uma dose diária de 1 mg. O anastrozol não teve efeito inibitório nas reações catalisadas pelo citocromo P450 2A6 ou 2D6 in vitro. A administração de uma única dose de 30 mg/kg ou doses múltiplas de 10 mg/kg de anastrozol a indivíduos saudáveis não teve efeito na depuração da antipirina ou na recuperação urinária dos metabólitos da antipirina.
Excreção
Oitenta e cinco por cento do anastrozol radiomarcado foi recuperado nas fezes e na urina. O metabolismo hepático é responsável por aproximadamente 85% da eliminação do anastrozol. A eliminação renal é responsável por aproximadamente 10% da depuração total. A meia-vida média de eliminação do anastrozol é de 50 horas.
Efeito de Gênero e Idade
farmacocinética do anastrozol foi investigada em voluntárias na pós-menopausa e pacientes com câncer de mama. Não foram observados efeitos relacionados com a idade no intervalo 80 anos.
Efeito da raça
Os níveis séricos de estradiol e sulfato de estrona foram semelhantes entre mulheres pós-menopáusicas japonesas e caucasianas que receberam 1 mg de anastrozol diariamente por 16 dias. As concentrações plasmáticas médias mínimas de anastrozol no estado de equilíbrio em mulheres pós-menopáusicas caucasianas e japonesas foram de 25,7 e 30,4 ng/mL, respectivamente.
Efeito da Insuficiência Renal
A farmacocinética do anastrozol foi investigada em indivíduos com insuficiência renal. A depuração renal do anastrozol diminuiu proporcionalmente com a depuração da creatinina e foi aproximadamente 50% inferior em voluntários com insuficiência renal grave (depuração da creatinina DOSAGEM E ADMINISTRAÇÃO e Uso em populações específicas ].
Efeito do Insuficiência Hepática
A farmacocinética do anastrozol foi investigada em indivíduos com cirrose hepática relacionada ao abuso de álcool. A depuração oral aparente (CL/F) do anastrozol foi aproximadamente 30% menor em indivíduos com cirrose hepática estável do que em indivíduos controle com função hepática normal. No entanto, essas concentrações plasmáticas ainda estavam dentro da faixa de valores observada em indivíduos normais. O efeito da insuficiência hepática grave não foi estudado. Não é necessário ajuste de dose para cirrose hepática estável [ver DOSAGEM E ADMINISTRAÇÃO e Uso em populações específicas ].
Toxicologia e/ou Farmacologia Animal
Toxicologia Reprodutiva
Verificou-se que o anastrozol atravessa a placenta após administração oral de 0,1 mg/kg em ratos e coelhos (cerca de 1 e 1,9 vezes a dose humana recomendada, respectivamente, numa base de mg/m²). Estudos em ratos e coelhos com doses iguais ou superiores a 0,1 e 0,02 mg/kg/dia, respectivamente (cerca de 1 e 1/3, respectivamente, da dose humana recomendada em mg/m²), administradas durante o período de a organogênese mostrou que o anastrozol aumentou a perda gestacional (aumento da perda pré e/ou pós-implantação, aumento da reabsorção e diminuição do número de fetos vivos); efeitos foram relacionados com a dose em ratos. O peso da placenta aumentou significativamente em ratos com doses de 0,1 mg/kg/dia ou mais.
Evidência de fetotoxicidade, incluindo atraso no desenvolvimento fetal (ou seja, ossificação incompleta e redução do peso corporal fetal), foi observada em ratos administrados com doses de 1 mg/kg/dia (que produziram anastrozol Cssmax e AUC 0-24 h que foram 19 vezes e 9 vezes superior aos respectivos valores encontrados em voluntárias pós-menopáusicas na dose recomendada). Não houve evidência de teratogenicidade em ratos administrados com doses de até 1,0 mg/kg/dia. Em coelhas, o anastrozol causou falha de prenhez em doses iguais ou superiores a 1,0 mg/kg/dia (cerca de 16 vezes a dose humana recomendada com base em mg/m²); não houve evidência de teratogenicidade em coelhos administrados 0,2 mg/kg/dia (cerca de 3 vezes a dose humana recomendada com base em mg/m²).
Estudos clínicos
Tratamento adjuvante do câncer de mama em mulheres na pós-menopausa
Um estudo multicêntrico, duplo-cego (ATAC) randomizou 9.366 mulheres na pós-menopausa com câncer de mama operável para tratamento adjuvante com ARIMIDEX 1 mg ao dia, tamoxifeno 20 mg ao dia ou uma combinação dos dois tratamentos por cinco anos ou até a recorrência da doença.
O desfecho primário do estudo foi a sobrevida livre de doença (ou seja, tempo até a ocorrência de uma recorrência distante ou local, ou câncer de mama contralateral ou morte por qualquer causa). Os desfechos secundários do estudo incluíram sobrevida livre de doença distante, a incidência de câncer de mama contralateral e sobrevida global. Em um acompanhamento médio de 33 meses, a combinação de ARIMIDEX e tamoxifeno não demonstrou nenhum benefício de eficácia quando comparado ao tamoxifeno em todos os pacientes, bem como na subpopulação positiva para receptores hormonais. Este braço de tratamento foi descontinuado do estudo. Com base nos resultados clínicos e farmacocinéticos do estudo ATAC, o tamoxifeno não deve ser administrado com anastrozol [ver INTERAÇÕES MEDICAMENTOSAS ].
As características demográficas e outras características basais foram semelhantes entre os três grupos de tratamento (ver Tabela 7).
Os pacientes nos dois braços de monoterapia do estudo ATAC foram tratados por uma média de 60 meses (5 anos) e acompanhados por uma média de 68 meses. A sobrevida livre de doença na população com intenção de tratar foi estatisticamente melhorada [Hazard Ratio (HR) = 0,87, IC 95%: 0,78, 0,97, p = 0,0127] no braço ARIMIDEX em comparação com o braço de tamoxifeno. Na subpopulação positiva para o receptor hormonal representando cerca de 84% dos pacientes do estudo, a sobrevida livre de doença também foi estatisticamente significativamente melhorada (HR = 0,83, IC 95%: 0,73, 0,94, p = 0,0049) no braço ARIMIDEX 1mg em comparação com o grupo braço de tamoxifeno.
Figura 1: Curva de sobrevida livre de doença de Kaplan Meier para todos os pacientes randomizados para ARIMIDEX 1mg ou monoterapia com tamoxifeno no estudo ATAC (intenção de tratar) 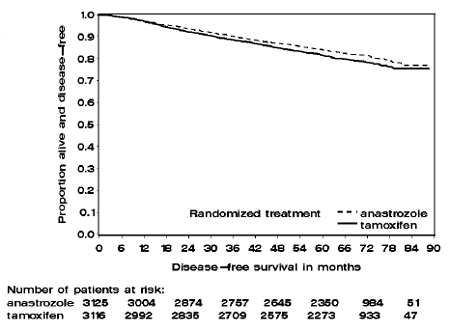
Figura 2: Sobrevida livre de doença para subpopulação positiva para receptores hormonais de pacientes randomizados para monoterapia com ARIMIDEX ou Tamoxifeno no estudo ATAC 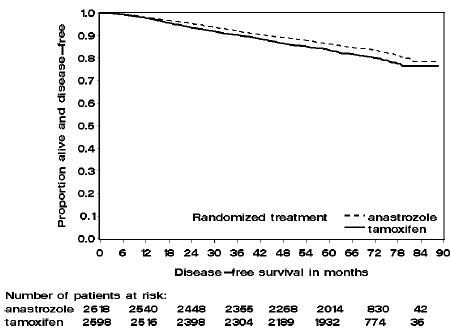
Os dados de sobrevida com 68 meses de acompanhamento são apresentados na Tabela 9.
No grupo de pacientes que tiveram quimioterapia adjuvante prévia (N=698 para ARIMIDEX 1mg e N=647 para tamoxifeno), a taxa de risco para sobrevida livre de doença foi de 0,91 (IC 95%: 0,73 a 1,13) no braço ARIMIDEX em comparação com o braço de tamoxifeno.
A frequência de eventos individuais na população com intenção de tratar e a subpopulação positiva para o receptor hormonal são descritos na Tabela 8.
Um resumo dos resultados de eficácia do estudo é fornecido na Tabela 9.
Resultados de eficácia de acompanhamento médio de 10 anos do estudo ATAC
Em uma análise subsequente do estudo ATAC, os pacientes nos dois braços de monoterapia foram acompanhados por uma média de 120 meses (10 anos). Os pacientes receberam o tratamento do estudo por uma média de 60 meses (5 anos) (ver Tabela 10).
Figura 3: Curva de sobrevida livre de doença de Kaplan Meier para todos os pacientes randomizados para monoterapia com ARIMIDEX ou Tamoxifeno no estudo ATAC (intenção de tratar)a 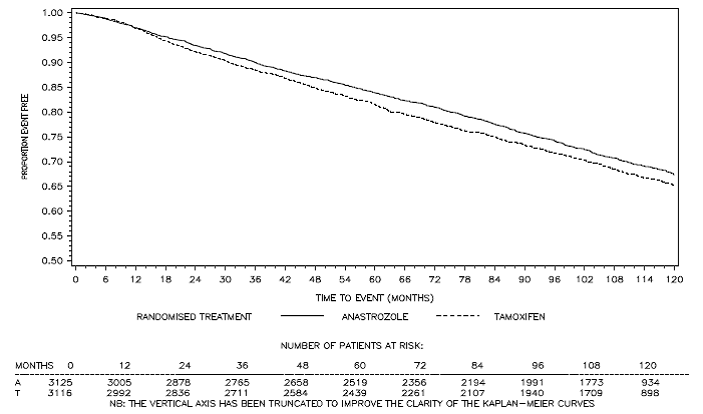
a A proporção de pacientes com seguimento de 120 meses foi de 29,4%.
Figura 4: Sobrevida livre de doença para subpopulação positiva para receptores hormonais de pacientes randomizados para ARIMIDEX 1mg ou monoterapia com tamoxifeno no estudo ATAC 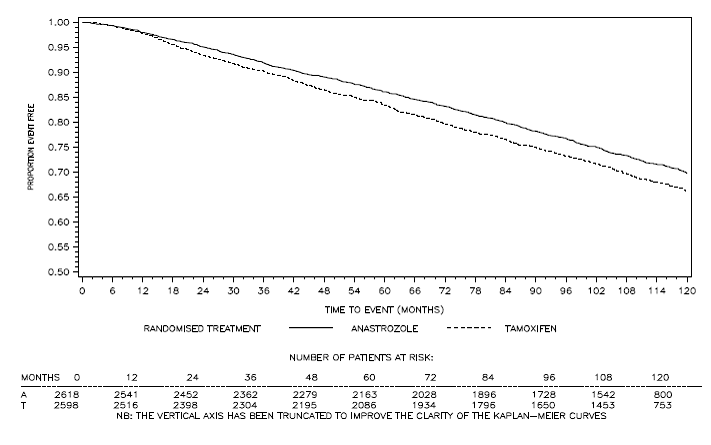
bA proporção de pacientes com 120 meses de seguimento foi de 29,8%.
Terapia de primeira linha em mulheres na pós-menopausa com câncer de mama avançado
Dois estudos clínicos controlados duplo-cegos de desenho semelhante (0030, um estudo norte-americano e 0027, um estudo predominantemente europeu) foram conduzidos para avaliar a eficácia de ARIMIDEX 1mg em comparação com tamoxifeno como terapia de primeira linha para receptores hormonais positivos ou receptores hormonais câncer de mama localmente avançado ou metastático desconhecido em mulheres na pós-menopausa. Um total de 1.021 pacientes com idades entre 30 e 92 anos foram randomizados para receber tratamento experimental. Os pacientes foram randomizados para receber 1 mg de ARIMIDEX 1 mg uma vez ao dia ou 20 mg de tamoxifeno uma vez ao dia. Os desfechos primários para ambos os estudos foram o tempo de progressão do tumor, a taxa de resposta objetiva do tumor e a segurança.
Demografia e outras características basais, incluindo pacientes com doença mensurável e não mensurável, pacientes que receberam terapia adjuvante anterior, o local da doença metastática e origem étnica foram semelhantes para os dois grupos de tratamento para ambos os ensaios. A tabela a seguir resume o status do receptor hormonal na entrada para todos os pacientes randomizados nos ensaios 0030 e 0027.
Para os desfechos primários, o estudo 0030 mostrou que o ARIMIDEX teve uma vantagem estatisticamente significativa sobre o tamoxifeno (p=0,006) quanto ao tempo de progressão do tumor; as taxas de resposta tumoral objetivas foram semelhantes para ARIMIDEX 1mg e tamoxifeno. O ensaio 0027 mostrou que ARIMIDEX 1mg e tamoxifeno tiveram taxas de resposta tumoral objetivas semelhantes e tempo para progressão tumoral (ver Tabela 12 e Figuras 5 e 6).
A Tabela 12 abaixo resume os resultados do estudo 0030 e do estudo 0027 para os desfechos primários de eficácia.
Figura 5: Probabilidade de Kaplan-Meier de tempo para progressão da doença para todos os pacientes randomizados (intenção de tratar) no Ensaio 0030 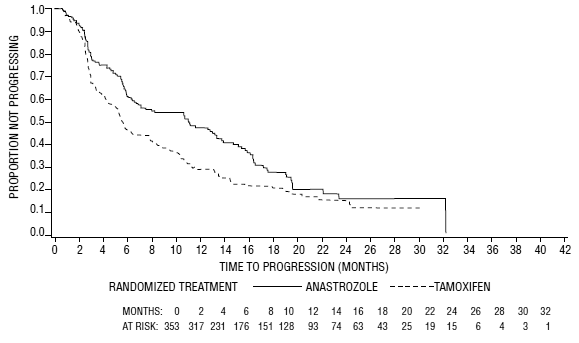
Figura 6: Probabilidade de Kaplan-Meier de tempo para progressão para todos os pacientes randomizados (intenção de tratar) no Ensaio 0027 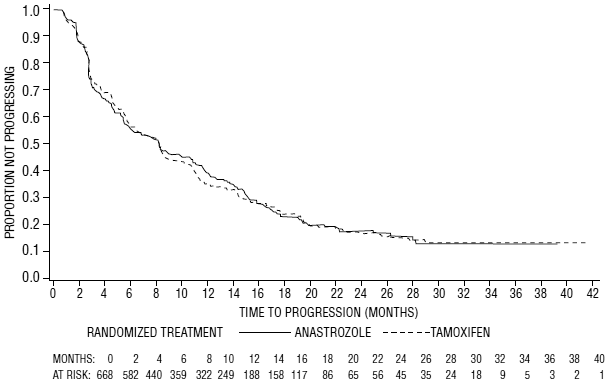
Os resultados dos parâmetros secundários deram suporte aos resultados dos parâmetros primários de eficácia. Houve muito poucas mortes ocorrendo entre os grupos de tratamento de ambos os ensaios para tirar conclusões sobre as diferenças de sobrevida global.
Terapia de segunda linha em mulheres na pós-menopausa com câncer de mama avançado que tiveram progressão da doença após terapia com tamoxifeno
anastrozol foi estudado em dois ensaios clínicos controlados (0004, um estudo norte-americano; 0005, um estudo predominantemente europeu) em mulheres na pós-menopausa com câncer de mama avançado que apresentaram progressão da doença após terapia com tamoxifeno para câncer de mama avançado ou precoce. Alguns dos pacientes também haviam recebido tratamento citotóxico prévio. A maioria dos pacientes era ER-positivo; uma fração menor era ER-desconhecida ou ER-negativa; os pacientes ER-negativos eram elegíveis apenas se tivessem uma resposta positiva ao tamoxifeno. Pacientes elegíveis com doença mensurável e não mensurável foram randomizados para receber uma dose única diária de 1 mg ou 10 mg de ARIMIDEX ou acetato de megestrol 40 mg quatro vezes ao dia. Os estudos foram duplo-cegos em relação ao ARIMIDEX. O tempo de progressão e as taxas de resposta objetiva (somente pacientes com doença mensurável podem ser considerados respondedores parciais) foram as variáveis primárias de eficácia. As taxas de resposta objetiva foram calculadas com base nos critérios da Union Internationale Contre le Cancer (UICC). A taxa de doença estável prolongada (mais de 24 semanas), a taxa de progressão e a sobrevida também foram calculadas.
Ambos os ensaios incluíram mais de 375 pacientes; demografia e outras características de linha de base foram semelhantes para os três grupos de tratamento em cada ensaio. Os pacientes do estudo 0005 responderam melhor ao tratamento anterior com tamoxifeno. Dos pacientes incluídos que tiveram terapia prévia com tamoxifeno para doença avançada (58% no Ensaio 0004; 57% no Ensaio 0005), 18% desses pacientes no Ensaio 0004 e 42% no Ensaio 0005 foram relatados pelo investigador principal como tendo respondido. No Ensaio 0004, 81% dos pacientes eram ER-positivos, 13% eram ER-desconhecidos e 6% eram ER-negativos. No Ensaio 0005, 58% dos pacientes eram ER-positivos, 37% eram ER-desconhecidos e 5% eram ER-negativos. No Ensaio 0004, 62% dos pacientes tinham doença mensurável em comparação com 79% no Ensaio 0005. Os locais da doença metastática foram semelhantes entre os grupos de tratamento para cada ensaio. Em média, 40% dos pacientes apresentavam metástases em partes moles; 60% tinham metástases ósseas; e 40% tinham metástases viscerais (15% fígado).
Os resultados de eficácia dos dois estudos foram semelhantes aos apresentados na Tabela 13. Em ambos os estudos não houve diferenças significativas entre os braços de tratamento em relação a qualquer um dos parâmetros de eficácia listados na tabela abaixo.
Quando os dados dos dois estudos controlados são agrupados, as taxas de resposta objetiva e os tempos médios de progressão e morte foram semelhantes para pacientes randomizados para ARIMIDEX 1 mg e acetato de megestrol. Não há, nestes dados, nenhuma indicação de que ARIMIDEX 10 mg seja superior a ARIMIDEX 1 mg.
INFORMAÇÃO DO PACIENTE
ARIMIDEX® Comprimidos de A-rim-eh-dex (anastrozol) para administração oral
Quais são as informações mais importantes que devo saber sobre o ARIMIDEX?
ARIMIDEX pode causar efeitos colaterais graves, incluindo:
- doença cardíaca. Mulheres com câncer de mama precoce, que têm histórico de obstrução nas artérias do coração (doença cardíaca isquêmica) e que tomam ARIMIDEX 1mg, podem ter um aumento nos sintomas de diminuição do fluxo sanguíneo para o coração em comparação com mulheres semelhantes que tomam tamoxifeno.
Obtenha ajuda médica imediatamente se tiver dores no peito novas ou agravadas ou falta de ar durante o tratamento com ARIMIDEX.
O que é ARIMIDEX?
ARIMIDEX 1mg é um medicamento de prescrição usado em mulheres após a menopausa (“a mudança de vida”) para:
- tratamento do câncer de mama precoce
- depois da cirurgia
- em mulheres cujo câncer de mama é positivo para receptores hormonais
- o primeiro tratamento de câncer de mama que se espalhou para tecidos próximos ou linfonodos (localmente avançado) ou se espalhou para outras partes do corpo (metastático), em mulheres cujo câncer de mama é receptor hormonal positivo ou os receptores hormonais não são conhecidos
- tratamento de câncer de mama avançado, se o câncer cresceu ou a doença se espalhou após a terapia com tamoxifeno
ARIMIDEX 1mg não funciona em mulheres com câncer de mama que não passaram pela menopausa (mulheres na pré-menopausa).
Quem não deve tomar ARIMIDEX?
Não tome ARIMIDEX 1mg se você:
- estão grávidas ou podem engravidar. ARIMIDEX pode prejudicar o feto. Se engravidar enquanto estiver a tomar ARIMIDEX, informe o seu médico imediatamente.
- não passaram pela menopausa (estão na pré-menopausa)
- teve uma reação alérgica grave ao anastrozol ou a qualquer um dos ingredientes de ARIMIDEX. Consulte o final deste folheto para obter uma lista completa dos ingredientes de ARIMIDEX. Os sintomas de uma reação alérgica grave ao ARIMIDEX incluem: inchaço da face, lábios, língua ou garganta, dificuldade para respirar ou engolir, urticária e coceira.
O que devo dizer ao meu médico antes de tomar ARIMIDEX 1mg?
Antes de tomar ARIMIDEX, informe o seu médico se:
- não passaram pela menopausa. Fale com o seu médico se não tiver a certeza.
- tem ou teve um problema cardíaco
- foi informado que você tem afinamento ou fraqueza óssea (osteoporose)
- tem colesterol alto
- tem outras condições médicas
- estão grávidas ou planejam engravidar. ARIMIDEX pode prejudicar o feto. Consulte “Quem não deve tomar ARIMIDEX?”
- está amamentando ou planeja amamentar. Não se sabe se ARIMIDEX passa para o leite materno. Você e seu médico devem decidir se você vai tomar ARIMIDEX 1mg ou amamentar. Você não deve fazer ambos.
Informe o seu médico sobre todos os medicamentos que toma, incluindo medicamentos prescritos e de venda livre, vitaminas e suplementos de ervas. Informe especialmente o seu médico se estiver a tomar:
- tamoxifeno. Você não deve tomar ARIMIDEX se você tomar tamoxifeno. Tomar ARIMIDEX 1mg com tamoxifeno pode diminuir a quantidade de ARIMIDEX 1mg no sangue e pode fazer com que ARIMIDEX 1mg também não funcione.
- Medicamentos que contêm estrogênio. ARIMIDEX 1mg pode não funcionar se tomado com qualquer um destes medicamentos:
- terapia de reposição hormonal
- pílulas anticoncepcionais
- cremes de estrogênio
- anéis vaginais
- supositórios vaginais
Conheça os medicamentos que você toma. Mantenha uma lista deles para mostrar ao seu médico e farmacêutico quando receber um novo medicamento.
Como devo tomar ARIMIDEX?
- Tome ARIMIDEX exatamente como seu médico lhe disse para tomá-lo.
- Continue a tomar ARIMIDEX até que o seu médico lhe diga para parar.
- ARIMIDEX 1mg pode ser tomado com ou sem alimentos.
- Se você esquecer de uma dose, tome-a assim que se lembrar. Se estiver quase na hora da próxima dose, pule a dose esquecida. Tome a sua próxima dose programada regularmente. Não tome duas doses ao mesmo tempo.
Se você tomar muito ARIMIDEX 1mg, ligue para o seu médico ou dirija-se imediatamente ao pronto-socorro do hospital mais próximo.
Quais são os possíveis efeitos colaterais do ARIMIDEX?
ARIMIDEX pode causar efeitos colaterais graves, incluindo:
- Ver “Qual é a informação mais importante que devo saber sobre o ARIMIDEX?”
- afinamento ou fraqueza óssea (osteoporose). ARIMIDEX 1mg reduz o estrogênio em seu corpo, o que pode fazer com que seus ossos se tornem mais finos e fracos. Isso pode aumentar o risco de fraturas, especialmente da coluna, quadril e pulso. O seu médico pode pedir um teste de densidade mineral óssea
- antes de iniciar e durante o tratamento com ARIMIDEX para verificar se há alterações ósseas.
- aumento do colesterol no sangue (gordura no sangue). O seu médico pode fazer análises ao sangue para verificar o seu colesterol enquanto estiver a tomar ARIMIDEX.
- reações da pele. Pare de tomar ARIMIDEX 1mg e chame seu médico imediatamente se tiver lesões na pele, úlceras ou bolhas.
- reações alérgicas graves. Obtenha ajuda médica imediatamente se você receber:
- inchaço do rosto, lábios, língua ou garganta
- dificuldade para engolir ou respirar
- problemas de fígado. ARIMIDEX 1mg pode causar inflamação do fígado e alterações nos exames de sangue da função hepática. O seu médico pode examiná-lo para isso. Pare de tomar ARIMIDEX 1mg e chame seu médico imediatamente se tiver algum destes sinais ou sintomas de um problema de fígado:
- uma sensação geral de não estar bem
- amarelecimento da pele ou do branco dos olhos
- dor no lado direito da área do estômago (abdômen)
Os efeitos colaterais comuns em mulheres que tomam ARIMIDEX 1mg incluem:
- ondas de calor
- fraqueza
- dores nas articulações
- dor nas articulações, rigidez ou inchaço (artrite)
- dor
- dor de garganta
- pressão alta
- depressão
- nausea e vomito
- irritação na pele
- dor nas costas
- problemas de sono
- dor no osso
- dor de cabeça
- inchaço das pernas, tornozelos ou pés
- aumento da tosse
- falta de ar
- acúmulo de fluido linfático nos tecidos do braço afetado (linfedema)
ARIMIDEX também pode causar cócegas, formigamento ou dormência na pele.
Informe o seu médico se tiver algum efeito secundário que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do ARIMIDEX. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
Como devo armazenar o ARIMIDEX 1mg?
- Armazene ARIMIDEX 1mg em temperatura ambiente entre 20°C e 25°C (68°F a 77°F).
Mantenha ARIMIDEX e todos os medicamentos fora do alcance das crianças.
Informações gerais sobre o uso seguro e eficaz de ARIMIDEX.
Os medicamentos às vezes são prescritos para outros fins que não os listados em um folheto de informações ao paciente. Não tome ARIMIDEX 1mg para uma condição para a qual não foi prescrito. Não dê ARIMIDEX a outras pessoas, mesmo que tenham os mesmos sintomas que você. Pode prejudicá-los.
Se você quiser mais informações, converse com seu médico. Você pode pedir ao seu farmacêutico ou médico informações sobre ARIMIDEX escritas para profissionais de saúde. Para obter mais informações, ligue para 1-866-992-9276 ou acesse www.ARIMIDEX.com.
Quais são os ingredientes do ARIMIDEX?
Ingrediente ativo: anastrozol
Ingredientes inativos: lactose, estearato de magnésio, hidroxipropilmetilcelulose, polietilenoglicol, povidona, amidoglicolato de sódio e dióxido de titânio.
