Celebrex 100mg, 200mg Celecoxib Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Celebrex 100mg e como é usado?
Celebrex 200mg é um medicamento de prescrição usado para tratar os sintomas de dor aguda ou inflamação. Celebrex pode ser usado sozinho ou com outros medicamentos.
Celebrex 100mg pertence a uma classe de medicamentos chamados anti-inflamatórios não esteróides (AINEs).
Não se sabe se Celebrex é seguro e eficaz em crianças com menos de 2 anos de idade.
Quais são os possíveis efeitos colaterais do Celebrex 100mg?
Celebrex 200mg pode causar efeitos colaterais graves, incluindo:
- inchaço,
- ganho de peso rápido,
- falta de ar,
- fezes com sangue ou alcatrão,
- tossir sangue ou vômito que parece borra de café,
- náusea,
- dor de estômago do lado superior direito,
- coceira,
- cansaço,
- urina escura,
- amarelecimento da pele ou dos olhos (icterícia),
- pouca ou nenhuma micção,
- inchaço nos pés ou tornozelos,
- sentindo-se cansado,
- pele pálida,
- tontura, e
- mãos e pés frios
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Celebrex incluem:
- dor de estômago,
- azia,
- gás,
- diarréia,
- constipação,
- náusea,
- vômito,
- inchaço nas mãos ou pés,
- tontura, um
- d
- sintomas de resfriado (nariz entupido, espirros, dor de garganta)
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Celebrex. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
AVISO
RISCO DE EVENTOS CARDIOVASCULARES E GASTROINTESTINAIS GRAVES
Eventos Trombóticos Cardiovasculares
- Os anti-inflamatórios não esteroides (AINEs) aumentam o risco de eventos trombóticos cardiovasculares graves, incluindo infarto do miocárdio e acidente vascular cerebral, que podem ser fatais. Este risco pode ocorrer no início do tratamento e pode aumentar com a duração do uso. [ver ADVERTÊNCIAS E PRECAUÇÕES]
- CELEBREX é contraindicado no cenário de cirurgia de revascularização do miocárdio (CRM). [ver CONTRA-INDICAÇÕES e ADVERTÊNCIAS E PRECAUÇÕES]
Hemorragia, Ulceração e Perfuração Gastrointestinal
- Os AINEs causam um risco aumentado de eventos adversos gastrointestinais (GI) graves, incluindo sangramento, ulceração e perfuração do estômago ou intestinos, que podem ser fatais. Esses eventos podem ocorrer a qualquer momento durante o uso e sem sintomas de aviso. Pacientes idosos e pacientes com história prévia de úlcera péptica e/ou sangramento GI apresentam maior risco de eventos graves (GI). [ver ADVERTÊNCIAS E PRECAUÇÕES]
DESCRIÇÃO
CELEBREX (celecoxib) cápsula é um medicamento anti-inflamatório não esteróide, disponível em cápsulas contendo 50 mg, 100 mg, 200 mg e 400 mg de celecoxib para administração oral. O nome químico é 4-[5-(4-metilfenil)-3-(trifluorometil)-1H-pirazol-1-il]benzenossulfonamida e é um pirazol substituído por diaril. O peso molecular é 381,38. Sua fórmula molecular é C17H14F3N3O2S, e tem a seguinte estrutura química:
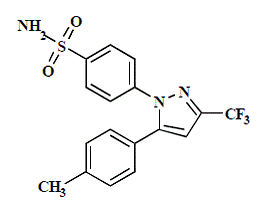
O celecoxib é um pó branco a esbranquiçado com um pKa de 11,1 (porção sulfonamida). O celecoxib é hidrofóbico (log P é 3,5) e é praticamente insolúvel em meio aquoso na faixa de pH fisiológico.
Os ingredientes inativos de CELEBREX 200mg incluem: croscarmelose sódica, tintas comestíveis, gelatina, lactose monohidratada, estearato de magnésio, povidona e lauril sulfato de sódio.
INDICAÇÕES
CELEBREX é indicado
Osteoartrite (OA)
Para o manejo dos sinais e sintomas da OA [ver Estudos clínicos ].
Artrite Reumatóide (AR)
Para o manejo dos sinais e sintomas da AR [ver Estudos clínicos ].
Artrite Reumatóide Juvenil (ARJ)
Para o manejo dos sinais e sintomas de ARJ em pacientes com 2 anos ou mais [ver Estudos clínicos ].
Espondilite Anquilosante (EA)
Para o manejo dos sinais e sintomas da EA [ver Estudos clínicos ].
Dor aguda
Para o tratamento da dor aguda em adultos [ver Estudos clínicos ].
Dismenorreia primária
Para o tratamento da dismenorreia primária [ver Estudos clínicos ].
DOSAGEM E ADMINISTRAÇÃO
Instruções Gerais de Dosagem
Considere cuidadosamente os potenciais benefícios e riscos de CELEBREX e outras opções de tratamento antes de decidir usar CELEBREX. Use a dosagem eficaz mais baixa pelo menor período de tempo consistente com as metas de tratamento do paciente individual [consulte AVISOS E PRECAUÇÕES ].
Essas doses podem ser administradas independentemente do horário das refeições.
Osteoartrite
Para OA, a dosagem é de 200 mg por dia administrada em dose única ou 100 mg duas vezes ao dia.
Artrite reumatoide
Para AR, a dosagem é de 100 mg a 200 mg duas vezes ao dia.
Artrite Reumatóide Juvenil
Para ARJ, a dosagem para pacientes pediátricos (2 anos de idade ou mais) é baseada no peso. Para pacientes ≥10 kg a ≤25 kg, a dose recomendada é de 50 mg duas vezes ao dia. Para pacientes >25 kg, a dose recomendada é de 100 mg duas vezes ao dia.
Para pacientes que têm dificuldade em engolir cápsulas, o conteúdo de uma cápsula CELEBREX pode ser adicionado ao molho de maçã. Todo o conteúdo da cápsula é cuidadosamente esvaziado em uma colher de chá rasa de molho de maçã frio ou à temperatura ambiente e ingerido imediatamente com água. O conteúdo da cápsula polvilhada no molho de maçã é estável por até 6 horas sob condições refrigeradas (2°C a 8°C/35°F a 45°F).
Espondilite anquilosante
Para EA, a dosagem de CELEBREX é de 200 mg por dia em doses únicas (uma vez por dia) ou divididas (duas vezes por dia). Se nenhum efeito for observado após 6 semanas, um teste de 400 mg por dia pode valer a pena. Se nenhum efeito for observado após 6 semanas com 400 mg diários, uma resposta não é provável e devem ser consideradas opções alternativas de tratamento.
Manejo da dor aguda e tratamento da dismenorreia primária
Para o manejo da dor aguda e tratamento da dismenorreia primária, a dosagem é de 400 mg inicialmente, seguida por uma dose adicional de 200 mg, se necessário, no primeiro dia. Nos dias subsequentes, a dose recomendada é de 200 mg duas vezes ao dia, conforme necessário.
Populações Especiais
Insuficiência hepática
Em pacientes com insuficiência hepática moderada (Child-Pugh Classe B), reduza a dose em 50%. O uso de CELEBREX 100mg em pacientes com insuficiência hepática grave não é recomendado [ver AVISOS E PRECAUÇÕES , Uso em populações específicas , e FARMACOLOGIA CLÍNICA ].
Metabolizadores pobres de substratos CYP2C9
Em pacientes adultos que são conhecidos ou suspeitos de serem metabolizadores fracos de CYP2C9 com base no genótipo ou história/experiência anterior com outros substratos de CYP2C9 (como varfarina, fenitoína), inicie o tratamento com metade da dose mais baixa recomendada.
Em pacientes com ARJ que são conhecidos ou suspeitos de serem metabolizadores fracos de CYP2C9, considere o uso de tratamentos alternativos [ver Uso em populações específicas e FARMACOLOGIA CLÍNICA ].
COMO FORNECIDO
Formas de dosagem e pontos fortes
Cápsulas de CELEBREX (celecoxib):
50 mg branco, com impressão reversa branca na faixa vermelha do corpo e tampa com marcações de 7767 na tampa e 50 no corpo.
100 mg branco, com impressão reversa branca na faixa azul do corpo e tampa com as marcações 7767 na tampa e 100 no corpo.
200 mg branco, com verso impresso branco sobre faixa dourada com marcações de 7767 na tampa e 200 no corpo.
400 mg branco, com verso impresso branco na faixa verde com marcações de 7767 na tampa e 400 no corpo.
Armazenamento e manuseio
CELEBREX (celecoxib) 50 mg as cápsulas são brancas, com o reverso impresso em branco na faixa vermelha do corpo e na tampa com as marcações de 7767 na tampa e 50 no corpo, fornecidas como:
CELEBREX (celecoxibe) 100 mg as cápsulas são brancas, com impressão reversa branca na faixa azul do corpo e na tampa com as marcações de 7767 na tampa e 100 no corpo, fornecidas como:
CELEBREX (celecoxibe) 200 mg as cápsulas são brancas, com o verso impresso branco na faixa dourada com as marcações de 7767 na tampa e 200 no corpo, fornecidas como:
CELEBREX (celecoxibe) 400 mg as cápsulas são brancas, com o reverso impresso em branco na faixa verde com as marcações de 7767 na teca e 400 no corpo, fornecidas como:
Armazenar
Armazenar em temperatura ambiente de 20°C a 25°C (68°F a 77°F); excursões permitidas entre 15°C a 30°C (59°F a 86°F) [ver Temperatura ambiente controlada USP ].
Distribuído por: GD Searle LLC, Division of Pfizer Inc, NY, NY 10017. Revisado: abril de 2021
EFEITOS COLATERAIS
As seguintes reações adversas são discutidas em mais detalhes em outras seções da bula:
- Eventos Trombóticos Cardiovasculares [ver AVISOS E PRECAUÇÕES ]
- Sangramento, Ulceração e Perfuração GI [ver AVISOS E PRECAUÇÕES ]
- Hepatotoxicidade [ver AVISOS E PRECAUÇÕES ]
- Hipertensão [ver AVISOS E PRECAUÇÕES ]
- Insuficiência Cardíaca e Edema [ver AVISOS E PRECAUÇÕES ]
- Toxicidade renal e hipercalemia [ver AVISOS E PRECAUÇÕES ]
- Reações anafiláticas [ver AVISOS E PRECAUÇÕES ]
- Reações cutâneas graves [ver AVISOS E PRECAUÇÕES ]
- Toxicidade hematológica [ver AVISOS E PRECAUÇÕES ]
Experiência de Ensaios Clínicos
Como os ensaios clínicos são conduzidos em condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparadas às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática. As informações de reações adversas de ensaios clínicos, no entanto, fornecem uma base para identificar os eventos adversos que parecem estar relacionados ao uso de medicamentos e para aproximar as taxas.
Dos pacientes tratados com CELEBREX nos ensaios clínicos controlados pré-comercialização, aproximadamente 4.250 eram pacientes com OA, aproximadamente 2.100 eram pacientes com AR e aproximadamente 1.050 eram pacientes com dor pós-cirúrgica. Mais de 8.500 pacientes receberam uma dose diária total de CELEBREX 200 mg de 200 mg (100 mg duas vezes ao dia ou 200 mg uma vez ao dia) ou mais, incluindo mais de 400 tratados com 800 mg (400 mg duas vezes ao dia). Aproximadamente 3.900 pacientes receberam CELEBREX nessas doses por 6 meses ou mais; aproximadamente 2.300 deles o receberam por 1 ano ou mais e 124 deles o receberam por 2 anos ou mais.
Ensaios de artrite controlada pré-comercialização
Tabela 1 lista todos os eventos adversos, independentemente da causalidade, que ocorreram em ≥2% dos pacientes que receberam CELEBREX 100mg de 12 estudos controlados realizados em pacientes com OA ou AR que incluíram um placebo e/ou um grupo controle positivo. Como esses 12 estudos tiveram durações diferentes e os pacientes nos estudos podem não ter sido expostos pelo mesmo período de tempo, essas porcentagens não capturam as taxas cumulativas de ocorrência.
Em ensaios clínicos controlados por placebo ou ativo, a taxa de descontinuação devido a eventos adversos foi de 7,1% para pacientes que receberam CELEBREX e 6,1% para pacientes que receberam placebo. Entre os motivos mais comuns para descontinuação devido a eventos adversos nos grupos de tratamento com CELEBREX foram dispepsia e dor abdominal (citados como motivos de descontinuação em 0,8% e 0,7% dos pacientes com CELEBREX, respectivamente). Entre os pacientes que receberam placebo, 0,6% descontinuaram por dispepsia e 0,6% por dor abdominal.
As seguintes reações adversas ocorreram em 0,1% a 1,9% dos pacientes tratados com CELEBREX (100 mg a 200 mg duas vezes ao dia ou 200 mg uma vez ao dia):
Gastrointestinal: Constipação, diverticulite, disfagia, eructação, esofagite, gastrite, gastroenterite, refluxo gastroesofágico, hemorroidas, hérnia de hiato, melena, boca seca, estomatite, tenesmo, vômito
Cardiovascular: Hipertensão agravada, angina pectoris, doença arterial coronariana, infarto do miocárdio
Em geral: Hipersensibilidade, reação alérgica, dor torácica, cisto SOE, edema generalizado, edema facial, fadiga, febre, ondas de calor, sintomas semelhantes aos da gripe, dor, dor periférica
Sistema nervoso central e periférico: Cãibras nas pernas, hipertonia, hipoestesia, enxaqueca, parestesia, vertigem
Audição e vestibular: Surdez, zumbido
Frequência e ritmo cardíacos: Palpitação, taquicardia
Fígado e biliar: Enzima hepática aumentada (incluindo SGOT aumentada, SGPT aumentada)
Metabólico e nutricional: aumento do nitrogênio da uréia no sangue (BUN), aumento da creatina fosfoquinase (CPK), hipercolesterolemia, hiperglicemia, hipocalemia, aumento do NPN, aumento da creatinina, aumento da fosfatase alcalina, aumento do peso
Musculoesquelético: Artralgia, artrose, mialgia, sinovite, tendinite
Plaquetas (sangramento ou coagulação): Equimose, epistaxe, trombocitemia,
Psiquiátrico: Anorexia, ansiedade, aumento do apetite, depressão, nervosismo, sonolência
Hemico: Anemia
Respiratório: Bronquite, broncoespasmo, broncoespasmo agravado, tosse, dispneia, laringite, pneumonia
Pele e anexos: Alopecia, dermatite, reação de fotossensibilidade, prurido, erupção cutânea eritematosa, erupção cutânea maculopapular, alteração da pele, pele seca, sudorese aumentada, urticária
Distúrbios do local de aplicação: Celulite, dermatite de contato
Urinário: Albuminúria, cistite, disúria, hematúria, frequência de micção, cálculo renal
Os seguintes eventos adversos graves (causalidade não avaliada) ocorreram em
Cardiovascular: Síncope, insuficiência cardíaca congestiva, fibrilação ventricular, embolia pulmonar, acidente vascular cerebral, gangrena periférica, tromboflebite
Gastrointestinal: Obstrução intestinal, perfuração intestinal, sangramento gastrointestinal, colite com sangramento, perfuração esofágica, pancreatite, íleo
Em geral: Sepse, morte súbita
Fígado e biliar: Colelitíase
Hemico e linfático: Trombocitopenia
Nervoso: Ataxia, suicídio [ver INTERAÇÕES MEDICAMENTOSAS ]
Renal: Insuficiência renal aguda
O Estudo de Segurança de Artrite de Longo Prazo do Celecoxib
[Vejo Estudos clínicos ]
Eventos hematológicos: A incidência de reduções clinicamente significativas na hemoglobina (> 2 g/dL) foi menor em pacientes que receberam CELEBREX 400 mg duas vezes ao dia (0,5%) em comparação com pacientes que receberam diclofenaco 75 mg duas vezes ao dia (1,3%) ou ibuprofeno 800 mg três vezes ao dia 1,9 %. A menor incidência de eventos com CELEBREX foi mantida com ou sem uso de aspirina [ver FARMACOLOGIA CLÍNICA ].
Retiradas/Eventos Adversos Graves: As taxas cumulativas de Kaplan-Meier em 9 meses para retiradas devido a eventos adversos para CELEBREX 100mg, diclofenaco e ibuprofeno foram de 24%, 29% e 26%, respectivamente. As taxas de eventos adversos graves (ou seja, causando hospitalização ou considerados potencialmente fatais ou clinicamente significativos), independentemente da causalidade, não foram diferentes entre os grupos de tratamento (8%, 7% e 8%, respectivamente).
Estudo de Artrite Reumatóide Juvenil
Em um estudo de 12 semanas, duplo-cego, com controle ativo, 242 pacientes com ARJ de 2 a 17 anos de idade foram tratados com celecoxib ou naproxeno; 77 pacientes com ARJ foram tratados com celecoxib 3 mg/kg duas vezes ao dia, 82 pacientes foram tratados com celecoxib 6 mg/kg duas vezes ao dia e 83 pacientes foram tratados com naproxeno 7,5 mg/kg duas vezes ao dia. Os eventos adversos mais comuns (≥5%) em pacientes tratados com celecoxibe foram cefaleia, febre (pirexia), dor abdominal superior, tosse, nasofaringite, dor abdominal, náusea, artralgia, diarreia e vômito. As experiências adversas mais comuns (≥5%) para pacientes tratados com naproxeno foram cefaleia, náusea, vômito, febre, dor abdominal superior, diarreia, tosse, dor abdominal e tontura (Tabela 2). Comparado com o naproxeno, o celecoxib em doses de 3 e 6 mg/kg duas vezes ao dia não teve efeito deletério observável no crescimento e desenvolvimento durante o curso do estudo duplo-cego de 12 semanas. Não houve diferença substancial no número de exacerbações clínicas de uveíte ou características sistêmicas de ARJ entre os grupos de tratamento.
Em uma extensão aberta de 12 semanas do estudo duplo-cego descrito acima, 202 pacientes com ARJ foram tratados com celecoxib 6mg/kg duas vezes ao dia. A incidência de eventos adversos foi semelhante à observada durante o estudo duplo-cego; nenhum evento adverso inesperado de importância clínica surgiu.
Outros estudos de pré-aprovação
Eventos adversos de estudos de espondilite anquilosante
Um total de 378 pacientes foram tratados com CELEBREX 200mg em estudos de EA controlados por placebo e ativo. Doses de até 400 mg uma vez ao dia foram estudadas. Os tipos de eventos adversos relatados nos estudos AS foram semelhantes aos relatados nos estudos OA/RA.
Eventos adversos de estudos de analgesia e dismenorreia
Aproximadamente 1.700 pacientes foram tratados com CELEBREX 200mg em estudos de analgesia e dismenorreia. Todos os pacientes em estudos de dor pós-cirurgia oral receberam uma dose única da medicação do estudo. Doses de até 600 mg/dia de CELEBREX 200 mg foram estudadas em estudos de dismenorreia primária e dor pós-cirurgia ortopédica. Os tipos de eventos adversos nos estudos de analgesia e dismenorreia foram semelhantes aos relatados em estudos de artrite. O único evento adverso adicional relatado foi a osteíte alveolar pós-extração dentária (alveolite seca) nos estudos de dor pós-cirurgia oral.
Os testes APC e PreSAP
Reações adversas de estudos de prevenção de pólipos controlados por placebo a longo prazo
A exposição ao CELEBREX nos estudos APC e PreSAP foi de 400 mg a 800 mg diariamente por até 3 anos [ver Estudos clínicos ].
Algumas reações adversas ocorreram em porcentagens mais altas de pacientes do que nos estudos de artrite pré-comercialização (duração do tratamento de até 12 semanas; veja Eventos adversos dos estudos de artrite controlados pré-comercialização de CELEBREX 200mg, acima). As reações adversas para as quais essas diferenças em pacientes tratados com CELEBREX foram maiores em comparação com os estudos de pré-comercialização de artrite foram as seguintes:
As seguintes reações adversas adicionais ocorreram em ≥0,1% e
Distúrbios do sistema nervoso: Infarto cerebral
Distúrbios oculares: Flutuadores vítreos, hemorragia conjuntival
Ouvido e labirinto: Labirintite
Distúrbios cardíacos: Angina instável, incompetência da válvula aórtica, aterosclerose da artéria coronária, bradicardia sinusal, hipertrofia ventricular
Distúrbios vasculares: Trombose venosa profunda
Distúrbios do sistema reprodutor e da mama: Cisto no ovário
Investigações: Aumento do potássio no sangue, aumento do sódio no sangue, diminuição da testosterona no sangue
Lesões, envenenamento e complicações do procedimento: Epicondilite, ruptura do tendão
Experiência pós-marketing
As seguintes reações adversas foram identificadas durante o uso pós-aprovação de CELEBREX. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento
Cardiovascular: Vasculite, trombose venosa profunda
Em geral: Reação anafilactóide, angioedema
Fígado e biliar: Necrose hepática, hepatite, icterícia, insuficiência hepática
Hemico e linfático: Agranulocitose, anemia aplástica, pancitopenia, leucopenia
Metabólico: Hipoglicemia, hiponatremia
Nervoso: Meningite asséptica, ageusia, anosmia, hemorragia intracraniana fatal
Renal: Nefrite intersticial
INTERAÇÕES MEDICAMENTOSAS
Consulte a Tabela 3 para interações medicamentosas clinicamente significativas com celecoxib.
AVISOS
Incluído como parte do PRECAUÇÕES seção.
PRECAUÇÕES
Eventos Trombóticos Cardiovasculares
Ensaios clínicos de vários AINEs seletivos e não seletivos da ciclooxigenase-2 (COX-2) com duração de até três anos mostraram um risco aumentado de eventos trombóticos cardiovasculares (CV) graves, incluindo infarto do miocárdio (IM) e acidente vascular cerebral, que podem ser fatais. Com base nos dados disponíveis, não está claro que o risco de eventos trombóticos CV seja semelhante para todos os AINEs. O aumento relativo de eventos trombóticos CV graves em relação à linha de base conferida pelo uso de AINEs parece ser semelhante naqueles com e sem doença CV conhecida ou fatores de risco para doença CV. No entanto, pacientes com doença CV conhecida ou fatores de risco tiveram uma incidência absoluta mais alta de excesso de eventos trombóticos CV graves, devido ao aumento da taxa basal. Alguns estudos observacionais descobriram que esse risco aumentado de eventos trombóticos CV graves começou logo nas primeiras semanas de tratamento. O aumento do risco trombótico CV foi observado de forma mais consistente em doses mais elevadas.
No estudo APC (Adenoma Prevention with Celecoxib), houve um risco cerca de três vezes maior do desfecho composto de morte cardiovascular, infarto do miocárdio ou acidente vascular cerebral para os braços de tratamento CELEBREX 400 mg duas vezes ao dia e CELEBREX 200 mg duas vezes ao dia em comparação com placebo. Os aumentos em ambos os grupos de dose de celecoxibe versus pacientes tratados com placebo foram principalmente devido a um aumento na incidência de infarto do miocárdio [ver Estudos clínicos ].
Um estudo controlado randomizado intitulado Avaliação Prospectiva Randomizada da Segurança Integrada do Celecoxibe vs. Ibuprofeno ou Naproxeno (PRECISION) foi realizado para avaliar o risco trombótico cardiovascular relativo de um inibidor de COX-2, o celecoxibe, em comparação com os AINEs não seletivos naproxeno e ibuprofeno. O celecoxib 100 mg duas vezes ao dia não foi inferior ao naproxeno 375 a 500 mg duas vezes ao dia e ao ibuprofeno 600 a 800 mg três vezes ao dia para o desfecho composto dos Antiplaquetários Trialists' Colaboração (APTC), que consiste em morte cardiovascular (incluindo morte hemorrágica), infarto do miocárdio não fatal e acidente vascular cerebral não fatal [ver Estudos clínicos ].
Para minimizar o risco potencial de um evento CV adverso em pacientes tratados com AINEs, use a menor dose eficaz pelo menor tempo possível. Médicos e pacientes devem permanecer alertas para o desenvolvimento de tais eventos, durante todo o curso do tratamento, mesmo na ausência de sintomas CV prévios. Os pacientes devem ser informados sobre os sintomas de eventos CV graves e as medidas a serem tomadas se ocorrerem.
Não há evidências consistentes de que o uso concomitante de aspirina reduza o risco aumentado de eventos trombóticos CV graves associados ao uso de AINEs. O uso concomitante de aspirina e um AINE, como o celecoxibe, aumenta o risco de eventos gastrointestinais (GI) graves [ver AVISOS E PRECAUÇÕES ].
Status Pós Cirurgia de Revascularização do Miocárdio (CRM)
Dois grandes ensaios clínicos controlados de um AINE seletivo para COX-2 para o tratamento da dor nos primeiros 10 a 14 dias após a cirurgia de revascularização do miocárdio encontraram um aumento na incidência de infarto do miocárdio e acidente vascular cerebral. Os AINEs são contraindicados no contexto de CRM [ver CONTRA-INDICAÇÕES ].
Pacientes pós-IM
Estudos observacionais conduzidos no Registro Nacional Dinamarquês demonstraram que pacientes tratados com AINEs no período pós-IM apresentaram risco aumentado de reinfarto, morte relacionada a CV e mortalidade por todas as causas a partir da primeira semana de tratamento. Nesta mesma coorte, a incidência de morte no primeiro ano pós-IAM foi de 20 por 100 pessoas-ano em pacientes tratados com AINEs em comparação com 12 por 100 pessoas-anos em pacientes não expostos a AINEs. Embora a taxa absoluta de morte tenha diminuído um pouco após o primeiro ano pós-IM, o aumento do risco relativo de morte em usuários de AINEs persistiu durante pelo menos os próximos quatro anos de acompanhamento.
Evite o uso de CELEBREX 100mg em pacientes com infarto recente do miocárdio, a menos que se espere que os benefícios superem o risco de eventos trombóticos CV recorrentes. Se CELEBREX for usado em pacientes com infarto recente do miocárdio, monitore os pacientes quanto a sinais de isquemia cardíaca.
Hemorragia, ulceração e perfuração gastrointestinais
Os AINEs, incluindo o celecoxib, causam eventos adversos gastrointestinais (GI) graves, incluindo inflamação, sangramento, ulceração e perfuração do esôfago, estômago, intestino delgado ou intestino grosso, que podem ser fatais. Esses eventos adversos graves podem ocorrer a qualquer momento, com ou sem sintomas de alerta, em pacientes tratados com CELEBREX. Apenas um em cada cinco pacientes que desenvolvem um evento adverso grave no trato GI superior na terapia com AINEs é sintomático. Úlceras do trato GI superior, sangramento grave ou perfuração causada por AINEs ocorreram em aproximadamente 1% dos pacientes tratados por 3 a 6 meses e em cerca de 2% a 4% dos pacientes tratados por um ano. No entanto, mesmo a terapia com AINEs de curto prazo não é isenta de riscos.
Fatores de risco para sangramento GI, ulceração e perfuração
Pacientes com história prévia de úlcera péptica e/ou sangramento GI que usaram AINEs tiveram um risco 10 vezes maior de desenvolver sangramento GI em comparação com pacientes sem esses fatores de risco. Outros fatores que aumentam o risco de sangramento GI em pacientes tratados com AINEs incluem maior duração da terapia com AINEs; uso concomitante de corticosteroides orais, medicamentos antiplaquetários (como aspirina), anticoagulantes; ou inibidores seletivos da recaptação da serotonina (SSRIs); fumar; uso de álcool; idoso; e mau estado geral de saúde. A maioria das notificações pós-comercialização de eventos GI fatais ocorreram em pacientes idosos ou debilitados. Além disso, pacientes com doença hepática avançada e/ou coagulopatia apresentam risco aumentado de sangramento GI.
As taxas de úlceras complicadas e sintomáticas foram de 0,78% em nove meses para todos os pacientes no estudo CLASS e 2,19% para o subgrupo em baixas doses de AAS. Pacientes com 65 anos de idade ou mais tiveram uma incidência de 1,40% aos nove meses, 3,06% quando também tomaram AAS [ver Estudos clínicos ].
Estratégias para minimizar os riscos gastrointestinais em pacientes tratados com AINEs
- Use a dosagem eficaz mais baixa para a duração mais curta possível.
- Evite a administração de mais de um AINE de cada vez.
- Evite o uso em pacientes de alto risco, a menos que se espere que os benefícios superem o risco aumentado de sangramento. Para esses pacientes, bem como aqueles com sangramento GI ativo, considere terapias alternativas além dos AINEs.
- Permaneça alerta para sinais e sintomas de ulceração GI e sangramento durante a terapia com AINEs.
- Se houver suspeita de um evento adverso GI grave, inicie imediatamente a avaliação e o tratamento e descontinue CELEBREX 200mg até que um evento adverso GI grave seja descartado.
- No caso de uso concomitante de aspirina em baixas doses para profilaxia cardíaca, monitore os pacientes mais de perto quanto a evidências de sangramento GI [ver INTERAÇÕES MEDICAMENTOSAS ].
Hepatotoxicidade
Elevações de ALT ou AST (três ou mais vezes o limite superior do normal [LSN]) foram relatadas em aproximadamente 1% dos pacientes tratados com AINEs em ensaios clínicos. Além disso, casos raros, às vezes fatais, de lesão hepática grave, incluindo hepatite fulminante, necrose hepática e insuficiência hepática foram relatados.
Elevações de ALT ou AST (menos de três vezes o LSN) podem ocorrer em até 15% dos pacientes tratados com AINEs, incluindo celecoxibe.
Em ensaios clínicos controlados de CELEBREX 200mg, a incidência de elevações limítrofes (maior ou igual a 1,2 vezes e inferior a 3 vezes o limite superior do normal) das enzimas hepáticas associadas foi de 6% para CELEBREX e 5% para placebo, e aproximadamente 0,2 % dos pacientes que tomaram CELEBREX e 0,3% dos pacientes que tomaram placebo apresentaram elevações notáveis de ALT e AST.
Informe os pacientes sobre os sinais e sintomas de alerta de hepatotoxicidade (p. Se surgirem sinais e sintomas clínicos consistentes com doença hepática, ou se ocorrerem manifestações sistêmicas (por exemplo, eosinofilia, erupção cutânea), descontinue CELEBREX imediatamente e realize uma avaliação clínica do paciente.
Hipertensão
Os AINEs, incluindo CELEBREX 200mg, podem levar a um novo aparecimento de hipertensão ou agravamento de hipertensão preexistente, podendo contribuir para o aumento da incidência de eventos CV. Pacientes em uso de inibidores da enzima conversora de angiotensina (ECA), diuréticos tiazídicos ou diuréticos de alça podem apresentar resposta prejudicada a essas terapias ao tomar AINEs [ver INTERAÇÕES MEDICAMENTOSAS ].
Ver Estudos clínicos para dados adicionais de pressão arterial para CELEBREX.
Monitorar a pressão arterial (PA) durante o início do tratamento com AINEs e durante o curso da terapia.
Insuficiência Cardíaca e Edema
Coxib e os tradicionais NSAID Trialists' A metanálise de colaboração de ensaios clínicos randomizados demonstrou um aumento de aproximadamente duas vezes nas hospitalizações por insuficiência cardíaca em pacientes tratados com COX-2 seletivamente e pacientes tratados com AINEs não seletivos em comparação com pacientes tratados com placebo. Em um estudo do Registro Nacional Dinamarquês de pacientes com insuficiência cardíaca, o uso de AINEs aumentou o risco de infarto do miocárdio, hospitalização por insuficiência cardíaca e morte.
Além disso, retenção de líquidos e edema foram observados em alguns pacientes tratados com AINEs. O uso de celecoxibe pode atenuar os efeitos CV de vários agentes terapêuticos usados para tratar essas condições médicas (por exemplo, diuréticos, inibidores da ECA ou bloqueadores dos receptores da angiotensina [BRA]) [ver INTERAÇÕES MEDICAMENTOSAS ].
No estudo CLASS [ver Estudos clínicos ], as taxas cumulativas de Kaplan-Meier em 9 meses de edema periférico em pacientes com CELEBREX 400 mg duas vezes ao dia (4 vezes e 2 vezes as doses recomendadas de OA e AR, respectivamente), ibuprofeno 800 mg três vezes ao dia e diclofenaco 75 mg duas vezes ao dia foram de 4,5%, 6,9% e 4,7%, respectivamente.
Evite o uso de CELEBREX 200mg em pacientes com insuficiência cardíaca grave, a menos que se espere que os benefícios superem o risco de agravamento da insuficiência cardíaca. Se CELEBREX 100mg for usado em pacientes com insuficiência cardíaca grave, monitore os pacientes quanto a sinais de piora da insuficiência cardíaca.
Toxicidade renal e hipercalemia
Toxicidade renal
A administração a longo prazo de AINEs resultou em necrose papilar renal e outras lesões renais.
toxicidade renal também foi observada em pacientes nos quais as prostaglandinas renais têm um papel compensatório na manutenção da perfusão renal. Nesses pacientes, a administração de um AINE pode causar uma redução dose-dependente na informação de prostagland e, secundariamente, no fluxo sanguíneo renal, o que pode precipitar uma descompensação renal evidente. Os pacientes com maior risco desta reação são aqueles com função renal comprometida, desidratação, hipovolemia, insuficiência cardíaca, disfunção hepática, aqueles que tomam diuréticos, inibidores da ECA ou BRA e os idosos. A descontinuação da terapia com AINEs geralmente é seguida pela recuperação ao estado pré-tratamento.
Não há informações disponíveis de estudos clínicos controlados sobre o uso de CELEBREX 100mg em pacientes com doença renal avançada. Os efeitos renais de CELEBREX podem acelerar a progressão da disfunção renal em pacientes com doença renal preexistente.
Corrija o status do volume em pacientes desidratados ou hipovolêmicos antes de iniciar CELEBREX. Monitorar a função renal em pacientes com insuficiência renal ou hepática, insuficiência cardíaca, desidratação ou hipovolemia durante o uso de CELEBREX [ver INTERAÇÕES MEDICAMENTOSAS ]. Evite o uso de CELEBREX 200mg em pacientes com doença renal avançada, a menos que se espere que os benefícios superem o risco de piora da função renal. Se CELEBREX 200mg for usado em pacientes com doença renal avançada, monitore os pacientes quanto a sinais de piora da função renal.
Hipercalemia
Aumentos na concentração sérica de potássio, incluindo hipercalemia, foram relatados com o uso de AINEs, mesmo em alguns pacientes sem insuficiência renal. Em pacientes com função renal normal, esses efeitos foram atribuídos ao estado de hipoaldosteronismo hiporeninêmico.
Reações anafiláticas
celecoxib tem sido associado a reações anafiláticas em pacientes com e sem hipersensibilidade conhecida ao celecoxib e em pacientes com asma sensível à aspirina. Celebrex 200mg é uma sulfonamida e tanto os AINEs quanto as sulfonamidas podem causar reações do tipo alérgico, incluindo sintomas anafiláticos e episódios asmáticos com risco de vida ou menos graves em certas pessoas suscetíveis. CONTRA-INDICAÇÕES e AVISOS E PRECAUÇÕES ].
Procure ajuda de emergência se ocorrer alguma reação anafilática.
Exacerbação da asma relacionada à sensibilidade à aspirina
Uma subpopulação de pacientes com asma pode ter asma sensível à aspirina, que pode incluir rinossinusite crônica complicada por pólipos nasais; broncoespasmo grave e potencialmente fatal; e/ou intolerância à aspirina e outros AINEs. Como a reação cruzada entre aspirina e outros AINEs foi relatada nesses pacientes sensíveis à aspirina, CELEBREX é contraindicado em pacientes com essa forma de sensibilidade à aspirina [ver CONTRA-INDICAÇÕES ]. Quando CELEBREX é usado em pacientes com asma preexistente (sem sensibilidade conhecida à aspirina), monitore os pacientes quanto a alterações nos sinais e sintomas da asma.
Reações cutâneas graves
Reações cutâneas graves ocorreram após o tratamento com Celebrex 200mg, incluindo eritema multiforme, dermatite esfoliativa, síndrome de Stevens-Johnson (SSJ), necrólise epidérmica tóxica (NET), reação medicamentosa com eosinofilia e sintomas sistêmicos (DRESS) e pustulose exantematosa generalizada aguda. AGEP). Estes eventos graves podem ocorrer sem aviso prévio e podem ser fatais.
Informar os pacientes sobre os sinais e sintomas de reações cutâneas graves e descontinuar o uso de CELEBREX 100mg ao primeiro aparecimento de erupção cutânea ou qualquer outro sinal de hipersensibilidade. CELEBREX 200mg é contraindicado em pacientes com reações cutâneas graves prévias a AINEs [ver CONTRA-INDICAÇÕES ].
Reação medicamentosa com eosinofilia e sintomas sistêmicos (DRESS)
Reação medicamentosa com eosinofilia e sintomas sistêmicos (DRESS) foi relatada em pacientes tomando AINEs, como CELEBREX. Alguns desses eventos foram fatais ou com risco de vida. DRESS tipicamente, embora não exclusivamente, apresenta febre, erupção cutânea, linfadenopatia e/ou edema facial. Outras manifestações clínicas podem incluir hepatite, nefrite, anormalidades hematológicas, miocardite ou miosite. Às vezes, os sintomas do DRESS podem se assemelhar a uma infecção viral aguda. A eosinofilia está frequentemente presente. Como esse distúrbio é variável em sua apresentação, outros sistemas orgânicos não mencionados aqui podem estar envolvidos. É importante notar que manifestações precoces de hipersensibilidade, como febre ou linfadenopatia, podem estar presentes, mesmo que a erupção não seja evidente. Se tais sinais ou sintomas estiverem presentes, descontinue CELEBREX 200mg e avalie o paciente imediatamente.
Toxicidade Fetal
Fechamento prematuro do canal arterial fetal
Evite o uso de AINEs, incluindo CELEBREX 100mg, em mulheres grávidas com cerca de 30 semanas de gestação e mais tarde. Os AINEs, incluindo CELEBREX, aumentam o risco de fechamento prematuro do canal arterial fetal aproximadamente nesta idade gestacional.
Oligoidrâmnio/Insuficiência Renal Neonatal
O uso de AINEs, incluindo CELEBREX, com cerca de 20 semanas de gestação ou mais tarde na gravidez, pode causar disfunção renal fetal levando a oligoidrâmnio e, em alguns casos, insuficiência renal neonatal. Esses resultados adversos são observados, em média, após dias a semanas de tratamento, embora oligoidrâmnios tenham sido relatados com pouca frequência tão logo 48 horas após o início dos AINEs. O oligoidrâmnio é frequentemente, mas nem sempre, reversível com a descontinuação do tratamento. As complicações do oligoidrâmnio prolongado podem, por exemplo, incluir contraturas dos membros e maturação pulmonar retardada. Em alguns casos pós-comercialização de insuficiência renal neonatal, foram necessários procedimentos invasivos, como exsanguineotransfusão ou diálise.
Se o tratamento com AINE for necessário entre cerca de 20 semanas e 30 semanas de gestação, limite o uso de CELEBREX à menor dose eficaz e à menor duração possível. Considere o monitoramento por ultrassom do líquido amniótico se o tratamento com CELEBREX se estender além de 48 horas. Interrompa o CELEBREX se ocorrer oligoidrâmnio e faça o acompanhamento de acordo com a prática clínica [consulte Uso em populações específicas ].
Toxicidade hematológica
Anemia ocorreu em pacientes tratados com AINEs. Isso pode ser devido à perda de sangue oculta ou grosseira, retenção de líquidos ou um efeito descrito de forma incompleta na eritropoiese. Se um paciente tratado com CELEBREX apresentar quaisquer sinais ou sintomas de anemia, monitore a hemoglobina ou o hematócrito.
Em ensaios clínicos controlados, a incidência de anemia foi de 0,6% com CELEBREX e 0,4% com placebo. Pacientes em tratamento prolongado com CELEBREX 200mg devem ter sua hemoglobina ou hematócrito verificados se apresentarem quaisquer sinais ou sintomas de anemia ou perda de sangue.
AINEs, incluindo CELEBREX 100mg, podem aumentar o risco de eventos hemorrágicos. Condições comórbidas, como distúrbios de coagulação ou uso concomitante de varfarina, outros anticoagulantes, medicamentos antiplaquetários (por exemplo, aspirina), ISRSs e inibidores da recaptação de serotonina e noradrenalina (IRSNs) podem aumentar esse risco. Monitore esses pacientes quanto a sinais de sangramento [ver INTERAÇÕES MEDICAMENTOSAS ].
Mascaramento de inflamação e febre
A atividade farmacológica de CELEBREX 100mg na redução da inflamação, e possivelmente da febre, pode diminuir a utilidade dos sinais diagnósticos na detecção de infecções.
Monitoramento de Laboratório
Como sangramento GI grave, hepatotoxicidade e lesão renal podem ocorrer sem sinais ou sintomas de alerta, considere monitorar os pacientes em tratamento prolongado com AINEs com hemograma e perfil químico periodicamente [ver AVISOS E PRECAUÇÕES ].
Em ensaios clínicos controlados, o BUN elevado ocorreu com mais frequência em pacientes que receberam CELEBREX em comparação com o placebo. Essa anormalidade laboratorial também foi observada em pacientes que receberam AINEs comparadores nesses estudos. O significado clínico desta anormalidade não foi estabelecido.
Coagulação Intravascular Disseminada (DIC)
Devido ao risco de coagulação intravascular disseminada com o uso de CELEBREX 200mg em pacientes pediátricos com ARJ de início sistêmico, monitore os pacientes quanto a sinais e sintomas de coagulação ou sangramento anormal e informe os pacientes e seus cuidadores para relatar os sintomas o mais rápido possível.
Informações de Aconselhamento do Paciente
Aconselhe o paciente a ler o rótulo do paciente aprovado pela FDA ( Guia de Medicação ) que acompanha cada receita dispensada. Informe os pacientes, familiares ou seus cuidadores sobre as seguintes informações antes de iniciar a terapia com CELEBREX e periodicamente durante o curso da terapia em andamento.
Eventos Trombóticos Cardiovasculares
Aconselhe os pacientes a ficarem alertas para os sintomas de eventos trombóticos cardiovasculares, incluindo dor no peito, falta de ar, fraqueza ou fala arrastada, e relatar qualquer um desses sintomas ao seu médico imediatamente [ver AVISOS E PRECAUÇÕES ].
Hemorragia, ulceração e perfuração gastrointestinais
Aconselhe os pacientes a relatar sintomas de ulcerações e sangramento, incluindo dor epigástrica, dispepsia, melena e hematêmese ao seu médico. No caso de uso concomitante de aspirina em baixas doses para profilaxia cardíaca, informe os pacientes sobre o risco aumentado e os sinais e sintomas de sangramento GI [ver AVISOS E PRECAUÇÕES ].
Hepatotoxicidade
Informe os pacientes sobre os sinais e sintomas de alerta de hepatotoxicidade (p. Se isso ocorrer, instrua os pacientes a interromper CELEBREX 200mg e procurar tratamento médico imediato [ver AVISOS E PRECAUÇÕES , Uso em populações específicas ].
Insuficiência Cardíaca e Edema
Aconselhe os pacientes a ficarem atentos aos sintomas de insuficiência cardíaca congestiva, incluindo falta de ar, ganho de peso inexplicável ou edema, e a entrar em contato com seu médico se tais sintomas ocorrerem [ver AVISOS E PRECAUÇÕES ].
Reações anafiláticas
Informe os pacientes sobre os sinais de uma reação anafilática (por exemplo, dificuldade em respirar, inchaço da face ou garganta). Instrua os pacientes a procurar ajuda de emergência imediata se isso ocorrer [ver CONTRA-INDICAÇÕES e AVISOS E PRECAUÇÕES ].
Reações cutâneas graves, incluindo DRESS
Aconselhe os pacientes a parar de tomar CELEBREX 100mg imediatamente se desenvolverem qualquer tipo de erupção cutânea ou febre e a entrar em contato com seu médico o mais rápido possível [ver AVISOS E PRECAUÇÕES ].
Fertilidade Feminina
Aconselhar as mulheres com potencial reprodutivo que desejam engravidar que os AINEs, incluindo CELEBREX 200mg, podem estar associados a atrasos versáteis na ovulação [ver Uso em populações específicas ].
Toxicidade Fetal
Informar as mulheres grávidas para evitar o uso de CELEBREX e outros AINEs a partir de 30 semanas de gestação devido ao risco de fechamento prematuro do canal arterial fetal. Se o tratamento com CELEBREX 200mg for necessário para uma gestante entre cerca de 20 a 30 semanas de gestação, informe-a de que ela pode precisar ser monitorada para oligoidrâmnio, se o tratamento continuar por mais de 48 horas [ver AVISOS E PRECAUÇÕES e Uso em populações específicas ].
Evite o uso concomitante de AINEs
Informe os pacientes que o uso concomitante de CELEBREX com outros AINEs ou salicilatos (por exemplo, diflunisal, salsalato) não é recomendado devido ao risco aumentado de toxicidade gastrointestinal e pouco ou nenhum aumento na eficácia [ver AVISOS E PRECAUÇÕES e INTERAÇÕES MEDICAMENTOSAS ]. Alertar os pacientes de que os AINEs podem estar presentes em medicamentos de venda livre para o tratamento de resfriados, febre ou insônia.
Uso de AINEs e aspirina em baixas doses
Informe os pacientes para não usar aspirina em baixas doses concomitantemente com CELEBREX 200mg até que conversem com seu médico [ver INTERAÇÕES MEDICAMENTOSAS ].
rotulagem deste produto pode ter sido atualizada. Para obter as informações de prescrição mais recentes, visite www.pfizer.com.
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Carcinogênese
O celecoxibe não foi carcinogênico em ratos Sprague-Dawley que receberam doses orais de até 200 mg/kg para machos e 10 mg/kg para fêmeas (aproximadamente 2 a 4 vezes a exposição humana medida pela AUC0-24 a 200 mg duas vezes ao dia ) ou em camundongos que receberam doses orais de até 25 mg/kg para machos e 50 mg/kg para fêmeas (aproximadamente igual à exposição humana medida pela AUC0-24 a 200 mg duas vezes ao dia) por dois anos.
Mutagênese
O celecoxibe não foi mutagênico em um teste de Ames e um ensaio de mutação em células de ovário de hamster chinês (CHO), nem clastogênico em um ensaio de aberração cromossômica em células CHO e um teste de micronúcleo in vivo em medula óssea de rato.
Prejuízo da Fertilidade
celecoxib não teve efeito na fertilidade masculina ou feminina ou na função reprodutiva masculina em ratos em doses orais de até 600 mg/kg/dia (aproximadamente 11 vezes a exposição humana em 200 mg duas vezes ao dia com base na AUC0-24). Em ≥50 mg/kg/dia (aproximadamente 6 vezes a exposição humana com base na AUC0-24 em 200 mg duas vezes ao dia), houve aumento da perda pré-implantação.
Uso em populações específicas
Gravidez
Resumo do risco
O uso de AINEs, incluindo CELEBREX 200mg, pode causar fechamento prematuro do canal arterial fetal e disfunção renal fetal levando a oligoidrâmnio e, em alguns casos, insuficiência renal neonatal. Devido a esses riscos, limite a dose e a duração do uso de CELEBREX 200mg entre cerca de 20 e 30 semanas de gestação e evite o uso de CELEBREX por volta de 30 semanas de gestação e mais tarde na gravidez (consulte Considerações Clínicas, Dados ).
Fechamento prematuro do canal arterial fetal
O uso de AINEs, incluindo CELEBREX, por volta de 30 semanas de gestação ou mais tarde na gravidez aumenta o risco de fechamento prematuro do canal arterial fetal.
Oligoidrâmnio/Insuficiência Renal Neonatal
uso de AINEs com cerca de 20 semanas de gestação ou mais tarde na gravidez tem sido associado a casos de disfunção renal fetal levando a oligoidrâmnio e, em alguns casos, insuficiência renal neonatal.
Os dados de estudos observacionais sobre outros potenciais riscos embriofetais do uso de AINEs em mulheres no primeiro ou segundo trimestre de gravidez são inconclusivos. Em estudos de reprodução em animais, foram observadas mortes embriofetais e um aumento nas hérnias diafragmáticas em ratos que receberam celecoxib diariamente durante o período de organogênese em doses orais aproximadamente 6 vezes a dose humana máxima recomendada (MRHD) de 200 mg duas vezes ao dia. Além disso, anormalidades estruturais (p. Dados ). Com base em dados de animais, as prostaglandinas demonstraram ter um papel importante na permeabilidade vascular endometrial, implantação de blastocistos e decidualização. Em estudos com animais, a administração de inibidores da síntese de prostaglandinas, como o celecoxib, resultou em aumento da perda pré e pós-implantação. As prostaglandinas também demonstraram ter um papel importante no desenvolvimento do rim fetal. Em estudos publicados em animais, foi relatado que os inibidores da síntese de prostaglandinas prejudicam o desenvolvimento renal quando administrados em doses clinicamente relevantes.
O risco de fundo estimado de defeitos congênitos graves e aborto espontâneo para a população indicada é desconhecido. Todas as gestações têm um risco histórico de defeitos congênitos, perda ou outros resultados adversos. Na população geral dos EUA, o risco de fundo estimado de defeitos congênitos graves e aborto espontâneo em gestações clinicamente reconhecidas é de 2% a 4% e 15% a 20%, respectivamente.
Considerações Clínicas
Reações Adversas Fetais/Neonatais
Fechamento prematuro do canal arterial fetal
Evite o uso de AINEs em mulheres com cerca de 30 semanas de gestação e mais tarde na gravidez, porque os AINEs, incluindo CELEBREX 200mg, podem causar fechamento prematuro do canal arterial fetal (ver Dados ).
Oligoidrâmnio/Insuficiência Renal Neonatal:
Se um AINE for necessário por volta da 20ª semana de gestação ou mais tarde na gravidez, limite o uso à menor dose eficaz e à menor duração possível. Se o tratamento com CELEBREX se estender além de 48 horas, considere monitorar com ultra-som para oligoidrâmnio. Se ocorrer oligoidrâmnio, descontinue CELEBREX e faça o acompanhamento de acordo com a prática clínica (consulte Dados ).
Mão de obra ou entrega
Não existem estudos sobre os efeitos de CELEBREX durante o trabalho de parto ou parto. Em estudos com animais, os AINEs, incluindo o celecoxib, inibem a síntese de prostaglandinas, causam atraso no parto e aumentam a incidência de natimortos.
Dados
Dados humanos
Os dados disponíveis não estabelecem a presença ou ausência de toxicidade no desenvolvimento relacionada ao uso de CELEBREX.
Fechamento prematuro do canal arterial fetal
A literatura publicada relata que o uso de AINEs em cerca de 30 semanas de gestação e mais tarde na gravidez pode causar fechamento prematuro do canal arterial fetal.
Oligoidrâmnio/Insuficiência Renal Neonatal
Estudos publicados e relatórios pós-comercialização descrevem o uso materno de AINEs em cerca de 20 semanas de gestação ou mais tarde na gravidez associado a disfunção renal fetal levando a oligoidrâmnio e, em alguns casos, insuficiência renal neonatal. Esses resultados adversos são observados, em média, após dias a semanas de tratamento, embora oligoidrâmnios tenham sido relatados com pouca frequência tão logo 48 horas após o início dos AINEs. Em muitos casos, mas não em todos, a diminuição do líquido amniótico foi transitória e reversível com a suspensão da droga. Houve um número limitado de relatos de casos de uso materno de AINEs e disfunção renal neonatal sem oligoidrâmnio, alguns dos quais irreversíveis. Alguns casos de disfunção renal neonatal necessitaram de tratamento com procedimentos invasivos, como exsanguineotransfusão ou diálise.
As limitações metodológicas desses estudos e relatórios pós-comercialização incluem a falta de um grupo de controle; informações limitadas sobre dose, duração e tempo de exposição ao medicamento; e uso concomitante de outros medicamentos. Essas limitações impedem o estabelecimento de uma estimativa confiável do risco de desfechos fetais e neonatais adversos com o uso materno de AINEs. Como os dados de segurança publicados sobre os resultados neonatais envolveram principalmente bebês prematuros, a generalização de certos riscos relatados para o bebê a termo exposto a AINEs pelo uso materno é incerto.
Dados de animais
celecoxibe em doses orais ≥150 mg/kg/dia (aproximadamente 2 vezes a exposição humana em 200 mg duas vezes ao dia, medido pela AUC0-24), causou um aumento na incidência de defeitos do septo ventricular, um evento raro e alterações fetais, como costelas fundidas, esternébras fundidas e esternébras deformadas quando os coelhos foram tratados ao longo da organogênese. Um aumento dependente da dose de hérnias diafragmáticas foi observado quando ratos receberam celecoxibe em doses orais ≥ 30 mg/kg/dia (aproximadamente 6 vezes a exposição humana com base na AUC 0-24 em 200 mg duas vezes ao dia para AR) ao longo da organogênese. Em ratos, a exposição ao celecoxib durante o desenvolvimento embrionário inicial resultou em perdas pré-implantação e pós-implantação em doses orais ≥50 mg/kg/dia (aproximadamente 6 vezes a exposição humana com base na AUC 0-24 em 200 mg duas vezes ao dia para AR).
celecoxib não produziu evidência de atraso no trabalho de parto ou parto em doses orais de até 100 mg/kg em ratos (aproximadamente 7 vezes a exposição humana medida pela AUC 0-24 a 200 mg duas vezes ao dia). Os efeitos de CELEBREX no trabalho de parto e parto em mulheres grávidas são desconhecidos.
Lactação
Resumo do risco
Dados limitados de 3 relatórios publicados que incluíram um total de 12 mulheres amamentando mostraram baixos níveis de CELEBREX no leite materno. A dose média diária calculada para crianças foi de 10 a 40 mcg/kg/dia, menos de 1% da dose terapêutica baseada no peso para uma criança de dois anos. Um relato de dois bebês amamentados com 17 e 22 meses de idade não mostrou nenhum evento adverso. Deve-se ter cuidado quando CELEBREX 100mg é administrado a uma lactante. Os benefícios do aleitamento materno para o desenvolvimento e para a saúde devem ser considerados juntamente com a necessidade clínica da mãe de CELEBREX e quaisquer potenciais efeitos adversos no lactente do CELEBREX 200mg ou da condição materna subjacente.
Fêmeas e Machos com Potencial Reprodutivo
Infertilidade
Mulheres
Com base no mecanismo de ação, o uso de AINEs mediados por prostaglandinas, incluindo CELEBREX, pode retardar ou prevenir a ruptura dos folículos ovarianos, que tem sido associada à infertilidade reversível em algumas mulheres. Estudos em animais publicados mostraram que a administração de inibidores da síntese de prostaglandinas tem o potencial de interromper a ruptura folicular mediada por prostaglandinas necessária para a ovulação. Pequenos estudos em mulheres tratadas com AINEs também mostraram um atraso reversível na ovulação. Considerar a retirada de AINEs, incluindo CELEBREX 200mg, em mulheres com dificuldades de conceber ou em investigação de infertilidade.
Uso Pediátrico
CELEBREX 200mg é aprovado para alívio dos sinais e sintomas da Artrite Reumatóide Juvenil em pacientes com 2 anos ou mais. A segurança e a eficácia não foram estudadas além de seis meses em crianças. A toxicidade cardiovascular a longo prazo em crianças expostas a CELEBREX 100mg não foi avaliada e não se sabe se os riscos a longo prazo podem ser semelhantes aos observados em adultos expostos a CELEBREX ou outros AINEs seletivos e não seletivos para COX-2 [ver AVISO EM CAIXA , AVISOS E PRECAUÇÕES , e Estudos clínicos ].
uso de celecoxib em pacientes de 2 anos a 17 anos de idade com ARJ pauciarticular, poliarticular ou em pacientes com ARJ de início sistêmico foi estudado em um estudo de 12 semanas, duplo-cego, ativo controlado, farmacocinético, segurança e eficácia, com um Extensão de rótulo aberto de 12 semanas. O celecoxib não foi estudado em pacientes com idade inferior a 2 anos, em pacientes com peso corporal inferior a 10 kg (22 lbs) e em pacientes com características sistêmicas ativas. Pacientes com ARJ de início sistêmico (sem características sistêmicas ativas) parecem estar em risco de desenvolver testes laboratoriais de coagulação anormais. Em alguns pacientes com ARJ de início sistêmico, tanto o celecoxibe quanto o naproxeno foram associados a um leve prolongamento do tempo de tromboplastina parcial ativada (APTT), mas não do tempo de protrombina (TP). Quando AINEs, incluindo celecoxibe, são usados em pacientes com ARJ de início sistêmico, monitore os pacientes quanto a sinais e sintomas de coagulação anormal ou sangramento, devido ao risco de coagulação intravascular disseminada. Pacientes com ARJ de início sistêmico devem ser monitorados quanto ao desenvolvimento de testes de coagulação anormais [ver DOSAGEM E ADMINISTRAÇÃO , AVISOS E PRECAUÇÕES , REAÇÕES ADVERSAS , Toxicologia Animal , Estudos clínicos ].
Terapias alternativas para o tratamento da ARJ devem ser consideradas em pacientes pediátricos identificados como metabolizadores fracos de CYP2C9 [ver Metabolizadores pobres de substratos CYP2C9 ].
Uso Geriátrico
Pacientes idosos, em comparação com pacientes mais jovens, estão em maior risco de reações adversas cardiovasculares, gastrointestinais e/ou renais graves associadas aos AINEs. Se o benefício previsto para o paciente idoso superar esses riscos potenciais, inicie a dosagem no limite inferior da faixa de dosagem e monitore os pacientes quanto a efeitos adversos [ver AVISOS E PRECAUÇÕES ].
Do número total de pacientes que receberam CELEBREX 100mg em ensaios clínicos de pré-aprovação, mais de 3.300 tinham 65-74 anos de idade, enquanto aproximadamente 1.300 pacientes adicionais tinham 75 anos ou mais. Não foram observadas diferenças substanciais na eficácia entre estes indivíduos e indivíduos mais jovens. Em estudos clínicos comparando a função renal medida pela TFG, BUN e creatinina, e função plaquetária medida pelo tempo de sangramento e agregação plaquetária, os resultados não foram diferentes entre voluntários idosos e jovens. No entanto, assim como com outros AINEs, incluindo aqueles que inibem seletivamente a COX-2, houve mais relatos espontâneos pós-comercialização de eventos GI fatais e insuficiência renal aguda em idosos do que em pacientes mais jovens. AVISOS E PRECAUÇÕES ].
Insuficiência hepática
A dose diária recomendada de CELEBREX cápsulas em pacientes com insuficiência hepática moderada (Child-Pugh Classe B) deve ser reduzida em 50%. O uso de CELEBREX em pacientes com insuficiência hepática grave não é recomendado [ver DOSAGEM E ADMINISTRAÇÃO e FARMACOLOGIA CLÍNICA ].
Insuficiência renal
CELEBREX não é recomendado em pacientes com insuficiência renal grave [ver AVISOS E PRECAUÇÕES e FARMACOLOGIA CLÍNICA ].
Metabolizadores pobres de substratos CYP2C9
Em pacientes que são conhecidos ou suspeitos de serem metabolizadores fracos de CYP2C9 (ou seja, CYP2C9*3/*3), com base no genótipo ou história/experiência anterior com outros substratos de CYP2C9 (como varfarina, fenitoína), administrar CELEBREX 200mg começando com metade do menor dose recomendada. O manejo alternativo deve ser considerado em pacientes com ARJ identificados como metabolizadores fracos de CYP2C9 [ver DOSAGEM E ADMINISTRAÇÃO e FARMACOLOGIA CLÍNICA ].
SOBREDOSAGEM
Os sintomas após superdosagem aguda de AINEs têm sido tipicamente limitados a letargia, sonolência, náusea, vômito e dor epigástrica, que geralmente são reversíveis com cuidados de suporte. Ocorreu sangramento gastrointestinal. Hipertensão, insuficiência renal aguda, depressão respiratória e coma ocorreram, mas foram raros [ver AVISOS E PRECAUÇÕES ].
Não foram notificadas sobredosagens de CELEBREX 200 mg durante os ensaios clínicos. Doses de até 2.400 mg/dia por até 10 dias em 12 pacientes não resultaram em toxicidade grave. Não há informações disponíveis sobre a remoção do celecoxibe por hemodiálise, mas com base em seu alto grau de ligação às proteínas plasmáticas (> 97%) é improvável que a diálise seja útil em superdosagem.
Gerencie os pacientes com cuidados sintomáticos e de suporte após uma superdosagem de AINEs. Não existem antídotos específicos. Considerar vômito e/ou carvão ativado (60 a 100 gramas em adultos, 1 a 2 gramas por kg de peso corporal em pacientes pediátricos) e/ou catártico osmótico em pacientes sintomáticos atendidos dentro de quatro horas após a ingestão ou em pacientes com grande superdosagem ( 5 a 10 vezes a dosagem recomendada). Diurese forçada, alcalinização da urina, hemodiálise ou hemoperfusão podem não ser úteis devido à alta ligação às proteínas.
Para obter informações adicionais sobre o tratamento de superdosagem, entre em contato com um centro de controle de intoxicações (1-800-222-1222).
CONTRA-INDICAÇÕES
CELEBREX é contraindicado nos seguintes pacientes:
- Hipersensibilidade conhecida (por exemplo, reações anafiláticas e reações cutâneas graves) ao celecoxibe, a qualquer componente do medicamento [ver AVISOS E PRECAUÇÕES ].
- História de asma, urticária ou outras reações alérgicas após tomar aspirina ou outros AINEs. Reações anafiláticas graves, às vezes fatais, aos AINEs foram relatadas nesses pacientes [ver AVISOS E PRECAUÇÕES ].
- No cenário da cirurgia de revascularização do miocárdio [ver AVISOS E PRECAUÇÕES ].
- Em pacientes que demonstraram reações do tipo alérgico às sulfonamidas [ver AVISOS E PRECAUÇÕES ].
FARMACOLOGIA CLÍNICA
Mecanismo de ação
O celecoxib tem propriedades analgésicas, anti-inflamatórias e antipiréticas.
Acredita-se que o mecanismo de ação de CELEBREX 100mg seja devido à inibição da síntese de prostaglandinas, principalmente pela inibição da COX-2.
celecoxib é um potente inibidor da síntese de prostaglandinas in vitro. As concentrações de celecoxib alcançadas durante a terapia produziram efeitos in vivo. As prostaglandinas sensibilizam os nervos aferentes e potencializam a ação da bradicinina na indução da dor em modelos animais. As prostaglandinas são mediadores da inflamação. Como o celecoxib é um inibidor da síntese de prostaglandinas, seu modo de ação pode ser devido à diminuição das prostaglandinas nos tecidos periféricos.
Farmacodinâmica
Plaquetas
Em ensaios clínicos com voluntários normais, CELEBREX em doses únicas de até 800 mg e doses múltiplas de 600 mg duas vezes ao dia por até 7 dias de duração (doses terapêuticas superiores às recomendadas) não tiveram efeito na redução da agregação plaquetária ou aumento no tempo de sangramento. Devido à sua falta de efeitos plaquetários, CELEBREX 100mg não substitui a aspirina na profilaxia cardiovascular. Não se sabe se existem quaisquer efeitos de CELEBREX nas plaquetas que possam contribuir para o aumento do risco de eventos adversos trombóticos cardiovasculares graves associados ao uso de CELEBREX.
Retenção de fluidos
A inibição da síntese de PGE2 pode levar à retenção de sódio e água através do aumento da reabsorção na alça de Henle ascendente espessa da medula renal e talvez em outros segmentos do néfron distal. Nos ductos coletores, a PGE2 parece inibir a reabsorção de água ao neutralizar a ação do hormônio antidiurético.
Farmacocinética
celecoxib apresenta aumento proporcional à dose na exposição após administração oral de até 200 mg duas vezes ao dia e aumento menos do que proporcional em doses mais altas. Possui ampla distribuição e alta ligação protéica. É metabolizado principalmente pelo CYP2C9 com meia-vida de aproximadamente 11 horas.
Absorção
Os níveis plasmáticos máximos de celecoxib ocorrem aproximadamente 3 horas após uma dose oral. Em condições de jejum, tanto os níveis plasmáticos de pico (Cmax) quanto a área sob a curva (AUC) são aproximadamente proporcionais à dose até 200 mg duas vezes ao dia; em doses mais altas há aumentos menos do que proporcionais na Cmax e AUC (ver Efeitos dos alimentos ). Não foram realizados estudos de biodisponibilidade absoluta. Com doses múltiplas, as condições de estado de equilíbrio são alcançadas no dia 5 ou antes. Os parâmetros farmacocinéticos do celecoxib em um grupo de indivíduos saudáveis são mostrados na Tabela 4.
Efeitos dos alimentos
Quando as cápsulas de CELEBREX 200 mg foram tomadas com uma refeição rica em gordura, os níveis plasmáticos de pico foram retardados por cerca de 1 a 2 horas com um aumento na absorção total (AUC) de 10% a 20%. Em condições de jejum, em doses acima de 200 mg, há um aumento menor do que proporcional na Cmax e na AUC, o que se acredita ser devido à baixa solubilidade do fármaco em meio aquoso.
A coadministração de CELEBREX com antiácidos contendo alumínio e magnésio resultou em uma redução nas concentrações plasmáticas de celecoxibe com uma diminuição de 37% na Cmax e 10% na AUC. CELEBREX, em doses de até 200 mg duas vezes ao dia, pode ser administrado independentemente do horário das refeições. Doses mais altas (400 mg duas vezes ao dia) devem ser administradas com alimentos para melhorar a absorção.
Em voluntários adultos saudáveis, a exposição sistêmica global (AUC) do celecoxib foi equivalente quando o celecoxib foi administrado como cápsula intacta ou conteúdo da cápsula polvilhado em compota de maçã. Não houve alterações significativas na Cmax, Tmax ou t½ após a administração do conteúdo das cápsulas em compota de maçã [ver DOSAGEM E ADMINISTRAÇÃO ].
Distribuição
Em indivíduos saudáveis, o celecoxib é altamente ligado às proteínas (~97%) dentro do intervalo de dose clínica. Estudos in vitro indicam que o celecoxib se liga principalmente à albumina e, em menor extensão, à α-glicoproteína ácida. O volume aparente de distribuição no estado estacionário (V/F) é de aproximadamente 400 L, sugerindo distribuição extensa nos tecidos. O celecoxib não se liga preferencialmente aos glóbulos vermelhos.
Eliminação
Metabolismo
O metabolismo do celecoxib é mediado principalmente pelo CYP2C9. Três metabólitos, um álcool primário, o ácido carboxílico correspondente e seu conjugado glicuronídeo, foram identificados no plasma humano. Esses metabólitos são inativos como inibidores de COX-1 ou COX-2.
Excreção
celecoxib é eliminado predominantemente por metabolismo hepático com pouca (
Populações Específicas
Geriátrico
No estado de equilíbrio, os indivíduos idosos (com mais de 65 anos) apresentaram uma Cmax 40% mais alta e uma AUC 50% mais alta em comparação com os indivíduos jovens. Em mulheres idosas, a Cmax e AUC do celecoxib são mais elevadas do que as dos homens idosos, mas estes aumentos são predominantemente devidos ao menor peso corporal nas mulheres idosas. O ajuste de dose em idosos geralmente não é necessário. No entanto, para pacientes com peso corporal inferior a 50 kg, inicie a terapia com a dose mais baixa recomendada [ver Uso em populações específicas ].
Pediátrico
farmacocinética no estado de equilíbrio do celecoxibe administrado como suspensão oral experimental foi avaliada em 152 pacientes com ARJ de 2 anos a 17 anos de idade com peso ≥10 kg com ARJ de curso pauciarticular ou poliarticular e em pacientes com ARJ de início sistêmico. A análise farmacocinética da população indicou que a depuração oral (não ajustada para o peso corporal) do celecoxib aumenta menos do que proporcionalmente ao aumento do peso, com previsão de pacientes com 10 kg e 25 kg terem uma depuração 40% e 24% menor, respectivamente, em comparação com um AR adulto de 70 kg paciente.
A administração de cápsulas de 50 mg duas vezes ao dia em pacientes com ARJ com peso ≥12 a ≤25 kg e cápsulas de 100 mg em pacientes com ARJ com peso >25 kg deve atingir concentrações plasmáticas semelhantes às observadas em um ensaio clínico que demonstrou a não inferioridade do celecoxibe em relação naproxeno 7,5 mg/kg duas vezes ao dia [ ver DOSAGEM E ADMINISTRAÇÃO ]. O celecoxib não foi estudado em doentes com ARJ com idade inferior a 2 anos, em doentes com peso corporal inferior a 10 kg (22 lbs) ou superior a 24 semanas.
Corrida
A meta-análise de estudos farmacocinéticos sugeriu uma AUC de celecoxib aproximadamente 40% mais alta em negros em comparação com caucasianos. A causa e o significado clínico deste achado são desconhecidos.
Insuficiência hepática
Um estudo farmacocinético em indivíduos com insuficiência hepática leve (Child-Pugh Classe A) e moderada (Child-Pugh Classe B) mostrou que a AUC do celecoxibe no estado de equilíbrio aumenta cerca de 40% e 180%, respectivamente, acima do observado no controle saudável assuntos. Portanto, a dose diária recomendada de CELEBREX cápsulas deve ser reduzida em aproximadamente 50% em pacientes com insuficiência hepática moderada (Classe B de Child-Pugh). Pacientes com insuficiência hepática grave (Child-Pugh Classe C) não foram estudados. O uso de CELEBREX em pacientes com insuficiência hepática grave não é recomendado [ver DOSAGEM E ADMINISTRAÇÃO e Uso em populações específicas ].
Insuficiência renal
Em uma comparação entre estudos, a AUC do celecoxibe foi aproximadamente 40% menor em pacientes com insuficiência renal crônica (TFG35-60 mL/min) do que a observada em indivíduos com função renal normal. Nenhuma relação significativa foi encontrada entre a TFG e a depuração do celecoxib. Pacientes com insuficiência renal grave não foram estudados. Semelhante a outros AINEs, CELEBREX 200mg não é recomendado em pacientes com insuficiência renal grave [ver AVISOS E PRECAUÇÕES ].
Estudos de interação medicamentosa
Estudos in vitro indicam que o celecoxib não é um inibidor do citocromo P450 2C9, 2C19 ou 3A4.
Estudos in vivo mostraram o seguinte:
Aspirina
Quando os AINEs foram administrados com aspirina, a ligação proteica dos AINEs foi reduzida, embora a depuração do AINE livre não tenha sido alterada. O significado clínico desta interação não é conhecido. Consulte a Tabela 3 para interações medicamentosas clinicamente significativas de AINEs com aspirina [ver INTERAÇÕES MEDICAMENTOSAS ].
Lítio
Em um estudo realizado em indivíduos saudáveis, os níveis plasmáticos médios de lítio no estado de equilíbrio aumentaram aproximadamente 17% em indivíduos que receberam 450 mg de lítio duas vezes ao dia com CELEBREX 200 mg duas vezes ao dia em comparação com indivíduos que receberam apenas lítio [ver INTERAÇÕES MEDICAMENTOSAS ].
Fluconazol
A administração concomitante de fluconazol na dose de 200 mg uma vez ao dia resultou em um aumento de duas vezes na concentração plasmática de celecoxibe. Este aumento é devido à inibição do metabolismo do celecoxib via P450 2C9 pelo fluconazol [ver INTERAÇÕES MEDICAMENTOSAS ].
Outras drogas
Os efeitos do celecoxib na farmacocinética e/ou farmacodinâmica da gliburida, cetoconazol, [ver INTERAÇÕES MEDICAMENTOSAS ], fenitoína e tolbutamida foram estudados in vivo e interações clinicamente importantes não foram encontradas.
Farmacogenômica
atividade do CYP2C9 é reduzida em indivíduos com polimorfismos genéticos que levam à redução da atividade enzimática, como aqueles homozigotos para os polimorfismos CYP2C9*2 e CYP2C9*3. Dados limitados de 4 relatórios publicados que incluíram um total de 8 indivíduos com o genótipo homozigoto CYP2C9*3/*3 mostraram níveis sistêmicos de celecoxib que eram 3 a 7 vezes maiores nesses indivíduos em comparação com indivíduos com CYP2C9*1/*1 ou * I/*3 genótipos. A farmacocinética do celecoxib não foi avaliada em indivíduos com outros polimorfismos do CYP2C9, como *2, *5, *6, *9 e *11. Estima-se que a frequência do genótipo homozigoto *3/*3 seja de 0,3% a 1,0% em vários grupos étnicos [ver DOSAGEM E ADMINISTRAÇÃO , Uso em populações específicas ].
Toxicologia Animal
Um aumento na incidência de achados de fundo de espermatocele com ou sem alterações secundárias, tais como póspermia epididimal, bem como dilatação mínima a leve dos túbulos seminíferos foi observado no rato jovem. Esses achados reprodutivos, embora aparentemente relacionados ao tratamento, não aumentaram em incidência ou gravidade com a dose e podem indicar uma exacerbação de uma condição espontânea. Não foram observados achados reprodutivos semelhantes em estudos com cães jovens ou adultos ou em ratos adultos tratados com celecoxibe. O significado clínico desta observação é desconhecido.
Estudos clínicos
Osteoartrite
CELEBREX 200mg demonstrou redução significativa na dor nas articulações em comparação com placebo. CELEBREX foi avaliado para o tratamento dos sinais e sintomas da OA do joelho e quadril em ensaios clínicos controlados por placebo e ativo de até 12 semanas de duração. Em pacientes com OA, o tratamento com CELEBREX 100 mg duas vezes ao dia ou 200 mg uma vez ao dia resultou em melhora no índice de osteoartrite WOMAC (Western Ontario and McMaster Universities), um composto de dor, rigidez e medidas funcionais na OA. Em três estudos de 12 semanas de dor que acompanha o surto de OA, doses de 100 mg de CELEBREX de 100 mg duas vezes ao dia e 200 mg duas vezes ao dia proporcionaram redução significativa da dor dentro de 24 a 48 horas após o início da dosagem. Em doses de 100 mg duas vezes ao dia ou 200 mg duas vezes ao dia, a eficácia de CELEBREX 200 mg mostrou ser semelhante à de naproxeno 500 mg duas vezes ao dia. Doses de 200 mg duas vezes ao dia não proporcionaram benefício adicional acima do observado com 100 mg duas vezes ao dia. Uma dose diária total de 200 mg demonstrou ser igualmente eficaz se administrada como 100 mg duas vezes ao dia ou 200 mg uma vez ao dia.
Artrite reumatoide
CELEBREX demonstrou redução significativa na sensibilidade/dor nas articulações e inchaço nas articulações em comparação com placebo. CELEBREX 100mg foi avaliado para o tratamento dos sinais e sintomas da AR em ensaios clínicos controlados por placebo e ativo de até 24 semanas de duração. CELEBREX mostrou-se superior ao placebo nesses estudos, usando o Índice de Resposta ACR20, um composto de medidas clínicas, laboratoriais e funcionais na AR. As doses de CELEBREX de 100 mg duas vezes ao dia e 200 mg duas vezes ao dia foram semelhantes em eficácia e ambas foram comparáveis ao naproxeno 500 mg duas vezes ao dia.
Embora CELEBREX 100 mg duas vezes ao dia e 200 mg duas vezes ao dia tenham apresentado eficácia global semelhante, alguns pacientes obtiveram benefícios adicionais com a dose de 200 mg duas vezes ao dia. Doses de 400 mg duas vezes ao dia não proporcionaram benefício adicional acima do observado com 100 mg a 200 mg duas vezes ao dia.
Artrite Reumatóide Juvenil (NCT00652925)
Em um estudo de 12 semanas, randomizado, duplo-cego, controlado por ativo, de grupos paralelos, multicêntrico, de não inferioridade, pacientes de 2 a 17 anos de idade com ARJ pauciarticular, poliarticular ou ARJ de início sistêmico (com características sistêmicas atualmente inativas ), receberam um dos seguintes tratamentos: celecoxib 3 mg/kg (até um máximo de 150 mg) duas vezes ao dia; celecoxib 6mg/kg (até um máximo de 300mg) duas vezes ao dia; ou naproxeno 7,5 mg/kg (até um máximo de 500 mg) duas vezes ao dia. As taxas de resposta foram baseadas no critério JRA Definition of Improvement maior ou igual a 30% (JRA DOI 30), que é um composto de medidas clínicas, laboratoriais e funcionais de JRA. As taxas de resposta JRA DOI 30 na semana 12 foram de 69%, 80% e 67% nos grupos de tratamento com celecoxib 3 mg/kg duas vezes ao dia, celecoxib 6 mg/kg duas vezes ao dia e naproxeno 7,5 mg/kg duas vezes ao dia, respectivamente.
eficácia e segurança de CELEBREX 100mg para ARJ não foram estudadas além de seis meses. A toxicidade cardiovascular a longo prazo em crianças expostas a CELEBREX 200mg não foi avaliada e não se sabe se o risco a longo prazo pode ser semelhante ao observado em adultos expostos a CELEBREX 100mg ou outros AINEs seletivos e não seletivos de COX-2 [ Vejo AVISO EM CAIXA , AVISOS E PRECAUÇÕES ].
Espondilite anquilosante
CELEBREX foi avaliado em pacientes com EA em dois ensaios clínicos controlados por placebo e ativo de 6 e 12 semanas de duração. CELEBREX em doses de 100 mg duas vezes ao dia, 200 mg uma vez ao dia e 400 mg uma vez ao dia mostrou-se estatisticamente superior ao placebo nestes estudos para todas as três medidas de eficácia co-primária que avaliam a intensidade global da dor (Escala Visual Analógica), atividade global da doença (Escala Visual Analógica) e comprometimento funcional (Índice Funcional da Espondilite Anquilosante de Banho). No estudo de 12 semanas, não houve diferença na extensão da melhora entre as doses de 200 mg e 400 mg de CELEBREX 200 mg em comparação com a alteração média da linha de base, mas houve uma porcentagem maior de pacientes que responderam a CELEBREX 400 mg, 53 %, do que para CELEBREX 200 mg, 44%, usando os critérios de resposta de Avaliação em Espondilite Anquilosante (ASAS20). A ASAS 20 define um respondedor como uma melhora da linha de base de pelo menos 20% e uma melhora absoluta de pelo menos 10 mm, em uma escala de 0 mm a 100 mm, em pelo menos três dos quatro domínios a seguir: dor global do paciente, espondilite anquilosante de banho Índice funcional e inflamação. A análise de resposta também não demonstrou alteração nas taxas de resposta além de 6 semanas.
Analgesia, incluindo dismenorreia primária
Em modelos analgésicos agudos de dor pós-cirurgia oral, dor pós-cirúrgica ortopédica e dismenorreia primária, CELEBREX 100mg aliviou a dor que foi classificada pelos pacientes como moderada a grave. Doses únicas [ver DOSAGEM E ADMINISTRAÇÃO ] de CELEBREX 200mg proporcionou alívio da dor em 60 minutos.
Ensaio de Resultados Cardiovasculares: Avaliação Prospectiva Randomizada da Segurança Integrada do Celecoxibe vs. Ibuprofeno ou Naproxeno (PRECISION; NCT00346216)
Projeto
O estudo PRECISION foi um estudo duplo-cego randomizado controlado de segurança cardiovascular em pacientes com OA e AR com ou em alto risco de doença cardiovascular comparando celecoxib com naproxeno e ibuprofeno. Os pacientes foram randomizados para uma dose inicial de 100 mg duas vezes ao dia de celecoxib, 600 mg três vezes ao dia de ibuprofeno ou 375 mg duas vezes ao dia de naproxeno, com a opção de aumentar a dose conforme necessário para o controle da dor. Com base nas doses rotuladas, os pacientes com OA randomizados para celecoxib não puderam aumentar a dose.
endpoint primário, os Antiplatelet Trialists' Collaboration (APTC) foi um composto julgado independentemente de morte cardiovascular (incluindo morte hemorrágica), infarto do miocárdio não fatal e acidente vascular cerebral não fatal com poder de 80% para avaliar a não inferioridade. Todos os pacientes receberam prescrição de esomeprazol em rótulo aberto (20-40 mg) para proteção gastro. A randomização do tratamento foi estratificada pelo uso basal de aspirina em baixa dose.
Além disso, houve um subestudo de 4 meses avaliando os efeitos dos três medicamentos na pressão arterial medida por monitoramento ambulatorial.
Resultados
Entre os indivíduos com OA, apenas 0,2% (17/7259) escalou o celecoxib para a dose de 200 mg duas vezes ao dia, enquanto 54,7% (3946/7208) escalou o ibuprofeno para 800 mg três vezes ao dia e 54,8% (3937/7178) escalou o naproxeno para a dose de 500 mg duas vezes ao dia. Entre os indivíduos com AR, 55,7% (453/813) aumentaram o celecoxib para a dose de 200 mg duas vezes ao dia, 56,5% (470/832) aumentaram o ibuprofeno para 800 mg três vezes ao dia e 54,6% (432/791) aumentaram o naproxeno para a dose dose de 500 mg duas vezes ao dia; no entanto, a população com AR representou apenas 10% da população do estudo.
Como relativamente poucos pacientes com celecoxibe em geral (5,8% [470/8072]) aumentaram a dose para 200 mg duas vezes ao dia, os resultados do estudo PRECISION não são adequados para determinar a segurança CV relativa do celecoxibe na dose de 200 mg duas vezes ao dia em comparação com ibuprofeno e naproxeno nas doses tomadas.
Endpoint principal
O estudo teve duas populações de análise pré-especificadas:
- População com intenção de tratar (ITT): Composto por todos os indivíduos randomizados seguidos por um máximo de 30 meses
- População com intenção de tratar modificada (mITT): Composto por todos os indivíduos randomizados que receberam pelo menos uma dose da medicação do estudo e tiveram pelo menos uma visita pós-inicial seguida até a descontinuação do tratamento mais cedo mais 30 dias ou 43 meses
O celecoxibe, na dose de 100 mg duas vezes ao dia, em comparação com naproxeno ou ibuprofeno nas doses tomadas, atendeu a todos os quatro critérios de não inferioridade pré-especificados (p
Os resultados da análise primária para ITT e mITT estão descritos na Tabela 5.
Na população de análise ITT até 30 meses, a mortalidade por todas as causas foi de 1,6% no grupo celecoxib, 1,8% no grupo ibuprofeno e 2,0% no grupo naproxeno.
Subestudo de Monitorização Ambulatorial da Pressão Arterial (MAPA)
No subestudo PRECISION-ABPM, entre o total de 444 pacientes analisáveis no mês 4, o celecoxibe administrado em 100 mg duas vezes ao dia diminuiu a pressão arterial sistólica média de 24 horas (PAS) em 0,3 mmHg, enquanto o ibuprofeno e o naproxeno nas doses tomadas aumentaram PAS média de 24 horas em 3,7 e 1,6 mmHg, respectivamente. Essas alterações resultaram em uma diferença estatisticamente significativa e clinicamente significativa de 3,9 mmHg (p=0,0009) entre celecoxib e ibuprofeno e uma diferença não estatisticamente significativa de 1,8 (p=0,119) mmHg entre celecoxib e naproxeno.
Estudos Especiais
Estudos de prevenção de pólipos adenomatosos (NCT00005094 e NCT00141193)
segurança cardiovascular foi avaliada em dois estudos randomizados, duplo-cegos, controlados por placebo, de três anos envolvendo pacientes com pólipos adenomatosos esporádicos tratados com CELEBREX: o estudo APC (Adenoma Prevention with Celecoxib) e o estudo PreSAP (Prevention of Spontaneous Adenomatos Polyps) . No estudo APC, houve um aumento relacionado à dose no desfecho composto (julgado) de morte cardiovascular, infarto do miocárdio ou acidente vascular cerebral com celecoxibe em comparação com placebo ao longo de 3 anos de tratamento. O estudo PreSAP não demonstrou um risco aumentado estatisticamente significativo para o mesmo desfecho composto (julgado):
- No estudo APC, as taxas de risco comparadas ao placebo para um desfecho composto (julgado) de morte cardiovascular, infarto do miocárdio ou acidente vascular cerebral foram 3,4 (IC 95% 1,4 – 8,5) com celecoxibe 400 mg duas vezes ao dia e 2,8 (95% IC 1.1 – 7.2) com celecoxib 200 mg duas vezes ao dia. As taxas cumulativas para este desfecho composto ao longo de 3 anos foram de 3,0% (20/671 indivíduos) e 2,5% (17/685 indivíduos), respectivamente, em comparação com 0,9% (6/679 indivíduos) com tratamento com placebo. Os aumentos em ambos os grupos de dose de celecoxib versus pacientes tratados com placebo foram principalmente devido a um aumento na incidência de infarto do miocárdio.
- No estudo PreSAP, a razão de risco para este mesmo desfecho composto (ajuizado) foi de 1,2 (IC 95% 0,6 – 2,4) com celecoxibe 400 mg uma vez ao dia em comparação com placebo. As taxas cumulativas para este desfecho composto ao longo de 3 anos foram de 2,3% (21/933 indivíduos) e 1,9% (12/628 indivíduos), respectivamente.
Ensaios clínicos de outros AINEs seletivos e não seletivos de COX-2 com duração de até três anos mostraram um risco aumentado de eventos trombóticos cardiovasculares graves, infarto do miocárdio e acidente vascular cerebral, que podem ser fatais. Como resultado, todos os AINEs são considerados potencialmente associados a esse risco.
Estudo de Segurança de Artrite de Longo Prazo com Celecoxibe (CLASS)
Este foi um estudo prospectivo, de longo prazo, de resultados de segurança realizado pós-comercialização em aproximadamente 5.800 pacientes com OA e 2.200 pacientes com AR. Os pacientes receberam CELEBREX 400 mg duas vezes ao dia (4 vezes e 2 vezes as doses recomendadas de OA e AR, respectivamente), ibuprofeno 800 mg três vezes ao dia ou diclofenaco 75 mg duas vezes ao dia (doses terapêuticas comuns). As exposições medianas para CELEBREX (n = 3.987) e diclofenaco (n = 1.996) foram de 9 meses, enquanto o ibuprofeno (n = 1.985) foi de 6 meses. O desfecho primário deste estudo de desfecho foi a incidência de úlceras complicadas (sangramento gastrointestinal, perfuração ou obstrução). Os pacientes foram autorizados a tomar aspirina (AAS) concomitante em dose baixa (≤ 325 mg/dia) para profilaxia cardiovascular (subgrupos AAS: CELEBREX, n = 882; diclofenaco, n = 445; ibuprofeno, n = 412). As diferenças na incidência de úlceras complicadas entre CELEBREX 200mg e o grupo combinado de ibuprofeno e diclofenaco não foram estatisticamente significativas.
Os pacientes que receberam CELEBREX e AAS em baixas doses concomitantes (N = 882) apresentaram taxas 4 vezes maiores de úlceras complicadas em comparação com aqueles que não receberam AAS (N = 3105). A taxa de Kaplan-Meier para úlceras complicadas em 9 meses foi de 1,12% versus 0,32% para aqueles em baixa dose de AAS e aqueles que não receberam AAS, respectivamente [ver AVISOS E PRECAUÇÕES ].
As taxas cumulativas estimadas em 9 meses de úlceras complicadas e sintomáticas para pacientes tratados com CELEBREX 400mg duas vezes ao dia estão descritas na Tabela 7. A Tabela 7 também apresenta resultados para pacientes com idade inferior ou superior a 65 anos. A diferença nas taxas entre os grupos CELEBREX 200mg sozinho e CELEBREX 100mg com AAS pode ser devido ao maior risco de eventos gastrointestinais em usuários de AAS.
Em um pequeno número de pacientes com história de doença ulcerosa, as taxas de úlcera complicada e sintomática em pacientes tomando CELEBREX 100mg isolado ou CELEBREX 100mg com AAS foram, respectivamente, 2,56% (n=243) e 6,85% (n=91) em 48 semanas. Esses resultados são esperados em pacientes com história prévia de doença ulcerosa [ver AVISOS E PRECAUÇÕES e REAÇÕES ADVERSAS ].
Os resultados de segurança cardiovascular também foram avaliados no estudo CLASS. As taxas cumulativas de Kaplan-Meier para eventos adversos tromboembólicos cardiovasculares graves relatados pelo investigador (incluindo infarto do miocárdio, embolia pulmonar, trombose venosa profunda, angina instável, ataques isquêmicos transitórios e acidentes cerebrovasculares isquêmicos) não demonstraram diferenças entre o tratamento com CELEBREX 200mg, diclofenaco ou ibuprofeno grupos. As taxas cumulativas em todos os pacientes em nove meses para CELEBREX, diclofenaco e ibuprofeno foram 1,2%, 1,4% e 1,1%, respectivamente. As taxas cumulativas em usuários não-ASA em nove meses em cada um dos três grupos de tratamento foram inferiores a 1%. As taxas cumulativas de infarto do miocárdio em não usuários de AAS aos nove meses em cada um dos três grupos de tratamento foram inferiores a 0,2%. Não houve grupo placebo no estudo CLASS, o que limita a capacidade de determinar se os três medicamentos testados não aumentaram o risco de eventos CV ou se todos aumentaram o risco em um grau semelhante. No estudo CLASS, as taxas cumulativas de Kaplan-Meier em 9 meses de edema periférico em pacientes recebendo CELEBREX 400 mg duas vezes ao dia (4 vezes e 2 vezes as doses recomendadas de OA e AR, respectivamente), ibuprofeno 800 mg três vezes ao dia e diclofenaco 75 mg duas vezes ao dia foram de 4,5%, 6,9% e 4,7%, respectivamente. As taxas de hipertensão do estudo CLASS nos pacientes tratados com CELEBREX, ibuprofeno e diclofenaco foram de 2,4%, 4,2% e 2,5%, respectivamente.
Estudos endoscópicos
A correlação entre os achados de estudos endoscópicos de curto prazo com CELEBREX e a incidência relativa de eventos GI superiores graves clinicamente significativos com uso de longo prazo não foi estabelecida. Hemorragia digestiva alta clinicamente significativa foi observada em pacientes que receberam CELEBREX 100mg em estudos controlados e abertos [ver AVISOS E PRECAUÇÕES e Estudos clínicos ].
Um estudo randomizado, duplo-cego em 430 pacientes com AR foi realizado no qual um exame endoscópico foi realizado aos 6 meses. A incidência de úlceras endoscópicas em pacientes tomando CELEBREX 200 mg duas vezes ao dia foi de 4% vs. 15% para pacientes tomando diclofenaco SR 75 mg duas vezes ao dia. No entanto, CELEBREX não foi estatisticamente diferente do diclofenaco para desfechos gastrointestinais clinicamente relevantes no estudo CLASS [ver Estudos clínicos ].
incidência de úlceras endoscópicas foi estudada em dois estudos de 12 semanas, controlados com placebo, em 2.157 pacientes com OA e AR, nos quais as endoscopias iniciais não revelaram úlceras. Não houve relação de dose para a incidência de úlceras gastro duodenais e a dose de CELEBREX (50 mg a 400 mg duas vezes ao dia). A incidência para naproxeno 500 mg duas vezes ao dia foi de 16,2% e 17,6% nos dois estudos, para placebo foi de 2,0% e 2,3%, e para todas as doses de CELEBREX a incidência variou entre 2,7%–5,9%. Não houve grandes estudos de resultados clínicos para comparar resultados gastrointestinais clinicamente relevantes com CELEBREX e naproxeno.
Nos estudos endoscópicos, aproximadamente 11% dos pacientes estavam tomando aspirina (≤ 325 mg/dia). Nos grupos CELEBREX, a taxa de úlcera endoscópica pareceu ser maior em usuários de aspirina do que em não usuários. No entanto, a taxa aumentada de úlceras nesses usuários de aspirina foi menor do que as taxas de úlcera endoscópica observadas nos grupos comparadores ativos, com ou sem aspirina.
INFORMAÇÃO DO PACIENTE
Guia de Medicação para Anti-inflamatórios Não Esteroides (AINEs)
Qual é a informação mais importante que devo saber sobre medicamentos chamados Anti-inflamatórios Não Esteroides (AINEs)?
Os AINEs podem causar efeitos colaterais graves, incluindo:
- Aumento do risco de ataque cardíaco ou acidente vascular cerebral que pode levar à morte. Este risco pode ocorrer no início do tratamento e pode aumentar:
- com doses crescentes de AINEs
- com uso mais prolongado de AINEs
Não tome AINEs antes ou depois de uma cirurgia cardíaca chamada “enxerto de revascularização do miocárdio (CRM)”. Evite tomar AINEs após um ataque cardíaco recente, a menos que seu médico lhe diga. Você pode ter um risco aumentado de outro ataque cardíaco se tomar AINEs após um ataque cardíaco recente.
- Aumento do risco de sangramento, úlceras e lágrimas (perfuração) do esôfago (tubo que vai da boca ao estômago), estômago e intestinos:
- a qualquer momento durante o uso
- sem sintomas de alerta
- que pode causar a morte
- risco de ter uma úlcera ou sangramento aumenta com:
- história pregressa de úlceras estomacais ou sangramento estomacal ou intestinal com uso de AINEs
- tomar medicamentos chamados “corticosteróides”, “medicamentos antiplaquetários”, “anticoagulantes”, “SSRIs” ou “SNRIs”
- doses crescentes de AINEs
- uso mais prolongado de AINEs
- fumar
- beber álcool
- idoso
- saúde debilitada
- doença hepática avançada
- problemas de sangramento
- Os AINEs só devem ser usados:
- exatamente como prescrito
- na dose mais baixa possível para o seu tratamento
- pelo menor tempo necessário
O que são AINEs?
Os AINEs são usados para tratar dor e vermelhidão, inchaço e calor (inflamação) de condições médicas, como diferentes tipos de artrite, cólicas menstruais e outros tipos de dor de curto prazo.
Quem não deve tomar AINEs?
Não tome AINEs:
- se você teve um ataque de asma, urticária ou outra reação alérgica com aspirina ou qualquer outro AINE.
- imediatamente antes ou após a cirurgia de bypass cardíaco.
Antes de tomar AINEs, informe o seu médico sobre todas as suas condições médicas, incluindo se você:
- tem problemas de fígado ou rins
- tem pressão alta
- tem asma
- estão grávidas ou planejam engravidar. Tomar AINEs com cerca de 20 semanas de gravidez ou mais tarde pode prejudicar o feto. Se você precisar tomar AINEs por mais de 2 dias quando estiver entre 20 e 30 semanas de gravidez, seu médico pode precisar monitorar a quantidade de líquido no útero ao redor do bebê. Você não deve tomar AINEs após cerca de 30 semanas de gravidez
- está amamentando ou planeja amamentar.
Informe o seu médico sobre todos os medicamentos que você toma, incluindo medicamentos prescritos ou de venda livre, vitaminas ou suplementos de ervas. Os AINEs e alguns outros medicamentos podem interagir entre si e causar efeitos colaterais graves. Não comece a tomar nenhum medicamento novo sem falar primeiro com o seu médico.
Quais são os possíveis efeitos colaterais dos AINEs?
Os AINEs podem causar efeitos colaterais graves, incluindo:
Consulte “ Quais são as informações mais importantes que devo saber sobre medicamentos chamados Anti-inflamatórios Não Esteroides (AINEs) ?
- pressão alta nova ou pior
- insuficiência cardíaca
- problemas hepáticos, incluindo insuficiência hepática
- problemas renais, incluindo insuficiência renal
- glóbulos vermelhos baixos (anemia)
- reações cutâneas com risco de vida
- reações alérgicas com risco de vida
Outros efeitos colaterais dos AINEs incluem: dor de estômago, constipação, diarréia, gases, azia, náusea, vômito e tontura.
Obtenha ajuda de emergência imediatamente se tiver algum dos seguintes sintomas:
- falta de ar ou dificuldade para respirar
- dor no peito
- fraqueza em uma parte ou lado do seu corpo
- fala arrastada
- inchaço do rosto ou garganta
Pare de tomar seu AINE e ligue para seu médico imediatamente se tiver algum dos seguintes sintomas:
- náusea
- mais cansado ou mais fraco do que o habitual
- diarréia
- coceira
- sua pele ou olhos parecem amarelos
- indigestão ou dor de estômago
- sintomas como os da gripe
- vômito de sangue
- há sangue em seu movimento intestinal ou é preto e pegajoso como alcatrão
- ganho de peso incomum
- erupção cutânea ou bolhas com febre
- inchaço dos braços, pernas, mãos e pés
Se você tomar muito do seu AINE, ligue para o seu médico ou procure ajuda médica imediatamente.
Estes não são todos os possíveis efeitos colaterais dos AINEs. Para obter mais informações, pergunte ao seu médico ou farmacêutico sobre AINEs.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
Outras informações sobre AINEs
- A aspirina é um AINE, mas não aumenta a chance de ataque cardíaco. A aspirina pode causar sangramento no cérebro, estômago e intestinos. A aspirina também pode causar úlceras no estômago e nos intestinos.
- Alguns AINEs são vendidos em doses mais baixas sem receita médica (sem receita). Converse com seu médico antes de usar AINEs de venda livre por mais de 10 dias.
Informações gerais sobre o uso seguro e eficaz de AINEs
Os medicamentos às vezes são prescritos para outros fins que não os listados em um Guia de Medicamentos. Não use AINEs para uma condição para a qual não foi prescrito. Não dê AINEs a outras pessoas, mesmo que tenham os mesmos sintomas que você. Pode prejudicá-los.
Se você quiser mais informações sobre AINEs, fale com seu médico. Você pode pedir ao seu farmacêutico ou profissional de saúde informações sobre AINEs escritas para profissionais de saúde.
Este Guia de Medicação foi aprovado pela Food and Drug Administration dos EUA.
