Tratamento da Doenças Femininas: Clomid 100mg, 25mg, 50mg Clomiphene Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Clomid 50mg e como é usado?
Clomid 100mg é um medicamento de prescrição usado para tratar os sintomas de infertilidade em mulheres que têm insuficiência ovulatória. Clomid pode ser usado sozinho ou com outros medicamentos.
Clomid pertence a uma classe de medicamentos chamados Moduladores Seletivos do Receptor de Estrogênio.
Não se sabe se Clomid é seguro e eficaz em crianças.
Quais são os possíveis efeitos colaterais do Clomid?
Clomid pode causar efeitos colaterais graves, incluindo:
- dor de estômago,
- inchaço,
- náusea,
- vômito,
- diarréia,
- ganho de peso rápido (especialmente em seu rosto e barriga),
- pouca ou nenhuma micção,
- dor ao respirar,
- batimentos cardíacos acelerados e
- falta de ar
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Clomid incluem:
- rubor (calor, vermelhidão ou sensação de formigamento),
- náusea,
- vômito,
- inchaço,
- dor ou sensibilidade mamária,
- dor de cabeça, e
- sangramento de escape ou spotting
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Clomid. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
DESCRIÇÃO
CLOMID (comprimidos de citrato de clomifeno USP) é um estimulante ovulatório não esteróide administrado por via oral, designado quimicamente como citrato de 2-[p-(2-cloro-1,2-difenilvinil)fenoxi] trietilamina (1:1). Tem a fórmula molecular de C26H28ClNO • C6H8O7 e um peso molecular de 598,09. É representado estruturalmente como:
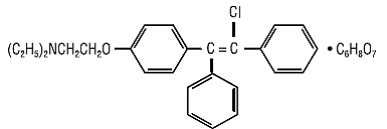
O citrato de clomifeno é um pó cristalino branco a amarelo pálido, essencialmente inodoro. É livremente solúvel em metanol; solúvel em etanol; ligeiramente solúvel em acetona, água e clorofórmio; e insolúvel em éter.
CLOMID 50mg é uma mistura de dois isômeros geométricos [cis (zuclomifeno) e trans (enclomifeno)] contendo entre 30% e 50% do isômero cis.
Cada comprimido branco contém 50 mg de citrato de clomifeno USP. O comprimido também contém os seguintes ingredientes inativos: amido de milho, lactose, estearato de magnésio, amido de milho pré-gelatinizado e sacarose.
INDICAÇÕES
CLOMID 100mg é indicado para o tratamento da disfunção ovulatória em mulheres que desejam engravidar. Os impedimentos à gravidez devem ser excluídos ou tratados adequadamente antes de iniciar a terapia com CLOMID 50mg. Os pacientes com maior probabilidade de obter sucesso com a terapia com clomifeno incluem pacientes com síndrome dos ovários policísticos (ver AVISOS : Síndrome de hiperestimulação ovariana ), síndrome de amenorreia-galactorreia, amenorreia psicogênica, amenorreia pós-contraceptiva oral e alguns casos de amenorreia secundária de etiologia indeterminada.
coito corretamente cronometrado em relação à ovulação é importante. Um gráfico de temperatura corporal basal ou outros testes apropriados podem ajudar a paciente e seu médico a determinar se ocorreu a ovulação. Uma vez que a ovulação tenha sido estabelecida, cada ciclo de CLOMID 100mg deve ser iniciado no 5º dia do ciclo ou por volta dele. A terapia cíclica de longo prazo não é recomendada além de um total de cerca de seis ciclos (incluindo três ciclos ovulatórios). (Ver DOSAGEM E ADMINISTRAÇÃO e PRECAUÇÕES .)
CLOMID é indicado apenas em pacientes com disfunção ovulatória demonstrada que preencham as condições descritas abaixo:
Além disso, os pacientes selecionados para a terapia com CLOMID devem ser avaliados em relação ao seguinte:
Não existem estudos adequados ou bem controlados que demonstrem a eficácia de CLOMID 100mg no tratamento da infertilidade masculina. Além disso, tumores testiculares e ginecomastia foram relatados em homens usando clomifeno. A relação de causa e efeito entre relatos de tumores testiculares e a administração de CLOMID 25mg não é conhecida.
Embora a literatura médica sugira vários métodos, não existe um regime padrão universalmente aceito para terapia combinada (ou seja, CLOMID em conjunto com outros medicamentos indutores de ovulação). Da mesma forma, não existe um regime CLOMID padrão para indução da ovulação em programas de fertilização in vitro para produzir óvulos para fertilização e reintrodução. Portanto, CLOMID 50mg não é recomendado para esses usos.
DOSAGEM E ADMINISTRAÇÃO
considerações gerais
A avaliação e o tratamento de candidatos à terapia com CLOMID 100mg devem ser supervisionados por médicos experientes no tratamento de distúrbios ginecológicos ou endócrinos. Os pacientes devem ser escolhidos para terapia com CLOMID 50mg somente após cuidadosa avaliação diagnóstica (ver INDICAÇÕES ). O plano de terapia deve ser delineado com antecedência. Impedimentos para atingir o objetivo da terapia devem ser excluídos ou tratados adequadamente antes de iniciar CLOMID. O objetivo terapêutico deve ser equilibrado com os riscos potenciais e discutido com a paciente e outras pessoas envolvidas na obtenção de uma gravidez.
ovulação ocorre mais frequentemente de 5 a 10 dias após um curso de CLOMID. O coito deve ser cronometrado para coincidir com o momento esperado da ovulação. Testes apropriados para determinar a ovulação podem ser úteis durante esse período.
Dosagem recomendada
O tratamento do paciente selecionado deve começar com uma dose baixa, 50 mg ao dia (1 comprimido) por 5 dias. A dose deve ser aumentada apenas naquelas pacientes que não ovulam em resposta a 50 mg de CLOMID cíclico. Uma dose baixa ou duração do tratamento é particularmente recomendada se houver suspeita de sensibilidade incomum à gonadotrofina hipofisária, como em pacientes com síndrome dos ovários policísticos (ver AVISOS ; Síndrome de hiperestimulação ovariana ).
A paciente deve ser avaliada cuidadosamente para excluir gravidez, aumento ovariano ou formação de cisto ovariano entre cada ciclo de tratamento.
Se houver planejamento de sangramento induzido por progesterona, ou se ocorrer sangramento uterino espontâneo antes da terapia, o regime de 50 mg diários por 5 dias deve ser iniciado no 5º dia do ciclo ou por volta dele. A terapia pode ser iniciada a qualquer momento na paciente que não teve sangramento uterino recente. Quando a ovulação ocorre nesta dosagem, não há vantagem em aumentar a dose nos ciclos subsequentes de tratamento.
Se a ovulação não parece ocorrer após o primeiro ciclo de terapia, um segundo ciclo de 100 mg por dia (dois comprimidos de 50 mg administrados em dose única diária) por 5 dias deve ser administrado. Este curso pode ser iniciado tão cedo quanto 30 dias após o anterior, após serem tomadas precauções para excluir a presença de gravidez. Não é recomendado aumentar a dosagem ou a duração da terapia além de 100 mg/dia por 5 dias.
maioria das pacientes que vai ovular o fará após o primeiro ciclo de terapia. Se a ovulação não ocorrer após três ciclos de terapia, o tratamento adicional com CLOMID 50mg não é recomendado e a paciente deve ser reavaliada. Se ocorrerem três respostas ovulatórias, mas a gravidez não for alcançada, o tratamento adicional não é recomendado. Se a menstruação não ocorrer após uma resposta ovulatória, a paciente deve ser reavaliada. A terapia cíclica de longo prazo não é recomendada além de um total de cerca de seis ciclos (ver PRECAUÇÕES ).
COMO FORNECIDO
NDC 0068-0226-30: Os comprimidos de 50 mg em embalagens de 30 comprimidos são redondos, brancos, com ranhuras e gravados CLOMID 50. Conservar os comprimidos à temperatura ambiente controlada 59-86°F (15-30°C). Proteger do calor, luz e umidade excessiva e armazenar em recipientes fechados.
Fabricado por: A SANOFI COMPANY, sanofi-aventis US LLC, Bridgewater, NJ 08807. Revisado: julho de 2017
EFEITOS COLATERAIS
Eventos Adversos de Ensaios Clínicos.
CLOMID, nas dosagens recomendadas, é geralmente bem tolerado. As reações adversas geralmente foram leves e transitórias e a maioria desapareceu imediatamente após a descontinuação do tratamento. As experiências adversas relatadas em pacientes tratados com citrato de clomifeno durante os estudos clínicos são mostradas na Tabela 2.
Os seguintes eventos adversos foram relatados em menos de 1% dos pacientes em estudos clínicos: abdômen agudo, aumento do apetite, constipação, dermatite ou erupção cutânea, depressão, diarreia, tontura, fadiga, perda de cabelo/cabelo seco, aumento da frequência/volume urinário, insônia, tontura, tensão nervosa, secura vaginal, vertigem, ganho/perda de peso.
Pacientes em terapia prolongada com CLOMID 25mg podem apresentar níveis séricos elevados de desmosterol. Isto é provavelmente devido a uma interferência direta com a síntese de colesterol. No entanto, os esteróis séricos em pacientes que recebem a dose recomendada de CLOMID 50mg não são significativamente alterados. O câncer de ovário foi relatado com pouca frequência em pacientes que receberam medicamentos para fertilidade. A infertilidade é um fator de risco primário para câncer de ovário; entretanto, dados epidemiológicos sugerem que o uso prolongado de clomifeno pode aumentar o risco de tumor ovariano borderline ou invasivo.
Eventos Adversos Pós-comercialização
As seguintes reações adversas foram identificadas durante o uso pós-aprovação de Clomid. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento.
Corpo como um todo: Febre, zumbido, fraqueza
Cardiovascular: Arritmia, dor torácica, edema, hipertensão, palpitação, flebite, embolia pulmonar, falta de ar, taquicardia, tromboflebite
Sistema nervoso central: Enxaqueca, parestesia, convulsão, acidente vascular cerebral, síncope
Dermatológico: Acne, reação alérgica, eritema, eritema multiforme, eritema nodoso, hipertricose, prurido, urticária
Anomalias Fetais/Neonatais:
- Desenvolvimento ósseo anormal: malformações esqueléticas do crânio, face, passagens nasais, mandíbula, mão, membro (ectromelia, incluindo amelia, hemimelia e focomelia), pé (pé torto), coluna e articulações
- Anormalidades cardíacas: defeitos cardíacos septais, defeito septal ventricular muscular, persistência do canal arterial, tetralogia de Fallot e coarctação da aorta
- Distúrbios cromossômicos: síndrome de Down
- Anormalidades do ouvido e surdez
- Anormalidades do trato gastrointestinal: fissura labiopalatina, ânus imperfurado, fístula traqueoesofágica, hérnia diafragmática, onfalocele
- Anormalidades genitais: hipospádia, extrofia cloacal
- Malformações do tecido pulmonar
- Malformações do olho e da lente (catarata)
- Neoplasias: tumor neuroectodérmico, tumor de tireóide, hepatoblastoma, leucemia linfocítica
- Anormalidades do sistema nervoso: defeitos do tubo neural (anencefalia, meningomielocele), microcefalia e hidrocefalia
- Anormalidades renais: agenesia renal e disgenesia renal
- Outros: nanismo, retardo mental
Gastrointestinal: Pancreatite
Geniturinário: Endometriose, cisto ovariano (aumento ou cistos ovarianos podem, como tal, ser complicados por torção anexial), hemorragia ovariana, gravidez tubária, hemorragia uterina, espessura endometrial reduzida
Hepático: Transaminases aumentadas, hepatite
Distúrbios do Metabolismo: Hipertrigliceridemia, em alguns casos com pancreatite
Musculoesquelético: Artralgia, dor nas costas, mialgia
Neoplasias: Fígado (hemangiossarcoma hepático, adenoma de células hepáticas, carcinoma hepatocelular); mama (doença fibrocística, carcinoma da mama); endométrio (carcinoma endometrial); sistema nervoso (astrocitoma, tumor hipofisário, prolactinoma, neurofibromatose, glioblastoma multiforme, abcesso cerebral); ovário (luteoma da gravidez, cisto dermóide do ovário, carcinoma ovariano); trofoblástica (mola hidatiforme, coriocarcinoma); diversos (melanoma, mieloma, cistos perianais, carcinoma de células renais, linfoma de Hodgkin, carcinoma de língua, carcinoma de bexiga)
Psiquiátrico: Ansiedade, irritabilidade, alterações de humor, psicose
Distúrbios Visuais: Acomodação anormal, catarata, dor ocular, edema macular, neurite óptica, fotopsia, descolamento vítreo posterior, hemorragia retiniana, trombose retiniana, espasmo vascular retiniano, perda temporária ou prolongada da visão, possivelmente irreversível.
Outro: Leucocitose, distúrbio da tireoide
INTERAÇÕES MEDICAMENTOSAS
As interações medicamentosas com CLOMID não foram documentadas.
Abuso e Dependência de Drogas
Tolerância, abuso ou dependência com CLOMID não foram relatados.
AVISOS
Sintomas visuais
Os pacientes devem ser avisados de que, ocasionalmente, podem ocorrer embaçamento ou outros sintomas visuais, como manchas ou flashes (escotomas cintilantes), durante a terapia com CLOMID. Esses sintomas visuais aumentam em incidência com o aumento da dose total ou da duração da terapia. Esses distúrbios visuais são geralmente reversíveis; entretanto, casos de distúrbios visuais prolongados foram relatados, alguns ocorrendo após a descontinuação de CLOMID 50mg. Os distúrbios visuais podem ser irreversíveis, especialmente com o aumento da dosagem ou duração da terapia. Os pacientes devem ser avisados de que esses sintomas visuais podem tornar atividades como dirigir um carro ou operar máquinas mais perigosas do que o normal, principalmente sob condições de iluminação variável.
Esses sintomas visuais parecem ser devidos à intensificação e prolongamento das pós-imagens. Os sintomas geralmente aparecem pela primeira vez ou são acentuados com a exposição a um ambiente bem iluminado. Embora a acuidade visual medida geralmente não tenha sido afetada, um paciente do estudo tomando 200 mg de CLOMID diariamente desenvolveu embaçamento visual no 7º dia de tratamento, que progrediu para diminuição grave da acuidade visual no 10º dia. Nenhuma outra anormalidade foi encontrada e a acuidade visual voltou ao normal no 3º dia após a interrupção do tratamento.
Escotomas definíveis oftalmologicamente e alterações na função das células da retina (eletrorretinografia) também foram relatadas. Um paciente tratado durante os estudos clínicos desenvolveu fosfenos e escotomas durante a administração prolongada de CLOMID 50mg, que desapareceu no 32º dia após a interrupção da terapia.
A vigilância pós-comercialização de eventos adversos também revelou outros sinais e sintomas visuais durante a terapia com CLOMID (ver REAÇÕES ADVERSAS ).
Embora a etiologia desses sintomas visuais ainda não seja compreendida, os pacientes com quaisquer sintomas visuais devem descontinuar o tratamento e realizar uma avaliação oftalmológica completa imediatamente.
Síndrome de hiperestimulação ovariana
A síndrome de hiperestimulação ovariana (OHSS) foi relatada em pacientes recebendo terapia com citrato de clomifeno para indução da ovulação. A OHSS pode progredir rapidamente (dentro de 24 horas a vários dias) e se tornar um distúrbio médico grave. Em alguns casos, a SHO ocorreu após o uso cíclico de terapia com citrato de clomifeno ou quando o citrato de clomifeno foi usado em combinação com gonadotrofinas. Anormalidades transitórias nos testes de função hepática sugestivas de disfunção hepática, que podem ser acompanhadas por alterações morfológicas na biópsia hepática, foram relatadas em associação com SHO.
OHSS é um evento médico distinto do aumento ovariano não complicado. Os sinais clínicos desta síndrome em casos graves podem incluir aumento macroscópico dos ovários, sintomas gastrointestinais, ascite, dispneia, oligúria e derrame pleural. Além disso, os seguintes sintomas foram relatados em associação com esta síndrome: derrame pericárdico, anasarca, hidrotórax, abdome agudo, hipotensão, insuficiência renal, edema pulmonar, hemorragia intraperitoneal e ovariana, trombose venosa profunda, torção do ovário e insuficiência respiratória aguda. sofrimento. Os primeiros sinais de alerta de SHO são dor e distensão abdominal, náuseas, vômitos, diarreia e ganho de peso. Níveis elevados de esteróides urinários, graus variados de desequilíbrio eletrolítico, hipovolemia, hemoconcentração e hipoproteinemia podem ocorrer. Ocorreu morte devido a choque hipovolêmico, hemoconcentração ou tromboembolismo. Devido à fragilidade dos ovários aumentados em casos graves, o exame abdominal e pélvico deve ser realizado com muita cautela. Se a concepção resultar, pode ocorrer uma rápida progressão para a forma grave da síndrome.
Para minimizar o risco associado ao aumento anormal ocasional do ovário associado à terapia com CLOMID 100mg, deve-se usar a dose mais baixa consistente com os resultados clínicos esperados. O aumento máximo do ovário, seja fisiológico ou anormal, pode não ocorrer até vários dias após a descontinuação da dose recomendada de CLOMID. Algumas pacientes com síndrome dos ovários policísticos que são excepcionalmente sensíveis à gonadotrofina podem ter uma resposta exagerada às doses usuais de CLOMID. Portanto, pacientes com síndrome dos ovários policísticos devem ser iniciados com a dose mais baixa recomendada e a menor duração do tratamento para o primeiro ciclo de terapia (ver DOSAGEM E ADMINISTRAÇÃO ).
Se ocorrer aumento do ovário, a terapia adicional com CLOMID não deve ser administrada até que os ovários retornem ao tamanho pré-tratamento e a dosagem ou duração do próximo ciclo deve ser reduzida. O aumento ovariano e a formação de cistos associados à terapia com CLOMID 50mg geralmente regridem espontaneamente dentro de alguns dias ou semanas após a descontinuação do tratamento. O benefício potencial da terapia subsequente com CLOMID 25mg nesses casos deve exceder o risco. A menos que exista indicação cirúrgica para laparotomia, esse aumento cístico deve sempre ser tratado de forma conservadora.
A relação causal entre hiperestimulação ovariana e câncer de ovário não foi determinada. No entanto, como foi sugerida uma correlação entre câncer de ovário e nuliparidade, infertilidade e idade, se os cistos ovarianos não regredirem espontaneamente, uma avaliação completa deve ser realizada para descartar a presença de neoplasia ovariana.
PRECAUÇÕES
Em geral
Atenção cuidadosa deve ser dada à seleção de candidatos à terapia com CLOMID. O exame pélvico é necessário antes do tratamento com CLOMID e antes de cada ciclo subsequente (ver CONTRA-INDICAÇÕES e AVISOS ).
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Estudos de toxicidade de longo prazo em animais não foram realizados para avaliar o potencial carcinogênico ou mutagênico do citrato de clomifeno.
A administração oral de CLOMID 25mg a ratos machos em doses de 0,3 ou 1 mg/kg/dia causou diminuição da fertilidade, enquanto doses mais altas causaram infertilidade temporária. Doses orais de 0,1 mg/kg/dia em ratas interromperam temporariamente o padrão cíclico normal do esfregaço vaginal e impediram a concepção. Doses de 0,3 mg/kg/dia reduziram levemente o número de óvulos ovulados e corpos lúteos, enquanto 3 mg/kg/dia inibiram a ovulação.
Gravidez
Resumo do risco fetal
O uso de CLOMID 100mg em gestantes é contraindicado, pois o tratamento com CLOMID 25mg não oferece benefício nesta população.
Os dados humanos disponíveis não sugerem um risco aumentado de anomalias congênitas acima do risco populacional de base. No entanto, estudos de toxicologia reprodutiva em animais mostraram aumento da perda embriofetal e malformações estruturais na prole. Se este medicamento for usado durante a gravidez, ou se a paciente engravidar enquanto estiver tomando este medicamento, a paciente deve ser informada dos riscos potenciais para o feto.
Considerações Clínicas
Para evitar a administração inadvertida de CLOMID 25mg durante o início da gravidez, testes apropriados devem ser utilizados durante cada ciclo de tratamento para determinar se ocorre ovulação e/ou gravidez. As pacientes devem ser avaliadas cuidadosamente para excluir aumento ovariano ou formação de cisto ovariano entre cada ciclo de tratamento. O próximo ciclo de terapia com CLOMID deve ser adiado até que essas condições sejam excluídas.
Dados humanos
Os dados humanos disponíveis de estudos epidemiológicos não mostram nenhuma relação aparente de causa e efeito entre a exposição periconceptual ao citrato de clomifeno e um risco aumentado de defeitos congênitos gerais ou qualquer anomalia específica. No entanto, devido ao pequeno número de casos de anomalias congênitas que ocorrem em mulheres tratadas com citrato de clomifeno, esses estudos epidemiológicos só foram capazes de descartar grandes diferenças de risco. Os estudos não consideraram fatores associados à subfertilidade feminina e não foram capazes de ajustar outros fatores de confusão importantes. Além disso, os dados disponíveis não suportam um aumento da taxa de aborto espontâneo entre mulheres subférteis tratadas com citrato de clomifeno para indução da ovulação.
Dados de animais
administração oral de citrato de clomifeno a ratas grávidas durante a organogênese em doses de 1 a 2 mg/kg/dia resultou em hidrâmnio e fetos fracos e edematosos com costelas onduladas e outras alterações ósseas temporárias. Doses de 8 mg/kg/dia ou mais também causaram aumento das reabsorções e fetos mortos, distocia e atraso no parto, e 40 mg/kg/dia resultou em aumento da mortalidade materna. Doses únicas de 50 mg/kg causaram catarata fetal, enquanto 200 mg/kg causaram fenda palatina. Após a injeção de citrato de clomifeno 2 mg/kg em camundongos e ratos durante a gravidez, a prole exibiu alterações metaplásicas do trato reprodutivo. Camundongos e ratos recém-nascidos injetados durante os primeiros dias de vida também desenvolveram alterações metaplásicas na mucosa uterina e vaginal, assim como abertura vaginal prematura e ovários anovulatórios. Esses achados são semelhantes ao comportamento reprodutivo anormal e à esterilidade descritos com outros estrogênios e antiestrogênios.
Em coelhos, algumas alterações ósseas temporárias foram observadas em fetos de mães que receberam doses orais de 20 ou 40 mg/kg/dia durante a gravidez, mas não após 8 mg/kg/dia. Não foram observadas malformações permanentes nesses estudos. Além disso, macacos rhesus que receberam doses orais de 1,5 a 4,5 mg/kg/dia por vários períodos durante a gravidez não tiveram descendentes anormais.
Mães que amamentam
Não se sabe se CLOMID é excretado no leite humano. Como muitos medicamentos são excretados no leite humano, deve-se ter cautela se CLOMID for administrado a lactantes. Em alguns pacientes, CLOMID pode reduzir a lactação.
Cancro do ovário
O uso prolongado de comprimidos de citrato de clomifeno USP pode aumentar o risco de um tumor ovariano borderline ou invasivo (ver REAÇÕES ADVERSAS ).
SOBREDOSAGEM
Sinais e sintomas
Efeitos tóxicos que acompanham a superdosagem aguda de CLOMID 50mg não foram relatados. Sinais e sintomas de superdosagem como resultado do uso de mais do que a dose recomendada durante a terapia com CLOMID 100mg incluem náuseas, vômitos, rubores vasomotores, embaçamento visual, manchas ou flashes, escotomas, aumento ovariano com dor pélvica ou abdominal. (Ver CONTRA-INDICAÇÕES : Cisto no ovário .)
LD50 oral
A LD50 oral aguda de CLOMID 25mg é 1700 mg/kg em camundongos e 5750 mg/kg em ratos. A dose tóxica em humanos não é conhecida.
Diálise
Não se sabe se CLOMID é dialisável.
Tratamento
Em caso de sobredosagem, devem ser utilizadas medidas de suporte adequadas, além da descontaminação gastrointestinal.
CONTRA-INDICAÇÕES
Hipersensibilidade
CLOMID 100mg é contraindicado em pacientes com hipersensibilidade ou alergia conhecida ao citrato de clomifeno ou a qualquer um de seus componentes.
Gravidez
O uso de CLOMID em mulheres grávidas é contraindicado, pois CLOMID não oferece benefício nesta população.
Os dados humanos disponíveis não sugerem um risco aumentado de anomalias congênitas acima do risco populacional de base quando usado conforme indicado. No entanto, estudos de toxicologia reprodutiva em animais mostraram aumento da perda embriofetal e malformações estruturais na prole. Se este medicamento for usado durante a gravidez, ou se a paciente engravidar enquanto estiver tomando este medicamento, a paciente deve ser informada dos riscos potenciais para o feto. (Ver PRECAUÇÕES : Gravidez .)
Doença hepática
A terapia com CLOMID 25mg é contraindicada em pacientes com doença hepática ou história de disfunção hepática (ver também INDICAÇÕES e REAÇÕES ADVERSAS ).
Sangramento Uterino Anormal
CLOMID 25mg é contraindicado em pacientes com sangramento uterino anormal de origem indeterminada (ver INDICAÇÕES ).
Cistos ovarianos
CLOMID é contraindicado em pacientes com cistos ovarianos ou aumento não devido à síndrome do ovário policístico (ver INDICAÇÕES e AVISOS ).
Outro
CLOMID é contraindicado em pacientes com disfunção tireoidiana ou adrenal não controlada ou na presença de uma lesão orgânica intracraniana, como tumor hipofisário (ver INDICAÇÕES ).
FARMACOLOGIA CLÍNICA
Ação
CLOMID 25mg é um medicamento de considerável potência farmacológica. Com seleção cuidadosa e manejo adequado da paciente, CLOMID 100mg demonstrou ser uma terapia útil para a paciente anovulatória que deseja engravidar.
citrato de clomifeno é capaz de interagir com tecidos contendo receptores de estrogênio, incluindo hipotálamo, hipófise, ovário, endométrio, vagina e colo do útero. Pode competir com o estrogênio pelos locais de ligação ao receptor de estrogênio e pode retardar a reposição dos receptores de estrogênio intracelular. O citrato de clomifeno inicia uma série de eventos endócrinos que culminam em um surto de gonadotrofina pré-ovulatória e subsequente ruptura folicular. O primeiro evento endócrino em resposta a um curso de terapia com clomifeno é um aumento na liberação de gonadotrofinas hipofisárias. Isso inicia a esteroidogênese e a foliculogênese, resultando no crescimento do folículo ovariano e no aumento do nível circulante de estradiol. Após a ovulação, a progesterona e o estradiol plasmáticos aumentam e diminuem como ocorreriam em um ciclo ovulatório normal.
Os dados disponíveis sugerem que as propriedades estrogênicas e antiestrogênicas do clomifeno podem participar do início da ovulação. Os dois isômeros do clomifeno têm efeitos estrogênicos e antiestrogênicos mistos, que podem variar de uma espécie para outra. Alguns dados sugerem que o zuclomifeno tem maior atividade estrogênica do que o enclomifeno.
O citrato de clomifeno não tem efeitos progestacionais, androgênicos ou antiandrogênicos aparentes e não parece interferir na função pituitária-adrenal ou pituitária-tireoidiana. Embora não haja evidência de um “efeito de transmissão” de CLOMID, menstruações ovulatórias espontâneas foram observadas em algumas pacientes após a terapia com CLOMID 100mg.
Farmacocinética
Com base em estudos iniciais com citrato de clomifeno marcado com 14C, a droga mostrou ser prontamente absorvida por via oral em humanos e excretada principalmente nas fezes. A excreção urinária e fecal cumulativa do 14C foi em média cerca de 50% da dose oral e 37% da dose intravenosa após 5 dias. A excreção urinária média foi de aproximadamente 8% com excreção fecal de cerca de 42%.
Algum marcador de 14C ainda estava presente nas fezes 6 semanas após a administração. Estudos subsequentes de dose única em voluntários normais mostraram que o zuclomifeno (cis) tem uma meia-vida mais longa do que o enclomifeno (trans). Níveis detectáveis de zuclomifeno persistiram por mais de um mês nesses indivíduos. Isso pode ser sugestivo de reciclagem entero-hepática estereo-específica ou sequestro do zuclomifeno. Assim, é possível que algum fármaco ativo permaneça no corpo durante o início da gravidez em mulheres que concebem no ciclo menstrual durante a terapia com CLOMID.
Estudos clínicos
Durante as investigações clínicas, 7.578 pacientes receberam CLOMID, algumas das quais apresentavam impedimentos à ovulação além da disfunção ovulatória (ver INDICAÇÕES ). Nesses ensaios clínicos, a terapia bem-sucedida caracterizada por gravidez ocorreu em aproximadamente 30% dessas pacientes.
Houve um total de 2.635 gestações relatadas durante o período do ensaio clínico. Dessas gestações, a informação sobre o resultado estava disponível apenas para 2.369 dos casos. A Tabela 1 resume o resultado desses casos.
Das gestações relatadas, a incidência de gestações múltiplas foi de 7,98%: 6,9% gemelar, 0,5% trigêmeo, 0,3% quádruplo e 0,1% quíntuplo. Das 165 gestações gemelares para as quais informações suficientes estavam disponíveis, a proporção de gêmeos monozigóticos para dizigóticos foi de cerca de 1:5. A Tabela 1 relata a sobrevida dos nascidos múltiplos vivos.
Um nascimento de sêxtuplos foi relatado após a conclusão dos estudos clínicos originais; nenhum dos sêxtuplos sobreviveu (cada um pesava menos de 400 g), embora cada um parecesse grosseiramente normal.
A sobrevida global de bebês de gestações múltiplas, incluindo abortos espontâneos, natimortos e mortes neonatais é de 73%.
Anomalias e mortalidade fetal/neonatal
As seguintes anormalidades fetais foram relatadas após gestações após terapia de indução da ovulação com CLOMID durante ensaios clínicos. Cada uma das seguintes anormalidades fetais foi relatada a uma taxa de
Além disso, relatos de anomalias congênitas foram recebidos durante a vigilância pós-comercialização de CLOMID (ver REAÇÕES ADVERSAS ).
INFORMAÇÃO DO PACIENTE
A finalidade e os riscos da terapia com CLOMID devem ser apresentados ao paciente antes de iniciar o tratamento. Deve-se enfatizar que o objetivo da terapia com CLOMID é a ovulação para a gravidez subsequente. O médico deve aconselhar o paciente com atenção especial aos seguintes riscos potenciais:
Sintomas visuais
Aconselhe que ocasionalmente podem ocorrer embaçamento ou outros sintomas visuais durante ou logo após a terapia com CLOMID. Deve ficar claro para o paciente que, em alguns casos, os distúrbios visuais podem ser prolongados e possivelmente irreversíveis, especialmente com aumento da dosagem ou duração da terapia. Avise que os sintomas visuais podem tornar atividades como dirigir um carro ou operar máquinas mais perigosas do que o normal, principalmente sob condições de iluminação variável (consulte AVISOS ).
paciente deve ser instruído a informar o médico sempre que ocorrer qualquer sintoma visual incomum. Se o paciente apresentar algum sintoma visual, o tratamento deve ser descontinuado e realizada avaliação oftalmológica completa.
Dor ou distensão abdominal/pélvica
O aumento ovariano pode ocorrer durante ou logo após a terapia com CLOMID. Para minimizar os riscos associados ao aumento ovariano, a paciente deve ser instruída a informar o médico sobre qualquer dor abdominal ou pélvica, ganho de peso, desconforto ou distensão após tomar CLOMID (ver AVISOS ).
Gravidez múltipla
Informe a paciente que há uma chance maior de gravidez múltipla, incluindo gravidez tubária bilateral e gravidez tubária e intrauterina coexistentes, quando a concepção ocorre em relação à terapia com CLOMID. As complicações e riscos potenciais da gravidez múltipla devem ser explicados.
Aborto Espontâneo e Anomalias Congênitas
Informar a paciente que os dados disponíveis não sugerem aumento nas taxas de aborto espontâneo (aborto) ou anomalias congênitas com o uso materno de CLOMID 50mg em comparação com as taxas na população geral.
Durante a investigação clínica, a experiência de pacientes com desfecho de gravidez conhecido (Tabela 1) mostra uma taxa de aborto espontâneo de 20,4% e taxa de natimorto de 1,0%. (Ver Estudos clínicos ). Entre as anomalias de nascimento relatadas espontaneamente como casos individuais desde a disponibilidade comercial de Clomid, a proporção de defeitos do tubo neural tem sido alta entre as gestações associadas à ovulação induzida por Clomid, mas isso não foi apoiado por dados de estudos populacionais.
