Copegus 100mg Ribavirin Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Copegus 100mg e como é usado?
Copegus 100mg é um medicamento de prescrição usado para tratar os sintomas da hepatite C crônica. Copegus 100mg pode ser usado sozinho ou com outros medicamentos.
Copegus pertence a uma classe de medicamentos chamados Agentes da Hepatite B/Hepatite C; Agentes RSV.
Quais são os possíveis efeitos colaterais do Copegus?
Copegus pode causar efeitos colaterais graves, incluindo:
- urticária,
- dificuldade para respirar,
- inchaço do rosto, lábios, língua ou garganta,
- problemas com sua visão,
- dor intensa na parte superior do estômago se espalhando para as costas,
- náusea,
- vômito,
- diarréia,
- tosse nova ou agravada,
- febre,
- dor no peito lancinante,
- chiado,
- falta de ar,
- Depressão severa,
- pensamentos de automutilação ou de prejudicar outra pessoa,
- pele pálida ou amarelada,
- urina de cor escura,
- confusão,
- fraqueza,
- arrepios,
- sintomas como os da gripe,
- gengivas inflamadas,
- aftas,
- feridas na pele,
- contusões fáceis,
- sangramento incomum e
- tontura
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Copegus incluem:
- náusea,
- vômito,
- perda de apetite,
- febre,
- calafrios ou tremores,
- baixa contagem de células sanguíneas,
- anemia,
- fraqueza,
- cansaço,
- dor de cabeça,
- dor muscular,
- mudanca de humor,
- ansiedade, e
- irritabilidade
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Copegus. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
AVISO
RISCO DE TRANSTORNOS GRAVES E EFEITOS ASSOCIADOS À RIBAVIRINA
A monoterapia com COPEGUS (ribavirina) não é eficaz para o tratamento da infecção crônica pelo vírus da hepatite C e não deve ser usada isoladamente para esta indicação.
toxicidade clínica primária da ribavirina é a anemia hemolítica. A anemia associada à terapia com ribavirina pode resultar no agravamento da doença cardíaca e levar a infartos do miocárdio fatais e não fatais. Pacientes com história de doença cardíaca significativa ou instável não devem ser tratados com COPEGUS [ver ADVERTÊNCIAS E PRECAUÇÕES, REAÇÕES ADVERSAS e DOSAGEM E ADMINISTRAÇÃO].
Efeitos teratogênicos e/ou embriocidas significativos foram demonstrados em todas as espécies animais expostas à ribavirina. Além disso, a ribavirina tem meia-vida de dose múltipla de 12 dias e pode persistir em compartimentos não plasmáticos por até 6 meses. Portanto, a ribavirina, incluindo COPEGUS 100mg, é contraindicada em mulheres grávidas e nos parceiros masculinos de mulheres grávidas. Deve-se ter extremo cuidado para evitar a gravidez durante a terapia e por 6 meses após a conclusão da terapia em pacientes do sexo feminino e em parceiras de pacientes do sexo masculino que estejam recebendo terapia com ribavirina. Pelo menos duas formas confiáveis de contracepção eficaz devem ser utilizadas durante o tratamento e durante o período de acompanhamento de 6 meses após o tratamento [ver CONTRA-INDICAÇÕES, ADVERTÊNCIAS E PRECAUÇÕES e Uso em populações específicas].
DESCRIÇÃO
COPEGUS 100mg, ribavirina, é um análogo de nucleosídeo com atividade antiviral. O nome químico da ribavirina é 1-β-Dribofuranosil-1H-1,2,4-triazol-3-carboxamida e tem a seguinte fórmula estrutural:
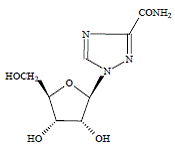
A fórmula empírica da ribavirina é C8H12N4O5 e o peso molecular é 244,2. A ribavirina é um pó branco a esbranquiçado. É livremente solúvel em água e ligeiramente solúvel em álcool anidro.
COPEGUS (ribavirina) está disponível na forma de comprimido revestido por película de cor rosa claro a rosa, plano, oval, para administração oral. Cada comprimido contém 200 mg de ribavirina e os seguintes ingredientes inativos: amido pré-gelatinizado, celulose microcristalina, amidoglicolato de sódio, amido de milho e estearato de magnésio. O revestimento do comprimido contém Chromatone-P ou Opadry Pink (feito usando hidroxipropilmetilcelulose, talco, dióxido de titânio, óxido de ferro amarelo sintético e óxido de ferro vermelho sintético), etilcelulose (ECD-30) e triacetina.
INDICAÇÕES
COPEGUS 100mg em combinação com PEGASYS (peginterferon alfa-2a) é indicado para o tratamento de pacientes com 5 anos de idade ou mais com infecção crônica pelo vírus da hepatite C (CHC) que tenham doença hepática compensada e não tenham sido previamente tratados com interferon alfa.
Os seguintes pontos devem ser considerados ao iniciar a terapia combinada de COPEGUS 100mg com PEGASYS:
- Esta indicação baseia-se em ensaios clínicos de terapêutica combinada em doentes com CHC e doença hepática compensada, alguns dos quais com evidência histológica de cirrose (Child-Pugh classe A), e em doentes adultos com doença VIH clinicamente estável e contagem de CD4 superior a 100 células/mm³.
- Esta indicação é baseada na obtenção de RNA do HCV indetectável após o tratamento por 24 ou 48 semanas, com base no genótipo do HCV, e na manutenção de uma Resposta Virológica Sustentada (SVR) 24 semanas após a última dose.
- Não estão disponíveis dados de segurança e eficácia para tratamentos superiores a 48 semanas.
- segurança e eficácia da terapia com COPEGUS 100mg e PEGASYS não foram estabelecidas em receptores de transplante de fígado ou de outros órgãos, pacientes com doença hepática descompensada ou não respondedores anteriores à terapia com interferon.
- A segurança e eficácia da terapia com COPEGUS para o tratamento de infecções por adenovírus, VSR, parainfluenza ou influenza não foram estabelecidas. COPEGUS não deve ser utilizado para estas indicações. A ribavirina para inalação tem uma bula separada, que deve ser consultada se a terapia inalatória com ribavirina estiver sendo considerada.
DOSAGEM E ADMINISTRAÇÃO
COPEGUS 100mg deve ser tomado com alimentos. COPEGUS deve ser administrado em combinação com PEGASYS; é importante notar que COPEGUS 100mg nunca deve ser administrado como monoterapia. Ver Folheto Informativo do PEGASYS para todas as instruções relativas à dosagem e administração do PEGASYS.
Monoinfecção por Hepatite C Crônica
Pacientes adultos
dose recomendada de COPEGUS 100 mg comprimidos é apresentada na Tabela 1. A duração recomendada do tratamento para doentes não tratados previamente com ribavirina e interferão é de 24 a 48 semanas.
A dose diária de COPEGUS 100 mg é de 800 mg a 1200 mg administrados por via oral em duas doses divididas. A dose deve ser individualizada para o paciente, dependendo das características basais da doença (por exemplo, genótipo), resposta à terapia e tolerabilidade do regime (ver ).
Pacientes pediátricos
PEGASYS é administrado como 180 mcg/1,73m² x BSA uma vez por semana por via subcutânea, até uma dose máxima de 180 mcg, e deve ser administrado em combinação com ribavirina. A duração do tratamento recomendada para pacientes com genótipo 2 ou 3 é de 24 semanas e para outros genótipos é de 48 semanas.
COPEGUS deve ser administrado em combinação com PEGASYS. COPEGUS 100 mg está disponível apenas em comprimidos de 200 mg e, portanto, o profissional de saúde deve determinar se este comprimido pode ser engolido pelo paciente pediátrico. As doses recomendadas para COPEGUS são fornecidas na Tabela 2. Os pacientes que iniciam o tratamento antes de completarem 18 anos devem manter a dosagem pediátrica até a conclusão da terapia.
Hepatite C crônica com coinfecção por HIV
Pacientes adultos
A dose recomendada para o tratamento da hepatite C crônica em pacientes coinfectados com HIV é PEGASYS 180 mcg subcutâneo uma vez por semana e COPEGUS 800 mg por via oral diariamente por um período total de 48 semanas, independentemente do genótipo do HCV.
Modificações de dose
Pacientes Adultos e Pediátricos
Se ocorrerem reações adversas graves ou anormalidades laboratoriais durante a terapia combinada com COPEGUS/PEGASYS, a dose deve ser modificada ou descontinuada, se apropriado, até que as reações adversas diminuam ou diminuam em gravidade. Se a intolerância persistir após o ajuste de dose, a terapia com COPEGUS/PEGASYS deve ser descontinuada. A Tabela 3 fornece diretrizes para modificações de dose e descontinuação com base na concentração de hemoglobina e estado cardíaco do paciente.
COPEGUS 100mg deve ser administrado com cautela a pacientes com doença cardíaca pré-existente. Os pacientes devem ser avaliados antes do início da terapia e devem ser monitorados adequadamente durante a terapia. Se houver qualquer deterioração do estado cardiovascular, a terapia deve ser interrompida [ver AVISOS E PRECAUÇÕES ].
As diretrizes para modificações da dose de COPEGUS 100mg descritas nesta tabela também se aplicam a anormalidades laboratoriais ou reações adversas que não sejam diminuições nos valores de hemoglobina.
Pacientes adultos
Uma vez que COPEGUS 100mg tenha sido suspenso devido a uma anormalidade laboratorial ou reação adversa clínica, pode-se tentar reiniciar COPEGUS 100mg com 600mg diários e aumentar ainda mais a dose para 800mg diários. No entanto, não é recomendado que COPEGUS seja aumentado para a dose original atribuída (1000 mg a 1200 mg).
Pacientes pediátricos
Após a resolução de uma anormalidade laboratorial ou reação adversa clínica, pode-se tentar aumentar a dose de COPEGUS 100mg para a dose original, dependendo do julgamento do médico. Se COPEGUS tiver sido suspenso devido a uma anormalidade laboratorial ou reação adversa clínica, pode-se tentar reiniciar COPEGUS 100mg na metade da dose total.
Insuficiência renal
A dose diária total de COPEGUS deve ser reduzida para pacientes com clearance de creatinina menor ou igual a 50 mL/min; e a dose semanal de PEGASYS deve ser reduzida para depuração de creatinina inferior a 30 mL/min como segue na Tabela 4 [ver Uso em populações específicas , Farmacocinética , e Folheto do Pacote PEGASYS ].
dose de COPEGUS 100mg não deve ser modificada em pacientes com insuficiência renal. Se ocorrerem reações adversas graves ou anormalidades laboratoriais, COPEGUS deve ser descontinuado, se apropriado, até que as reações adversas diminuam ou diminuam em gravidade. Se a intolerância persistir após reiniciar COPEGUS 100mg, a terapia com COPEGUS/PEGASYS deve ser descontinuada.
Não há dados disponíveis para pacientes pediátricos com insuficiência renal.
Descontinuação da dosagem
A descontinuação da terapia com PEGASYS/COPEGUS 100mg deve ser considerada se o paciente não conseguiu demonstrar uma redução de pelo menos 2 log10 da linha de base no RNA do VHC em 12 semanas de terapia, ou níveis indetectáveis de RNA do VHC após 24 semanas de terapia.
A terapia com PEGASYS/COPEGUS 100mg deve ser descontinuada em pacientes que desenvolvem descompensação hepática durante o tratamento [ver AVISOS E PRECAUÇÕES ].
COMO FORNECIDO
Formas de dosagem e pontos fortes
COPEGUS (ribavirina) está disponível na forma de comprimido revestido por película de cor rosa claro a rosa, plano, oval, para administração oral. Cada comprimido contém 200 mg de ribavirina.
COPEGUS® (ribavirina) está disponível na forma de comprimidos para administração oral. Cada comprimido contém 200 mg de ribavirina e é de cor rosa claro a rosa, plano, oval, revestido por película e gravado com RIB 200 de um lado e ROCHE do outro lado. Eles são embalados em frascos de 168 comprimidos ( NDC 0004-0086-94).
Armazenamento e manuseio
Armazene o frasco de COPEGUS® Tablets a 25°C (77°F); excursões são permitidas entre 15°C e 30°C (59°F e 86°F) [ver Temperatura ambiente controlada USP ]. Mantenha o frasco bem fechado.
Fabricado por: Hoffmann-La Roche, Inc. c/o Genentech, Inc. Membro do Grupo Roche, 1 DNA Way, South San Francisco, CA 94080-4990. Revisado: agosto de 2015
EFEITOS COLATERAIS
PEGASYS em combinação com COPEGUS causa uma ampla variedade de reações adversas graves [ver AVISO EM CAIXA e AVISOS E PRECAUÇÕES ]. As reações adversas graves ou potencialmente fatais mais comuns induzidas ou agravadas por COPEGUS/PEGASYS incluem depressão, suicídio, recaída de abuso de drogas/overdose e infecções bacterianas, cada uma ocorrendo com uma frequência inferior a 1%. A descompensação hepática ocorreu em 2% (10/574) pacientes com CHC/HIV [ver AVISOS E PRECAUÇÕES ].
Experiência em Estudos Clínicos
Como os ensaios clínicos são conduzidos sob condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparadas às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática clínica.
Pacientes adultos
Nos ensaios de registro principais NV15801 e NV15942, 886 pacientes receberam COPEGUS por 48 semanas em doses de 1.000/1.200 mg com base no peso corporal. Nesses estudos, uma ou mais reações adversas graves ocorreram em 10% dos indivíduos monoinfectados com CHC e em 19% dos indivíduos com CHC/HIV recebendo PEGASYS isoladamente ou em combinação com COPEGUS. O evento adverso grave mais comum (3% no CHC e 5% no CHC/HIV) foi infecção bacteriana (por exemplo, sepse, osteomielite, endocardite, pielonefrite, pneumonia).
Outras reações adversas graves ocorreram com frequência inferior a 1% e incluíram: suicídio, ideação suicida, psicose, agressão, ansiedade, abuso de drogas e overdose de drogas, angina, disfunção hepática, fígado gorduroso, colangite, arritmia, diabetes mellitus, fenômenos autoimunes (p. transtorno psicótico e alucinação.
porcentagem de pacientes em ensaios clínicos que apresentaram um ou mais eventos adversos foi de 98%. As reações adversas mais comumente relatadas foram reações psiquiátricas, incluindo depressão, insônia, irritabilidade, ansiedade e sintomas semelhantes aos da gripe, como fadiga, pirexia, mialgia, dor de cabeça e calafrios. Outras reações comuns foram anorexia, náuseas e vômitos, diarreia, artralgias, reações no local da injeção, alopecia e prurido.
mostra taxas de eventos adversos que ocorrem em mais ou igual a 5% dos indivíduos recebendo terapia combinada de interferon peguilado e ribavirina no ensaio clínico CHC, NV15801.
Dez por cento dos pacientes monoinfectados com CHC recebendo 48 semanas de terapia com PEGASYS em combinação com COPEGUS 100mg interromperam a terapia; 16% dos pacientes co-infectados CHC/HIV interromperam a terapia. As razões mais comuns para a descontinuação da terapia foram síndrome psiquiátrica, semelhante à gripe (por exemplo, letargia, fadiga, dor de cabeça), distúrbios dermatológicos e gastrointestinais e anormalidades laboratoriais (trombocitopenia, neutropenia e anemia).
No geral, 39% dos pacientes com CHC ou CHC/HIV necessitaram de modificação da terapia com PEGASYS e/ou COPEGUS. A razão mais comum para a modificação da dose de PEGASYS em pacientes com CHC e CHC/HIV foi por anormalidades laboratoriais; neutropenia (20% e 27%, respectivamente) e trombocitopenia (4% e 6%, respectivamente). A razão mais comum para a modificação da dose de COPEGUS em pacientes com CHC e CHC/HIV foi anemia (22% e 16%, respectivamente).
dose de PEGASYS foi reduzida em 12% dos pacientes que receberam 1.000 mg a 1.200 mg de COPEGUS 100 mg por 48 semanas e em 7% dos pacientes que receberam 800 mg de COPEGUS por 24 semanas. A dose de COPEGUS foi reduzida em 21% dos pacientes que receberam 1.000 mg a 1.200 mg de COPEGUS 100 mg por 48 semanas e em 12% dos pacientes que receberam 800 mg de COPEGUS 100 mg por 24 semanas.
Pacientes monoinfectados com hepatite C crônica tratados por 24 semanas com PEGASYS e 800 mg de COPEGUS 100 mg apresentaram menor incidência de eventos adversos graves (3% vs. 10%), hemoglobina menor que 10 g/dL (3% vs. 15%) , modificação da dose de PEGASYS (30% vs. 36%) e COPEGUS (19% vs. 38%) e de retirada do tratamento (5% vs. 15%) em comparação com pacientes tratados por 48 semanas com PEGASYS e 1000 mg ou 1200mg COPEGUS. Por outro lado, a incidência geral de eventos adversos pareceu ser semelhante nos dois grupos de tratamento.
Pacientes pediátricos
Em um ensaio clínico com 114 pacientes pediátricos (5 a 17 anos de idade) tratados com PEGASYS sozinho ou em combinação com COPEGUS 100 mg, foram necessárias modificações de dose em aproximadamente um terço dos pacientes, mais comumente para neutropenia e anemia. Em geral, o perfil de segurança observado em indivíduos pediátricos foi semelhante ao observado em adultos. No estudo pediátrico, os eventos adversos mais comuns em indivíduos tratados com terapia combinada PEGASYS e COPEGUS 100mg por até 48 semanas foram doença tipo influenza (91%), infecção do trato respiratório superior (60%), dor de cabeça (64%), distúrbio gastrointestinal (56%), distúrbio da pele (47%) e reação no local da injeção (45%). Sete indivíduos recebendo tratamento combinado com PEGASYS e COPEGUS por 48 semanas interromperam a terapia por razões de segurança (depressão, avaliação psiquiátrica anormal, cegueira transitória, exsudatos retinianos, hiperglicemia, diabetes mellitus tipo 1 e anemia). Eventos adversos graves foram relatados em 2 indivíduos no grupo de terapia combinada PEGASYS mais COPEGUS 100mg (hiperglicemia e colecistectomia).
Em indivíduos pediátricos randomizados para terapia combinada, a incidência da maioria das reações adversas foi semelhante durante todo o período de tratamento (até 48 semanas mais 24 semanas de acompanhamento) em comparação com as primeiras 24 semanas, e aumentou apenas ligeiramente para cefaleias, distúrbios gastrointestinais , irritabilidade e erupção cutânea. A maioria das reações adversas ocorreu nas primeiras 24 semanas de tratamento.
Inibição do crescimento em indivíduos pediátricos
[Vejo AVISOS E PRECAUÇÕES ].
Indivíduos pediátricos tratados com a terapia combinada de PEGASYS mais ribavirina mostraram um atraso no aumento de peso e altura com até 48 semanas de terapia em comparação com a linha de base. Tanto os escores z de peso para idade quanto de altura para idade, bem como os percentis da população normativa para peso e altura do sujeito diminuíram durante o tratamento. Ao final de 2 anos de acompanhamento após o tratamento, a maioria dos indivíduos havia retornado aos percentis da curva normativa basal para peso (64º percentil médio no início do estudo, 60º percentil médio em 2 anos pós-tratamento) e altura (54º percentil médio no início do estudo, 56º percentil médio em 2 anos pós-tratamento). No final do tratamento, 43% (23 de 53) dos indivíduos experimentaram uma diminuição do percentil de peso de mais de 15 percentis e 25% (13 de 53) experimentaram uma diminuição do percentil de altura de mais de 15 percentis nas curvas de crescimento normativas. Aos 2 anos após o tratamento, 16% (6 de 38) dos indivíduos estavam mais de 15 percentis abaixo de sua curva de peso basal e 11% (4 de 38) estavam mais de 15 percentis abaixo de sua curva de altura basal.
Trinta e oito dos 114 indivíduos inscritos no estudo de acompanhamento de longo prazo, estendendo-se até 6 anos após o tratamento. Para a maioria dos indivíduos, a recuperação pós-tratamento no crescimento em 2 anos após o tratamento foi mantida até 6 anos após o tratamento.
Reações Adversas Comuns em CHC com Coinfecção por HIV (Adultos)
O perfil de eventos adversos de pacientes coinfectados tratados com PEGASYS/COPEGUS no Estudo NR15961 foi geralmente semelhante ao mostrado para pacientes monoinfectados no Estudo NV15801 (Tabela 5). Os eventos que ocorreram com maior frequência em pacientes coinfectados foram neutropenia (40%), anemia (14%), trombocitopenia (8%), diminuição de peso (16%) e alteração do humor (9%).
Anormalidades de Testes Laboratoriais
Pacientes adultos
anemia por hemólise é a toxicidade mais significativa da terapia com ribavirina. Anemia (hemoglobina inferior a 10 g/dL) foi observada em 13% de todos os pacientes tratados com a combinação de COPEGUS e PEGASYS em ensaios clínicos. A queda máxima na hemoglobina ocorreu durante as primeiras 8 semanas do início da terapia com ribavirina [ver DOSAGEM E ADMINISTRAÇÃO ].
Pacientes pediátricos
A diminuição da hemoglobina, neutrófilos e plaquetas pode exigir redução da dose ou descontinuação permanente do tratamento [ver DOSAGEM E ADMINISTRAÇÃO ]. A maioria das anormalidades laboratoriais observadas durante o ensaio clínico retornou aos níveis basais logo após a descontinuação do tratamento.
Em pacientes randomizados para terapia combinada, a incidência de anormalidades durante toda a fase de tratamento (até 48 semanas mais 24 semanas de acompanhamento) em comparação com as primeiras 24 semanas aumentou ligeiramente para neutrófilos entre 500 e 1.000 células/mm³ e valores de hemoglobina entre 8,5 e 10 g/dL. A maioria das anormalidades hematológicas ocorreu nas primeiras 24 semanas de tratamento.
Experiência pós-marketing
As seguintes reações adversas foram identificadas e relatadas durante o uso pós-aprovação da terapia combinada PEGASYS/COPEGUS 100mg. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento.
Distúrbios do Sangue e do Sistema Linfático
Aplasia pura de eritrócitos
Distúrbios do ouvido e labirinto
Deficiência auditiva, perda auditiva
Distúrbios oculares
Descolamento seroso de retina
Distúrbios imunológicos
Rejeição de enxertos hepáticos e renais
Distúrbios do Metabolismo e Nutrição
Desidratação
Distúrbios da Pele e Tecidos Subcutâneos
Síndrome de Stevens-Johnson (SSJ)
Necrólise epidérmica tóxica (NET)
INTERAÇÕES MEDICAMENTOSAS
Os resultados de um subestudo farmacocinético não demonstraram interação farmacocinética entre PEGASYS (peginterferon alfa-2a) e ribavirina.
Inibidores Nucleosídeos da Transcriptase Reversa (NRTIs)
Dados in vitro indicam que a ribavirina reduz a fosforilação da lamivudina, estavudina e zidovudina. No entanto, nenhuma interação farmacocinética (por exemplo, concentrações plasmáticas ou concentrações de metabólito ativo trifosforilado intracelular) ou farmacodinâmica (por exemplo, perda de supressão virológica de HIV/HCV) foi observada quando ribavirina e lamivudina (n=18), estavudina (n=10) ou zidovudina (n=6) foram coadministrados como parte de um regime multimedicamentoso para pacientes coinfectados com HCV/HIV.
No Estudo NR15961 entre os pacientes cirróticos coinfectados com CHC/HIV recebendo NRTIs, foram observados casos de descompensação hepática (alguns fatais) [ver AVISOS E PRECAUÇÕES ].
Os doentes a receber PEGASYS/COPEGUS 100 mg e NRTIs devem ser cuidadosamente monitorizados quanto a toxicidades associadas ao tratamento. Os médicos devem consultar as informações de prescrição dos respectivos NRTIs para orientação sobre o manejo da toxicidade. Além disso, a redução da dose ou a descontinuação de PEGASYS, COPEGUS 100mg ou ambos também devem ser consideradas se forem observadas toxicidades agravadas, incluindo descompensação hepática (por exemplo, Child-Pugh maior ou igual a 6) [ver AVISOS E PRECAUÇÕES e DOSAGEM E ADMINISTRAÇÃO ].
Didanosina
A coadministração de COPEGUS e didanosina é contraindicada. As concentrações de didanosina ou do seu metabolito ativo (didesoxiadenosina 5'-trifosfato) aumentam quando a didanosina é coadministrada com ribavirina, o que pode causar ou agravar toxicidades clínicas. Relatos de insuficiência hepática fatal, bem como neuropatia periférica, pancreatite e hiperlactatemia sintomática/acidose lática foram relatados em ensaios clínicos [ver CONTRA-INDICAÇÕES ].
Zidovudina
No Estudo NR15961, os pacientes que receberam zidovudina em combinação com PEGASYS/COPEGUS desenvolveram neutropenia grave (CAN inferior a 500) e anemia grave (hemoglobina inferior a 8 g/dL) com mais frequência do que pacientes semelhantes que não receberam zidovudina (neutropenia 15% vs. 9%) (anemia 5% vs. 1%). A descontinuação da zidovudina deve ser considerada clinicamente apropriada.
Fármacos Metabolizados Pelo Citocromo P450
Estudos in vitro indicam que a ribavirina não inibe CYP 2C9, CYP 2C19, CYP 2D6 ou CYP 3A4.
Azatioprina
Foi relatado que o uso de ribavirina para tratar hepatite C crônica em pacientes recebendo azatioprina induz pancitopenia grave e pode aumentar o risco de mielotoxicidade relacionada à azatioprina. A inosina monofosfato desidrogenase (IMDH) é necessária para uma das vias metabólicas da azatioprina. A ribavirina é conhecida por inibir a IMDH, levando ao acúmulo de um metabólito da azatioprina, monofosfato de 6-metiltioinosina (6-MTITP), que está associado à mielotoxicidade (neutropenia, trombocitopenia e anemia). Os pacientes que recebem azatioprina com ribavirina devem ter hemogramas completos, incluindo contagem de plaquetas, monitorados semanalmente no primeiro mês, duas vezes ao mês no segundo e terceiro meses de tratamento e, em seguida, mensalmente ou com mais frequência, se a dosagem ou outras alterações na terapia forem necessárias. AVISOS E PRECAUÇÕES ].
AVISOS
Incluído como parte do PRECAUÇÕES seção.
PRECAUÇÕES
As reações adversas significativas associadas à terapia combinada com COPEGUS/PEGASYS incluem depressão grave e ideação suicida, anemia hemolítica, supressão da função da medula óssea, distúrbios autoimunes e infecciosos, distúrbios oftalmológicos, distúrbios cerebrovasculares, disfunção pulmonar, colite, pancreatite e diabetes.
O Folheto Informativo do PEGASYS deve ser revisto em sua totalidade para obter informações de segurança adicionais antes do início do tratamento combinado.
Gravidez
COPEGUS 100mg pode causar defeitos congênitos e/ou morte do feto exposto. A ribavirina demonstrou efeitos teratogênicos e/ou embriocidas significativos em todas as espécies animais nas quais foram realizados estudos adequados. Esses efeitos ocorreram em doses tão baixas quanto um vigésimo da dose humana recomendada de ribavirina.
A terapia com COPEGUS não deve ser iniciada a menos que um relatório de um teste de gravidez negativo tenha sido obtido imediatamente antes do início planejado da terapia. Extremo cuidado deve ser tomado para evitar a gravidez em pacientes do sexo feminino e em parceiras de pacientes do sexo masculino. As pacientes devem ser instruídas a usar pelo menos duas formas de contracepção eficazes durante o tratamento e por 6 meses após a interrupção do tratamento. O teste de gravidez deve ocorrer mensalmente durante a terapia com COPEGUS 100mg e por 6 meses após a interrupção da terapia [ver AVISO EM CAIXA , CONTRA-INDICAÇÕES , Uso em populações específicas , e INFORMAÇÃO DO PACIENTE ].
Anemia
toxicidade primária da ribavirina é a anemia hemolítica, que foi observada em aproximadamente 13% de todos os indivíduos tratados com COPEGUS/PEGASYS em ensaios clínicos. A anemia associada a COPEGUS 100mg ocorre dentro de 1 a 2 semanas após o início da terapia. Como a queda inicial na hemoglobina pode ser significativa, é aconselhável que a hemoglobina ou o hematócrito sejam obtidos antes do tratamento e na semana 2 e na semana 4 de terapia ou com mais frequência, se clinicamente indicado. Os pacientes devem então ser acompanhados conforme clinicamente apropriado. Deve-se ter cautela ao iniciar o tratamento em qualquer paciente com risco basal de anemia grave (p. DOSAGEM E ADMINISTRAÇÃO ].
Infartos do miocárdio fatais e não fatais foram relatados em pacientes com anemia causada por COPEGUS. Os pacientes devem ser avaliados para doença cardíaca subjacente antes do início da terapia com ribavirina. Pacientes com doença cardíaca pré-existente devem realizar eletrocardiogramas antes do tratamento e devem ser monitorados adequadamente durante a terapia. Se houver qualquer deterioração do estado cardiovascular, a terapia deve ser suspensa ou descontinuada [ver DOSAGEM E ADMINISTRAÇÃO ]. Como a doença cardíaca pode ser agravada pela anemia induzida por drogas, pacientes com história de doença cardíaca significativa ou instável não devem usar COPEGUS [ver AVISO EM CAIXA e DOSAGEM E ADMINISTRAÇÃO ].
Insuficiência Hepática
Pacientes com hepatite C crônica (CHC) com cirrose podem estar em risco de descompensação hepática e morte quando tratados com interferons alfa, incluindo PEGASYS. Pacientes com CHC cirrótico coinfectados com HIV recebendo terapia antirretroviral altamente ativa (HAART) e interferon alfa-2a com ou sem ribavirina parecem ter risco aumentado para o desenvolvimento de descompensação hepática em comparação com pacientes que não recebem HAART. No Estudo NR15961 [ver Estudos clínicos ], entre 129 pacientes cirróticos CHC/HIV recebendo HAART, 14 (11%) desses pacientes em todos os braços de tratamento desenvolveram descompensação hepática resultando em 6 mortes. Todos os 14 pacientes estavam em uso de NRTIs, incluindo estavudina, didanosina, abacavir, zidovudina e lamivudina. Este pequeno número de pacientes não permite a discriminação entre ITRNs específicos ou o risco associado. Durante o tratamento, o estado clínico e a função hepática dos pacientes devem ser monitorados de perto quanto a sinais e sintomas de descompensação hepática. O tratamento com PEGASYS/COPEGUS 100mg deve ser descontinuado imediatamente em pacientes com descompensação hepática [ver CONTRA-INDICAÇÕES ].
Hipersensibilidade
Reações graves de hipersensibilidade aguda (por exemplo, urticária, angioedema, broncoconstrição e anafilaxia) foram observadas durante a terapia com interferon alfa e ribavirina. Se tal reação ocorrer, a terapia com PEGASYS e COPEGUS 100mg deve ser descontinuada imediatamente e a terapia médica apropriada instituída. Reações cutâneas graves, incluindo erupções vesiculobolhosas, reações no espectro da Síndrome de Stevens-Johnson (eritema multiforme maior) com vários graus de envolvimento da pele e das mucosas e dermatite esfoliativa (eritrodermia) foram relatadas em pacientes recebendo PEGASYS com e sem ribavirina. Pacientes que desenvolvem sinais ou sintomas de reações cutâneas graves devem descontinuar o tratamento [ver REAÇÕES ADVERSAS ].
Distúrbios Pulmonares
Dispneia, infiltrados pulmonares, pneumonite, hipertensão pulmonar e pneumonia foram relatados durante a terapia com ribavirina e interferon. Casos ocasionais de pneumonia fatal ocorreram. Além disso, foi relatada sarcoidose ou exacerbação da sarcoidose. Se houver evidência de infiltrados pulmonares ou comprometimento da função pulmonar, os pacientes devem ser monitorados de perto e, se apropriado, o tratamento combinado com COPEGUS/PEGASYS deve ser descontinuado.
Supressão da Medula Óssea
Pancitopenia (diminuição acentuada dos eritrócitos, neutrófilos e plaquetas) e supressão da medula óssea foram relatadas na literatura como ocorrendo dentro de 3 a 7 semanas após a administração concomitante de interferon peguilado/ribavirina e azatioprina. Neste número limitado de pacientes (n=8), a mielotoxicidade foi reversível dentro de 4 a 6 semanas após a retirada da terapia antiviral para HCV e azatioprina concomitante e não houve recorrência após a reintrodução de qualquer tratamento isolado. PEGASYS, COPEGUS 100mg e azatioprina devem ser descontinuados por pancitopenia, e interferon peguilado/ribavirina não deve ser reintroduzido com azatioprina concomitante [ver INTERAÇÕES MEDICAMENTOSAS ].
Pancreatite
A terapia com COPEGUS e PEGASYS deve ser suspensa em pacientes com sinais e sintomas de pancreatite e descontinuada em pacientes com pancreatite confirmada.
Impacto no crescimento em pacientes pediátricos
Durante a terapia combinada por até 48 semanas com PEGASYS mais ribavirina, foi observada inibição do crescimento em pacientes pediátricos de 5 a 17 anos de idade. Foram observadas diminuições no peso para o escore z de idade e na altura para o escore z de idade até 48 semanas de terapia em comparação com a linha de base. Aos 2 anos após o tratamento, 16% dos pacientes pediátricos estavam mais de 15 percentis abaixo de sua curva de peso basal e 11% estavam mais de 15 percentis abaixo de sua curva de altura basal.
Os dados disponíveis de longo prazo em indivíduos que foram acompanhados até 6 anos após o tratamento são muito limitados para determinar o risco de redução da altura adulta em alguns pacientes [ver Experiência em Estudos Clínicos ].
Testes laboratoriais
Antes de iniciar a terapia combinada PEGASYS/COPEGUS, são recomendados testes laboratoriais hematológicos e bioquímicos padrão para todos os pacientes. A triagem de gravidez para mulheres com potencial para engravidar deve ser realizada. Pacientes com anormalidades cardíacas pré-existentes devem realizar eletrocardiogramas antes do tratamento com PEGASYS/COPEGUS.
Após o início da terapia, os testes hematológicos devem ser realizados em 2 semanas e 4 semanas e os testes bioquímicos devem ser realizados em 4 semanas. Testes adicionais devem ser realizados periodicamente durante a terapia. Em estudos clínicos em adultos, o hemograma completo (incluindo nível de hemoglobina e contagem de glóbulos brancos e plaquetas) e os químicos (incluindo testes de função hepática e ácido úrico) foram medidos em 1, 2, 4, 6 e 8 semanas e, em seguida, a cada 4 a 6 semanas ou mais frequentemente se forem encontradas anormalidades. No ensaio clínico pediátrico, as avaliações hematológicas e químicas foram em 1, 3, 5 e 8 semanas, depois a cada 4 semanas. O hormônio estimulante da tireóide (TSH) foi medido a cada 12 semanas. O teste de gravidez mensal deve ser realizado durante a terapia combinada e por 6 meses após a descontinuação da terapia.
Os critérios de entrada usados para os estudos clínicos de COPEGUS 100mg e PEGASYS podem ser considerados como uma diretriz para valores basais aceitáveis para o início do tratamento:
- Contagem de plaquetas maior ou igual a 90.000 células/mm³ (até 75.000 células/mm³ em pacientes com HCV com cirrose ou 70.000 células/mm³ em pacientes com CHC e HIV)
- Contagem absoluta de neutrófilos (ANC) maior ou igual a 1500 células/mm³
- TSH e T4 dentro dos limites normais ou função tireoidiana adequadamente controlada
- Contagem de células CD4+ maior ou igual a 200 células/mm³ ou contagem de células CD4+ maior ou igual a 100 células/mm³ mas menor que 200 células/mm³ e RNA HIV-1 menor que 5.000 cópias/mL em pacientes coinfectados com HIV
- Hemoglobina maior ou igual a 12 g/dL para mulheres e maior ou igual a 13 g/dL para homens em pacientes monoinfectados com CHC
- Hemoglobina maior ou igual a 11 g/dL para mulheres e maior ou igual a 12 g/dL para homens em pacientes com CHC e HIV
Informações de Aconselhamento do Paciente
- Ver Rotulagem do paciente aprovada pela FDA (Guia de Medicação)
Gravidez
Os pacientes devem ser informados de que a ribavirina pode causar defeitos congênitos e/ou morte do feto exposto. A terapia com COPEGUS 100mg não deve ser usada por mulheres grávidas ou por homens cujas parceiras estejam grávidas. Deve-se ter extremo cuidado para evitar a gravidez em pacientes do sexo feminino e em parceiras de pacientes do sexo masculino em tratamento com COPEGUS e por 6 meses após a terapia. Os pacientes devem usar dois métodos confiáveis de controle de natalidade durante o tratamento com COPEGUS e por 6 meses após a terapia. A terapia com COPEGUS não deve ser iniciada até que um relatório de um teste de gravidez negativo tenha sido obtido imediatamente antes do início da terapia. Os pacientes devem realizar um teste de gravidez mensalmente durante a terapia e por 6 meses após a terapia.
Pacientes do sexo feminino com potencial para engravidar e pacientes do sexo masculino com parceiras com potencial para engravidar devem ser avisados sobre os riscos teratogênicos/embriocidas e devem ser instruídos a praticar contracepção eficaz durante a terapia com COPEGUS e por 6 meses após a terapia. As pacientes devem ser aconselhadas a notificar imediatamente o profissional de saúde em caso de gravidez [ver CONTRA-INDICAÇÕES e AVISOS E PRECAUÇÕES ].
Anemia
O evento adverso mais comum associado à ribavirina é a anemia, que pode ser grave [ver AVISO EM CAIXA , AVISOS E PRECAUÇÕES e REAÇÕES ADVERSAS ]. Os pacientes devem ser informados de que são necessárias avaliações laboratoriais antes de iniciar a terapia com COPEGUS e periodicamente depois disso [ver AVISOS E PRECAUÇÕES ]. É aconselhável que os pacientes estejam bem hidratados, especialmente durante as fases iniciais do tratamento.
Pacientes que desenvolvem tontura, confusão, sonolência e fadiga devem ser advertidos para evitar dirigir ou operar máquinas.
Os doentes devem ser aconselhados a tomar COPEGUS 100 mg com alimentos.
Os pacientes devem ser questionados sobre história prévia de abuso de drogas antes de iniciar COPEGUS/PEGASYS, pois foram relatadas recaídas de dependência de drogas e overdoses de drogas em pacientes tratados com interferons.
Os pacientes devem ser aconselhados a não ingerir bebidas alcoólicas, pois o álcool pode exacerbar a infecção crônica por hepatite C.
Os pacientes devem ser informados sobre o que fazer caso percam uma dose de COPEGUS. As doses esquecidas devem ser tomadas o mais rápido possível durante o mesmo dia. Os doentes não devem duplicar a dose seguinte. Os pacientes devem ser aconselhados a ligar para seu médico se tiverem dúvidas.
Os pacientes devem ser informados de que o efeito do tratamento com PEGASYS/COPEGUS da infecção por hepatite C na transmissão não é conhecido e que devem ser tomadas as precauções apropriadas para prevenir a transmissão do vírus da hepatite C durante o tratamento ou em caso de falha do tratamento.
Os pacientes devem ser informados sobre os potenciais benefícios e riscos associados ao uso de COPEGUS. Devem ser fornecidas instruções sobre o uso apropriado, incluindo a revisão do conteúdo do GUIA DE MEDICAÇÃO , que não é uma divulgação de todos ou possíveis efeitos adversos.
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Carcinogênese
Em um estudo de carcinogenicidade em camundongos p53 (+/-) até a dose máxima tolerada de 100 mg/kg/dia, a ribavirina não foi oncogênica. A ribavirina também não foi oncogênica em um estudo de carcinogenicidade de 2 anos em ratos com doses até a dose máxima tolerada de 60 mg/kg/dia. Com base na área de superfície corporal, essas doses são aproximadamente 0,5 e 0,6 vezes a dose humana diária máxima recomendada de ribavirina, respectivamente.
Mutagênese
ribavirina demonstrou atividade mutagênica no ensaio in vitro de linfoma de camundongo. Nenhuma atividade clastogênica foi observada em um ensaio de micronúcleo de camundongo in vivo em doses de até 2.000 mg/kg. No entanto, resultados de estudos publicados na literatura mostram atividade clastogênica no ensaio de micronúcleo de camundongo in vivo em doses orais de até 2.000 mg/kg. Um ensaio letal dominante em ratos foi negativo, indicando que, se as mutações ocorreram em ratos, elas não foram transmitidas através de gametas masculinos.
Prejuízo da Fertilidade
Em um estudo de fertilidade em ratos, a ribavirina mostrou uma redução marginal na contagem de espermatozóides na dose de 100 mg/kg/dia sem efeito sobre a fertilidade. Após a interrupção do tratamento, a recuperação total ocorreu após 1 ciclo de espermatogênese. Anormalidades no esperma foram observadas em estudos em camundongos projetados para avaliar o curso de tempo e a reversibilidade da degeneração testicular induzida pela ribavirina em doses de 15 a 150 mg/kg/dia (aproximadamente 0,1 a 0,8 vezes a dose humana diária máxima recomendada de ribavirina) administradas por 3 a 6 meses. Após a interrupção do tratamento, a recuperação essencialmente total da toxicidade testicular induzida pela ribavirina foi aparente em 1 ou 2 ciclos espermatogênicos.
Pacientes do sexo feminino com potencial para engravidar e pacientes do sexo masculino com parceiras com potencial para engravidar não devem receber COPEGUS a menos que o paciente e seu parceiro estejam usando métodos contraceptivos eficazes (duas formas confiáveis). Com base em uma meia-vida de dose múltipla (t½) de ribavirina de 12 dias, a contracepção eficaz deve ser utilizada por 6 meses após a terapia (ou seja, 15 meias-vidas de depuração da ribavirina).
Não foram realizados estudos de toxicologia reprodutiva com PEGASYS em combinação com COPEGUS. No entanto, peginterferon alfa-2a e ribavirina quando administrados separadamente, cada um tem efeitos adversos na reprodução. Deve-se supor que os efeitos produzidos por qualquer agente sozinho também seriam causados pela combinação dos dois agentes.
Uso em populações específicas
Gravidez
Categoria X [Vejo CONTRA-INDICAÇÕES ]. A ribavirina produziu efeitos embriocidas e/ou teratogénicos significativos em todas as espécies animais nas quais foram realizados estudos adequados. Foram observadas malformações do crânio, palato, olho, mandíbula, membros, esqueleto e trato gastrointestinal. A incidência e a gravidade dos efeitos teratogênicos aumentaram com o aumento da dose do fármaco. A sobrevivência de fetos e descendentes foi reduzida [ver CONTRA-INDICAÇÕES e AVISOS E PRECAUÇÕES ].
Em estudos convencionais de embriotoxicidade/teratogenicidade em ratos e coelhos, os níveis de dose sem efeito observados foram bem abaixo daqueles para uso clínico proposto (0,3 mg/kg/dia para ratos e coelhos; aproximadamente 0,06 vezes a dose humana diária recomendada de ribavirina) . Nenhuma toxicidade materna ou efeitos na prole foram observados em um estudo de toxicidade peri/pós-natal em ratos com doses oralmente de até 1 mg/kg/dia (aproximadamente 0,01 vezes a dose humana máxima diária recomendada de ribavirina).
Tratamento e pós-tratamento: risco potencial para o feto
ribavirina é conhecida por se acumular em componentes intracelulares de onde é eliminada muito lentamente. Não se sabe se a ribavirina está contida no esperma e, em caso afirmativo, exercerá um potencial efeito teratogênico na fertilização dos óvulos. No entanto, devido aos potenciais efeitos teratogénicos humanos da ribavirina, os doentes do sexo masculino devem ser aconselhados a tomar todas as precauções para evitar o risco de gravidez para as suas parceiras.
COPEGUS não deve ser utilizado por mulheres grávidas ou por homens cujas parceiras estejam grávidas. Pacientes do sexo feminino com potencial para engravidar e pacientes do sexo masculino com parceiras com potencial para engravidar não devem receber COPEGUS a menos que o paciente e seu parceiro estejam usando contracepção eficaz (duas formas confiáveis) durante a terapia e por 6 meses após a terapia [ver CONTRA-INDICAÇÕES ].
Registro de Gravidez Ribavirina
Um Registro de Gravidez Ribavirina foi estabelecido para monitorar os resultados materno-fetais de gestações de pacientes do sexo feminino e parceiras de pacientes do sexo masculino expostos à ribavirina durante o tratamento e por 6 meses após a interrupção do tratamento. Os profissionais de saúde e os pacientes são incentivados a relatar esses casos ligando para 1-800-593-2214.
Mães que amamentam
Não se sabe se a ribavirina é excretada no leite humano. Como muitos medicamentos são excretados no leite humano e para evitar qualquer potencial de reações adversas graves em lactentes devido à ribavirina, deve-se decidir entre descontinuar a amamentação ou a terapia com COPEGUS 100mg, com base na importância da terapia para a mãe.
Uso Pediátrico
Não foram realizadas avaliações farmacocinéticas em pacientes pediátricos.
A segurança e a eficácia de COPEGUS não foram estabelecidas em pacientes com idade inferior a 5 anos.
Uso Geriátrico
Os estudos clínicos de COPEGUS 100 mg e PEGASYS não incluíram um número suficiente de indivíduos com 65 anos ou mais para determinar se respondem de forma diferente dos indivíduos mais jovens. Não foram realizadas avaliações farmacocinéticas específicas da ribavirina em idosos. O risco de reações tóxicas a este medicamento pode ser maior em pacientes com função renal comprometida. A dose de COPEGUS 100mg deve ser reduzida em pacientes com clearance de creatinina menor ou igual a 50 mL/min; e a dose de PEGASYS deve ser reduzida em pacientes com clearance de creatinina menor que 30 mL/min [ver DOSAGEM E ADMINISTRAÇÃO ; Uso em populações específicas ].
Corrida
Um estudo farmacocinético em 42 indivíduos demonstrou que não há diferença clinicamente significativa na farmacocinética da ribavirina entre indivíduos negros (n=14), hispânicos (n=13) e caucasianos (n=15).
Insuficiência renal
A função renal deve ser avaliada em todos os pacientes antes do início do COPEGUS, estimando a depuração de creatinina do paciente.
Um ensaio clínico avaliou o tratamento com COPEGUS e PEGASYS em 50 indivíduos CHC com insuficiência renal moderada (clearance de creatinina 30 – 50 mL/min) ou grave (clearance de creatinina inferior a 30 mL/min) ou doença renal terminal (ESRD) que requer hemodiálise crônica (HD). Em 18 indivíduos com insuficiência renal terminal recebendo HD crônica, COPEGUS foi administrado na dose de 200 mg por dia, sem diferença aparente no perfil de eventos adversos em comparação com indivíduos com função renal normal. Reduções de dose e interrupções temporárias de COPEGUS (devido a reações adversas relacionadas a COPEGUS, principalmente anemia) foram observadas em até um terço dos indivíduos com ESRD/HD durante o tratamento; e apenas um terço desses indivíduos recebeu COPEGUS por 48 semanas. As exposições plasmáticas da ribavirina foram aproximadamente 20% menores em indivíduos com insuficiência renal terminal em HD em comparação com indivíduos com função renal normal recebendo a dose diária padrão de 1000/1200 mg de COPEGUS.
Indivíduos com insuficiência renal moderada (n=17) ou grave (n=14) não toleraram doses diárias de 600 mg ou 400 mg de COPEGUS, respectivamente, devido a reações adversas relacionadas ao COPEGUS, principalmente anemia, e exibiram 20% a 30% exposições plasmáticas de ribavirina mais elevadas (apesar de modificações frequentes da dose) em comparação com indivíduos com função renal normal (clearance de creatinina superior a 80 mL/min) recebendo a dose padrão de COPEGUS. As taxas de descontinuação foram maiores em indivíduos com insuficiência renal grave em comparação com as observadas em indivíduos com insuficiência renal moderada ou função renal normal. A modelagem e simulação farmacocinética indicam que uma dose de 200 mg por dia em pacientes com insuficiência renal grave e uma dose de 200 mg por dia alternando com 400 mg no dia seguinte em pacientes com insuficiência renal moderada fornecerá exposição plasmática à ribavirina semelhante a pacientes com função renal normal recebendo o regime aprovado de COPEGUS. Essas doses não foram estudadas em pacientes [ver DOSAGEM E ADMINISTRAÇÃO e FARMACOLOGIA CLÍNICA ].
Com base nos resultados farmacocinéticos e de segurança deste estudo, pacientes com depuração de creatinina menor ou igual a 50 mL/min devem receber uma dose reduzida de COPEGUS; e pacientes com clearance de creatinina menor que 30 mL/min devem receber uma dose reduzida de PEGASYS. O estado clínico e hematológico de pacientes com clearance de creatinina menor ou igual a 50 mL/min recebendo COPEGUS 100mg deve ser cuidadosamente monitorado. Pacientes com anormalidades laboratoriais clinicamente significativas ou reações adversas que são persistentemente graves ou que pioram devem ter a terapia suspensa [ver DOSAGEM E ADMINISTRAÇÃO , FARMACOLOGIA CLÍNICA , e Folheto do Pacote PEGASYS ].
Insuficiência hepática
O efeito da insuficiência hepática na farmacocinética da ribavirina após a administração de COPEGUS não foi avaliado. Os ensaios clínicos de COPEGUS 100mg foram restritos a pacientes com doença Child-Pugh classe A.
Gênero
Não foram observadas diferenças clinicamente significativas na farmacocinética da ribavirina entre indivíduos do sexo masculino e feminino.
farmacocinética da ribavirina, quando corrigida pelo peso, é semelhante em pacientes do sexo masculino e feminino.
Destinatários de Transplante de Órgãos
A segurança e eficácia do tratamento com PEGASYS e COPEGUS 100mg não foram estabelecidas em pacientes com transplantes de fígado e outros. Assim como com outros interferons alfa, foram relatadas rejeições de enxertos renais e hepáticos com PEGASYS, isoladamente ou em combinação com COPEGUS [ver REAÇÕES ADVERSAS ].
SOBREDOSAGEM
Não foram notificados casos de sobredosagem com COPEGUS em ensaios clínicos. Hipocalcemia e hipomagnesemia foram observadas em pessoas que receberam doses maiores que a recomendada de ribavirina. Na maioria destes casos, a ribavirina foi administrada por via intravenosa em doses até e em alguns casos superiores a quatro vezes a dose oral diária máxima recomendada.
CONTRA-INDICAÇÕES
COPEGUS (ribavirina) é contraindicado em:
- Mulheres que estão grávidas. COPEGUS pode causar danos ao feto quando administrado a mulheres grávidas. COPEGUS é contraindicado em mulheres grávidas ou que possam vir a engravidar. Se este medicamento for usado durante a gravidez, ou se a paciente engravidar enquanto estiver tomando este medicamento, a paciente deve ser informada do risco potencial para o feto [ver AVISOS E PRECAUÇÕES , Uso em populações específicas , e INFORMAÇÃO DO PACIENTE ].
- Homens cujas parceiras estão grávidas.
- Pacientes com hemoglobinopatias (por exemplo, talassemia maior ou anemia falciforme).
- Em combinação com didanosina. Relatos de insuficiência hepática fatal, bem como neuropatia periférica, pancreatite e hiperlactatemia sintomática/acidose lática foram relatados em ensaios clínicos [ver INTERAÇÕES MEDICAMENTOSAS ].
A terapia combinada de COPEGUS e PEGASYS é contraindicada em pacientes com:
- Hepatite autoimune.
- Descompensação hepática (escore de Child-Pugh maior que 6; classe B e C) em pacientes cirróticos monoinfectados com CHC antes do tratamento [ver AVISOS E PRECAUÇÕES ].
- Descompensação hepática (pontuação de Child-Pugh maior ou igual a 6) em pacientes cirróticos com CHC coinfectados com HIV antes do tratamento [ver AVISOS E PRECAUÇÕES ].
FARMACOLOGIA CLÍNICA
Mecanismo de ação
A ribavirina é um medicamento antiviral [ver Microbiologia ].
Farmacocinética
Estão disponíveis dados farmacocinéticos de dose múltipla de ribavirina para doentes com VHC que receberam ribavirina em combinação com peginterferão alfa-2a. Após a administração de 1200 mg/dia com alimentos durante 12 semanas, média±DP (n=39; peso corporal superior a 75 kg), a AUC0-12h foi de 25.361±7110 ng·h/mL e a Cmax foi de 2748±818 ng/mL. O tempo médio para atingir a Cmax foi de 2 horas. As concentrações plasmáticas mínimas de ribavirina após 12 semanas de dosagem com alimentos foram 1662±545 ng/mL em pacientes infectados pelo HCV que receberam 800 mg/dia (n=89), e 2112±810 ng/mL em pacientes que receberam 1200 mg/dia ( n=75; peso corporal superior a 75 kg).
meia-vida terminal da ribavirina após a administração de uma dose oral única de COPEGUS é de cerca de 120 a 170 horas. A depuração aparente total após a administração de uma dose oral única de COPEGUS 100mg é de cerca de 26 L/h. Existe uma extensa acumulação de ribavirina após a administração de doses múltiplas (duas vezes por dia) de tal forma que a Cmax no estado estacionário foi quatro vezes superior à de uma dose única.
Efeito dos Alimentos na Absorção da Ribavirina
A biodisponibilidade de uma dose oral única de ribavirina foi aumentada pela coadministração com uma refeição rica em gordura. A absorção foi retardada (Tmax foi duplicada) e a AUC0-192h e Cmax aumentaram 42% e 66%, respectivamente, quando COPEGUS foi tomado com uma refeição rica em gordura em comparação com condições de jejum [ver DOSAGEM E ADMINISTRAÇÃO e INFORMAÇÃO DO PACIENTE ].
Eliminação e Metabolismo
A contribuição das vias renal e hepática para a eliminação da ribavirina após a administração de COPEGUS 100mg não é conhecida. Estudos in vitro indicam que a ribavirina não é um substrato das enzimas CYP450.
Insuficiência renal
Um ensaio clínico avaliou 50 indivíduos com CHC com insuficiência renal moderada (clearance de creatinina 30 a 50 mL/min) ou grave (clearance de creatinina inferior a 30 mL/min) ou doença renal terminal (ESRD) que requer hemodiálise crônica (HD). A depuração aparente da ribavirina foi reduzida em indivíduos com depuração de creatinina menor ou igual a 50 mL/min, incluindo indivíduos com DRT em HD, exibindo aproximadamente 30% do valor encontrado em indivíduos com função renal normal. A modelagem e simulação farmacocinética indicam que uma dose de 200 mg por dia em pacientes com insuficiência renal grave e uma dose de 200 mg por dia alternada com 400 mg no dia seguinte em pacientes com insuficiência renal moderada fornecerá exposições plasmáticas à ribavirina semelhantes às observadas em pacientes com função renal normal recebendo a dose diária padrão de 1000/1200 mg de COPEGUS. Estas doses não foram estudadas em pacientes.
Em 18 indivíduos com insuficiência renal terminal recebendo HD crônica, COPEGUS foi administrado na dose de 200 mg por dia. As exposições plasmáticas da ribavirina nesses indivíduos foram aproximadamente 20% menores em comparação com indivíduos com função renal normal recebendo a dose diária padrão de 1000/1200 mg de COPEGUS [ver DOSAGEM E ADMINISTRAÇÃO , Uso em populações específicas ].
A ribavirina plasmática é removida por hemodiálise com uma taxa de extração de aproximadamente 50%; no entanto, devido ao grande volume de distribuição da ribavirina, não se espera que a exposição plasmática mude com a hemodiálise.
Microbiologia
Mecanismo de ação
O mecanismo pelo qual a ribavirina contribui para sua eficácia antiviral na clínica não é totalmente compreendido. A ribavirina tem atividade antiviral direta na cultura de tecidos contra muitos vírus de RNA. A ribavirina aumenta a frequência de mutação nos genomas de vários vírus de RNA e o trifosfato de ribavirina inibe a polimerase do HCV em uma reação bioquímica.
Atividade antiviral em cultura celular
No sistema modelo de cultura de células de HCV estável (replicão de HCV), a ribavirina inibiu a replicação autônoma de RNA de HCV com um valor de concentração efetiva de 50% (EC50) de 11-21 mcM. No mesmo modelo, o PEG-IFN α-2a também inibiu a replicação do RNA do HCV, com um valor de EC50 de 0,1-3 ng/mL. A combinação de PEG-IFN α-2a e ribavirina foi mais eficaz na inibição da replicação do RNA do HCV do que qualquer agente sozinho.
Resistência
Diferentes genótipos de HCV apresentam variabilidade clínica considerável em sua resposta à terapia com PEG-IFN-α e ribavirina. Os determinantes genéticos virais associados à resposta variável não foram definitivamente identificados.
Resistência cruzada
Não foi observada resistência cruzada entre IFNα e ribavirina.
Toxicologia Animal
Em um estudo em ratos, concluiu-se que a letalidade dominante não foi induzida pela ribavirina em doses de até 200 mg/kg por 5 dias (até 1,7 vezes a dose humana máxima recomendada de ribavirina).
Estudos de longo prazo em camundongos e ratos (18 a 24 meses; dose de 20 a 75 e 10 a 40 mg/kg/dia, respectivamente, aproximadamente 0,1 a 0,4 vezes a dose máxima diária humana de ribavirina) demonstraram uma relação entre exposição crônica à ribavirina e aumento da incidência de lesões vasculares (hemorragias microscópicas) em camundongos. Em ratos, a degeneração da retina ocorreu em controles, mas a incidência foi aumentada em ratos tratados com ribavirina.
Estudos clínicos
Pacientes com hepatite C crônica
Pacientes adultos
A segurança e eficácia de PEGASYS em combinação com COPEGUS para o tratamento da infecção pelo vírus da hepatite C foram avaliadas em dois ensaios clínicos controlados aleatorizados. Todos os pacientes eram adultos, apresentavam doença hepática compensada, vírus da hepatite C detectável, biópsia hepática com diagnóstico de hepatite crônica e não haviam sido previamente tratados com interferon. Aproximadamente 20% dos pacientes em ambos os estudos tinham cirrose compensada (Child-Pugh classe A). Pacientes coinfectados com HIV foram excluídos desses estudos.
No estudo NV15801, os pacientes foram randomizados para receber PEGASYS 180 mcg subcutâneo uma vez por semana com placebo oral, PEGASYS 180 mcg uma vez por semana com COPEGUS 1000 mg por via oral (peso corporal inferior a 75 kg) ou 1200 mg por via oral (peso corporal superior a ou igual a 75 kg) ou interferão alfa-2b 3 MUI subcutâneo três vezes por semana mais ribavirina 1000 mg ou 1200 mg por via oral. Todos os pacientes receberam 48 semanas de terapia seguidas de 24 semanas de acompanhamento sem tratamento. A atribuição de tratamento COPEGUS ou placebo foi cega. A resposta virológica sustentada foi definida como RNA de HCV indetectável (menos de 50 UI/mL) na ou após a semana 68 do estudo. PEGASYS em combinação com COPEGUS 100mg resultou em uma RVS mais alta em comparação com PEGASYS sozinho ou interferon alfa-2b e ribavirina (Tabela 9) . Em todos os braços de tratamento, os doentes com genótipo 1 viral, independentemente da carga viral, tiveram uma taxa de resposta mais baixa ao PEGASYS em combinação com COPEGUS 100 mg em comparação com doentes com outros genótipos virais.
diferença na resposta global ao tratamento (PEGASYS/COPEGUS – Interferão alfa-2b/ribavirina) foi de 9% (IC 95% 2,3, 15,3).
No estudo NV15942, todos os pacientes receberam PEGASYS 180 mcg subcutâneo uma vez por semana e foram randomizados para tratamento por 24 ou 48 semanas e para uma dose de COPEGUS de 800 mg ou 1000 mg/1200 mg (para peso corporal inferior a 75 kg/superior a ou igual a 75 kg). A atribuição aos quatro braços de tratamento foi estratificada por genótipo viral e título viral de HCV de linha de base. Pacientes com genótipo 1 e título viral alto (definido como maior que 2 x 106 cópias de RNA do HCV/mL de soro) foram preferencialmente designados para tratamento por 48 semanas.
Resposta Virológica Sustentada (SVR) e Genótipo de HCV
HCV 1 e 4 — Independentemente do título viral inicial, o tratamento por 48 semanas com PEGASYS e 1.000 mg ou 1.200 mg de COPEGUS resultou em RVS mais alta (definida como RNA do HCV indetectável no final do período de acompanhamento de 24 semanas sem tratamento) em comparação com o tratamento mais curto (24 semanas) e/ou 800 mg de COPEGUS.
HCV 2 e 3 — Independentemente do título viral inicial, o tratamento por 24 semanas com PEGASYS e 800 mg de COPEGUS resultou em uma RVS semelhante em comparação com um tratamento mais longo (48 semanas) e/ou 1.000 mg ou 1.200 mg de COPEGUS (ver Tabela 10).
O número de pacientes com genótipo 5 e 6 era muito pequeno para permitir uma avaliação significativa.
Pacientes pediátricos
Indivíduos pediátricos não tratados anteriormente de 5 a 17 anos de idade (55% menos de 12 anos) com hepatite C crônica, doença hepática compensada e RNA do HCV detectável foram tratados com COPEGUS 100mg aproximadamente 15 mg/kg/dia mais PEGASYS 180 mcg/1,73 m² x área de superfície corporal uma vez por semana durante 48 semanas. Todos os indivíduos foram acompanhados por 24 semanas pós-tratamento. A resposta virológica sustentada (SVR) foi definida como RNA do HCV indetectável (menos de 50 UI/mL) na semana 68 do estudo ou após. Um total de 114 indivíduos foram randomizados para receber o tratamento combinado de COPEGUS mais PEGASYS ou monoterapia com PEGASYS; indivíduos que falharam em monoterapia com PEGASYS em 24 semanas ou mais tarde poderiam receber COPEGUS mais PEGASYS em rótulo aberto. Os braços randomizados iniciais foram balanceados para fatores demográficos; 55 indivíduos receberam tratamento inicial combinado de COPEGUS 100mg mais PEGASYS e 59 receberam PEGASYS mais placebo; na população geral com intenção de tratar, 45% eram do sexo feminino, 80% eram caucasianos e 81% estavam infectados com o genótipo 1 do HCV. Os resultados da RVS estão resumidos na Tabela 11.
Outros Preditores de Resposta ao Tratamento
As taxas de resposta ao tratamento são mais baixas em pacientes com fatores de mau prognóstico que recebem terapia com interferon alfa peguilado. Nos estudos NV15801 e NV15942, as taxas de resposta ao tratamento foram menores em pacientes com mais de 40 anos (50% vs. 66%), em pacientes com cirrose (47% vs. 59%), em pacientes com peso acima de 85 kg (49% vs. 60%), e em pacientes com genótipo 1 com carga viral alta vs. baixa (43% vs. 56%). Os pacientes afro-americanos tiveram taxas de resposta mais baixas em comparação com os caucasianos.
Nos estudos NV15801 e NV15942, a falta de resposta virológica precoce em 12 semanas (definida como HCV RNA indetectável ou superior a 2 log10 abaixo da linha de base) foi motivo para descontinuação do tratamento. Dos pacientes que não tiveram uma resposta viral precoce em 12 semanas e completaram um curso recomendado de terapia, apesar de uma opção definida pelo protocolo para descontinuar a terapia, 5/39 (13%) alcançaram uma RVS. Dos pacientes que não tiveram uma resposta viral precoce em 24 semanas, 19 completaram um curso completo de terapia e nenhum atingiu um SVR.
Pacientes Coinfectados com Hepatite C/HIV Crônica
No estudo NR15961, pacientes com CHC/HIV foram randomizados para receber PEGASYS 180 mcg subcutâneo uma vez por semana mais placebo oral, PEGASYS 180 mcg uma vez por semana mais COPEGUS 800 mg por via oral diariamente ou interferon alfa-2a, 3 MUI subcutâneo três vezes por semana mais COPEGUS 800 mg por via oral diariamente. Todos os pacientes receberam 48 semanas de terapia e a resposta virológica sustentada (SVR) foi avaliada em 24 semanas de acompanhamento sem tratamento. A atribuição de tratamento com COPEGUS 100 mg ou placebo foi cega nos braços de tratamento com PEGASYS. Todos os pacientes eram adultos, com doença hepática compensada, vírus da hepatite C detectável, biópsia hepática com diagnóstico de hepatite C crônica e não haviam sido previamente tratados com interferon. Os pacientes também tinham contagem de células CD4+ maior ou igual a 200 células/mm³ ou contagem de células CD4+ maior ou igual a 100 células/mm³ mas menor que 200 células/mm³ e RNA HIV-1 menor que 5.000 cópias/mL, e estado estável do HIV. Aproximadamente 15% dos pacientes no estudo tinham cirrose. Os resultados são mostrados na Tabela 12.
As taxas de resposta ao tratamento foram menores em pacientes com CHC/HIV com fatores de mau prognóstico (incluindo HCV genótipo 1, HCV RNA maior que 800.000 UI/mL e cirrose) recebendo terapia com interferon alfa peguilado.
Dos pacientes que não demonstraram RNA do VHC indetectável ou pelo menos uma redução de 2 log10 da linha de base no título de RNA do VHC em 12 semanas de terapia combinada com PEGASYS e COPEGUS, 2% (2/85) alcançaram uma RVS.
Em pacientes com CHC com coinfecção por HIV que receberam 48 semanas de PEGASYS sozinho ou em combinação com COPEGUS 100mg, os títulos médios e medianos de RNA HIV não aumentaram acima da linha de base durante o tratamento ou 24 semanas após o tratamento.
INFORMAÇÃO DO PACIENTE
COPEGUS® (Co-PEG-UHS) (ribavirina) Comprimidos
Leia atentamente este Guia de Medicação antes de começar a tomar COPEGUS 100mg e leia o Guia de Medicação sempre que tomar mais COPEGUS. Pode haver novas informações. Esta informação não substitui a conversa com seu médico sobre sua condição médica ou seu tratamento.
Leia também o Guia de Medicação para PEGASYS (peginterferon alfa-2a).
Qual é a informação mais importante que devo saber sobre a COPEGUS?
- As mulheres devem fazer um teste de gravidez antes de iniciar o COPEGUS, todos os meses durante o tratamento com COPEGUS 100mg e todos os meses durante os 6 meses após o tratamento com COPEGUS.
- Se você ou sua parceira sexual engravidar enquanto estiver a tomar COPEGUS 100 mg ou dentro de 6 meses após parar de tomar COPEGUS, informe o seu médico imediatamente. Você ou seu médico devem entrar em contato com o Registro de Gravidez Ribavirina ligando para 1-800-593-2214. O Registro de Gravidez Ribavirina coleta informações sobre o que acontece com as mães e seus bebês se a mãe tomar COPEGUS durante a gravidez.
O que é COPEGUS 100mg?
COPEGUS 100 mg é um medicamento sujeito a receita médica utilizado com outro medicamento denominado PEGASYS (peginterferão alfa-2a) para tratar a infecção crónica (duração prolongada) da hepatite C em pessoas com 5 anos ou mais cujo fígado ainda funciona normalmente e que não foram tratadas anteriormente com um medicamento chamado interferon alfa. Não se sabe se COPEGUS é seguro e funciona em crianças com menos de 5 anos de idade.
Quem não deve tomar COPEGUS 100mg?
Ver “Qual é a informação mais importante que devo saber sobre COPEGUS 100mg?”
Não tome COPEGUS se você:
- tem certos tipos de hepatite causada pelo ataque do seu sistema imunológico ao seu fígado (hepatite autoimune)
- tem certos distúrbios do sangue, como talassemia maior ou anemia falciforme (hemoglobinopatias)
- tome didanosina (Videx ou Videx EC)
Fale com o seu médico antes de iniciar o tratamento com COPEGUS 100 mg se tiver alguma destas condições médicas.
O que devo dizer ao meu médico antes de tomar COPEGUS 100mg?
Antes de tomar COPEGUS, informe o seu médico se você tem ou teve:
- tratamento para hepatite C que não funcionou para você
- reações alérgicas graves ao COPEGUS ou a qualquer um dos ingredientes do COPEGUS. Consulte o final deste Guia de Medicação para obter uma lista de ingredientes.
- problemas respiratórios. COPEGUS 100mg pode causar ou piorar seus problemas respiratórios que você já tem.
- problemas de visão. COPEGUS pode causar problemas oculares ou agravar problemas oculares que você já tem. Você deve fazer um exame oftalmológico antes de iniciar o tratamento com COPEGUS.
- certos distúrbios do sangue, como anemia
- pressão arterial elevada, problemas cardíacos ou teve um ataque cardíaco. Seu médico deve testar seu sangue e coração antes de iniciar o tratamento com COPEGUS.
- problemas de tireóide
- diabetes. A terapia combinada de COPEGUS 100mg e PEGASYS pode piorar ou dificultar o tratamento do diabetes.
- problemas de fígado além da infecção pelo vírus da hepatite C
- vírus da imunodeficiência humana (HIV) ou outros problemas de imunidade
- Problemas de saúde mental, incluindo depressão ou pensamentos de suicídio
- problemas renais
- transplante de órgão
- toxicodependência ou abuso
- infecção pelo vírus da hepatite B
- qualquer outra condição médica
- estão amamentando. Não se sabe se COPEGUS 100 mg passa para o leite materno. Você e seu médico devem decidir se você vai tomar COPEGUS ou amamentar.
Informe o seu médico sobre todos os medicamentos que toma, incluindo medicamentos prescritos e não prescritos, vitaminas e suplementos de ervas. Alguns medicamentos podem causar efeitos colaterais graves se tomados enquanto você também toma COPEGUS. Alguns medicamentos podem afetar o funcionamento de COPEGUS 100mg ou COPEGUS 100mg podem afetar o funcionamento de outros medicamentos.
Informe especialmente o seu médico se você tomar algum medicamento para tratar o HIV, incluindo didanosina (Videx ou Videx EC), ou se você tomar azatioprina (Imuran ou Azasan).
Conheça os medicamentos que você toma. Mantenha uma lista deles para mostrar ao seu médico ou farmacêutico quando receber um novo medicamento.
Como devo tomar COPEGUS 100mg?
- Tome COPEGUS exatamente como seu médico lhe disser. O seu médico dir-lhe-á quanto COPEGUS deve tomar e quando o deve tomar. Para crianças com 5 anos de idade ou mais, seu médico irá prescrever a dose de COPEGUS 100mg com base no peso.
- Tome COPEGUS com alimentos.
- Se você perder uma dose de COPEGUS 100mg, tome a dose esquecida o mais rápido possível durante o mesmo dia. Não duplique a próxima dose. Se você tiver dúvidas sobre o que fazer, ligue para o seu médico.
- Se você tomar COPEGUS 100mg demais, ligue para o seu médico ou para o Centro de Controle de Intoxicações local imediatamente, ou dirija-se ao pronto-socorro do hospital mais próximo imediatamente.
- seu médico deve fazer análises ao sangue antes de iniciar o tratamento com COPEGUS, nas semanas 2 e 4 do tratamento e, em seguida, conforme necessário, para verificar se está a tolerar bem o tratamento e verificar os efeitos secundários. O seu médico pode alterar a sua dose de COPEGUS 100 mg com base nos resultados das análises ao sangue ou nos efeitos secundários que possa ter.
- Se você tiver problemas cardíacos, seu médico deve verificar seu coração fazendo um eletrocardiograma antes de iniciar o tratamento com COPEGUS e, se necessário, durante o tratamento.
O que devo evitar ao tomar COPEGUS?
COPEGUS 100mg pode fazer você se sentir cansado, tonto ou confuso. Você não deve dirigir ou operar máquinas se tiver algum destes sintomas.
Não beber álcool, incluindo cerveja, vinho e licor. Isso pode piorar sua doença hepática.
Quais são os possíveis efeitos colaterais do COPEGUS?
COPEGUS 100mg pode causar efeitos colaterais graves, incluindo:
Consulte “Qual é a informação mais importante que devo saber sobre COPEGUS 100mg?”
- Inchaço e irritação do pâncreas (pancreatite). Você pode ter dor de estômago, náuseas, vômitos ou diarréia.
- Reações alérgicas graves. Os sintomas podem incluir urticária, chiado no peito, dificuldade para respirar, dor no peito, inchaço da boca, língua ou lábios ou erupção cutânea grave.
- Problemas respiratórios graves. Dificuldade em respirar pode ser um sinal de uma infecção pulmonar grave (pneumonia) que pode levar à morte.
- Problemas oculares graves que pode levar à perda de visão ou cegueira.
- Problemas de fígado. Algumas pessoas podem ter piora da função hepática. Informe o seu médico imediatamente se tiver algum destes sintomas: inchaço no estômago, confusão, urina marrom e olhos amarelos.
- Depressão severa
- Pensamentos e tentativas suicidas
- Efeito sobre o crescimento em crianças. As crianças podem apresentar um atraso no ganho de peso e aumento da altura durante o tratamento com PEGASYS e COPEGUS. A recuperação do crescimento ocorre após a interrupção do tratamento, mas algumas crianças podem não atingir a altura que se esperava antes do tratamento. Fale com o seu médico se estiver preocupado com o crescimento do seu filho durante o tratamento com PEGASYS e COPEGUS.
Ligue para o seu médico ou procure ajuda médica imediatamente se tiver algum dos sintomas listados acima. Estes podem ser sinais de um efeito secundário grave do tratamento com COPEGUS 100 mg.
Os efeitos colaterais comuns do COPEGUS tomado com PEGASYS incluem:
- sintomas semelhantes aos da gripe - sensação de cansaço, dor de cabeça, tremores junto com temperatura alta (febre) e dores musculares ou articulares
- alterações de humor, sensação de irritação, ansiedade e dificuldade para dormir
- perda de apetite, náuseas, vômitos e diarreia
- perda de cabelo
- coceira
Informe o seu médico sobre qualquer efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do tratamento com COPEGUS. Para mais informações, pergunte ao seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
Você também pode relatar efeitos colaterais à Genentech pelo telefone 1-888-835-2555.
Como devo armazenar COPEGUS 100mg?
- Armazene os comprimidos de COPEGUS entre 15°C e 30°C (59°F e 86°F).
- Mantenha o frasco bem fechado.
Mantenha COPEGUS 100mg e todos os medicamentos fora do alcance das crianças.
Informações gerais sobre o uso seguro e eficaz de COPEGUS
Não se sabe se o tratamento com COPEGUS 100 mg em combinação com PEGASYS impedirá que uma pessoa infectada transmita o vírus da hepatite C a outra pessoa durante o tratamento.
Os medicamentos às vezes são prescritos para outros fins que não os listados em um Guia de Medicamentos. Não use COPEGUS 100mg para uma condição para a qual não foi prescrito. Não dê COPEGUS a outras pessoas, mesmo que tenham os mesmos sintomas que você. Pode prejudicá-los.
Este Guia de Medicação resume as informações mais importantes sobre o COPEGUS. Se você quiser mais informações, converse com seu médico. Você pode pedir ao seu médico ou farmacêutico informações sobre COPEGUS que foram escritas para profissionais de saúde.
Quais são os ingredientes de COPEGUS 100mg?
Princípio ativo: ribavirina
Ingredientes inativos: O núcleo do comprimido contém amido pré-gelatinizado, celulose microcristalina, glicolato de amido sódico, amido de milho e estearato de magnésio. O revestimento do comprimido contém Chromatone-P ou Opadry Pink (feito usando hidroxipropilmetilcelulose, talco, dióxido de titânio, óxido de ferro amarelo sintético e óxido de ferro vermelho sintético), etilcelulose (ECD-30) e triacetina.
Este Guia de Medicação foi aprovado pela Food and Drug Administration dos EUA.
