Cozaar 25mg, 50mg, 100mg Losartan Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Cozaar 50mg e como é usado?
Cozaar é um medicamento de prescrição usado para tratar os sintomas de pressão alta (hipertensão), diminuir o risco de acidente vascular cerebral em certas pessoas com doença cardíaca e dor no nervo diabético (neuropatia). Cozaar 100mg pode ser usado sozinho ou com outros medicamentos.
Cozaar 25mg pertence a uma classe de medicamentos chamada Antagonista do Receptor da Angiotensina II (ARBs).
Não se sabe se Cozaar 25mg é seguro e eficaz em crianças menores de 6 anos de idade.
Quais são os possíveis efeitos colaterais do Cozaar 100mg?
Cozaar 100mg pode causar efeitos colaterais graves, incluindo:
- tontura,
- dor ou ardor ao urinar,
- náusea,
- fraqueza,
- sensação de formigamento,
- dor no peito,
- batimentos cardíacos irregulares,
- perda de movimentos,
- pouca ou nenhuma micção,
- ganho de peso rápido e
- inchaço nas mãos, pés ou tornozelos
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Cozaar incluem:
- tontura,
- dores nas costas e
- sintomas de resfriado (nariz entupido, espirros, dor de garganta)
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Cozaar. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
AVISO
TOXICIDADE FETAL
Quando a gravidez for detectada, descontinue COZAAR o mais rápido possível. Drogas que agem diretamente no sistema renina-angiotensina podem causar lesão e morte do feto em desenvolvimento [ver AVISOS E PRECAUÇÕES ].
DESCRIÇÃO
COZAAR (losartana potássica) é um bloqueador do receptor da angiotensina II que atua no subtipo do receptor AT1. A losartana potássica, uma molécula não peptídica, é quimicamente descrita como sal monopotássico de 2-butil-4-cloro-1-[p-(o-1H-tetrazol-5-ilfenil)benzil]imidazol-5-metanol.
Sua fórmula empírica é C22H22ClKN6O, e sua fórmula estrutural é:
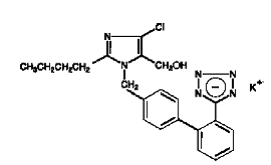
Losartana potássica é um pó cristalino de fluxo livre branco a esbranquiçado com um peso molecular de 461,01. É livremente solúvel em água, solúvel em álcoois e ligeiramente solúvel em solventes orgânicos comuns, como acetonitrila e metiletilcetona. A oxidação do grupo 5-hidroximetil no anel imidazol resulta no metabólito ativo do losartan.
COZAAR 100 mg está disponível na forma de comprimidos para administração oral contendo 25 mg, 50 mg ou 100 mg de losartana potássica e os seguintes ingredientes inativos: celulose microcristalina, lactose hidratada, amido pré-gelatinizado, estearato de magnésio, hidroxipropilcelulose, hipromelose e dióxido de titânio.
Os comprimidos de COZAAR 25 mg, 50 mg e 100 mg contêm potássio nas seguintes quantidades: 2,12 mg (0,054 mEq), 4,24 mg (0,108 mEq) e 8,48 mg (0,216 mEq), respectivamente. COZAAR 25 mg, COZAAR 50 mg e COZAAR 100 mg também podem conter cera de carnaúba.
INDICAÇÕES
Hipertensão
COZAAR® é indicado para o tratamento da hipertensão em adultos e pacientes pediátricos com 6 anos de idade ou mais, para baixar a pressão arterial. A redução da pressão arterial reduz o risco de eventos cardiovasculares (CV) fatais e não fatais, principalmente acidentes vasculares cerebrais e infarto do miocárdio. Esses benefícios foram observados em ensaios controlados de medicamentos anti-hipertensivos de uma ampla variedade de classes farmacológicas, incluindo losartana.
O controle da pressão arterial elevada deve fazer parte do gerenciamento abrangente do risco cardiovascular, incluindo, conforme apropriado, controle lipídico, controle do diabetes, terapia antitrombótica, cessação do tabagismo, exercícios e ingestão limitada de sódio. Muitos pacientes precisarão de mais de 1 medicamento para atingir as metas de pressão arterial. Para obter conselhos específicos sobre metas e gerenciamento, consulte as diretrizes publicadas, como as do Joint National Committeeon Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC) do National High Blood Pressure Education Program.
Numerosos anti-hipertensivos, de diversas classes farmacológicas e com diferentes mecanismos de ação, têm demonstrado em ensaios controlados randomizados reduzir a morbimortalidade cardiovascular, podendo-se concluir que é a redução da pressão arterial, e não alguma outra propriedade farmacológica do drogas, que é o grande responsável por esses benefícios. O maior e mais consistente benefício de resultado cardiovascular tem sido a redução do risco de acidente vascular cerebral, mas reduções no infarto do miocárdio e na mortalidade cardiovascular também têm sido observadas regularmente.
pressão sistólica ou diastólica elevada causa aumento do risco cardiovascular, e o aumento do risco absoluto por mmHg é maior em pressões sanguíneas mais altas, de modo que até mesmo reduções modestas da hipertensão grave podem proporcionar benefícios substanciais. A redução do risco relativo da redução da pressão arterial é semelhante em populações com risco absoluto variável, de modo que o benefício absoluto é maior em pacientes que estão em maior risco independentemente de sua hipertensão (por exemplo, pacientes com diabetes ou hiperlipidemia), e espera-se que esses pacientes se beneficiem de um tratamento mais agressivo para uma meta de pressão arterial mais baixa.
Alguns medicamentos anti-hipertensivos têm efeitos menores na pressão arterial (como monoterapia) em pacientes negros, e muitos medicamentos anti-hipertensivos têm indicações e efeitos adicionais aprovados (por exemplo, na angina, insuficiência cardíaca ou doença renal diabética). Essas considerações podem orientar a seleção da terapia.
COZAAR pode ser administrado com outros agentes anti-hipertensivos.
Pacientes hipertensos com hipertrofia ventricular esquerda
COZAAR 25mg é indicado para reduzir o risco de acidente vascular cerebral em pacientes com hipertensão e hipertrofia ventricular esquerda, mas há evidências de que esse benefício não se aplica a pacientes negros [ver Uso em populações específicas e FARMACOLOGIA CLÍNICA ] .
Nefropatia em pacientes diabéticos tipo 2
COZAAR é indicado para o tratamento da nefropatia diabética com creatinina sérica elevada e proteinúria (relação albumina/creatinina urinária ≥300 mg/g) em pacientes com diabetes tipo 2 e história de hipertensão. Nesta população, COZAAR 50mg reduz a taxa de progressão da nefropatia medida pela ocorrência de duplicação da creatinina sérica ou doença renal terminal (necessidade de diálise ou transplante renal) [ver Estudos clínicos ] .
DOSAGEM E ADMINISTRAÇÃO
Hipertensão
Hipertensão adulta
A dose inicial usual de COZAAR 50mg é de 50mg uma vez ao dia. A dosagem pode ser aumentada para uma dose máxima de 100 mg uma vez ao dia, conforme necessário para controlar a pressão arterial [ver Estudos clínicos ] . Uma dose inicial de 25 mg é recomendada para pacientes com possível depleção intravascular (por exemplo, em terapia diurética).
Hipertensão Pediátrica
dose inicial usualmente recomendada é de 0,7 mg por kg uma vez ao dia (até 50 mg no total) administrada na forma de comprimido ou suspensão. Preparação da suspensão (para 200 mL de uma suspensão de 2,5 mg/mL) ] .A dosagem deve ser ajustada de acordo com a resposta da pressão arterial. Doses acima de 1,4 mg por kg (ou acima de 100 mg) diariamente não foram estudadas em pacientes pediátricos [ver FARMACOLOGIA CLÍNICA , Estudos clínicos e AVISOS E PRECAUÇÕES ] .
COZAAR não é recomendado em pacientes pediátricos com menos de 6 anos de idade ou em pacientes pediátricos com taxa de filtração glomerular estimada inferior a 30 mL/min/1,73m 2 [ver Uso em populações específicas , FARMACOLOGIA CLÍNICA e Estudos clínicos ] .
Pacientes hipertensos com hipertrofia ventricular esquerda
A dose inicial usual é de 50 mg de COZAAR uma vez ao dia. Hidroclorotiazida 12,5 mg diários devem ser adicionados e/ou a dose de COZAAR deve ser aumentada para 100 mg uma vez ao dia seguido por um aumento de hidroclorotiazida para 25 mg uma vez ao dia com base na resposta da pressão arterial [ver Estudos clínicos ] .
Nefropatia em pacientes diabéticos tipo 2
A dose inicial habitual é de 50 mg uma vez por dia. A dose deve ser aumentada para 100 mg uma vez ao dia com base na resposta da pressão arterial [ver Estudos clínicos ] .
Modificações de dosagem em pacientes com insuficiência hepática
Em pacientes com insuficiência hepática leve a moderada, a dose inicial recomendada de COZAAR é de 25 mg uma vez ao dia. COZAAR não foi estudado em pacientes com insuficiência hepática grave [ver Uso em populações específicas e FARMACOLOGIA CLÍNICA ] .
Preparação da suspensão (para 200 mL de uma suspensão de 2,5 mg/mL)
Adicione 10 mL de Água Purificada USP a um frasco de tereftalato de polietileno (PET) âmbar de 8 onças (240 mL) contendo dez comprimidos de COZAAR de 50 mg. Agite imediatamente por pelo menos 2 minutos. Deixe o concentrado repousar durante 1 hora e depois agite durante 1 minuto para dispersar o conteúdo do comprimido. Prepare separadamente uma mistura volumétrica 50/50 de Ora-Plus™ e Ora-Sweet SF™. Adicione 190 mL da mistura 50/50 Ora-Plus™/Ora-Sweet SF™ ao comprimido e pasta de água na garrafa PET e agite por 1 minuto para dispersar os ingredientes. A suspensão deve ser refrigerada a 2-8°C (36-46°F) e pode ser armazenada por até 4 semanas. Agite a suspensão antes de cada uso e retorne imediatamente ao refrigerador.
COMO FORNECIDO
Formas de dosagem e pontos fortes
- COZAAR 100 mg, 25 mg, são comprimidos revestidos por película brancos, ovais, com o código 951 numa das faces.
- COZAAR, 50 mg, são comprimidos revestidos por película brancos, ovais, com o código 952 numa das faces e ranhurado na outra.
- COZAAR 25 mg, 100 mg, são comprimidos revestidos por película brancos, em forma de lágrima, com o código 960 numa das faces.
Armazenamento e manuseio
COZAAR é um comprimido revestido por película branco fornecido da seguinte forma:
Armazenar a 25°C (77°F); excursões permitidas para 15-30°C (59-86°F) [veja USP Controlled Room Temperature]. Mantenha o recipiente bem fechado. Proteja da luz.
Fabricado para: Organon LLC, uma subsidiária da ORGANON & Co., Jersey City, NJ 07302, EUA. Revisado: outubro de 2021.
EFEITOS COLATERAIS
Experiência de Ensaios Clínicos
Como os ensaios clínicos são conduzidos sob condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparadas às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
Hipertensão
COZAAR foi avaliado quanto à segurança em mais de 3.300 pacientes adultos tratados para hipertensão essencial e 4.058 pacientes/indivíduos em geral. Mais de 1200 pacientes foram tratados por mais de 6 meses e mais de 800 por mais de um ano.
O tratamento com COZAAR 25mg foi bem tolerado com uma incidência geral de eventos adversos semelhante à do placebo. Em ensaios clínicos controlados, a descontinuação da terapia por eventos adversos ocorreu em 2,3% dos pacientes tratados com COZAAR 25mg e em 3,7% dos pacientes que receberam placebo. Em 4 ensaios clínicos envolvendo mais de 1.000 pacientes em várias doses (10-150 mg) de losartana potássica e mais de 300 pacientes que receberam placebo, os eventos adversos que ocorreram em ≥2% dos pacientes tratados com COZAAR 25mg e mais comumente do que placebo foram: tontura (3 % vs. 2%), infecção do trato respiratório superior (8% vs. 7%), congestão nasal (2% vs. 1%) e dor nas costas (2% vs. 1%).
As seguintes reações adversas menos comuns foram relatadas:
Distúrbios do sangue e do sistema linfático: Anemia.
Distúrbios psiquiátricos: Depressão.
Distúrbios do sistema nervoso: Sonolência, cefaleia, distúrbios do sono, parestesia, enxaqueca.
Distúrbios do ouvido e do labirinto: Vertigem, zumbido.
Distúrbios cardíacos: Palpitações, síncope, fibrilação atrial, AVC.
Distúrbios respiratórios, torácicos e mediastinais: Dispnéia.
Problemas gastrointestinais: Dor abdominal, constipação, náuseas, vômitos.
Distúrbios da pele e tecidos subcutâneos: Urticária, prurido, erupção cutânea, fotossensibilidade.
Distúrbios musculoesqueléticos e do tecido conjuntivo: Mialgia, artralgia.
Distúrbios do sistema reprodutor e da mama: Impotência.
Distúrbios gerais e condições do local de administração: Edema.
Tosse
tosse seca persistente (com uma incidência de alguns por cento) tem sido associada ao uso de inibidores da ECA e, na prática, pode ser uma causa de descontinuação da terapia com inibidores da ECA. Dois estudos prospectivos, de grupos paralelos, duplo-cegos, randomizados e controlados foram conduzidos para avaliar os efeitos da losartana na incidência de tosse em pacientes hipertensos que apresentaram tosse durante o tratamento com inibidor da ECA. Os pacientes que apresentaram tosse típica com inibidor da ECA quando desafiados com lisinopril, cuja tosse desapareceu com placebo, foram randomizados para losartana 50 mg, lisinopril 20 mg ou placebo (um estudo, n=97) ou 25 mg de hidroclorotiazida (n=135). O período de tratamento duplo-cego durou até 8 semanas. A incidência de tosse é mostrada na Tabela 1 abaixo.
Esses estudos demonstram que a incidência de tosse associada à terapia com losartana, em uma população em que todos tiveram tosse associada à terapia com inibidor da ECA, é semelhante à associada à terapia com hidroclorotiazida ou placebo.
Casos de tosse, incluindo reexposição positiva, foram relatados com o uso de losartana na experiência pós-comercialização.
Pacientes Hipertensos com Hipertrofia Ventricular Esquerda
No estudo Losartan Intervention for Endpoint (LIFE), as reações adversas com COZAAR 100mg foram semelhantes às relatadas anteriormente para pacientes com hipertensão.
Nefropatia em Pacientes Diabéticos Tipo 2
No estudo Redução de endpoints em NIDDM com o Angiotensin II Receptor Antagonist Losartan (RENAAL) envolvendo 1.513 pacientes tratados com COZAAR 100mg ou placebo, as incidências gerais de eventos adversos relatados foram semelhantes para os dois grupos. As descontinuações de COZAAR devido a efeitos colaterais foram semelhantes ao placebo (19% para COZAAR 100mg, 24% para placebo). Os eventos adversos, independentemente da relação medicamentosa, relatados com uma incidência de ≥4% dos pacientes tratados com COZAAR 50mg e ocorrendo com ≥2% de diferença no grupo losartana versus placebo em um histórico de terapia anti-hipertensiva convencional, foram astenia/fadiga, dor torácica , hipotensão, hipotensão ortostática, diarreia, anemia, hipercalemia, hipoglicemia, dor nas costas, fraqueza muscular e infecção do trato urinário.
Experiência pós-marketing
As seguintes reações adversas adicionais foram relatadas na experiência pós-comercialização com COZAAR. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar sua frequência de forma confiável ou estabelecer uma relação causal com a exposição ao medicamento:
Digestivo: Hepatite.
Distúrbios Gerais e Condições do Local de Administração: Mal-estar.
Hematologico: Trombocitopenia.
Hipersensibilidade: Angioedema, incluindo inchaço da laringe e da glote, causando obstrução das vias aéreas e/ou inchaço da face, lábios, faringe e/ou língua foi relatado raramente em pacientes tratados com losartana; alguns desses pacientes já apresentaram angioedema com outros medicamentos, incluindo inibidores da ECA. Vasculite, incluindo púrpura de Henoch-Schönlein, foi relatada. Reações anafiláticas foram relatadas.
Metabólico e Nutricional: Hiponatremia.
Musculoesquelético: Rabdomiólise.
Distúrbios do sistema nervoso: Disgeusia.
Pele: Eritrodermia.
INTERAÇÕES MEDICAMENTOSAS
Agentes que aumentam o potássio sérico
A coadministração de losartana com outros medicamentos que elevam os níveis séricos de potássio pode resultar em hipercalemia. Monitorar o potássio sérico nesses pacientes.
Lítio
Aumentos nas concentrações séricas de lítio e toxicidade do lítio foram relatados durante a administração concomitante de lítio com antagonistas dos receptores da angiotensina II. Monitorar os níveis séricos de lítio durante o uso concomitante.
Medicamentos anti-inflamatórios não esteroides (AINEs), incluindo inibidores seletivos da ciclooxigenase-2 (inibidores da COX-2)
Em pacientes idosos, com depleção de volume (incluindo aqueles em terapia diurética) ou com função renal comprometida, a coadministração de AINEs, incluindo inibidores seletivos da COX-2, com antagonistas dos receptores da angiotensina II (incluindo losartana) pode resultar em deterioração da função renal, incluindo possível insuficiência renal aguda. Estes efeitos são geralmente reversíveis. Monitorar a função renal periodicamente em pacientes recebendo terapia com losartana e AINEs.
O efeito anti-hipertensivo dos antagonistas dos receptores da angiotensina II, incluindo losartana, pode ser atenuado por AINEs, incluindo inibidores seletivos de COX-2.
Duplo bloqueio do sistema renina-angiotensina (RAS)
bloqueio duplo do SRA com bloqueadores dos receptores da angiotensina, inibidores da ECA ou alisquireno está associado a riscos aumentados de hipotensão, síncope, hipercalemia e alterações na função renal (incluindo insuficiência renal aguda) em comparação com a monoterapia.
O estudo Veterans Affairs Nephropathy in Diabetes (VA NEPHRON-D) recrutou 1.448 pacientes com diabetes tipo 2, relação urina-albumina-creatinina elevada e taxa de filtração glomerular estimada diminuída (TFG 30 a 89,9 mL/min), randomizando-os para lisinopril ou placebo em um histórico de terapia com losartana e os acompanhou por uma média de 2,2 anos. Os pacientes que receberam a combinação de losartana e lisinopril não obtiveram nenhum benefício adicional em comparação com a monoterapia para o desfecho combinado de declínio da TFG, doença renal em estágio final ou morte, mas apresentaram aumento da incidência de hipercalemia e lesão renal aguda em comparação com o grupo de monoterapia.
Na maioria dos pacientes, nenhum benefício foi associado ao uso concomitante de dois inibidores do RAS. Em geral, evite o uso combinado de inibidores do RAS. Monitore de perto a pressão arterial, função renal e eletrólitos em pacientes em uso de COZAAR 100mg e outros agentes que afetam o EAR.
Não coadministre alisquireno com COZAAR 100mg em pacientes com diabetes. Evitar o uso de alisquireno com COZAAR em pacientes com insuficiência renal (TFG
AVISOS
Incluído como parte do "PRECAUÇÕES" Seção
PRECAUÇÕES
Toxicidade Fetal
COZAAR pode causar danos ao feto quando administrado a mulheres grávidas. O uso de drogas que atuam no sistema renina-angiotensina durante o segundo e terceiro trimestres de gestação reduz a função renal fetal e aumenta a morbidade e morte fetal e neonatal. O oligoidrâmnio resultante pode estar associado a hipoplasia pulmonar fetal e deformações esqueléticas. Os potenciais efeitos adversos neonatais incluem hipoplasia do crânio, anúria, hipotensão, insuficiência renal e morte. Quando a gravidez for detectada, descontinue COZAAR 100mg o mais rápido possível [ver Uso em populações específicas ] .
Hipotensão em pacientes com depleção de volume ou sal
Em pacientes com um sistema renina-angiotensina ativado, como pacientes com depleção de volume ou sal (por exemplo, aqueles sendo tratados com altas doses de diuréticos), pode ocorrer hipotensão sintomática após o início do tratamento com COZAAR. Corrija o volume ou a depleção de sal antes da administração de COZAAR [ver DOSAGEM E ADMINISTRAÇÃO ] .
Deterioração da Função Renal
Alterações na função renal, incluindo insuficiência renal aguda, podem ser causadas por drogas que inibem o sistema renina-angiotensina e por diuréticos. Pacientes cuja função renal pode depender em parte da atividade do sistema renina-angiotensina (p. Monitore a função renal periodicamente nesses pacientes. Considere suspender ou descontinuar a terapia em pacientes que desenvolvem uma diminuição clinicamente significativa da função renal com COZAAR [ver INTERAÇÕES MEDICAMENTOSAS e Uso em populações específicas ] .
Hipercalemia
Monitorar o potássio sérico periodicamente e tratar adequadamente. A redução da dose ou a descontinuação de COZAAR 25mg pode ser necessária [ver REAÇÕES ADVERSAS ] .
O uso concomitante de outros medicamentos que podem aumentar o potássio sérico pode levar à hipercalemia [ver INTERAÇÕES MEDICAMENTOSAS ] .
Informações de Aconselhamento do Paciente
Aconselhe o paciente a ler o rótulo do paciente aprovado pela FDA (Informações ao Paciente).
Gravidez
Aconselhar as pacientes do sexo feminino em idade fértil sobre as consequências da exposição a COZAAR 100mg durante a gravidez. Discuta as opções de tratamento com as mulheres que planejam engravidar. Diga às pacientes para relatar a gravidez a seus médicos o mais rápido possível [ver AVISOS E PRECAUÇÕES e Uso em populações específicas ] .
Suplementos de potássio
Aconselhe os pacientes recebendo COZAAR a não usar suplementos de potássio ou substitutos do sal contendo potássio sem consultar seu médico [ver INTERAÇÕES MEDICAMENTOSAS ] .
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
losartana potássica não foi carcinogênica quando administrada em doses máximas toleradas a ratos e camundongos por 105 e 92 semanas, respectivamente. Ratas fêmeas que receberam a dose mais alta (270 mg/kg/dia) tiveram uma incidência ligeiramente maior de adenoma acinar pancreático. As dosagens máximas toleradas (270 mg/kg/dia em ratos, 200 mg/kg/dia em camundongos) forneceram exposições sistêmicas para losartana e seu metabólito farmacologicamente ativo que foram aproximadamente 160 e 90 vezes (ratos) e 30 e 15 vezes (camundongos). a exposição de um ser humano de 50 kg que recebeu 100 mg por dia.
A losartana potássica foi negativa nos ensaios de mutagênese microbiana e mutagênese em células de mamíferos V-79 e na eluição alcalina in vitro e nos ensaios de aberração cromossômica in vitro e in vivo. Além disso, o metabólito ativo não mostrou evidência de genotoxicidade na mutagênese microbiana, eluição alcalina in vitro e ensaios de aberração cromossômica in vitro.
fertilidade e o desempenho reprodutivo não foram afetados em estudos com ratos machos que receberam doses orais de losartana potássica até aproximadamente 150 mg/kg/dia. A administração de níveis de dosagem tóxica em fêmeas (300/200 mg/kg/dia) foi associada a uma diminuição significativa (p
Uso em populações específicas
Gravidez
Resumo do risco
COZAAR pode causar danos ao feto quando administrado a mulheres grávidas. O uso de drogas que atuam no sistema renina-angiotensina durante o segundo e terceiro trimestres de gestação reduz a função renal fetal e aumenta a morbidade e morte fetal e neonatal. A maioria dos estudos epidemiológicos examinando anormalidades fetais após exposição ao uso de anti-hipertensivos no primeiro trimestre não distinguiu drogas que afetam o sistema renina-angiotensina de outros agentes anti-hipertensivos. Quando a gravidez for detectada, descontinue COZAAR o mais rápido possível (ver Considerações Clínicas ).
O risco de fundo estimado de defeitos congênitos graves e aborto espontâneo para a população indicada é desconhecido. Todas as gestações têm um risco histórico de defeitos congênitos, perda ou outros resultados adversos. Na população geral dos EUA, o risco de fundo estimado de defeitos congênitos graves e aborto espontâneo em gestações clinicamente reconhecidas é de 2% a 4% e 15% a 20%, respectivamente.
Considerações Clínicas
Risco materno e/ou embrionário/fetal associado à doença
hipertensão na gravidez aumenta o risco materno de pré-eclâmpsia, diabetes gestacional, parto prematuro e complicações no parto (por exemplo, necessidade de cesariana, hemorragia pós-parto). A hipertensão aumenta o risco fetal de restrição de crescimento intrauterino e morte intrauterina. Mulheres grávidas com hipertensão devem ser cuidadosamente monitoradas e tratadas adequadamente.
Reações Adversas Fetais/Neonatais
Oligoidrâmnio em mulheres grávidas que usam drogas que afetam o sistema renina-angiotensina no segundo e terceiro trimestres de gravidez pode resultar no seguinte: redução da função renal fetal levando a anúria e insuficiência renal, hipoplasia pulmonar fetal, deformações esqueléticas, incluindo hipoplasia do crânio, hipotensão , e morte. No caso incomum de não haver alternativa adequada à terapia com drogas que afetem o sistema renina-angiotensina para um determinado paciente, informar a mãe do potencial risco para o feto.
Em pacientes tomando COZAAR durante a gravidez, realize exames ultrassonográficos seriados para avaliar o ambiente intra-amniótico. O teste fetal pode ser apropriado, com base na semana de gestação. Se for observado oligoidrâmnio, descontinuar COZAAR 50mg, a menos que seja considerado salva-vidas para a mãe. Pacientes e médicos devem estar cientes, no entanto, de que o oligoidrâmnio pode não aparecer até que o feto tenha sofrido lesão irreversível.
Observar de perto os recém-nascidos com história de exposição in utero ao COZAAR para hipotensão, oligúria e hipercalemia. Em recém-nascidos com história de exposição in utero a COZAAR 100mg, se ocorrer oligúria ou hipotensão, apoiar a pressão arterial e a perfusão renal. Transfusões de troca ou diálise podem ser necessárias como meio de reverter a hipotensão e substituir a função renal.
Dados
Dados de animais
losartana potássica foi administrada oralmente a ratas durante o período do final da gestação até a lactação (Dia 15 da Gestação até o Dia 20 da Lactação) em doses de 10, 25 e 100 mg/kg/dia. A losartana potássica demonstrou produzir efeitos adversos em fetos e neonatos de ratos, incluindo diminuição do peso corporal, atraso no desenvolvimento físico e comportamental, mortalidade e toxicidade renal. Com exceção do ganho de peso neonatal (que foi afetado em doses tão baixas quanto 10 mg/kg/dia), as doses associadas a esses efeitos excederam 25 mg/kg/dia (aproximadamente três vezes a dose humana máxima recomendada de 100 mg em um mg /m base). Esses achados são atribuídos à exposição ao fármaco no final da gestação e durante a lactação. Níveis significativos de losartana e seu metabólito ativo mostraram-se presentes no plasma fetal de rato durante o final da gestação e no leite de rato.
Lactação
Resumo do risco
Não se sabe se a losartana é excretada no leite humano, mas níveis significativos de losartana e seu metabólito ativo mostraram-se presentes no leite de rato. Devido ao potencial de efeitos adversos no lactente, deve-se decidir entre descontinuar a amamentação ou descontinuar o medicamento, levando em consideração a importância do medicamento para a mãe.
Uso Pediátrico
Os efeitos anti-hipertensivos de COZAAR foram estabelecidos em pacientes pediátricos hipertensos com idades entre 6 e 16 anos. A segurança e a eficácia não foram estabelecidas em pacientes pediátricos com menos de 6 anos ou em pacientes pediátricos com taxa de filtração glomerular DOSAGEM E ADMINISTRAÇÃO , FARMACOLOGIA CLÍNICA e Estudos clínicos ] .
Uso Geriátrico
Do número total de pacientes que receberam COZAAR 25mg em estudos clínicos controlados para hipertensão, 391 pacientes (19%) tinham 65 anos ou mais, enquanto 37 pacientes (2%) tinham 75 anos ou mais. Em um estudo clínico controlado para proteção renal em pacientes diabéticos tipo 2 com proteinúria, 248 pacientes (33%) tinham 65 anos ou mais. Em um estudo clínico controlado para redução do risco combinado de morte cardiovascular, acidente vascular cerebral e infarto do miocárdio em pacientes hipertensos com hipertrofia ventricular esquerda, 2.857 pacientes (62%) tinham 65 anos ou mais, enquanto 808 pacientes (18%) tinham 75 anos ou mais . Nenhuma diferença geral na eficácia ou segurança foi observada entre esses pacientes e pacientes mais jovens, mas a maior sensibilidade de alguns indivíduos mais velhos não pode ser descartada.
Corrida
No estudo LIFE, pacientes negros com hipertensão e hipertrofia ventricular esquerda tratados com atenolol apresentaram menor risco de apresentar o desfecho primário composto em comparação com pacientes negros tratados com COZAAR (ambos co-tratados com hidroclorotiazida na maioria dos pacientes). O desfecho primário foi a primeira ocorrência de acidente vascular cerebral, infarto do miocárdio ou morte cardiovascular, analisada por meio de uma abordagem de intenção de tratar (ITT). No subgrupo de pacientes negros (n=533, 6% dos pacientes do estudo LIFE), houve 29 desfechos primários entre 263 pacientes em uso de atenolol (11%, 26 por 1.000 pacientes-ano) e 46 desfechos primários entre 270 pacientes (17% , 42 por 1.000 pacientes-ano) em COZAAR. Este achado não pode ser explicado com base em diferenças nas populações além da raça ou em quaisquer desequilíbrios entre os grupos de tratamento. Além disso, as reduções da pressão arterial em ambos os grupos de tratamento foram consistentes entre pacientes negros e não negros. Dada a dificuldade em interpretar diferenças de subconjuntos em grandes ensaios, não se pode saber se a diferença observada é resultado do acaso. No entanto, o estudo LIFE não fornece evidências de que os benefícios de COZAAR 100mg na redução do risco de eventos cardiovasculares em pacientes hipertensos com hipertrofia ventricular esquerda se apliquem a pacientes negros [ver Estudos clínicos ] .
Insuficiência renal
Pacientes com insuficiência renal apresentam concentrações plasmáticas elevadas de losartana e seu metabólito ativo em comparação com indivíduos com função renal normal. Nenhum ajuste de dose é necessário em pacientes com insuficiência renal, a menos que um paciente com insuficiência renal também apresente depleção de volume [ver DOSAGEM E ADMINISTRAÇÃO , AVISOS E PRECAUÇÕES e FARMACOLOGIA CLÍNICA ] .
Insuficiência hepática
A dose inicial recomendada de COZAAR é de 25 mg em pacientes com insuficiência hepática leve a moderada. Após administração oral em pacientes com insuficiência hepática leve a moderada, as concentrações plasmáticas de losartana e de seu metabólito ativo foram, respectivamente, 5 vezes e 1,7 vezes maiores do que as observadas em voluntários saudáveis. DOSAGEM E ADMINISTRAÇÃO e FARMACOLOGIA CLÍNICA ] .
SOBREDOSAGEM
Foi observada letalidade significativa em camundongos e ratos após administração oral de 1.000 mg/kg e 2.000 mg/kg, respectivamente, cerca de 44 e 170 vezes a dose humana máxima recomendada em mg/m2.
Dados limitados estão disponíveis em relação à superdosagem em humanos. A manifestação mais provável de superdosagem seria hipotensão e taquicardia; bradicardia pode ocorrer por estimulação parassimpática (vagal). Se ocorrer hipotensão sintomática, deve ser instituído tratamento de suporte.
Nem a losartana nem seu metabólito ativo podem ser removidos por hemodiálise.
CONTRA-INDICAÇÕES
COZAAR 50mg é contraindicado:
- Em pacientes com hipersensibilidade a qualquer componente deste produto.
- Para coadministração com alisquireno em pacientes com diabetes.
FARMACOLOGIA CLÍNICA
Mecanismo de ação
angiotensina II [formada a partir da angiotensina I em uma reação catalisada pela enzima conversora da angiotensina (ECA, cininase II)] é um potente vasoconstritor, o hormônio vasoativo primário do sistema renina-angiotensina e um componente importante na fisiopatologia da hipertensão. Também estimula a secreção de aldosterona pelo córtex adrenal. A losartana e seu principal metabólito ativo bloqueiam os efeitos vasoconstritores e secretores de aldosterona da angiotensina II bloqueando seletivamente a ligação da angiotensina II ao receptor AT1 encontrado em muitos tecidos (p. ex., músculo liso vascular, glândula adrenal). Há também um receptor AT1 encontrado em muitos tecidos, mas não se sabe que esteja associado à homeostase cardiovascular. Nem a losartana nem seu principal metabólito ativo exibem qualquer atividade agonista parcial no receptor AT1, e ambos têm afinidade muito maior (cerca de 1.000 vezes) para o receptor AT1 do que para o receptor AT1. Estudos de ligação in vitro indicam que a losartana é um inibidor competitivo e reversível do receptor AT1. O metabólito ativo é 10 a 40 vezes mais potente em peso do que a losartana e parece ser um inibidor reversível e não competitivo do receptor AT1.
Nem a losartana nem seu metabólito ativo inibem a ECA (cininase II, a enzima que converte a angiotensina I em angiotensina II e degrada a bradicinina), nem se ligam ou bloqueiam outros receptores hormonais ou canais iônicos conhecidos por serem importantes na regulação cardiovascular.
Farmacodinâmica
A losartana inibe o efeito pressor de infusões de angiotensina II (assim como de angiotensina I). Uma dose de 100 mg inibe o efeito pressor em cerca de 85% no pico com 25-40% de inibição persistindo por 24 horas. A remoção do feedback negativo da angiotensina II causa uma duplicação ou triplicação da atividade da renina plasmática e conseqüente aumento da concentração plasmática de angiotensina II em pacientes hipertensos. A losartana não afeta a resposta à bradicinina, enquanto os inibidores da ECA aumentam a resposta à bradicinina. As concentrações plasmáticas de aldosterona caem após a administração de losartana. Apesar do efeito do losartan na secreção de aldosterona, foi observado muito pouco efeito sobre o potássio sérico.
efeito da losartana está substancialmente presente em uma semana, mas em alguns estudos o efeito máximo ocorreu em 3-6 semanas. Em estudos de acompanhamento de longo prazo (sem controle com placebo), o efeito da losartana pareceu se manter por até um ano. Não há efeito rebote aparente após a retirada abrupta de losartana. Não houve essencialmente nenhuma alteração na frequência cardíaca média em pacientes tratados com losartana em estudos controlados.
Farmacocinética
Absorção
Após administração oral, a losartana é bem absorvida e sofre substancial metabolismo de primeira passagem. A biodisponibilidade sistêmica da losartana é de aproximadamente 33%. As concentrações máximas médias de losartana e seu metabólito ativo são atingidas em 1 hora e em 3-4 horas, respectivamente. Embora as concentrações plasmáticas máximas de losartana e de seu metabólito ativo sejam aproximadamente iguais, a AUC (área sob a curva) do metabólito é cerca de 4 vezes maior que a de losartana. Uma refeição retarda a absorção de losartana e diminui sua Cmax, mas tem apenas efeitos menores na AUC de losartana ou na AUC do metabólito (diminuição de ~10%). A farmacocinética da losartana e de seu metabólito ativo é linear com doses de losartana oral de até 200 mg e não se altera com o tempo.
Distribuição
volume de distribuição da losartana e do metabólito ativo é de cerca de 34 litros e 12 litros, respectivamente. Tanto a losartana quanto seu metabólito ativo estão altamente ligados às proteínas plasmáticas, principalmente a albumina, com frações plasmáticas livres de 1,3% e 0,2%, respectivamente. A ligação às proteínas plasmáticas é constante ao longo da faixa de concentração alcançada com as doses recomendadas. Estudos em ratos indicam que o losartan atravessa mal a barreira hematoencefálica, se é que o atravessa.
Metabolismo
losartana é um agente oralmente ativo que sofre substancial metabolismo de primeira passagem pelas enzimas do citocromo P450. É convertido, em parte, em um metabólito ativo de ácido carboxílico que é responsável pela maior parte do antagonismo do receptor de angiotensina II que segue o tratamento com losartana. Cerca de 14% de uma dose de losartana administrada por via oral é convertida no metabólito ativo. Além do metabólito ativo do ácido carboxílico, vários metabólitos inativos são formados. Estudos in vitro indicam que o citocromo P450 2C9 e 3A4 estão envolvidos na biotransformação da losartana em seus metabólitos.
Eliminação
depuração plasmática total de losartana e do metabólito ativo é de cerca de 600 mL/min e 50 mL/min, respectivamente, com depuração renal de cerca de 75 mL/min e 25 mL/min, respectivamente. A meia-vida terminal do losartan é de cerca de 2 horas e do metabólito é de cerca de 6-9 horas. Após administração oral de doses únicas de losartana, cerca de 4% da dose é excretada inalterada na urina e cerca de 6% é excretada na urina como metabólito ativo. A excreção biliar contribui para a eliminação da losartana e seus metabólitos. Após losartana marcada com 14C oral, cerca de 35% da radioatividade é recuperada na urina e cerca de 60% nas fezes. Após uma dose intravenosa de losartana marcada com 14C, cerca de 45% da radioatividade é recuperada na urina e 50% nas fezes. Nem o losartan nem o seu metabolito acumulam-se no plasma com doses repetidas uma vez por dia.
Populações Específicas
Pediátrico
Os parâmetros farmacocinéticos após múltiplas doses de losartana (dose média de 0,7 mg/kg, intervalo de 0,36 a 0,97 mg/kg) na forma de comprimido para 25 pacientes hipertensos com idade entre 6 e 16 anos são mostrados na Tabela 4 abaixo. A farmacocinética do losartan e do seu metabolito ativo foi geralmente semelhante nos grupos etários estudados e semelhante aos dados farmacocinéticos históricos em adultos. Os principais parâmetros farmacocinéticos em adultos e crianças são apresentados na tabela abaixo.
A biodisponibilidade da formulação de suspensão foi comparada com comprimidos de losartana em adultos saudáveis. A suspensão e o comprimido são semelhantes em sua biodisponibilidade em relação ao losartan e ao metabólito ativo [ver DOSAGEM E ADMINISTRAÇÃO ] .
Geriatria e Gênero
farmacocinética da losartana tem sido investigada em idosos (65-75 anos) e em ambos os sexos. As concentrações plasmáticas de losartana e de seu metabólito ativo são semelhantes em idosos e hipertensos jovens. As concentrações plasmáticas de losartana foram cerca de duas vezes maiores em mulheres hipertensas do que em homens, mas as concentrações do metabólito ativo foram semelhantes em homens e mulheres. Não é necessário ajuste de dose [ver DOSAGEM E ADMINISTRAÇÃO ] .
Corrida
As diferenças farmacocinéticas devido à raça não foram estudadas [ver Uso em populações específicas ] .
Insuficiência renal
Após administração oral, as concentrações plasmáticas e as AUCs de losartana e seu metabólito ativo aumentam em 50-90% em pacientes com insuficiência renal leve (depuração de creatinina de 50 a 74 mL/min) ou moderada (depuração de creatinina de 30 a 49 mL/min) . Neste estudo, a depuração renal foi reduzida em 55-85% tanto para losartana quanto para seu metabólito ativo em pacientes com insuficiência renal leve ou moderada. Nem a losartana nem seu metabólito ativo podem ser removidos por hemodiálise [ver AVISOS E PRECAUÇÕES e Uso em populações específicas ] .
Insuficiência Hepática
Após administração oral em pacientes com cirrose hepática alcoólica leve a moderada, as concentrações plasmáticas de losartana e de seu metabólito ativo foram, respectivamente, 5 vezes e cerca de 1,7 vezes maiores que em voluntários jovens do sexo masculino. Em comparação com indivíduos normais, a depuração plasmática total de losartana em pacientes com insuficiência hepática foi cerca de 50% menor e a biodisponibilidade oral foi aproximadamente o dobro. Use uma dose inicial de 25 mg para pacientes com insuficiência hepática leve a moderada. COZAAR 50mg não foi estudado em pacientes com insuficiência hepática grave [ver DOSAGEM E ADMINISTRAÇÃO e Uso em populações específicas ] .
Interações medicamentosas
Não foram encontradas interações medicamentosas clinicamente significativas em estudos de losartana potássica com hidroclorotiazida, digoxina, varfarina, cimetidina e fenobarbital. No entanto, a rifampicina demonstrou diminuir a AUC de losartana e seu metabólito ativo em 30% e 40%, respectivamente. O fluconazol, um inibidor do citocromo P450 2C9, diminuiu a AUC do metabólito ativo em aproximadamente 40%, mas aumentou a AUC de losartana em aproximadamente 70% após doses múltiplas. A conversão de losartana em seu metabólito ativo após administração intravenosa não é afetada pelo cetoconazol, um inibidor de P450 3A4. A AUC do metabólito ativo após a losartana oral não foi afetada pela eritromicina, um inibidor de P450 3A4, mas a AUC da losartana foi aumentada em 30%.
As consequências farmacodinâmicas do uso concomitante de losartana e inibidores de P450 2C9 não foram examinadas. Indivíduos que não metabolizam losartana em metabólito ativo demonstraram ter um defeito específico e raro no citocromo P450 2C9. Esses dados sugerem que a conversão de losartana em seu metabólito ativo é mediada principalmente por P450 2C9 e não por P450 3A4.
Estudos clínicos
Hipertensão
Hipertensão adulta
Os efeitos anti-hipertensivos de COZAAR 25mg foram demonstrados principalmente em 4 ensaios controlados por placebo, de 6 a 12 semanas, com dosagens de 10 a 150 mg por dia em pacientes com pressão arterial diastólica basal de 95-115. Os estudos permitiram comparações de duas doses (50-100 mg/dia) como regimes de uma ou duas vezes ao dia, comparações de efeitos de pico e vale e comparações de resposta por sexo, idade e raça. Três estudos adicionais examinaram os efeitos anti-hipertensivos de losartana e hidroclorotiazida em combinação.
Os 4 estudos de monoterapia com losartana incluíram um total de 1.075 pacientes randomizados para várias doses de losartana e 334 para placebo. As doses de 10 e 25 mg produziram algum efeito no pico (6 horas após a administração), mas respostas pequenas e inconsistentes no vale (24 horas). Doses de 50, 100 e 150 mg uma vez ao dia produziram reduções médias sistólica/diastólica estatisticamente significativas na pressão arterial, em comparação com placebo na faixa de 5,5-10,5/3,5-7,5 mmHg, com a dose de 150 mg não dando efeito maior que 50- 100mg. A administração de duas vezes ao dia de 50-100 mg/dia deu respostas de vale consistentemente maiores do que a administração de uma vez ao dia na mesma dose total. Os efeitos de pico (6 horas) foram uniformemente, mas moderadamente, maiores do que os efeitos de vale, com a relação vale-pico para respostas sistólica e diastólica de 50-95% e 60-90%, respectivamente.
A adição de uma dose baixa de hidroclorotiazida (12,5 mg) a 50 mg de losartana uma vez ao dia resultou em reduções da pressão arterial ajustadas ao placebo de 15,5/9,2 mmHg.
análise dos subgrupos de idade, sexo e raça de pacientes mostrou que homens e mulheres, e pacientes acima e abaixo de 65 anos, tiveram respostas geralmente semelhantes. COZAAR 25mg foi eficaz na redução da pressão arterial independentemente da raça, embora o efeito tenha sido um pouco menor em pacientes negros (geralmente uma população com baixo teor de renina).
Hipertensão Pediátrica
O efeito anti-hipertensivo da losartana foi estudado em um estudo envolvendo 177 pacientes pediátricos hipertensos com idades entre 6 e 16 anos. Crianças com peso DOSAGEM E ADMINISTRAÇÃO . A maioria das crianças apresentava hipertensão associada à doença renal e urogenital. A pressão arterial diastólica sentada (SiDBP) na entrada no estudo era superior ao nível do percentil 95 para a idade, sexo e altura do paciente. Ao final de três semanas, a losartana reduziu a pressão arterial sistólica e diastólica, medida no vale, de maneira dose-dependente. No geral, as duas doses mais altas (25 a 50 mg em pacientes
Pacientes hipertensos com hipertrofia ventricular esquerda
estudo LIFE foi um estudo multinacional, duplo-cego, comparando COZAAR 50mg e atenolol em 9.193 pacientes hipertensos com hipertrofia ventricular esquerda documentada por ECG. Pacientes com infarto do miocárdio ou acidente vascular cerebral nos seis meses anteriores à randomização foram excluídos. Os pacientes foram randomizados para receber COZAAR 50 mg ou atenolol 50 mg uma vez ao dia. Se a meta de pressão arterial (
Dos pacientes randomizados, 4.963 (54%) eram do sexo feminino e 533 (6%) eram negros. A idade média foi de 67 anos com 5704 (62%) idade ≥65. No início do estudo, 1.195 (13%) tinham diabetes, 1.326 (14%) tinham hipertensão sistólica isolada, 1.469 (16%) tinham doença coronariana e 728 (8%) tinham doença cerebrovascular. A pressão arterial média basal foi de 174/98 mmHg em ambos os grupos de tratamento. O tempo médio de seguimento foi de 4,8 anos. No final do estudo ou na última visita antes de um desfecho primário, 77% do grupo tratado com COZAAR 50mg e 73% do grupo tratado com atenolol ainda estavam tomando a medicação do estudo. Dos pacientes que ainda tomavam a medicação do estudo, as doses médias de COZAAR e atenolol foram ambas de cerca de 80 mg/dia, e 15% estavam tomando atenolol ou losartana como monoterapia, enquanto 77% também estavam recebendo hidroclorotiazida (na dose média de 20 mg/dia em cada grupo). A redução da pressão arterial medida no vale foi semelhante para ambos os grupos de tratamento, mas a pressão arterial não foi medida em nenhuma outra hora do dia. No final do estudo ou na última visita antes de um desfecho primário, as pressões arteriais médias foram 144,1/81,3 mmHg para o grupo tratado com COZAAR e 145,4/80,9 mmHg para o grupo tratado com atenolol; a diferença na pressão arterial sistólica (PAS) de 1,3 mmHg foi significativa (p
desfecho primário foi a primeira ocorrência de morte cardiovascular, acidente vascular cerebral não fatal ou infarto do miocárdio não fatal. Os pacientes com eventos não fatais permaneceram no estudo, de modo que também havia um exame do primeiro evento de cada tipo, mesmo que não fosse o primeiro evento (por exemplo, um acidente vascular cerebral após um infarto do miocárdio inicial seria contado na análise do acidente vascular cerebral). O tratamento com COZAAR 50mg resultou em uma redução de 13% (p=0,021) no risco do desfecho primário em comparação com o grupo atenolol (ver Figura 1 e Tabela 3); esta diferença foi principalmente o resultado de um efeito sobre acidente vascular cerebral fatal e não fatal. O tratamento com COZAAR reduziu o risco de acidente vascular cerebral em 25% em relação ao atenolol (p=0,001) (ver Figura 2 e Tabela 3).
Figura 1: Estimativas de Kaplan-Meier do desfecho primário de tempo para morte cardiovascular, acidente vascular cerebral não fatal ou infarto do miocárdio não fatal nos grupos tratados com COZAAR 100mg e atenolol. A Redução de Risco é ajustada para o escore de risco de Framingham basal e nível de hipertrofia ventricular esquerda eletrocardiográfica
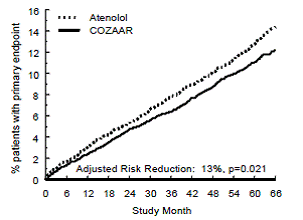
Figura 2: Estimativa de Kaplan-Meier do tempo para acidente vascular cerebral fatal/não fatal nos grupos tratados com COZAAR 50mg e atenolol. A Redução de Risco é ajustada para o escore de risco de Framingham inicial e nível de hipertrofia ventricular esquerda eletrocardiográfica
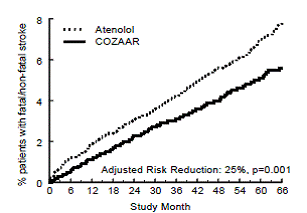
Tabela 3 mostra os resultados para o endpoint composto primário e os endpoints individuais. O desfecho primário foi a primeira ocorrência de acidente vascular cerebral, infarto do miocárdio ou morte cardiovascular, analisada pela abordagem ITT. A tabela mostra o número de eventos para cada componente de duas maneiras diferentes. Os Componentes do endpoint primário (como primeiro evento) contam apenas os eventos que definem o endpoint primário, enquanto os endpoints secundários contam todos os primeiros eventos de um determinado tipo, sejam eles precedidos ou não por um tipo diferente de evento.
Embora o estudo LIFE tenha favorecido o COZAAR em relação ao atenolol em relação ao desfecho primário (p=0,021), esse resultado é de um único estudo e, portanto, é menos contundente do que a diferença entre COZAAR e placebo. Embora não seja medida diretamente, a diferença entre COZAAR e placebo é convincente porque há evidências de que o próprio atenolol é eficaz (vs. placebo) na redução de eventos cardiovasculares, incluindo acidente vascular cerebral, em pacientes hipertensos.
Outros desfechos clínicos do estudo LIFE foram: mortalidade total, hospitalização por insuficiência cardíaca ou angina de peito, procedimentos de revascularização coronariana ou periférica e parada cardíaca reanimada. Não houve diferenças significativas nas taxas desses desfechos entre os grupos COZAAR e atenolol.
Para o desfecho primário e acidente vascular cerebral, os efeitos de COZAAR 25mg em subgrupos de pacientes definidos por idade, sexo, raça e presença ou ausência de hipertensão sistólica isolada (ISH), diabetes e histórico de doença cardiovascular (DCV) são mostrados na Figura 3 abaixo . As análises de subgrupos podem ser difíceis de interpretar e não se sabe se representam diferenças verdadeiras ou efeitos casuais.
Figura 3: Eventos de endpoint primário† em subgrupos demográficos
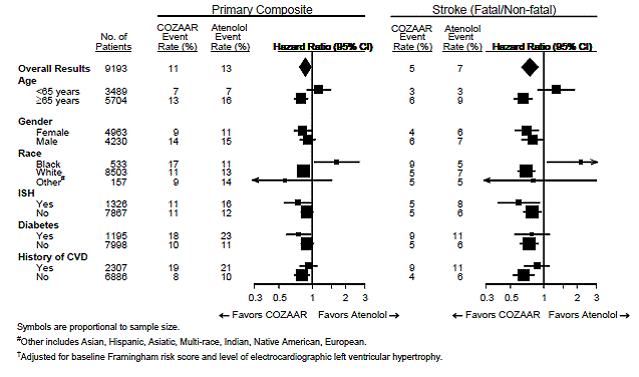
Nefropatia em pacientes diabéticos tipo 2
estudo RENAAL foi um estudo multicêntrico, duplo-cego, randomizado, controlado por placebo, realizado em todo o mundo em 1.513 pacientes com diabetes tipo 2 com nefropatia (definida como creatinina sérica de 1,3 a 3,0 mg/dL em mulheres ou homens ≤ 60 kg e 1,5 a 3,0 mg /dL em homens >60 kg e proteinúria [relação albumina/creatinina urinária ≥300 mg/g]).
Os pacientes foram randomizados para receber COZAAR 50 mg uma vez ao dia ou placebo em um histórico de terapia anti-hipertensiva convencional excluindo inibidores da ECA e antagonistas da angiotensina II. Após um mês, os investigadores foram instruídos a titular a droga do estudo para 100 mg uma vez ao dia se a meta de pressão arterial mínima (140/90 mmHg) não fosse alcançada. No geral, 72% dos pacientes receberam a dose diária de 100 mg em mais de 50% do tempo em que estavam tomando o medicamento do estudo. Como o estudo foi projetado para alcançar o controle igual da pressão arterial em ambos os grupos, outros agentes anti-hipertensivos (diuréticos, bloqueadores dos canais de cálcio, alfa ou betabloqueadores e agentes de ação central) podem ser adicionados conforme necessário em ambos os grupos. Os pacientes foram acompanhados por uma duração média de 3,4 anos.
população do estudo foi diversa em relação à raça (asiática 16,7%, negra 15,2%, hispânica 18,3%, branca 48,6%). No geral, 63,2% dos pacientes eram homens e 66,4% tinham menos de 65 anos. Quase todos os pacientes (96,6%) tinham histórico de hipertensão, e os pacientes entraram no estudo com creatinina sérica média de 1,9mg/dL e proteinúria média (albumina/creatinina urinária) de 1808 mg/g no início do estudo.
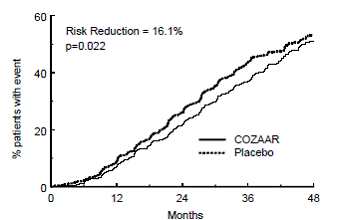
O desfecho primário do estudo foi o tempo até a primeira ocorrência de qualquer um dos seguintes eventos: duplicação da creatinina sérica, doença renal terminal (ESRD) (necessidade de diálise ou transplante) ou morte. O tratamento com COZAAR resultou em uma redução de risco de 16% neste desfecho (ver Figura 4 e Tabela 4). O tratamento com COZAAR também reduziu a ocorrência de duplicação sustentada da creatinina sérica em 25% e ESRD em 29% como desfechos separados, mas não teve efeito sobre a mortalidade geral (ver Tabela 4).
pressão arterial média basal foi de 152/82 mmHg para COZAAR mais terapia anti-hipertensiva convencional e 153/82 mmHg para placebo mais terapia anti-hipertensiva convencional. Ao final do estudo, as pressões arteriais médias foram de 143/76 mmHg para o grupo tratado com COZAAR 100mg e 146/77 mmHg para o grupo tratado com placebo.
Figura 4: Curva de Kaplan-Meier para o desfecho primário composto de duplicação da creatinina sérica, doença renal terminal (necessidade de diálise ou transplante) ou morte
Os desfechos secundários do estudo foram alteração na proteinúria, alteração na taxa de progressão da doença renal e o composto de morbidade e mortalidade por causas cardiovasculares (hospitalização por insuficiência cardíaca, infarto do miocárdio, revascularização, acidente vascular cerebral, hospitalização por angina instável ou doença cardiovascular Em comparação com placebo, COZAAR reduziu significativamente a proteinúria em uma média de 34%, um efeito que ficou evidente dentro de 3 meses após o início da terapia, e reduziu significativamente a taxa de declínio na taxa de filtração glomerular durante o estudo em 13%, conforme medido por o recíproco da concentração de creatinina sérica. Não houve diferença significativa na incidência do desfecho composto de morbidade e mortalidade cardiovascular.
Os efeitos favoráveis de COZAAR foram observados em pacientes também tomando outros medicamentos anti-hipertensivos (antagonistas dos receptores da angiotensina II e inibidores da enzima de conversão da angiotensina não foram permitidos), agentes hipoglicemiantes orais e agentes hipolipemiantes.
Para o desfecho primário e ESRD, os efeitos de COZAAR em subgrupos de pacientes definidos por idade, sexo e raça são mostrados na Tabela 5 abaixo. As análises de subgrupos podem ser difíceis de interpretar e não se sabe se representam diferenças verdadeiras ou efeitos casuais.
INFORMAÇÃO DO PACIENTE
COZAAR® (CO-zar) (comprimidos de losartana potássica) 25 mg, 50 mg, 100 mg
Leia as informações do paciente que acompanham o COZAAR antes de começar a tomá-lo e sempre que receber um reabastecimento. Pode haver novas informações. Este folheto não substitui a conversa com o seu médico sobre a sua condição e tratamento.
Qual é a informação mais importante que devo saber sobre COZAAR?
- COZAAR pode causar danos ou morte ao feto.
- Fale com o seu médico sobre outras formas de baixar a pressão arterial se planeia engravidar.
- Se engravidar enquanto estiver a tomar COZAAR, informe o seu médico imediatamente.
O que é COZAAR 100mg?
COZAAR 100mg é um medicamento de prescrição chamado bloqueador do receptor da angiotensina (BRA). É usado:
- sozinho ou com outros medicamentos para a pressão arterial para baixar a pressão arterial elevada (hipertensão).
- para diminuir a chance de acidente vascular cerebral em pacientes com pressão alta e um problema cardíaco chamado hipertrofia ventricular esquerda. COZAAR pode não ajudar pacientes negros com este problema.
- para retardar o agravamento da doença renal diabética (nefropatia) em pacientes com diabetes tipo 2 que têm ou tiveram pressão alta.
COZAAR 25mg não foi estudado em crianças com menos de 6 anos de idade ou em crianças com certos problemas renais.
Pressão alta (hipertensão) A pressão arterial é a força nos vasos sanguíneos quando o coração bate e quando o coração descansa. Você tem pressão alta quando a força é demais. COZAAR 25mg pode ajudar seus vasos sanguíneos a relaxarem para que sua pressão arterial seja mais baixa.
Hipertrofia Ventricular Esquerda (HVE) é um alargamento das paredes da câmara esquerda do coração (a principal câmara de bombeamento do coração). LVH pode acontecer de várias coisas. A hipertensão arterial é a causa mais comum de HVE.
Diabetes tipo 2 com nefropatia . O diabetes tipo 2 é um tipo de diabetes que ocorre principalmente em adultos. Se você tem nefropatia diabética, isso significa que seus rins não funcionam adequadamente devido aos danos causados pelo diabetes.
Quem não deve tomar COZAAR 100mg?
- Não tome COZAAR 25mg se você é alérgico a qualquer um dos ingredientes de COZAAR . Consulte o final deste folheto para obter uma lista completa dos ingredientes de COZAAR.
- Não tome COZAAR se você tem diabetes e está tomando um medicamento chamado alisquireno para reduzir a pressão arterial.
O que devo dizer ao meu médico antes de tomar COZAAR 50mg?
Informe o seu médico sobre todas as suas condições médicas, incluindo se você:
- está grávida ou planejando engravidar. Ver " Qual é a informação mais importante que devo saber sobre COZAAR 25mg? "
- está amamentando . Não se sabe se COZAAR 50mg passa para o leite materno. Você deve optar por tomar COZAAR 50mg ou amamentar, mas não ambos.
- estão vomitando muito ou tendo muita diarréia
- tem problemas de fígado
- tem problemas renais
Informe o seu médico sobre todos os medicamentos que você toma, incluindo medicamentos prescritos e não prescritos, vitaminas e suplementos de ervas. COZAAR e alguns outros medicamentos podem interagir entre si. Informe especialmente o seu médico se estiver a tomar:
- suplementos de potássio
- substitutos do sal contendo potássio
- outros medicamentos que podem aumentar o potássio sérico
- pílulas de água (diuréticos)
- lítio (um medicamento usado para tratar um certo tipo de depressão)
- medicamentos usados para tratar a dor e a artrite, chamados anti-inflamatórios não esteroides (AINEs), incluindo inibidores da COX-2
- outros medicamentos para reduzir a pressão arterial
Como devo tomar COZAAR 25mg?
- Tome COZAAR 100mg exatamente como prescrito pelo seu médico. O seu médico pode alterar a sua dose, se necessário.
- COZAAR 50mg pode ser tomado com ou sem alimentos.
- Se você esquecer de uma dose, tome-a assim que se lembrar. Se estiver próximo da próxima dose, não tome a dose esquecida. Apenas tome a próxima dose no horário habitual.
- Se você tomar muito COZAAR, ligue para o seu médico ou para o Centro de Controle de Intoxicações, ou dirija-se imediatamente ao pronto-socorro do hospital mais próximo.
Quais são os possíveis efeitos colaterais do COZAAR?
COZAAR 25mg pode causar os seguintes efeitos colaterais que podem ser graves:
- Lesão ou morte de bebês não nascidos. Consulte " Quais são as informações mais importantes que devo saber sobre COZAAR?"
- Reação alérgica Os sintomas de uma reação alérgica são inchaço da face, lábios, garganta ou língua. Obtenha ajuda médica de emergência imediatamente e pare de tomar COZAAR.
- Pressão arterial baixa (hipotensão) . A pressão arterial baixa pode fazer com que você se sinta fraco ou tonto. Deite-se se você se sentir fraco ou tonto. Ligue para o seu médico imediatamente.
- Para as pessoas que já têm problemas renais, você pode ver uma piora no funcionamento dos rins. Ligue para o seu médico se você tiver inchaço nos pés, tornozelos ou mãos, ou ganho de peso inexplicável.
- Níveis elevados de potássio no sangue
Os efeitos colaterais mais comuns de COZAAR 50mg em pessoas com pressão alta são:
- "resfriados" (infecção respiratória superior)
- tontura
- nariz entupido
- dor nas costas
Os efeitos colaterais mais comuns de COZAAR 50mg em pessoas com diabetes tipo 2 com doença renal diabética são:
- diarréia
- cansaço
- Baixo teor de açúcar no sangue
- dor no peito
- potássio no sangue alto
- pressão sanguínea baixa
Informe o seu médico se tiver algum efeito colateral que o incomode ou que não vá embora.
Isto é não uma lista completa de efeitos colaterais. Para obter uma lista completa, pergunte ao seu médico ou farmacêutico.
Como devo armazenar o COZAAR 100mg?
- Armazene os comprimidos de COZAAR entre 15°C e 30°C (59°F a 86°F).
- Mantenha COZAAR em um recipiente bem fechado que proteja o medicamento da luz.
- Mantenha COZAAR e todos os medicamentos fora do alcance das crianças.
Informações gerais sobre COZAAR
Às vezes, medicamentos são prescritos para condições que não são mencionadas nos folhetos informativos do paciente. Não use COZAAR para uma condição para a qual não foi prescrito. Não dê COZAAR a outras pessoas, mesmo que tenham os mesmos sintomas que você. Pode prejudicá-los.
Este folheto resume as informações mais importantes sobre COZAAR. Se você quiser mais informações, converse com seu médico. Você pode pedir ao seu farmacêutico ou médico informações sobre COZAAR que são escritas para profissionais de saúde.
Quais são os ingredientes de COZAAR 25mg?
Ingredientes ativos: losartana potássica
Ingredientes inativos:
celulose microcristalina, lactose hidratada, amido pré-gelatinizado, estearato de magnésio, hidroxipropilcelulose, hipromelose e dióxido de titânio. COZAAR 25 mg, COZAAR 50 mg e COZAAR 100 mg também podem conter cera de carnaúba.
