Epivir 150mg Lamivudine Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Epivir e como é usado?
Epivir 150mg é um medicamento de prescrição usado para tratar os sintomas da infecção pelo HIV e da hepatite B crônica. Epivir 150mg pode ser usado sozinho ou com outros medicamentos.
Epivir pertence a uma classe de medicamentos chamados Agentes da Hepatite B/Hepatite C; HIV, ITRNs.
Não se sabe se Epivir é seguro e eficaz em crianças com menos de 3 meses de idade.
Quais são os possíveis efeitos colaterais do Epivir 150mg?
Epivir pode causar efeitos colaterais graves, incluindo:
- urticária,
- dificuldade para respirar,
- inchaço do rosto, lábios, língua ou garganta,
- dores musculares incomuns,
- dor de estômago,
- vômito,
- frequência cardíaca irregular,
- tontura,
- sentindo frio,
- fraqueza,
- cansaço,
- dor intensa na parte superior do estômago se espalhando para as costas,
- náusea,
- ritmo cardíaco acelerado,
- inchaço em torno de seu meio,
- dor de estômago superior do lado direito,
- perda de apetite,
- urina escura,
- fezes cor de barro,
- amarelecimento da pele ou dos olhos (icterícia),
- febre,
- suor noturno,
- glândulas inchadas,
- feridas frias,
- tosse,
- chiado,
- diarréia,
- perda de peso,
- dificuldade para falar ou engolir,
- problemas de equilíbrio ou movimento dos olhos,
- sensação espinhosa,
- inchaço no pescoço ou na garganta (tireoide aumentada),
- alterações menstruais e
- impotência
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Epivir incluem:
- náusea,
- diarréia,
- dor de cabeça,
- febre,
- cansaço,
- mal-estar geral,
- dor de ouvido ou sensação de plenitude,
- problemas de audição,
- drenagem do ouvido,
- agitação em uma criança,
- nariz entupido,
- espirrando,
- dor de garganta, e
- tosse
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Epivir. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
AVISO
EXACERBAÇÕES DE HEPATITE B, E DIFERENTES FORMULAÇÕES DE EPIVIR.
Exacerbações da Hepatite B
Exacerbações agudas graves da hepatite B foram relatadas em pacientes co-infectados pelo vírus da hepatite B (HBV) e vírus da imunodeficiência humana (HIV-1) e que descontinuaram EPIVIR. A função hepática deve ser monitorada de perto com acompanhamento clínico e laboratorial por pelo menos vários meses em pacientes que descontinuam EPIVIR e estão coinfectados com HIV-1 e HBV. Se apropriado, o início da terapia anti-hepatite B pode ser justificado [ver ADVERTÊNCIAS E PRECAUÇÕES].
Diferenças importantes entre produtos contendo lamivudina
Os comprimidos e a solução oral de EPIVIR 150mg (usados para tratar a infecção pelo HIV-1) contêm uma dose mais alta do ingrediente ativo (lamivudina) do que os comprimidos e a solução oral de EPIVIR-HBV (usados para tratar a infecção crônica pelo HBV). Pacientes com infecção pelo HIV-1 devem receber apenas formas farmacêuticas apropriadas para o tratamento do HIV-1 [ver ADVERTÊNCIAS E PRECAUÇÕES].
DESCRIÇÃO
EPIVIR (também conhecido como 3TC) é uma marca para lamivudina, um análogo de nucleosídeo sintético com atividade contra HIV-1 e HBV. O nome químico da lamivudina é (2R,cis)-4-amino-1(2-hidroximetil-1,3-oxatiolan-5-il)-(1H)-pirimidin-2-ona. A lamivudina é o (-)enantiômero de um análogo didesoxi da citidina. A lamivudina também foi referida como (-)2',3'-didesoxi, 3'tiacitidina. Tem uma fórmula molecular de C8H11N3O3S e um peso molecular de 229,3 g por mol. Tem a seguinte fórmula estrutural:
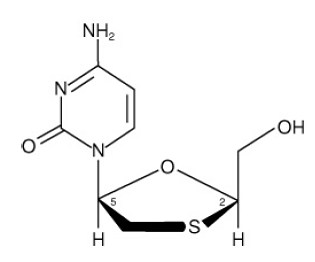
A lamivudina é um sólido cristalino branco a esbranquiçado com uma solubilidade de aproximadamente 70 mg por mL em água a 20°C.
Os comprimidos de EPIVIR 150mg são para administração oral. Cada comprimido revestido por película de 150 mg contém 150 mg de lamivudina e os ingredientes inativos hipromelose, estearato de magnésio, celulose microcristalina, polietilenoglicol, polissorbato 80, amidoglicolato de sódio e dióxido de titânio.
Cada comprimido revestido por película de 300 mg contém 300 mg de lamivudina e os ingredientes inativos óxido de ferro preto, hipromelose, estearato de magnésio, celulose microcristalina, polietilenoglicol, polissorbato 80, amidoglicolato de sódio e dióxido de titânio.
EPIVIR solução oral é para administração oral. Um mililitro (1 mL) de EPIVIR solução oral contém 10 mg de lamivudina (10 mg por mL) em solução aquosa e os ingredientes inativos aromas artificiais de morango e banana, ácido cítrico (anidro), metilparabeno, propilenoglicol, propilparabeno, citrato de sódio (di-hidrato) e sacarose (200 mg).
INDICAÇÕES
EPIVIR 150mg é um análogo de nucleosídeo indicado em combinação com outros agentes antirretrovirais para o tratamento da infecção pelo vírus da imunodeficiência humana tipo 1 (HIV-1).
Limitações de uso
- A dosagem deste produto é para HIV-1 e não para HBV.
DOSAGEM E ADMINISTRAÇÃO
Dosagem recomendada para pacientes adultos
A dosagem recomendada de EPIVIR 150 mg em adultos infectados pelo HIV-1 é de 300 mg por dia, administrados como 150 mg por via oral duas vezes ao dia ou 300 mg por via oral uma vez ao dia com ou sem alimentos. Se a lamivudina for administrada a um paciente infectado pelo HIV-1 e HBV, a dosagem indicada para a terapia do HIV-1 deve ser usada como parte de um regime de combinação apropriado [ver AVISOS E PRECAUÇÕES ].
Dosagem recomendada para pacientes pediátricos
EPIVIR 150mg comprimido é a formulação preferida para pacientes pediátricos infectados pelo HIV-1 que pesam pelo menos 14 kg e para os quais uma forma farmacêutica sólida é apropriada. Antes de prescrever os comprimidos marcados com EPIVIR, os pacientes pediátricos devem ser avaliados quanto à capacidade de engolir os comprimidos. Para pacientes incapazes de engolir comprimidos de EPIVIR 150mg de forma segura e confiável, a formulação de solução oral pode ser prescrita [ver AVISOS E PRECAUÇÕES ]. A dosagem oral recomendada de comprimidos de EPIVIR 150mg para pacientes pediátricos infectados pelo HIV-1 é apresentada na Tabela 1.
Solução oral
A dose recomendada de EPIVIR 150 mg solução oral em pacientes pediátricos infectados pelo HIV-1 com 3 meses ou mais é de 5 mg por kg por via oral duas vezes ao dia ou 10 mg por kg por via oral uma vez ao dia (até um máximo de 300 mg por dia), administrado em combinação com outros agentes antirretrovirais [ver FARMACOLOGIA CLÍNICA ]. Considere a carga viral do HIV-1 e a contagem/porcentagem de células CD4+ ao selecionar o intervalo de dosagem para pacientes que iniciam o tratamento com solução oral [ver AVISOS E PRECAUÇÕES , FARMACOLOGIA CLÍNICA ].
Pacientes com Insuficiência Renal
dosagem de EPIVIR 150mg é ajustada de acordo com a função renal. Os ajustes de dosagem estão listados na Tabela 2 [ver FARMACOLOGIA CLÍNICA ].
Nenhuma dosagem adicional de EPIVIR 150mg é necessária após hemodiálise de rotina (4 horas) ou diálise peritoneal.
Embora não existam dados suficientes para recomendar um ajuste específico da dose de EPIVIR em pacientes pediátricos com insuficiência renal, deve-se considerar uma redução na dose e/ou um aumento no intervalo entre as doses.
COMO FORNECIDO
Formas de dosagem e pontos fortes
Comprimidos com pontuação EPIVIR
Os comprimidos marcados com EPIVIR contêm 150 mg de lamivudina. Os comprimidos são brancos, em forma de diamante, com ranhuras, revestidos por película, gravados com “GX CJ7” em ambos os lados.
EPIVIR Comprimidos
Os comprimidos de EPIVIR contêm 300 mg de lamivudina. Os comprimidos são cinzentos, em forma de diamante modificado, revestidos por película e gravados com “GX EJ7” num dos lados e lisos no verso.
EPIVIR Solução Oral
EPIVIR solução oral contém 10 mg de lamivudina por 1 mL. A solução é um líquido límpido, incolor a amarelo pálido, com sabor a morango-banana.
Armazenamento e manuseio
EPIVIR Os comprimidos ranhurados contêm 150 mg de lamivudina, são brancos, em forma de diamante, revestidos por película e gravados com “GX CJ7” em ambos os lados. Embalado da seguinte forma:
Frasco de 60 comprimidos ( NDC 49702-203-18) com fecho resistente a crianças.
EPIVIR Os comprimidos contêm 300 mg de lamivudina, são cinzentos, em forma de diamante modificado, revestidos por película e gravados com “GX EJ7” num dos lados e lisos no verso. Embalado da seguinte forma:
Frasco de 30 comprimidos ( NDC 49702-204-13) com fecho resistente a crianças.
Armazenamento recomendado
Armazene os comprimidos de EPIVIR a 25°C (77°F); excursões permitidas de 15° a 30°C (59° a 86°F) [ver Temperatura ambiente controlada USP ].
EPIVIR solução oral é um líquido límpido, incolor a amarelo pálido, com sabor a morango e banana. Cada mL da solução contém 10 mg de lamivudina. Embalado da seguinte forma:
Frasco plástico de 240 mL (NDC 49702-205-48) com fecho resistente a crianças. Este produto não requer reconstituição.
Armazenar em frascos bem fechados a 25°C (77°F) [ver Temperatura ambiente controlada USP ].
Fabricado para: ViiV Healthcare Research Triangle Park, NC 27709. por: GlaxoSmithKline Research Triangle Park, NC 27709, Fabricado sob acordo do Shire Pharmaceuticals Group plc. Revisado: abril de 2018
EFEITOS COLATERAIS
As seguintes reações adversas são discutidas em outras seções da bula:
- Exacerbações da hepatite B [ver AVISO EM CAIXA , AVISOS E PRECAUÇÕES ].
- Acidose láctica e hepatomegalia grave com esteatose [ver AVISOS E PRECAUÇÕES ].
- Descompensação hepática em pacientes coinfectados com HIV-1 e hepatite C [ver AVISOS E PRECAUÇÕES ].
- Pancreatite [ver AVISOS E PRECAUÇÕES ].
- Síndrome de reconstituição imune [ver AVISOS E PRECAUÇÕES ].
Experiência de Ensaios Clínicos
Experiência de Ensaios Clínicos em Indivíduos Adultos
Como os ensaios clínicos são conduzidos em condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser comparadas diretamente com as taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática clínica.
O perfil de segurança de EPIVIR 150mg em adultos é baseado principalmente em 3.568 indivíduos infectados pelo HIV-1 em 7 ensaios clínicos.
As reações adversas mais comuns são cefaleia, náusea, mal-estar, fadiga, sinais e sintomas nasais, diarreia e tosse.
As reações adversas clínicas selecionadas em mais ou igual a 5% dos indivíduos durante a terapia com EPIVIR 150 mg duas vezes ao dia mais RETROVIR 200 mg 3 vezes ao dia por até 24 semanas estão listadas na Tabela 3.
Pancreatite
Pancreatite foi observada em 9 de 2.613 indivíduos adultos (0,3%) que receberam EPIVIR 150mg em ensaios clínicos controlados EPV20001, NUCA3001, NUCB3001, NUCA3002, NUCB3002 e NUCB3007 [ver AVISOS E PRECAUÇÕES ].
EPIVIR 300 mg uma vez ao dia
Os tipos e frequências de reações adversas clínicas relatadas em indivíduos recebendo EPIVIR 300 mg uma vez ao dia ou EPIVIR 150 mg duas vezes ao dia (em regimes de combinação de 3 medicamentos em EPV20001 e EPV40001) por 48 semanas foram semelhantes.
Anormalidades laboratoriais selecionadas observadas durante a terapia estão resumidas na Tabela 4.
As frequências de anormalidades laboratoriais selecionadas relatadas em indivíduos recebendo EPIVIR 300 mg uma vez ao dia ou EPIVIR 150 mg duas vezes ao dia (em regimes de combinação de 3 medicamentos em EPV20001 e EPV40001) foram semelhantes.
Experiência de Ensaios Clínicos em Sujeitos Pediátricos
EPIVIR solução oral foi estudado em 638 indivíduos pediátricos com idades compreendidas entre os 3 meses e os 18 anos em 3 ensaios clínicos.
Reações adversas clínicas selecionadas e achados físicos com frequência maior ou igual a 5% durante a terapia com EPIVIR 4 mg por kg duas vezes ao dia mais RETROVIR 160 mg por m² 3 vezes ao dia em pacientes virgens de terapia (menor ou igual a 56 dias de antirretroviral terapia) pacientes pediátricos estão listados na Tabela 5.
Pancreatite
Pancreatite, que foi fatal em alguns casos, foi observada em pacientes pediátricos com experiência com nucleosídeos antirretrovirais recebendo EPIVIR sozinho ou em combinação com outros agentes antirretrovirais. Em um estudo aberto de escalonamento de dose (NUCA2002), 14 indivíduos (14%) desenvolveram pancreatite enquanto recebiam monoterapia com EPIVIR. Três desses indivíduos morreram de complicações da pancreatite. Em um segundo estudo aberto (NUCA2005), 12 indivíduos (18%) desenvolveram pancreatite. No Ensaio ACTG300, não foi observada pancreatite em 236 indivíduos randomizados para EPIVIR 150mg mais RETROVIR. Pancreatite foi observada em 1 paciente neste estudo que recebeu EPIVIR aberto em combinação com RETROVIR e ritonavir após a descontinuação da monoterapia com didanosina [ver AVISOS E PRECAUÇÕES ].
Parestesias e Neuropatias Periféricas
Parestesias e neuropatias periféricas foram relatadas em 15 indivíduos (15%) no Ensaio NUCA2002, 6 indivíduos (9%) no Ensaio NUCA2005 e 2 indivíduos (menos de 1%) no Ensaio ACTG300.
Anormalidades laboratoriais selecionadas experimentadas por pacientes pediátricos virgens de terapia (menos ou igual a 56 dias de terapia antirretroviral) estão listadas na Tabela 6.
Sujeitos Pediátricos Dosagem Uma Vez ao Dia Versus Duas Vezes ao Dia (COL105677)
A segurança da administração de EPIVIR 150mg uma vez ao dia em comparação com duas vezes ao dia foi avaliada no estudo ARROW. A avaliação de segurança primária no estudo ARROW foi baseada em eventos adversos de Grau 3 e Grau 4. A frequência de eventos adversos de Grau 3 e 4 foi semelhante entre os indivíduos randomizados para a dosagem de uma vez ao dia em comparação com os indivíduos randomizados para a dosagem de duas vezes ao dia. Um evento de hepatite de Grau 4 na coorte de uma vez ao dia foi considerado como causalidade incerta pelo investigador e todos os outros eventos adversos de Grau 3 ou 4 foram considerados não relacionados pelo investigador.
Recém-nascidos
Informações limitadas de segurança de curto prazo estão disponíveis a partir de 2 pequenos estudos não controlados na África do Sul em recém-nascidos recebendo lamivudina com ou sem zidovudina na primeira semana de vida após tratamento materno iniciado na semana 38 ou 36 de gestação [ver FARMACOLOGIA CLÍNICA ]. Reações adversas selecionadas relatadas nesses recém-nascidos incluíram aumento dos testes de função hepática, anemia, diarreia, distúrbios eletrolíticos, hipoglicemia, icterícia e hepatomegalia, erupção cutânea, infecções respiratórias e sepse; 3 neonatos morreram (1 de gastroenterite com acidose e convulsões, 1 de lesão traumática e 1 de causas desconhecidas). Dois outros casos de gastroenterite ou diarreia não fatais foram relatados, incluindo 1 com convulsões; 1 criança teve insuficiência renal transitória associada à desidratação. A ausência de grupos de controle limita as avaliações de causalidade, mas deve-se supor que bebês expostos no período perinatal podem estar em risco de reações adversas comparáveis às relatadas em pacientes pediátricos e adultos infectados pelo HIV-1 tratados com regimes combinados contendo lamivudina. Os efeitos a longo prazo da exposição in utero e infantil à lamivudina não são conhecidos.
Experiência pós-marketing
As seguintes reações adversas foram identificadas durante o uso pós-aprovação de EPIVIR. Como essas reações são relatadas voluntariamente por uma população de tamanho desconhecido, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento. Essas reações foram escolhidas para inclusão devido a uma combinação de sua gravidade, frequência de notificação ou potencial relação causal com a lamivudina.
Corpo como um todo
Redistribuição/acumulação de gordura corporal.
Endócrino e Metabólico
Hiperglicemia.
Em geral
Fraqueza. Anemia Hemica e Linfática (incluindo aplasia pura de eritrócitos e anemias graves que progridem na terapia).
Hepático e Pancreático
Acidose láctica e esteatose hepática [ver AVISOS E PRECAUÇÕES ], exacerbações pós-tratamento da hepatite B [ver AVISOS E PRECAUÇÕES ].
Hipersensibilidade
Anafilaxia, urticária.
Musculoesquelético
Fraqueza muscular, elevação de CPK, rabdomiólise. Pele Alopecia, prurido.
INTERAÇÕES MEDICAMENTOSAS
Fármacos que Inibem os Transportadores de Cátions Orgânicos
lamivudina é predominantemente eliminada na urina por secreção catiônica orgânica ativa. A possibilidade de interações com outros medicamentos administrados concomitantemente deve ser considerada, particularmente quando sua principal via de eliminação é a secreção renal ativa via sistema de transporte catiônico orgânico (p. FARMACOLOGIA CLÍNICA ]. Não há dados disponíveis sobre interações com outros medicamentos que tenham mecanismos de depuração renal semelhantes aos da lamivudina.
Sorbitol
A coadministração de doses únicas de lamivudina e sorbitol resultou em uma redução dependente da dose de sorbitol nas exposições à lamivudina. Quando possível, evite o uso de medicamentos contendo sorbitol com lamivudina [ver AVISOS E PRECAUÇÕES , FARMACOLOGIA CLÍNICA ].
AVISOS
Incluído como parte do PRECAUÇÕES seção.
PRECAUÇÕES
Pacientes com coinfecção pelo vírus da hepatite B
Exacerbações de hepatite pós-tratamento
Evidências clínicas e laboratoriais de exacerbações de hepatite ocorreram após a descontinuação da lamivudina. Essas exacerbações foram detectadas principalmente por elevações séricas de ALT, além do ressurgimento do DNA do VHB. Embora a maioria dos eventos pareça ter sido autolimitada, fatalidades foram relatadas em alguns casos. Eventos semelhantes foram relatados na experiência pós-comercialização após mudanças de regimes de tratamento de HIV-1 contendo lamivudina para regimes sem lamivudina em pacientes infectados com HIV-1 e HBV. A relação causal com a descontinuação do tratamento com lamivudina é desconhecida. Os pacientes devem ser monitorados de perto com acompanhamento clínico e laboratorial por pelo menos vários meses após a interrupção do tratamento.
Diferenças importantes entre os produtos que contêm lamivudina
Os comprimidos e a solução oral de EPIVIR 150mg contêm uma dose mais elevada do mesmo ingrediente ativo (lamivudina) do que os comprimidos de EPIVIR-HBV e a solução oral de EPIVIR-HBV. EPIVIR-HBV foi desenvolvido para pacientes com hepatite B crônica. A formulação e dosagem de lamivudina em EPIVIR-HBV não são apropriadas para pacientes co-infectados com HIV-1 e HBV. A segurança e eficácia da lamivudina não foram estabelecidas para o tratamento da hepatite B crônica em pacientes co-infectados com HIV-1 e HBV. Se o tratamento com EPIVIR-HBV for prescrito para hepatite B crônica para um paciente com infecção por HIV-1 não diagnosticada ou não tratada, é provável que ocorra o surgimento rápido de resistência ao HIV-1 devido à dose subterapêutica e à inadequação do tratamento de HIV-1 em monoterapia. Se for tomada a decisão de administrar lamivudina a pacientes co-infectados com HIV-1 e HBV, EPIVIR 150mg comprimidos, EPIVIR 150mg solução oral ou outro produto contendo a dose mais alta de lamivudina deve ser usado como parte de um regime de combinação apropriado.
Surgimento do HBV resistente à lamivudina
A segurança e a eficácia da lamivudina não foram estabelecidas para o tratamento da hepatite B crônica em indivíduos duplamente infectados com HIV-1 e HBV (ver informações completas de prescrição de EPIVIR-HBV). O surgimento de variantes do vírus da hepatite B associado à resistência à lamivudina também foi relatado em indivíduos infectados pelo HIV-1 que receberam esquemas antirretrovirais contendo lamivudina na presença de infecção concomitante pelo vírus da hepatite B.
Acidose láctica e hepatomegalia grave com esteatose
Acidose lática e hepatomegalia grave com esteatose, incluindo casos fatais, foram relatados com o uso de análogos de nucleosídeos, incluindo EPIVIR. A maioria desses casos ocorreu em mulheres. Sexo feminino e obesidade podem ser fatores de risco para o desenvolvimento de acidose lática e hepatomegalia grave com esteatose em pacientes tratados com análogos de nucleosídeos antirretrovirais. O tratamento com EPIVIR deve ser suspenso em qualquer paciente que desenvolva achados clínicos ou laboratoriais sugestivos de acidose láctica ou hepatotoxicidade pronunciada, que pode incluir hepatomegalia e esteatose, mesmo na ausência de elevações acentuadas das transaminases.
Uso com regimes baseados em interferon e ribavirina
Estudos in vitro mostraram que a ribavirina pode reduzir a fosforilação de análogos de nucleosídeos de pirimidina, como a lamivudina. Embora nenhuma evidência de interação farmacocinética ou farmacodinâmica (p. FARMACOLOGIA CLÍNICA ], descompensação hepática (algum fatal) ocorreu em pacientes co-infectados HIV-1/HCV recebendo terapia antirretroviral combinada para HIV-1 e interferon alfa com ou sem ribavirina. Pacientes recebendo interferon alfa com ou sem ribavirina e EPIVIR devem ser monitorados de perto para toxicidades associadas ao tratamento, especialmente descompensação hepática. A descontinuação de EPIVIR 150mg deve ser considerada clinicamente apropriada. A redução da dose ou a descontinuação de interferon alfa, ribavirina ou ambos também devem ser consideradas se forem observadas toxicidades clínicas agravadas, incluindo descompensação hepática (por exemplo, Child-Pugh maior que 6). Consulte as informações completas de prescrição de interferon e ribavirina.
Pancreatite
Em pacientes pediátricos com histórico de exposição prévia a nucleosídeos antirretrovirais, histórico de pancreatite ou outros fatores de risco significativos para o desenvolvimento de pancreatite, EPIVIR 150mg deve ser usado com cautela. O tratamento com EPIVIR 150mg deve ser interrompido imediatamente se ocorrerem sinais clínicos, sintomas ou anormalidades laboratoriais sugestivas de pancreatite [ver REAÇÕES ADVERSAS ].
Síndrome de Reconstituição Imune
A síndrome de reconstituição imune foi relatada em pacientes tratados com terapia antirretroviral combinada, incluindo EPIVIR. Durante a fase inicial do tratamento antirretroviral combinado, os pacientes cujos sistemas imunológicos respondem podem desenvolver uma resposta inflamatória a infecções oportunistas indolentes ou residuais (como infecção por Mycobacterium avium, citomegalovírus, pneumonia por Pneumocystis jirovecii [PCP] ou tuberculose), que podem necessitar de avaliação adicional e tratamento.
Distúrbios autoimunes (como doença de Graves, polimiosite e síndrome de Guillain-Barré) também foram relatados no contexto da reconstituição imune, no entanto, o tempo de início é mais variável e pode ocorrer muitos meses após o início do tratamento.
Menores taxas de supressão virológica e aumento do risco de resistência viral com solução oral
Indivíduos pediátricos que receberam EPIVIR 150 mg solução oral (em doses baseadas em faixas de peso aproximadas de 8 mg por kg por dia) concomitantemente com outras soluções orais antirretrovirais em qualquer momento no estudo ARROW tiveram taxas mais baixas de supressão virológica, menor exposição plasmática à lamivudina e desenvolveram resistência viral com mais frequência do que aqueles que receberam comprimidos de EPIVIR [ver FARMACOLOGIA CLÍNICA , Microbiologia , Estudos clínicos ].
comprimido com pontuação de EPIVIR é a formulação preferida para pacientes pediátricos infectados pelo HIV-1 que pesam pelo menos 14 kg e para os quais uma forma de dosagem sólida é apropriada. Um regime de todos os comprimidos deve ser usado quando possível para evitar uma potencial interação com o sorbitol [ver FARMACOLOGIA CLÍNICA ]. Considere o monitoramento mais frequente da carga viral do HIV-1 ao tratar com EPIVIR 150mg solução oral.
Informações de Aconselhamento do Paciente
Aconselhe o paciente a ler o rótulo do paciente aprovado pela FDA (Informações ao Paciente).
Pacientes com Co-infecção Hepatite B ou C
Informar os pacientes co-infectados com HIV-1 e HBV que a deterioração da doença hepática ocorreu em alguns casos quando o tratamento com lamivudina foi descontinuado. Aconselhe os pacientes a discutir quaisquer mudanças no regime com seu médico [ver AVISOS E PRECAUÇÕES ].
Informar os pacientes com co-infecção HIV-1/HCV que ocorreu descompensação hepática (algum fatal) em pacientes co-infectados HIV-1/HCV recebendo terapia antirretroviral combinada para HIV-1 e interferon alfa com ou sem ribavirina [ver AVISOS E PRECAUÇÕES ].
Diferenças nas formulações de EPIVIR
Aconselhe os pacientes que EPIVIR 150mg comprimidos e solução oral contêm uma dose mais alta do mesmo ingrediente ativo (lamivudina) que EPIVIR-HBV comprimidos e solução oral. Se for tomada a decisão de incluir lamivudina no regime de tratamento do HIV-1 de um paciente co-infectado com HIV-1 e HBV, a formulação e a dosagem de lamivudina em EPIVIR (não EPIVIR-HBV) devem ser usadas [ver AVISOS E PRECAUÇÕES ].
Acidose láctica/hepatomegalia com esteatose
Avise os pacientes que acidose lática e hepatomegalia grave com esteatose foram relatadas com o uso de análogos de nucleosídeos e outros antirretrovirais. Aconselhe os pacientes a parar de tomar EPIVIR se desenvolverem sintomas clínicos sugestivos de acidose láctica ou hepatotoxicidade pronunciada [ver AVISOS E PRECAUÇÕES ].
Risco de pancreatite
Aconselhar os pais ou responsáveis a monitorar os pacientes pediátricos quanto a sinais e sintomas de pancreatite [ver AVISOS E PRECAUÇÕES ].
Síndrome de Reconstituição Imune
Aconselhe os doentes a informarem imediatamente o seu prestador de cuidados de saúde sobre quaisquer sinais e sintomas de infeção, uma vez que pode ocorrer inflamação de uma infeção anterior logo após a terapêutica antirretroviral combinada, incluindo quando o EPIVIR é iniciado [ver AVISOS E PRECAUÇÕES ].
Menores taxas de supressão virológica e aumento do risco de resistência viral com solução oral
Aconselhe os pacientes que um regime de todos os comprimidos deve ser usado quando possível devido a uma maior taxa de falha do tratamento entre os pacientes pediátricos que receberam EPIVIR solução oral concomitantemente com outras soluções antirretrovirais orais [ver AVISOS E PRECAUÇÕES ].
Conteúdo de sacarose da solução oral EPIVIR
Aconselhe os pacientes diabéticos que cada dose de 15 mL de EPIVIR solução oral contém 3 gramas de sacarose (1 mL = 200 mg de sacarose) [ver DESCRIÇÃO ].
Registro de gravidez
Avisar as pacientes de que existe um registro de exposição à gravidez que monitora os resultados da gravidez em mulheres expostas ao EPIVIR durante a gravidez [ver Uso em populações específicas ].
Lactação
Instruir as mulheres com infecção pelo HIV-1 a não amamentar porque o HIV-1 pode ser transmitido ao bebê no leite materno [ver Uso em populações específicas ].
Dosagem perdida
Instrua os pacientes que, se perderem uma dose de EPIVIR 150mg, tomem-na assim que se lembrarem. Aconselhe os pacientes a não dobrarem a próxima dose ou tomarem mais do que a dose prescrita [ver DOSAGEM E ADMINISTRAÇÃO ].
EPIVIR e RETROVIR são marcas registradas de propriedade ou licenciadas para o grupo de empresas ViiV Healthcare.
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Carcinogênese
Estudos de carcinogenicidade de longo prazo com lamivudina em camundongos e ratos não mostraram evidência de potencial carcinogênico em exposições até 10 vezes (camundongos) e 58 vezes (ratos) as exposições humanas na dose recomendada de 300 mg.
Mutagênese
lamivudina foi mutagênica em um ensaio de linfoma de camundongo L5178Y e clastogênica em um ensaio citogenético usando linfócitos humanos cultivados. A lamivudina não foi mutagênica em um ensaio de mutagenicidade microbiana, em um ensaio de transformação celular in vitro, em um teste de micronúcleo de rato, em um ensaio citogenético de medula óssea de rato e em um ensaio para síntese de DNA não programada em fígado de rato. A lamivudina não mostrou evidência de atividade genotóxica in vivo no rato em doses orais de até 2.000 mg por kg, produzindo níveis plasmáticos de 35 a 45 vezes aqueles em humanos na dose recomendada para infecção pelo HIV-1.
Prejuízo da Fertilidade
Em um estudo de desempenho reprodutivo, a lamivudina administrada a ratos em doses de até 4.000 mg por kg por dia, produzindo níveis plasmáticos 47 a 70 vezes maiores que em humanos, não revelou evidência de fertilidade prejudicada e nenhum efeito sobre a sobrevivência, crescimento e desenvolvimento ao desmame da prole.
Uso em populações específicas
Gravidez
Registro de Exposição à Gravidez
Existe um registro de exposição à gravidez que monitora os resultados da gravidez em mulheres expostas ao EPIVIR durante a gravidez. Os profissionais de saúde são incentivados a registrar pacientes ligando para o Registro de Gravidez Antirretroviral (APR) no número 1-800-258-4263.
Resumo do risco
Os dados disponíveis do APR não mostram diferença no risco geral de defeitos congênitos para lamivudina em comparação com a taxa de base para defeitos congênitos de 2,7% na população de referência do Programa Metropolitano de Defeitos Congênitos de Atlanta (MACDP) (consulte Dados ). A APR usa o MACDP como a população de referência dos EUA para defeitos congênitos na população em geral. O MACDP avalia mulheres e bebês de uma área geográfica limitada e não inclui resultados para nascimentos que ocorreram com menos de 20 semanas de gestação. A taxa de aborto não é relatada na TAEG. A taxa estimada de aborto espontâneo em gestações clinicamente reconhecidas na população geral dos EUA é de 15% a 20%. O risco de fundo para defeitos congênitos graves e aborto para a população indicada é desconhecido.
Em estudos de reprodução em animais, a administração oral de lamivudina a coelhas grávidas durante a organogénese resultou em embrioletalidade na exposição sistémica (AUC) semelhante à dose clínica recomendada; no entanto, nenhum efeito adverso no desenvolvimento foi observado com a administração oral de lamivudina a ratas grávidas durante a organogênese em concentrações plasmáticas (Cmax) 35 vezes a dose clínica recomendada (ver Dados ).
Dados
Dados humanos
Com base em relatórios prospectivos à APR de mais de 11.000 exposições à lamivudina durante a gravidez, resultando em nascidos vivos (incluindo mais de 4.500 expostos no primeiro trimestre), não houve diferença entre o risco geral de defeitos congênitos para lamivudina em comparação com a taxa de defeitos congênitos de fundo de 2,7% na população de referência dos EUA do MACDP. A prevalência de defeitos em nascidos vivos foi de 3,1% (IC 95%: 2,6% a 3,6%) após exposição no primeiro trimestre a regimes contendo lamivudina e 2,8% (IC 95%: 2,5% a 3,3%) após exposição no segundo/terceiro trimestre regimes contendo lamivudina.
farmacocinética da lamivudina foi estudada em mulheres grávidas durante 2 ensaios clínicos realizados na África do Sul. Os ensaios avaliaram a farmacocinética em 16 mulheres com 36 semanas de gestação usando 150 mg de lamivudina duas vezes ao dia com zidovudina, 10 mulheres com 38 semanas de gestação usando 150 mg de lamivudina duas vezes ao dia com zidovudina e 10 mulheres com 38 semanas de gestação usando lamivudina 300 mg duas vezes diariamente sem outros antirretrovirais. Esses estudos não foram projetados ou desenvolvidos para fornecer informações de eficácia. As concentrações de lamivudina foram geralmente semelhantes nas amostras de soro materno, neonatal e do cordão umbilical. Em um subconjunto de indivíduos, amostras de líquido amniótico foram coletadas após a ruptura natural das membranas e confirmaram que a lamivudina atravessa a placenta em humanos. Com base em dados limitados no momento do parto, as concentrações medianas (intervalo) de lamivudina no líquido amniótico foram 3,9 (1,2 a 12,8) vezes maiores em comparação com a concentração sérica materna pareada (n = 8).
Dados de animais
lamivudina foi administrada por via oral a ratas grávidas (90, 600 e 4.000 mg por kg por dia) e coelhos (a 90, 300 e 1.000 mg por kg por dia e a 15, 40 e 90 mg por kg por dia) durante a organogênese (nos dias de gestação 7 a 16 [rato] e 8 a 20 [coelho]). Nenhuma evidência de malformações fetais devido à lamivudina foi observada em ratos e coelhos em doses que produzam concentrações plasmáticas (Cmax) aproximadamente 35 vezes maiores do que a exposição humana na dose diária recomendada. Evidência de embrioletalidade precoce foi observada no coelho em exposições do sistema (AUC) semelhantes às observadas em humanos, mas não houve indicação desse efeito no rato em concentrações plasmáticas (Cmax) 35 vezes maiores do que a exposição humana na dose diária recomendada . Estudos em ratas grávidas mostraram que a lamivudina é transferida para o feto através da placenta. No estudo de fertilidade/desenvolvimento pré e pós-natal em ratos, a lamivudina foi administrada oralmente em doses de 180, 900 e 4.000 mg por kg por dia (desde antes do acasalamento até o dia 20 pós-natal). No estudo, o desenvolvimento da prole, incluindo fertilidade e desempenho reprodutivo, não foi afetado pela administração materna de lamivudina.
Lactação
Resumo do risco
Os Centros de Controle e Prevenção de Doenças recomendam que as mães infectadas pelo HIV-1 nos Estados Unidos não amamentem seus bebês para evitar o risco de transmissão pós-natal da infecção pelo HIV-1. A lamivudina está presente no leite humano. Não há informações sobre os efeitos da lamivudina no lactente ou os efeitos dos medicamentos na produção de leite. Devido ao potencial de (1) transmissão do HIV-1 (em bebês HIV negativos), (2) desenvolvimento de resistência viral (em bebês HIV positivos) e (3) reações adversas em bebês amamentados, instrua as mães a não amamentar se estiverem recebendo EPIVIR.
Uso Pediátrico
segurança e eficácia de EPIVIR 150mg em combinação com outros agentes antirretrovirais foram estabelecidas em pacientes pediátricos com 3 meses de idade ou mais. O comprimido com pontuação de EPIVIR é a formulação preferida para pacientes pediátricos infectados pelo HIV-1 que pesam pelo menos 14 kg e para os quais uma forma de dosagem sólida é apropriada porque os pacientes pediátricos que receberam EPIVIR 150 mg solução oral apresentaram menores taxas de supressão virológica, menor exposição à lamivudina plasmática , e desenvolveram resistência viral com mais frequência do que aqueles que receberam comprimidos de EPIVIR 150mg no estudo ARROW [ver DOSAGEM E ADMINISTRAÇÃO , AVISOS E PRECAUÇÕES , REAÇÕES ADVERSAS , FARMACOLOGIA CLÍNICA , Estudos clínicos ].
Uso Geriátrico
Os ensaios clínicos de EPIVIR não incluíram um número suficiente de indivíduos com 65 anos ou mais para determinar se eles respondem de forma diferente dos indivíduos mais jovens. Em geral, deve-se ter cautela na administração de EPIVIR em pacientes idosos, refletindo a maior frequência de diminuição da função hepática, renal ou cardíaca e de doença concomitante ou outra terapia medicamentosa [ver DOSAGEM E ADMINISTRAÇÃO , FARMACOLOGIA CLÍNICA ].
Pacientes com função renal prejudicada
A redução da dose de EPIVIR 150mg é recomendada para pacientes com insuficiência renal [ver DOSAGEM E ADMINISTRAÇÃO , FARMACOLOGIA CLÍNICA ].
SOBREDOSAGEM
Não há tratamento específico conhecido para superdosagem com EPIVIR. Se ocorrer superdose, o paciente deve ser monitorado e o tratamento de suporte padrão aplicado conforme necessário. Como uma quantidade insignificante de lamivudina foi removida por meio de hemodiálise (4 horas), diálise peritoneal ambulatorial contínua e diálise peritoneal automatizada, não se sabe se a hemodiálise contínua proporcionaria benefício clínico em um evento de superdosagem de lamivudina.
CONTRA-INDICAÇÕES
EPIVIR 150mg é contraindicado em pacientes com reação de hipersensibilidade prévia à lamivudina.
FARMACOLOGIA CLÍNICA
Mecanismo de ação
A lamivudina é um agente antirretroviral [ver Microbiologia ].
Farmacocinética
Farmacocinética em Adultos
As propriedades farmacocinéticas da lamivudina foram estudadas em indivíduos adultos infectados pelo HIV-1 assintomáticos após a administração de doses únicas intravenosas (IV) variando de 0,25 a 8 mg por kg, bem como doses orais únicas e múltiplas (regime de duas vezes ao dia). variando de 0,25 a 10 mg por kg.
As propriedades farmacocinéticas da lamivudina também foram estudadas como doses orais únicas e múltiplas, variando de 5 mg a 600 mg por dia, administradas a indivíduos infectados pelo HBV.
As propriedades farmacocinéticas de estado de equilíbrio do comprimido de EPIVIR 300 mg uma vez ao dia por 7 dias em comparação com o comprimido de EPIVIR 150 mg duas vezes ao dia por 7 dias foram avaliadas em um estudo cruzado em 60 indivíduos saudáveis. EPIVIR 300 mg uma vez ao dia resultou em exposições à lamivudina que foram semelhantes a EPIVIR 150 mg duas vezes ao dia em relação à AUC24,ss plasmática; no entanto, a Cmax,ss foi 66% maior e o valor mínimo foi 53% menor em comparação com o regime de 150 mg duas vezes ao dia. As exposições de trifosfato de lamivudina intracelular em células mononucleares do sangue periférico também foram semelhantes em relação à AUC24,ss e Cmax24,ss; no entanto, os valores mínimos foram menores em comparação com o regime de 150 mg duas vezes ao dia. A variabilidade entre indivíduos foi maior para as concentrações intracelulares de trifosfato de lamivudina versus as concentrações plasmáticas mínimas de lamivudina.
farmacocinética da lamivudina foi avaliada em 12 indivíduos adultos infectados pelo HIV-1 que receberam lamivudina 150 mg duas vezes ao dia em combinação com outros agentes antirretrovirais. A média geométrica (IC 95%) para AUC(0-12) foi de 5,53 (4,58, 6,67) mcg.h por mL e para Cmax foi de 1,40 (1,17, 1,69) mcg por mL.
Absorção e Biodisponibilidade
A biodisponibilidade absoluta em 12 indivíduos adultos foi de 86% ± 16% (média ± SD) para o comprimido de 150 mg e 87% ± 13% para a solução oral. Após administração oral de 2 mg por kg duas vezes ao dia a 9 adultos com HIV-1, o pico de concentração sérica de lamivudina (Cmax) foi de 1,5 ± 0,5 mcg por mL (média ± SD). A área sob a curva de concentração plasmática versus tempo (AUC) e Cmax aumentou proporcionalmente à dose oral no intervalo de 0,25 a 10 mg por kg.
A taxa de acumulação de lamivudina em adultos assintomáticos HIV-1 positivos com função renal normal foi de 1,50 após 15 dias de administração oral de 2 mg por kg duas vezes ao dia.
Efeitos dos alimentos na absorção oral
EPIVIR 150mg comprimidos e solução oral podem ser administrados com ou sem alimentos. Uma forma de dosagem experimental de 25 mg de lamivudina foi administrada oralmente a 12 indivíduos infectados pelo HIV-1 assintomáticos em 2 ocasiões, uma vez em jejum e uma vez com alimentos (1.099 kcal; 75 gramas de gordura, 34 gramas de proteína, 72 gramas de carboidrato ). A absorção da lamivudina foi mais lenta no estado alimentado (Tmax: 3,2 ± 1,3 horas) em comparação com o estado de jejum (Tmax: 0,9 ± 0,3 horas); A Cmax no estado alimentado foi 40% ± 23% (média ± SD) menor do que no estado de jejum. Não houve diferença significativa na exposição sistêmica (AUC∞) nos estados alimentado e em jejum.
Distribuição
O volume aparente de distribuição após a administração IV de lamivudina a 20 indivíduos foi de 1,3 ± 0,4 L por kg, sugerindo que a lamivudina se distribui nos espaços extravasculares. O volume de distribuição foi independente da dose e não se correlacionou com o peso corporal.
ligação da lamivudina às proteínas plasmáticas humanas é inferior a 36%. Estudos in vitro mostraram que na faixa de concentração de 0,1 a 100 mcg por mL, a quantidade de lamivudina associada aos eritrócitos variou de 53% a 57% e foi independente da concentração.
Metabolismo
O metabolismo da lamivudina é uma via de eliminação menor. Em humanos, o único metabólito conhecido da lamivudina é o metabólito trans-sulfóxido (aproximadamente 5% de uma dose oral após 12 horas). As concentrações séricas deste metabólito não foram determinadas. A lamivudina não é significativamente metabolizada pelas enzimas do citocromo P450.
Eliminação
maior parte da lamivudina é eliminada inalterada na urina por secreção catiônica orgânica ativa. Em 9 indivíduos saudáveis que receberam uma dose oral única de 300 mg de lamivudina, a depuração renal foi de 199,7 ± 56,9 mL por minuto (média ± desvio padrão). Em 20 indivíduos infectados pelo HIV-1 que receberam uma única dose IV, a depuração renal foi de 280,4 ± 75,2 mL por min (média ± DP), representando 71% ± 16% (média ± DP) da depuração total da lamivudina.
Na maioria dos ensaios de dose única em indivíduos infectados pelo HIV-1, indivíduos infectados pelo VHB ou indivíduos saudáveis com amostragem de soro por 24 horas após a dosagem, a meia-vida de eliminação média observada (t½) variou de 5 a 7 horas. Em indivíduos infectados pelo HIV-1, a depuração total foi de 398,5 ± 69,1 mL por minuto (média ± desvio padrão). A depuração oral e a meia-vida de eliminação foram independentes da dose e do peso corporal em uma faixa de dosagem oral de 0,25 a 10 mg por kg.
Populações Específicas
Pacientes com Insuficiência Renal
As propriedades farmacocinéticas da lamivudina foram determinadas em um pequeno grupo de adultos infectados pelo HIV-1 com função renal comprometida (Tabela 7).
Tmax não foi significativamente afetado pela função renal. Com base nessas observações, recomenda-se que a dosagem de lamivudina seja modificada em pacientes com insuficiência renal [ver DOSAGEM E ADMINISTRAÇÃO ].
Com base em um estudo em indivíduos saudáveis com função renal comprometida, a hemodiálise aumentou a depuração da lamivudina de uma média de 64 para 88 mL por minuto; no entanto, o tempo de hemodiálise (4 horas) foi insuficiente para alterar significativamente a exposição média à lamivudina após a administração de uma dose única. A diálise peritoneal ambulatorial contínua e a diálise peritoneal automatizada têm efeitos insignificantes na depuração da lamivudina. Portanto, recomenda-se, após a correção da dose para a depuração da creatinina, que nenhuma modificação adicional da dose seja feita após hemodiálise de rotina ou diálise peritoneal.
Os efeitos da insuficiência renal na farmacocinética da lamivudina em pacientes pediátricos não são conhecidos.
Pacientes com Insuficiência Hepática
As propriedades farmacocinéticas da lamivudina foram determinadas em adultos com insuficiência hepática. Os parâmetros farmacocinéticos não foram alterados pela diminuição da função hepática. A segurança e eficácia da lamivudina não foram estabelecidas na presença de doença hepática descompensada.
Mulheres Grávidas
A farmacocinética da lamivudina foi estudada em 36 mulheres grávidas durante 2 ensaios clínicos realizados na África do Sul. A farmacocinética da lamivudina em mulheres grávidas foi semelhante à observada em adultos não grávidas e em mulheres no pós-parto. As concentrações de lamivudina foram geralmente semelhantes nas amostras de soro materno, neonatal e do cordão umbilical.
Pacientes pediátricos
farmacocinética da lamivudina foi estudada após doses únicas ou repetidas de EPIVIR em 210 pacientes pediátricos. Indivíduos pediátricos recebendo lamivudina solução oral (dosagem de aproximadamente 8 mg por kg por dia) atingiram concentrações plasmáticas de lamivudina aproximadamente 25% mais baixas em comparação com adultos infectados pelo HIV-1. Os indivíduos pediátricos que receberam comprimidos orais de lamivudina atingiram concentrações plasmáticas comparáveis ou ligeiramente superiores às observadas em adultos. A biodisponibilidade absoluta dos comprimidos de EPIVIR e da solução oral é menor em crianças do que em adultos. A biodisponibilidade relativa de EPIVIR solução oral é aproximadamente 40% menor do que os comprimidos contendo lamivudina em pacientes pediátricos, apesar de não haver diferença em adultos. A menor exposição à lamivudina em pacientes pediátricos recebendo EPIVIR 150mg solução oral é provavelmente devido à interação entre lamivudina e soluções concomitantes contendo sorbitol (como ZIAGEN). A modelagem de dados farmacocinéticos sugere que é necessário aumentar a dosagem de EPIVIR solução oral para 5 mg por kg, administrado por via oral duas vezes ao dia ou 10 mg por kg, administrado por via oral uma vez ao dia (até um máximo de 300 mg por dia) para atingir concentrações suficientes de lamivudina [ver DOSAGEM E ADMINISTRAÇÃO ]. Não há dados clínicos em pacientes pediátricos infectados pelo HIV-1 coadministrados com medicamentos contendo sorbitol nesta dose.
A farmacocinética da lamivudina administrada uma vez ao dia em pacientes pediátricos infectados pelo HIV-1 com idades entre 3 meses e 12 anos foi avaliada em 3 estudos (PENTA-15 [n = 17], PENTA 13 [n = 19] e ARROW PK [n = 35]). Todos os 3 ensaios foram ensaios farmacocinéticos abertos de 2 períodos, cruzados, de administração de abacavir e lamivudina duas vezes versus uma vez ao dia. Esses 3 estudos demonstraram que a dosagem de uma vez ao dia fornece AUC0-24 semelhante à dosagem de duas vezes ao dia de lamivudina na mesma dose diária total ao comparar os regimes de dosagem dentro da mesma formulação (ou seja, a solução oral ou a formulação em comprimido). A Cmax média foi aproximadamente 80% a 90% maior com a administração de lamivudina uma vez ao dia em comparação com a administração de duas vezes ao dia.
distribuição da lamivudina no líquido cefalorraquidiano (LCR) foi avaliada em 38 pacientes pediátricos após administração oral múltipla de lamivudina. As amostras de LCR foram coletadas entre 2 e 4 horas após a dose. Na dose de 8 mg por kg por dia, as concentrações de lamivudina no LCR em 8 indivíduos variaram de 5,6% a 30,9% (média ± desvio padrão de 14,2% ± 7,9%) da concentração em uma amostra de soro simultânea, com concentrações de lamivudina no LCR variando de 0,04 a 0,3 mcg por mL.
Dados limitados e não controlados de farmacocinética e segurança estão disponíveis a partir da administração de lamivudina (e zidovudina) a 36 crianças com até 1 semana de idade em 2 estudos na África do Sul. Nestes ensaios, a depuração da lamivudina foi substancialmente reduzida em recém-nascidos com 1 semana de idade em relação a indivíduos pediátricos (com idade superior a 3 meses) estudados anteriormente. Não há informações suficientes para estabelecer a evolução temporal das mudanças na depuração entre o período neonatal imediato e as faixas etárias acima de 3 meses [ver REAÇÕES ADVERSAS ].
Pacientes Geriátricos
farmacocinética da lamivudina após administração de EPIVIR 150mg a indivíduos com mais de 65 anos não foi estudada [ver Uso em populações específicas ].
Pacientes Masculinos e Femininos
Não existem diferenças significativas ou clinicamente relevantes entre os sexos na farmacocinética da lamivudina.
Grupos Raciais
Não existem diferenças raciais significativas ou clinicamente relevantes na farmacocinética da lamivudina.
Estudos de interação medicamentosa
Efeito da lamivudina na farmacocinética de outros agentes
Com base nos resultados do estudo in vitro, não se espera que a lamivudina em exposições terapêuticas a drogas afete a farmacocinética de drogas que são substratos dos seguintes transportadores: polipeptídeo transportador de ânions orgânicos 1B1/3 (OATP1B1/3), proteína de resistência ao câncer de mama (BCRP), P-glicoproteína (P-gp), multidrogas e proteína de extrusão de toxina 1 (MATE)1, MATE2-K, transportador de cátions orgânicos 1 (OCT)1, OCT2 ou OCT3.
Efeito de outros agentes na farmacocinética da lamivudina
lamivudina é um substrato de MATE1, MATE2-K e OCT2 in vitro. O trimetoprim (um inibidor desses transportadores de drogas) demonstrou aumentar as concentrações plasmáticas de lamivudina. Esta interação não é considerada clinicamente significativa, pois não é necessário ajuste de dose de lamivudina.
A lamivudina é um substrato da P-gp e BCRP; entretanto, considerando sua biodisponibilidade absoluta (87%), é improvável que esses transportadores desempenhem um papel significativo na absorção da lamivudina. Portanto, é improvável que a coadministração de medicamentos inibidores desses transportadores de efluxo afete a disposição e eliminação da lamivudina.
Interferon Alfa
Não houve interação farmacocinética significativa entre lamivudina e interferon alfa em um estudo com 19 indivíduos saudáveis do sexo masculino [ver AVISOS E PRECAUÇÕES ].
Ribavirina
Dados in vitro indicam que a ribavirina reduz a fosforilação da lamivudina, estavudina e zidovudina. No entanto, nenhuma interação farmacocinética (por exemplo, concentrações plasmáticas ou concentrações de metabólito ativo trifosforilado intracelular) ou farmacodinâmica (por exemplo, perda de supressão virológica de HIV-1/HCV) foi observada quando ribavirina e lamivudina (n = 18), estavudina (n = 10) , ou zidovudina (n = 6) foram coadministrados como parte de um regime multimedicamentoso para indivíduos coinfectados com HIV-1/HCV [ver AVISOS E PRECAUÇÕES ].
Sorbitol (Excipiente)
As soluções de lamivudina e sorbitol foram coadministradas a 16 indivíduos adultos saudáveis em um estudo cruzado, aberto, de sequência aleatória, de 4 períodos. Cada sujeito recebeu uma dose única de 300 mg de solução oral de lamivudina isolada ou coadministrada com uma dose única de 3,2 gramas, 10,2 gramas ou 13,4 gramas de sorbitol em solução. A coadministração de lamivudina com sorbitol resultou em diminuições dependentes da dose de 20%, 39% e 44% na AUC(0-24), 14%, 32% e 36% na AUC(∞), e 28%, 52% e 55% na Cmax; de lamivudina, respectivamente.
Trimetoprima/Sulfametoxazol
Lamivudina e TMP/SMX foram coadministrados a 14 indivíduos HIV-1-positivos em um único centro, aberto, randomizado e cruzado. Cada indivíduo recebeu tratamento com uma dose única de 300 mg de lamivudina e TMP 160 mg/SMX 800 mg uma vez ao dia por 5 dias com administração concomitante de lamivudina 300 mg com a quinta dose em um desenho cruzado. A coadministração de TMP/SMX com lamivudina resultou em um aumento de 43% ± 23% (média ± SD) na AUC∞ da lamivudina, uma diminuição de 29% ± 13% na depuração oral da lamivudina e uma diminuição de 30% ± 36% na depuração renal da lamivudina. As propriedades farmacocinéticas de TMP e SMX não foram alteradas pela coadministração com lamivudina. Não há informações sobre o efeito na farmacocinética da lamivudina de doses mais altas de TMP/SMX, como as usadas no tratamento da PCP.
Zidovudina
Não foram observadas alterações clinicamente significativas na farmacocinética da lamivudina ou da zidovudina em 12 indivíduos adultos infectados pelo HIV-1 assintomáticos que receberam uma dose única de zidovudina (200 mg) em combinação com doses múltiplas de lamivudina (300 mg a cada 12 horas).
Microbiologia
Mecanismo de ação
A lamivudina é um análogo de nucleosídeo sintético. Intracelularmente, a lamivudina é fosforilada em seu metabólito ativo 5'-trifosfato, trifosfato de lamivudina (3TC-TP). O principal modo de ação do 3TC-TP é a inibição da transcriptase reversa (RT) do HIV-1 através da terminação da cadeia de DNA após a incorporação do análogo de nucleotídeo.
Atividade antiviral
atividade antiviral da lamivudina contra o HIV-1 foi avaliada em várias linhagens celulares, incluindo monócitos e linfócitos de sangue periférico humano fresco (PBMCs) usando ensaios de suscetibilidade padrão. Os valores de EC50 estavam na faixa de 0,003 a 15 microM (1 microM = 0,23 mcg por mL). Os valores médios de EC50 de lamivudina foram 60 nM (intervalo: 20 a 70 nM), 35 nM (intervalo: 30 a 40 nM), 30 nM (intervalo: 20 a 90 nM), 20 nM (intervalo: 3 a 40 nM) , 30 nM (intervalo: 1 a 60 nM), 30 nM (intervalo: 20 a 70 nM), 30 nM (intervalo: 3 a 70 nM) e 30 nM (intervalo: 20 a 90 nM) contra clados de HIV-1 Vírus AG e grupo O (n = 3 exceto n = 2 para o clado B), respectivamente. Os valores de EC50 contra isolados de HIV-2 (n = 4) variaram de 0,003 a 0,120 microM em PBMCs. A lamivudina não foi antagônica a todos os agentes anti-HIV testados. A ribavirina (50 microM) usada no tratamento da infecção crônica pelo HCV diminuiu a atividade anti-HIV-1 da lamivudina em 3,5 vezes nas células MT-4.
Resistência
Variantes do HIV-1 resistentes à lamivudina foram selecionadas em cultura de células. A análise genotípica mostrou que a resistência era devida a uma substituição específica de aminoácidos na transcriptase reversa do HIV-1 no códon 184, alterando a metionina para valina ou isoleucina (M184V/I).
As cepas de HIV-1 resistentes tanto à lamivudina quanto à zidovudina foram isoladas de indivíduos. A suscetibilidade de isolados clínicos à lamivudina e zidovudina foi monitorada em ensaios clínicos controlados. Em indivíduos recebendo monoterapia com lamivudina ou terapia combinada com lamivudina mais zidovudina, os isolados de HIV-1 da maioria dos indivíduos tornaram-se fenotipicamente e genotipicamente resistentes à lamivudina em 12 semanas.
Análise genotípica e fenotípica de isolados de HIV-1 em terapia de indivíduos com falha virológica
Teste EPV20001
Cinquenta e três de 554 (10%) indivíduos inscritos no EPV20001 foram identificados como falhas virológicas (nível plasmático de RNA HIV-1 maior ou igual a 400 cópias por mL) na Semana 48. Vinte e oito indivíduos foram randomizados para a lamivudina uma vez- grupo de tratamento diário e 25 para o grupo de tratamento com lamivudina duas vezes ao dia. A mediana dos níveis plasmáticos basais de RNA HIV-1 de indivíduos no grupo lamivudina uma vez ao dia e lamivudina duas vezes ao dia foram 4,9 log10 cópias por mL e 4,6 log10 cópias por mL, respectivamente.
análise genotípica de isolados em terapia de 22 indivíduos identificados como falhas virológicas no grupo de lamivudina uma vez ao dia mostrou que os isolados de 8 de 22 indivíduos continham uma substituição associada à resistência à lamivudina emergente do tratamento (M184V ou M184I), isolados de 0 de 22 os indivíduos continham substituições de aminoácidos emergentes do tratamento associadas à resistência à zidovudina (M41L, D67N, K70R, L210W, T215Y/F ou K219Q/E), e isolados de 10 de 22 indivíduos continham substituições de aminoácidos emergentes do tratamento associadas à resistência ao efavirenz ( L100I, K101E, K103N, V108I ou Y181C).
análise genotípica de isolados em terapia de indivíduos (n = 22) no grupo de tratamento com lamivudina duas vezes ao dia mostrou que isolados de 5 de 22 indivíduos continham substituições de resistência à lamivudina emergentes do tratamento, isolados de 1 de 22 indivíduos continham resistência à zidovudina emergente do tratamento substituições e isolados de 7 de 22 indivíduos continham substituições de resistência ao efavirenz emergentes do tratamento.
A análise fenotípica de isolados de HIV-1 em terapia pareados na linha de base de indivíduos (n = 13) recebendo lamivudina uma vez ao dia mostrou que isolados de 7 de 13 indivíduos mostraram uma diminuição de 85 a 299 vezes na suscetibilidade à lamivudina, isolados de 12 de 13 indivíduos foram suscetíveis à zidovudina e isolados de 8 de 13 indivíduos apresentaram uma diminuição de 25 a 295 vezes na suscetibilidade ao efavirenz.
análise fenotípica de isolados de HIV-1 em terapia pareados na linha de base de indivíduos (n = 13) recebendo lamivudina duas vezes ao dia mostrou que isolados de 4 de 13 indivíduos exibiram uma diminuição de 29 a 159 vezes na suscetibilidade à lamivudina, isolados de todos os 13 os indivíduos eram susceptíveis à zidovudina e os isolados de 3 de 13 indivíduos apresentaram uma diminuição de 21 a 342 vezes na susceptibilidade ao efavirenz.
Teste EPV40001
Cinquenta indivíduos receberam lamivudina 300 mg uma vez ao dia mais zidovudina 300 mg duas vezes ao dia mais abacavir 300 mg duas vezes ao dia e 50 indivíduos receberam lamivudina 150 mg mais zidovudina 300 mg mais abacavir 300 mg duas vezes ao dia. A mediana dos níveis plasmáticos basais de RNA do HIV-1 para indivíduos nos 2 grupos foi de 4,79 log10 cópias por mL e 4,83 log10 cópias por mL, respectivamente. Quatorze dos 50 indivíduos no grupo de tratamento com lamivudina uma vez ao dia e 9 dos 50 indivíduos no grupo de lamivudina duas vezes ao dia foram identificados como falhas virológicas.
análise genotípica de isolados de HIV-1 em terapia de indivíduos (n = 9) no grupo de tratamento com lamivudina uma vez ao dia mostrou que isolados de 6 indivíduos tinham uma substituição M184V associada à resistência ao abacavir e/ou lamivudina isoladamente. Isolados em terapia de indivíduos (n = 6) recebendo lamivudina duas vezes ao dia mostraram que isolados de 2 indivíduos tinham M184V sozinho e isolados de 2 indivíduos abrigavam a substituição de M184V em combinação com substituições de aminoácidos associadas à resistência à zidovudina.
A análise fenotípica de isolados em terapia de indivíduos (n = 6) recebendo lamivudina uma vez ao dia mostrou que os isolados de HIV-1 de 4 indivíduos exibiram uma diminuição de 32 a 53 vezes na suscetibilidade à lamivudina. Os isolados de HIV-1 desses 6 indivíduos foram suscetíveis à zidovudina.
análise fenotípica de isolados em terapia de indivíduos (n = 4) recebendo lamivudina duas vezes ao dia mostrou que os isolados de HIV-1 de 1 indivíduo exibiram uma diminuição de 45 vezes na suscetibilidade à lamivudina e uma diminuição de 4,5 vezes na suscetibilidade à zidovudina.
Pediatria
Pacientes pediátricos recebendo lamivudina solução oral concomitantemente com outras soluções antirretrovirais orais (abacavir, nevirapina/efavirenz ou zidovudina) em ARROW desenvolveram resistência viral com mais frequência do que aqueles que receberam comprimidos. Na randomização para uma ou duas doses diárias de EPIVIR mais abacavir, 13% dos indivíduos que iniciaram os comprimidos e 32% dos indivíduos que iniciaram a solução apresentaram substituições de resistência. O perfil de resistência observado em pediatria é semelhante ao observado em adultos em termos de substituições genotípicas detectadas e frequência relativa, com as substituições mais comumente detectadas em M184 (V ou I) [ver Estudos clínicos ].
Resistência cruzada
resistência cruzada foi observada entre os inibidores da transcriptase reversa de nucleosídeos (NRTIs). Mutantes de HIV-1 resistentes à lamivudina apresentaram resistência cruzada em cultura de células à didanosina (ddI). A resistência cruzada também é esperada com abacavir e emtricitabina, pois essas substituições selecionadas de M184V.
Estudos clínicos
O uso de EPIVIR é baseado nos resultados de ensaios clínicos em indivíduos infectados pelo HIV-1 em regimes de combinação com outros agentes antirretrovirais. Informações de estudos com desfechos clínicos ou uma combinação de contagens de células CD4+ e medições de RNA HIV-1 estão incluídas abaixo como documentação da contribuição da lamivudina para um regime de combinação em estudos controlados.
Assuntos adultos
Ensaio de desfecho clínico
NUCB3007 (CAESAR) foi um estudo multicêntrico, duplo-cego, controlado por placebo, comparando a terapia atual contínua (zidovudina isolada [62% dos indivíduos] ou zidovudina com didanosina ou zalcitabina [38% dos indivíduos]) à adição de EPIVIR 150mg ou EPIVIR 150mg mais um inibidor da transcriptase reversa não nucleosídeo (NNRTI) em investigação, randomizado 1:2:1. Um total de 1.816 adultos infectados pelo HIV-1 com 25 a 250 células CD4+ por mm³ (mediana = 122 células por mm³) na linha de base foram inscritos: a idade média foi de 36 anos, 87% eram do sexo masculino, 84% tinham experiência com nucleosídeos e 16% eram virgens de terapia. A duração mediana no julgamento foi de 12 meses. Os resultados estão resumidos na Tabela 9.
Testes de endpoint substitutos
Ensaios Análogos de Nucleosídeos Duplos
Os principais ensaios clínicos no desenvolvimento inicial da lamivudina compararam as combinações de lamivudina/zidovudina com monoterapia com zidovudina ou com zidovudina mais zalcitabina. Esses estudos demonstraram o efeito antiviral da lamivudina em uma combinação de 2 medicamentos. Usos mais recentes da lamivudina no tratamento da infecção pelo HIV-1 a incorporam em regimes de múltiplas drogas contendo pelo menos 3 drogas antirretrovirais para maior supressão viral.
Ensaios de desfechos substitutos de comparação de regime de dose em adultos virgens de terapia
EPV20001 foi um estudo multicêntrico, duplo-cego e controlado no qual os indivíduos foram randomizados 1:1 para receber EPIVIR 300 mg uma vez ao dia ou EPIVIR 150 mg duas vezes ao dia, em combinação com zidovudina 300 mg duas vezes ao dia e efavirenz 600 mg uma vez ao dia. Um total de 554 adultos infectados pelo HIV-1 virgens de tratamento antirretroviral inscritos: homens (79%), brancos (50%), idade mediana de 35 anos, contagem de células CD4+ basal de 69 a 1.089 células por mm³ (mediana = 362 células por mm³), e RNA de HIV-1 plasmático de linha de base mediana de 4,66 log10 cópias por mL. Os resultados do tratamento ao longo de 48 semanas estão resumidos na Figura 1 e na Tabela 10.
Figura 1: Resposta Virológica até a Semana 48, EPV20001a,b (Intenção de Tratar) 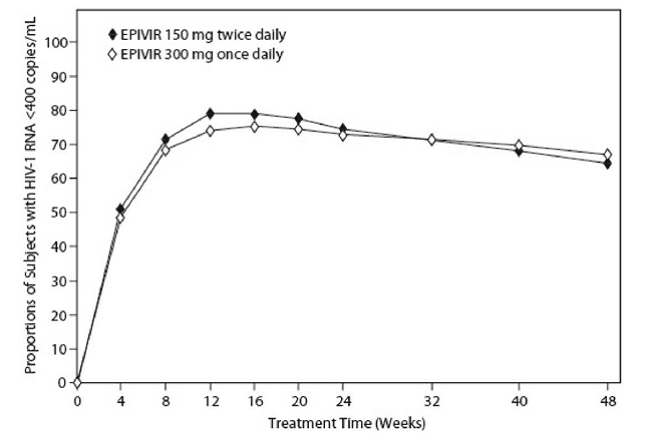
a MONITOR AMPLICOR HIV-1 da Roche. b Os respondedores em cada visita são indivíduos que alcançaram e mantiveram o RNA do HIV-1 inferior a 400 cópias por mL sem interrupção nessa visita.
As proporções de indivíduos com ARN do VIH-1 inferior a 50 cópias por ml (através do ensaio Roche Ultrasensitive) até à Semana 48 foram de 61% para indivíduos a receber EPIVIR 300 mg uma vez por dia e 63% para indivíduos a receber EPIVIR 150 mg duas vezes por dia. Os aumentos medianos nas contagens de células CD4+ foram de 144 células por mm³ na Semana 48 em indivíduos recebendo EPIVIR 300 mg uma vez ao dia e 146 células por mm³ para indivíduos recebendo EPIVIR 150 mg duas vezes ao dia.
Um pequeno estudo piloto randomizado e aberto, EPV40001, foi realizado na Tailândia. Um total de 159 indivíduos adultos virgens de tratamento (32% do sexo masculino, 100% asiáticos, idade mediana de 30 anos, contagem mediana de células CD4+ 380 células por mm³, RNA do HIV-1 no plasma mediana 4,8 log10 cópias por mL) foram inscritos. Dois dos braços de tratamento neste estudo forneceram uma comparação entre lamivudina 300 mg uma vez ao dia (n = 54) e lamivudina 150 mg duas vezes ao dia (n = 52), cada um em combinação com zidovudina 300 mg duas vezes ao dia e abacavir 300 mg duas vezes ao dia. Em análises de intenção de tratamento de dados de 48 semanas, as proporções de indivíduos com RNA HIV-1 abaixo de 400 cópias por mL foram 61% (33 de 54) no grupo randomizado para lamivudina uma vez ao dia e 75% (39 de 54) 52) no grupo randomizado para receber os 3 medicamentos duas vezes ao dia; as proporções com HIV-1 RNA abaixo de 50 cópias por mL foram de 54% (29 de 54) no grupo de lamivudina uma vez ao dia e 67% (35 de 52) no grupo de todas as duas vezes ao dia; e os aumentos médios na contagem de células CD4+ foram de 166 células por mm³ no grupo de lamivudina uma vez ao dia e 216 células por mm³ no grupo de todas as duas vezes ao dia.
Sujeitos Pediátricos
Ensaio de desfecho clínico
ACTG300 foi um estudo multicêntrico, randomizado e duplo-cego que forneceu a comparação de EPIVIR mais RETROVIR (zidovudina) com monoterapia com didanosina. Um total de 471 pacientes pediátricos sintomáticos, infectados pelo HIV-1 virgens de terapia (menos ou igual a 56 dias de terapia antirretroviral) foram inscritos nesses 2 braços de tratamento. A idade mediana foi de 2,7 anos (variação: 6 semanas a 14 anos), 58% eram do sexo feminino e 86% não brancos. A contagem média de células CD4+ na linha de base foi de 868 células por mm³ (média: 1.060 células por mm³ e intervalo: 0 a 4.650 células por mm³ para indivíduos com idade inferior ou igual a 5 anos; média: 419 células por mm³ e intervalo: 0 a 1.555 células por mm³ para indivíduos com idade superior a 5 anos) e a média de RNA do HIV-1 no plasma basal foi de 5,0 log10 cópias por mL. A duração média do estudo foi de 10,1 meses para os indivíduos que receberam EPIVIR 150mg mais RETROVIR e 9,2 meses para os indivíduos que receberam monoterapia com didanosina. Os resultados estão resumidos na Tabela 11.
Dosagem uma vez ao dia
ARROW (COL105677) foi um estudo multicêntrico randomizado de 5 anos que avaliou vários aspectos do manejo clínico da infecção pelo HIV-1 em indivíduos pediátricos. Indivíduos infectados pelo HIV-1, virgens de tratamento, com idade entre 3 meses e 17 anos, foram inscritos e tratados com um regime de primeira linha contendo EPIVIR 150mg e abacavir, administrado duas vezes ao dia de acordo com as recomendações da Organização Mundial da Saúde. Após um mínimo de 36 semanas de tratamento, os indivíduos tiveram a opção de participar da Randomização 3 do estudo ARROW, comparando a segurança e a eficácia da dose única diária com a dose duas vezes ao dia de EPIVIR e abacavir, em combinação com um terceiro antirretroviral droga, por mais 96 semanas. Dos 1.206 indivíduos ARROW originais, 669 participaram da Randomização 3. A supressão virológica não era um requisito para a participação: na linha de base da Randomização 3 (após um mínimo de 36 semanas de tratamento duas vezes ao dia), 75% dos indivíduos na coorte foram suprimidos virologicamente, em comparação com 71% dos indivíduos na coorte uma vez ao dia.
proporção de indivíduos com HIV-1 RNA de menos de 80 cópias por mL até 96 semanas é mostrada na Tabela 12. As diferenças entre as respostas virológicas nos dois braços de tratamento foram comparáveis nas características basais para sexo e idade.
As análises por formulação demonstraram que a proporção de indivíduos com RNA do HIV-1 inferior a 80 cópias por mL na randomização e a Semana 96 foi maior em indivíduos que receberam formulações de comprimidos de EPIVIR 150mg e abacavir (75% [458/610] e 72% [434/601]) do que naqueles que receberam formulação(ões) de solução (com solução de EPIVIR 150mg administrada em doses baseadas em faixas de peso de aproximadamente 8 mg por kg por dia) a qualquer momento (52% [29/56] e 54 % [30/56]), respectivamente [ver AVISOS E PRECAUÇÕES ]. Essas diferenças foram observadas em cada uma das diferentes faixas etárias avaliadas.
INFORMAÇÃO DO PACIENTE
EPIVIR (EP-i-veer) (lamivudina) comprimidos
EPIVIR (EP-i-veer) (lamivudina) solução oral
Qual é a informação mais importante que devo saber sobre EPIVIR 150mg?
EPIVIR pode causar efeitos colaterais graves, incluindo:
- Agravamento do vírus da hepatite B em pessoas que têm infecção pelo HIV-1. Se você tem infecção pelo HIV-1 (vírus da imunodeficiência humana tipo 1) e pelo vírus da hepatite B (HBV), seu HBV pode piorar (surto) se você parar de tomar EPIVIR. Um “surto” é quando sua infecção por HBV retorna repentinamente de uma maneira pior do que antes. O agravamento da doença hepática pode ser grave e pode levar à morte.
- Não fique sem EPIVIR. Recarregue sua receita ou fale com seu médico antes que seu EPIVIR acabe.
- Não pare EPIVIR sem primeiro falar com seu médico.
- Se você parar de tomar EPIVIR, seu médico precisará verificar sua saúde com frequência e fazer exames de sangue regularmente por vários meses para verificar seu fígado.
- Vírus da Hepatite B Resistente (HBV). Se você tem HIV-1 e hepatite B, o vírus da hepatite B pode mudar (mutar) durante o tratamento com EPIVIR 150mg e se tornar mais difícil de tratar (resistente).
- Use com regimes baseados em interferon e ribavirina. O agravamento da doença hepática que causou a morte ocorreu em pessoas infectadas com HIV-1 e vírus da hepatite C que estão tomando medicamentos antirretrovirais e também estão sendo tratadas para hepatite C com interferon com ou sem ribavirina. Se estiver a tomar EPIVIR 150 mg e interferão com ou sem ribavirina, informe o seu médico se tiver quaisquer novos sintomas.
O que é EPIVIR?
EPIVIR é um medicamento sujeito a receita médica utilizado em conjunto com outros medicamentos antirretrovirais para tratar a infeção pelo Vírus da Imunodeficiência Humana (VIH-1).
O HIV-1 é o vírus que causa a Síndrome da Imunodeficiência Adquirida (AIDS).
Os comprimidos de EPIVIR e a solução oral (usados para tratar a infecção por HIV-1) contêm uma dose mais alta do mesmo ingrediente ativo (lamivudina) do que o medicamento EPIVIR-HBV comprimidos e a solução oral (usados para tratar o HBV). Se você tem HIV-1 e HBV, não deve usar EPIVIR-HBV para tratar suas infecções.
A segurança e eficácia de EPIVIR não foram estabelecidas em crianças com menos de 3 meses de idade.
Quem não deve tomar EPIVIR 150mg?
Não tome EPIVIR se tem alergia à lamivudina ou a qualquer um dos ingredientes de EPIVIR. Consulte o final deste folheto informativo para o paciente para obter uma lista completa dos ingredientes de EPIVIR.
O que devo dizer ao meu médico antes de tomar EPIVIR?
Antes de tomar EPIVIR 150mg, informe o seu médico se:
- tem ou teve problemas de fígado, incluindo infecção pelo vírus da hepatite B ou C.
- tem problemas renais.
- tem diabetes. Cada dose de 15 mL (150 mg) de EPIVIR solução oral contém 3 gramas de sacarose.
- estão grávidas ou planejam engravidar. Tomar EPIVIR durante a gravidez não foi associado a um risco aumentado de defeitos congênitos. Converse com seu médico se estiver grávida ou planeja engravidar. Registro de gravidez. Existe um registro de gravidez para mulheres que tomam medicamentos antirretrovirais durante a gravidez. O objetivo deste registro é coletar informações sobre sua saúde e de seu bebê. Converse com seu médico sobre como você pode participar desse registro.
- está amamentando ou planeja amamentar. Não amamente se estiver a tomar EPIVIR.
- Você não deve amamentar se tiver HIV-1 por causa do risco de passar o HIV-1 para seu bebê.
Informe o seu médico sobre todos os medicamentos que toma, incluindo medicamentos prescritos e de venda livre, vitaminas e suplementos de ervas.
Alguns medicamentos interagem com EPIVIR. Mantenha uma lista de seus medicamentos e mostre-a ao seu médico e farmacêutico quando receber um novo medicamento. Você pode pedir ao seu médico ou farmacêutico uma lista de medicamentos que interagem com EPIVIR.
Não comece a tomar um novo medicamento sem informar o seu médico. O seu médico pode dizer-lhe se é seguro tomar EPIVIR com outros medicamentos.
Como devo tomar EPIVIR?
- Tome EPIVIR exatamente como seu médico lhe disse para tomá-lo.
- Se falhar uma dose de EPIVIR 150mg, tome-a assim que se lembrar. Não tome 2 doses ao mesmo tempo ou tome mais do que o seu médico lhe disse para tomar.
- Fique sob os cuidados de um profissional de saúde durante o tratamento com EPIVIR.
- EPIVIR pode ser tomado com ou sem alimentos.
- Para crianças com 3 meses ou mais, seu médico irá prescrever uma dose de EPIVIR 150mg com base no peso corporal do seu filho.
- Informe o seu médico se você ou seu filho tiver problemas para engolir comprimidos. EPIVIR 150mg também vem como um líquido (solução oral).
- Não fique sem EPIVIR. O vírus no sangue pode aumentar e o vírus pode se tornar mais difícil de tratar. Quando seu suprimento começar a acabar, obtenha mais do seu médico ou farmácia.
- Se tomar demasiado EPIVIR 150mg, contacte o seu médico ou dirija-se imediatamente ao serviço de urgência do hospital mais próximo.
Quais são os possíveis efeitos colaterais do EPIVIR 150mg?
- EPIVIR 150mg pode causar efeitos colaterais graves, incluindo:
- Consulte “Qual é a informação mais importante que devo saber sobre EPIVIR 150mg?”
- Acúmulo de um ácido no sangue (acidose láctica). A acidose láctica pode ocorrer em algumas pessoas que tomam EPIVIR. A acidose láctica é uma emergência médica grave que pode causar a morte. Ligue para o seu médico imediatamente se tiver algum dos seguintes sintomas que podem ser sinais de acidose láctica:
- sentir-se muito fraco ou cansado
- sentir frio, especialmente em seus braços e pernas
- dor muscular incomum (não normal)
- sentir-se tonto ou tonto
- Problemas respiratórios
- tem um batimento cardíaco rápido ou irregular
- dor de estômago com náuseas e vômitos
- Problemas graves no fígado pode acontecer em pessoas que tomam EPIVIR. Em alguns casos, esses graves problemas hepáticos podem levar à morte. Seu fígado pode ficar grande (hepatomegalia) e você pode desenvolver gordura no fígado (esteatose). Ligue para o seu médico imediatamente se tiver algum dos seguintes sinais ou sintomas de problemas no fígado:
- a sua pele ou a parte branca dos seus olhos fica amarela (icterícia)
- perda de apetite por vários dias ou mais
- náusea
- urina escura ou “cor de chá”
- dor, dor ou sensibilidade no lado direito da área do estômago
- fezes de cor clara (movimentos intestinais)
Você pode ter mais probabilidade de ter acidose láctica ou problemas graves no fígado se for mulher ou estiver com excesso de peso (obesidade).
- Risco de inflamação do pâncreas (pancreatite). As crianças podem estar em risco de desenvolver pancreatite durante o tratamento com EPIVIR se:
- tomou medicamentos análogos de nucleosídeos
- tem uma história de pancreatite no passado
- tem outros fatores de risco para pancreatite
Ligue para o seu médico imediatamente se o seu filho desenvolver sinais e sintomas de pancreatite, incluindo dor intensa na parte superior do estômago, com ou sem náuseas e vômitos. O seu médico pode dizer-lhe para parar de dar EPIVIR 150 mg ao seu filho se os seus sintomas e os resultados das análises ao sangue mostrarem que o seu filho pode ter pancreatite.
- Alterações no seu sistema imunológico (Síndrome de Reconstituição Imune) pode acontecer quando você começa a tomar medicamentos para o HIV-1. Seu sistema imunológico pode ficar mais forte e começar a combater infecções que estão escondidas em seu corpo há muito tempo. Informe o seu médico imediatamente se começar a ter novos sintomas depois de começar a tomar EPIVIR.
Os efeitos colaterais mais comuns de EPIVIR 150mg em adultos incluem:
- dor de cabeça
- sinais e sintomas nasais
- náusea
- diarréia
- geralmente não se sente bem
- cansaço
- tosse
Os efeitos colaterais mais comuns de EPIVIR 150mg em crianças incluem febre e tosse.
Informe o seu médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do EPIVIR. Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
Como devo armazenar o EPIVIR?
- Armazene os comprimidos de EPIVIR 150mg e a solução oral em temperatura ambiente entre 20°C e 25°C (68°F a 77°F).
- Mantenha os frascos de EPIVIR 150mg solução oral bem fechados.
Mantenha EPIVIR e todos os medicamentos fora do alcance das crianças.
Informações gerais sobre o uso seguro e eficaz de EPIVIR.
Os medicamentos às vezes são prescritos para outros fins que não os listados em um folheto de informações ao paciente. Não use EPIVIR para uma condição para a qual não foi prescrito. Não dê EPIVIR a outras pessoas, mesmo que tenham os mesmos sintomas que você. Pode prejudicá-los.
Você pode pedir ao seu médico ou farmacêutico informações sobre EPIVIR 150mg que foram escritas para profissionais de saúde.
Para obter mais informações, acesse www.viivhealthcare.com ou ligue para 1-877-844-8872.
Quais são os ingredientes de EPIVIR 150mg?
Princípio ativo: lamivudina
Ingredientes inativos:
EPIVIR 150 mg comprimidos revestidos por película de 150 mg: hipromelose, estearato de magnésio, celulose microcristalina, polietilenoglicol, polissorbato 80, amidoglicolato de sódio e dióxido de titânio.
EPIVIR 300 mg comprimidos revestidos por película: óxido de ferro preto, hipromelose, estearato de magnésio, celulose microcristalina, polietilenoglicol, polissorbato 80, amidoglicolato de sódio e dióxido de titânio.
EPIVIR 150mg solução oral: sabores artificiais de morango e banana, ácido cítrico (anidro), metilparabeno, propilenoglicol, propilparabeno, citrato de sódio (dihidratado) e sacarose (200 mg por mL).
Esta informação do paciente foi aprovada pela Food and Drug Administration dos EUA.
