Geodon 40mg, 80mg, 20mg Ziprasidone Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Geodon e como é usado?
Geodon é um medicamento de prescrição usado para tratar os sintomas da Esquizofrenia, agitação aguda com Esquizofrenia e Transtorno Bipolar I. Geodon pode ser usado sozinho ou com outros medicamentos.
Geodon 20mg pertence a uma classe de medicamentos chamados antipsicóticos.
Não se sabe se Geodon é seguro e eficaz em crianças.
Quais são os possíveis efeitos colaterais do Geodon?
Geodon 20mg pode causar efeitos colaterais graves, incluindo:
- batimentos cardíacos rápidos ou acelerados,
- vibrando em seu peito,
- falta de ar,
- tontura repentina,
- movimentos musculares descontrolados em seu rosto (mastigação, estalar os lábios, franzir a testa, movimento da língua, piscar ou movimento dos olhos),
- qualquer erupção cutânea,
- febre,
- aftas,
- feridas na pele,
- dor de garganta,
- tosse,
- Problemas respiratórios,
- aumento da sede,
- aumento da micção
- boca seca,
- odor de hálito frutado,
- músculos muito rígidos,
- febre alta,
- sudorese,
- agitação, e
- confusão
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns de Geodon 40mg incluem:
- tontura,
- sonolência,
- fraqueza,
- náusea,
- vômito,
- dificuldade para engolir,
- sentindo-se inquieto,
- tremores,
- problemas de visão,
- nariz escorrendo, e
- tosse nova ou agravada
Informe o seu médico se tiver algum efeito secundário que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Prometrium. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
AVISO
MORTALIDADE AUMENTADA EM PACIENTES IDOSOS COM PSICOSE RELACIONADA À DEMÊNCIA
Pacientes idosos com psicose relacionada à demência tratados com medicamentos antipsicóticos apresentam risco aumentado de morte. GEODON não está aprovado para o tratamento de psicose relacionada à demência [ver ADVERTÊNCIAS E PRECAUÇÕES].
DESCRIÇÃO
GEODON 40mg está disponível em cápsulas (cloridrato de ziprasidona) para administração oral e como injeção (mesilato de ziprasidona) apenas para uso intramuscular. A ziprasidona é um agente psicotrópico que não está quimicamente relacionado aos agentes antipsicóticos fenotiazina ou butirofenona. Possui peso molecular de 412,94 (base livre), com o seguinte nome químico: 5-[2-[4-(1,2-benzisotiazol-3-il)-1-piperazinil]etil]-6-cloro-1 ,3-di-hidro-2H-indol-2-ona. A fórmula empírica de C21H21ClN4OS (base livre de ziprasidona) representa a seguinte fórmula estrutural:
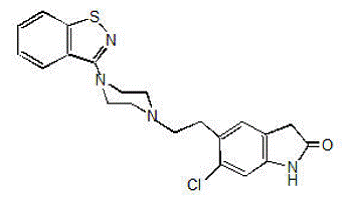
GEODON Cápsulas contém um monocloridrato, sal monohidratado de ziprasidona. Quimicamente, o monohidrato de cloridrato de ziprasidona é 5-[2-[4-(1,2-benzisotiazol-3-il)-1-piperazinil]etil]-6-cloro-1,3-di-hidro-2H-indol-2-ona , monocloridrato, monohidrato. A fórmula empírica é C21H21ClN4OS• HCl• H2O e seu peso molecular é 467,42. O cloridrato de ziprasidona monohidratado é um pó branco a ligeiramente rosa.
As cápsulas de GEODON 20mg são fornecidas para administração oral em cápsulas de 20 mg (azul/branco), 40 mg (azul/azul), 60 mg (branco/branco) e 80 mg (azul/branco). GEODON 40mg cápsulas contém cloridrato de ziprasidona monohidratado, lactose, amido pré-gelatinizado e estearato de magnésio.
GEODON para injeção contém uma forma liofilizada de trihidrato de mesilato de ziprasidona. Quimicamente, tri-hidrato de mesilato de ziprasidona é 5-[2-[4-(1,2-benzisotiazol-3-il)-1-piperazinil]etil]-6-cloro-1,3-di-hidro-2H-indol-2-ona , metanossulfonato, tri-hidrato. A fórmula empírica é C21H21ClN4OS • CH3SO3H • 3H2O e seu peso molecular é 563,09.
GEODON 40mg para injeção está disponível em um frasco de dose única como mesilato de ziprasidona (20 mg de ziprasidona/mL quando reconstituído de acordo com as instruções do rótulo) [ver DOSAGEM E ADMINISTRAÇÃO ]. Cada mL de mesilato de ziprasidona para injeção (quando reconstituído) contém 20 mg de ziprasidona e 4,7 mg de ácido metanossulfônico solubilizado por 294 mg de β-ciclodextrina de sulfobutiléter sódico (SBECD).
INDICAÇÕES
GEODON é indicado para o tratamento da esquizofrenia, como monoterapia para o tratamento agudo de episódios maníacos bipolares ou mistos e como adjuvante ao lítio ou valproato para o tratamento de manutenção do transtorno bipolar. GEODON intramuscular é indicado para agitação aguda em pacientes esquizofrênicos. Ao decidir entre os tratamentos alternativos disponíveis para a condição que necessita de tratamento, o prescritor deve considerar o achado da maior capacidade da ziprasidona de prolongar o intervalo QT/QTc em comparação com vários outros medicamentos antipsicóticos [ver AVISOS E PRECAUÇÕES ]. O prolongamento do intervalo QTc está associado em algumas outras drogas com a capacidade de causar arritmia tipo torsade de pointes, uma taquicardia ventricular polimórfica potencialmente fatal e morte súbita. Em muitos casos, isso levaria à conclusão de que outras drogas deveriam ser experimentadas primeiro. Ainda não se sabe se a ziprasidona causará torsade de pointes ou aumentará a taxa de morte súbita [ver AVISOS E PRECAUÇÕES ]
Esquizofrenia
- GEODON é indicado para o tratamento da esquizofrenia em adultos [ver Estudos clínicos ].
Transtorno Bipolar I (episódios agudos mistos ou maníacos e tratamento de manutenção como adjuvante ao lítio ou valproato)
- GEODON é indicado como monoterapia para o tratamento agudo de adultos com episódios maníacos ou mistos associados ao transtorno bipolar I [ver Estudos clínicos ].
- GEODON 40mg é indicado como adjuvante ao lítio ou valproato para o tratamento de manutenção do transtorno bipolar I em adultos [ver Estudos clínicos ].
Tratamento agudo da agitação na esquizofrenia
- GEODON 40mg intramuscular é indicado para o tratamento da agitação aguda em pacientes adultos esquizofrênicos para os quais o tratamento com ziprasidona é apropriado e que precisam de medicação antipsicótica intramuscular para controle rápido da agitação [ver Estudos clínicos ].
Uma vez que não há experiência em relação à segurança da administração intramuscular de ziprasidona a pacientes esquizofrênicos que já estejam tomando ziprasidona oral, a prática de coadministração não é recomendada.
DOSAGEM E ADMINISTRAÇÃO
Esquizofrenia
Seleção de Dose
As cápsulas de GEODON 40mg devem ser administradas em uma dose diária inicial de 20 mg duas vezes ao dia com alimentos. Em alguns pacientes, a dose diária pode ser ajustada posteriormente com base no estado clínico individual até 80 mg duas vezes ao dia. Os ajustes de dose, se indicados, geralmente devem ocorrer em intervalos não inferiores a 2 dias, pois o estado de equilíbrio é alcançado em 1 a 3 dias. A fim de garantir o uso da menor dose eficaz, os pacientes devem ser observados quanto à melhora por várias semanas antes do ajuste da dose para cima.
A eficácia na esquizofrenia foi demonstrada em uma faixa de dose de 20 mg a 100 mg duas vezes ao dia em ensaios clínicos controlados por placebo de curto prazo. Houve tendências de resposta à dose na faixa de 20 mg a 80 mg duas vezes ao dia, mas os resultados não foram consistentes. Um aumento para uma dose superior a 80 mg duas vezes ao dia geralmente não é recomendado. A segurança de doses acima de 100 mg duas vezes ao dia não foi sistematicamente avaliada em estudos clínicos [ver Estudos clínicos ].
Tratamento de manutenção
Embora não haja evidências disponíveis para responder à questão de quanto tempo um paciente tratado com ziprasidona deve permanecer com ela, um estudo de manutenção em pacientes que estavam sintomaticamente estáveis e depois randomizados para continuar com ziprasidona ou mudar para placebo demonstrou um atraso no tempo recaída para pacientes recebendo GEODON [ver Estudos clínicos ]. Nenhum benefício adicional foi demonstrado para doses acima de 20 mg duas vezes ao dia. Os pacientes devem ser reavaliados periodicamente para determinar a necessidade de tratamento de manutenção.
Transtorno Bipolar I (episódios agudos mistos ou maníacos e tratamento de manutenção como adjuvante ao lítio ou valproato)
Tratamento Agudo de Episódios Maníacos ou Mistos
Seleção de Dose - Ziprasidona oral deve ser administrada em uma dose diária inicial de 40 mg duas vezes ao dia com alimentos. A dose pode então ser aumentada para 60 mg ou 80 mg duas vezes ao dia no segundo dia de tratamento e subsequentemente ajustada com base na tolerância e eficácia na faixa de 40 mg-80 mg duas vezes ao dia. Nos ensaios clínicos de dose flexível, a dose média diária administrada foi de aproximadamente 120 mg [ver Estudos clínicos ].
Tratamento de manutenção (como adjuvante ao lítio ou valproato)
Continue o tratamento com a mesma dose em que o paciente foi inicialmente estabilizado, dentro do intervalo de 40 mg-80 mg duas vezes ao dia com alimentos. Os pacientes devem ser reavaliados periodicamente para determinar a necessidade de tratamento de manutenção [ver Estudos clínicos ].
Tratamento agudo da agitação na esquizofrenia
Dosagem Intramuscular
A dose recomendada é de 10 mg a 20 mg administrada conforme necessário até uma dose máxima de 40 mg por dia. Doses de 10 mg podem ser administradas a cada duas horas; doses de 20 mg podem ser administradas a cada quatro horas até um máximo de 40 mg/dia. A administração intramuscular de ziprasidona por mais de três dias consecutivos não foi estudada.
Se a terapia de longo prazo for indicada, as cápsulas de cloridrato de ziprasidona oral devem substituir a administração intramuscular o mais rápido possível.
Uma vez que não há experiência em relação à segurança da administração intramuscular de ziprasidona a pacientes esquizofrênicos que já estejam tomando ziprasidona oral, a prática de coadministração não é recomendada.
A ziprasidona intramuscular destina-se apenas ao uso intramuscular e não deve ser administrada por via intravenosa.
Preparação intramuscular para administração
GEODON para injeção (mesilato de ziprasidona) só deve ser administrado por injeção intramuscular e não deve ser administrado por via intravenosa. Os frascos de dose única requerem reconstituição antes da administração.
Adicione 1,2 mL de água estéril para injeção ao frasco e agite vigorosamente até que todo o medicamento esteja dissolvido. Cada ml de solução reconstituída contém 20 mg de ziprasidona. Para administrar uma dose de 10 mg, aspire 0,5 mL da solução reconstituída. Para administrar uma dose de 20 mg, aspire 1,0 mL da solução reconstituída. Qualquer porção não utilizada deve ser descartada. Uma vez que nenhum conservante ou agente bacteriostático está presente neste produto, a técnica asséptica deve ser usada na preparação da solução final. Este medicamento não deve ser misturado com outros medicamentos ou solventes que não a água estéril para injeção. Os medicamentos parenterais devem ser inspecionados visualmente quanto a partículas e descoloração antes da administração, sempre que a solução e o recipiente permitirem.
COMO FORNECIDO
Formas de dosagem e pontos fortes
Cápsulas GEODON são diferenciados pela cor/tamanho da cápsula e são impressos em tinta preta com “Pfizer e ZDX [força de dosagem]” ou “Pfizer” e um número único. As cápsulas de GEODON 40mg são fornecidas para administração oral em cápsulas de 20 mg (azul/branco), 40 mg (azul/azul), 60 mg (branco/branco) e 80 mg (azul/branco). Eles são fornecidos nas seguintes potências e configurações de embalagem:
GEODON para injeção está disponível em um frasco de dose única como mesilato de ziprasidona (20 mg de ziprasidona/mL quando reconstituído de acordo com as instruções do rótulo) [ver DOSAGEM E ADMINISTRAÇÃO ]. Cada mL de mesilato de ziprasidona para injeção (quando reconstituído) fornece uma solução incolor a rosa pálido que contém 20 mg de ziprasidona e 4,7 mg de ácido metanossulfônico solubilizado por 294 mg de sulfobutiléter β-ciclodextrina sódica (SBECD).
Armazenamento e manuseio
Cápsulas GEODON são diferenciados pela cor/tamanho da cápsula e são impressos em tinta preta com “Pfizer e ZDX [força de dosagem]” ou com “Pfizer” e um número único. As cápsulas de GEODON 20mg são fornecidas para administração oral em cápsulas de 20 mg (azul/branco), 40 mg (azul/azul), 60 mg (branco/branco) e 80 mg (azul/branco). Eles são fornecidos nas seguintes potências e configurações de embalagem:
Ou
As cápsulas de GEODON devem ser armazenadas a 25°C (77°F); excursões permitidas de 15°C a 30°C (59°F a 86°F) [ver Temperatura ambiente controlada USP ].
GEODON 80mg para injeção está disponível em um frasco de dose única como mesilato de ziprasidona (20 mg de ziprasidona/mL quando reconstituído de acordo com as instruções do rótulo) [ver DOSAGEM E ADMINISTRAÇÃO ]. Cada mL de mesilato de ziprasidona para injeção (quando reconstituído) fornece uma solução incolor a rosa pálido que contém 20 mg de ziprasidona e 4,7 mg de ácido metanossulfônico solubilizado por 294 mg de sulfobutiléter β-ciclodextrina sódica (SBECD).
GEODON 40mg para injeção deve ser armazenado a 25°C (77°F); excursões permitidas de 15°C a 30°C (59°F a 86°F) [ver Temperatura ambiente controlada USP na forma seca. Proteja da luz. Após a reconstituição, GEODON 40mg para injeção pode ser armazenado, quando protegido da luz, por até 24 horas a 15°C a 30°C (59°F a 86°F) ou até 7 dias refrigerado, 2°C a 8 °C (36°F a 46°F).
Distribuído por: Roerig Division of Pfizer Inc, NY, NY 10017. Revisado: outubro de 2020
EFEITOS COLATERAIS
Experiência de Ensaios Clínicos
Como os ensaios clínicos são conduzidos em condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparadas às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
Ensaios clínicos para ziprasidona oral incluíram aproximadamente 5.700 pacientes e/ou indivíduos normais expostos a uma ou mais doses de ziprasidona. Destes 5.700, mais de 4.800 eram pacientes que participaram de ensaios de eficácia de dose múltipla, e sua experiência correspondeu a aproximadamente 1.831 pacientes-ano. Esses pacientes incluem: (1) 4.331 pacientes que participaram de ensaios de dose múltipla, predominantemente em esquizofrenia, representando aproximadamente 1.698 pacientes-ano de exposição em 5 de fevereiro de 2000; e (2) 472 pacientes que participaram de ensaios de mania bipolar representando aproximadamente 133 pacientes-ano de exposição. Outros 127 pacientes com transtorno bipolar participaram de um estudo de tratamento de manutenção de longo prazo, representando aproximadamente 74,7 pacientes-ano de exposição à ziprasidona. As condições e a duração do tratamento com ziprasidona incluíram estudos abertos e duplo-cegos, estudos de pacientes internados e ambulatoriais e exposição de curto e longo prazo.
Ensaios clínicos para ziprasidona intramuscular incluíram 570 pacientes e/ou indivíduos normais que receberam uma ou mais injeções de ziprasidona. Mais de 325 desses indivíduos participaram de ensaios envolvendo a administração de doses múltiplas.
As reações adversas durante a exposição foram obtidas pela coleta de experiências adversas relatadas voluntariamente, bem como resultados de exames físicos, sinais vitais, pesos, análises laboratoriais, ECGs e resultados de exames oftalmológicos.
As frequências declaradas de reações adversas representam a proporção de indivíduos que sofreram, pelo menos uma vez, uma reação adversa emergente do tratamento do tipo listado. Uma reação foi considerada emergente do tratamento se ocorreu pela primeira vez ou piorou durante o tratamento após a avaliação inicial.
Descobertas adversas observadas em ensaios controlados por placebo de curto prazo com ziprasidona oral
Os achados a seguir são baseados nos ensaios de pré-comercialização de curto prazo controlados por placebo para esquizofrenia (um conjunto de dois ensaios de dose fixa de 6 semanas e dois de 4 semanas) e mania bipolar (um conjunto de dois ensaios de dose flexível de 3 semanas estudos) nos quais a ziprasidona foi administrada em doses variando de 10 a 200 mg/dia.
Reações Adversas Comumente Observadas em Ensaios de Curto Prazo Controlados por Placebo
As seguintes reações adversas foram as reações adversas mais comumente observadas associadas ao uso de ziprasidona (incidência de 5% ou mais) e não observadas em uma incidência equivalente entre os pacientes tratados com placebo (incidência de ziprasidona pelo menos duas vezes a do placebo):
Ensaios de esquizofrenia (ver Tabela 11)
- Sonolência
- Infecção do trato respiratório
Ensaios bipolares (ver Tabela 12)
- Sonolência
- Sintomas extrapiramidais que incluem os seguintes termos de reação adversa: síndrome extrapiramidal, hipertonia, distonia, discinesia, hipocinesia, tremor, paralisia e espasmos. Nenhuma dessas reações adversas ocorreu individualmente com uma incidência superior a 10% em ensaios de mania bipolar.
- Tontura que inclui os termos de reação adversa tontura e vertigem.
- Acatisia
- Visão anormal
- Astenia
- Vômito
Esquizofrenia
Reações Adversas Associadas à Interrupção do Tratamento em Ensaios de Curto Prazo Controlados por Placebo de Ziprasidona Oral
Aproximadamente 4,1% (29/702) dos pacientes tratados com ziprasidona em estudos de curto prazo controlados por placebo interromperam o tratamento devido a uma reação adversa, em comparação com cerca de 2,2% (6/273) no placebo. A reação mais comum associada à desistência foi erupção cutânea, incluindo 7 desistências por erupção cutânea entre pacientes com ziprasidona (1%) em comparação com nenhum paciente placebo [ver AVISOS E PRECAUÇÕES ].
Reações adversas que ocorrem com uma incidência de 2% ou mais entre pacientes tratados com ziprasidona em estudos de curta duração, orais e controlados por placebo
A Tabela 11 enumera a incidência, arredondada para o percentual mais próximo, de reações adversas emergentes do tratamento que ocorreram durante a terapia aguda (até 6 semanas) em pacientes predominantemente com esquizofrenia, incluindo apenas aquelas reações que ocorreram em 2% ou mais dos pacientes tratados com ziprasidona e para os quais a incidência em pacientes tratados com ziprasidona foi maior do que a incidência em pacientes tratados com placebo.
Dependência de Dose de Reações Adversas em Ensaios de Curto Prazo, de Dose Fixa e Controlados por Placebo
Uma análise da resposta à dose no conjunto de 4 estudos de esquizofrenia revelou uma relação aparente de reação adversa à dose para as seguintes reações: astenia, hipotensão postural, anorexia, boca seca, salivação aumentada, artralgia, ansiedade, tontura, distonia, hipertonia, sonolência , tremor, rinite, erupção cutânea e visão anormal.
Sintomas Extrapiramidais (EPS)
A incidência de EPS relatado (que incluiu os termos de reação adversa síndrome extrapiramidal, hipertonia, distonia, discinesia, hipocinesia, tremor, paralisia e espasmos) para pacientes tratados com ziprasidona nos estudos de esquizofrenia de curto prazo controlados por placebo foi de 14% vs. 8% para placebo. Dados coletados objetivamente desses estudos na Escala de Avaliação Simpson-Angus (para EPS) e na Escala de Acatisia de Barnes (para acatisia) geralmente não mostraram diferença entre ziprasidona e placebo.
Distonia
Efeito de classe: Sintomas de distonia, contrações anormais prolongadas de grupos musculares, podem ocorrer em indivíduos suscetíveis durante os primeiros dias de tratamento. Os sintomas distônicos incluem: espasmo dos músculos do pescoço, algumas vezes progredindo para aperto na garganta, dificuldade para engolir, dificuldade para respirar e/ou protrusão da língua. Embora esses sintomas possam ocorrer em doses baixas, eles ocorrem com mais frequência e com maior gravidade com alta potência e em doses mais altas de medicamentos antipsicóticos de primeira geração. Um risco elevado de distonia aguda é observado em homens e grupos etários mais jovens.
Mudanças nos sinais vitais
A ziprasidona está associada à hipotensão ortostática [ver AVISOS E PRECAUÇÕES ]
Alterações de ECG
A ziprasidona está associada a um aumento do intervalo QTc [ver AVISOS E PRECAUÇÕES ]. Nos estudos de esquizofrenia, a ziprasidona foi associada a um aumento médio na frequência cardíaca de 1,4 batimentos por minuto em comparação com uma diminuição de 0,2 batimentos por minuto entre os pacientes que receberam placebo.
Outras reações adversas observadas durante a avaliação pré-comercialização da ziprasidona oral
A seguir está uma lista de termos COSTART que refletem as reações adversas emergentes do tratamento, conforme definido na introdução da seção REAÇÕES ADVERSAS relatadas por pacientes tratados com ziprasidona em estudos de esquizofrenia em doses múltiplas > 4 mg/dia no banco de dados de 3.834 pacientes. Todas as reações relatadas estão incluídas, exceto aquelas já listadas na Tabela 11 ou em outro lugar na bula, os termos de reação que foram tão gerais que não foram informativos, as reações relatadas apenas uma vez e que não tiveram uma probabilidade substancial de ameaçar a vida, reações que fazem parte da doença a ser tratada ou são comuns como reações de base e reações consideradas improváveis de estarem relacionadas com o medicamento. É importante ressaltar que, embora as reações relatadas tenham ocorrido durante o tratamento com ziprasidona, não necessariamente foram causadas por ela.
As reações adversas são ainda categorizadas por sistema corporal e listadas em ordem decrescente de frequência de acordo com as seguintes definições:
Frequentes - reações adversas que ocorrem em pelo menos 1/100 pacientes (≥1,0% dos pacientes) (somente aquelas não listadas nos resultados tabulados de estudos controlados por placebo aparecem nesta lista);
Infrequentes - reações adversas que ocorrem em 1/100 a 1/1.000 pacientes (em 0,1-1,0% dos pacientes)
Raros - reações adversas ocorrendo em menos de 1/1.000 pacientes (
Corpo como um todo
Dor abdominal frequente, síndrome gripal, febre, queda acidental, edema facial, calafrios, reação de fotossensibilidade, dor no flanco, hipotermia, acidente automobilístico
Sistema cardiovascular
Taquicardia frequente, hipertensão, hipotensão postural
Bradicardia infrequente, angina pectoris, fibrilação atrial
Raros bloqueio AV de primeiro grau, bloqueio de ramo, flebite, embolia pulmonar, cardiomegalia, infarto cerebral, acidente vascular cerebral, tromboflebite profunda, miocardite, tromboflebite
Sistema digestivo
Anorexia frequente, vômitos
Hemorragia retal pouco frequente, disfagia, edema da língua
Hemorragia gengival rara, icterícia, impactação fecal, aumento da gama glutamil transpeptidase, hematêmese, icterícia colestática, hepatite, hepatomegalia, leucoplasia da boca, depósito de fígado gorduroso, melena
Endócrino
Raro hipotireoidismo, hipertireoidismo, tireoidite
Sistema Hemico e Linfático
Anemia infrequente, equimose, leucocitose, leucopenia, eosinofilia, linfadenopatia
Raros trombocitopenia, anemia hipocrômica, linfocitose, monocitose, basofilia, linfedema, policitemia, trombocitemia
Distúrbios metabólicos e nutricionais
Sede infrequente, transaminase aumentada, edema periférico, hiperglicemia, creatinofosfoquinase aumentada, fosfatase alcalina aumentada, hipercolesteremia, desidratação, desidrogenase lática aumentada, albuminúria, hipocalemia
Raro BUN aumentado, creatinina aumentada, hiperlipemia, hipocolesteremia, hipercalemia, hipocloremia, hipoglicemia, hiponatremia, hipoproteinemia, diminuição da tolerância à glicose, gota, hipercloremia, hiperuricemia, hipocalcemia, hipoglicemia, hipomagnesemia, cetose, alcalose respiratória
Sistema musculo-esquelético
Mialgia frequente
tenossinovite infrequente
Miopatia rara
Sistema nervoso
Agitação frequente, síndrome extrapiramidal, tremor, distonia, hipertonia, discinesia, hostilidade, espasmos, parestesia, confusão, vertigem, hipocinesia, hipercinesia, marcha anormal, crise oculogírica, hipoestesia, ataxia, amnésia, rigidez de roda dentada, delírio, hipotonia, acinesia, disartria, síndrome de abstinência, síndrome bucoglossal, coreoatetose, diplopia, incoordenação, neuropatia
Paralisia pouco frequente
Raro mioclonia, nistagmo, torcicolo, parestesia perioral, opistótono, reflexos aumentados, trismo
Sistema respiratório
Dispneia frequente
Pneumonia infrequente, epistaxe
Raros hemoptise, laringismo
Pele e Anexos
Erupção maculopapular pouco frequente, urticária, alopecia, eczema, dermatite esfoliativa, dermatite de contato, erupção vesiculobolhosa
Sentidos Especiais
Dermatite fúngica frequente
Conjuntivite pouco frequente, olhos secos, zumbido, blefarite, catarata, fotofobia
Hemorragia ocular rara, defeito de campo visual, ceratite, ceratoconjuntivite
Sistema Urogenital
Impotência infrequente, ejaculação anormal, amenorreia, hematúria, menorragia, lactação feminina, poliúria, retenção urinária metrorragia, disfunção sexual masculina, anorgasmia, glicosúria
Rara ginecomastia, hemorragia vaginal, noctúria, oligúria, disfunção sexual feminina, hemorragia uterina
Transtorno bipolar
Tratamento Agudo de Episódios Maníacos ou Mistos
Reações Adversas Associadas à Interrupção do Tratamento em Curto Prazo, Ensaios Controlados por Placebo
Aproximadamente 6,5% (18/279) dos pacientes tratados com ziprasidona em estudos de curto prazo controlados por placebo interromperam o tratamento devido a uma reação adversa, em comparação com cerca de 3,7% (5/136) no placebo. As reações mais comuns associadas à desistência nos pacientes tratados com ziprasidona foram acatisia, ansiedade, depressão, tontura, distonia, erupção cutânea e vômito, com 2 desistências para cada uma dessas reações entre os pacientes com ziprasidona (1%) em comparação com um paciente placebo cada para distonia e erupção cutânea (1%) e nenhum paciente placebo para as reações adversas restantes.
Reações adversas que ocorrem com uma incidência de 2% ou mais entre pacientes tratados com ziprasidona em estudos de curta duração, orais e controlados por placebo
Tabela 12 enumera a incidência, arredondada para o percentual mais próximo, de reações adversas emergentes do tratamento que ocorreram durante a terapia aguda (até 3 semanas) em pacientes com mania bipolar, incluindo apenas aquelas reações que ocorreram em 2% ou mais dos pacientes tratados com ziprasidona e para os quais a incidência em pacientes tratados com ziprasidona foi maior do que a incidência em pacientes tratados com placebo.
Explorações de interações com base no sexo não revelaram diferenças clinicamente significativas na ocorrência de reações adversas com base nesse fator demográfico.
Ziprasidona intramuscular
Reações Adversas Ocorrendo com Incidência de 1% ou Mais entre Pacientes Tratados com Ziprasidona em Ensaios de Curto Prazo de Ziprasidona Intramuscular
A Tabela 13 enumera a incidência, arredondada para o percentual mais próximo, de reações adversas emergentes do tratamento que ocorreram durante a terapia aguda com ziprasidona intramuscular em 1% ou mais dos pacientes.
Nestes estudos, as reações adversas mais comumente observadas associadas ao uso de ziprasidona intramuscular (incidência de 5% ou mais) e observadas em uma taxa de ziprasidona intramuscular (nos grupos de dose mais alta) pelo menos duas vezes a do grupo de ziprasidona intramuscular mais baixa foram cefaleia (13%), náusea (12%) e sonolência (20%).
Experiência pós-marketing
As seguintes reações adversas foram identificadas durante o uso pós-aprovação de GEODON. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento.
As notificações de reações adversas não listadas acima que foram recebidas desde a introdução no mercado incluem ocorrências raras dos seguintes: Distúrbios cardíacos: taquicardia, torsade de pointes (na presença de múltiplos fatores de confusão), [ver AVISOS E PRECAUÇÕES ]; Distúrbios do Sistema Digestivo: Língua Inchada; Distúrbios do Sistema Reprodutivo e da Mama: Galactorreia, priapismo; Distúrbios do sistema nervoso: queda facial, síndrome neuroléptica maligna, síndrome serotoninérgica (isolada ou em combinação com medicamentos serotoninérgicos), discinesia tardia; Distúrbios Psiquiátricos: Insônia, mania/hipomania; Distúrbios da pele e do tecido subcutâneo: Reação alérgica (como dermatite alérgica, angioedema, edema orofacial, urticária), erupção cutânea, Reação a Medicamentos com Eosinofilia e Sintomas Sistêmicos (DRESS); Distúrbios do Sistema Urogenital: Enurese, incontinência urinária; Distúrbios vasculares: hipotensão postural, síncope.
INTERAÇÕES MEDICAMENTOSAS
As interações medicamentosas podem ser farmacodinâmicas (efeitos farmacológicos combinados) ou farmacocinéticas (alteração dos níveis plasmáticos). Os riscos do uso de ziprasidona em combinação com outros medicamentos foram avaliados conforme descrito abaixo. Todos os estudos de interação foram realizados com ziprasidona oral. Com base no perfil farmacodinâmico e farmacocinético da ziprasidona, possíveis interações podem ser antecipadas:
Via Metabólica
Aproximadamente dois terços da ziprasidona são metabolizados através de uma combinação de redução química pela glutationa e redução enzimática pela aldeído oxidase. Não são conhecidos inibidores ou indutores clinicamente relevantes da aldeído oxidase. Menos de um terço da depuração metabólica da ziprasidona é mediada pela oxidação catalisada pelo citocromo P450.
Estudos in vitro
Um estudo de inibição enzimática in vitro utilizando microssomas hepáticos humanos mostrou que a ziprasidona teve pouco efeito inibitório sobre CYP1A2, CYP2C9, CYP2C19, CYP2D6 e CYP3A4 e, portanto, provavelmente não interferiria no metabolismo de medicamentos metabolizados principalmente por essas enzimas. Há pouco potencial para interações medicamentosas com ziprasidona devido ao deslocamento [ver FARMACOLOGIA CLÍNICA ].
Interações Farmacodinâmicas
A ziprasidona não deve ser usada com nenhum medicamento que prolongue o intervalo QT [ver CONTRA-INDICAÇÕES ].
Dados os efeitos primários da ziprasidona no SNC, deve-se ter cautela quando ela for administrada em combinação com outros medicamentos de ação central.
Devido ao seu potencial para induzir hipotensão, a ziprasidona pode potencializar os efeitos de certos agentes anti-hipertensivos.
A ziprasidona pode antagonizar os efeitos da levodopa e dos agonistas da dopamina.
Interações Farmacocinéticas
Carbamazepina
carbamazepina é um indutor do CYP3A4; a administração de 200 mg duas vezes ao dia por 21 dias resultou em uma diminuição de aproximadamente 35% na AUC da ziprasidona. Este efeito pode ser maior quando são administradas doses mais elevadas de carbamazepina.
Cetoconazol
O cetoconazol, um potente inibidor do CYP3A4, na dose de 400 mg QD por 5 dias, aumentou a AUC e Cmax da ziprasidona em cerca de 35-40%. Espera-se que outros inibidores do CYP3A4 tenham efeitos semelhantes.
Cimetidina
A cimetidina na dose de 800 mg QD por 2 dias não afetou a farmacocinética da ziprasidona.
Antiácido
A coadministração de 30 mL de Maalox® com ziprasidona não afetou a farmacocinética da ziprasidona.
Lítio
A ziprasidona na dose de 40 mg duas vezes ao dia administrada concomitantemente com lítio na dose de 450 mg duas vezes ao dia por 7 dias não afetou o nível de equilíbrio ou a depuração renal do lítio. Ziprasidona administrada como adjuvante ao lítio em um estudo de manutenção de pacientes bipolares não afetou os níveis terapêuticos médios de lítio.
Contraceptivos orais
Estudos in vivo não revelaram efeito da ziprasidona na farmacocinética dos componentes de estrogênio ou progesterona. A ziprasidona na dose de 20 mg duas vezes ao dia não afetou a farmacocinética dos contraceptivos orais administrados concomitantemente, etinilestradiol (0,03 mg) e levonorgestrel (0,15 mg).
Dextrometorfano
Consistente com os resultados in vitro, um estudo em voluntários saudáveis normais mostrou que a ziprasidona não alterou o metabolismo do dextrometorfano, um substrato modelo CYP2D6, em seu principal metabólito, o dextrorfano. Não houve alteração estatisticamente significativa na relação dextrometorfano/dextrorfano urinário.
Valproato
Uma interação farmacocinética da ziprasidona com o valproato é improvável devido à falta de vias metabólicas comuns para os dois medicamentos. Ziprasidona administrada como adjuvante ao valproato em um estudo de manutenção de pacientes bipolares não afetou os níveis terapêuticos médios de valproato.
Outra terapia medicamentosa concomitante
análise farmacocinética populacional de pacientes esquizofrênicos inscritos em ensaios clínicos controlados não revelou evidência de quaisquer interações farmacocinéticas clinicamente significativas com benzotropina, propranolol ou lorazepam.
Interação Alimentar
A biodisponibilidade absoluta de uma dose de 20 mg em condições de alimentação é de aproximadamente 60%. A absorção da ziprasidona é aumentada em até duas vezes na presença de alimentos. FARMACOLOGIA CLÍNICA ].
AVISOS
Incluído como parte do "PRECAUÇÕES" Seção
PRECAUÇÕES
Aumento da mortalidade em pacientes idosos com psicose relacionada à demência
Pacientes idosos com psicose relacionada à demência tratados com medicamentos antipsicóticos apresentam risco aumentado de morte. Análises de 17 estudos controlados por placebo (duração modal de 10 semanas), principalmente em pacientes tomando antipsicóticos atípicos, revelaram um risco de morte em pacientes tratados com drogas entre 1,6 a 1,7 vezes o risco de morte em pacientes tratados com placebo. Ao longo de um estudo controlado típico de 10 semanas, a taxa de morte em pacientes tratados com drogas foi de cerca de 4,5%, em comparação com uma taxa de cerca de 2,6% no grupo placebo.
Embora as causas de morte fossem variadas, a maioria das mortes parecia ser de natureza cardiovascular (por exemplo, insuficiência cardíaca, morte súbita) ou infecciosa (por exemplo, pneumonia). GEODON não está aprovado para o tratamento de pacientes com psicose relacionada à demência. [Vejo AVISO DE CAIXA , Reações Adversas Cerebrovasculares, Incluindo AVC, em Pacientes Idosos com Psicose Relacionada à Demência ].
Reações Adversas Cerebrovasculares, Incluindo AVC, em Pacientes Idosos com Psicose Relacionada à Demência
Em estudos controlados por placebo em idosos com demência, os pacientes randomizados para risperidona, aripiprazol e olanzapina tiveram maior incidência de acidente vascular cerebral e ataque isquêmico transitório, incluindo acidente vascular cerebral fatal. GEODON não está aprovado para o tratamento de pacientes com psicose relacionada à demência [ver AVISO DE CAIXA e Aumento da mortalidade em pacientes idosos com psicose relacionada à demência ].
Prolongamento do QT e Risco de Morte Súbita
O uso de ziprasidona deve ser evitado em combinação com outros medicamentos que sabidamente prolongam o intervalo QTc [ver CONTRA-INDICAÇÕES e INTERAÇÕES MEDICAMENTOSAS ]. Além disso, os médicos devem estar alertas para a identificação de outras drogas que foram consistentemente observadas para prolongar o intervalo QTc. Esses medicamentos não devem ser prescritos com ziprasidona. A ziprasidona também deve ser evitada em pacientes com síndrome do QT longo congênito e em pacientes com histórico de arritmias cardíacas. CONTRA-INDICAÇÕES ].
Um estudo comparando diretamente o efeito de prolongamento do intervalo QT/QTc da ziprasidona oral com vários outros medicamentos eficazes no tratamento da esquizofrenia foi realizado em pacientes voluntários. Na primeira fase do estudo, os ECGs foram obtidos no momento da concentração plasmática máxima, quando a droga foi administrada isoladamente. Na segunda fase do estudo, os ECGs foram obtidos no momento da concentração plasmática máxima enquanto o medicamento era coadministrado com um inibidor do metabolismo CYP4503A4 do medicamento.
Na primeira fase do estudo, a alteração média no QTc da linha de base foi calculada para cada droga, usando uma correção baseada em amostra que remove o efeito da frequência cardíaca no intervalo QT. O aumento médio no QTc desde o início para ziprasidona variou de aproximadamente 9 a 14 mseg maior do que para quatro dos medicamentos comparadores (risperidona, olanzapina, quetiapina e haloperidol), mas foi aproximadamente 14 mseg menor que o prolongamento observado para tioridazina.
Na segunda fase do estudo, o efeito da ziprasidona no comprimento do intervalo QTc não foi aumentado pela presença de um inibidor metabólico (cetoconazol 200 mg duas vezes ao dia).
Em estudos controlados por placebo, a ziprasidona oral aumentou o intervalo QTc em comparação ao placebo em aproximadamente 10 ms na dose diária mais alta recomendada de 160 mg. Em ensaios clínicos com ziprasidona oral, os eletrocardiogramas de 2/2.988 (0,06%) pacientes que receberam GEODON 80mg e 1/440 (0,23%) pacientes que receberam placebo revelaram intervalos QTc superiores ao limiar potencialmente clinicamente relevante de 500 mseg. Nos pacientes tratados com ziprasidona, nenhum dos casos sugeriu um papel da ziprasidona. Um paciente tinha histórico de QTc prolongado e uma medida de triagem de 489 mseg; QTc foi de 503 ms durante o tratamento com ziprasidona. O outro paciente teve um QTc de 391 mseg no final do tratamento com ziprasidona e, ao mudar para tioridazina, apresentou medições de QTc de 518 e 593 mseg.
Alguns medicamentos que prolongam o intervalo QT/QTc têm sido associados à ocorrência de torsade de pointes e morte súbita inexplicada. A relação do prolongamento do QT com a torsade de pointes é mais clara para aumentos maiores (20 mseg e maiores), mas é possível que prolongamentos QT/QTc menores também possam aumentar o risco, ou aumentá-lo em indivíduos suscetíveis. Embora torsade de pointes não tenha sido observada em associação com o uso de ziprasidona em estudos de pré-comercialização e a experiência seja muito limitada para descartar um risco aumentado, houve raros relatos pós-comercialização (na presença de múltiplos fatores de confusão) [ver REAÇÕES ADVERSAS ].
Um estudo avaliando o efeito de prolongamento do intervalo QT/QTc da ziprasidona intramuscular, com haloperidol intramuscular como controle, foi realizado em pacientes voluntários. No estudo, os ECGs foram obtidos no momento da concentração plasmática máxima após duas injeções de ziprasidona (20 mg e 30 mg) ou haloperidol (7,5 mg e 10 mg) administradas com quatro horas de intervalo. Observe que uma dose de 30 mg de ziprasidona intramuscular é 50% maior do que a dose terapêutica recomendada. A alteração média no QTc da linha de base foi calculada para cada droga, usando uma correção baseada em amostra que remove o efeito da frequência cardíaca no intervalo QT. O aumento médio no QTc da linha de base para ziprasidona foi de 4,6 ms após a primeira injeção e 12,8 ms após a segunda injeção. O aumento médio no QTc desde a linha de base para haloperidol foi de 6,0 ms após a primeira injeção e 14,7 ms após a segunda injeção. Neste estudo, nenhum paciente apresentou intervalo QTc superior a 500 mseg.
Assim como com outros medicamentos antipsicóticos e placebo, foram relatadas mortes súbitas inexplicáveis em pacientes tomando ziprasidona nas doses recomendadas. A experiência de pré-comercialização da ziprasidona não revelou um risco excessivo de mortalidade para a ziprasidona em comparação com outros medicamentos antipsicóticos ou placebo, mas a extensão da exposição foi limitada, especialmente para os medicamentos usados como controles ativos e placebo. No entanto, o maior prolongamento da duração do intervalo QTc da ziprasidona em comparação com vários outros medicamentos antipsicóticos levanta a possibilidade de que o risco de morte súbita possa ser maior para a ziprasidona do que para outros medicamentos disponíveis para o tratamento da esquizofrenia. Essa possibilidade precisa ser considerada na decisão entre medicamentos alternativos [ver INDICAÇÕES ].
Certas circunstâncias podem aumentar o risco de ocorrência de torsade de pointes e/ou morte súbita associada ao uso de medicamentos que prolongam o intervalo QTc, incluindo (1) bradicardia; (2) hipocalemia ou hipomagnesemia; (3) uso concomitante de outras drogas que prolongam o intervalo QTc; e (4) presença de prolongamento congênito do intervalo QT.
Recomenda-se que os pacientes considerados para tratamento com ziprasidona que estão em risco de distúrbios eletrolíticos significativos, hipocalemia em particular, tenham medições basais de potássio e magnésio séricos. A hipocalemia (e/ou hipomagnesemia) pode aumentar o risco de prolongamento do intervalo QT e arritmia. A hipocalemia pode resultar de terapia diurética, diarreia e outras causas. Pacientes com níveis séricos baixos de potássio e/ou magnésio devem ser reabastecidos com esses eletrólitos antes de prosseguir com o tratamento. É essencial monitorar periodicamente os eletrólitos séricos em pacientes para os quais a terapia diurética é introduzida durante o tratamento com ziprasidona. Intervalos QTc persistentemente prolongados também podem aumentar o risco de prolongamento adicional e arritmia, mas não está claro se as medidas de triagem de ECG de rotina são eficazes na detecção desses pacientes. Em vez disso, a ziprasidona deve ser evitada em pacientes com história de doença cardiovascular significativa, por exemplo, prolongamento do intervalo QT, infarto agudo do miocárdio recente, insuficiência cardíaca descompensada ou arritmia cardíaca. A ziprasidona deve ser descontinuada em pacientes que apresentam medições persistentes do QTc > 500 mseg.
Para pacientes em uso de ziprasidona que apresentam sintomas que podem indicar a ocorrência de torsade de pointes, por exemplo, tontura, palpitações ou síncope, o prescritor deve iniciar uma avaliação adicional, por exemplo, o monitoramento de Holter pode ser útil.
Síndrome Neuroléptica Maligna (SNM)
Um complexo de sintomas potencialmente fatal, algumas vezes referido como Síndrome Neuroléptica Maligna (SNM), foi relatado em associação com a administração de medicamentos antipsicóticos. As manifestações clínicas da SNM são hiperpirexia, rigidez muscular, estado mental alterado e evidência de instabilidade autonômica (pulso ou pressão arterial irregulares, taquicardia, sudorese e disritmia cardíaca). Sinais adicionais podem incluir creatinina fosfoquinase elevada, mioglobinúria (rabdomiólise) e insuficiência renal aguda.
avaliação diagnóstica de pacientes com esta síndrome é complicada. Ao chegar a um diagnóstico, é importante excluir casos em que a apresentação clínica inclui doença médica grave (por exemplo, pneumonia, infecção sistêmica, etc.) e sinais e sintomas extrapiramidais (SEP) não tratados ou tratados inadequadamente. Outras considerações importantes no diagnóstico diferencial incluem toxicidade anticolinérgica central, insolação, febre medicamentosa e patologia primária do sistema nervoso central (SNC).
O manejo da SNM deve incluir: (1) descontinuação imediata de drogas antipsicóticas e outras drogas não essenciais à terapia concomitante; (2) tratamento sintomático intensivo e acompanhamento médico; e (3) tratamento de quaisquer problemas médicos graves concomitantes para os quais estejam disponíveis tratamentos específicos. Não há acordo geral sobre regimes de tratamento farmacológico específico para SNM.
Se um paciente necessitar de tratamento medicamentoso antipsicótico após a recuperação da SNM, a potencial reintrodução da terapia medicamentosa deve ser cuidadosamente considerada. O paciente deve ser cuidadosamente monitorado, uma vez que foram relatadas recorrências de SNM.
Reações Adversas Cutâneas Graves
Reação medicamentosa com eosinofilia e sintomas sistêmicos (DRESS)
Reação medicamentosa com eosinofilia e sintomas sistêmicos (DRESS) foi relatada com a exposição à Ziprasidona. DRESS consiste em uma combinação de três ou mais dos seguintes: reação cutânea (como erupção cutânea ou dermatite esfoliativa), eosinofilia, febre, linfadenopatia e uma ou mais complicações sistêmicas, como hepatite, nefrite, pneumonite, miocardite e pericardite. DRESS às vezes é fatal. Descontinuar a ziprasidona se houver suspeita de DRESS.
Outras reações adversas cutâneas graves
Outras reações adversas cutâneas graves, como síndrome de Stevens-Johnson, foram relatadas com a exposição à ziprasidona. As reações adversas cutâneas graves às vezes são fatais. Descontinuar a ziprasidona se houver suspeita de reações adversas cutâneas graves.
Discinesia tardia
Uma síndrome de movimentos discinéticos, involuntários e potencialmente irreversíveis pode se desenvolver em pacientes em tratamento com drogas antipsicóticas. Embora a prevalência da síndrome pareça ser maior entre os idosos, especialmente as mulheres idosas, é impossível confiar nas estimativas de prevalência para prever, no início do tratamento antipsicótico, quais pacientes provavelmente desenvolverão a síndrome. Se os medicamentos antipsicóticos diferem em seu potencial para causar discinesia tardia é desconhecido.
Acredita-se que o risco de desenvolver discinesia tardia e a probabilidade de que se torne irreversível aumente à medida que a duração do tratamento e a dose cumulativa total de drogas antipsicóticas administradas ao paciente aumentam. No entanto, a síndrome pode se desenvolver, embora muito menos comumente, após períodos de tratamento relativamente breves com doses baixas.
Não há tratamento conhecido para casos estabelecidos de discinesia tardia, embora a síndrome possa regredir, parcial ou completamente, se o tratamento antipsicótico for retirado. O próprio tratamento antipsicótico, no entanto, pode suprimir (ou suprimir parcialmente) os sinais e sintomas da síndrome e, portanto, pode mascarar o processo subjacente. O efeito que a supressão sintomática tem sobre o curso a longo prazo da síndrome é desconhecido.
Dadas essas considerações, a ziprasidona deve ser prescrita da maneira mais provável de minimizar a ocorrência de discinesia tardia. O tratamento antipsicótico crônico geralmente deve ser reservado para pacientes que sofrem de uma doença crônica que (1) responde a medicamentos antipsicóticos e (2) para os quais tratamentos alternativos igualmente eficazes, mas potencialmente menos prejudiciais, não estão disponíveis ou são apropriados. Em pacientes que necessitam de tratamento crônico, deve-se buscar a menor dose e a menor duração do tratamento que produza uma resposta clínica satisfatória. A necessidade de continuação do tratamento deve ser reavaliada periodicamente.
Se surgirem sinais e sintomas de discinesia tardia em um paciente em uso de ziprasidona, a descontinuação do medicamento deve ser considerada. No entanto, alguns pacientes podem necessitar de tratamento com ziprasidona apesar da presença da síndrome.
Alterações metabólicas
Os antipsicóticos atípicos têm sido associados a alterações metabólicas que podem aumentar o risco cardiovascular/cerebrovascular. Essas alterações metabólicas incluem hiperglicemia, dislipidemia e ganho de peso corporal. Embora todos os medicamentos da classe tenham demonstrado produzir algumas alterações metabólicas, cada medicamento tem seu próprio perfil de risco específico.
Hiperglicemia e Diabetes Mellitus
Hiperglicemia e diabetes mellitus, em alguns casos extremos e associados a cetoacidose ou coma hiperosmolar ou morte, foram relatados em pacientes tratados com antipsicóticos atípicos. Houve poucos relatos de hiperglicemia ou diabetes em pacientes tratados com GEODON. Embora menos pacientes tenham sido tratados com GEODON, não se sabe se esta experiência mais limitada é a única razão para a escassez de tais relatos. A avaliação da relação entre o uso de antipsicóticos atípicos e anormalidades da glicose é complicada pela possibilidade de um risco aumentado de diabetes mellitus em pacientes com esquizofrenia e o aumento da incidência de diabetes mellitus na população em geral. Diante desses fatores de confusão, a relação entre o uso de antipsicóticos atípicos e as reações adversas relacionadas à hiperglicemia não é completamente compreendida. Não estão disponíveis estimativas de risco precisas para reações adversas relacionadas à hiperglicemia em pacientes tratados com antipsicóticos atípicos.
Pacientes com diagnóstico estabelecido de diabetes mellitus que iniciaram antipsicóticos atípicos devem ser monitorados regularmente quanto à piora do controle glicêmico. Pacientes com fatores de risco para diabetes mellitus (p. Qualquer paciente tratado com antipsicóticos atípicos deve ser monitorado quanto a sintomas de hiperglicemia, incluindo polidipsia, poliúria, polifagia e fraqueza. Os pacientes que desenvolvem sintomas de hiperglicemia durante o tratamento com antipsicóticos atípicos devem ser submetidos ao teste de glicemia em jejum. Em alguns casos, a hiperglicemia foi resolvida quando o antipsicótico atípico foi descontinuado; no entanto, alguns pacientes necessitaram de continuação do tratamento antidiabético apesar da descontinuação do medicamento suspeito.
Dados agrupados de estudos controlados por placebo de curto prazo em esquizofrenia e transtorno bipolar são apresentados nas Tabelas 1-4. Observe que para os estudos de dose flexível tanto na esquizofrenia quanto no transtorno bipolar, cada sujeito é categorizado como tendo recebido dose baixa (20-40 mg BID) ou alta (60-80 mg BID) com base na dose diária modal do sujeito. Nas tabelas que mostram as mudanças categóricas, as porcentagens (coluna %) são calculadas como 100x(n/N).

Em estudos de dose flexível de longo prazo (pelo menos 1 ano), controlados por placebo, em esquizofrenia, a alteração média da linha de base na glicose aleatória para ziprasidona 20-40 mg BID foi de -3,4 mg/dL (N = 122); para ziprasidona 60-80 mg BID foi +1,3 mg/dL (N=10); e para placebo foi de +0,3 mg/dL (N=71).
Dislipidemia
Alterações indesejáveis nos lipídios foram observadas em pacientes tratados com antipsicóticos atípicos. Dados agrupados de estudos controlados por placebo de curto prazo em esquizofrenia e transtorno bipolar são apresentados nas Tabelas 5-8.
Em estudos de dose flexível de longo prazo (pelo menos 1 ano), controlados por placebo, em esquizofrenia, a alteração média da linha de base nos triglicerídeos aleatórios para ziprasidona 20-40 mg BID foi de +26,3 mg/dL (N = 15); para ziprasidona 60-80 mg BID foi -39,3 mg/dL (N=10); e para placebo foi de +12,9 mg/dL (N=9). Em estudos de dose flexível de longo prazo (pelo menos 1 ano), controlados por placebo, em esquizofrenia, a alteração média da linha de base no colesterol total aleatório para ziprasidona 20-40 mg BID foi +2,5 mg/dL (N = 14); para ziprasidona 60-80 mg BID foi -19,7 mg/dL (N=10); e para placebo foi de -28,0 mg/dL (N=9).
Ganho de peso
O ganho de peso foi observado com o uso de antipsicótico atípico. Recomenda-se o monitoramento do peso. Dados agrupados de estudos controlados por placebo de curto prazo em esquizofrenia e transtorno bipolar são apresentados nas Tabelas 9-10.
Em estudos de dose flexível de longo prazo (pelo menos 1 ano), controlados por placebo, em esquizofrenia, a alteração média do peso basal para ziprasidona 20-40 mg BID foi de -2,3 kg (N = 124); para ziprasidona 60-80 mg BID foi +2,5 kg (N=10); e para placebo foi de -2,9 kg (N=72). Nos mesmos estudos de longo prazo, a proporção de indivíduos com aumento de peso ≥ 7% em relação à linha de base para ziprasidona 20-40 mg BID foi de 5,6% (N=124); para ziprasidona 60-80 mg BID foi de 20,0% (N=10), e para placebo foi de 5,6% (N=72). Em um estudo de dose fixa de longo prazo (pelo menos 1 ano), controlado por placebo, em esquizofrenia, a alteração média do peso basal para ziprasidona 20 mg BID foi de -2,6 kg (N = 72); para ziprasidona 40 mg BID foi de -3,3 kg (N=69); para ziprasidona 80 mg BID foi de -2,8 kg (N=70) e para placebo foi de -3,8 kg (N=70). No mesmo estudo de esquizofrenia de dose fixa de longo prazo, a proporção de indivíduos com aumento de peso ≥ 7% em relação à linha de base para ziprasidona 20 mg BID foi de 5,6% (N=72); para ziprasidona 40 mg BID foi de 2,9% (N=69); para ziprasidona 80 mg BID foi de 5,7% (N=70) e para placebo foi de 2,9% (N=70).
Esquizofrenia
As proporções de pacientes que atendem a um critério de ganho de peso ≥ 7% do peso corporal foram comparadas em um conjunto de quatro ensaios clínicos de esquizofrenia controlados por placebo de 4 e 6 semanas, revelando uma incidência estatisticamente significativamente maior de ganho de peso para ziprasidona (10% ) em comparação com placebo (4%). Um ganho de peso médio de 0,5 kg foi observado em pacientes com ziprasidona em comparação com nenhuma alteração de peso mediana em pacientes com placebo. Neste conjunto de ensaios clínicos, o ganho de peso foi relatado como reação adversa em 0,4% e 0,4% dos pacientes com ziprasidona e placebo, respectivamente. Durante a terapia de longo prazo com ziprasidona, uma categorização de pacientes no início do estudo com base no índice de massa corporal (IMC) revelou o maior ganho de peso médio e maior incidência de ganho de peso clinicamente significativo (> 7% do peso corporal) em pacientes com baixo IMC (27). Houve um ganho de peso médio de 1,4 kg para os pacientes com IMC basal “baixo”, nenhuma alteração média para pacientes com IMC “normal” e uma perda de peso média de 1,3 kg para os pacientes que entraram no programa com um IMC “alto”. IMC.
Transtorno bipolar
Durante um estudo de manutenção bipolar controlado por placebo de 6 meses em adultos com ziprasidona como adjuvante de lítio ou valproato, a incidência de ganho de peso clinicamente significativo (≥ 7% do peso corporal) durante o período duplo-cego foi de 5,6% para ambos os ziprasidona e grupos de tratamento com placebo que completaram os 6 meses de observação para recaída. A interpretação desses achados deve levar em consideração que apenas os pacientes que toleraram adequadamente a ziprasidona entraram na fase duplo-cega do estudo, e houve desistências substanciais durante a fase aberta.
Irritação na pele
Em estudos de pré-comercialização com ziprasidona, cerca de 5% dos pacientes desenvolveram erupção cutânea e/ou urticária, com descontinuação do tratamento em cerca de um sexto desses casos. A ocorrência de erupção cutânea foi relacionada à dose de ziprasidona, embora o achado também possa ser explicado pelo maior tempo de exposição nos pacientes com doses mais altas. Vários pacientes com erupção cutânea apresentaram sinais e sintomas de doença sistêmica associada, por exemplo, leucócitos elevados. A maioria dos pacientes melhorou prontamente com o tratamento adjuvante com anti-histamínicos ou esteróides e/ou após a descontinuação da ziprasidona, e todos os pacientes que apresentaram essas reações relataram se recuperar completamente. Após o aparecimento de erupção cutânea para a qual uma etiologia alternativa não possa ser identificada, a ziprasidona deve ser descontinuada.
Hipotensão ortostática
ziprasidona pode induzir hipotensão ortostática associada a tontura, taquicardia e, em alguns pacientes, síncope, especialmente durante o período inicial de titulação da dose, provavelmente refletindo suas propriedades antagonistas α1-adrenérgicas. Síncope foi relatada em 0,6% dos pacientes tratados com ziprasidona.
A ziprasidona deve ser usada com cuidado especial em pacientes com doença cardiovascular conhecida (história de infarto do miocárdio ou doença cardíaca isquêmica, insuficiência cardíaca ou anormalidades de condução), doença cerebrovascular ou condições que predisponham os pacientes à hipotensão (desidratação, hipovolemia e tratamento com anti-hipertensivos). medicamentos).
Cataratas
Drogas antipsicóticas (que incluem GEODON) podem causar sonolência, hipotensão postural e instabilidade motora e sensorial, o que pode levar a quedas e, consequentemente, fraturas ou outras lesões. Para pacientes com doenças, condições ou medicamentos que possam exacerbar esses efeitos, complete as avaliações de risco de queda ao iniciar o tratamento antipsicótico e recorrentemente para pacientes em terapia antipsicótica de longo prazo.
Leucopenia, neutropenia e agranulocitose
Em ensaios clínicos e experiência pós-comercialização, eventos de leucopenia/neutropenia foram relatados temporariamente relacionados a agentes antipsicóticos. Agranulocitose (incluindo casos fatais) também foi relatada.
Possíveis fatores de risco para leucopenia/neutropenia incluem baixa contagem de glóbulos brancos (WBC) pré-existente e história de leucopenia/neutropenia induzida por drogas. Pacientes com leucograma baixo preexistente ou história de leucopenia/neutropenia induzida por drogas devem ter seu hemograma completo monitorado frequentemente durante os primeiros meses de terapia e devem descontinuar GEODON ao primeiro sinal de declínio no leucograma na ausência de outros fatores causais.
Pacientes com neutropenia devem ser cuidadosamente monitorados quanto a febre ou outros sintomas ou sinais de infecção e tratados imediatamente se tais sintomas ou sinais ocorrerem. Pacientes com neutropenia grave (contagem absoluta de neutrófilos
Convulsões
Durante os ensaios clínicos, ocorreram convulsões em 0,4% dos doentes tratados com ziprasidona. Houve fatores de confusão que podem ter contribuído para a ocorrência de convulsões em muitos desses casos. Assim como com outros medicamentos antipsicóticos, a ziprasidona deve ser usada com cautela em pacientes com histórico de convulsões ou com condições que potencialmente diminuem o limiar convulsivo, por exemplo, demência de Alzheimer. Condições que diminuem o limiar convulsivo podem ser mais prevalentes em uma população de 65 anos ou mais.
Disfagia
A dismotilidade esofágica e a aspiração têm sido associadas ao uso de drogas antipsicóticas. A pneumonia aspirativa é uma causa comum de morbidade e mortalidade em pacientes idosos, em particular naqueles com demência de Alzheimer avançada. A ziprasidona e outros medicamentos antipsicóticos devem ser usados com cautela em pacientes com risco de pneumonia por aspiração [ver AVISO DE CAIXA ].
Hiperprolactinemia
Tal como acontece com outras drogas que antagonizam os receptores D2 da dopamina, a ziprasidona eleva os níveis de prolactina em humanos. Níveis aumentados de prolactina também foram observados em estudos em animais com este composto e foram associados a um aumento na neoplasia da glândula mamária em camundongos; um efeito semelhante não foi observado em ratos [ver Toxicologia não clínica ]. Experimentos em cultura de tecidos indicam que aproximadamente um terço dos cânceres de mama humanos são dependentes de prolactina in vitro, um fator de potencial importância se a prescrição desses medicamentos for contemplada em uma paciente com câncer de mama previamente detectado. Nem os estudos clínicos nem os estudos epidemiológicos realizados até o momento mostraram associação entre a administração crônica dessa classe de medicamentos e a tumorigênese em humanos; a evidência disponível é considerada muito limitada para ser conclusiva neste momento.
Embora distúrbios como galactorreia, amenorreia, ginecomastia e impotência tenham sido relatados com compostos que elevam a prolactina, o significado clínico dos níveis séricos elevados de prolactina é desconhecido para a maioria dos pacientes. A hiperprolactinemia de longa duração quando associada ao hipogonadismo pode levar à diminuição da densidade óssea.
Potencial para comprometimento cognitivo e motor
A sonolência foi uma reação adversa comumente relatada em pacientes tratados com ziprasidona. Nos estudos controlados com placebo de 4 e 6 semanas, foi relatada sonolência em 14% dos pacientes tratados com ziprasidona em comparação com 7% dos pacientes tratados com placebo. A sonolência levou à descontinuação em 0,3% dos pacientes em ensaios clínicos de curto prazo. Como a ziprasidona tem o potencial de prejudicar o julgamento, o pensamento ou as habilidades motoras, os pacientes devem ser advertidos sobre a realização de atividades que exijam alerta mental, como dirigir veículos motorizados (incluindo automóveis) ou operar máquinas perigosas até que tenham certeza razoável de que a terapia com ziprasidona não afetá-los negativamente.
Priapismo
Um caso de priapismo foi relatado no banco de dados de pré-comercialização. Embora a relação da reação ao uso de ziprasidona não tenha sido estabelecida, outros medicamentos com efeitos bloqueadores alfa-adrenérgicos foram relatados como indutores de priapismo, e é possível que a ziprasidona compartilhe essa capacidade. Priapismo grave pode exigir intervenção cirúrgica.
Regulação da temperatura corporal
Embora não relatado com ziprasidona em estudos de pré-comercialização, a interrupção da capacidade do corpo de reduzir a temperatura corporal central foi atribuída a agentes antipsicóticos. Recomenda-se o cuidado apropriado ao prescrever ziprasidona para pacientes que apresentarão condições que possam contribuir para uma elevação da temperatura corporal central, por exemplo, exercícios extenuantes, exposição a calor extremo, receber medicação concomitante com atividade anticolinérgica ou estar sujeito a desidratação.
Suicídio
possibilidade de tentativa de suicídio é inerente à doença psicótica ou transtorno bipolar, e a supervisão cuidadosa de pacientes de alto risco deve acompanhar a terapia medicamentosa. As prescrições de ziprasidona devem ser feitas para a menor quantidade de cápsulas consistente com o bom manejo do paciente, a fim de reduzir o risco de superdosagem.
Pacientes com Doenças Concomitantes
A experiência clínica com ziprasidona em pacientes com certas doenças sistêmicas concomitantes é limitada. Uso em populações específicas ].
A ziprasidona não foi avaliada ou utilizada de forma apreciável em pacientes com história recente de infarto do miocárdio ou doença cardíaca instável. Os pacientes com esses diagnósticos foram excluídos dos estudos clínicos pré-comercialização. Devido ao risco de prolongamento do intervalo QTc e hipotensão ortostática com ziprasidona, deve-se ter cautela em pacientes cardíacos. [Vejo Prolongamento do intervalo QT e risco de morte súbita, hipotensão ortostática ].
Testes laboratoriais
Os pacientes considerados para tratamento com ziprasidona que estão em risco de distúrbios eletrolíticos significativos devem ter medições basais de potássio e magnésio séricos. O potássio e o magnésio séricos baixos devem ser repostos antes de prosseguir com o tratamento. Os doentes que iniciaram o tratamento com diuréticos durante a terapêutica com Ziprasidona necessitam de monitorização periódica do potássio e magnésio séricos. A ziprasidona deve ser descontinuada em pacientes que apresentam medições persistentes do QTc > 500 ms [ver Prolongamento do QT e Risco de Morte Súbita ].
Informações de Aconselhamento do Paciente
Aconselhe o paciente a ler o rótulo do paciente aprovado pela FDA ( INFORMAÇÃO DO PACIENTE ).
Informações de administração para cápsulas
Aconselhe os pacientes a tomar GEODON cápsulas inteiras. Não abra, esmague ou mastigue as cápsulas. Instrua os pacientes a tomar as cápsulas de GEODON com alimentos para uma absorção ideal. A absorção da ziprasidona é aumentada em até duas vezes na presença de alimentos. DOSAGEM E ADMINISTRAÇÃO , INTERAÇÕES MEDICAMENTOSAS , e FARMACOLOGIA CLÍNICA ].
Prolongamento do QTc
Aconselhe os pacientes a informar seus profissionais de saúde sobre o seguinte: História de prolongamento do intervalo QT; infarto agudo do miocárdio recente; insuficiência cardíaca não compensada; prescrição de outros medicamentos que demonstraram prolongamento do intervalo QT; risco de anormalidades eletrolíticas significativas; e história de arritmia cardíaca [ver CONTRA-INDICAÇÕES e AVISOS E PRECAUÇÕES ].
Instruir os pacientes a relatar o início de quaisquer condições que os coloquem em risco de distúrbios eletrolíticos significativos, hipocalemia em particular, incluindo, mas não se limitando ao início da terapia diurética ou diarreia prolongada. Além disso, instrua os pacientes a relatar sintomas como tontura, palpitações ou síncope ao prescritor [ver AVISOS E PRECAUÇÕES ].
Reações Adversas Cutâneas Graves
Instruir os pacientes a relatar ao seu médico, o mais cedo possível, quaisquer sinais ou sintomas que possam estar associados à reação ao medicamento com eosinofilia e sintomas sistêmicos (DRESS) ou a reações adversas cutâneas graves, como síndrome de Stevens-Johnson [ver AVISOS E PRECAUÇÕES ].
Gravidez
Aconselhe as mulheres grávidas a notificarem o seu médico se engravidarem ou pretendem engravidar durante o tratamento com GEODON. Avise os pacientes que GEODON pode causar sintomas extrapiramidais e/ou de abstinência (agitação, hipertonia, hipotonia, tremor, sonolência, dificuldade respiratória e distúrbio alimentar) em um recém-nascido. Avise as pacientes que existe um registro de exposição à gravidez que monitora os resultados da gravidez em mulheres expostas ao GEODON durante a gravidez [ver Uso em populações específicas ].
Lactação
Aconselhe as mulheres que amamentam usando GEODON 20mg para monitorar os bebês quanto a sedação excessiva, irritabilidade, má alimentação e sintomas extrapiramidais (tremores e movimentos musculares anormais) e a procurar atendimento médico se notarem esses sinais [ver Uso em populações específicas ].
Infertilidade
Aconselhe as mulheres com potencial reprodutivo que GEODON 80mg pode prejudicar a fertilidade devido a um aumento nos níveis séricos de prolactina. Os efeitos sobre a fertilidade são reversíveis [ver AVISOS E PRECAUÇÕES e Uso em populações específicas ].
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Carcinogênese
Estudos de carcinogenicidade ao longo da vida foram conduzidos com ziprasidona em ratos Long Evans e camundongos CD-1. A ziprasidona foi administrada por 24 meses na dieta em doses de 2, 6 ou 12 mg/kg/dia para ratos e 50, 100 ou 200 mg/kg/dia para camundongos (0,1 a 0,6 e 1 a 5 vezes a dose humana máxima recomendada (MRHD) de 200 mg/dia com base em mg/m2 de área de superfície corporal, respectivamente). No estudo com ratos, não houve evidência de aumento da incidência de tumores em comparação com os controles. Em camundongos machos, não houve aumento na incidência de tumores em relação aos controles. Em camundongos fêmeas, houve aumentos relacionados à dose na incidência de adenoma e carcinoma da glândula pituitária e adenocarcinoma da glândula mamária em todas as doses testadas (50 a 200 mg/kg/dia ou 1 a 5 vezes o MRHD com base em mg/m2 de corpo superfície). Alterações proliferativas nas glândulas pituitária e mamária de roedores foram observadas após a administração crônica de outros agentes antipsicóticos e são consideradas mediadas pela prolactina. Aumentos na prolactina sérica foram observados em um estudo dietético de 1 mês em camundongos fêmeas, mas não machos, em 100 e 200 mg/kg/dia (ou 2,5 e 5 vezes o MRHD com base em mg/m2 de área de superfície corporal). A ziprasidona não teve efeito sobre a prolactina sérica em ratos em um estudo dietético de 5 semanas nas doses que foram usadas no estudo de carcinogenicidade. A relevância para o risco humano dos achados de tumores endócrinos mediados por prolactina em roedores é desconhecida [ver AVISOS E PRECAUÇÕES ].
Mutagênese
ziprasidona foi testada no ensaio de mutação bacteriana de Ames, no ensaio in vitro de mutação genética de células de mamíferos em linfoma de camundongo, no ensaio in vitro de aberrações cromossômicas em linfócitos humanos e no ensaio in vivo de aberrações cromossômicas em medula óssea de camundongos. Houve uma resposta mutagênica reprodutível no ensaio de Ames em uma cepa de S. typhimurium na ausência de ativação metabólica. Foram obtidos resultados positivos tanto no ensaio in vitro de mutação genética em células de mamífero como no ensaio in vitro de aberrações cromossómicas em linfócitos humanos.
Prejuízo da Fertilidade
ziprasidona demonstrou aumentar o tempo de cópula em ratos Sprague-Dawley em dois estudos de fertilidade e desenvolvimento embrionário inicial com doses de 10 a 160 mg/kg/dia (0,5 a 8 vezes a MRHD de 200 mg/dia com base em mg/m2 corporal superfície). A taxa de fertilidade foi reduzida em 160 mg/kg/dia (8 vezes a MRHD com base em mg/m2 de área de superfície corporal). Não houve efeito na fertilidade com 40 mg/kg/dia (2 vezes a MRHD com base em mg/m2 de área de superfície corporal). O efeito sobre a fertilidade parece ser na fêmea, uma vez que a fertilidade não foi prejudicada quando machos que receberam 160 mg/kg/dia (8 vezes a MRHD com base em mg/m2 de área de superfície corporal) foram acasalados com fêmeas não tratadas.
Uso em populações específicas
Gravidez
Registro de Exposição à Gravidez
Existe um registro de exposição à gravidez que monitora os resultados da gravidez em mulheres expostas a antipsicóticos atípicos, incluindo GEODON 40mg, durante a gravidez. Os profissionais de saúde são incentivados a registrar pacientes entrando em contato com o Registro Nacional de Gravidez para Antipsicóticos Atípicos em 1-866-961-2388 ou on-line em http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/.
Resumo do risco
Recém-nascidos expostos a drogas antipsicóticas, incluindo GEODON, durante o terceiro trimestre estão em risco de sintomas extrapiramidais e/ou de abstinência após o parto (ver Considerações Clínicas ). Os dados gerais disponíveis de estudos epidemiológicos publicados de mulheres grávidas expostas à ziprasidona não estabeleceram um risco associado ao medicamento de defeitos congênitos graves, aborto espontâneo ou resultados maternos ou fetais adversos (ver Dados ). Existem riscos para a mãe associados à esquizofrenia não tratada ou transtorno bipolar I e à exposição a antipsicóticos, incluindo GEODON, durante a gravidez (ver Considerações Clínicas ).
Em estudos com animais, a administração de ziprasidona em ratas e coelhas grávidas durante a organogênese causou toxicidade no desenvolvimento em doses semelhantes às doses humanas recomendadas e foi teratogênica em coelhos em 3 vezes a dose humana máxima recomendada (MRHD). Ratos expostos à ziprasidona durante a gestação e lactação exibiram aumento da mortalidade perinatal dos filhotes e atraso no desenvolvimento neurocomportamental e funcional da prole em doses menores ou semelhantes às doses terapêuticas humanas (ver Dados ).
O risco de fundo estimado de grandes defeitos congênitos e aborto para as populações indicadas é desconhecido. Todas as gestações têm um risco histórico de defeitos congênitos, perda ou outros resultados adversos. Na população geral dos EUA, o risco de fundo estimado de defeitos congênitos graves e aborto espontâneo em gestações clinicamente reconhecidas é de 2 a 4% e 15 a 20%, respectivamente.
Considerações Clínicas
Risco materno e/ou embrio/fetal associado à doença
Há risco para a mãe de esquizofrenia não tratada ou transtorno bipolar I, incluindo aumento do risco de recaída, hospitalização e suicídio. A esquizofrenia e o transtorno bipolar I estão associados ao aumento de resultados perinatais adversos, incluindo parto prematuro. Não se sabe se isso é resultado direto da doença ou de outros fatores comórbidos.
Reações adversas fetais/neonatais
Sintomas extrapiramidais e/ou de abstinência, incluindo agitação, hipertonia, hipotonia, tremor, sonolência, dificuldade respiratória e distúrbios alimentares foram relatados em recém-nascidos que foram expostos a medicamentos antipsicóticos, incluindo GEODON, durante o terceiro trimestre de gravidez. Esses sintomas têm variado em gravidade. Monitore os neonatos quanto a sintomas extrapiramidais e/ou de abstinência e gerencie os sintomas adequadamente. Alguns neonatos se recuperaram em horas ou dias sem tratamento específico; outros necessitaram de hospitalização prolongada.
Dados
Dados humanos
Dados publicados de estudos observacionais, registros de nascimento e relatos de casos sobre o uso de antipsicóticos atípicos durante a gravidez não relatam uma associação clara com antipsicóticos e defeitos congênitos maiores. Um estudo de coorte retrospectivo de um banco de dados Medicaid de 9.258 mulheres expostas a antipsicóticos durante a gravidez não indicou um aumento geral do risco de defeitos congênitos graves.
Dados de animais
Quando a ziprasidona foi administrada a coelhas grávidas durante o período de organogênese, observou-se um aumento na incidência de anormalidades estruturais fetais (defeitos do septo ventricular e outras malformações cardiovasculares e alterações renais) na dose de 30 mg/kg/dia (3 vezes a MRHD de 200 mg/dia com base em mg/m2 de área de superfície corporal). Não houve evidência que sugerisse que esses efeitos no desenvolvimento fossem secundários à toxicidade materna. A dose de desenvolvimento sem efeito foi de 10 mg/kg/dia (equivalente à MRHD com base em mg/m2 de área de superfície corporal). Em ratos, a toxicidade embriofetal (diminuição do peso fetal, ossificação esquelética retardada) foi observada após a administração de 10 a 160 mg/kg/dia (0,5 a 8 vezes a MRHD com base em mg/m2 de área de superfície corporal) durante a organogênese ou durante a gestação, mas não houve evidência de teratogenicidade. Doses de 40 e 160 mg/kg/dia (2 e 8 vezes a MRHD com base em mg/m2 de área de superfície corporal) foram associadas à toxicidade materna. A dose de desenvolvimento sem efeito é de 5 mg/kg/dia (0,2 vezes a MRHD com base em mg/m2 de área de superfície corporal).
Houve um aumento no número de filhotes nascidos mortos e uma diminuição na sobrevida pós-natal nos primeiros 4 dias de lactação entre a prole de ratas tratadas durante a gestação e lactação com doses de 10 mg/kg/dia (0,5 vezes o MRHD baseado em mg/m2 de área de superfície corporal) ou superior. Atrasos no desenvolvimento da prole (diminuição do peso dos filhotes) e comprometimento funcional neurocomportamental (endireitamento do ar de abertura dos olhos) foram observados em doses de 5 mg/kg/dia (0,2 vezes o MRHD com base em mg/m2 de área de superfície corporal) ou maiores. Um nível sem efeito não foi estabelecido para esses efeitos.
Lactação
Resumo do risco
Dados limitados de um relato de caso publicado indicam a presença de ziprasidona no leite humano. Embora não haja relatos de efeitos adversos em lactentes expostos à ziprasidona via leite materno, há relatos de sedação excessiva, irritabilidade, má alimentação e sintomas extrapiramidais (tremores e movimentos musculares anormais) em lactentes expostos a outros antipsicóticos atípicos através da mama. leite (ver Considerações Clínicas ). Não há informações sobre os efeitos da ziprasidona na produção de leite. Os benefícios da amamentação para o desenvolvimento e para a saúde devem ser considerados juntamente com a necessidade clínica da mãe de GEODON e quaisquer potenciais efeitos adversos na criança amamentada de GEODON 20mg ou da condição subjacente da mãe.
Considerações Clínicas
Os bebês expostos ao GEODON devem ser monitorados quanto à sedação excessiva, irritabilidade, alimentação inadequada e sintomas extrapiramidais (tremores e movimentos musculares anormais).
Fêmeas e Machos com Potencial Reprodutivo
Infertilidade
Mulheres
Com base na ação farmacológica da ziprasidona (antagonismo D2), o tratamento com GEODON 40mg pode resultar em aumento dos níveis séricos de prolactina, o que pode levar a uma redução reversível da fertilidade em mulheres com potencial reprodutivo [ver AVISOS E PRECAUÇÕES e Toxicologia não clínica ].
Uso Pediátrico
A segurança e eficácia da ziprasidona em pacientes pediátricos não foram estabelecidas.
Uso Geriátrico
Do número total de indivíduos em estudos clínicos de ziprasidona, 2,4 por cento tinham 65 anos ou mais. Não foram observadas diferenças gerais na segurança ou eficácia entre esses indivíduos e indivíduos mais jovens, e outras experiências clínicas relatadas não identificaram diferenças nas respostas entre os pacientes idosos e os pacientes mais jovens, mas a maior sensibilidade de alguns indivíduos mais velhos não pode ser descartada. No entanto, a presença de múltiplos fatores que podem aumentar a resposta farmacodinâmica à ziprasidona, ou causar menor tolerância ou ortostase, deve levar à consideração de uma dose inicial mais baixa, titulação mais lenta e monitoramento cuidadoso durante o período inicial de dosagem para alguns pacientes idosos.
A ziprasidona intramuscular não foi sistematicamente avaliada em pacientes idosos (65 anos ou mais).
Insuficiência renal
Como a ziprasidona é altamente metabolizada, com menos de 1% do fármaco excretado inalterado, é improvável que a insuficiência renal isolada tenha um grande impacto na farmacocinética da ziprasidona. A farmacocinética da ziprasidona após 8 dias de administração de 20 mg duas vezes ao dia foi semelhante entre indivíduos com vários graus de insuficiência renal (n = 27) e indivíduos com função renal normal, indicando que não é necessário ajuste de dose com base no grau de insuficiência renal . A ziprasidona não é removida por hemodiálise.
A ziprasidona intramuscular não foi sistematicamente avaliada em pacientes idosos ou em pacientes com insuficiência hepática ou renal. Como o excipiente de ciclodextrina é depurado por filtração renal, a ziprasidona intramuscular deve ser administrada com cautela a pacientes com função renal comprometida. FARMACOLOGIA CLÍNICA ].
Insuficiência hepática
Uma vez que a ziprasidona é substancialmente eliminada pelo fígado, seria de esperar que a presença de insuficiência hepática aumentasse a AUC da ziprasidona; um estudo de dose múltipla de 20 mg duas vezes ao dia por 5 dias em indivíduos (n = 13) com cirrose clinicamente significativa (Childs-Pugh Classe A e B) revelou um aumento na AUC 0-12 de 13% e 34% em Childs- Classe A e B de Pugh, respectivamente, em comparação com um grupo controle pareado (n=14). Uma meia-vida de 7,1 horas foi observada em indivíduos com cirrose em comparação com 4,8 horas no grupo controle.
Efeitos de idade e gênero
Em um estudo de dose múltipla (8 dias de tratamento) envolvendo 32 indivíduos, não houve diferença na farmacocinética da ziprasidona entre homens e mulheres ou entre indivíduos idosos (>65 anos) e jovens (18 a 45 anos). Além disso, a avaliação farmacocinética populacional de pacientes em estudos controlados não revelou evidências de diferenças clinicamente significativas relacionadas à idade ou sexo na farmacocinética da ziprasidona. Modificações de dosagem para idade ou sexo não são, portanto, recomendadas.
Fumar
Com base em estudos in vitro utilizando enzimas hepáticas humanas, a ziprasidona não é um substrato para CYP1A2; fumar não deve, portanto, afetar a farmacocinética da ziprasidona. Consistente com esses resultados in vitro, a avaliação farmacocinética populacional não revelou diferenças farmacocinéticas significativas entre fumantes e não fumantes.
SOBREDOSAGEM
Experiência Humana
Em estudos de pré-comercialização envolvendo mais de 5.400 pacientes e/ou indivíduos normais, a superdosagem acidental ou intencional de ziprasidona oral foi documentada em 10 pacientes. Todos esses pacientes sobreviveram sem sequelas. No paciente que tomou a maior quantidade confirmada, 3.240 mg, os únicos sintomas relatados foram sedação mínima, fala arrastada e hipertensão transitória (200/95).
As reações adversas relatadas com superdosagem de ziprasidona incluíram sintomas extrapiramidais, sonolência, tremor e ansiedade. [Vejo REAÇÕES ADVERSAS ]
Gerenciamento de superdosagem
Em caso de superdosagem aguda, estabeleça e mantenha uma via aérea e assegure oxigenação e ventilação adequadas. O acesso intravenoso deve ser estabelecido e a lavagem gástrica (após a intubação, se o paciente estiver inconsciente) e a administração de carvão ativado juntamente com um laxante devem ser consideradas. A possibilidade de obnubilação, convulsão ou reação distônica da cabeça e pescoço após superdosagem pode criar risco de aspiração com vômito induzido.
monitoramento cardiovascular deve começar imediatamente e deve incluir monitoramento eletrocardiográfico contínuo para detectar possíveis arritmias. Se a terapia antiarrítmica for administrada, disopiramida, procainamida e quinidina acarretam um risco teórico de efeitos aditivos de prolongamento do intervalo QT que podem ser aditivos aos da ziprasidona.
Hipotensão e colapso circulatório devem ser tratados com medidas apropriadas, como fluidos intravenosos. Se agentes simpaticomiméticos forem usados para suporte vascular, epinefrina e dopamina não devem ser usadas, pois a estimulação beta combinada com antagonismo α1 associado à ziprasidona pode piorar a hipotensão. Da mesma forma, é razoável esperar que as propriedades bloqueadoras alfa-adrenérgicas do bretílio possam ser aditivas às da ziprasidona, resultando em hipotensão problemática.
Em casos de sintomas extrapiramidais graves, deve-se administrar medicação anticolinérgica. Não há antídoto específico para a ziprasidona e não é dialisável. A possibilidade de envolvimento de múltiplas drogas deve ser considerada. A supervisão médica e o monitoramento devem continuar até que o paciente se recupere.
CONTRA-INDICAÇÕES
Prolongamento QT
Devido ao prolongamento do intervalo QT relacionado à dose da ziprasidona e à conhecida associação de arritmias fatais com prolongamento do intervalo QT por alguns outros medicamentos, a ziprasidona é contraindicada:
- em pacientes com história conhecida de prolongamento do intervalo QT (incluindo síndrome congênita do QT longo)
- em pacientes com infarto agudo do miocárdio recente
- em pacientes com insuficiência cardíaca descompensada
Não foram realizados estudos farmacocinéticos/farmacodinâmicos entre a ziprasidona e outros medicamentos que prolongam o intervalo QT. Um efeito aditivo da ziprasidona e outros medicamentos que prolongam o intervalo QT não pode ser excluído. Portanto, a ziprasidona não deve ser administrada com:
- dofetilida, sotalol, quinidina, outros antiarrítmicos Classe Ia e III, mesoridazina, tioridazina, clorpromazina, droperidol, pimozida, esparfloxacina, gatifloxacina, moxifloxacina, halofantrina, mefloquina, pentamidina, trióxido de arsênio, acetato de levometadil, mesilato de dolasetron, probucol ou tacrolimus.
- outros medicamentos que demonstraram prolongamento do intervalo QT como um de seus efeitos farmacodinâmicos e têm esse efeito descrito na bula completa como contraindicação ou advertência em caixa ou em negrito [ver AVISOS E PRECAUÇÕES ].
Hipersensibilidade
A ziprasidona é contraindicada em indivíduos com hipersensibilidade conhecida ao produto.
FARMACOLOGIA CLÍNICA
Mecanismo de ação
O mecanismo de ação da ziprasidona no tratamento das indicações listadas pode ser mediado por uma combinação de antagonismo da dopamina tipo 2 (D2) e serotonina tipo 2 (5HT2).
Farmacodinâmica
ziprasidona liga-se com afinidade relativamente alta aos receptores de dopamina D2 e D3, serotonina 5HT2A, 5HT2C, 5HT1A, 5HT1D e α1-adrenérgicos (Ki s de 4,8, 7,2, 0,4, 1,3, 3,4, 2 e 10 nM, respectivamente), e com afinidade moderada para o receptor de histamina H1 (Ki=47 nM). A ziprasidona é um antagonista dos receptores D2, 5HT2A e 5HT1D e um agonista do receptor 5HT1A. A ziprasidona inibiu a recaptação sináptica de serotonina e norepinefrina. Nenhuma afinidade apreciável foi exibida para outros receptores/sítios de ligação testados, incluindo o receptor muscarínico colinérgico (IC50 > 1 μM).
Farmacocinética
Farmacocinética Oral
atividade da ziprasidona deve-se principalmente ao fármaco original. A farmacocinética de doses múltiplas da ziprasidona é proporcional à dose dentro da faixa de dose clínica proposta, e o acúmulo de ziprasidona é previsível com doses múltiplas. A eliminação da ziprasidona ocorre principalmente por metabolismo hepático com meia-vida terminal média de cerca de 7 horas dentro da faixa de dose clínica proposta. As concentrações de estado estacionário são alcançadas dentro de um a três dias após a administração. A depuração sistêmica aparente média é de 7,5 mL/min/kg. É improvável que a ziprasidona interfira no metabolismo de medicamentos metabolizados pelas enzimas do citocromo P450.
Absorção
A ziprasidona é bem absorvida após administração oral, atingindo concentrações plasmáticas máximas em 6 a 8 horas. A biodisponibilidade absoluta de uma dose de 20 mg em condições de alimentação é de aproximadamente 60%. A absorção da ziprasidona aumenta até duas vezes na presença de alimentos.
Distribuição
ziprasidona tem um volume médio aparente de distribuição de 1,5 L/kg. Liga-se mais de 99% às proteínas plasmáticas, ligando-se principalmente à albumina e à glicoproteína α1-ácida. A ligação da ziprasidona às proteínas plasmáticas in vitro não foi alterada pela varfarina ou propranolol, duas drogas altamente ligadas às proteínas, nem a ziprasidona alterou a ligação dessas drogas no plasma humano. Assim, o potencial de interações medicamentosas com ziprasidona devido ao deslocamento é mínimo.
Metabolismo e eliminação
ziprasidona é extensivamente metabolizada após administração oral com apenas uma pequena quantidade excretada na urina (
Farmacocinética Intramuscular
Biodisponibilidade Sistêmica
A biodisponibilidade da ziprasidona administrada por via intramuscular é de 100%. Após a administração intramuscular de doses únicas, as concentrações séricas máximas ocorrem tipicamente aproximadamente 60 minutos após a dose ou antes e a meia-vida média (T½) varia de duas a cinco horas. A exposição aumenta de forma dose-dependente e após três dias de administração intramuscular, observa-se pouca acumulação.
Metabolismo e eliminação
Embora o metabolismo e a eliminação da ziprasidona IM não tenham sido sistematicamente avaliados, não se espera que a via de administração intramuscular altere as vias metabólicas.
Estudos clínicos
Esquizofrenia
eficácia da ziprasidona oral no tratamento da esquizofrenia foi avaliada em 5 estudos controlados por placebo, 4 estudos de curto prazo (4 e 6 semanas) e um estudo de manutenção. Todos os estudos foram em pacientes adultos internados, a maioria dos quais preenchia os critérios do DSM III-R para esquizofrenia. Cada estudo incluiu 2 a 3 doses fixas de ziprasidona, bem como placebo. Quatro dos 5 ensaios foram capazes de distinguir a ziprasidona do placebo; um estudo de curto prazo não. Embora um único braço de dose fixa de haloperidol tenha sido incluído como tratamento comparativo em um dos três estudos de curto prazo, este único estudo foi inadequado para fornecer uma comparação confiável e válida de ziprasidona e haloperidol.
Vários instrumentos foram utilizados para avaliar sinais e sintomas psiquiátricos nesses estudos. A Escala de Avaliação Psiquiátrica Breve (BPRS) e a Escala de Síndrome Positiva e Negativa (PANSS) são ambos inventários de vários itens de psicopatologia geral geralmente usados para avaliar os efeitos do tratamento medicamentoso na esquizofrenia. O cluster de psicose BPRS (desorganização conceitual, comportamento alucinatório, suspeita e conteúdo de pensamento incomum) é considerado um subconjunto particularmente útil para avaliar pacientes esquizofrênicos ativamente psicóticos. Uma segunda avaliação amplamente utilizada, a Impressão Clínica Global (CGI), reflete a impressão de um observador habilidoso, totalmente familiarizado com as manifestações da esquizofrenia, sobre o estado clínico geral do paciente. Além disso, a Escala para Avaliação de Sintomas Negativos (SANS) foi empregada para avaliar sintomas negativos em um estudo.
Seguem os resultados dos ensaios orais com ziprasidona na esquizofrenia
- Em um estudo controlado por placebo de 4 semanas (n = 139) comparando 2 doses fixas de ziprasidona (20 e 60 mg duas vezes ao dia) com placebo, apenas a dose de 60 mg foi superior ao placebo no escore total de BPRS e na gravidade do CGI pontuação. Este grupo de dose mais alta não foi superior ao placebo no grupo de psicose BPRS ou no SANS.
- Em um estudo controlado por placebo de 6 semanas (n=302) comparando 2 doses fixas de ziprasidona (40 e 80 mg duas vezes ao dia) com placebo, ambos os grupos de dose foram superiores ao placebo na pontuação total de BPRS, no agrupamento de psicose de BPRS, o escore de gravidade CGI e os escores totais e negativos da subescala da PANSS. Embora 80 mg duas vezes ao dia tenham um efeito numericamente maior do que 40 mg duas vezes ao dia, a diferença não foi estatisticamente significativa.
- Em um estudo controlado por placebo de 6 semanas (n=419) comparando 3 doses fixas de ziprasidona (20, 60 e 100 mg duas vezes ao dia) com placebo, todos os três grupos de dose foram superiores ao placebo na pontuação total da PANSS, o Escore total BPRS, o cluster de psicose BPRS e o escore de gravidade CGI. Apenas o grupo de dose de 100 mg duas vezes ao dia foi superior ao placebo na pontuação da subescala negativa da PANSS. Não houve evidência clara de uma relação dose-resposta dentro do intervalo de dose de 20 mg duas vezes ao dia a 100 mg duas vezes ao dia.
- Em um estudo controlado por placebo de 4 semanas (n=200) comparando 3 doses fixas de ziprasidona (5, 20 e 40 mg duas vezes ao dia), nenhum dos grupos de dose foi estatisticamente superior ao placebo em qualquer resultado de interesse.
- Um estudo foi realizado em pacientes esquizofrênicos estáveis crônicos ou subcrônicos (CGI-S ≤5 na linha de base) internados (n = 294) que haviam sido hospitalizados por pelo menos dois meses. Após um período de 3 dias de placebo cego, os indivíduos foram randomizados para uma das 3 doses fixas de ziprasidona (20 mg, 40 mg ou 80 mg duas vezes ao dia) ou placebo e observados quanto à recidiva. Os pacientes foram observados para “recaída psicótica iminente”, definida como pontuação de melhora do CGI ≤6 (muito pior ou muito pior) e/ou pontuações ≤6 (moderadamente grave) nos itens de hostilidade ou não cooperação da PANSS em dois dias consecutivos . A ziprasidona foi significativamente superior ao placebo no tempo de recidiva, sem diferença significativa entre os diferentes grupos de dose. Não havia dados suficientes para examinar subconjuntos populacionais com base em idade e raça. O exame de subconjuntos populacionais com base no gênero não revelou qualquer responsividade diferencial.
Transtorno Bipolar I (episódios agudos mistos ou maníacos e tratamento de manutenção como adjuvante ao lítio ou valproato)
Episódios Maníacos Agudos e Mistos Associados ao Transtorno Bipolar I
eficácia da ziprasidona foi estabelecida em 2 estudos de monoterapia duplo-cegos, controlados por placebo, de 3 semanas em pacientes que preenchiam os critérios do DSM-IV para transtorno bipolar I, episódio maníaco ou misto com ou sem características psicóticas. Os instrumentos de classificação primários usados para avaliar os sintomas maníacos nesses estudos foram: (1) a Mania Rating Scale (MRS), que é derivada do Schedule for Affective Disorders and Schizophrenia-Change Version (SADS-CB) com itens agrupados como Síndrome Maníaca subescala (humor elevado, menor necessidade de sono, excesso de energia, atividade excessiva, grandiosidade), subescala Comportamento e Ideação (irritabilidade, hiperatividade motora, fala acelerada, pensamentos acelerados, mau julgamento) e insight prejudicado; e (2) a Escala Clínica Global de Impressão-Gravidade da Doença (CGI-S), que foi usada para avaliar a significância clínica da resposta ao tratamento.
Seguem os resultados dos estudos com ziprasidona oral no transtorno bipolar I adulto, episódio maníaco/misto: em um estudo controlado por placebo de 3 semanas (n=210), a dose de ziprasidona foi de 40 mg duas vezes ao dia no Dia 1 e 80 mg duas vezes diariamente no Dia 2. A titulação dentro do intervalo de 40-80 mg duas vezes ao dia (em incrementos de 20 mg duas vezes ao dia) foi permitida durante a duração do estudo. A ziprasidona foi significativamente mais eficaz do que o placebo na redução do escore total MRS e do escore CGI-S. A dose média diária de ziprasidona neste estudo foi de 132 mg. Em um segundo estudo controlado por placebo de 3 semanas (n=205), a dose de ziprasidona foi de 40 mg duas vezes ao dia no Dia 1. A titulação dentro do intervalo de 40-80 mg duas vezes ao dia (em incrementos de 20 mg duas vezes ao dia) foi permitida para a duração do estudo (começando no Dia 2). A ziprasidona foi significativamente mais eficaz do que o placebo na redução do escore total MRS e do escore CGI-S. A dose média diária de ziprasidona neste estudo foi de 112 mg.
Terapia de manutenção
eficácia da ziprasidona como terapia adjuvante ao lítio ou valproato no tratamento de manutenção do transtorno bipolar I foi estabelecida em um estudo controlado por placebo em pacientes que preencheram os critérios do DSM-IV para transtorno bipolar I. O estudo incluiu pacientes cujo episódio mais recente foi maníaco ou misto, com ou sem características psicóticas. Na fase aberta, os pacientes precisaram ser estabilizados com ziprasidona mais lítio ou ácido valpróico por pelo menos 8 semanas para serem randomizados. Na fase randomizada duplo-cega, os pacientes continuaram o tratamento com lítio ou ácido valpróico e foram randomizados para receber ziprasidona (administrada duas vezes ao dia totalizando 80 mg a 160 mg por dia) ou placebo. Geralmente, na fase de manutenção, os pacientes continuaram com a mesma dose em que foram estabilizados durante a fase de estabilização. O desfecho primário neste estudo foi o tempo até a recorrência de um episódio de humor (episódio maníaco, misto ou depressivo) que exigisse intervenção, que foi definido como qualquer um dos seguintes: interrupção devido a um episódio de humor, intervenção clínica para um episódio de humor (p. início da medicação ou hospitalização), ou pontuação da Mania Rating Scale ≥ 18 ou uma pontuação MADRS ≥ 18 (em 2 avaliações consecutivas com intervalo não superior a 10 dias). Um total de 584 indivíduos foram tratados no período de estabilização aberta. No período de randomização duplo-cego, 127 indivíduos foram tratados com ziprasidona e 112 indivíduos foram tratados com placebo. A ziprasidona foi superior ao placebo no aumento do tempo de recorrência de um episódio de humor. Os tipos de eventos de recaída observados incluíram episódios depressivos, maníacos e mistos. Episódios depressivos, maníacos e mistos representaram 53%, 34% e 13%, respectivamente, do número total de eventos de recaída no estudo.
Tratamento agudo da agitação na esquizofrenia
eficácia da ziprasidona intramuscular no tratamento de pacientes esquizofrênicos agitados foi estabelecida em dois estudos duplo-cegos de curta duração em indivíduos esquizofrênicos que foram considerados pelos investigadores como “agudamente agitados” e com necessidade de medicação antipsicótica IM. Além disso, os pacientes deveriam ter uma pontuação de 3 ou mais em pelo menos 3 dos seguintes itens da PANSS: ansiedade, tensão, hostilidade e excitação. A eficácia foi avaliada pela análise da área sob a curva (AUC) da Escala de Avaliação de Atividade Comportamental (BARS) e classificação de gravidade de Impressão Clínica Global (CGI). O BARS é uma escala de sete pontos com pontuações que variam de 1 (difícil ou incapaz de despertar) a 7 (violento, requer contenção). Pacientes' as pontuações no BARS no início do estudo foram principalmente 5 (sinais de atividade ostensiva [física ou verbal], acalma-se com instruções) e, conforme determinado pelos investigadores, exibiu um grau de agitação que justificou a terapia intramuscular. Havia poucos pacientes com uma classificação superior a 5 no BARS, pois os pacientes mais gravemente agitados geralmente eram incapazes de fornecer consentimento informado para participação em ensaios clínicos pré-comercialização.
Ambos os estudos compararam doses mais altas de ziprasidona intramuscular com uma dose de controle de 2 mg. Em um estudo, a dose mais alta foi de 20 mg, que pode ser administrada até 4 vezes nas 24 horas do estudo, em intervalos entre as doses não inferiores a 4 horas. No outro estudo, a dose mais alta foi de 10 mg, que pode ser administrada até 4 vezes nas 24 horas do estudo, em intervalos entre as doses não inferiores a 2 horas.
Seguem os resultados dos ensaios intramusculares com ziprasidona
INFORMAÇÃO DO PACIENTE
GEODON® Cápsulas (ziprasidona)
Informações para pacientes que tomam GEODON ou seus cuidadores
Este resumo contém informações importantes sobre o GEODON. Não se destina a substituir as instruções do seu médico. Leia estas informações cuidadosamente antes de tomar GEODON. Pergunte ao seu médico ou farmacêutico se você não entender alguma dessas informações ou se quiser saber mais sobre GEODON.
O que é Geodon 80mg?
GEODON é um tipo de medicamento de prescrição chamado psicotrópico, também conhecido como antipsicótico atípico. GEODON pode ser usado para tratar sintomas de esquizofrenia e episódios agudos de mania ou mistos associados ao transtorno bipolar. GEODON 80mg também pode ser usado como tratamento de manutenção do transtorno bipolar quando adicionado ao lítio ou valproato.
Quem deve tomar GEODON 20mg?
Somente seu médico pode saber se GEODON é adequado para você. GEODON 20mg pode ser prescrito para você se tiver esquizofrenia ou transtorno bipolar.
Os sintomas da esquizofrenia podem incluir:
- ouvir vozes, ver coisas ou sentir coisas que não estão lá (alucinações)
- crenças que não são verdadeiras (delírios)
- suspeita incomum (paranóia)
- tornando-se afastado da família e amigos
Os sintomas de episódios maníacos ou mistos de transtorno bipolar podem incluir:
- humor extremamente alto ou irritável
- aumento da energia, atividade e inquietação
- pensamentos acelerados ou falando muito rápido
- Facilmente distraído
- pouca necessidade de sono
Se apresentar uma resposta ao GEODON 40mg, os seus sintomas podem melhorar. Se você continuar a tomar GEODON 40mg, há menos chance de seus sintomas retornarem. Não pare de tomar as cápsulas mesmo quando se sentir melhor sem primeiro falar com o seu médico.
Também é importante lembrar que as cápsulas de GEODON 40mg devem ser tomadas com alimentos.
Qual é a informação de segurança mais importante que devo saber sobre GEODON 20mg?
GEODON não está aprovado para o tratamento de pacientes com psicose relacionada à demência. Pacientes idosos com diagnóstico de psicose relacionada à demência tratados com antipsicóticos apresentam risco aumentado de morte quando comparados a pacientes tratados com placebo (uma pílula de açúcar).
GEODON é um medicamento eficaz para tratar os sintomas da esquizofrenia e os episódios maníacos ou mistos do transtorno bipolar. No entanto, um efeito colateral potencial é que pode alterar a maneira como a corrente elétrica em seu coração funciona mais do que alguns outros medicamentos. A alteração é pequena e não se sabe se isso será prejudicial, mas alguns outros medicamentos que causam esse tipo de alteração, em casos raros, causaram anormalidades perigosas no ritmo cardíaco. Devido a isso, GEODON deve ser usado somente após seu médico ter considerado este risco para GEODON contra os riscos e benefícios de outros medicamentos disponíveis para o tratamento de esquizofrenia ou episódios maníacos e mistos bipolares.
Seu risco de alterações perigosas no ritmo cardíaco pode ser aumentado se você estiver tomando certos outros medicamentos e se já tiver certas condições cardíacas anormais. Portanto, é importante informar seu médico sobre quaisquer outros medicamentos que você esteja tomando, incluindo medicamentos sem receita médica, suplementos e medicamentos fitoterápicos. Deve também informar o seu médico sobre quaisquer problemas cardíacos que tenha ou teve.
Quem NÃO deve tomar GEODON 40mg?
Pacientes idosos com diagnóstico de psicose relacionada à demência. GEODON não está aprovado para o tratamento desses pacientes.
Qualquer coisa que possa aumentar a chance de uma anormalidade do ritmo cardíaco deve ser evitada. Portanto, não tome GEODON 80mg se:
- Você tem certas doenças cardíacas, por exemplo, síndrome do QT longo, um ataque cardíaco recente, insuficiência cardíaca grave ou certas irregularidades do ritmo cardíaco (discutir as especificidades com seu médico)
- Você está atualmente tomando medicamentos que não devem ser tomados em combinação com ziprasidona, por exemplo, dofetilida, sotalol, quinidina, outros antiarrítmicos Classe Ia e III, mesoridazina, tioridazina, clorpromazina, droperidol, pimozida, esparfloxacina, gatifloxacina, moxifloxacina, halofantrina , mefloquina, pentamidina, trióxido de arsênio, acetato de levometadil, mesilato de dolasetron, probucol ou tacrolimus.
O que dizer ao seu médico antes de começar GEODON
Somente seu médico pode decidir se GEODON é adequado para você. Antes de iniciar GEODON, certifique-se de informar o seu médico se você:
- teve algum problema com a forma como o seu coração bate ou qualquer doença ou doença relacionada com o coração
- qualquer histórico familiar de doença cardíaca, incluindo ataque cardíaco recente
- teve algum problema com desmaios ou tonturas
- está tomando ou tomou recentemente algum medicamento prescrito
- está tomando medicamentos de venda livre que você pode comprar sem receita médica, incluindo remédios naturais / à base de plantas
- teve algum problema com o seu fígado
- está grávida, pode estar grávida ou planeja engravidar
- está amamentando ou planeja amamentar
- são alérgicos a algum medicamento
- já teve uma reação alérgica à ziprasidona ou a qualquer outro componente de GEODON 20 mg cápsulas. Peça ao seu médico ou farmacêutico uma lista destes ingredientes
- tem níveis baixos de potássio ou magnésio no sangue
Seu médico pode querer que você faça exames laboratoriais adicionais para ver se GEODON 40mg é um tratamento adequado para você.
GEODON e outros medicamentos
Existem alguns medicamentos que podem ser inseguros de usar ao tomar GEODON, e existem alguns medicamentos que podem afetar o funcionamento de GEODON 40mg. Enquanto estiver usando GEODON, verifique com seu médico antes de iniciar qualquer nova prescrição ou medicamentos de venda livre, incluindo remédios naturais/à base de plantas.
Como tomar GEODON
- Tome GEODON apenas conforme indicado pelo seu médico.
- Engula as cápsulas de GEODON inteiras. Não mastigue, esmague ou abra as cápsulas.
- Tome GEODON 40mg cápsulas com alimentos.
- É melhor tomar GEODON 80mg à mesma hora todos os dias.
- GEODON 80mg pode levar algumas semanas para fazer efeito. É importante ser paciente.
- Não altere a dose ou pare de tomar o medicamento sem a aprovação do seu médico.
- Lembre-se de continuar tomando suas cápsulas, mesmo quando se sentir melhor.
Possíveis efeitos colaterais
Como esses problemas podem significar que você está tendo uma anormalidade no ritmo cardíaco, entre em contato com seu médico IMEDIATAMENTE se vocês:
- Desmaiar ou perder a consciência
- Sinta uma mudança na maneira como seu coração bate (palpitações)
Os efeitos colaterais comuns de GEODON incluem o seguinte e também devem ser discutidos com seu médico se ocorrerem:
- Sentindo-se incomumente cansado ou sonolento
- Náusea ou dor de estômago
- Constipação
- Tontura
- Inquietação
- Movimentos musculares anormais, incluindo tremores, arrastamento e movimentos involuntários descontrolados
- Diarréia
- Irritação na pele
- Aumento da tosse/corrimento nasal
Se desenvolver quaisquer efeitos secundários que o preocupem, fale com o seu médico. É particularmente importante informar o seu médico se tiver diarreia, vómitos ou outra doença que possa causar perda de líquidos. O seu médico pode querer verificar o seu sangue para se certificar de que tem a quantidade certa de sais importantes após tais doenças.
Para obter uma lista de todos os efeitos secundários notificados, peça ao seu médico ou farmacêutico o folheto informativo de GEODON Professional.
O que fazer para uma overdose
Em caso de overdose, ligue imediatamente para o seu médico ou centro de controle de envenenamento ou vá para a sala de emergência mais próxima.
Outras informações importantes de segurança
Uma condição grave chamada síndrome neuroléptica maligna (SNM) pode ocorrer com todos os medicamentos antipsicóticos, incluindo GEODON. Os sinais de SNM incluem febre muito alta, músculos rígidos, tremores, confusão, sudorese ou aumento da frequência cardíaca e pressão arterial. NMS é um efeito colateral raro, mas grave, que pode ser fatal. Portanto, informe o seu médico se sentir algum destes sinais.
Reação medicamentosa de início tardio chamada reação medicamentosa com eosinofilia e sintomas sistêmicos (DRESS) pode ocorrer com ziprasidona. Os sinais de DRESS podem incluir erupção cutânea, febre e linfonodos inchados. Outras reações adversas cutâneas graves (SCAR), como a síndrome de Stevens-Johnson, podem ocorrer com ziprasidona. Os sinais da síndrome de Stevens-Johnson podem incluir erupções cutâneas com bolhas que podem incluir úlceras na boca, descamação da pele, febre e manchas semelhantes a alvos na pele. DRESS e outras SCAR às vezes são fatais; portanto, informe imediatamente o seu médico se sentir algum destes sinais.
Reações adversas relacionadas a níveis elevados de açúcar no sangue (hiperglicemia), algumas vezes graves, foram relatadas em pacientes tratados com antipsicóticos atípicos. Houve poucos relatos de hiperglicemia ou diabetes em pacientes tratados com GEODON, e não se sabe se GEODON está associado a essas reações. Pacientes tratados com um antipsicótico atípico devem ser monitorados quanto a sintomas de hiperglicemia.
Tonturas causadas por uma queda na pressão arterial podem ocorrer com GEODON, especialmente quando você começa a tomar este medicamento ou quando a dose é aumentada. Se isso acontecer, tome cuidado para não se levantar muito rapidamente e converse com seu médico sobre o problema.
Antes de tomar GEODON, informe o seu médico se você
- estão grávidas ou planejam engravidar.
- Se você engravidar enquanto estiver recebendo GEODON 80mg, converse com seu médico sobre o registro no Registro Nacional de Gravidez para Antipsicóticos Atípicos. Você pode se registrar ligando para 1-866-961-2388 ou acesse http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/
- está amamentando ou planeja amamentar. GEODON 40mg pode passar para o leite materno. Converse com seu médico sobre a melhor maneira de alimentar seu bebê se você receber GEODON.
Como GEODON 80mg pode causar sonolência, tenha cuidado ao operar máquinas ou dirigir veículos motorizados.
Como os medicamentos da mesma classe de medicamentos do GEODON podem interferir na capacidade do corpo de se ajustar ao calor, é melhor evitar situações que envolvam alta temperatura ou umidade.
É melhor evitar o consumo de bebidas alcoólicas enquanto estiver a tomar GEODON.
Ligue para o seu médico imediatamente se tomar mais do que a quantidade de GEODON prescrita pelo seu médico.
GEODON não demonstrou ser seguro ou eficaz no tratamento de crianças e adolescentes com idade inferior a 18 anos.
Mantenha GEODON 80mg e todos os medicamentos fora do alcance das crianças.
Como armazenar GEODON
Armazene as cápsulas de GEODON 20mg à temperatura ambiente (59°F a 86°F ou 15°C a 30°C).
Para mais informações sobre GEODON
Esta folha é apenas um resumo. GEODON 20mg é um medicamento sujeito a receita médica e apenas o seu médico pode decidir se é adequado para si. Se você tiver alguma dúvida ou quiser mais informações sobre GEODON, fale com seu médico ou farmacêutico. Você também pode visitar www.geodon.com.
A rotulagem deste produto pode ter sido atualizada. Para obter as informações de prescrição mais recentes, visite www.pfizer.com
