Imitrex 100mg, 25mg, 50mg Sumatriptan Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Imitrex 25mg e como é usado?
Imitrex 100mg é um medicamento de prescrição usado para tratar os sintomas de enxaqueca e cefaleia em salvas. Imitrex pode ser usado sozinho ou com outros medicamentos.
Imitrex 50mg é um agente anti-enxaqueca, agonista do receptor 5-HT da serotonina.
Não se sabe se Imitrex 50mg é seguro e eficaz em crianças menores de 18 anos e o uso não é recomendado para pacientes geriátricos.
Quais são os possíveis efeitos colaterais do Imitrex 50mg?
Imitrex 25mg pode causar efeitos colaterais graves, incluindo:
- dor de estômago súbita e intensa,
- diarreia com ou sem a presença de sangue,
- dor forte no peito,
- dor na mandíbula ou no ombro,
- falta de ar,
- batimentos cardíacos irregulares,
- convulsão (convulsões),
- cãibras nas pernas,
- dormência ou formigamento nas pernas ou pés,
- dor ardente nas pernas ou pés,
- sensação de frio nas pernas ou pés,
- mudanças de cor em suas pernas ou pés,
- Dor no quadril,
- náusea,
- vômito,
- suando ou tremendo,
- agitação,
- alucinações,
- febre,
- rigidez muscular,
- perda de coordenação,
- dormência súbita ou fraqueza em um lado do corpo,
- fala arrastada,
- dificuldade em enxergar,
- equilíbrio ruim e
- dor de cabeça forte repentina
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Imitrex incluem:
- dor ou aperto no peito, garganta ou mandíbula,
- pressão em qualquer parte do seu corpo,
- dormência ou formigamento,
- sensação de calor ou frio,
- tontura,
- sonolência,
- fraqueza,
- gosto desagradável após o uso do medicamento nasal,
- dor, queimação, dormência ou formigamento no nariz ou na garganta após o uso do medicamento nasal e
- nariz escorrendo ou congestionado depois de usar o medicamento nasal
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Imitrex. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
DESCRIÇÃO
A injeção de IMTREX 50mg contém succinato de sumatriptano, um agonista seletivo do receptor 5-HT1B/1D. Succinato de sumatriptano é quimicamente designado como succinato de 3-[2-(dimetilamino)etil]-N-metil-indole5-metanossulfonamida (1:1), e tem a seguinte estrutura:
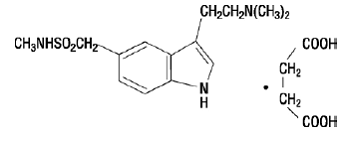
A fórmula empírica é C14H21N3O2S•C4H6O4, representando um peso molecular de 413,5. O succinato de sumatriptano é um pó branco a esbranquiçado que é facilmente solúvel em água e em solução salina.
injeção de IMITREX é uma solução límpida, incolor a amarelo pálido, estéril e não pirogênica para injeção subcutânea. Cada 0,5 mL de solução de injeção de 8 mg/mL de IMITREX contém 4 mg de sumatriptano (base) como o sal succinato e 3,8 mg de cloreto de sódio, USP em Água para Injeção, USP. Cada 0,5 mL de solução injetável de 12 mg/mL de IMITREX contém 6 mg de sumatriptano (base) como o sal succinato e 3,5 mg de cloreto de sódio, USP em Água para Injeção, USP. A faixa de pH de ambas as soluções é de aproximadamente 4,2 a 5,3. A osmolalidade de ambas as injeções é de 291 mOsmol.
INDICAÇÕES
IMITREX® Injection é indicado em adultos para (1) o tratamento agudo da enxaqueca, com ou sem aura, e (2) o tratamento agudo da cefaleia em salvas.
Limitações de uso
- Use apenas se tiver sido estabelecido um diagnóstico claro de enxaqueca ou cefaleia em salvas. Se um paciente não tiver resposta à primeira crise de enxaqueca ou cefaleia em salvas tratada com IMITREX 50mg Injetável, reconsidere o diagnóstico antes de administrar IMITREX Injetável para tratar quaisquer crises subsequentes.
- IMITREX Injection não é indicado para a prevenção de crises de enxaqueca ou cefaleia em salvas.
DOSAGEM E ADMINISTRAÇÃO
Informações de dosagem
A dose única máxima recomendada para adultos de IMITREX 25mg Injetável para o tratamento agudo da enxaqueca ou cefaleia em salvas é de 6 mg injetados por via subcutânea. Para o tratamento da enxaqueca, se os efeitos colaterais forem limitantes da dose, doses mais baixas (1 mg a 5 mg) podem ser usadas [ver Estudos clínicos ]. Para o tratamento da cefaleia em salvas, a eficácia de doses mais baixas não foi estabelecida.
dose cumulativa máxima que pode ser administrada em 24 horas é de 12 mg, duas injeções de 6 mg separadas por pelo menos 1 hora. Uma segunda dose de 6 mg só deve ser considerada se alguma resposta a uma primeira injeção foi observada.
Administração usando a caneta IMTREX STATdose®
Um dispositivo autoinjetor (IMITREX 25mg STATdose Pen) está disponível para uso com cartuchos de seringa pré-cheia de 4 mg e 6 mg. Com este dispositivo, a agulha penetra aproximadamente 5 a 6 mm (1/4 polegada). A injeção destina-se a ser administrada por via subcutânea e a administração intramuscular ou intravascular deve ser evitada. Instruir os pacientes sobre o uso adequado da caneta STATdose 100mg IMITREX e direcioná-los a usar locais de injeção com pele e espessura subcutânea adequadas para acomodar o comprimento da agulha.
Administração de doses de imitrex diferentes de 4 ou 6 mg
Em pacientes recebendo doses diferentes de 4 mg ou 6 mg, use o frasco de dose única de 6 mg; não use a caneta STATdose IMTREX 50mg. Inspecione visualmente o frasco quanto a partículas e descoloração antes da administração. Não use se forem observadas partículas e descolorações.
COMO FORNECIDO
Formas de dosagem e pontos fortes
- Injeção: cartuchos de seringa pré-cheia de dose única de 4 mg e 6 mg para uso com a caneta IMTREX STATdose.
- Injeção: frasco de dose única de 6 mg.
Armazenamento e manuseio
Injeção de IMTREX 100mg contém sumatriptano (base) como o sal succinato e é fornecido como uma solução límpida, incolor a amarelo pálido, estéril e não pirogênica, como segue:
Seringa pré-cheia e/ou caneta autoinjetora
Cada embalagem contém um folheto de Informações ao Paciente e Instruções de Uso ao Paciente.
IMTREX 100mg STATdose System®, 4mg , contendo 1 caneta STATdose IMTREX 25mg, 2 cartuchos de seringa de dose única pré-cheios e 1 estojo de transporte ( NDC 0173-0739-00).
IMTREX 100mg STATdose System, 6mg contendo 1 caneta IMTREX STATdose, 2 cartuchos de seringa de dose única pré-cheios e 1 estojo de transporte ( NDC 0173-0479-00).
Duas seringas pré-cheias de dose única de 4 mg cartuchos para uso com o sistema IMTREX STATdose ( NDC 0173-0739-02).
Duas seringas pré-cheias de dose única de 6 mg cartuchos para uso com IMTREX 25mg STATdose System ( NDC 0173-0478-00).
Frasco de Dose Única
Frasco de dose única de injeção de imitrex 25mg (6 mg/0,5 mL) em embalagens contendo 5 frascos ( NDC 01730449-02).
Armazenar entre 2° e 30°C (36° e 86°F). Proteja da luz.
GlaxoSmithKline, Research Triangle Park, NC 27709
EFEITOS COLATERAIS
As seguintes reações adversas graves estão descritas abaixo e em outras partes da bula:
- Isquemia miocárdica, infarto do miocárdio e angina de Prinzmetal [ver AVISOS E PRECAUÇÕES ]
- Arritmias [ver AVISOS E PRECAUÇÕES ]
- Dor/aperto/pressão no peito, garganta, pescoço e/ou mandíbula [ver AVISOS E PRECAUÇÕES ]
- Eventos cerebrovasculares [ver AVISOS E PRECAUÇÕES ]
- Outras reações de vasoespasmo [ver AVISOS E PRECAUÇÕES ]
- Cefaleia por uso excessivo de medicamentos [ver AVISOS E PRECAUÇÕES ]
- Síndrome serotoninérgica [ver AVISOS E PRECAUÇÕES ]
- Aumento da pressão arterial [ver AVISOS E PRECAUÇÕES ]
- Reações de hipersensibilidade [ver CONTRA-INDICAÇÕES , AVISOS E PRECAUÇÕES ]
- Convulsões [ver AVISOS E PRECAUÇÕES ]
Experiência de Ensaios Clínicos
Como os ensaios clínicos são conduzidos sob condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser comparadas diretamente com as taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
Enxaqueca
A Tabela 1 lista as reações adversas que ocorreram em 2 ensaios clínicos controlados por placebo nos EUA em pacientes com enxaqueca (Estudos 2 e 3) após uma dose única de 6 mg de IMITREX 100 mg Injetável ou placebo. Apenas as reações que ocorreram com uma frequência de 2% ou mais nos grupos tratados com IMITREX Injetável 6 mg e que ocorreram com uma frequência maior do que o grupo placebo estão incluídas na Tabela 1.
A incidência de reações adversas em ensaios clínicos controlados não foi afetada pelo sexo ou idade dos pacientes. Não havia dados suficientes para avaliar o impacto da raça na incidência de reações adversas.
Cefaleia em grupo
Nos ensaios clínicos controlados que avaliaram a eficácia de IMITREX 50mg Injetável como tratamento para cefaleia em salvas (Estudos 4 e 5), não foram detectadas novas reações adversas significativas que já não tivessem sido identificadas nos ensaios de IMITREX 100mg em pacientes com enxaqueca.
No geral, a frequência de reações adversas relatadas nos estudos de cefaleia em salvas foi geralmente menor do que nos estudos de enxaqueca. As exceções incluem relatos de parestesia (5% de IMITREX, 0% de placebo), náuseas e vômitos (4% de IMITREX, 0% de placebo) e broncoespasmo (1% de IMITREX 50mg, 0% de placebo).
Experiência pós-marketing
As seguintes reações adversas foram identificadas durante o uso pós-aprovação de IMITREX 50mg Comprimidos, IMITREX Spray Nasal e IMITREX 50mg Injetável. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento.
Cardiovascular
Hipotensão, palpitações.
Neurológico
Distonia, tremor.
INTERAÇÕES MEDICAMENTOSAS
Medicamentos contendo Ergot
Medicamentos contendo ergot foram relatados como causadores de reações vasoespásticas prolongadas. Como esses efeitos podem ser aditivos, o uso de medicamentos contendo ergotamina ou do tipo ergot (como diidroergotamina ou metisergida) e IMITREX 25mg injeção dentro de 24 horas um do outro é contraindicado.
Inibidores da Monoamina Oxidase-A
Os inibidores da MAO-A aumentam a exposição sistêmica em 2 vezes. Portanto, o uso de IMITREX em pacientes recebendo inibidores da MAO-A é contraindicado [ver FARMACOLOGIA CLÍNICA ].
Outros Agonistas de 5-HT1
Como seus efeitos vasoespásticos podem ser aditivos, é contraindicada a coadministração de IMITREX Injetável e outros agonistas 5-HT1 (por exemplo, triptanos) dentro de 24 horas um do outro.
Inibidores seletivos de recaptação de serotonina/inibidores de recaptação de serotonina e noradrenalina e síndrome de serotonina
Casos de síndrome serotoninérgica foram relatados durante a coadministração de triptanos e ISRSs, SNRIs, TCAs e inibidores da MAO [ver AVISOS E PRECAUÇÕES ].
AVISOS
Incluído como parte do PRECAUÇÕES seção.
PRECAUÇÕES
Isquemia do Miocárdio, Infarto do Miocárdio e Angina de Prinzmetal
O uso de IMITREX é contraindicado em pacientes com DAC isquêmica ou vasoespástica. Houve relatos raros de reações adversas cardíacas graves, incluindo infarto agudo do miocárdio, ocorrendo dentro de algumas horas após a administração de IMITREX Injetável. Algumas dessas reações ocorreram em pacientes sem DAC conhecida. IMTREX 100mg Injetável pode causar vasoespasmo da artéria coronária (angina de Prinzmetal), mesmo em pacientes sem história de DAC.
Realize uma avaliação cardiovascular em pacientes virgens de triptano que tenham múltiplos fatores de risco cardiovascular (por exemplo, idade avançada, diabetes, hipertensão, tabagismo, obesidade, forte histórico familiar de DAC) antes de receber IMITREX Injetável. Se houver evidência de DAC ou vasoespasmo da artéria coronária, IMTREX 100mg é contraindicado. Para pacientes com múltiplos fatores de risco cardiovascular com avaliação cardiovascular negativa, considere administrar a primeira dose de IMITREX em um ambiente com supervisão médica e realizar um eletrocardiograma (ECG) imediatamente após a administração de IMITREX. Para esses pacientes, considere a avaliação cardiovascular periódica em usuários intermitentes de longo prazo de IMITREX 100mg Injetável.
Arritmias
Distúrbios do ritmo cardíaco com risco de vida, incluindo taquicardia ventricular e fibrilação ventricular levando à morte, foram relatados dentro de algumas horas após a administração de agonistas 5-HT1. Interrompa a injeção de IMITREX se ocorrerem esses distúrbios. IMITREX é contraindicado em pacientes com síndrome de Wolff-Parkinson-White ou arritmias associadas a outros distúrbios da via de condução acessória cardíaca.
Dor no peito, garganta, pescoço e/ou mandíbula/aperto/pressão
Sensações de aperto, dor, pressão e peso no precórdio, garganta, pescoço e mandíbula geralmente ocorrem após o tratamento com IMITREX e geralmente são de origem não cardíaca. No entanto, realize uma avaliação cardíaca se esses pacientes estiverem em alto risco cardíaco. O uso de IMITREX Injection é contraindicado em pacientes com DAC e aqueles com angina variante de Prinzmetal.
Eventos cerebrovasculares
Hemorragia cerebral, hemorragia subaracnóidea e acidente vascular cerebral ocorreram em pacientes tratados com agonistas 5-HT1, e alguns resultaram em fatalidades. Em vários casos, parece possível que os eventos cerebrovasculares tenham sido primários, tendo o agonista 5-HT1 sido administrado na crença incorreta de que os sintomas experimentados eram uma consequência da enxaqueca quando não eram. Além disso, pacientes com enxaqueca podem apresentar risco aumentado de certos eventos cerebrovasculares (por exemplo, acidente vascular cerebral, hemorragia, AIT). Interrompa a injeção de IMITREX se ocorrer um evento cerebrovascular.
Antes de tratar dores de cabeça em pacientes sem diagnóstico prévio de enxaqueca ou cefaléia em salvas ou em pacientes que apresentam sintomas atípicos, exclua outras condições neurológicas potencialmente graves. IMITREX Injetável é contraindicado em pacientes com histórico de acidente vascular cerebral ou AIT.
Outras reações de vasoespasmo
IMITREX 25mg pode causar reações vasoespásticas não coronarianas, como isquemia vascular periférica, isquemia vascular gastrointestinal e infarto (apresentando-se com dor abdominal e diarréia sanguinolenta), infarto esplênico e síndrome de Raynaud. Em pacientes que apresentarem sintomas ou sinais sugestivos de reação de vasoespasmo não coronariano após o uso de qualquer agonista 5-HT1, descarte uma reação vasoespástica antes de receber injeções adicionais de IMITREX.
Relatos de cegueira transitória e permanente e perda parcial significativa da visão foram relatados com o uso de agonistas 5-HT1. Como os distúrbios visuais podem fazer parte de um ataque de enxaqueca, uma relação causal entre esses eventos e o uso de agonistas 5-HT1 não foi claramente estabelecida.
Cefaleia por uso excessivo de medicamentos
uso excessivo de medicamentos para enxaqueca aguda (por exemplo, ergotamina, triptanos, opioides ou combinação desses medicamentos por 10 ou mais dias por mês) pode levar à exacerbação da cefaleia (cefaleia por uso excessivo de medicamentos). A cefaleia por uso excessivo de medicamentos pode se apresentar como dores de cabeça diárias semelhantes à enxaqueca ou como um aumento acentuado na frequência de ataques de enxaqueca. A desintoxicação dos pacientes, incluindo a retirada dos medicamentos usados em excesso, e o tratamento dos sintomas de abstinência (que geralmente incluem um agravamento transitório da cefaleia) podem ser necessários.
Síndrome da serotonina
A síndrome da serotonina pode ocorrer com IMITREX Injetável, particularmente durante a coadministração com inibidores seletivos da recaptação da serotonina (ISRSs), inibidores da recaptação da serotonina norepinefrina (IRSNs), antidepressivos tricíclicos (TCAs) e inibidores da MAO [ver INTERAÇÕES MEDICAMENTOSAS ]. Os sintomas da síndrome serotoninérgica podem incluir alterações do estado mental (p. ex., agitação, alucinações, coma), instabilidade autonômica (p. náuseas, vómitos, diarreia). O início dos sintomas geralmente ocorre dentro de minutos a horas após receber uma nova ou uma dose maior de um medicamento serotoninérgico. Interrompa a injeção de IMITREX se houver suspeita de síndrome serotoninérgica.
Aumento da Pressão Arterial
Elevação significativa da pressão arterial, incluindo crise hipertensiva com comprometimento agudo dos sistemas orgânicos, foi relatada em raras ocasiões em pacientes tratados com agonistas 5-HT1, incluindo pacientes sem histórico de hipertensão. Monitorar a pressão arterial em pacientes tratados com IMITREX. IMITREX Injetável é contraindicado em pacientes com hipertensão não controlada.
Reações anafiláticas/anafilactóides
Reações anafiláticas/anafilactóides ocorreram em pacientes recebendo IMITREX. Tais reações podem ser fatais ou fatais. Em geral, reações anafiláticas a medicamentos são mais prováveis de ocorrer em indivíduos com história de sensibilidade a múltiplos alérgenos. IMITREX 50mg Injetável é contraindicado em pacientes com história de reação de hipersensibilidade ao IMITREX.
Convulsões
Convulsões foram relatadas após a administração de IMITREX. Alguns ocorreram em pacientes com histórico de convulsões ou condições concomitantes que predispõem a convulsões. Há também relatos em pacientes em que esses fatores predisponentes não são aparentes. IMITREX Injetável deve ser usado com cautela em pacientes com histórico de epilepsia ou condições associadas a um limiar convulsivo reduzido.
Informações de Aconselhamento do Paciente
Aconselhe o paciente a ler o rótulo do paciente aprovado pela FDA ( INFORMAÇÕES DO PACIENTE e Instruções de Uso ).
Risco de isquemia e/ou infarto do miocárdio, angina de Prinzmetal, outros eventos relacionados ao vasoespasmo, arritmias e eventos cerebrovasculares
Informe os pacientes que IMITREX 50mg pode causar efeitos colaterais cardiovasculares graves, como infarto do miocárdio ou acidente vascular cerebral. Embora eventos cardiovasculares graves possam ocorrer sem sintomas de alerta, os pacientes devem estar alertas para os sinais e sintomas de dor no peito, falta de ar, batimentos cardíacos irregulares, aumento significativo da pressão arterial, fraqueza e fala arrastada, e devem procurar aconselhamento médico se qualquer sinal ou sintomas indicativos são observados. Informe os pacientes sobre a importância desse acompanhamento [ver AVISOS E PRECAUÇÕES ].
Reações anafiláticas/anafilactóides
Informe os pacientes que reações anafiláticas/anafilactóides ocorreram em pacientes recebendo 100mg de IMITREX. Tais reações podem ser fatais ou fatais. Em geral, reações anafiláticas a medicamentos são mais prováveis de ocorrer em indivíduos com história de sensibilidade a múltiplos alérgenos [ver CONTRA-INDICAÇÕES , AVISOS E PRECAUÇÕES ].
Uso concomitante com outros triptanos ou medicamentos de ergotamina
Informar os pacientes que o uso de IMITREX 50mg Injetável dentro de 24 horas de outro triptano ou medicação do tipo ergot (incluindo diidroergotamina ou metisergida) é contraindicado [ver CONTRA-INDICAÇÕES , INTERAÇÕES MEDICAMENTOSAS ].
Síndrome da serotonina
Alertar os pacientes sobre o risco de síndrome serotoninérgica com o uso de IMITREX Injetável ou outros triptanos, particularmente durante o uso combinado com ISRSs, SNRIs, TCAs e inibidores da MAO [ver AVISOS E PRECAUÇÕES , INTERAÇÕES MEDICAMENTOSAS ].
Cefaleia por uso excessivo de medicamentos
Informe os pacientes que o uso de medicamentos para enxaqueca aguda por 10 ou mais dias por mês pode levar a uma exacerbação da cefaleia e incentive os pacientes a registrar a frequência da cefaleia e o uso de medicamentos (p. AVISOS E PRECAUÇÕES ].
Gravidez
Informar as pacientes que IMITREX 25mg injetável não deve ser usado durante a gravidez, a menos que o benefício potencial justifique o risco potencial para o feto [ver Uso em populações específicas ].
Mães que amamentam
Aconselhe as pacientes a notificarem seu médico se estiverem amamentando ou planejam amamentar [ver Uso em populações específicas ].
Capacidade de executar tarefas complexas
tratamento com IMTREX 25mg Injetável pode causar sonolência e tontura; instruir os pacientes a avaliar sua capacidade de realizar tarefas complexas após a administração de IMTREX 25mg Injetável.
Como usar imitrex 100mg injeção
Fornecer instruções aos pacientes sobre o uso adequado de IMITREX 100mg Injetável se eles forem capazes de autoadministrar IMITREX 50mg Injetável em situações sem supervisão médica.
Informe os pacientes que a agulha na caneta IMTREX STATdose Pen penetra aproximadamente 1/4 de polegada (5 a 6 mm). Informe os pacientes que a injeção deve ser administrada por via subcutânea e que a administração intramuscular ou intravascular deve ser evitada. Instrua os pacientes a usar locais de injeção com pele e espessura subcutânea adequadas para acomodar o comprimento da agulha.
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Carcinogênese
Em estudos de carcinogenicidade em camundongos e ratos nos quais o sumatriptano foi administrado oralmente por 78 semanas e 104 semanas, respectivamente, em doses de até 160 mg/kg/dia (a dose mais alta em ratos foi reduzida de 360 mg/kg/dia durante a Semana 21 ). A dose mais alta para camundongos e ratos foi aproximadamente 130 e 260 vezes a MRHD única de 6 mg administrada por via subcutânea na base de mg/m². Não houve evidência em nenhuma das espécies de aumento de tumores relacionados à administração de sumatriptano.
Mutagênese
A sumatriptana foi negativa em ensaios in vitro (mutação reversa bacteriana [Ames], mutação genética em hamster chinês V79/HGPRT, aberração cromossômica em linfócitos humanos) e in vivo (micronúcleo de rato).
Prejuízo da Fertilidade
Quando o sumatriptano foi administrado por injeção subcutânea a ratos machos e fêmeas antes e durante o período de acasalamento, não houve evidência de fertilidade prejudicada em doses de até 60 mg/kg/dia ou aproximadamente 100 vezes a dose humana única de 6 mg em um base mg/m². Quando o sumatriptano (5, 50, 500 mg/kg/dia) foi administrado oralmente a ratos machos e fêmeas antes e durante o período de acasalamento, houve uma diminuição da fertilidade relacionada ao tratamento secundária a uma diminuição no acasalamento em animais tratados com doses superior a 5 mg/kg/dia. Não está claro se esse achado foi devido a um efeito em homens, mulheres ou ambos.
Uso em populações específicas
Gravidez
Gravidez Categoria C
Não há estudos adequados e bem controlados de IMTREX 50mg em mulheres grávidas. Em estudos de toxicidade de desenvolvimento em ratos e coelhos, a administração oral de sumatriptano a animais prenhes foi associada à letalidade embrionária, anormalidades fetais e mortalidade de filhotes. Quando administrado por via intravenosa a coelhas grávidas, o sumatriptano foi embrioletal. IMITREX 100mg Injetável deve ser usado durante a gravidez somente se o benefício potencial justificar o risco potencial para o feto.
administração oral de sumatriptano a ratas grávidas durante o período de organogénese resultou num aumento da incidência de anomalias nos vasos sanguíneos fetais (cervicotorácicos e umbilicais). A dose mais alta sem efeito para toxicidade no desenvolvimento embriofetal em taxas foi de 60 mg/kg/dia, ou aproximadamente 100 vezes a dose humana máxima recomendada (MRHD) de 6 mg administrada por via subcutânea em uma base de mg/m². A administração oral de sumatriptano a coelhas grávidas durante o período de organogénese resultou num aumento da incidência de embrioletalidade e anomalias vasculares e esqueléticas cervicotorácicas fetais. A administração intravenosa de sumatriptano a coelhas grávidas durante o período de organogénese resultou num aumento da incidência de embrioletalidade. As maiores doses orais e intravenosas sem efeito para toxicidade no desenvolvimento em coelhos foram de 15 e 0,75 mg/kg/dia, ou aproximadamente 50 e 2 vezes, respectivamente, a MRHD única de 6 mg administrada por via subcutânea na base de mg/m².
administração oral de sumatriptano a ratos antes e durante a gestação resultou em toxicidade embriofetal (diminuição do peso corporal, diminuição da ossificação, aumento da incidência de anormalidades esqueléticas). A dose mais alta sem efeito foi de 50 mg/kg/dia, ou aproximadamente 80 vezes a MRHD única de 6 mg administrada por via subcutânea na base de mg/m². Nas crias de ratas grávidas tratadas por via oral com sumatriptano durante a organogénese, houve uma diminuição na sobrevivência das crias. A dose mais alta sem efeito para este efeito foi de 60 mg/kg/dia, ou aproximadamente 100 vezes a MRHD única de 6 mg administrada por via subcutânea na base de mg/m². O tratamento oral de ratas grávidas com sumatriptano durante a última parte da gestação e durante toda a lactação resultou em uma diminuição na sobrevida dos filhotes. A dose mais alta sem efeito para esse achado foi de 100 mg/kg/dia, ou aproximadamente 160 vezes a MRHD única de 6 mg administrada por via subcutânea na base de mg/m².
Mães que amamentam
sumatriptana é excretada no leite humano após administração subcutânea. A exposição infantil ao sumatriptano pode ser minimizada evitando a amamentação por 12 horas após o tratamento com IMITREX 50mg Injetável.
Uso Pediátrico
A segurança e eficácia em pacientes pediátricos não foram estabelecidas. IMTREX 100mg Injetável não é recomendado para uso em pacientes com menos de 18 anos de idade.
Dois ensaios clínicos controlados avaliaram o spray nasal IMITREX (5 a 20 mg) em 1.248 pacientes pediátricos com enxaqueca de 12 a 17 anos de idade que trataram um único ataque. Os ensaios não estabeleceram a eficácia de IMITREX spray nasal em comparação com placebo no tratamento da enxaqueca em pacientes pediátricos. As reações adversas observadas nestes ensaios clínicos foram de natureza semelhante às relatadas em ensaios clínicos em adultos.
Cinco ensaios clínicos controlados (2 ensaios de ataque único, 3 ensaios de ataque múltiplo) avaliando IMITREX oral (25 a 100 mg) em pacientes pediátricos de 12 a 17 anos de idade inscreveram um total de 701 pacientes pediátricos com enxaqueca. Esses estudos não estabeleceram a eficácia de IMITREX 25mg oral em comparação com placebo no tratamento da enxaqueca em pacientes pediátricos. As reações adversas observadas nestes ensaios clínicos foram de natureza semelhante às relatadas em ensaios clínicos em adultos. A frequência de todas as reações adversas nesses pacientes pareceu ser dependente da dose e da idade, com pacientes mais jovens relatando reações mais comumente do que pacientes pediátricos mais velhos.
experiência pós-comercialização documenta que ocorreram reações adversas graves na população pediátrica após o uso de IMITREX subcutâneo, oral e/ou intranasal. Esses relatos incluem reações de natureza semelhante àquelas raramente relatadas em adultos, incluindo acidente vascular cerebral, perda visual e morte. Um infarto do miocárdio foi relatado em um homem de 14 anos após o uso de imitrex oral; os sinais clínicos ocorreram dentro de 1 dia após a administração do fármaco. Dados clínicos para determinar a frequência de reações adversas graves em pacientes pediátricos que podem receber IMITREX subcutâneo, oral ou intranasal não estão disponíveis atualmente.
Uso Geriátrico
Os ensaios clínicos de IMTREX 100mg Injetável não incluíram um número suficiente de pacientes com 65 anos de idade ou mais para determinar se eles respondem de forma diferente dos pacientes mais jovens. Outras experiências clínicas relatadas não identificaram diferenças nas respostas entre os pacientes idosos e os mais jovens. Em geral, a seleção da dose para um paciente idoso deve ser cautelosa, geralmente começando na extremidade inferior da faixa de dosagem, refletindo a maior frequência de diminuição da função hepática, renal ou cardíaca e de doença concomitante ou outra terapia medicamentosa.
Uma avaliação cardiovascular é recomendada para pacientes geriátricos que têm outros fatores de risco cardiovascular (por exemplo, diabetes, hipertensão, tabagismo, obesidade, forte histórico familiar de DAC) antes de receber IMITREX Injetável [ver AVISOS E PRECAUÇÕES ].
SOBREDOSAGEM
O vasoespasmo coronariano foi observado após a administração intravenosa de IMITREX 50mg Injetável [ver CONTRA-INDICAÇÕES ]. A superdosagem seria esperada a partir de dados em animais (cães a 0,1 g/kg, ratos a 2 g/kg) para possivelmente causar convulsões, tremores, inatividade, eritema das extremidades, redução da frequência respiratória, cianose, ataxia, midríase, reações no local da injeção ( descamação, queda de cabelo e formação de crostas) e paralisia.
A meia-vida de eliminação do sumatriptano é de cerca de 2 horas [ver FARMACOLOGIA CLÍNICA ]; portanto, o monitoramento de pacientes após superdosagem com IMITREX Injetável deve continuar por pelo menos 10 horas ou enquanto os sintomas ou sinais persistirem.
Não se sabe qual o efeito da hemodiálise ou diálise peritoneal nas concentrações séricas de sumatriptano.
CONTRA-INDICAÇÕES
IMITREX Injetável é contraindicado em pacientes com:
- Doença isquêmica da artéria coronária (DAC) (angina pectoris, história de infarto do miocárdio ou isquemia silenciosa documentada) ou vasoespasmo da artéria coronária, incluindo angina de Prinzmetal [ver AVISOS E PRECAUÇÕES ].
- Síndrome de Wolff-Parkinson-White ou arritmias associadas a outros distúrbios da via de condução acessória cardíaca [ver AVISOS E PRECAUÇÕES ].
- História de acidente vascular cerebral ou ataque isquêmico transitório (AIT) ou história de enxaqueca hemiplégica ou basilar porque esses pacientes têm maior risco de acidente vascular cerebral [ver AVISOS E PRECAUÇÕES ].
- Doença vascular periférica [ver AVISOS E PRECAUÇÕES ].
- Doença isquêmica do intestino [ver AVISOS E PRECAUÇÕES ].
- Hipertensão não controlada [ver AVISOS E PRECAUÇÕES ].
- Uso recente (ou seja, dentro de 24 horas) de medicamentos contendo ergotamina, medicamentos do tipo ergot (como diidroergotamina ou metisergida) ou outro agonista de 5-hidroxitriptamina1 (5-HT1) [ver INTERAÇÕES MEDICAMENTOSAS ].
- Administração concomitante de um inibidor da monoaminoxidase (MAO)-A ou uso recente (dentro de 2 semanas) de um inibidor da MAO-A [ver INTERAÇÕES MEDICAMENTOSAS , FARMACOLOGIA CLÍNICA ].
- Hipersensibilidade ao IMITREX (observados angioedema e anafilaxia) [ver AVISOS E PRECAUÇÕES ].
- Insuficiência hepática grave [ver FARMACOLOGIA CLÍNICA ].
FARMACOLOGIA CLÍNICA
Mecanismo de ação
sumatriptana se liga com alta afinidade aos receptores 5-HT1B/1D clonados humanos. Presumivelmente, a sumatriptana exerce seus efeitos terapêuticos no tratamento da enxaqueca e da cefaleia em salvas por meio de efeitos agonistas nos receptores 5-HT1B/1D nos vasos sanguíneos intracranianos e nos nervos sensoriais do sistema trigêmeo, que resultam na constrição dos vasos cranianos e na inibição do neuropeptídeo pró-inflamatório liberar.
Farmacodinâmica
Pressão arterial
Elevação significativa da pressão arterial, incluindo crise hipertensiva, foi relatada em pacientes com e sem história de hipertensão [ver AVISOS E PRECAUÇÕES ].
Artérias periféricas (pequenas)
Em voluntários saudáveis (N = 18), um estudo avaliando os efeitos do sumatriptano na reatividade arterial periférica (pequenos vasos) não conseguiu detectar um aumento clinicamente significativo na resistência periférica.
Frequência cardíaca
Os aumentos transitórios da pressão arterial observados em alguns doentes em ensaios clínicos realizados durante o desenvolvimento do sumatriptano como tratamento para a enxaqueca não foram acompanhados por quaisquer alterações clinicamente significativas na frequência cardíaca.
Farmacocinética
Absorção e Biodisponibilidade
A biodisponibilidade do sumatriptano por injeção subcutânea em 18 indivíduos saudáveis do sexo masculino foi de 97% ± 16% da obtida após injeção intravenosa.
Após uma única injeção manual subcutânea de 6 mg na área deltóide do braço em 18 homens saudáveis (idade: 24 ± 6 anos, peso: 70 kg), a concentração sérica máxima (Cmax) de sumatriptano foi (média ± desvio padrão) 74 ± 15 ng/mL e o tempo até o pico de concentração (Tmax) foi de 12 minutos após a injeção (intervalo: 5 a 20 minutos). Neste ensaio, a mesma dose injetada por via subcutânea na coxa deu uma Cmax de 61 ± 15 ng/mL por injeção manual versus 52 ± 15 ng/mL por técnicas de autoinjeção. O Tmax ou quantidade absorvida não foi significativamente alterado pelo local ou técnica de injeção.
Distribuição
A ligação proteica, determinada por diálise de equilíbrio na faixa de concentração de 10 a 1.000 ng/mL é baixa, aproximadamente 14% a 21%. O efeito do sumatriptano na ligação às proteínas de outros medicamentos não foi avaliado.
Após uma injeção subcutânea de 6 mg na área deltóide do braço em 9 homens (idade média: 33 anos, peso médio: 77 kg), o volume de distribuição do compartimento central de sumatriptano foi de 50 ± 8 litros e a meia-vida de distribuição foi 15 ± 2 minutos.
Metabolismo
Estudos in vitro com microssomas humanos sugerem que o sumatriptano é metabolizado pela MAO, predominantemente pela isoenzima A. A maior parte de uma dose radiomarcada de sumatriptano excretada na urina é o principal metabólito ácido indol acético (IAA) ou o IAA glicuronídeo, ambos inativos.
Eliminação
Após uma única dose subcutânea de 6 mg, 22% ± 4% foi excretado na urina como sumatriptano inalterado e 38% ± 7% como metabólito IAA.
Após uma injeção subcutânea de 6 mg na área deltóide do braço, a depuração sistêmica do sumatriptano foi de 1.194 ± 149 mL/min e a meia-vida terminal foi de 115 ± 19 minutos.
Populações Específicas
Era
farmacocinética do sumatriptano em idosos (idade média: 72 anos, 2 homens e 4 mulheres) e em indivíduos com enxaqueca (idade média: 38 anos, 25 homens e 155 mulheres) foi semelhante à de homens saudáveis (idade média: 30 anos).
Insuficiência hepática
O efeito da doença hepática leve a moderada na farmacocinética do sumatriptano administrado por via subcutânea foi avaliado. Não houve diferenças significativas na farmacocinética do sumatriptano administrado por via subcutânea em indivíduos com insuficiência hepática moderada em comparação com controles saudáveis. A farmacocinética do sumatriptano administrado por via subcutânea em pacientes com insuficiência hepática grave não foi estudada. O uso de IMITREX Injetável nesta população é contraindicado [ver CONTRA-INDICAÇÕES ].
Corrida
A depuração sistêmica e Cmax do sumatriptano subcutâneo foram semelhantes em indivíduos do sexo masculino saudáveis, negros (n = 34) e caucasianos (n = 38).
Estudos de interação medicamentosa
Inibidores da Monoamina Oxidase-A
Em um estudo com 14 mulheres saudáveis, o pré-tratamento com um inibidor da MAO-A diminuiu a depuração do sumatriptano subcutâneo, resultando em um aumento de 2 vezes na área sob a curva de concentração plasmática do sumatriptano-tempo (AUC), correspondendo a um aumento de 40% na meia-vida de eliminação.
Toxicologia e/ou Farmacologia Animal
Opacidades da córnea
Os cães que receberam sumatriptano oral desenvolveram opacidades da córnea e defeitos no epitélio da córnea. Opacidades da córnea foram observadas na dose mais baixa testada, 2 mg/kg/dia, e estavam presentes após 1 mês de tratamento. Defeitos no epitélio da córnea foram observados em um estudo de 60 semanas. Não foram realizados exames anteriores para essas toxicidades e não foram estabelecidas doses sem efeito; no entanto, a exposição plasmática relativa na dose mais baixa testada foi aproximadamente 3 vezes a exposição humana após uma dose subcutânea de 6 mg.
Estudos clínicos
Enxaqueca
Em ensaios clínicos controlados envolvendo mais de 1.000 pacientes durante crises de enxaqueca que apresentavam dor moderada ou intensa e 1 ou mais dos sintomas enumerados na Tabela 3, o início do alívio começou tão cedo quanto 10 minutos após uma injeção de 6 mg de IMITREX 50 mg. Doses mais baixas de IMITREX 100mg Injetável também podem ser eficazes, embora a proporção de pacientes que obtiveram alívio adequado tenha diminuído e a latência para esse alívio seja maior com doses mais baixas.
No Estudo 1, 6 doses diferentes de IMITREX 100mg Injeção (n = 30 cada grupo) foram comparadas com placebo (n = 62), em um projeto de ataque único, de grupos paralelos, a relação dose-resposta foi a mostrada na Tabela 2.
Em 2 ensaios clínicos randomizados e controlados por placebo de IMITREX 25mg Injetável 6 mg em 1.104 pacientes com dor de enxaqueca moderada ou grave (Estudos 2 e 3), o início do alívio foi inferior a 10 minutos. O alívio da cefaleia, definido pela redução da dor de intensa ou moderadamente intensa para leve ou sem cefaleia, foi alcançado em 70% dos pacientes dentro de 1 hora após uma dose única subcutânea de 6 mg de IMITREX Injetável. Aproximadamente 82% e 65% dos pacientes tratados com IMITREX 6 mg tiveram alívio da dor de cabeça e ficaram sem dor em 2 horas, respectivamente.
A Tabela 3 mostra os resultados de eficácia de 1 e 2 horas para IMITREX Injetável 6 mg nos Estudos 2 e 3.
A injeção de 100mg de imitrex também aliviou a fotofobia, a fonofobia (sensibilidade ao som), náuseas e vômitos associados a crises de enxaqueca. Eficácia semelhante foi observada quando os pacientes autoadministraram IMITREX 50mg Injection usando a caneta IMITREX 100mg STATdose Pen.
eficácia de IMITREX Injetável não foi afetada pelo fato de a enxaqueca estar ou não associada à aura, duração do ataque, sexo ou idade do paciente ou uso concomitante de medicamentos profiláticos comuns para enxaqueca (por exemplo, betabloqueadores).
Cefaleia em grupo
A eficácia de IMITREX Injection no tratamento agudo da cefaleia em salvas foi demonstrada em 2 estudos cruzados de 2 períodos, randomizados, duplo-cegos, controlados por placebo (Estudos 4 e 5). Pacientes de 21 a 65 anos de idade foram incluídos e instruídos a tratar uma dor de cabeça moderada a muito intensa dentro de 10 minutos após o início. O alívio da dor de cabeça foi definido como uma redução na gravidade da dor de cabeça para leve ou nenhuma dor. Em ambos os estudos, a proporção de indivíduos que obtiveram alívio em 10 ou 15 minutos foi significativamente maior entre os pacientes que receberam 6 mg de IMITREX em comparação com aqueles que receberam placebo (ver Tabela 4).
Uma estimativa da probabilidade cumulativa de um paciente com cefaleia em salvas obter alívio após ser tratado com 25mg de imitrex ou placebo é apresentada na Figura 1.
Figura 1: Tempo para alívio da cefaleia em salvas a partir do momento da injeçãoa 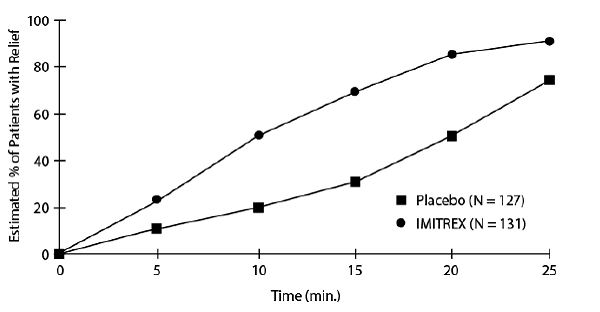
aA figura usa o Gráfico de Sobrevivência Kaplan-Meier (limite do produto). Os pacientes em uso de medicação de resgate foram censurados em 15 minutos.
O gráfico foi construído com dados de pacientes que experimentaram alívio ou não necessitaram (solicitaram) medicação de resgate dentro de um período de 2 horas após o tratamento. Como consequência, os dados no gráfico são derivados de apenas um subconjunto das 258 dores de cabeça tratadas (medicação de resgate foi necessária em 52 das 127 dores de cabeça tratadas com placebo e 18 das 131 dores de cabeça tratadas com IMITREX 50mg Injeção).
Outros dados sugerem que o tratamento com IMITREX 25mg Injetável não está associado a um aumento na recorrência precoce de cefaleia e tem pouco efeito sobre a incidência de cefaleias de ocorrência tardia (ou seja, aquelas que ocorrem após 2, mas antes de 18 ou 24 horas).
INFORMAÇÃO DO PACIENTE
IMITREX® (IM-i-trex) (succinato de sumatriptano) Injeção
Leia estas informações do paciente antes de começar a tomar imitrex e cada vez que receber uma recarga. Pode haver novas informações. Esta informação não substitui a conversa com seu médico sobre sua condição médica ou tratamento.
Qual é a informação mais importante que devo saber sobre o imitrex?
IMITREX pode causar efeitos colaterais graves, incluindo:
Ataque cardíaco e outros problemas cardíacos. Problemas cardíacos podem levar à morte.
Pare de tomar IMITREX 25mg e procure ajuda médica de emergência imediatamente se tiver algum dos seguintes sintomas de ataque cardíaco:
- desconforto no centro do peito que dura mais do que alguns minutos ou que desaparece e volta
- aperto grave, dor, pressão ou peso no peito, garganta, pescoço ou mandíbula
- dor ou desconforto nos braços, costas, pescoço, mandíbula ou estômago
- falta de ar com ou sem desconforto no peito
- saindo em um suor frio
- náusea ou vômito
- sentindo-se tonto
IMITREX não é para pessoas com fatores de risco para doenças cardíacas, a menos que um exame cardíaco seja feito e não mostre nenhum problema. Você tem um risco maior de doença cardíaca se você:
- tem pressão alta
- tem níveis elevados de colesterol
- fumaça
- estão acima do peso
- tem diabetes
- tem um histórico familiar de doença cardíaca
O que é IMITEX?
IMITREX Injection é um medicamento de prescrição utilizado para tratar enxaquecas agudas com ou sem aura e cefaleias em salvas agudas em adultos que foram diagnosticados com enxaqueca ou cefaleias em salvas.
IMITREX 50mg não é usado para tratar outros tipos de dores de cabeça, como enxaquecas hemiplégicas (que o tornam incapaz de se mover em um lado do corpo) ou basilar (forma rara de enxaqueca com aura).
IMITREX 100mg não é usado para prevenir ou diminuir o número de enxaquecas ou cefaleias em salvas que você tem.
Não se sabe se IMITREX 100mg é seguro e eficaz em crianças menores de 18 anos.
Quem não deve tomar IMITREX 100mg?
Não tome IMITREX 50mg se tiver:
- problemas cardíacos ou histórico de problemas cardíacos
- estreitamento dos vasos sanguíneos nas pernas, braços, estômago ou rins (doença vascular periférica)
- pressão alta não controlada
- problemas graves de fígado
- enxaqueca hemiplégica ou enxaqueca basilar. Se você não tem certeza se tem esses tipos de enxaqueca, pergunte ao seu médico.
- teve um acidente vascular cerebral, ataques isquêmicos transitórios (TIAs) ou problemas com a circulação sanguínea
- tomou algum dos seguintes medicamentos nas últimas 24 horas:
- almotriptano (AXERT®)
- eletriptano (RELPAX®)
- frovatriptano (FROVA®)
- naratriptano (AMERGE®)
- rizatriptano (MAXALT®, MAXALT-MLT®)
- sumatriptano e naproxeno (TREXIMET®)
- ergotaminas (CAFERGOT®, ERGOMAR®, MIGERGOT®)
- diidroergotamina (DHE 45®, MIGRANAL®) Pergunte ao seu médico se não tiver certeza se o seu medicamento está listado acima.
- uma alergia ao sumatriptano ou a qualquer um dos ingredientes de IMITREX. Consulte o final deste folheto para obter uma lista completa dos ingredientes de IMTREX.
O que devo dizer ao meu médico antes de tomar IMITREX?
Antes de tomar IMITREX, informe o seu médico sobre todas as suas condições médicas, incluindo se você:
- tem pressão alta
- tem colesterol alto
- tem diabetes
- fumaça
- estão acima do peso
- tem problemas cardíacos ou histórico familiar de problemas cardíacos ou acidente vascular cerebral
- tem problemas renais
- tem problemas de fígado
- teve epilepsia ou convulsões
- não estão usando controle de natalidade eficaz
- engravidar enquanto estiver a tomar imitrex
- está amamentando ou planeja amamentar. IMITREX 25mg passa para o leite materno e pode prejudicar o bebê. Converse com seu médico sobre a melhor maneira de alimentar seu bebê se você tomar IMITREX.
Informe o seu médico sobre todos os medicamentos que toma, incluindo medicamentos prescritos e não prescritos, vitaminas e suplementos de ervas.
IMITREX e alguns outros medicamentos podem afetar uns aos outros, causando efeitos colaterais graves.
Informe especialmente o seu médico se toma medicamentos antidepressivos chamados:
- inibidores seletivos da recaptação da serotonina (ISRSs)
- inibidores da recaptação da serotonina norepinefrina (SNRIs)
- antidepressivos tricíclicos (ADTs)
- inibidores da monoamina oxidase (IMAOs)
Peça ao seu médico ou farmacêutico uma lista desses medicamentos se não tiver certeza.
Conheça os medicamentos que você toma. Mantenha uma lista deles para mostrar ao seu médico ou farmacêutico quando receber um novo medicamento.
Como devo tomar IMITREX 100mg?
- Certas pessoas devem tomar sua primeira dose de IMITREX 25mg no consultório de seu médico ou em outro ambiente médico. Pergunte ao seu médico se você deve tomar sua primeira dose em um ambiente médico.
- Use IMITREX 50mg exatamente como seu médico lhe disse para usá-lo.
- Seu médico pode alterar sua dose. Não altere sua dose sem primeiro falar com seu médico.
- Para adultos, a dose usual é uma única injeção administrada logo abaixo da pele.
- Você deve administrar uma injeção assim que os sintomas de sua dor de cabeça começarem, mas ela pode ser administrada a qualquer momento durante uma crise de enxaqueca ou cefaleia em salvas.
- Se você não obteve nenhum alívio após a primeira injeção, não dê uma segunda injeção sem primeiro falar com seu médico.
- Se a dor de cabeça voltar ou você só sentir algum alívio após a primeira injeção, você pode tomar uma segunda injeção 1 hora após a primeira injeção, mas não antes.
- Não tome mais de 12 mg em um período de 24 horas.
- Se você usar muito IMITREX 25mg, ligue para o seu médico ou dirija-se imediatamente ao pronto-socorro do hospital mais próximo.
- Você deve anotar quando tem dores de cabeça e quando toma IMITREX para que possa conversar com seu médico sobre como IMITREX 25mg está funcionando para você.
O que devo evitar ao tomar IMITREX?
IMITREX pode causar tontura, fraqueza ou sonolência. Se você tiver esses sintomas, não dirija, use máquinas ou faça qualquer coisa em que precise estar alerta.
Quais são os possíveis efeitos colaterais do IMITREX 25mg?
IMITREX pode causar efeitos colaterais graves. Consulte “Quais são as informações mais importantes que devo saber sobre o IMTREX?”
Esses efeitos colaterais graves incluem:
- alterações na cor ou sensação nos dedos das mãos e dos pés (síndrome de Raynaud)
- problemas estomacais e intestinais (eventos isquêmicos gastrointestinais e colônicos). Os sintomas de eventos isquêmicos gastrointestinais e colônicos incluem:
- dor de estômago súbita ou grave
- dor de estômago após as refeições
- perda de peso
- náusea ou vômito
- constipação ou diarréia
- diarreia sanguinolenta
- febre
- problemas com a circulação sanguínea nas pernas e pés (isquemia vascular periférica). Os sintomas de isquemia vascular periférica incluem:
- cãibras e dor nas pernas ou quadris
- sensação de peso ou aperto nos músculos das pernas
- dor ardente ou dolorosa nos pés ou dedos dos pés enquanto descansa
- dormência, formigamento ou fraqueza nas pernas
- sensação de frio ou mudanças de cor em 1 ou ambas as pernas ou pés
- urticária (comichão); inchaço da sua língua, boca ou garganta
- dores de cabeça por uso excessivo de medicamentos. Algumas pessoas que usam muitas injeções de IMITREX 100mg podem ter dores de cabeça piores (cefaleia por uso excessivo de medicamentos). Se suas dores de cabeça piorarem, seu médico pode decidir interromper seu tratamento com imitrex.
- síndrome serotoninérgica. A síndrome serotoninérgica é um problema raro, mas sério, que pode ocorrer em pessoas que usam IMITREX, especialmente se IMITREX 50mg for usado com medicamentos antidepressivos chamados SSRIs ou SNRIs. Ligue para o seu médico imediatamente se tiver algum dos seguintes sintomas da síndrome da serotonina:
- alterações mentais, como ver coisas que não existem (alucinações), agitação ou coma
- batimento cardíaco rápido
- alterações na pressão arterial
- alta temperatura corporal
- músculos tensos
- dificuldade para andar
- convulsões. Ocorreram convulsões em pessoas que tomaram IMITREX que nunca tiveram convulsões antes. Converse com seu médico sobre sua chance de ter convulsões enquanto estiver tomando IMITREX.
Os efeitos colaterais mais comuns da injeção de imitrex 50mg incluem:
- dor ou vermelhidão no local da injeção
- formigamento ou dormência nos dedos das mãos ou dos pés
- tontura
- sensação de calor, calor e queimação no rosto (rubor)
- desconforto ou rigidez no pescoço
- sentindo-se fraco, sonolento ou cansado
Informe o seu médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do imitrex. Para mais informações, pergunte ao seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
Como devo armazenar IMITREX Injetável?
- Armazene MITREX entre 36°F a 86°F (2°C a 30°C).
- Guarde o seu medicamento ao abrigo da luz.
- Mantenha o medicamento na embalagem ou estojo de transporte fornecido com ele.
Mantenha IMITREX e todos os medicamentos fora do alcance das crianças.
Informações gerais sobre o uso seguro e eficaz de IMITREX
Às vezes, os medicamentos são prescritos para outros fins que não os listados nos folhetos de informações ao paciente. Não use IMITREX para uma condição para a qual não foi prescrito. Não dê IMITREX 25mg a outras pessoas, mesmo que tenham os mesmos sintomas que você. Pode prejudicá-los.
Este folheto informativo do paciente resume as informações mais importantes sobre o IMTREX. Se você quiser mais informações, converse com seu médico. Você pode pedir ao seu médico ou farmacêutico informações sobre IMTREX que foram escritas para profissionais de saúde.
Para obter mais informações, acesse www.gsk.com ou ligue para 1-888-825-5249.
Quais são os ingredientes da injeção de IMTREX?
Princípio ativo: succinato de sumatriptano
Ingredientes inativos: cloreto de sódio, água para injeção
Estas Informações ao Paciente e Instruções de Uso foram aprovadas pela Food and Drug Administration dos EUA.
Instruções de uso do paciente
Sistema de dose IMTREX STAT
Leia estas Instruções de Uso do Paciente antes de começar a usar o Sistema IMTREX STATdose. Pode haver novas informações. Esta informação não substitui a conversa com seu médico sobre sua condição médica ou tratamento. Você e seu médico devem conversar sobre IMITREX 25mg Injetável quando começar a tomá-lo e em exames regulares.
Mantenha o Sistema IMITREX STATdose fora do alcance das crianças.
Antes de usar o sistema IMTREX STATdose
Quando você abre pela primeira vez a caixa do Sistema IMITREX 25mg STATdose, o Cartridge Pack e a IMITREX STATdose Pen® já estão no estojo de transporte para sua conveniência.
O cinza e o azul Maleta é usado para armazenar a caneta descarregada e o cartucho de cartucho quando não estiverem sendo usados.
o Pacote de cartuchos comporta 2 selados individualmente Cartuchos de Seringa Cada Cartucho de Seringa contém 1 dose de Injeção de IMITREX® (succinato de sumatriptano). A embalagem do cartucho para a dosagem de 4 mg deste medicamento é amarela e a embalagem do cartucho para a dosagem de 6 mg é azul (como mostrado). Pacotes de cartuchos de recarga estão disponíveis.
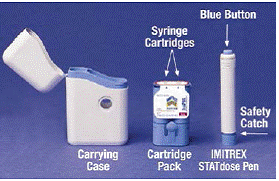
O cinza e o azul Caneta é usado para injetar automaticamente 1 dose de medicamento de um cartucho de seringa. Não toque no Botão Azul até ter pressionado a caneta contra a pele para administrar uma dose. Se você pressioná-lo em qualquer outro momento, poderá perder uma dose. o Trava de segurança impede que a caneta dispare acidentalmente até que você esteja pronto. A Caneta só funcionará quando você deslizar a parte cinza do barril até a parte azul. Certifique-se sempre de que a haste de escorva branca não está saindo da extremidade da caneta (como mostrado na Figura B) antes de carregar um novo cartucho de seringa. Se estiver saindo, você perderá essa dose.
Como carregar a caneta IMTREX STATdose
Não carregue a caneta até que esteja pronto para administrar uma injeção. Não toque no botão azul na parte superior da caneta (consulte a Figura A) enquanto estiver carregando a caneta.
Figura A 
Figura B 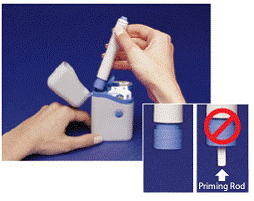
1. Abra a tampa do estojo de transporte. Os selos invioláveis sobre os 2 Cartuchos de Seringa são rotulados como “A” e “B” (consulte Figura A inserida ).
Sempre use o cartucho de seringa marcado com “A” antes do marcado com “B” para ajudá-lo a controlar suas doses. Não use se um dos selos estiver quebrado ou faltando ao abrir o estojo de transporte pela primeira vez.
2. Rasgue um dos selos invioláveis (consulte Figura A ). Jogue fora o selo. Abra a tampa sobre o cartucho de seringa.
3. Segure a caneta pelas saliências na parte superior. Retire a caneta do estojo de transporte (consulte Figura B ).
Certifique-se de que o Priming Rod branco não está saindo da extremidade inferior da caneta (consulte Figura B inserida ). Se estiver saindo, coloque a caneta de volta no estojo de transporte e pressione com firmeza até sentir um clique. Retire a caneta do estojo de transporte.
Figura C 
4. Coloque a caneta na embalagem do cartucho. Gire-o para a direita (sentido horário) até que não gire mais (cerca de meia volta) (consulte Figura C ).
5. Segure a caneta carregada pelas saliências e puxe-a para fora (consulte Figura D ). Pode ser necessário puxar com força a caneta, mas isso é normal. Não pressione o botão azul ainda.
Figura D 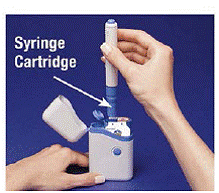
A caneta agora está pronta para uso. Não faça coloque a caneta carregada de volta no estojo de transporte porque isso danificará a agulha.
Como utilizar a caneta doseadora IMTREX STAT para tomar o seu medicamento
Antes de injetar o seu medicamento, escolha uma área com uma camada de tecido adiposo (ver Figura E ou Figura F). Pergunte ao seu médico se tiver dúvidas sobre onde injetar seu medicamento.
Para preparar a área da pele onde IMITREX deve ser injetado, limpe o local da injeção com um algodão embebido em álcool. Não toque novamente nesta área antes de aplicar a injeção.
Figura E ou Figura F Figura G 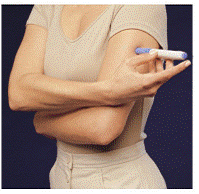
6. Sem pressionar o botão azul, pressione a caneta carregada firmemente contra a pele para que o cilindro cinza deslize para baixo em direção à seção azul que segura o cartucho de seringa (consulte Figura D ). (Isso libera a trava de segurança que impede que a caneta dispare por engano até que você esteja pronto.)
7. Pressione o botão azul. Mantenha a caneta parada por pelo menos 5 segundos . Se a caneta for retirada da pele muito cedo, nem todo o medicamento sairá.
8 Após 5 segundos , retire cuidadosamente a caneta da sua pele. A agulha estará aparecendo (veja Figura G ). Não toque na agulha.
Como descarregar a caneta doseadora IMTREX STAT após tomar o seu medicamento
Logo após tomar uma dose com a caneta, você precisa devolver o cartucho de seringa usado à embalagem do cartucho.
Figura H Figura I e Figura J 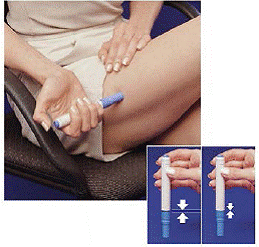
9. Empurre a caneta para baixo no lado vazio da embalagem do cartucho o máximo possível (consulte Figura H ).
10. Gire a caneta para a esquerda (sentido anti-horário) cerca de meia volta até que ela seja liberada do cartucho de seringa (consulte Figura I ).
11. Retire a caneta vazia da embalagem do cartucho (consulte Figura J ).
Como a caneta já foi usada, o Priming Rod branco ficará para fora da extremidade inferior da caneta (consulte Figura J ).
12. Feche a tampa do Cartridge Pack sobre o cartucho de seringa usado. Quando os cartuchos de seringa usados são inseridos corretamente, o cartucho de cartucho é um estojo protetor descartável para ajudá-lo a evitar picadas de agulha e usar as seringas corretamente.
13. Coloque a caneta de volta no estojo de transporte e pressione-a com firmeza até ouvir um clique. Feche a tampa do estojo de transporte. Isso deixa a caneta pronta para o próximo uso.
Se a tampa não fechar, empurre a caneta para baixo até sentir um clique. Em seguida, feche a tampa.
Como retirar uma embalagem de cartucho usada
Depois que ambos os cartuchos de seringa forem usados, retire o pacote de cartuchos do estojo de transporte. Nunca reutilize ou recicle um cartucho de seringa.
Figura K Figura L 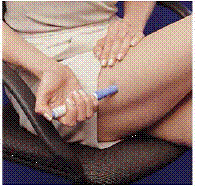
14. Abra a tampa do estojo de transporte.
15. Segure o estojo de transporte com uma mão e pressione os 2 botões em cada lado do estojo de transporte (consulte Figura K ).
16. Puxe cuidadosamente a embalagem do cartucho com a outra mão (consulte Figura L ).
17. Deite fora o Cartridge Pack ou elimine-o conforme indicado pelo seu prestador de cuidados de saúde. Pode haver leis estaduais e locais especiais para o descarte de agulhas e seringas usadas. Mantenha sempre fora do alcance das crianças.
Como inserir um novo pacote de cartuchos
Figura M Figura N e Figura O 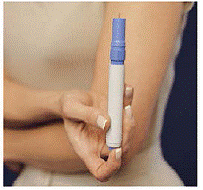
18. Retire o novo Cartridge Pack da caixa. Não retire os selos invioláveis (ver Figura M).
19. Coloque o pacote de cartuchos no estojo de transporte. Deslize-o suavemente (consulte Figura N ).
20. O Cartucho se encaixará no lugar quando os 2 botões aparecerem através dos orifícios do estojo de transporte (consulte Figura O ). Feche a tampa.
Estas Informações ao Paciente e Instruções de Uso foram aprovadas pela Food and Drug Administration dos EUA.
