Imuran 50mg, 25mg Azathioprine Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Imuran e como é usado?
Imuran 25mg é um medicamento de prescrição usado para tratar os sintomas da Artrite Reumatóide e como prevenção da rejeição de transplantes. Imuran pode ser usado sozinho ou com outros medicamentos.
Imuran 25mg pertence a uma classe de medicamentos chamados DMARDs, Imunomoduladores; Imunossupressores.
Quais são os possíveis efeitos colaterais do Imuran?
Imuran 25mg pode causar efeitos colaterais graves, incluindo:
- febre,
- glândulas inchadas,
- dores no corpo,
- suor noturno,
- não se sentindo bem,
- pele pálida,
- irritação na pele,
- hematomas ou sangramentos fáceis,
- mãos e pés frios,
- tontura,
- falta de ar,
- dor na parte superior do estômago que pode se espalhar para o ombro,
- sentindo-se cheio depois de comer apenas uma pequena quantidade,
- perda de peso,
- sinais de infecção (febre, calafrios, fraqueza, sintomas de gripe, dor de garganta, tosse, dor ou ardor ao urinar),
- náusea intensa,
- vômito,
- diarréia,
- batimentos cardíacos rápidos,
- urina escura e
- amarelecimento da pele ou dos olhos (icterícia)
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns de Imuran 50mg incluem:
- náusea,
- diarréia,
- dor de estômago,
- queda de cabelo e
- erupção cutânea
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Imuran. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
AVISO
MALIGNIDADE
A imunossupressão crônica com IMURAN, um antimetabólito de purina, aumenta o risco de malignidade em humanos. Relatos de malignidade incluem linfoma pós-transplante e linfoma hepatoesplênico de células T (HSTCL) em pacientes com doença inflamatória intestinal. Os médicos que usam este medicamento devem estar muito familiarizados com esse risco, bem como com o potencial mutagênico para homens e mulheres e com possíveis toxicidades hematológicas. Os médicos devem informar os pacientes sobre o risco de malignidade com IMURAN. Ver AVISOS .
DESCRIÇÃO
IMURAN (azatioprina), um antimetabólito imunossupressor, está disponível em forma de comprimido para administração oral. Cada comprimido sulcado contém 50 mg de azatioprina e os ingredientes inativos lactose, estearato de magnésio, amido de batata, povidona e ácido esteárico.
A azatioprina é quimicamente 6-[(1-metil-4-nitro-1H-imidazol-5-il)tio]-1H-purina. A fórmula estrutural da azatioprina é:
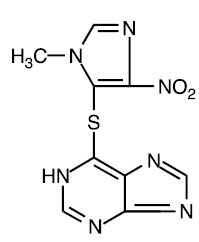
É um derivado imidazolil da 6-mercaptopurina e muitos de seus efeitos biológicos são semelhantes aos do composto original.
A azatioprina é insolúvel em água, mas pode ser dissolvida com a adição de um equivalente molar de álcali. A azatioprina é estável em solução em pH neutro ou ácido, mas a hidrólise em mercaptopurina ocorre em excesso de hidróxido de sódio (0,1N), especialmente sob aquecimento. A conversão em mercaptopurina também ocorre na presença de compostos sulfidrila, como cisteína, glutationa e sulfeto de hidrogênio.
INDICAÇÕES
IMURAN é indicado como adjuvante na prevenção da rejeição no homotransplante renal. Também é indicado para o tratamento da artrite reumatóide ativa para reduzir os sinais e sintomas.
Homotransplante renal
IMURAN é indicado como adjuvante na prevenção da rejeição no homotransplante renal. A experiência com mais de 16.000 transplantes mostra uma sobrevida do paciente em 5 anos de 35% a 55%, mas isso depende do doador, correspondência para antígenos HLA, anticorpo antidoador ou anti-aloantígeno de células B e outras variáveis. O efeito de IMURAN nessas variáveis não foi testado em estudos controlados.
Artrite reumatoide
IMURAN é indicado para o tratamento da artrite reumatóide (AR) ativa para reduzir os sinais e sintomas. Aspirina, anti-inflamatórios não esteróides e/ou glicocorticóides em baixas doses podem ser continuados durante o tratamento com IMURAN. O uso combinado de IMURAN 25mg com medicamentos antirreumáticos modificadores da doença (DMARDs) não foi estudado para benefício adicional ou efeitos adversos inesperados. O uso de IMURAN com esses agentes não pode ser recomendado.
DOSAGEM E ADMINISTRAÇÃO
O TESTE TPMT NÃO PODE SUBSTITUIR O MONITORAMENTO DE CONTAGEM SANGUÍNEA COMPLETA (CBC) EM PACIENTES QUE RECEBEM IMURAN. genotipagem ou fenotipagem de TPMT pode ser usada para identificar pacientes com atividade de TPMT ausente ou reduzida. Pacientes com atividade de TPMT baixa ou ausente têm um risco aumentado de desenvolver mielotoxicidade grave com risco de vida de IMURAN se as doses convencionais forem administradas. Os médicos podem considerar terapias alternativas para pacientes com atividade de TPMT baixa ou ausente (homozigotos para alelos não funcionais). IMURAN 25mg deve ser administrado com cautela a pacientes com um alelo não funcional (heterozigotos) que estejam em risco de atividade reduzida de TPMT que pode levar à toxicidade se forem administradas doses convencionais. A redução da dose é recomendada em pacientes com atividade de TPMT reduzida. A descontinuação precoce do medicamento pode ser considerada em pacientes com resultados anormais de hemograma que não respondem à redução da dose.
Homotransplante renal
dose de IMURAN 50mg necessária para prevenir a rejeição e minimizar a toxicidade irá variar de acordo com cada paciente; isso requer uma gestão cuidadosa. A dose inicial é geralmente de 3 a 5 mg/kg por dia, começando no momento do transplante. IMURAN é geralmente administrado em dose única diária no dia e em uma minoria de casos 1 a 3 dias antes do transplante. A redução da dose para níveis de manutenção de 1 a 3 mg/kg por dia é geralmente possível. A dose de IMURAN 50mg não deve ser aumentada para níveis tóxicos devido à ameaça de rejeição. A descontinuação pode ser necessária para toxicidade hematológica grave ou outra, mesmo que a rejeição do homoenxerto possa ser consequência da retirada do medicamento.
Artrite reumatoide
IMURAN 50mg é geralmente administrado diariamente. A dose inicial deve ser de aproximadamente 1,0 mg/kg (50 a 100 mg) administrada em dose única ou duas vezes ao dia. A dose pode ser aumentada, começando em 6 a 8 semanas e, posteriormente, em intervalos de 4 semanas, se não houver toxicidade grave e se a resposta inicial for insatisfatória. Os incrementos de dose devem ser de 0,5 mg/kg por dia, até uma dose máxima de 2,5 mg/kg por dia. A resposta terapêutica ocorre após várias semanas de tratamento, geralmente 6 a 8; um ensaio adequado deve ter um mínimo de 12 semanas. Pacientes que não melhoraram após 12 semanas podem ser considerados refratários. IMURAN 50mg pode ser continuado a longo prazo em pacientes com resposta clínica, mas os pacientes devem ser monitorados cuidadosamente, e a redução gradual da dose deve ser tentada para reduzir o risco de toxicidades.
terapia de manutenção deve ser na dose eficaz mais baixa, e a dose administrada pode ser diminuída de forma decrescente com alterações de 0,5 mg/kg ou aproximadamente 25 mg diariamente a cada 4 semanas, enquanto a outra terapia é mantida constante. A duração ideal da manutenção de IMURAN 50mg não foi determinada. IMURAN pode ser descontinuado abruptamente, mas efeitos retardados são possíveis.
Uso em Disfunção Renal
Pacientes relativamente oligúricos, especialmente aqueles com necrose tubular no período imediato pós-transplante cadavérico, podem apresentar retardo na depuração de IMURAN ou de seus metabólitos, podem ser particularmente sensíveis a esse medicamento e geralmente recebem doses menores.
Devem ser considerados os procedimentos para o manuseio e descarte adequados deste medicamento antimetabólito imunossupressor. Várias diretrizes sobre esse assunto foram publicadas.25-31 Não há um consenso geral de que todos os procedimentos recomendados nas diretrizes sejam necessários ou apropriados.
COMO FORNECIDO
50 mg comprimidos sobrepostos em forma de círculo, amarelos a esbranquiçados, com ranhuras impressas com “IMURAN” e “50” em cada comprimido; garrafa de 100 ( NDC 65483-590-10).
Armazenar de 15° a 25°C (59° a 77°F) em local seco e protegido da luz.
REFERÊNCIAS
25. Recomendações para manuseio seguro de drogas antineoplásicas parenterais. Washington, DC: Divisão de Segurança; Departamento de Farmácia do Centro Clínico e Serviços de Enfermagem Oncológica, Instituto Nacional de Saúde; 1992. Departamento de Saúde e Serviços Humanos dos EUA. Publicação do Serviço de Saúde Pública NIH 92-2621.
26. Conselho de Assuntos Científicos da AMA. Diretrizes para manuseio de antineoplásicos parenterais. JAMA. 1985; 253:15901592.
27. Comissão Nacional de Estudos sobre Exposição Citotóxica. Recomendações para manuseio de agentes citotóxicos. 1987. Disponível de Louis P. Jeffrey, Presidente, Comissão Nacional de Estudo sobre Exposição Citotóxica. Massachusetts College of Pharmacy and Allied Health Sciences, 179 Longwood Avenue, Boston, MA 02115.
28. Sociedade Oncológica Clínica da Austrália. Diretrizes e recomendações para manuseio seguro de agentes antineoplásicos. Med J Aust. 1983; 1:426-428.
29. Jones RB, Frank R, Mass T. Manuseio seguro de agentes quimioterápicos: um relatório do The Mount Sinai Medical Center. CA Cancer J para Clínicos. 1983; 33:258-263.
30. Sociedade Americana de Farmacêuticos Hospitalares. Boletim de assistência técnica ASHP sobre manuseio de drogas citotóxicas e perigosas. Am J Hosp Pharm. 1990; 47:1033-1049.
31. Yodaiken RE, Bennett D. Diretrizes de Práticas de Trabalho da OSHA para o pessoal que lida com drogas citotóxicas (antineoplásicas). Am J Hosp Pharm, 1996; 43:1193-1204.
Fabricado pela Pharmaceutics International, Inc. Hunt Valley, MD 21031 para Prometheus Laboratories Inc. San Diego, CA 92121. Revisado: fevereiro de 2014
EFEITOS COLATERAIS
Os principais e potencialmente graves efeitos tóxicos de IMURAN são hematológicos e gastrointestinais. Os riscos de infecção secundária e malignidade também são significativos (ver AVISOS ). A frequência e gravidade das reações adversas dependem da dose e duração de IMURAN, bem como da doença subjacente do paciente ou das terapias concomitantes. A incidência de toxicidades hematológicas e neoplasias encontradas em grupos de receptores de homoenxerto renal é significativamente maior do que em estudos empregando IMURAN 25mg para artrite reumatóide. As incidências relativas em estudos clínicos estão resumidas abaixo:
Hematologico
Leucopenia e/ou trombocitopenia são dose-dependentes e podem ocorrer tardiamente no curso da terapia com IMURAN. A redução da dose ou suspensão temporária pode resultar na reversão dessas toxicidades. A infecção pode ocorrer como manifestação secundária de supressão da medula óssea ou leucopenia, mas a incidência de infecção no homotransplante renal é 30 a 60 vezes maior que na artrite reumatóide. Foram relatadas anemias, incluindo anemia macrocítica e/ou sangramento.
genotipagem ou fenotipagem de TPMT pode ajudar a identificar pacientes com atividade de TPMT baixa ou ausente (homozigotos para alelos não funcionais) que apresentam risco aumentado de mielossupressão grave e com risco de vida por IMURAN. Ver FARMACOLOGIA CLÍNICA , AVISOS e PRECAUÇÕES : Testes laboratoriais . Morte associada à pancitopenia foi relatada em pacientes com atividade de TPMT ausente recebendo azatioprina.6,20
Gastrointestinal
Náuseas e vômitos podem ocorrer nos primeiros meses de terapia com IMURAN 50mg e ocorreram em aproximadamente 12% dos 676 pacientes com artrite reumatóide. A frequência de distúrbios gástricos muitas vezes pode ser reduzida pela administração do fármaco em doses divididas e/ou após as refeições. No entanto, em alguns pacientes, náuseas e vômitos podem ser graves e podem ser acompanhados por sintomas como diarreia, febre, mal-estar e mialgias (ver PRECAUÇÕES ). Vômitos com dor abdominal podem ocorrer raramente com pancreatite de hipersensibilidade. Sabe-se que a hepatotoxicidade manifestada pela elevação da fosfatase alcalina sérica, bilirrubina e/ou transaminases séricas ocorre após o uso de azatioprina, principalmente em receptores de aloenxertos. A hepatotoxicidade tem sido incomum (menos de 1%) em pacientes com artrite reumatóide. A hepatotoxicidade após o transplante ocorre mais frequentemente dentro de 6 meses após o transplante e geralmente é reversível após a interrupção de IMURAN. Uma doença veno-oclusiva hepática rara, mas com risco de vida, associada à administração crônica de azatioprina foi descrita em pacientes transplantados e em um paciente recebendo IMURAN para panuveíte.21,22,23 A medição periódica das transaminases séricas, fosfatase alcalina e bilirrubina é indicado para detecção precoce de hepatotoxicidade. Se houver suspeita clínica de doença veno-oclusiva hepática, IMURAN deve ser descontinuado permanentemente.
Outros
Efeitos colaterais adicionais de baixa frequência foram relatados. Estes incluem erupções cutâneas, alopecia, febre, artralgias, diarreia, esteatorréia, balanço nitrogenado negativo, pneumonite intersticial reversível, linfoma hepatoesplênico de células T (ver AVISOS – Malignidade ) e Síndrome de Sweet (dermatose neutrofílica febril aguda).
INTERAÇÕES MEDICAMENTOSAS
Use com Alopurinol
Uma das vias de inativação da azatioprina é inibida pelo alopurinol. Pacientes recebendo IMURAN 50mg e alopurinol concomitantemente devem ter uma redução da dose de IMURAN 50mg, para aproximadamente 1/3 a 1/4 da dose usual. Recomenda-se que uma redução adicional da dose ou terapias alternativas sejam consideradas para pacientes com atividade de TPMT baixa ou ausente recebendo IMURAN 50mg e alopurinol porque ambas as vias de inativação de TPMT e XO são afetadas. Ver FARMACOLOGIA CLÍNICA , AVISOS , PRECAUÇÕES : Testes laboratoriais e REAÇÕES ADVERSAS Seções.
Use com Aminossalicilatos
Há evidências in vitro de que derivados de aminossalicilato (por exemplo, sulfassalazina, mesalazina ou olsalazina) inibem a enzima TPMT. O uso concomitante desses agentes com IMURAN 50mg deve ser feito com cautela.
Uso com outros agentes que afetam a mielopoese
Medicamentos que podem afetar a produção de leucócitos, incluindo cotrimoxazol, podem levar a leucopenia exagerada, especialmente em receptores de transplante renal.
Uso com Inibidores da Enzima Conversora de Angiotensina
Foi relatado que o uso de inibidores da enzima conversora de angiotensina para controlar a hipertensão em pacientes em uso de azatioprina induz anemia e leucopenia grave.
Usar com Varfarina
IMURAN pode inibir o efeito anticoagulante da varfarina.
Usar com ribavirina
Foi relatado que o uso de ribavirina para hepatite C em pacientes recebendo azatioprina induz pancitopenia grave e pode aumentar o risco de mielotoxicidade relacionada à azatioprina. A inosina monofosfato desidrogenase (IMDH) é necessária para uma das vias metabólicas da azatioprina. A ribavirina é conhecida por inibir a IMDH, levando ao acúmulo de um metabólito da azatioprina, monofosfato de 6-metiltioionosina (6MTITP), que está associado à mielotoxicidade (neutropenia, trombocitopenia e anemia). Os pacientes que recebem azatioprina com ribavirina devem ter hemogramas completos, incluindo contagem de plaquetas, monitorados semanalmente no primeiro mês, duas vezes ao mês no segundo e terceiro meses de tratamento e, em seguida, mensalmente ou com mais frequência, se a dosagem ou outras alterações na terapia forem necessárias.
REFERÊNCIAS
6. Dados em arquivo, Prometheus Laboratories Inc.
20. Schutz E, Gummert J, Mohr F, Oellerich M. Mielossupressão induzida por azatioprina em pacientes com deficiência de tiopurina metiltransferase transplante de coração. Lanceta. 1993; 341:436.
21. Leia AE, Wiesner RH, LaBrecque DR, et al. Doença veno-oclusiva hepática associada a transplante renal e terapia com azatioprina. Ann Intern Med. 1986; 104:651-655.
22. Katzka DA, Saul SH, Jorkasky D, et al. Azatioprina e doença veno-oclusiva hepática em pacientes transplantados renais. Gastroenterologia. 1986; 90:446-454.
23. Weitz H, Gokel JM, Loeshke K, et al. Doença veno-oclusiva do fígado em pacientes recebendo terapia imunossupressora. Arco de Virchows Um Pathol Anat Histol. 1982; 395:245-256.
AVISOS
Malignidade
Pacientes recebendo imunossupressores, incluindo IMURAN 50mg, apresentam risco aumentado de desenvolver linfoma e outras malignidades, particularmente da pele. Os médicos devem informar os pacientes sobre o risco de malignidade com IMURAN. Como de costume para pacientes com risco aumentado de câncer de pele, a exposição à luz solar e à luz ultravioleta deve ser limitada pelo uso de roupas de proteção e uso de protetor solar com alto fator de proteção.
Pós-transplante
Pacientes transplantados renais são conhecidos por terem um risco aumentado de malignidade, predominantemente câncer de pele e células do retículo ou tumores linfomatosos. O risco de linfomas pós-transplante pode ser aumentado em pacientes que recebem tratamento agressivo com drogas imunossupressoras, incluindo IMURAN. Portanto, a terapia medicamentosa imunossupressora deve ser mantida nos níveis eficazes mais baixos.
Artrite reumatoide
Informações estão disponíveis sobre o risco de malignidade com o uso de IMURAN 50mg na artrite reumatoide (ver REAÇÕES ADVERSAS ). Não foi possível definir o risco preciso de malignidade devido ao IMURAN. Os dados sugerem que o risco pode ser elevado em pacientes com artrite reumatóide, embora menor do que em pacientes com transplante renal. No entanto, leucemia mielóide aguda, bem como tumores sólidos, foram relatados em pacientes com artrite reumatóide que receberam IMURAN.
Doença inflamatória intestinal
Casos pós-comercialização de linfoma hepatoesplênico de células T (HSTCL), um tipo raro de linfoma de células T, foram relatados em pacientes tratados com IMURAN. Esses casos tiveram um curso muito agressivo da doença e foram fatais. A maioria dos casos notificados ocorreu em doentes com doença de Crohn ou colite ulcerosa e a maioria ocorreu em adolescentes e adultos jovens do sexo masculino. Alguns dos pacientes foram tratados com IMURAN como monoterapia e alguns receberam tratamento concomitante com um bloqueador de TNFα no momento ou antes do diagnóstico. A segurança e eficácia de IMURAN 25mg para o tratamento da doença de Crohn e colite ulcerativa não foram estabelecidas.
Citopenias
Leucopenia grave, trombocitopenia, anemias incluindo anemia macrocítica e/ou pancitopenia podem ocorrer em pacientes em tratamento com IMURAN. Supressão grave da medula óssea também pode ocorrer. Pacientes com atividade intermediária de tiopurina S-metil transferase (TPMT) podem apresentar risco aumentado de mielotoxicidade se receberem doses convencionais de IMURAN. Pacientes com atividade de TPMT baixa ou ausente têm um risco aumentado de desenvolver mielotoxicidade grave e com risco de vida se receberem doses convencionais de IMURAN. A genotipagem ou fenotipagem de TPMT pode ajudar a identificar pacientes com risco aumentado de desenvolver toxicidade de IMURAN 50mg.2-9 (Consulte PRECAUÇÕES : Testes laboratoriais ). As toxicidades hematológicas são dose-dependentes e podem ser mais graves em pacientes transplantados renais cujo homoenxerto está sendo rejeitado. Sugere-se que os pacientes em uso de IMURAN tenham hemogramas completos, incluindo contagem de plaquetas, semanalmente durante o primeiro mês, duas vezes por mês durante o segundo e terceiro meses de tratamento, depois mensalmente ou com maior frequência se forem necessárias alterações de dosagem ou outras alterações na terapia. Pode ocorrer supressão hematológica tardia. A redução imediata da dosagem ou a suspensão temporária do medicamento pode ser necessária se houver uma queda rápida ou uma contagem de leucócitos persistentemente baixa, ou outra evidência de depressão da medula óssea. A leucopenia não se correlaciona com o efeito terapêutico; portanto, a dose não deve ser aumentada intencionalmente para diminuir a contagem de glóbulos brancos.
Infecções graves
Pacientes recebendo imunossupressores, incluindo Imuran 25mg, apresentam risco aumentado de infecções bacterianas, virais, fúngicas, protozoárias e oportunistas, incluindo reativação de infecções latentes. Essas infecções podem levar a resultados graves, incluindo fatais.
Leucoencefalopatia Multifocal Progressiva
Casos de infecção associada ao vírus JC resultando em leucoencefalopatia multifocal progressiva (LMP), às vezes fatal, foram relatados em pacientes tratados com imunossupressores, incluindo Imuran. Os fatores de risco para LMP incluem tratamento com terapias imunossupressoras e comprometimento da função imunológica. Considerar o diagnóstico de LMP em qualquer paciente que apresente manifestações neurológicas de início recente e considerar a consulta com um neurologista conforme indicação clínica. Considere reduzir a quantidade de imunossupressão em pacientes que desenvolvem LMP. Em pacientes transplantados, considere o risco que a imunossupressão reduzida representa para o enxerto.
Efeito sobre o esperma em animais
Foi relatado que IMURAN causa depressão temporária na espermatogênese e redução na viabilidade do esperma e na contagem de esperma em camundongos em doses 10 vezes a dose terapêutica humana;10 ocorreu uma porcentagem reduzida de acasalamentos férteis quando os animais receberam 5 mg/kg.11
Gravidez
Gravidez Categoria D
IMURAN pode causar dano fetal quando administrado a mulheres grávidas. IMURAN 50mg não deve ser administrado durante a gravidez sem uma ponderação cuidadosa do risco versus benefício. Sempre que possível, o uso de IMURAN em pacientes grávidas deve ser evitado. Este medicamento não deve ser usado no tratamento da artrite reumatóide em mulheres grávidas.12
IMURAN é teratogênico em coelhos e camundongos quando administrado em doses equivalentes à dose humana (5 mg/kg diariamente). As anormalidades incluíam malformações esqueléticas e anomalias viscerais.11
Anormalidades imunológicas e outras limitadas ocorreram em alguns bebês nascidos de receptores de aloenxerto renal em IMURAN. Em um relato de caso detalhado,13 linfopenia documentada, níveis diminuídos de IgG e IgM, infecção por CMV e uma sombra tímica diminuída foram observados em uma criança nascida de uma mãe que recebeu 150 mg de azatioprina e 30 mg de prednisona diariamente durante toda a gravidez. Em 10 semanas, a maioria dos recursos foram normalizados. DeWitte et al relataram pancitopenia e deficiência imunológica grave em um bebê prematuro cuja mãe recebeu 125 mg de azatioprina e 12,5 mg de prednisona diariamente.14 Houve dois relatos publicados de achados físicos anormais. Williamson e Karp descreveram um bebê nascido com polidactilia pré-axial cuja mãe recebeu 200 mg de azatioprina diariamente e 20 mg de prednisona em dias alternados durante a gravidez. talipes equinovarus. O pai estava em terapia prolongada com azatioprina.16
benefício versus risco deve ser ponderado cuidadosamente antes do uso de IMURAN em pacientes com potencial reprodutivo. Não existem estudos adequados e bem controlados em mulheres grávidas. Se este medicamento for usado durante a gravidez ou se a paciente engravidar enquanto estiver tomando este medicamento, a paciente deve ser informada do risco potencial para o feto. As mulheres em idade fértil devem ser aconselhadas a evitar engravidar.
PRECAUÇÕES
Em geral
Foi relatada uma reação de hipersensibilidade gastrointestinal caracterizada por náuseas e vômitos graves. Esses sintomas também podem ser acompanhados por diarreia, erupção cutânea, febre, mal-estar, mialgias, elevação das enzimas hepáticas e, ocasionalmente, hipotensão. Os sintomas de toxicidade gastrointestinal geralmente se desenvolvem nas primeiras semanas de terapia com IMURAN 25mg e são reversíveis com a descontinuação do medicamento. A reação pode ocorrer dentro de horas após a reexposição com uma dose única de IMURAN.
Testes laboratoriais
Monitoramento de hemograma completo (CBC)
Pacientes em tratamento com IMURAN 25mg devem ter hemogramas completos, incluindo contagem de plaquetas, semanalmente durante o primeiro mês, duas vezes por mês durante o segundo e terceiro meses de tratamento, depois mensalmente ou mais frequentemente se forem necessárias alterações de dosagem ou outras alterações na terapia.
Teste TPMT
Recomenda-se a consideração de pacientes com genótipo ou fenótipo para TPMT. Os métodos de fenotipagem e genotipagem estão comercialmente disponíveis. Os alelos não funcionais mais comuns associados a níveis reduzidos de atividade de TPMT são TPMT*2, TPMT*3A e TPMT*3C. Pacientes com dois alelos não funcionais (homozigotos) têm atividade de TPMT baixa ou ausente e aqueles com um alelo não funcional (heterozigotos) têm atividade intermediária. Resultados precisos de fenotipagem (atividade de TPMT de glóbulos vermelhos) não são possíveis em pacientes que receberam transfusões de sangue recentes. O teste de TPMT também pode ser considerado em pacientes com resultados anormais de hemograma que não respondem à redução da dose. A descontinuação precoce do medicamento nesses pacientes é aconselhável. O TESTE TPMT NÃO PODE SUBSTITUIR O MONITORAMENTO DE CONTAGEM SANGUÍNEA COMPLETA (CBC) EM PACIENTES QUE RECEBEM IMURAN. Ver FARMACOLOGIA CLÍNICA , AVISOS , REAÇÕES ADVERSAS e DOSAGEM E ADMINISTRAÇÃO Seções.
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Ver AVISOS seção.
Gravidez
Efeitos teratogênicos
Gravidez Categoria D. Ver AVISOS seção.
Mães que amamentam
uso de IMURAN 25mg em lactantes não é recomendado. A azatioprina ou seus metabólitos são transferidos em níveis baixos, tanto por via transplacentária quanto no leite materno.17,18,19 Devido ao potencial de tumorigenicidade demonstrado pela azatioprina, deve-se decidir entre descontinuar a amamentação ou descontinuar o medicamento, levando em consideração a importância do medicamento para a mãe.
Uso Pediátrico
A segurança e eficácia da azatioprina em pacientes pediátricos não foram estabelecidas.
REFERÊNCIAS
2. Weinshilboum R. Farmacogenética da tiopurina: estudos clínicos e moleculares da tiopurina metiltransferase. Droga Metab Dispos. 2001;29:601-605.
3. McLeod HL, Siva C. O locus do gene tiopurina S-metiltransferase --implicações para farmacogenômica clínica. Farmacogenômica. 2002;3:89-98.
4. Anstey A, Lennard L, Mayou SC, et al. Pancitopenia relacionada à azatioprina – uma deficiência enzimática causada por um polimorfismo genético comum: uma revisão. JR Soc Med. 1992; 85:752-756.
5. Stolk JN, Beorbooms AM, de Abreu RA, et al. Redução da atividade da tiopurina metiltransferase e desenvolvimento de efeitos colaterais do tratamento com azatioprina em pacientes com artrite reumatóide. Artrite Reum. 1998; 41:18581866.
6. Dados em arquivo, Prometheus Laboratories Inc.
7. Yates CR, Krynetski EY, Loennechen T, et al. Diagnóstico molecular da deficiência de tiopurina S-metiltransferase: bases genéticas para intolerância à azatioprina e mercaptopurina. Ann Intern Med. 1997; 126:608-614.
8. Black AJ, McLeod HL, Capell HA, et al. O genótipo da tiopurina metiltransferase prevê a toxicidade grave limitante da terapia da azatioprina. Ann Intern Med. 1998; 129:716-718.
9. Clunie GP, Lennard L. Relevância do status da tiopurina metiltransferase em pacientes de reumatologia recebendo azatioprina. Reumatologia. 2004; 43:13-18.
10. Clark JM. A mutagenicidade da azatioprina em camundongos, Drosophila melanogaster e Neurospora crassa. Mut Res. 1975; 28:87-99.
11. Dados em arquivo, Prometheus Laboratories Inc.
12. Tagatz GE, Simmons RL. Gravidez após transplante renal. Ann Intern Med. 1975; 82:113-114. Notas Editoriais.
13. Cote' CJ, Meuwissen HJ, Pickering RJ. Efeitos sobre o recém-nascido de prednisona e azatioprina administrados à mãe durante a gravidez. J Pediatr. 1974; 85:324-328.
14. DeWitte DB, Buick MK, Cyran SE, et al. Pancitopenia neonatal e imunodeficiência combinada grave associada à administração pré-natal de azatioprina e prednisona. J Pediatr. 1984; 105:625-628.
15. Williamson RA, Karp LE. Teratogenicidade da azatioprina: revisão da literatura e relato de caso. Obstet Gynecol. 1981; 58:247-250.
16. Tallent MB, Simmons RL, Najarian JS. Defeitos congênitos em filho de homem receptor de transplante renal. JAMA. 1970; 211: 1854-1855.
17. Dados em arquivo, Prometheus Laboratories Inc.
18. Saarikoski S, Seppälä M. Imunossupressão durante a gravidez: transmissão de azatioprina e seus metabólitos da mãe para o feto. Am J Obstet Gynecol. 1973; 115:1100-1106.
19. Coulam CB, Moyer TP, Jiang NS, et al. Aleitamento materno após transplante renal. Transplante Proc. 1982; 14: 605-609.
SOBREDOSAGEM
As LD50s orais para doses únicas de IMURAN 50mg em camundongos e ratos são 2.500 mg/kg e 400 mg/kg, respectivamente. Doses muito grandes desse antimetabólito podem levar à hipoplasia da medula, sangramento, infecção e morte. Cerca de 30% de IMURAN está ligado às proteínas séricas, mas aproximadamente 45% é removido durante uma hemodiálise de 8 horas.24 Foi relatado um único caso de um paciente de transplante renal que ingeriu uma dose única de 7.500 mg de IMURAN. As reações tóxicas imediatas foram náuseas, vômitos e diarreia, seguidos de leucopenia leve e anormalidades leves na função hepática. A contagem de glóbulos brancos, SGOT e bilirrubina voltaram ao normal 6 dias após a sobredosagem.
CONTRA-INDICAÇÕES
IMURAN 25mg não deve ser administrado a pacientes que demonstraram hipersensibilidade ao medicamento. IMURAN não deve ser usado no tratamento da artrite reumatóide em mulheres grávidas. Pacientes com artrite reumatoide previamente tratados com agentes alquilantes (ciclofosfamida, clorambucil, melfalano ou outros) podem apresentar risco proibitivo de malignidade se tratados com IMURAN.
REFERÊNCIAS
24. Schusziarra V, Ziekursch V, Schlamp R, et ai. Farmacocinética da azatioprina sob hemodiálise. Int J Clin Pharmacol Biopharm. 1976; 14:298-302.
FARMACOLOGIA CLÍNICA
azatioprina é bem absorvida após administração oral. A radioatividade sérica máxima ocorre 1 a 2 horas após a 35S-azatioprina oral e decai com meia-vida de 5 horas. Esta não é uma estimativa da meia-vida da azatioprina em si, mas é a taxa de decaimento para todos os metabólitos contendo 35S da droga. Devido ao extenso metabolismo, apenas uma fração da radioatividade está presente como azatioprina. Doses usuais produzem níveis sanguíneos de azatioprina e de mercaptopurina derivada dela, que são baixos ( SUPERDOSAGEM .
azatioprina é metabolizada em 6-mercaptopurina (6-MP). Ambos os compostos são rapidamente eliminados do sangue e são oxidados ou metilados nos eritrócitos e no fígado; nenhuma azatioprina ou mercaptopurina é detectável na urina após 8 horas. A ativação de 6-mercaptopurina ocorre via hipoxantina-guanina fosforibosiltransferase (HGPRT) e uma série de processos multienzimáticos envolvendo quinases para formar nucleotídeos de 6-tioguanina (6-TGNs) como metabólitos principais (Consulte Esquema de Metabolismo na Figura 1 ). A citotoxicidade da azatioprina deve-se, em parte, à incorporação de 6-TGN no DNA.
6-MP sofre duas principais rotas de inativação (Figura 1). Uma delas é a metilação do tiol, que é catalisada pela enzima tiopurina S-metiltransferase (TPMT), para formar o metabólito inativo metil-6-MP (6-MeMP). A atividade de TPMT é controlada por um polimorfismo genético.1,2,3 Para caucasianos e afro-americanos, aproximadamente 10% da população herda um alelo TPMT não funcional (heterozigoto) conferindo atividade intermediária de TPMT, e 0,3% herda dois TPMT não funcionais alelos (homozigotos) para atividade de TPMT baixa ou ausente. Alelos não funcionais são menos comuns em asiáticos. A atividade de TPMT correlaciona-se inversamente com os níveis de 6-TGN em eritrócitos e presumivelmente em outros tecidos hematopoiéticos, uma vez que essas células têm atividades insignificantes de xantina oxidase (envolvida em outra via de inativação), deixando a metilação de TPMT como a única via de inativação. Pacientes com atividade intermediária de TPMT podem apresentar risco aumentado de mielotoxicidade se receberem doses convencionais de IMURAN. Pacientes com atividade de TPMT baixa ou ausente têm risco aumentado de desenvolver mielotoxicidade grave e com risco de vida se receberem doses convencionais de IMURAN.4-9 A genotipagem ou fenotipagem de TPMT (atividade de TPMT de glóbulos vermelhos) pode ajudar a identificar pacientes que estão em risco de desenvolver toxicidade de IMURAN 25mg.2,3,7,8,9 Resultados precisos de fenotipagem (atividade de TPMT de glóbulos vermelhos) não são possíveis em pacientes que receberam transfusões de sangue recentes. Ver AVISOS , PRECAUÇÕES : INTERAÇÕES MEDICAMENTOSAS , PRECAUÇÕES : Testes laboratoriais e REAÇÕES ADVERSAS Seções.
figura 1 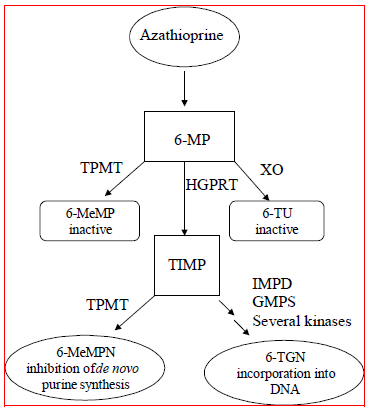 Figura 1. Via de metabolismo da azatioprina: vias concorrentes resultam em inativação por TPMT ou XO, ou incorporação de nucleotídeos citotóxicos no DNA.
Figura 1. Via de metabolismo da azatioprina: vias concorrentes resultam em inativação por TPMT ou XO, ou incorporação de nucleotídeos citotóxicos no DNA.
GMPS: Guanosina monofosfato sintetase; HGPRT: Hipoxantina-guanina-fosforibosil-transferase; IMPD: Inosina monofosfato desidrogenase; MeMP: Metilmercaptopurina; MeMPN: nucleótido de metilmercaptopurina; TGN: nucleótidos de tioguanina; TIMP: Monofosfato de tioinosina; TPMT: Tiopurina S-metiltransferase; TU ácido tiúrico; XO: Xantina oxidase (Adaptado de Pharmacogenomics 2002; 3:89-98; e Cancer Res 2001; 61:5810-5816.)
Outra via de inativação é a oxidação, que é catalisada pela xantina oxidase (XO) para formar ácido 6-tioúrico. A inibição da xantina oxidase em pacientes recebendo alopurinol (ZYLOPRIM®) é a base para a redução da dose de azatioprina necessária nesses pacientes (ver PRECAUÇÕES : INTERAÇÕES MEDICAMENTOSAS ). As proporções de metabólitos são diferentes em pacientes individuais, e isso presumivelmente explica a magnitude e duração variáveis dos efeitos da droga. A depuração renal provavelmente não é importante para prever a eficácia biológica ou toxicidades, embora a redução da dose seja praticada em pacientes com função renal deficiente.
Sobrevivência do Homoenxerto
O uso de azatioprina para inibição da rejeição de homoenxertos renais está bem estabelecido, o(s) mecanismo(s) para esta ação são um tanto obscuros. A droga suprime as hipersensibilidades do tipo mediado por células e causa alterações variáveis na produção de anticorpos. A supressão dos efeitos das células T, incluindo a ablação da supressão das células T, depende da relação temporal com o estímulo antigênico ou enxerto. Este agente tem pouco efeito sobre as rejeições de enxerto estabelecidas ou respostas secundárias.
Alterações nas respostas imunes específicas ou funções imunológicas em receptores de transplante são difíceis de relacionar especificamente com a imunossupressão pela azatioprina. Esses pacientes têm respostas subnormais às vacinas, baixo número de células T e fagocitose anormal pelas células do sangue periférico, mas suas respostas mitogênicas, imunoglobulinas séricas e respostas secundárias de anticorpos geralmente são normais.
Resposta imunoinflamatória
A azatioprina suprime as manifestações da doença, bem como a patologia subjacente em modelos animais de doença autoimune. Por exemplo, a gravidade da artrite adjuvante é reduzida pela azatioprina.
Os mecanismos pelos quais a azatioprina afeta doenças autoimunes não são conhecidos. A azatioprina é imunossupressora, os testes de hipersensibilidade tardia e citotoxicidade celular são suprimidos em maior grau do que as respostas de anticorpos. No modelo de artrite adjuvante em ratos, a azatioprina demonstrou inibir a hiperplasia dos linfonodos, que precede o início dos sinais da doença. Ambos os efeitos imunossupressores e terapêuticos em modelos animais estão relacionados com a dose. A azatioprina é considerada um medicamento de ação lenta e os efeitos podem persistir após a descontinuação do medicamento.
REFERÊNCIAS
1. Lennard L. A farmacologia clínica da 6-mercaptopurina. Eur J Clin Pharmacol. 1992;43:329-339.
2. Weinshilboum R. Farmacogenética da tiopurina: estudos clínicos e moleculares da tiopurina metiltransferase. Droga Metab Dispos. 2001;29:601-605.
3. McLeod HL, Siva C. O locus do gene tiopurina S-metiltransferase --implicações para farmacogenômica clínica. Farmacogenômica. 2002;3:89-98.
4. Anstey A, Lennard L, Mayou SC, et al. Pancitopenia relacionada à azatioprina – uma deficiência enzimática causada por um polimorfismo genético comum: uma revisão. JR Soc Med. 1992; 85:752-756.
5. Stolk JN, Beorbooms AM, de Abreu RA, et al. Redução da atividade da tiopurina metiltransferase e desenvolvimento de efeitos colaterais do tratamento com azatioprina em pacientes com artrite reumatóide. Artrite Reum. 1998; 41:18581866.
6. Dados em arquivo, Prometheus Laboratories Inc.
7. Yates CR, Krynetski EY, Loennechen T, et al. Diagnóstico molecular da deficiência de tiopurina S-metiltransferase: bases genéticas para intolerância à azatioprina e mercaptopurina. Ann Intern Med. 1997; 126:608-614.
8. Black AJ, McLeod HL, Capell HA, et al. O genótipo da tiopurina metiltransferase prevê a toxicidade grave limitante da terapia da azatioprina. Ann Intern Med. 1998; 129:716-718.
9. Clunie GP, Lennard L. Relevância do status da tiopurina metiltransferase em pacientes de reumatologia recebendo azatioprina. Reumatologia. 2004; 43:13-18.
INFORMAÇÃO DO PACIENTE
Os pacientes que iniciaram o tratamento com IMURAN devem ser informados da necessidade de realizar hemogramas periódicos enquanto estiverem recebendo o medicamento e devem ser encorajados a relatar qualquer sangramento ou hematoma incomum ao seu médico. Eles devem ser informados sobre o perigo de infecção durante o tratamento com IMURAN e solicitados a relatar sinais e sintomas de infecção ao seu médico. Instruções cuidadosas de dosagem devem ser dadas ao paciente, especialmente quando IMURAN estiver sendo administrado na presença de insuficiência renal ou concomitantemente com alopurinol (ver INTERAÇÕES MEDICAMENTOSAS subseção e DOSAGEM E ADMINISTRAÇÃO ). As pacientes devem ser avisadas sobre os riscos potenciais do uso de IMURAN 50mg durante a gravidez e durante o período de amamentação. O risco aumentado de malignidade após a terapia com IMURAN deve ser explicado ao paciente.
