Leukeran 2mg, 5mg Chlorambucil Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Leukeran 5mg e como é usado?
Leukeran 5mg é um medicamento de prescrição usado para tratar os sintomas da Leucemia Linfática Crônica (Linfocítica) e Linfoma de Hodgkin. Leukeran 5mg pode ser usado sozinho ou com outros medicamentos.
Leukeran 5mg pertence a uma classe de medicamentos chamados Antineoplásicos, Alquilantes.
Não se sabe se Leukeran é seguro e eficaz em crianças.
Quais são os possíveis efeitos colaterais do Leukeran?
Leukeran pode causar efeitos colaterais graves, incluindo:
- urticária,
- dificuldade para respirar,
- inchaço do rosto, lábios, língua ou garganta,
- convulsões,
- massa ou caroço incomum,
- vómitos ou diarreia graves,
- tosse nova ou agravada,
- contusões fáceis,
- sangramento incomum (nariz, boca, vagina ou reto),
- manchas roxas ou vermelhas sob a pele,
- náusea,
- dor de estômago superior,
- coceira,
- cansaço,
- perda de apetite,
- urina escura,
- fezes cor de barro,
- amarelecimento da pele ou dos olhos (icterícia),
- febre,
- gengivas inflamadas,
- feridas dolorosas na boca,
- dor ao engolir,
- feridas na pele,
- sintomas de resfriado ou gripe,
- tosse,
- Problemas respiratórios,
- dor de garganta,
- dor na pele e
- uma erupção cutânea vermelha ou roxa que se espalha (especialmente no rosto ou na parte superior do corpo) e causa bolhas e descamação
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns de Leukeran incluem:
- febre,
- sangramento, e
- sintomas da gripe
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Leukeran. Para mais informações, consulte seu médico ou farmacêutico.
AVISO
LEUKERAN (clorambucil) pode suprimir severamente a função da medula óssea. Clorambucil é um agente cancerígeno em humanos. O clorambucil é provavelmente mutagênico e teratogênico em humanos. Clorambucil produz infertilidade humana (ver AVISOS E PRECAUÇÕES ).
DESCRIÇÃO
LEUKERAN (clorambucil) foi sintetizado pela primeira vez por Everett et al. É um agente alquilante bifuncional do tipo mostarda nitrogenada que se mostrou ativo contra doenças neoplásicas humanas selecionadas. O clorambucil é conhecido quimicamente como ácido 4-[bis(2-cloretil)amino]benzenobutanoico e tem a seguinte fórmula estrutural:
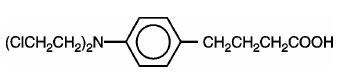
Clorambucil hidrolisa em água e tem um pKa de 5,8.
LEUKERAN (clorambucil) está disponível em forma de comprimido para administração oral. Cada comprimido revestido por película contém 2 mg de clorambucil e os ingredientes inativos dióxido de silício coloidal, hipromelose, lactose (anidra), macrogol/PEG 400, celulose microcristalina, óxido de ferro vermelho, ácido esteárico, dióxido de titânio e óxido de ferro amarelo.
INDICAÇÕES
LEUKERAN (clorambucil) é indicado no tratamento de leucemia linfática crônica (linfocítica), linfomas malignos, incluindo linfossarcoma, linfoma folicular gigante e doença de Hodgkin. Não é curativo em nenhum desses distúrbios, mas pode produzir paliação clinicamente útil.
DOSAGEM E ADMINISTRAÇÃO
dosagem oral usual é de 0,1 a 0,2 mg/kg de peso corporal diariamente por 3 a 6 semanas, conforme necessário. Isso geralmente equivale a 4 a 10 mg por dia para o paciente médio. Toda a dose diária pode ser administrada de uma só vez. Estas dosagens são para o início da terapia ou para cursos curtos de tratamento. A dosagem deve ser cuidadosamente ajustada de acordo com a resposta do paciente e deve ser reduzida assim que houver uma queda abrupta na contagem de leucócitos. Pacientes com doença de Hodgkin geralmente requerem 0,2 mg/kg por dia, enquanto pacientes com outros linfomas ou leucemia linfocítica crônica geralmente requerem apenas 0,1 mg/kg por dia. Quando houver infiltração linfocítica da medula óssea, ou quando a medula óssea estiver hipoplásica, a dose diária não deve exceder 0,1 mg/kg (cerca de 6 mg para o paciente médio).
Esquemas alternativos para o tratamento da leucemia linfocítica crônica empregando doses intermitentes, quinzenais ou uma vez por mês de clorambucil foram relatados. Os esquemas intermitentes de clorambucil começam com uma dose única inicial de 0,4 mg/kg. As doses são geralmente aumentadas em 0,1 mg/kg até que o controle da linfocitose ou toxicidade seja observado. As doses subsequentes são modificadas para produzir toxicidade hematológica leve. Acredita-se que a taxa de resposta da leucemia linfocítica crônica ao esquema quinzenal ou mensal de administração de clorambucil é semelhante ou melhor à relatada anteriormente com administração diária e que a toxicidade hematológica foi menor ou igual à encontrada em estudos usando clorambucil diariamente .
radiação e as drogas citotóxicas tornam a medula óssea mais vulnerável a danos, e o clorambucil deve ser usado com cuidado especial dentro de 4 semanas após um ciclo completo de radioterapia ou quimioterapia. No entanto, pequenas doses de radiação paliativa sobre focos isolados distantes da medula óssea geralmente não deprimem a contagem de neutrófilos e plaquetas. Nestes casos, o clorambucil pode ser administrado na dosagem habitual.
Atualmente, considera-se que cursos curtos de tratamento são mais seguros do que a terapia de manutenção contínua, embora ambos os métodos tenham sido eficazes. Deve-se reconhecer que a terapia contínua pode dar a aparência de “manutenção” em pacientes que estão realmente em remissão e não têm necessidade imediata de mais drogas. Se a dosagem de manutenção for usada, ela não deve exceder 0,1 mg/kg por dia e pode ser tão baixa quanto 0,03 mg/kg por dia. Uma dose de manutenção típica é de 2 mg a 4 mg por dia, ou menos, dependendo do estado das contagens sanguíneas. Pode, portanto, ser desejável retirar a droga após o controle máximo ter sido alcançado, uma vez que a terapia intermitente reinstituída no momento da recaída pode ser tão eficaz quanto o tratamento contínuo.
Devem ser utilizados procedimentos para manuseio e descarte adequados de drogas anticancerígenas. Várias diretrizes sobre esse assunto foram publicadas.1-4 Não há um consenso geral de que todos os procedimentos recomendados nas diretrizes sejam necessários ou apropriados.
Populações Especiais
Insuficiência hepática
Pacientes com insuficiência hepática devem ser cuidadosamente monitorados quanto à toxicidade. Como o clorambucil é metabolizado principalmente no fígado, a redução da dose pode ser considerada em pacientes com insuficiência hepática quando tratados com LEUKERAN. No entanto, não há dados suficientes em pacientes com insuficiência hepática para fornecer uma recomendação de dosagem específica.
COMO FORNECIDO
Leukeran é fornecido na forma de comprimidos redondos, biconvexos, castanhos, revestidos por película, contendo 2 mg de clorambucil em frascos de vidro âmbar com fechos resistentes à abertura por crianças. Um lado é gravado com “GX EG3” e o outro lado é gravado com um “L”.
Garrafa de 25 ( NDC 76388-635-25)
Armazenar na geladeira, 2° a 8°C (36° a 46°F).
REFERÊNCIAS
1. Alerta NIOSH: Prevenção de exposições ocupacionais a antineoplásicos e outras drogas perigosas em ambientes de saúde. 2004. Departamento de Saúde e Serviços Humanos dos EUA, Serviço de Saúde Pública, Centros para Controle e Prevenção de Doenças, Instituto Nacional de Segurança e Saúde Ocupacional, Publicação DHHS (NIOSH) No. 2004-165.
2. Manual Técnico da OSHA, TED 1-0.15A, Seção VI: Capítulo 2. Controle da Exposição Ocupacional a Drogas Perigosas. OSHA, 1999. http://www.osha.gov/dts/osta/otm/otm_vi/otm_vi_2.html
3. Sociedade Americana de Farmacêuticos do Sistema de Saúde. Diretrizes ASHP sobre o manuseio de drogas perigosas. Am J Health-Syst Pharm. (2006) 63:1172-1193.
4. Polovich, M., Branco, JM, & Kelleher, LO (eds.) 2005. Diretrizes de quimioterapia e bioterapia e recomendações para a prática (2ª ed.) Pittsburgh, PA: Oncology Nursing Society.
Fabricado por: Excella GmbH & Co. KG, Feucht, Alemanha. Revisado: março de 2017
EFEITOS COLATERAIS
Para relatar REAÇÕES ADVERSAS SUSPEITAS, entre em contato com a Aspen Global Inc. Toll-Free em 1-855-800-8165 ou FDA em 1-800-FDA-1088 ou www.fda.gov/medwatch.
Hematologico
O efeito colateral mais comum é a supressão da medula óssea, anemia, leucopenia, neutropenia, trombocitopenia ou pancitopenia. Embora a supressão da medula óssea ocorra com frequência, geralmente é reversível se a clorambucil for retirada precocemente. No entanto, foi relatada insuficiência irreversível da medula óssea.
Gastrointestinal
Distúrbios gastrointestinais, como náuseas e vômitos, diarreia e ulceração oral, ocorrem com pouca frequência.
SNC
Tremores, espasmos musculares, mioclonia, confusão, agitação, ataxia, paresia flácida e alucinações foram relatados como reações adversas raras ao clorambucil que se resolvem com a descontinuação do medicamento. Convulsões raras, focais e/ou generalizadas foram relatadas em crianças e adultos tanto em doses terapêuticas diárias quanto em regimes de dosagem de pulso, e em superdosagem aguda (ver PRECAUÇÕES : Em geral ).
Dermatológico
Reações alérgicas como urticária e edema angioneurótico foram relatadas após a administração inicial ou subsequente. Hipersensibilidade cutânea (incluindo relatos raros de erupção cutânea progredindo para eritema multiforme, necrólise epidérmica tóxica e síndrome de Stevens-Johnson) foi relatada (ver AVISOS ).
Diversos
Outras reações adversas relatadas incluem: fibrose pulmonar, hepatotoxicidade e icterícia, febre medicamentosa, neuropatia periférica, pneumonia intersticial, cistite estéril, infertilidade, leucemia e malignidades secundárias (ver AVISOS ).

INTERAÇÕES MEDICAMENTOSAS
Não há interações medicamentosas conhecidas com clorambucil.
AVISOS
Devido às suas propriedades cancerígenas, o clorambucil não deve ser administrado a pacientes com outras condições além da leucemia linfática crônica ou linfomas malignos. Convulsões, infertilidade, leucemia e malignidades secundárias foram observadas quando o clorambucil foi empregado na terapia de doenças malignas e não malignas.
Existem muitos relatos de leucemia aguda surgindo em pacientes com doenças malignas e não malignas após o tratamento com clorambucil. Em muitos casos, esses pacientes também receberam outros agentes quimioterápicos ou alguma forma de radioterapia. A quantificação do risco de indução de clorambucil de leucemia ou carcinoma em humanos não é possível. A avaliação de relatos publicados de desenvolvimento de leucemia em pacientes que receberam clorambucil (e outros agentes alquilantes) sugere que o risco de leucemogênese aumenta com a cronicidade do tratamento e com grandes doses cumulativas. No entanto, provou-se impossível definir uma dose cumulativa abaixo da qual não há risco de indução de malignidade secundária. Os potenciais benefícios da terapia com clorambucil devem ser avaliados individualmente em relação ao possível risco de indução de uma malignidade secundária.
Foi demonstrado que o clorambucil causa danos nas cromátides ou nos cromossomos em humanos. Tanto a esterilidade reversível quanto a permanente foram observadas em ambos os sexos recebendo clorambucil.
Uma alta incidência de esterilidade foi documentada quando clorambucil é administrado a homens pré-púberes e púberes. Azoospermia prolongada ou permanente também foi observada em homens adultos. Embora a maioria dos relatos de disfunção gonadal secundária ao clorambucil tenha sido relacionada ao sexo masculino, a indução de amenorreia em mulheres com agentes alquilantes está bem documentada e o clorambucil é capaz de produzir amenorreia. Estudos de autópsia dos ovários de mulheres com linfoma maligno tratadas com quimioterapia combinada, incluindo clorambucil, mostraram graus variados de fibrose, vasculite e depleção de folículos primordiais.
Raros casos de erupção cutânea progredindo para eritema multiforme, necrólise epidérmica tóxica ou síndrome de Stevens-Johnson foram relatados. Clorambucil deve ser descontinuado imediatamente em pacientes que desenvolvem reações cutâneas.
Gravidez
Gravidez Categoria D
Clorambucil pode causar dano fetal quando administrado a uma mulher grávida. Agenesia renal unilateral foi observada em 2 filhos cujas mães receberam clorambucil durante o primeiro trimestre. Malformações urogenitais, incluindo ausência de rim, foram encontradas em fetos de ratos que receberam clorambucil. Não existem estudos adequados e bem controlados em mulheres grávidas. Se este medicamento for usado durante a gravidez, ou se a paciente engravidar enquanto estiver tomando este medicamento, a paciente deve ser informada do risco potencial para o feto. As mulheres com potencial para engravidar devem ser aconselhadas a evitar engravidar.
PRECAUÇÕES
Em geral
Muitos pacientes desenvolvem uma linfopenia lentamente progressiva durante o tratamento. A contagem de linfócitos geralmente retorna rapidamente aos níveis normais após a conclusão da terapia medicamentosa. A maioria dos pacientes tem alguma neutropenia após a terceira semana de tratamento e isso pode continuar por até 10 dias após a última dose. Subsequentemente, a contagem de neutrófilos geralmente volta rapidamente ao normal. A neutropenia grave parece estar relacionada à dosagem e geralmente ocorre apenas em pacientes que receberam uma dosagem total de 6,5 mg/kg ou mais em um ciclo de terapia com dosagem contínua. Cerca de um quarto de todos os pacientes que recebem o esquema de dose contínua e um terço daqueles que recebem essa dosagem em 8 semanas ou menos podem desenvolver neutropenia grave.
Embora não seja necessário descontinuar o clorambucil na primeira evidência de queda na contagem de neutrófilos, deve-se lembrar que a queda pode continuar por 10 dias após a última dose e que, à medida que a dose total se aproxima de 6,5 mg/kg, há risco de causar danos irreversíveis na medula óssea. A dose de clorambucil deve ser diminuída se a contagem de leucócitos ou plaquetas cair abaixo dos valores normais e deve ser descontinuada em caso de depressão mais grave.
Clorambucil deve não ser administrado em dosagens completas antes de 4 semanas após um ciclo completo de radioterapia ou quimioterapia devido à vulnerabilidade da medula óssea a danos nessas condições. Se as contagens de leucócitos ou plaquetas pré-terapia estiverem deprimidas devido ao processo de doença da medula óssea antes da instituição da terapia, o tratamento deve ser instituído com uma dosagem reduzida.
Contagens persistentemente baixas de neutrófilos e plaquetas ou linfocitose periférica sugerem infiltração da medula óssea. Se confirmado por exame de medula óssea, a dose diária de clorambucil não deve exceder 0,1 mg/kg. O clorambucil parece ser relativamente livre de efeitos colaterais gastrointestinais ou outras evidências de toxicidade além da ação depressora da medula óssea. Em humanos, doses orais únicas de 20 mg ou mais podem produzir náuseas e vômitos.
Crianças com síndrome nefrótica e pacientes que recebem altas doses de pulso de clorambucil podem ter um risco aumentado de convulsões. Como com qualquer medicamento potencialmente epileptogênico, deve-se ter cautela ao administrar clorambucil a pacientes com histórico de transtorno convulsivo ou traumatismo craniano, ou que estejam recebendo outros medicamentos potencialmente epileptogênicos.
A administração de vacinas vivas a pacientes imunocomprometidos deve ser evitada.
Testes laboratoriais
Os pacientes devem ser acompanhados cuidadosamente para evitar danos à medula óssea com risco de vida durante o tratamento. Exames semanais do sangue devem ser feitos para determinar os níveis de hemoglobina, contagem total e diferencial de leucócitos e contagem quantitativa de plaquetas. Além disso, durante as primeiras 3 a 6 semanas de terapia, recomenda-se que as contagens de glóbulos brancos sejam feitas 3 ou 4 dias após cada uma das contagens sanguíneas completas semanais. Galton et al sugeriram que, ao seguir pacientes, é útil traçar as contagens sanguíneas em um gráfico ao mesmo tempo em que o peso corporal, a temperatura, o tamanho do baço etc. são registrados. É considerado perigoso permitir que um paciente fique mais de 2 semanas sem exame hematológico e clínico durante o tratamento.
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Ver AVISOS seção para informações sobre carcinogênese, mutagênese e diminuição da fertilidade.
Gravidez
Efeitos teratogênicos
Gravidez Categoria D
Ver AVISOS seção.
Mães que amamentam
Não se sabe se este medicamento é excretado no leite humano. Como muitos medicamentos são excretados no leite humano e devido ao potencial de reações adversas graves em lactentes de clorambucil, deve-se decidir entre interromper a amamentação ou descontinuar o medicamento, levando em consideração a importância do medicamento para a mãe.
Uso Pediátrico
A segurança e eficácia em pacientes pediátricos não foram estabelecidas.
Uso Geriátrico
Os estudos clínicos de clorambucil não incluíram um número suficiente de indivíduos com 65 anos ou mais para determinar se eles respondem de forma diferente dos indivíduos mais jovens. Outras experiências clínicas relatadas não identificaram diferenças nas respostas entre os pacientes idosos e os mais jovens. Em geral, a seleção da dose para um paciente idoso deve ser cautelosa, geralmente começando no limite inferior da faixa de dosagem, refletindo a maior frequência de diminuição da função hepática, renal ou cardíaca e de doença concomitante ou outra terapia medicamentosa.
Uso em pacientes com insuficiência renal
O impacto da insuficiência renal na eliminação de clorambucil não foi formalmente estudado. A eliminação renal de clorambucil inalterado e de seus principais metabólitos ativos, mostarda de ácido fenilacético, representa menos de 1% da dose administrada. Além disso, nenhum ajuste de dose foi necessário em 2 pacientes em diálise com clorambucil. Portanto, não é esperado que a insuficiência renal afete significativamente a eliminação de clorambucil.
Uso em pacientes com insuficiência hepática
Nenhum estudo formal foi realizado em pacientes com insuficiência hepática. Como o clorambucil é metabolizado principalmente no fígado, os pacientes com insuficiência hepática devem ser monitorados de perto quanto à toxicidade e a redução da dose pode ser considerada em pacientes com insuficiência hepática quando tratados com LEUKERAN (ver DOSAGEM E ADMINISTRAÇÃO ).
SOBREDOSAGEM
Pancitopenia reversível foi o principal achado de superdosagem inadvertida de clorambucil. Também ocorreu toxicidade neurológica variando de comportamento agitado e ataxia a múltiplas convulsões de grande mal. Como não há antídoto conhecido, o hemograma deve ser monitorado de perto e medidas gerais de suporte devem ser instituídas, juntamente com transfusões de sangue apropriadas, se necessário. Clorambucil não é dialisável.
As doses orais de LD50 em camundongos são de 123 mg/kg. Em ratos, uma dose única intraperitoneal de 12,5 mg/kg de clorambucil produz efeitos típicos de mostarda de nitrogênio; estes incluem atrofia da membrana mucosa intestinal e dos tecidos linfóides, linfopenia grave tornando-se máxima em 4 dias, anemia e trombocitopenia. Após esta dose, os animais começam a se recuperar em 3 dias e parecem normais em cerca de uma semana, embora a medula óssea possa não se tornar completamente normal por cerca de 3 semanas. Uma dose intraperitoneal de 18,5 mg/kg mata cerca de 50% dos ratos com desenvolvimento de convulsões. Até 50 mg/kg foram administrados por via oral a ratos em dose única, com recuperação. Tal dose causa bradicardia, salivação excessiva, hematúria, convulsões e disfunção respiratória.
CONTRA-INDICAÇÕES
Clorambucil deve não ser usado em pacientes cuja doença tenha demonstrado uma resistência prévia ao agente. Pacientes que demonstraram hipersensibilidade ao clorambucil não devem receber o medicamento. Pode haver hipersensibilidade cruzada (erupção cutânea) entre o clorambucil e outros agentes alquilantes.
FARMACOLOGIA CLÍNICA
Mecanismo de ação
O clorambucil, um derivado aromático da mostarda nitrogenada, é um agente alquilante. O clorambucil interfere na replicação do DNA e induz a apoptose celular por meio do acúmulo de p53 citosólica e subsequente ativação de Bax, um promotor de apoptose.
Farmacocinética
Em um estudo de 12 pacientes que receberam doses orais únicas de 0,2 mg/kg de LEUKERAN 5mg, a Cmax plasmática média de clorambucil ajustada à dose (±SD) foi de 492 ± 160 ng/mL, a AUC foi de 883 ± 329 ng.h/mL , a meia-vida média de eliminação (t½) foi de 1,3 ± 0,5 horas e o Tmax foi de 0,83 ± 0,53 horas. Para o metabólito principal, mostarda de ácido fenilacético (PAAM), a Cmax plasmática média ajustada à dose (± SD) foi de 306 ± 73 ng/mL, a AUC foi de 1204 ± 285 ng.h/mL, t½ média foi de 1,8 ± 0,4 horas , e o Tmax foi de 1,9 ± 0,7 horas.
Após doses orais únicas de 0,6 a 1,2 mg/kg, os níveis plasmáticos máximos de clorambucil (Cmax) são atingidos em 1 hora e a meia-vida de eliminação terminal (t) do fármaco original é estimada em 1,5 horas.
Absorção
clorambucil é rápida e completamente (>70%) absorvido pelo trato gastrointestinal. Consistente com a absorção rápida e previsível de clorambucil, a variabilidade interindividual na farmacocinética plasmática de clorambucil mostrou ser relativamente pequena após doses orais entre 15 e 70 mg (variabilidade intrapaciente de 2 vezes e uma variabilidade de 2 a 4 vezes variabilidade interpaciente na AUC). A absorção do clorambucil é reduzida quando tomado após as refeições. Em um estudo com dez pacientes, a ingestão de alimentos aumentou o Tmax mediano em 2 vezes e reduziu os valores de Cmax e AUC ajustados à dose em 55% e 20%, respectivamente.
Distribuição
O volume aparente de distribuição foi em média de 0,31 L/kg após uma dose oral única de 0,2 mg/kg de clorambucil em 11 pacientes com câncer com leucemia linfocítica crônica.
clorambucil e seus metabólitos ligam-se extensivamente às proteínas plasmáticas e teciduais. In vitro, o clorambucil está 99% ligado às proteínas plasmáticas, especificamente à albumina. Os níveis de clorambucil no líquido cefalorraquidiano não foram determinados.
Metabolismo
O clorambucil é extensamente metabolizado no fígado principalmente em mostarda de ácido fenilacético, que tem atividade antineoplásica. O clorambucil e seu principal metabólito sofrem degradação oxidativa em derivados monoidroxi e diidroxi.
Excreção
Após uma dose única de clorambucil radiomarcado (14C), aproximadamente 20% a 60% da radioatividade aparece na urina após 24 horas. Novamente, menos de 1% da radioatividade urinária está na forma de clorambucil ou mostarda de ácido fenilacético.
INFORMAÇÃO DO PACIENTE
Os pacientes devem ser informados de que as principais toxicidades do clorambucil estão relacionadas à hipersensibilidade, febre medicamentosa, mielossupressão, hepatotoxicidade, infertilidade, convulsões, toxicidade gastrointestinal e malignidades secundárias. Os pacientes nunca devem tomar o medicamento sem supervisão médica e devem consultar seu médico se apresentarem erupções cutâneas, sangramento, febre, icterícia, tosse persistente, convulsões, náuseas, vômitos, amenorreia ou nódulos/massas incomuns. As mulheres com potencial para engravidar devem ser aconselhadas a evitar engravidar.
