Prevacid 15mg, 30mg Lansoprazole Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Prevacid e como é usado?
Prevacid 15mg é um medicamento de prescrição usado para tratar os sintomas de úlceras estomacais e intestinais e para diminuir a quantidade de ácido produzido no estômago. Prevacid 15mg pode ser usado sozinho ou com outros medicamentos.
- Prevacid 15mg é um inibidor da bomba de prótons.
Quais são os possíveis efeitos colaterais do Prevacid 30mg?
Prevacid 30mg pode causar efeitos colaterais graves, incluindo:
- dor de estômago severa,
- diarreia contendo sangue,
- convulsão (convulsões,
- dificuldade em urinar,
- sangue na urina,
- inchaço,
- ganho de peso rápido,
- tontura,
- frequência cardíaca rápida ou irregular,
- tremendo,
- movimentos musculares bruscos,
- sentindo-se nervoso,
- cãibras musculares ou espasmos nas mãos ou pés,
- tosse,
- sentindo como se estivesse sufocando,
- dores nas articulações e
- erupção cutânea nas bochechas ou braços que piora com a luz solar
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Prevacid 15mg incluem:
- náusea,
- dor de estômago,
- diarréia,
- constipação, e
- dor de cabeça
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Prevacid. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
PREVACID (lansoprazol) comprimidos de desintegração oral de liberação retardada
DESCRIÇÃO
ingrediente ativo em PREVACID 30mg cápsulas de liberação retardada e PREVACID 15mg SoluTab comprimidos de desintegração oral de liberação retardada é o lansoprazol, um benzimidazol substituído, 2-[[[3-metil-4-(2,2,2trifluoroetoxi)-2-piridil] metil] sulfinil] benzimidazol, um composto que inibe a secreção de ácido gástrico. Sua fórmula empírica é C16H14F3N3O2S com um peso molecular de 369,37. Lansoprazol tem a seguinte estrutura:
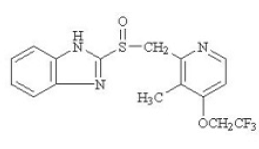
O lansoprazol é um pó cristalino inodoro branco a branco acastanhado que se funde com decomposição a aproximadamente 166°C. O lansoprazol é livremente solúvel em dimetilformamida; solúvel em metanol; pouco solúvel em etanol; ligeiramente solúvel em acetato de etilo, diclorometano e acetonitrilo; muito pouco solúvel em éter e praticamente insolúvel em hexano e água.
lansoprazol é estável quando exposto à luz por até dois meses. A taxa de degradação do composto em uma solução aquosa aumenta com a diminuição do pH. A meia-vida de degradação do fármaco em solução aquosa a 25°C é de aproximadamente 0,5 horas a pH 5,0 e aproximadamente 18 horas a pH 7,0.
PREVACID é fornecido em cápsulas de liberação retardada e PREVACID 15mg SoluTab é fornecido em comprimidos de desintegração oral de liberação retardada (SoluTab) para administração oral.
PREVACID está disponível em duas dosagens: 15 e 30 mg de lansoprazol por cápsula. Cada cápsula de liberação retardada contém grânulos com revestimento entérico consistindo em 15 ou 30 mg de lansoprazol (ingrediente ativo) e os seguintes ingredientes inativos: esfera de açúcar, sacarose, copolímero de ácido metacrílico, hidroxipropilcelulose de baixa substituição, amido, carbonato de magnésio, talco, polietileno glicol, dióxido de titânio, polissorbato 80, hidroxipropilcelulose, dióxido de silício coloidal, D&C Vermelho Nº 28, FD&C Azul Nº 1, FD&C Verde Nº 31 e FD&C Vermelho Nº 40.
PREVACID 30mg SoluTab está disponível em duas dosagens: 15 e 30 mg de lansoprazol por comprimido. Cada comprimido de desintegração oral de liberação retardada contém microgrânulos com revestimento entérico consistindo em 15 ou 30 mg de lansoprazol (ingrediente ativo) e os seguintes ingredientes inativos: manitol, ácido metacrílico, hidroxipropilcelulose, lactose monohidratada-esfera de celulose microcristalina, trietil citrato, crospovidona, poliacrilato, carbonato de magnésio, aspartame2, monoestearato de glicerila, hipromelose, estearato de magnésio, ácido cítrico, dióxido de titânio, talco, aroma artificial de morango, polietilenoglicol, polissorbato 80 e óxido férrico.
1PREVACID 15 mg apenas cápsulas. 2Fenilcetonúricos: PREVACID SoluTab Contém fenilalanina 2,5 mg por comprimido de 15 mg e 5,1 mg por comprimido de 30 mg.
INDICAÇÕES
Tratamento da úlcera duodenal ativa
PREVACID e PREVACID SoluTab são indicados em adultos para tratamento de curto prazo (por quatro semanas) para cicatrização e alívio dos sintomas da úlcera duodenal ativa [ver Estudos clínicos ].
Erradicação do H. pylori para reduzir o risco de recorrência da úlcera duodenal
Terapia tripla: PREVACID ou PREVACID SoluTab/amoxicilina/claritromicina
PREVACID ou PREVACID 30mg SoluTab em combinação com amoxicilina mais claritromicina como terapia tripla é indicado em adultos para o tratamento de pacientes com infecção por H. pylori e doença de úlcera duodenal (atividade ou história de um ano de úlcera duodenal) para erradicar o H. pylori. A erradicação do H. pylori demonstrou reduzir o risco de recorrência da úlcera duodenal [ver Estudos clínicos ].
Consulte as informações completas de prescrição de amoxicilina e claritromicina.
Terapia dupla: PREVACID ou PREVACID SoluTab/amoxicilina
PREVACID ou PREVACID 15mg SoluTab em combinação com amoxicilina como terapia dupla é indicado em adultos para o tratamento de pacientes com infecção por H. pylori e úlcera duodenal (ativo ou com história de um ano de úlcera duodenal) que são alérgicos ou intolerantes à claritromicina ou nos quais a resistência à claritromicina é conhecida ou suspeita (consulte a bula da claritromicina, seção Microbiologia). A erradicação do H. pylori demonstrou reduzir o risco de recorrência da úlcera duodenal [ver Estudos clínicos ].
Consulte as informações completas de prescrição da amoxicilina.
Manutenção de úlceras duodenais cicatrizadas
PREVACID e PREVACID SoluTab são indicados em adultos para manter a cicatrização de úlceras duodenais. Os estudos controlados não se estendem além de 12 meses [ver Estudos clínicos ].
Tratamento de úlcera gástrica benigna ativa
PREVACID e PREVACID 30mg SoluTab são indicados em adultos para tratamento de curto prazo (até oito semanas) para cicatrização e alívio dos sintomas de úlcera gástrica benigna ativa [ver Estudos clínicos ].
Cura de úlcera gástrica associada a AINEs
PREVACID 30mg e PREVACID SoluTab são indicados em adultos para o tratamento de úlcera gástrica associada a AINEs em pacientes que continuam o uso de AINEs. Os estudos controlados não se estenderam além de oito semanas [ver Estudos clínicos ].
Redução do risco de úlcera gástrica associada a AINEs
PREVACID 15mg e PREVACID SoluTab são indicados em adultos para reduzir o risco de úlceras gástricas associadas a AINEs em pacientes com histórico de úlcera gástrica documentada que requerem o uso de AINEs. Os estudos controlados não se estenderam além de 12 semanas [ver Estudos clínicos ].
Tratamento da Doença do Refluxo Gastroesofágico Sintomática (DRGE)
PREVACID 15mg e PREVACID 30mg SoluTab são indicados para tratamento de curta duração em adultos e pacientes pediátricos de 12 a 17 anos de idade (até oito semanas) e pacientes pediátricos de um a 11 anos de idade (até 12 semanas) para o tratamento de azia e outros sintomas associados à DRGE [ver Estudos clínicos ].
Tratamento da esofagite erosiva (EE)
PREVACID 15mg e PREVACID 30mg SoluTab são indicados para tratamento de curta duração em pacientes adultos e pediátricos de 12 a 17 anos de idade (até oito semanas) e pacientes pediátricos de um a 11 anos de idade (até 12 semanas) para cicatrização e alívio dos sintomas de todos os graus de EE.
Para adultos que não curam com PREVACID 30mg ou PREVACID 15mg SoluTab por oito semanas (5 a 10%), pode ser útil dar mais oito semanas de tratamento. Se houver uma recorrência de esofagite erosiva, um curso adicional de oito semanas de PREVACID 30mg ou PREVACID SoluTab pode ser considerado [ver Estudos clínicos ].
Manutenção da cicatrização de EE
PREVACID e PREVACID SoluTab são indicados em adultos para manter a cicatrização da EE. Os estudos controlados não se estenderam além de 12 meses [ver Estudos clínicos ].
Condições de hipersecreção patológicas, incluindo síndrome de Zollinger-Ellison (ZES)
PREVACID 15mg e PREVACID SoluTab são indicados em adultos para o tratamento a longo prazo de condições hipersecretoras patológicas, incluindo síndrome de Zollinger-Ellison [ver Estudos clínicos ].
DOSAGEM E ADMINISTRAÇÃO
Dosagem recomendada para adultos por indicação
Dosagem pediátrica recomendada por indicação
Pacientes pediátricos de 1 a 11 anos de idade
Em estudos clínicos, PREVACID não foi administrado além de 12 semanas em crianças de 1 a 11 anos. Não se sabe se PREVACID é seguro e eficaz se usado por mais tempo do que a duração recomendada. Não exceda a dose recomendada e a duração de uso em pacientes pediátricos conforme descrito abaixo [ver Uso em populações específicas ].
Insuficiência hepática
A dose recomendada é de 15 mg por via oral diariamente em pacientes com insuficiência hepática grave (Child-Pugh C) [ver Uso em populações específicas ].
Informações importantes de administração
- Tome PREVACID ou PREVACID 30mg SoluTab antes das refeições.
- Não esmague ou mastigue a cápsula de PREVACID 15mg ou PREVACID 30mg SoluTab.
- Tome PREVACID ou PREVACID 30mg SoluTab pelo menos 30 minutos antes do sucralfato [ver INTERAÇÕES MEDICAMENTOSAS ].
- Os antiácidos podem ser usados concomitantemente com PREVACID ou PREVACID SoluTab.
- Doses esquecidas: Se uma dose for esquecida, administre o mais rápido possível. No entanto, se a próxima dose programada for necessária, não tome a dose esquecida e tome a próxima dose no horário. Não tome duas doses de uma só vez para compensar uma dose esquecida.
Cápsulas PREVACID
- Engula tudo; não mastigue.
- Para pacientes com dificuldade em engolir cápsulas, as cápsulas de PREVACID podem ser abertas e administradas por via oral ou por sonda nasogástrica nos alimentos moles ou líquidos especificados abaixo.
- A administração de PREVACID em alimentos ou líquidos que não os discutidos abaixo não foi estudada clinicamente e, portanto, não é recomendada.
Administração em Soft Foods (molho de maçã, pudim ENSURE, requeijão, iogurte ou pêra tensa):
Administração em Líquidos (sumo de maçã, sumo de laranja ou sumo de tomate):
Administração com suco de maçã por sonda nasogástrica (≥16 francês)
PREVACID 15mg SoluTab
- Não quebre ou corte.
- Coloque o comprimido na língua, deixe-o se desintegrar, com ou sem água, até que os microgrânulos possam ser engolidos. Não mastigue os microgrânulos.
- O comprimido normalmente se desintegra em menos de um minuto.
- Alternativamente, para crianças ou outros pacientes que têm dificuldade em engolir comprimidos, PREVACID SoluTab pode ser administrado com água via seringa oral ou tubo NG da seguinte forma:
Administração com água em uma seringa oral
Administração com água através de um tubo NG (≥8 francês)
COMO FORNECIDO
Formas de dosagem e pontos fortes
PREVACID 15mg cápsulas de liberação retardada
- A dosagem de 15 mg é uma cápsula opaca, rosa e verde impressa com “TAP” e “PREVACID 15”.
- A dosagem de 30 mg é uma cápsula opaca, rosa e preta impressa com “TAP” e “PREVACID 30”.
PREVACID 30mg SoluTab comprimidos de desintegração oral de liberação retardada
- A dosagem de 15 mg é um comprimido redondo não revestido, branco a branco amarelado, contendo manchas laranja a castanho escuro com “15” gravado numa das faces.
- A dosagem de 30 mg é um comprimido redondo branco a branco amarelado, não revestido, contendo manchas laranja a marrom escuro com “30” gravado em um dos lados.
Armazenamento e manuseio
Cápsulas de liberação retardada PREVACID , 15 mg, são opacos, rosa e verde com “TAP” e “PREVACID 15” impressos nas cápsulas. As cápsulas de libertação retardada de 30 mg são opacas, cor-de-rosa e pretas com “TAP” e “PREVACID 30” impressos nas cápsulas. Eles estão disponíveis da seguinte forma:
PREVACID 30mg SoluTab comprimidos de desintegração oral de liberação retardada , 15 mg, são comprimidos não revestidos, brancos a branco amarelados, redondos, contendo manchas laranja a castanho escuro, com “15” gravado numa das faces do comprimido. Os comprimidos de 30 mg são brancos a branco amarelados, redondos, não revestidos, contendo manchas laranja a castanho escuro, com “30” gravado numa das faces do comprimido. Os comprimidos estão disponíveis da seguinte forma:
Armazenar a 25°C (77°F); excursões permitidas para 15-30°C (59-86°F)[ver Temperatura ambiente controlada USP ].
Distribuído por: Takeda Pharmaceuticals America, Inc., Deerfield, IL 60015. Revisado: junho de 2018
EFEITOS COLATERAIS
As seguintes reações adversas graves estão descritas abaixo e em outras partes da bula:
- Nefrite Tubulointersticial Aguda [ver AVISOS E PRECAUÇÕES ]
- Diarreia Associada a Clostridium difficile [ver AVISOS E PRECAUÇÕES ]
- Fratura Óssea [ver AVISOS E PRECAUÇÕES ]
- Reações Adversas Cutâneas Graves [ver AVISOS E PRECAUÇÕES ]
- Lúpus Eritematoso Cutâneo e Sistêmico [ver AVISOS E PRECAUÇÕES ]
- Deficiência de cianocobalamina (vitamina B12) [ver AVISOS E PRECAUÇÕES ]
- Hipomagnesemia e Metabolismo Mineral [ver AVISOS E PRECAUÇÕES ]
- Pólipos da glândula fúndica [ver AVISOS E PRECAUÇÕES ]
Experiência de Ensaios Clínicos
Como os ensaios clínicos são conduzidos sob condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparadas às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática clínica.
Em todo o mundo, mais de 10.000 pacientes foram tratados com PREVACID 30mg em ensaios clínicos de Fase 2 ou Fase 3 envolvendo várias dosagens e durações de tratamento. Em geral, o tratamento com PREVACID 30mg foi bem tolerado em ensaios de curto e longo prazo.
As seguintes reações adversas foram relatadas pelo médico assistente como tendo uma relação possível ou provável com o medicamento em 1% ou mais dos pacientes tratados com PREVACID e ocorreram em uma taxa maior em pacientes tratados com PREVACID do que pacientes tratados com placebo na Tabela 1.
A cefaleia também foi observada com incidência superior a 1%, mas foi mais comum com placebo. A incidência de diarreia foi semelhante entre os pacientes que receberam placebo e os pacientes que receberam 15 e 30 mg de PREVACID, mas maior nos pacientes que receberam 60 mg de PREVACID (2,9, 1,4, 4,2 e 7,4%, respectivamente).
O evento adverso possivelmente ou provavelmente relacionado ao tratamento mais comumente relatado durante a terapia de manutenção foi diarreia.
No estudo de redução de risco de PREVACID para úlceras gástricas associadas a AINEs, a incidência de diarreia para pacientes tratados com PREVACID 30mg, misoprostol e placebo foi de 5, 22 e 3%, respectivamente.
Outro estudo para a mesma indicação, em que os pacientes tomaram um inibidor da COX-2 ou lansoprazol e naproxeno, demonstrou que o perfil de segurança foi semelhante ao estudo anterior. As reações adicionais deste estudo não observadas anteriormente em outros ensaios clínicos com PREVACID 30mg incluíram contusão, duodenite, desconforto epigástrico, distúrbio esofágico, fadiga, fome, hérnia hiatal, rouquidão, esvaziamento gástrico prejudicado, metaplasia e insuficiência renal.
As experiências adversas adicionais que ocorreram em menos de 1% dos pacientes ou indivíduos que receberam PREVACID 15mg em estudos domésticos são mostradas abaixo:
Corpo como um todo - abdome aumentado, reação alérgica, astenia, dor nas costas, candidíase, carcinoma, dor no peito (sem outra especificação), calafrios, edema, febre, síndrome gripal, halitose, infecção (sem outra especificação), mal-estar, dor no pescoço, rigidez do pescoço, dor , dor pélvica
Sistema cardiovascular - angina, arritmia, bradicardia, acidente vascular cerebral/enfarte cerebral, hipertensão/hipotensão, enxaqueca, enfarte do miocárdio, palpitações, choque (insuficiência circulatória), síncope, taquicardia, vasodilatação
Sistema digestivo - fezes anormais, anorexia, bezoar, cardioespasmo, colelitíase, colite, boca seca, dispepsia, disfagia, enterite, eructação, estenose esofágica, úlcera esofágica, esofagite, descoloração fecal, flatulência, nódulos gástricos/pólipos das glândulas fúndicas, gastrite, gastroenterite, anomalia gastrointestinal , distúrbio gastrointestinal, hemorragia gastrointestinal, glossite, hemorragia gengival, hematêmese, aumento do apetite, aumento da salivação, melena, ulceração da boca, náusea e vômito, náusea e vômito e diarreia, monilíase gastrointestinal, distúrbio retal, hemorragia retal, estomatite, tenesmo, sede, distúrbio da língua, colite ulcerativa, estomatite ulcerativa
Sistema endócrino - diabetes mellitus, bócio, hipotireoidismo Sistema Hemico e Linfático - anemia, hemólise, linfadenopatia
Distúrbios do Metabolismo e Nutricionais - avitaminose, gota, desidratação, hiperglicemia/hipoglicemia, edema periférico, ganho/perda de peso
Sistema musculo-esquelético - artralgia, artrite, distúrbio ósseo, distúrbio articular, cãibras nas pernas, dor musculoesquelética, mialgia, miastenia, ptose, sinovite
Sistema nervoso - sonhos anormais, agitação, amnésia, ansiedade, apatia, confusão, convulsão, demência, despersonalização, depressão, diplopia, tontura, labilidade emocional, alucinações, hemiplegia, hostilidade agravada, hipercinesia, hipertonia, hipoestesia, insônia, diminuição/aumento da libido, nervosismo, neurose, parestesia, distúrbio do sono, sonolência, alteração do pensamento, tremor, vertigem
Sistema respiratório - asma, bronquite, tosse aumentada, dispneia, epistaxe, hemoptise, soluço, neoplasia laríngea, fibrose pulmonar, faringite, distúrbio pleural, pneumonia, distúrbio respiratório, inflamação/infecção do trato respiratório superior, rinite, sinusite, estridor
Pele e Anexos - acne, alopecia, dermatite de contato, pele seca, erupção fixa, distúrbio capilar, erupção maculopapular, distúrbio ungueal, prurido, erupção cutânea, carcinoma de pele, distúrbio da pele, sudorese, urticária
Sentidos Especiais - visão anormal, ambliopia, blefarite, visão turva, catarata, conjuntivite, surdez, olhos secos, distúrbio do ouvido/olho, dor ocular, glaucoma, otite média, parosmia, fotofobia, degeneração/distúrbio da retina, perda do paladar, alteração do paladar, zumbido, visão defeito de campo
Sistema Urogenital - menstruação anormal, aumento mamário, dor mamária, sensibilidade mamária, dismenorreia, disúria, ginecomastia, impotência, cálculo renal, dor renal, leucorréia, menorragia, distúrbio menstrual, distúrbio peniano, poliúria, distúrbio testicular, dor uretral, frequência urinária, retenção urinária, infecção do trato urinário, urgência urinária, dificuldade para urinar, vaginite
Experiência pós-marketing
Experiências adversas adicionais foram relatadas desde que PREVACID e PREVACID 30mg SoluTab foram comercializados. A maioria desses casos é de origem estrangeira e uma relação com PREVACID 15mg ou PREVACID SoluTab não foi estabelecida. Como essas reações foram relatadas voluntariamente por uma população de tamanho desconhecido, não é possível fazer estimativas de frequência. Esses eventos estão listados abaixo pelo sistema do corpo COSTART.
Corpo como um todo - reações anafiláticas/anafilactóides, lúpus eritematoso sistêmico;
Sistema digestivo - hepatotoxicidade, pancreatite, vômitos;
Sistema Hemico e Linfático - agranulocitose, anemia aplástica, anemia hemolítica, leucopenia, neutropenia, pancitopenia, trombocitopenia e púrpura trombocitopênica trombótica;
Infecções e Infestações - diarreia associada ao Clostridium difficile;
Distúrbios do Metabolismo e Nutricionais - hipomagnesemia, hipocalcemia, hipocalemia, hiponatremia;
Sistema musculo-esquelético - fratura óssea, miosite;
Pele e Anexos - reações dermatológicas graves incluindo eritema multiforme, SSJ/NET (algumas fatais), DRESS, AGEP, lúpus eritematoso cutâneo;
Sentidos Especiais - distúrbio da fala;
Sistema Urogenital - nefrite intersticial, retenção urinária.
Terapia combinada com amoxicilina e claritromicina
Em ensaios clínicos usando terapia combinada com PREVACID mais amoxicilina e claritromicina e PREVACID 30mg mais amoxicilina, não foram observadas reações adversas peculiares a essas combinações de medicamentos. As reações adversas que ocorreram foram limitadas àquelas relatadas anteriormente com PREVACID 15mg, amoxicilina ou claritromicina.
Terapia tripla: PREVACID/amoxicilina/claritromicina
As reações adversas mais frequentemente relatadas para pacientes que receberam terapia tripla por 14 dias foram diarreia (7%), dor de cabeça (6%) e alteração do paladar (5%). Não houve diferenças estatisticamente significativas na frequência de reações adversas relatadas entre os regimes de terapia tripla de 10 e 14 dias. Nenhuma reação adversa emergente do tratamento foi observada em taxas significativamente mais altas com a terapia tripla do que com qualquer regime de terapia dupla.
Terapia dupla: PREVACID/amoxicilina
As reações adversas relatadas com mais frequência para pacientes que receberam a terapia dupla de PREVACID 30 mg três vezes ao dia mais amoxicilina três vezes ao dia foram diarreia (8%) e cefaleia (7%). Nenhuma reação adversa emergente do tratamento foi observada em taxas significativamente mais altas com PREVACID 30mg três vezes ao dia mais amoxicilina três vezes ao dia em terapia dupla do que com PREVACID 15mg sozinho.
Para obter informações sobre reações adversas com agentes antibacterianos (amoxicilina e claritromicina) indicados em combinação com PREVACID ou PREVACID SoluTab, consulte a seção Reações Adversas de suas informações de prescrição.
Valores de laboratório
As seguintes alterações nos parâmetros laboratoriais em pacientes que receberam PREVACID 30mg foram relatadas como reações adversas:
Testes de função hepática anormais, aumento de SGOT (AST), aumento de SGPT (ALT), aumento de creatinina, aumento de fosfatase alcalina, aumento de globulinas, aumento de GGTP, leucócitos aumentados/diminuídos/anormais, razão AG anormal, eritrócitos anormais, bilirrubinemia, potássio sanguíneo aumentado, uréia no sangue aumentada, cristal na urina presente, eosinofilia, hemoglobina diminuída, hiperlipemia, eletrólitos aumentados/diminuídos, colesterol aumentado/diminuído, glicocorticóides aumentados, LDH aumentado, plaquetas aumentadas/diminuídas/anormais, níveis de gastrina aumentados e sangue oculto nas fezes positivo. Anormalidades urinárias como albuminúria, glicosúria e hematúria também foram relatadas. Anormalidades laboratoriais isoladas adicionais foram relatadas.
Nos estudos controlados com placebo, quando SGOT (AST) e SGPT (ALT) foram avaliados, 0,4% (4/978) e 0,4% (11/2677) pacientes, que receberam placebo e PREVACID, respectivamente, tiveram elevações enzimáticas maiores que três vezes o limite superior do intervalo normal na visita final do tratamento. Nenhum desses pacientes que receberam PREVACID 30mg relatou icterícia em qualquer momento durante o estudo.
Em ensaios clínicos usando terapia combinada com PREVACID 15mg mais amoxicilina e claritromicina e PREVACID mais amoxicilina, não foram observadas anormalidades laboratoriais aumentadas específicas para essas combinações de medicamentos.
Para obter informações sobre alterações de valores laboratoriais com agentes antibacterianos (amoxicilina e claritromicina) indicados em combinação com PREVACID ou PREVACID 30mg SoluTab, consulte a seção Reações Adversas de suas informações de prescrição.
INTERAÇÕES MEDICAMENTOSAS
As Tabelas 2 e 3 incluem medicamentos com interações medicamentosas clinicamente importantes e interação com diagnóstico quando administrados concomitantemente com PREVACID 15mg ou PREVACID SoluTab e instruções para preveni-los ou gerenciá-los.
Consulte a bula dos medicamentos usados concomitantemente para obter mais informações sobre interações com IBPs.
AVISOS
Incluído como parte do PRECAUÇÕES seção.
PRECAUÇÕES
Presença de malignidade gástrica
Em adultos, a resposta sintomática à terapia com PREVACID 15mg ou PREVACID SoluTab não exclui a presença de malignidade gástrica. Considerar acompanhamento adicional e testes diagnósticos em pacientes adultos que tenham uma resposta abaixo do ideal ou uma recaída sintomática precoce após completar o tratamento com um IBP. Em pacientes mais velhos, considere também uma endoscopia.
Nefrite Tubulointersticial Aguda
nefrite tubulointerstial aguda (TIN) foi observada em pacientes em uso de IBPs e pode ocorrer em qualquer momento durante a terapia com IBPs. Os pacientes podem apresentar sinais e sintomas variados, desde reações de hipersensibilidade sintomática a sintomas inespecíficos de função renal diminuída (por exemplo, mal-estar, náusea, anorexia). Na série de casos relatados, alguns pacientes foram diagnosticados por biópsia e na ausência de manifestações extra-renais (por exemplo, febre, erupção cutânea ou artralgia). Descontinuar PREVACID ou PREVACID 15mg SoluTab e avaliar pacientes com suspeita de TIN aguda [ver CONTRA-INDICAÇÕES ].
Diarreia Associada ao Clostridium Difficile
Estudos observacionais publicados sugerem que a terapia com IBP como PREVACID 30mg e PREVACID 30mg SoluTab pode estar associada a um risco aumentado de diarreia associada a Clostridium difficile (CDAD), especialmente em pacientes hospitalizados. Este diagnóstico deve ser considerado para diarreia que não melhora [ver REAÇÕES ADVERSAS ].
Os pacientes devem usar a dose mais baixa e a menor duração da terapia com IBP apropriada para a condição a ser tratada.
CDAD foi relatado com o uso de quase todos os agentes antibacterianos. Para obter mais informações específicas sobre agentes antibacterianos (claritromicina e amoxicilina) indicados para uso em combinação com PREVACID 15mg ou PREVACID 15mg SoluTab, consulte a seção Advertências e Precauções de suas informações de prescrição.
Fratura óssea
Vários estudos observacionais publicados sugerem que a terapia com IBP pode estar associada a um risco aumentado de fraturas relacionadas à osteoporose do quadril, punho ou coluna. O risco de fratura foi aumentado em pacientes que receberam altas doses, definidas como múltiplas doses diárias, e terapia de longo prazo com IBP (um ano ou mais). Os pacientes devem usar a dose mais baixa e a menor duração da terapia com IBP apropriada para a condição a ser tratada. Pacientes com risco de fraturas relacionadas à osteoporose devem ser tratados de acordo com as diretrizes de tratamento estabelecidas [ver DOSAGEM E ADMINISTRAÇÃO , REAÇÕES ADVERSAS ].
Reações Adversas Cutâneas Graves
Reações adversas cutâneas graves, incluindo síndrome de Stevens-Johnson (SSJ) e necrólise epidérmica tóxica (NET), reação medicamentosa com eosinofilia e sintomas sistêmicos (DRESS) e pustulose exantemática generalizada aguda (PEGA) foram relatadas em associação com o uso de IBPs [Vejo REAÇÕES ADVERSAS ]. Descontinue PREVACID 30mg ou PREVACID SoluTab aos primeiros sinais ou sintomas de reações adversas cutâneas graves ou outros sinais de hipersensibilidade e considere uma avaliação adicional.
Lúpus Eritematoso Cutâneo e Sistêmico
Lúpus eritematoso cutâneo (LEC) e lúpus eritematoso sistêmico (LES) foram relatados em pacientes tomando IBPs, incluindo lansoprazol. Esses eventos ocorreram como um novo início e uma exacerbação de doença autoimune existente. A maioria dos casos de lúpus eritematoso induzido por IBP foram CLE.
A forma mais comum de LEC relatada em pacientes tratados com IBPs foi a LEC subaguda (SCLE) e ocorreu dentro de semanas a anos após a terapia medicamentosa contínua em pacientes que variam de lactentes a idosos. Geralmente, os achados histológicos foram observados sem envolvimento de órgãos.
lúpus eritematoso sistêmico (LES) é menos comumente relatado do que o LEC em pacientes que recebem IBPs. O LES associado a IBP é geralmente mais leve do que o LES não induzido por drogas. O início do LES normalmente ocorreu dentro de dias a anos após o início do tratamento, principalmente em pacientes que variam de adultos jovens a idosos. A maioria dos pacientes apresentou erupção cutânea; entretanto, artralgia e citopenia também foram relatadas.
Evite a administração de IBPs por mais tempo do que o indicado clinicamente. Se forem observados sinais ou sintomas consistentes com LEC ou LES em pacientes recebendo PREVACID 15mg ou PREVACID SoluTab, interrompa o medicamento e encaminhe o paciente ao especialista apropriado para avaliação. A maioria dos pacientes melhora com a descontinuação do IBP isolado em quatro a 12 semanas. Testes sorológicos (por exemplo, ANA) podem ser positivos e resultados de testes sorológicos elevados podem levar mais tempo para serem resolvidos do que as manifestações clínicas.
Deficiência de cianocobalamina (vitamina B12)
tratamento diário com qualquer medicamento supressor de ácido por um longo período de tempo (por exemplo, mais de três anos) pode levar à má absorção de cianocobalamina (vitamina B12) causada por hipo ou acloridria. Relatos raros de deficiência de cianocobalamina ocorrendo com terapia supressora de ácido foram relatados na literatura. Este diagnóstico deve ser considerado se forem observados sintomas clínicos consistentes com deficiência de cianocobalamina em pacientes tratados com PREVACID ou PREVACID SoluTab.
Hipomagnesemia e Metabolismo Mineral
Hipomagnesemia, sintomática e assintomática, foi relatada raramente em pacientes tratados com IBPs por pelo menos três meses, na maioria dos casos após um ano de terapia. Eventos adversos graves incluem tetania, arritmias e convulsões. A hipomagnesemia pode levar à hipocalcemia e/ou hipocalemia e pode exacerbar a hipocalcemia subjacente em pacientes de risco. Na maioria dos pacientes, o tratamento da hipomagnesemia exigiu reposição de magnésio e descontinuação do IBP.
Para pacientes que devem estar em tratamento prolongado ou que tomam IBPs com medicamentos como digoxina ou medicamentos que podem causar hipomagnesemia (por exemplo, diuréticos), os profissionais de saúde podem considerar o monitoramento dos níveis de magnésio antes do início do tratamento com IBP e periodicamente [ver REAÇÕES ADVERSAS ].
Considere monitorar os níveis de magnésio e cálcio antes do início de PREVACID 30mg ou PREVACID SoluTab e periodicamente durante o tratamento em pacientes com risco preexistente de hipocalcemia (por exemplo, hipoparatireoidismo). Suplemento com magnésio e/ou cálcio, conforme necessário. Se a hipocalcemia for refratária ao tratamento, considerar a descontinuação do IBP.
Interações com Investigações de Tumores Neuroendócrinos
Os níveis séricos de cromogranina A (CgA) aumentam secundariamente à diminuição da acidez gástrica induzida por drogas. O aumento do nível de CgA pode causar resultados falso-positivos em investigações diagnósticas de tumores neuroendócrinos. Os profissionais de saúde devem interromper temporariamente o tratamento com lansoprazol pelo menos 14 dias antes de avaliar os níveis de CgA e considerar a repetição do teste se os níveis iniciais de CgA forem altos. Se forem realizados testes em série (por exemplo, para monitoramento), o mesmo laboratório comercial deve ser usado para testes, pois os intervalos de referência entre os testes podem variar [ver INTERAÇÕES MEDICAMENTOSAS , FARMACOLOGIA CLÍNICA ].
Interação com Metotrexato
literatura sugere que o uso concomitante de IBPs com metotrexato (principalmente em altas doses) pode elevar e prolongar os níveis séricos de metotrexato e/ou de seu metabólito, possivelmente levando a toxicidade do metotrexato. Na administração de altas doses de metotrexato, a suspensão temporária do IBP pode ser considerada em alguns pacientes [ver INTERAÇÕES MEDICAMENTOSAS , FARMACOLOGIA CLÍNICA ].
Pacientes com Fenilcetonúria
A fenilalanina pode ser prejudicial para pacientes com fenilcetonúria (PKU). PREVACID 30mg SoluTab contém fenilalanina, um componente do aspartame. Cada comprimido de 15 mg contém 2,5 mg e cada comprimido de 30 mg contém 5,1 mg de fenilalanina. Antes de prescrever PREVACID SoluTab a um paciente com PKU, considere a quantidade diária combinada de fenilalanina de todas as fontes, incluindo PREVACID 30mg SoluTab.
Pólipos da Glândula Fúndica
uso de IBP está associado a um risco aumentado de pólipos da glândula fúndica que aumenta com o uso a longo prazo, especialmente após um ano. A maioria dos usuários de IBP que desenvolveu pólipos de glândula fúndica era assintomática e pólipos de glândula fúndica foram identificados incidentalmente na endoscopia. Use a duração mais curta da terapia com IBP apropriada para a condição a ser tratada.
Risco de espessamento da válvula cardíaca em pacientes pediátricos com menos de um ano de idade
PREVACID 30mg e PREVACID SoluTab não são aprovados em pacientes pediátricos com menos de um ano de idade. Estudos não clínicos em ratos juvenis com lansoprazol demonstraram um efeito adverso do espessamento da válvula cardíaca. O risco de lesão da válvula cardíaca não parece ser relevante para pacientes com um ano de idade ou mais [ver Uso em populações específicas ].
Informações de Aconselhamento do Paciente
Aconselhe o paciente a ler o rótulo do paciente aprovado pela FDA ( Guia de Medicação e Instruções de uso ).
Aconselhar os pacientes a:
Nefrite Tubulointersticial Aguda
Ligar para o profissional de saúde se apresentarem sinais e/ou sintomas associados à nefrite tubulointersticial aguda [ver AVISOS E PRECAUÇÕES ].
Diarreia Associada ao Clostridium Difficile
Ligar imediatamente para o médico se tiver diarreia que não melhora [ver AVISOS E PRECAUÇÕES ].
Fratura óssea
Para relatar quaisquer fraturas, especialmente do quadril, punho ou coluna, ao seu médico [ver AVISOS E PRECAUÇÕES ].
Reações Adversas Cutâneas Graves
Para descontinuar PREVACID ou PREVACID 30mg SoluTab e ligar imediatamente para seu médico para avaliação adicional [consulte AVISOS E PRECAUÇÕES ].
Lúpus Eritematoso Cutâneo e Sistêmico
Ligar imediatamente para o seu médico para qualquer novo ou agravamento dos sintomas associados ao lúpus eritematoso cutâneo ou sistêmico [ver AVISOS E PRECAUÇÕES ].
Deficiência de cianocobalamina (vitamina B12)
 Para relatar quaisquer sintomas clínicos que possam estar associados à deficiência de cianocobalamina ao seu profissional de saúde, se eles estiverem recebendo PREVACID ou PREVACID SoluTab por mais de três anos [consulte AVISOS E PRECAUÇÕES ].
Hipomagnesemia e minerais
Metabolismo Para relatar quaisquer sintomas clínicos que possam estar associados a hipomagnesemia, hipocalcemia e/ou hipocalemia ao seu profissional de saúde, se eles estiverem recebendo PREVACID ou PREVACID 15mg SoluTab por pelo menos três meses [ver AVISOS E PRECAUÇÕES ].
Interações medicamentosas
Aconselhe os pacientes a relatar ao seu médico se estiverem tomando produtos contendo rilpivirina [ver CONTRA-INDICAÇÕES ] ou metotrexato em altas doses [ver AVISOS E PRECAUÇÕES ].
Gravidez
Aconselhar uma mulher grávida sobre o risco potencial para o feto. Aconselhar as mulheres com potencial reprodutivo a informar seu médico sobre uma gravidez conhecida ou suspeita [ver Uso em populações específicas ].
Administração
- Doses esquecidas: Se uma dose for esquecida, administre o mais rápido possível. No entanto, se a próxima dose programada for necessária, não tome a dose esquecida e tome a próxima dose no horário. Não tome duas doses de uma só vez para compensar uma dose esquecida.
- PREVACID ou PREVACID 30mg SoluTab deve ser tomado antes de comer.
- Não esmague ou mastigue a cápsula PREVACID 15mg ou PREVACID SoluTab.
- Tome PREVACID ou PREVACID 30mg SoluTab pelo menos 30 minutos antes do sucralfato.
- Fenilcetonúricos: Contém Fenilalanina 2,5 mg por 15 mg de PREVACID 30 mg SoluTab Tablet e 5,1 mg por 30 mg de PREVACID SoluTab Tablet.
Cápsulas PREVACID
- Engula tudo; não mastigue.
- Para pacientes que têm dificuldade em engolir cápsulas:
- As cápsulas de PREVACID 15mg podem ser abertas e polvilhadas em compota de maçã, pudim ENSURE, queijo cottage, iogurte ou peras coadas
- As cápsulas de PREVACID 15mg também podem ser esvaziadas em um pequeno volume de suco de maçã, suco de laranja ou suco de tomate
- Alternativamente, as cápsulas de PREVACID podem ser administradas com suco de maçã via sonda nasogástrica
- Consulte as Instruções de Uso para obter uma descrição de todas as instruções de preparação e administração
Guia de Solução PREVACID
- Não quebre ou corte.
- Coloque o comprimido na língua; deixe que se desintegre, com ou sem água, até que as partículas possam ser engolidas. Não mastigue as partículas.
- O comprimido normalmente se desintegra em menos de um minuto.
- Alternativamente, para crianças ou outros pacientes que têm dificuldade em engolir comprimidos, PREVACID 30mg SoluTab pode ser administrado com água via seringa oral ou tubo NG, conforme descrito nas Instruções de Uso.
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Em dois estudos de carcinogenicidade de 24 meses, ratos Sprague-Dawley foram tratados com doses de lansoprazol oral de 5 a 150 mg/kg/dia, cerca de uma a 40 vezes a exposição na superfície corporal (mg/m²) de uma pessoa de 50 kg de altura média [1,46 m² de área de superfície corporal (ASC)] dada a dose humana recomendada de 30 mg/dia. Lansoprazol produziu hiperplasia de células semelhantes a enterocromafins gástricas (ECL) e carcinoides de células ECL em ratos machos e fêmeas. Também aumentou a incidência de metaplasia intestinal do epitélio gástrico em ambos os sexos. Em ratos machos, o lansoprazol produziu um aumento relacionado com a dose de adenomas de células intersticiais testiculares. A incidência desses adenomas em ratos que receberam doses de 15 a 150 mg/kg/dia (quatro a 40 vezes a dose humana recomendada com base na BSA) excedeu a baixa incidência de fundo (intervalo = 1,4 a 10%) para esta cepa de rato.
Em um estudo de carcinogenicidade de 24 meses, camundongos CD-1 foram tratados com doses orais de lansoprazol de 15 a 600 mg/kg/dia, duas a 80 vezes a dose humana recomendada com base na BSA. O lansoprazol produziu um aumento da incidência de hiperplasia de células ECL gástricas relacionado com a dose. Também produziu um aumento da incidência de tumores hepáticos (adenoma hepatocelular mais carcinoma). As incidências de tumor em camundongos machos tratados com 300 e 600 mg/kg/dia (40 a 80 vezes a dose humana recomendada com base em BSA) e camundongos fêmeas tratados com 150 a 600 mg/kg/dia (20 a 80 vezes a dose humana recomendada dose baseada em BSA) excedeu as faixas de incidências de fundo em controles históricos para esta linhagem de camundongos. O tratamento com lansoprazol produziu adenoma de rete testis em camundongos machos recebendo 75 a 600 mg/kg/dia (10 a 80 vezes a dose humana recomendada com base na BSA).
Um estudo de carcinogenicidade de camundongo transgênico p53 (+/-) de 26 semanas não foi positivo.
Lansoprazol foi positivo no teste de Ames e no ensaio de aberração cromossômica de linfócitos humanos in vitro. O lansoprazol não foi genotóxico no teste ex vivo de síntese de DNA não programada de hepatócitos de rato (UDS), no teste de micronúcleo de camundongo in vivo ou no teste de aberração cromossômica de células de medula óssea de rato.
Lansoprazol em doses orais de até 150 mg/kg/dia (40 vezes a dose humana recomendada com base na BSA) não teve efeito sobre a fertilidade e o desempenho reprodutivo de ratos machos e fêmeas.
Uso em populações específicas
Gravidez
Resumo do risco
Os dados disponíveis de estudos observacionais publicados em geral não indicam uma associação de resultados adversos da gravidez com o tratamento com lansoprazol (ver Dados ).
Em estudos de reprodução em animais, a administração oral de lansoprazol a ratos durante a organogénese até à lactação a 6,4 vezes a dose humana máxima recomendada produziu reduções na descendência no peso do fémur, comprimento do fémur, comprimento coroa-nádega e espessura da placa de crescimento (apenas machos) no dia pós-natal 21 (ver Dados ). Esses efeitos foram associados à redução no ganho de peso corporal. Aconselhar as mulheres grávidas sobre o risco potencial para o feto.
O risco de fundo estimado de defeitos congênitos graves e aborto espontâneo para as populações indicadas é desconhecido. Todas as gestações têm um risco histórico de defeitos congênitos, perda ou outros resultados adversos. Na população geral dos EUA, o risco de fundo estimado de defeitos congênitos graves e aborto espontâneo em gestações clinicamente reconhecidas é de 2 a 4% e 15 a 20%, respectivamente.
Se PREVACID 15mg ou PREVACID 15mg SoluTab for administrado com claritromicina, as informações de gravidez para claritromicina também se aplicam ao regime de combinação. Consulte as informações de prescrição da claritromicina para obter mais informações sobre o uso na gravidez.
Dados
Dados humanos
Os dados disponíveis de estudos observacionais publicados não conseguiram demonstrar uma associação de resultados adversos relacionados à gravidez e uso de lansoprazol. As limitações metodológicas desses estudos observacionais não podem estabelecer ou excluir definitivamente qualquer risco associado a drogas durante a gravidez. Em um estudo prospectivo da European Network of Teratology Information Services, os resultados de um grupo de 62 mulheres grávidas que receberam doses médias diárias de 30 mg de lansoprazol foram comparados a um grupo controle de 868 mulheres grávidas que não tomaram IBPs. Não houve diferença na taxa de malformações maiores entre as mulheres expostas aos IBPs e o grupo controle, correspondendo a um Risco Relativo (RR)=1,04, [Intervalo de Confiança de 95% (IC) 0,25-4,21]. Em um estudo de coorte retrospectivo de base populacional cobrindo todos os nascidos vivos na Dinamarca de 1996 a 2008, não houve aumento significativo de defeitos congênitos maiores durante a análise da exposição ao lansoprazol no primeiro trimestre em 794 nascidos vivos. Uma meta-análise que comparou 1.530 gestantes expostas a IBPs pelo menos no primeiro trimestre com 133.410 gestantes não expostas não mostrou aumentos significativos no risco de malformações congênitas ou aborto espontâneo com exposição a IBPs (para malformações maiores Odds Ratio (OR)=1,12 , [IC 95% 0,86-1,45] e para abortos espontâneos OR = 1,29, [IC 95% 0,841,97]).
Dados de animais
Não ocorreram efeitos adversos no desenvolvimento embriofetal em estudos realizados em ratas grávidas com doses orais de lansoprazol de até 150 mg/kg/dia (40 vezes a dose humana recomendada [30 mg/dia] com base na área de superfície corporal) administradas durante a organogênese e coelhas grávidas em doses orais de lansoprazol de até 30 mg/kg/dia (16 vezes a dose humana recomendada com base na área de superfície corporal) administradas durante a organogênese.
Um estudo de toxicidade de desenvolvimento pré e pós-natal em ratos com parâmetros adicionais para avaliar o desenvolvimento ósseo foi realizado com lansoprazol em doses orais de 10 a 100 mg/kg/dia (0,7 a 6,4 vezes a dose máxima recomendada de lansoprazol humano de 30 mg com base na AUC [área sob a curva de concentração plasmática-tempo]) administrado durante a organogênese até a lactação. Os efeitos maternos observados com 100 mg/kg/dia (6,4 vezes a dose máxima recomendada de lansoprazol humano de 30 mg com base na AUC) incluíram aumento do período de gestação, diminuição do ganho de peso corporal durante a gestação e diminuição do consumo de alimentos. O número de natimortos aumentou com esta dose, o que pode ter sido secundário à toxicidade materna. O peso corporal dos filhotes foi reduzido em 100 mg/kg/dia começando no dia 11 pós-natal. O peso do fêmur, comprimento do fêmur e comprimento coroa-nádega foram reduzidos em 100 mg/kg/dia no dia 21 pós-natal. O peso do fêmur ainda foi diminuído em o grupo de 100 mg/kg/dia na idade de 17 a 18 semanas. A espessura da placa de crescimento foi diminuída nos machos de 100 mg/kg/dia no dia 21 pós-natal e foi aumentada nos machos de 30 e 100 mg/kg/dia na idade de 17 a 18 semanas. Os efeitos nos parâmetros ósseos foram associados à redução no ganho de peso corporal.
Lactação
Resumo do risco
Não há informações sobre a presença de lansoprazol no leite humano, os efeitos no lactente ou os efeitos na produção de leite. No entanto, o lansoprazol e os seus metabolitos estão presentes no leite de rato. Os benefícios da amamentação para o desenvolvimento e para a saúde devem ser considerados juntamente com a necessidade clínica da mãe de PREVACID 30mg ou PREVACID 30mg SoluTab e quaisquer potenciais efeitos adversos na criança amamentada de PREVACID 30mg ou PREVACID SoluTab ou da condição materna subjacente.
Uso Pediátrico
A segurança e eficácia de PREVACID 15mg e PREVACID 30mg SoluTab foram estabelecidas em pacientes pediátricos de um ano a 17 anos de idade para tratamento de curto prazo de DRGE sintomática e esofagite erosiva.
Em estudos clínicos de DRGE sintomática e esofagite erosiva, PREVACID 30 mg não foi administrado além de 12 semanas em pacientes de um ano a 11 anos de idade. Não se sabe se PREVACID 30mg e PREVACID SoluTab são seguros e eficazes se usados por mais tempo do que a duração recomendada. Não exceda a dose recomendada e a duração do uso em pacientes pediátricos (ver Dados de toxicidade de animais juvenis ).
PREVACID não foi eficaz em pacientes pediátricos com DRGE sintomática de um mês a menos de um ano de idade em um estudo multicêntrico, duplo-cego, controlado por placebo. Portanto, a segurança e a eficácia não foram estabelecidas em pacientes com menos de um ano de idade. Estudos não clínicos em ratos juvenis demonstraram um efeito adverso de espessamento da válvula cardíaca e alterações ósseas em doses de lansoprazol superiores à dose humana equivalente máxima recomendada.
Recém-nascido com menos de um ano de idade
farmacocinética do lansoprazol foi estudada em pacientes pediátricos com DRGE com idade inferior a 28 dias e um a 11 meses. Em comparação com adultos saudáveis que receberam 30 mg, os recém-nascidos tiveram maior exposição (valores médios de AUC normalizados com base no peso 2,04 e 1,88 vezes maiores em doses de 0,5 e 1 mg/kg/dia, respectivamente). Os bebês com idade ≤10 semanas apresentaram valores de depuração e exposição semelhantes aos neonatos. Os bebês com idade superior a 10 semanas que receberam 1 mg/kg/dia apresentaram valores médios de AUC semelhantes aos dos adultos que receberam uma dose de 30 mg.
Lansoprazol não se mostrou eficaz em um estudo de quatro semanas, multicêntrico, duplo-cego, controlado por placebo, de grupos paralelos nos EUA e na Polônia de 162 pacientes entre um mês e menos de 12 meses de idade com DRGE sintomática com base em um histórico médico de choro/agitação/irritabilidade associada à alimentação que não respondeu ao tratamento conservador da DRGE (ou seja, intervenção não farmacológica) por sete a 14 dias. Pacientes recebidos
lansoprazol como suspensão diária (0,2 a 0,3 mg/kg/dia em lactentes ≤ 10 semanas de idade ou 1,0 a 1,5 mg/kg/dia em lactentes com mais de 10 semanas ou placebo) por até quatro semanas de tratamento duplo-cego.
O desfecho primário de eficácia foi avaliado por uma redução superior a 50% da linha de base na porcentagem de mamadas com um episódio de choro/agitação/irritabilidade ou na duração (minutos) de um episódio de choro/agitação/irritabilidade dentro de uma hora após a alimentação.
Não houve diferença na porcentagem de respondedores entre o grupo de suspensão pediátrica de lansoprazol e o grupo placebo (54% em ambos os grupos).
Não houve eventos adversos relatados em estudos clínicos pediátricos (um mês a menos de 12 meses de idade) que não tenham sido observados anteriormente em adultos.
Com base nos resultados do estudo de eficácia de Fase 3, o lansoprazol não demonstrou ser eficaz. Portanto, esses resultados não suportam o uso de lansoprazol no tratamento da DRGE sintomática em lactentes.
Um ano a 11 anos de idade
Em um estudo multicêntrico não controlado, aberto, nos EUA, 66 pacientes pediátricos (um ano a 11 anos de idade) com DRGE foram designados, com base no peso corporal, para receber uma dose inicial de PREVACID 15 mg diariamente se ≤ 30 kg ou PREVACID 30 mg diariamente se maior que 30 kg administrado por oito a 12 semanas. A dose de PREVACID foi aumentada (até 30 mg duas vezes ao dia) em 24 de 66 pacientes pediátricos após duas ou mais semanas de tratamento, caso permanecessem sintomáticos. No início do estudo, 85% dos pacientes apresentavam sintomas gerais de DRGE leves a moderados (avaliados pela entrevista do investigador), 58% tinham DRGE não erosiva e 42% tinham esofagite erosiva (avaliada por endoscopia).
Após oito a 12 semanas de tratamento com PREVACID 15mg, a análise de intenção de tratar demonstrou uma redução aproximada de 50% na frequência e gravidade dos sintomas da DRGE.
Vinte e um dos 27 pacientes com esofagite erosiva foram curados em oito semanas e 100% dos pacientes foram curados em 12 semanas por endoscopia (Tabela 4).
Em um estudo com 66 pacientes pediátricos na faixa etária de um ano a 11 anos após o tratamento com PREVACID 15mg administrado por via oral em doses de 15mg ao dia a 30mg duas vezes ao dia, os aumentos nos níveis séricos de gastrina foram semelhantes aos observados em estudos com adultos. Os níveis medianos de gastrina sérica em jejum aumentaram 89% de 51 pg/mL na linha de base para 97 pg/mL [intervalo interquartil (percentil 25 a 75) de 71 a 130 pg/mL] na visita final.
A segurança pediátrica de PREVACID 30 mg cápsulas foi avaliada em 66 doentes pediátricos com idades compreendidas entre um e 11 anos. Dos 66 pacientes com DRGE, 85% (56/66) tomaram PREVACID 30mg por oito semanas e 15% (10/66) por 12 semanas.
As reações adversas relacionadas ao tratamento mais frequentemente relatadas (dois ou mais pacientes) em pacientes de um a 11 anos de idade (N=66) foram constipação (5%) e dor de cabeça (3%).
Doze anos a 17 anos de idade
Em um estudo multicêntrico não controlado, aberto, nos EUA, 87 pacientes adolescentes (12 anos a 17 anos de idade) com DRGE sintomática foram tratados com PREVACID por oito a 12 semanas. Endoscopias superiores basais classificaram esses pacientes em dois grupos: 64 (74%) DRGE não erosiva e 23 (26%) esofagite erosiva (EE). Os pacientes com DRGE não erosiva receberam PREVACID 15 mg diariamente por oito semanas e os pacientes com EE receberam PREVACID 30 mg diariamente por oito a 12 semanas. No início do estudo, 89% desses pacientes apresentavam sintomas gerais de DRGE leves a moderados (avaliados por entrevistas com investigadores). Durante oito semanas de tratamento com PREVACID 15mg, os pacientes adolescentes experimentaram uma redução de 63% na frequência e uma redução de 69% na gravidade dos sintomas da DRGE com base nos resultados do diário.
Vinte e um dos 22 (95,5%) pacientes adolescentes com esofagite erosiva foram curados após oito semanas de tratamento com PREVACID 15mg. Um paciente permaneceu sem cicatrização após 12 semanas de tratamento (Tabela 5).
Nesses 87 pacientes adolescentes, os aumentos nos níveis séricos de gastrina foram semelhantes aos observados em estudos em adultos, os níveis medianos de gastrina sérica em jejum aumentaram 42% de 45 pg/mL no início do estudo para 64 pg/mL [intervalo interquartil (25º a 75º percentil) de 44 a 88 pg/mL] na visita final. (Os níveis normais de gastrina sérica são de 25 a 111 pg/mL.)
A segurança das cápsulas de PREVACID foi avaliada nesses 87 pacientes adolescentes. Dos 87 pacientes adolescentes com DRGE, 6% (5/87) tomaram PREVACID 15mg por menos de seis semanas, 93% (81/87) por seis a 10 semanas e 1% (1/87) por mais de 10 semanas .
As reações adversas relacionadas com o tratamento mais frequentemente notificadas (pelo menos 3%) nestes doentes foram cefaleias (7%), dor abdominal (5%), náuseas (3%) e tonturas (3%). Tontura relacionada ao tratamento, relatada nesta bula como ocorrendo em menos de 1% dos pacientes adultos, foi relatada neste estudo por três pacientes adolescentes com DRGE não erosiva, que apresentaram tontura concomitantemente com outras reações (como enxaqueca, dispneia, e vômito).
Dados de toxicidade de animais juvenis
Espessamento da válvula cardíaca
Em dois estudos de toxicidade oral, ocorreu espessamento da válvula cardíaca mitral em ratos jovens tratados com lansoprazol. O espessamento da válvula cardíaca foi observado principalmente com a administração oral iniciada no dia 7 pós-natal (idade equivalente a neonatos humanos) e no dia 14 pós-natal (idade humana equivalente a aproximadamente um ano) em doses de 250 mg/kg/dia e superiores (no dia 7 pós-natal e dia 14 pós-natal, respectivamente 6,2 vezes e 4,2 vezes a dose pediátrica diária de 15 mg em pacientes pediátricos de um a 11 anos com peso igual ou inferior a 30 kg, com base na AUC). A duração do tratamento associado ao espessamento da válvula cardíaca variou de 5 dias a 8 semanas. Os achados reverteram ou tenderam para a reversibilidade após um período de recuperação de 4 semanas sem drogas. A incidência de espessamento da válvula cardíaca após o início da administração no dia 21 pós-natal (idade humana equivalente a aproximadamente dois anos) foi limitada a um único rato (1/24) em grupos que receberam 500 mg/kg/dia por 4 ou 8 semanas (aproximadamente 5,2 vezes a dose pediátrica diária de 15 mg em pacientes pediátricos de 1 a 11 anos com peso igual ou inferior a 30 kg, com base na AUC). Com base nas margens de exposição, o risco de lesão da válvula cardíaca não parece ser relevante para pacientes com um ano de idade ou mais.
Alterações ósseas
Em um estudo de toxicidade oral de oito semanas em ratos juvenis com dosagem iniciada no dia 7 pós-natal, doses iguais ou superiores a 100 mg/kg/dia (2,5 vezes a dose pediátrica diária de 15 mg em crianças de um a 11 anos com peso de 30 kg ou menos, com base na AUC) produziram atraso no crescimento, com comprometimento do ganho de peso observado já no 10º dia pós-natal (idade equivalente a humanos neonatais). No final do tratamento, os sinais de crescimento prejudicado a 100 mg/kg/dia e superiores incluíram reduções no peso corporal (14 a 44% em comparação com controles), peso absoluto de múltiplos órgãos, peso do fêmur, comprimento do fêmur e coroa- comprimento da garupa. A espessura da placa de crescimento femoral foi reduzida apenas nos machos e apenas na dose de 500 mg/kg/dia. Os efeitos relacionados ao atraso no crescimento persistiram até o final do período de recuperação de quatro semanas. Dados de longo prazo não foram coletados.
Uso Geriátrico
Do número total de pacientes (n=21.486) em estudos clínicos de PREVACID, 16% dos pacientes tinham 65 anos ou mais, enquanto 4% tinham 75 anos ou mais. Não foram observadas diferenças gerais na segurança ou eficácia entre esses pacientes e pacientes mais jovens e outras experiências clínicas relatadas não identificaram diferenças significativas nas respostas entre pacientes geriátricos e pacientes mais jovens, mas a maior sensibilidade de alguns indivíduos mais velhos não pode ser descartada [ver FARMACOLOGIA CLÍNICA ].

Insuficiência hepática
Em pacientes com vários graus de insuficiência hepática crônica, a exposição ao lansoprazol foi aumentada em comparação com indivíduos saudáveis com função hepática normal [ver FARMACOLOGIA CLÍNICA ]. Não é necessário ajuste de dose para PREVACID ou PREVACID SoluTab para pacientes com insuficiência hepática leve (Child-Pugh Classe A) ou moderada (Child-Pugh Classe B). A posologia recomendada é de 15 mg por via oral diariamente em pacientes com insuficiência hepática grave (Child-Pugh Classe C) [ver DOSAGEM E ADMINISTRAÇÃO ].
SOBREDOSAGEM
lansoprazol não é removido da circulação por hemodiálise. Em uma superdosagem relatada, um paciente consumiu 600 mg de PREVACID 15 mg sem reação adversa. Doses orais de lansoprazol até 5000 mg/kg em ratos [aproximadamente 1300 vezes a dose humana de 30 mg com base na área de superfície corporal (BSA)] e em camundongos (cerca de 675,7 vezes a dose humana de 30 mg com base na BSA) não produziram mortes ou quaisquer sinais clínicos.
Em caso de exposição excessiva, o tratamento deve ser sintomático e de suporte.
Se ocorrer superexposição, ligue para o seu centro de controle de envenenamento em 1-800-222-1222 para obter informações atualizadas sobre o gerenciamento de envenenamento ou superexposição.
CONTRA-INDICAÇÕES
- PREVACID 15mg e PREVACID 15mg SoluTab são contraindicados em pacientes com hipersensibilidade conhecida a qualquer componente da formulação. As reações de hipersensibilidade podem incluir anafilaxia, choque anafilático, angioedema, broncoespasmo, nefrite tubulointersticial aguda e urticária. AVISOS E PRECAUÇÕES , REAÇÕES ADVERSAS ].
- Os inibidores da bomba de prótons (IBPs), incluindo PREVACID e PREVACID SoluTab, são contraindicados com produtos contendo rilpivirina [consulte INTERAÇÕES MEDICAMENTOSAS ].
- Para obter informações sobre as contraindicações de agentes antibacterianos (claritromicina e amoxicilina) indicados em combinação com PREVACID ou PREVACID 30mg SoluTab, consulte a seção Contraindicações de suas informações de prescrição.
FARMACOLOGIA CLÍNICA
Mecanismo de ação
lansoprazol pertence a uma classe de compostos antissecretores, os benzimidazóis substituídos, que suprimem a secreção de ácido gástrico por inibição específica do sistema enzimático (H+, K+)-ATPase na superfície secretora da célula parietal gástrica. Como esse sistema enzimático é considerado a bomba de ácido (próton) dentro da célula parietal, o lansoprazol foi caracterizado como um inibidor da bomba de ácido gástrico, pois bloqueia a etapa final da produção de ácido. Este efeito está relacionado com a dose e leva à inibição da secreção de ácido gástrico basal e estimulado, independentemente do estímulo. O lansoprazol não apresenta atividade anticolinérgica ou antagonista de histamina tipo 2.
Farmacodinâmica
Atividade antisecretora
Após a administração oral, o lansoprazol mostrou diminuir significativamente a produção de ácido basal e aumentar significativamente o pH gástrico médio e a porcentagem de tempo em que o pH gástrico foi maior que três e maior que quatro. O lansoprazol também reduziu significativamente a produção de ácido gástrico estimulada pela refeição e o volume de secreção, bem como a produção de ácido estimulada pela pentagastrina. Em pacientes com hipersecreção de ácido, o lansoprazol reduziu significativamente a secreção de ácido gástrico basal e estimulada pela pentagastrina. O lansoprazol inibiu os aumentos normais do volume de secreção, acidez e produção de ácido induzidos pela insulina.
Os resultados de pH intragástrico de um estudo farmacodinâmico cruzado de cinco dias de 15 e 30 mg de lansoprazol uma vez ao dia são apresentados na Tabela 6:
Após a dose inicial neste estudo, observou-se aumento do pH gástrico em uma a duas horas com 30 mg de lansoprazol e duas a três horas com 15 mg de lansoprazol. Após várias doses diárias, observou-se aumento do pH gástrico na primeira hora após a administração de 30 mg de lansoprazol e uma a duas horas após a administração de 15 mg de lansoprazol.
A supressão ácida pode aumentar o efeito dos antimicrobianos na erradicação do Helicobacter pylori (H. pylori). A porcentagem de tempo que o pH gástrico estava elevado acima de cinco e seis foi avaliada em um estudo cruzado de PREVACID administrado diariamente, duas vezes ao dia e três vezes ao dia (Tabela 7).
A inibição da secreção de ácido gástrico medida pelo pH intragástrico voltou gradualmente ao normal ao longo de dois a quatro dias após doses múltiplas. Não houve indicação de acidez gástrica rebote.
Efeitos de células semelhantes à enterocromafina (ECL)
Durante a exposição ao longo da vida de ratos com até 150 mg/kg/dia de lansoprazol administrado sete dias por semana, observou-se hipergastrinemia acentuada seguida de proliferação de células ECL e formação de tumores carcinoides, especialmente em ratos fêmeas. Amostras de biópsia gástrica do corpo do estômago de aproximadamente 150 pacientes tratados continuamente com lansoprazol por pelo menos um ano não mostraram evidência de efeitos nas células ECL semelhantes aos observados em estudos em ratos. Dados de longo prazo são necessários para descartar a possibilidade de um risco aumentado de desenvolvimento de tumores gástricos em pacientes recebendo terapia de longo prazo com lansoprazol [ver Toxicologia não clínica ].
Outros efeitos gástricos em humanos
Lansoprazol não afetou significativamente o fluxo sanguíneo da mucosa no fundo do estômago. Devido ao efeito fisiológico normal causado pela inibição da secreção de ácido gástrico, observou-se uma diminuição de cerca de 17% no fluxo sanguíneo no antro, piloro e bulbo duodenal. Lansoprazol retardou significativamente o esvaziamento gástrico de sólidos digeríveis. Lansoprazol aumentou os níveis séricos de pepsinogênio e diminuiu a atividade da pepsina em condições basais e em resposta à estimulação da refeição ou injeção de insulina. Tal como acontece com outros agentes que elevam o pH intragástrico, aumentos no pH gástrico foram associados a aumentos nas bactérias redutoras de nitrato e elevação da concentração de nitrito no suco gástrico em pacientes com úlcera gástrica. Não foi observado aumento significativo nas concentrações de nitrosaminas.
Efeitos da gastrina sérica
Em mais de 2.100 pacientes, os níveis medianos de gastrina sérica em jejum aumentaram de 50 a 100% desde o início, mas permaneceram dentro da faixa normal após o tratamento com 15 a 60 mg de lansoprazol oral. Essas elevações atingiram um platô dentro de dois meses de terapia e retornaram aos níveis pré-tratamento dentro de quatro semanas após a descontinuação da terapia.
O aumento da gastrina causa hiperplasia de células semelhantes a enterocromafins e aumento dos níveis séricos de CgA. Os níveis aumentados de CgA podem causar resultados falso-positivos em investigações diagnósticas para tumores neuroendócrinos [ver AVISOS E PRECAUÇÕES ].
Efeitos Endócrinos
Estudos em humanos por até um ano não detectaram nenhum efeito clinicamente significativo no sistema endócrino. Os hormônios estudados incluem testosterona, hormônio luteinizante (LH), hormônio folículo estimulante (FSH), globulina ligadora de hormônios sexuais (SHBG), sulfato de dehidroepiandrosterona (DHEA-S), prolactina, cortisol, estradiol, insulina, aldosterona, paratormônio, glucagon, estimulante da tireóide hormônio (TSH), triiodotironina (T3), tiroxina (T4) e hormônio somatotrópico (STH). Lansoprazol em doses orais de 15 a 60 mg por até um ano não teve efeito clinicamente significativo na função sexual. Além disso, o lansoprazol em doses orais de 15 a 60 mg por duas a oito semanas não teve efeito clinicamente significativo na função da tireoide. Em estudos de carcinogenicidade de 24 meses em ratos Sprague-Dawley com doses diárias de lansoprazol de até 150 mg/kg, as alterações proliferativas nas células de Leydig dos testículos, incluindo neoplasia benigna, aumentaram em comparação com ratos controle.
Outros efeitos
Nenhum efeito sistêmico do lansoprazol no sistema nervoso central, linfóide, hematopoiético, renal, hepático, cardiovascular ou respiratório foi encontrado em humanos. Entre 56 pacientes que tiveram extensas avaliações oculares de base, nenhuma toxicidade visual foi observada após o tratamento com lansoprazol (até 180 mg/dia) por até 58 meses. Após exposição vitalícia ao lansoprazol em ratos, observou-se atrofia pancreática focal, hiperplasia linfóide difusa no timo e atrofia retiniana espontânea.
Farmacocinética
Absorção
PREVACID 15mg e PREVACID SoluTab contêm uma formulação de lansoprazol em grânulos com revestimento entérico (porque o lansoprazol é ácido-lábil), de modo que a absorção de lansoprazol começa apenas após os grânulos deixarem o estômago. O pico médio dos níveis plasmáticos de lansoprazol ocorre em aproximadamente 1,7 horas. Após uma administração de dose única de 15 a 60 mg de lansoprazol oral, as concentrações plasmáticas máximas (Cmax) de lansoprazol e a área sob as curvas de concentração plasmática (AUCs) de lansoprazol foram aproximadamente proporcionais à dose administrada. O lansoprazol não se acumula e sua farmacocinética não é alterada por doses múltiplas. A biodisponibilidade absoluta é superior a 80%. Em indivíduos saudáveis, a meia-vida plasmática média (±SD) foi de 1,5 (±1,0) horas. Tanto a Cmax como a AUC diminuem cerca de 50 a 70% se o lansoprazol for administrado 30 minutos após a refeição, em comparação com a condição de jejum. Não há efeito alimentar significativo se o lansoprazol for administrado antes das refeições.
Distribuição
lansoprazol está 97% ligado às proteínas plasmáticas. A ligação às proteínas plasmáticas é constante na faixa de concentração de 0,05 a 5 mcg/mL.
Eliminação
Metabolismo
O lansoprazol é extensamente metabolizado no fígado. Dois metabólitos foram identificados em quantidades mensuráveis no plasma (os derivados hidroxilados sulfinil e sulfona do lansoprazol). Esses metabólitos têm muito pouca ou nenhuma atividade antissecretora. Pensa-se que o lansoprazol se transforma em duas espécies activas que inibem a secreção ácida bloqueando a bomba de protões [sistema enzimático (H+, K+)-ATPase] na superfície secretora da célula parietal gástrica. As duas espécies ativas não estão presentes na circulação sistêmica. A meia-vida de eliminação plasmática do lansoprazol é inferior a duas horas, enquanto o efeito inibitório do ácido dura mais de 24 horas. Portanto, a meia-vida de eliminação plasmática do lansoprazol não reflete sua duração de supressão da secreção de ácido gástrico.
Excreção
Após a administração oral de dose única de PREVACID, praticamente nenhum lansoprazol inalterado foi excretado na urina. Em um estudo, após uma dose oral única de 14Clansoprazol, aproximadamente um terço da radiação administrada foi excretada na urina e dois terços foram recuperados nas fezes. Isto implica uma excreção biliar significativa dos metabolitos de lansoprazol.
Populações Específicas
Pacientes pediátricos
Um a 17 anos de idade
farmacocinética do lansoprazol foi estudada em doentes pediátricos com DRGE com idades entre um e 11 anos e 12 a 17 anos em dois estudos clínicos separados. Em crianças com idades entre um e 11 anos, lansoprazol foi administrado 15 mg por dia para indivíduos com peso ≤ 30 kg e 30 mg por dia para indivíduos com peso superior a 30 kg. Os valores médios de Cmax e AUC observados no Dia 5 de dosagem foram semelhantes entre os dois grupos de dose e não foram afetados pelo peso ou idade dentro de cada grupo de dose ajustado ao peso usado no estudo. Em indivíduos adolescentes com idade entre 12 e 17 anos, os indivíduos foram randomizados para receber lansoprazol na dose de 15 ou 30 mg por dia. Os valores médios de Cmax e AUC do lansoprazol não foram afetados pelo peso corporal ou idade; e foram observados aumentos quase proporcionais à dose nos valores médios de Cmax e AUC entre os dois grupos de dose no estudo. Globalmente, a farmacocinética do lansoprazol em doentes pediátricos com idades compreendidas entre um e 17 anos foi semelhante à observada em indivíduos adultos saudáveis.
Pacientes Geriátricos
depuração do lansoprazol está diminuída em idosos, com meia-vida de eliminação aumentada em aproximadamente 50 a 100%. Como a meia-vida média em idosos permanece entre 1,9 a 2,9 horas, a administração repetida uma vez ao dia não resulta em acúmulo de lansoprazol. Os níveis plasmáticos de pico não foram aumentados em idosos [ver Uso em populações específicas ].
Pacientes Masculinos e Femininos
Em um estudo comparando 12 indivíduos do sexo masculino e seis do sexo feminino que receberam lansoprazol, não foram encontradas diferenças relacionadas ao sexo na farmacocinética e nos resultados de pH intragástrico.
Grupos raciais ou étnicos
Os parâmetros farmacocinéticos médios agrupados de PREVACID de doze estudos americanos (N=513) foram comparados com os parâmetros farmacocinéticos médios de dois estudos asiáticos (N=20). As AUCs médias de PREVACID 30mg em indivíduos asiáticos foram aproximadamente o dobro daquelas observadas em dados agrupados dos EUA; entretanto, a variabilidade interindividual foi alta. Os valores de Cmax foram comparáveis.
Pacientes com Insuficiência Renal
Em pacientes com insuficiência renal grave, a ligação às proteínas plasmáticas diminuiu de 1 a 1,5% após a administração de 60 mg de lansoprazol. Pacientes com insuficiência renal tiveram uma meia-vida de eliminação reduzida e AUC total diminuída (livre e ligada). A AUC do lansoprazol livre no plasma, no entanto, não foi relacionada com o grau de insuficiência renal; e a Cmax e Tmax (tempo para atingir a concentração máxima) não foram diferentes da Cmax e Tmax de indivíduos com função renal normal. Portanto, a farmacocinética do lansoprazol não foi clinicamente diferente em pacientes com insuficiência renal leve, moderada ou grave em comparação com indivíduos saudáveis com função renal normal.
Pacientes com Insuficiência Hepática
Em pacientes com insuficiência hepática leve (Child-Pugh Classe A) ou moderada (Child-Pugh Classe B), houve um aumento aproximado de 3 vezes na AUC média em comparação com indivíduos saudáveis com função hepática normal após múltiplas doses orais de 30 mg de PREVACID 30 mg por sete dias. A meia-vida plasmática média correspondente do lansoprazol foi prolongada de 1,5 para quatro horas (Child-Pugh A) ou cinco horas (Child-Pugh B).
Em pacientes com cirrose compensada e descompensada, houve um aumento aproximado de 6 e 5 vezes na AUC, respectivamente, em comparação com indivíduos saudáveis com função hepática normal após uma dose oral única de 30 mg de PREVACID [ver DOSAGEM E ADMINISTRAÇÃO , Uso em populações específicas ].
Estudos de interação medicamentosa
Efeito do lansoprazol em outras drogas
Interações do Citocromo P450
lansoprazol é metabolizado através do sistema do citocromo P450, especificamente através das isoenzimas CYP3A e CYP2C19. Estudos demonstraram que PREVACID 15mg não possui interações clinicamente significativas com outros medicamentos metabolizados pelo sistema citocromo P450, como varfarina, antipirina, indometacina, ibuprofeno, fenitoína, propranolol, prednisona, diazepam ou claritromicina em indivíduos saudáveis. Esses compostos são metabolizados através de várias isoenzimas do citocromo P450, incluindo CYP1A2, CYP2C9, CYP2C19, CYP2D6 e CYP3A.
Teofilina
Quando PREVACID 30 mg foi administrado concomitantemente com teofilina (CYP1A2, CYP3A), foi observado um pequeno aumento (10%) na depuração da teofilina. Devido à pequena magnitude e à direção do efeito na depuração da teofilina, é improvável que essa interação seja motivo de preocupação clínica [ver INTERAÇÕES MEDICAMENTOSAS ].
Metotrexato e 7-hidroximetotrexato
Em um estudo farmacocinético aberto, de braço único, de oito dias, de 28 pacientes adultos com artrite reumatoide (que necessitaram do uso crônico de 7,5 a 15 mg de metotrexato administrados semanalmente), administração de sete dias de naproxeno 500 mg duas vezes ao dia e PREVACID 30 mg por dia não tiveram efeito na farmacocinética do metotrexato e do 7-hidroximetotrexato. Embora este estudo não tenha sido projetado para avaliar a segurança dessa combinação de medicamentos, não foram observadas reações adversas importantes. No entanto, este estudo foi realizado com baixas doses de metotrexato. Não foi realizado um estudo de interação medicamentosa com altas doses de metotrexato [ver AVISOS E PRECAUÇÕES ].
Amoxicilina
O PREVACID 30mg também demonstrou não ter interação clinicamente significativa com a amoxicilina.
Sucralfato
Em um estudo cruzado de dose única examinando PREVACID 30 mg administrado isoladamente e concomitantemente com 1 grama de sucralfato, a absorção de lansoprazol foi retardada e a biodisponibilidade foi reduzida em 17% quando administrado concomitantemente com sucralfato [ver DOSAGEM E ADMINISTRAÇÃO , INTERAÇÕES MEDICAMENTOSAS ].
Antiácidos
Em ensaios clínicos, antiácidos foram administrados concomitantemente com PREVACID 15mg e não houve evidência de alteração na eficácia de PREVACID.
Clopidogrel
O clopidogrel é metabolizado em seu metabólito ativo em parte pelo CYP2C19. Foi realizado um estudo de indivíduos saudáveis que eram metabolizadores extensos de CYP2C19, recebendo administração de clopidogrel 75 mg uma vez ao dia sozinho ou concomitantemente com PREVACID 30 mg (n=40), por nove dias. A AUC média do metabólito ativo do clopidogrel foi reduzida em aproximadamente 14% (a razão AUC média foi de 86%, com IC de 90% de 80 a 92%) quando PREVACID foi coadministrado em comparação com a administração de clopidogrel isoladamente.
Os parâmetros farmacodinâmicos também foram medidos e demonstraram que a alteração na inibição da agregação plaquetária (induzida por 5 mcM ADP) estava relacionada à alteração na exposição ao metabólito ativo do clopidogrel. O efeito na exposição ao metabólito ativo do clopidogrel e na inibição plaquetária induzida pelo clopidogrel não é considerado clinicamente importante.
Efeito de outras drogas no lansoprazol
Como o lansoprazol é metabolizado pelo CYP2C19 e CYP3A4, os indutores e inibidores dessas enzimas podem alterar potencialmente a exposição do lansoprazol.
Microbiologia
Microbiologia
Lansoprazol, claritromicina e/ou amoxicilina demonstraram ser ativos contra a maioria das cepas de Helicobacter pylori in vitro e em infecções clínicas. INDICAÇÕES E USO ].
Resistência ao pré-tratamento de Helicobacter Pylori
A resistência pré-tratamento com claritromicina (≥2,0 mcg/mL) foi de 9,5% (91/960) por E-teste e 11,3% (12/106) por diluição em ágar nos ensaios clínicos de terapia dupla e tripla (M93-125, M93-130, M93131, M95-392 e M95-399).
Isolados suscetíveis ao pré-tratamento de amoxicilina (≤0,25 mcg/mL) ocorreram em 97,8% (936/957) e 98,0% (98/100) dos pacientes nos ensaios clínicos de terapia dupla e tripla por E-test e diluição em ágar, respectivamente. Vinte e um dos 957 pacientes (2,2%) pelo teste E, e dois dos 100 pacientes (2,0%) pela diluição em ágar, tiveram CIMs pré-tratamento com amoxicilina maiores que 0,25 mcg/mL. Um paciente no regime de terapia tripla de 14 dias teve uma concentração inibitória mínima de amoxicilina pré-tratamento não confirmada (CIM) superior a 256 mcg/mL pelo teste E e o paciente foi erradicado de H. pylori (Tabela 8).
Pacientes não erradicados do H. pylori após terapia tripla com lansoprazol/amoxicilina/claritromicina provavelmente terão H. pylori resistente à claritromicina. Portanto, para aqueles pacientes que falharam na terapia, o teste de sensibilidade à claritromicina deve ser feito quando possível. Pacientes com H. pylori resistente à claritromicina não devem ser tratados com terapia tripla de lansoprazol/amoxicilina/claritromicina ou com regimes que incluem claritromicina como único agente antimicrobiano.
Resultados do Teste de Suscetibilidade à Amoxicilina e Resultados Clínicos/Bacteriológicos
Nos ensaios clínicos de terapia dupla e tripla, 82,6% (195/236) dos pacientes que tiveram CIMs suscetíveis à amoxicilina pré-tratamento (≤0,25 mcg/mL) foram erradicados de H. pylori. Daqueles com CIMs de amoxicilina pré-tratamento superiores a 0,25 mcg/mL, três de seis tiveram o H. pylori erradicado. Um total de 30% (21/70) dos pacientes falhou na terapia dupla com lansoprazol 30 mg três vezes ao dia/amoxicilina 1 g três vezes ao dia e um total de 12,8% (22/172) dos pacientes falhou na terapia tripla de 10 e 14 dias regimes de terapia. Os resultados de suscetibilidade pós-tratamento não foram obtidos em 11 dos pacientes que falharam na terapia. Nove dos 11 pacientes com CIMs pós-tratamento de amoxicilina que falharam no regime de terapia tripla também tinham isolados de H. pylori resistentes à claritromicina.
Teste de suscetibilidade para Helicobacter pylori
Para obter informações de teste de suscetibilidade sobre Helicobacter pylori, consulte Seção de microbiologia em informações de prescrição para claritromicina e amoxicilina .
Estudos clínicos
Úlcera duodenal
Em um estudo multicêntrico, duplo-cego, controlado por placebo, dose-resposta nos EUA (15, 30 e 60 mg de PREVACID uma vez ao dia) de 284 pacientes com úlcera duodenal documentada endoscopicamente, a porcentagem de pacientes curados após duas e quatro semanas foi significativamente maior com todas as doses de PREVACID do que com placebo. Não houve evidência de uma resposta maior ou mais precoce com as duas doses mais altas em comparação com PREVACID 15 mg. Com base neste estudo e no segundo estudo descrito abaixo, a dose recomendada de PREVACID 15mg na úlcera duodenal é de 15 mg por dia (Tabela 9).
PREVACID 15 mg foi significativamente mais eficaz do que o placebo no alívio da dor abdominal diurna e noturna e na diminuição da quantidade de antiácido tomado por dia.
Em um segundo estudo multicêntrico nos EUA, também duplo-cego, controlado por placebo, de comparação de dose (15 e 30 mg de PREVACID 15 mg uma vez ao dia) e incluindo uma comparação com ranitidina, em 280 pacientes com úlcera duodenal documentada por endoscopia, a porcentagem de pacientes curados após quatro semanas foi significativamente maior com ambas as doses de PREVACID 15mg do que com placebo. Não houve evidência de uma resposta maior ou mais precoce com a dose mais alta de PREVACID. Embora a dose de 15 mg de PREVACID tenha sido superior à ranitidina em quatro semanas, a falta de diferença significativa em duas semanas e a ausência de diferença entre 30 mg de PREVACID e ranitidina deixa a eficácia comparativa dos dois agentes indeterminada (Tabela 10) [ Vejo INDICAÇÕES E USO ].
Erradicação do H. pylori para reduzir o risco de recorrência da úlcera duodenal
Estudos clínicos randomizados e duplo-cegos realizados nos EUA em pacientes com H. pylori e úlcera duodenal (definida como úlcera ativa ou história de úlcera dentro de um ano) avaliaram a eficácia de PREVACID em combinação com amoxicilina e claritromicina como triplo 14 dia ou em combinação com amoxicilina como terapia dupla de 14 dias para a erradicação do H. pylori. Com base nos resultados desses estudos, a segurança e a eficácia de dois regimes de erradicação diferentes foram estabelecidas:
Terapia tripla : PREVACID 30 mg duas vezes ao dia/amoxicilina 1 g duas vezes ao dia/claritromicina 500 mg duas vezes ao dia
Terapia dupla : PREVACID 30 mg três vezes ao dia/amoxicilina 1 g três vezes ao dia
Todos os tratamentos foram por 14 dias. A erradicação do H. pylori foi definida como dois testes negativos (cultura e histologia) quatro a seis semanas após o término do tratamento.
terapia tripla mostrou-se mais eficaz do que todas as combinações de terapia dupla possíveis. A terapia dupla mostrou-se mais eficaz do que ambas as monoterapias. A erradicação do H. pylori demonstrou reduzir o risco de recorrência da úlcera duodenal.
Um estudo clínico randomizado e duplo-cego realizado nos EUA em pacientes com H. pylori e úlcera duodenal (definida como úlcera ativa ou história de úlcera dentro de um ano) comparou a eficácia da terapia tripla PREVACID por 10 e 14 dias. Este estudo estabeleceu que a terapia tripla de 10 dias foi equivalente à terapia tripla de 14 dias na erradicação do H. pylori (Tabelas 11 e 12) [ver INDICAÇÕES E USO ].
Manutenção de úlceras duodenais cicatrizadas
PREVACID demonstrou prevenir a recorrência de úlceras duodenais. Dois ensaios independentes, duplo-cegos, multicêntricos e controlados foram conduzidos em pacientes com úlceras duodenais curadas endoscopicamente confirmadas. Os pacientes permaneceram curados significativamente por mais tempo e o número de recorrências de úlceras duodenais foi significativamente menor em pacientes tratados com PREVACID 15mg do que em pacientes tratados com placebo durante um período de 12 meses (Tabela 13) [ver INDICAÇÕES E USO ].
No ensaio nº 2, não foi observada diferença significativa entre PREVACID 15 e 30 mg na manutenção da remissão.
Úlcera gástrica
Em um estudo multicêntrico, duplo-cego, controlado por placebo nos EUA de 253 pacientes com úlcera gástrica documentada endoscopicamente, a porcentagem de pacientes curados em quatro e oito semanas foi significativamente maior com PREVACID 15 e 30 mg uma vez ao dia do que com placebo (Tabela 14 ) [Vejo INDICAÇÕES E USO ].
Os pacientes tratados com qualquer dose de PREVACID relataram significativamente menos dor abdominal diurna e noturna, juntamente com menos dias de uso de antiácidos e menos comprimidos antiácidos usados por dia do que o grupo placebo.
A comprovação independente da eficácia de PREVACID 30 mg foi fornecida por uma meta-análise de dados publicados e não publicados.
Cura de úlcera gástrica associada a AINEs
Em dois estudos multicêntricos, duplo-cegos e controlados por ativos nos EUA e Canadá em pacientes com úlcera gástrica associada a AINEs confirmada por endoscopia que continuaram seu uso de AINEs, a porcentagem de pacientes curados após oito semanas foi estatisticamente significativamente maior com 30 mg de PREVACID do que com o controle ativo. Um total de 711 pacientes foram incluídos no estudo e 701 pacientes foram tratados. A idade dos pacientes variava de 18 a 88 anos (idade mediana de 59 anos), sendo 67% pacientes do sexo feminino e 33% pacientes do sexo masculino. A raça foi distribuída da seguinte forma: 87% caucasianos, 8% negros, 5% outros. Não houve diferença estatisticamente significativa entre PREVACID 30 mg por dia e o controle ativo no alívio dos sintomas (ou seja, dor abdominal) (Tabela 15) [ver INDICAÇÕES E USO ].
Redução do risco de úlcera gástrica associada a AINEs
Em um grande estudo americano, multicêntrico, duplo-cego, controlado por placebo e misoprostol (misoprostol cego apenas para o endoscopista) em pacientes que necessitaram de uso crônico de um AINE e que tinham histórico de úlcera gástrica documentada endoscopicamente, a proporção de pacientes que permaneceram livres de úlcera gástrica em quatro, oito e 12 semanas foi significativamente maior com 15 ou 30 mg de PREVACID 15mg do que com placebo. Um total de 537 pacientes foram incluídos no estudo e 535 pacientes foram tratados. A idade dos pacientes variava de 23 a 89 anos (idade mediana de 60 anos), sendo 65% pacientes do sexo feminino e 35% pacientes do sexo masculino. A raça foi distribuída da seguinte forma: 90% Caucasiano, 6% Preto, 4% Outros. A dose de 30 mg de PREVACID não demonstrou benefício adicional na redução do risco de úlcera gástrica associada a AINEs do que a dose de 15 mg (Tabela 16) [ver INDICAÇÕES E USO ].
Doença do Refluxo Gastroesofágico Sintomática (DRGE)
DRGE sintomática
Em um estudo multicêntrico, duplo-cego, controlado por placebo nos EUA de 214 pacientes com sintomas frequentes de DRGE, mas sem erosões esofágicas por endoscopia, foi observado alívio significativamente maior da azia associada à DRGE com a administração de lansoprazol 15 mg uma vez ao dia até oito semanas do que com placebo. Nenhum benefício adicional significativo de lansoprazol 30 mg uma vez ao dia foi observado.
As análises de intenção de tratar demonstraram redução significativa na frequência e gravidade da azia diurna e noturna. Os dados de frequência e gravidade para o período de tratamento de oito semanas são apresentados na Tabela 17 e nas Figuras 1 e 2:
Figura 1: Gravidade média do dia de azia por dia de estudo para pacientes avaliáveis (3 = grave, 2 = moderado, 1 = leve, 0 = nenhum)
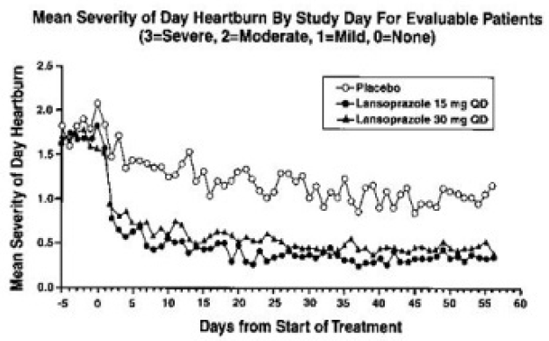
Figura 2: Gravidade média da azia noturna por dia de estudo para pacientes avaliáveis (3 = grave, 2 = moderado, 1 = leve, 0 = nenhum)
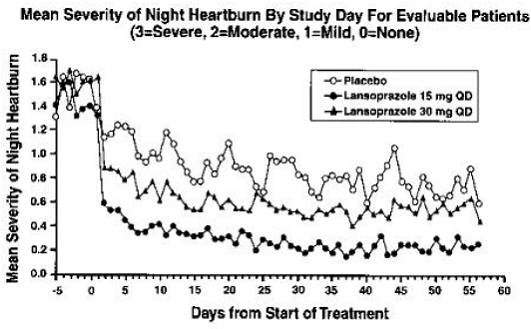
Em dois estudos multicêntricos, duplo-cegos, controlados por ranitidina nos EUA de 925 pacientes totais com sintomas frequentes de DRGE, mas sem erosões esofágicas por endoscopia, lansoprazol 15 mg foi superior a ranitidina 150 mg (duas vezes ao dia) na diminuição da frequência e gravidade do dia e pirose noturna associada à DRGE durante o período de tratamento de oito semanas. Nenhum benefício adicional significativo de 30 mg de lansoprazol uma vez ao dia foi observado [ver INDICAÇÕES E USO ].
Esofagite Erosiva
Em um estudo americano, multicêntrico, duplo-cego, controlado por placebo de 269 pacientes que entraram com diagnóstico endoscópico de esofagite com gradação da mucosa de dois ou mais e graus três e quatro significando doença erosiva, as porcentagens de pacientes com cicatrização são apresentadas na Tabela 18:
Neste estudo, todos os grupos PREVACID relataram alívio significativamente maior da azia e menos dor abdominal diurna e noturna, juntamente com menos dias de uso de antiácidos e menos comprimidos antiácidos tomados por dia do que o grupo placebo. Embora todas as doses tenham sido eficazes, a cicatrização mais precoce nas duas doses mais altas sugere 30 mg por dia como a dose recomendada.
O PREVACID também foi comparado em um estudo americano, multicêntrico e duplo-cego com uma dose baixa de ranitidina em 242 pacientes com esofagite de refluxo erosiva. PREVACID na dose de 30 mg foi significativamente mais eficaz do que a ranitidina 150 mg duas vezes ao dia como mostrado abaixo (Tabela 19).
Além disso, os pacientes tratados com PREVACID 30 mg relataram menos azia diurna e noturna e tomaram menos comprimidos antiácidos por menos dias do que os pacientes que tomaram ranitidina 150 mg duas vezes ao dia.
Embora este estudo demonstre eficácia do PREVACID 15mg na cicatrização da esofagite erosiva, não representa uma comparação adequada com a ranitidina porque a dose recomendada de ranitidina para esofagite é de 150 mg quatro vezes ao dia, duas vezes a dose utilizada neste estudo.
Nos dois ensaios descritos e em vários estudos menores envolvendo pacientes com esofagite erosiva moderada a grave, PREVACID produziu taxas de cura semelhantes às mostradas acima.
Em um estudo americano, multicêntrico, duplo-cego, com controle ativo, 30 mg de PREVACID 30 mg foram comparados com 150 mg de ranitidina duas vezes ao dia em 151 pacientes com esofagite de refluxo erosiva que respondeu pouco a um mínimo de 12 semanas de tratamento com pelo menos um antagonista do receptor H2 administrado na dose indicada para alívio dos sintomas ou maior, ou seja, cimetidina 800 mg/dia, ranitidina 300 mg/dia, famotidina 40 mg/dia ou nizatidina 300 mg/dia. PREVACID 30 mg foi mais eficaz do que ranitidina 150 mg duas vezes ao dia na cura da esofagite de refluxo, e a porcentagem de pacientes com cura foi a seguinte. Este estudo não constitui uma comparação da eficácia dos antagonistas dos receptores H2 da histamina com PREVACID 30 mg, uma vez que todos os doentes demonstraram não responder ao modo de tratamento do antagonista dos receptores H2 da histamina. Indica, no entanto, que PREVACID 30mg pode ser útil em pacientes que falham com um antagonista do receptor H2 da histamina (Tabela 20) [ver INDICAÇÕES E USO ].
Manutenção da cicatrização da esofagite erosiva
Dois ensaios independentes, duplo-cegos, multicêntricos e controlados foram conduzidos em pacientes com esofagite curada confirmada endoscopicamente. Os pacientes permaneceram em remissão significativamente mais tempo e o número de recorrências de esofagite erosiva foi significativamente menor em pacientes tratados com PREVACID 30mg do que em pacientes tratados com placebo durante um período de 12 meses (Tabela 21).
Independentemente do grau inicial de esofagite erosiva, PREVACID 15 e 30 mg foram semelhantes na manutenção da remissão.
Em um estudo americano, randomizado, duplo-cego, PREVACID 15 mg por dia (n = 100) foi comparado com ranitidina 150 mg duas vezes ao dia (n = 106), na dosagem recomendada, em pacientes com esofagite erosiva curada comprovada por endoscopia durante um período de período de 12 meses. O tratamento com PREVACID 15mg resultou em pacientes que permaneceram curados (lesões grau 0) de esofagite erosiva por períodos de tempo significativamente mais longos do que aqueles tratados com ranitidina (p INDICAÇÕES E USO ].
Condições Patológicas Hipersecretórias Incluindo Síndrome de Zollinger-Ellison
Em estudos abertos de 57 pacientes com condições patológicas de hipersecreção, como a síndrome de Zollinger-Ellison (ZES) com ou sem múltiplos adenomas endócrinos, PREVACID 15mg inibiu significativamente a secreção de ácido gástrico e controlou os sintomas associados de diarreia, anorexia e dor. Doses variando de 15 mg em dias alternados a 180 mg por dia mantiveram a secreção ácida basal abaixo de 10 mEq/h em pacientes sem cirurgia gástrica prévia e abaixo de 5 mEq/h em pacientes com cirurgia gástrica prévia.
As doses iniciais foram tituladas de acordo com a necessidade individual do paciente, e ajustes foram necessários com o tempo em alguns pacientes [ver DOSAGEM E ADMINISTRAÇÃO ]. PREVACID foi bem tolerado nesses níveis de dose alta por períodos prolongados (mais de quatro anos em alguns pacientes). Na maioria dos pacientes com ZES, os níveis séricos de gastrina não foram modificados pelo PREVACID. No entanto, em alguns pacientes, a gastrina sérica aumentou para níveis maiores do que os presentes antes do início da terapia com lansoprazol [ver INDICAÇÕES E USO ].
INFORMAÇÃO DO PACIENTE
PREVACID (prev-a-sid) (lansoprazol) cápsulas de liberação retardada, para uso oral e
Guia de Solução PREVACID (prev-a-sid sol-u-tab) (lansoprazol) comprimidos de desintegração oral de liberação retardada
Quais são as informações mais importantes que devo saber sobre PREVACID e PREVACID 15mg SoluTab?
Você deve tomar PREVACID e PREVACID 15mg SoluTab exatamente como prescrito, na dose mais baixa possível e pelo menor tempo necessário.
PREVACID e PREVACID SoluTab podem ajudar seus sintomas relacionados ao ácido, mas você ainda pode ter sérios problemas estomacais.
Converse com seu médico. PREVACID 30mg e PREVACID 30mg SoluTab podem causar sérios efeitos colaterais, incluindo:
- Um tipo de problema renal (nefrite tubulointersticial aguda). Algumas pessoas que tomam medicamentos inibidores da bomba de prótons (IBP), incluindo PREVACID 30mg e PREVACID 15mg SoluTab, podem desenvolver um problema renal chamado nefrite tubulointersticial aguda que pode ocorrer a qualquer momento durante o tratamento com medicamentos IBP, incluindo PREVACID e PREVACID SoluTab. Ligue para o seu médico imediatamente se tiver uma diminuição na quantidade de urina ou se tiver sangue na urina.
- Diarréia causada por uma infecção (Clostridium difficile) em seus intestinos. Ligue para o seu médico imediatamente se tiver fezes aquosas ou dor de estômago que não desaparece. Você pode ou não ter febre.
- Fraturas ósseas (quadril, punho ou coluna). Fraturas ósseas no quadril, punho ou coluna podem ocorrer em pessoas que tomam várias doses diárias de medicamentos IBP e por um longo período de tempo (um ano ou mais). Informe o seu médico se tiver uma fratura óssea, especialmente na anca, pulso ou coluna vertebral.
- Certos tipos de lúpus eritematoso. lúpus eritematoso é uma doença autoimune (as células imunes do corpo atacam outras células ou órgãos do corpo). Algumas pessoas que tomam medicamentos IBP, incluindo PREVACID 15mg e PREVACID 30mg SoluTab, podem desenvolver certos tipos de lúpus eritematoso ou piorar o lúpus que já têm. Ligue para o seu médico imediatamente se tiver dores nas articulações novas ou agravadas ou uma erupção cutânea nas bochechas ou braços que piora ao sol.
Converse com seu médico sobre o risco desses efeitos colaterais graves.
PREVACID 15mg e PREVACID SoluTab podem ter outros efeitos colaterais graves. Ver “Quais são os possíveis efeitos colaterais do PREVACID e do PREVACID SoluTab?”.
O que são PREVACID e PREVACID 30mg SoluTab?
Um medicamento de prescrição chamado inibidor da bomba de prótons (IBP) usado para reduzir a quantidade de ácido no estômago.
Em adultos, PREVACID 15mg e PREVACID SoluTab são usados para:
- 4 semanas para a cicatrização e alívio dos sintomas de úlceras duodenais.
- 10 a 14 dias com certos antibióticos para tratar uma infecção causada por uma bactéria chamada H. pylori.
- manutenção da cicatrização de úlceras duodenais. PREVACID 30mg não foi estudado além de 12 meses para esta finalidade.
- até 8 semanas para a cura e alívio dos sintomas de úlceras estomacais.
- até 8 semanas para a cicatrização de úlceras estomacais em pessoas que tomam medicamentos para a dor chamados anti-inflamatórios não esteróides (AINEs). PREVACID 30mg não foi estudado além de 8 semanas para este propósito.
- reduzir o risco de úlceras estomacais em pessoas que correm o risco de desenvolver úlceras estomacais com AINEs. PREVACID não foi estudado além de 12 semanas para este propósito.
- até 8 semanas para tratar azia e outros sintomas que ocorrem com a doença do refluxo gastroesofágico (DRGE). A DRGE acontece quando o ácido no estômago volta para o tubo (esôfago) que conecta a boca ao estômago. Isso pode causar uma sensação de queimação no peito ou na garganta, gosto amargo ou arrotos.
- até 8 semanas para a cura e alívio dos sintomas de danos relacionados ao ácido no revestimento do esôfago (chamado esofagite erosiva ou EE). Seu médico pode prescrever outras 8 a 16 semanas de PREVACID ou PREVACID 15mg SoluTab para pacientes cuja EE não melhora ou cujos sintomas retornam.
- manutenção da cicatrização da EE. PREVACID não foi estudado além de 12 meses para esta finalidade.
- o tratamento a longo prazo de condições em que seu estômago produz muito ácido. Isso inclui uma condição rara chamada síndrome de Zollinger-Ellison.
Crianças: Dê PREVACID 30mg e PREVACID 30mg SoluTab exatamente como prescrito pelo médico do seu filho. Não aumente a dose de PREVACID e PREVACID SoluTab ou dê ao seu filho PREVACID 15mg e PREVACID 15mg SoluTab por mais tempo do que o tempo indicado pelo seu médico.
Em crianças de 1 a 11 anos, PREVACID 15mg e PREVACID 15mg SoluTab são usados para:
- até 12 semanas para tratar azia e outros sintomas que podem ocorrer com DRGE.
- até 12 semanas para a cura e alívio dos sintomas da EE.
Em crianças de 12 a 17 anos, PREVACID e PREVACID SoluTab são usados para:
- até 8 semanas para tratar azia e outros sintomas que podem ocorrer com DRGE.
- até 8 semanas para a cura e alívio dos sintomas da EE.
PREVACID 30mg e PREVACID SoluTab não são recomendados para tratar os sintomas da DRGE em crianças com menos de 1 ano de idade e podem prejudicá-las.
Não tome PREVACID ou PREVACID 15mg SoluTab se você estiver:
- alérgico ao lansoprazol, a qualquer outro medicamento IBP ou a qualquer um dos ingredientes de PREVACID 15mg ou PREVACID 30mg SoluTab. Consulte o final deste Guia de Medicação para obter uma lista completa de ingredientes em PREVACID e PREVACID 30mg SoluTab.
- tomar um medicamento que contém rilpivirina (EDURANT, COMPLERA, ODEFSEY, JULUCA) usado para tratar o HIV-1 (vírus da imunodeficiência humana).
Antes de tomar PREVACID 15mg ou PREVACID SoluTab, informe o seu médico sobre todas as suas condições médicas, incluindo se você:
- tem níveis baixos de magnésio, cálcio, potássio ou sódio no sangue ou está a tomar um diurético.
- tem problemas de fígado.
- tem fenilcetonúria. PREVACID SoluTab contém aspartame.
- está grávida, pensa que pode estar grávida ou planeia engravidar. PREVACID ou PREVACID SoluTab pode prejudicar o feto. Fale com o seu médico sobre os possíveis riscos para o feto se tomar PREVACID 30mg ou PREVACID 15mg SoluTab durante a gravidez.
- está amamentando ou planeja amamentar. Não se sabe se PREVACID ou PREVACID 30mg SoluTab passa para o leite materno. Fale com o seu médico sobre a melhor forma de alimentar o seu bebé se estiver a tomar PREVACID ou PREVACID SoluTab.
Informe o seu médico sobre todos os medicamentos que toma, incluindo medicamentos prescritos e de venda livre, vitaminas e suplementos de ervas. Informe especialmente o seu médico se estiver a tomar metotrexato (OTREXUP, RASUVO, TREXALL, REDITREX, XATMEP).
Como devo tomar PREVACID 15mg e PREVACID 30mg SoluTab?
- Tome PREVACID 30mg ou PREVACID SoluTab exatamente como prescrito pelo seu médico.
- Não altere sua dose ou pare de tomar PREVACID 30mg ou PREVACID SoluTab sem falar com seu médico.
- Tome PREVACID 30mg ou PREVACID 15mg SoluTab antes das refeições.
Cápsulas de PREVACID 15mg:
-
- Engula as cápsulas de PREVACID 30mg inteiras.
- Não esmague ou mastigue as cápsulas de PREVACID.
- Se tiver dificuldade em engolir uma cápsula inteira, pode abrir a cápsula e tomar o conteúdo com certos alimentos ou sumos. Consulte as “Instruções de Uso” no final deste Guia de Medicação para obter instruções sobre como tomar as cápsulas de PREVACID 30mg com certos alimentos ou sucos.
- Consulte as “Instruções de Uso” no final deste Guia de Medicação para obter instruções sobre como misturar e administrar as cápsulas de PREVACID 30mg através de um tubo nasogástrico (tubo NG).
Solução PREVACID:
-
- PREVACID 30mg SoluTab é um comprimido que derrete na boca com ou sem água.
- Não quebre, corte, esmague ou mastigue os comprimidos.
- Consulte as “Instruções de Uso” no final deste Guia de Medicação para obter instruções sobre como misturar e administrar PREVACID SoluTab através de uma seringa e tubo NG.
- Se você perder uma dose de PREVACID ou PREVACID 30mg SoluTab, tome-a assim que se lembrar. Se estiver quase na hora da próxima dose, não tome a dose esquecida. Tome a sua próxima dose no horário habitual. Não tome 2 doses ao mesmo tempo.
- Se você tomar muito PREVACID ou PREVACID 30mg SoluTab, ligue para o seu médico ou centro de controle de envenenamento em 1-800-222-1222 imediatamente ou vá para a sala de emergência do hospital mais próximo.
Quais são os possíveis efeitos colaterais do PREVACID e do PREVACID SoluTab?
PREVACID e PREVACID SoluTab podem causar efeitos colaterais graves, incluindo:
- Ver “Qual é a informação mais importante que devo saber sobre PREVACID 30mg e PREVACID SoluTab?”.
- Níveis baixos de vitamina B12 no corpo pode ocorrer em pessoas que tomaram PREVACID 30mg ou PREVACID SoluTab por um longo tempo (mais de 3 anos). Informe o seu médico se tiver sintomas de níveis baixos de vitamina B12, incluindo falta de ar, tonturas, batimentos cardíacos irregulares, fraqueza muscular, pele pálida, sensação de cansaço, alterações de humor e formigueiro ou dormência nos braços e pernas.
- Crescimentos do estômago (pólipos da glândula fúndica). As pessoas que tomam medicamentos IBP por muito tempo têm um risco aumentado de desenvolver um certo tipo de crescimento do estômago chamado pólipos da glândula fúndica, especialmente após tomar medicamentos IBP por mais de 1 ano.
- Baixos níveis de magnésio no corpo pode acontecer em pessoas que tomaram PREVACID por pelo menos 3 meses. Informe o seu médico imediatamente se tiver sintomas de níveis baixos de magnésio, incluindo convulsões, tonturas, batimentos cardíacos irregulares, nervosismo, dores musculares ou fraqueza e espasmos nas mãos, pés ou voz.
- Reações cutâneas graves. PREVACID 15mg pode causar reações cutâneas raras, mas graves, que podem afetar qualquer parte do seu corpo. Essas reações cutâneas graves podem precisar ser tratadas em um hospital e podem ser fatais:
- Erupção cutânea que pode apresentar bolhas, descamação ou sangramento em qualquer parte da pele (incluindo lábios, olhos, boca, nariz, genitais, mãos ou pés).
- Você também pode ter febre, calafrios, dores no corpo, falta de ar ou aumento dos gânglios linfáticos.
Pare de tomar PREVACID e chame seu médico imediatamente. Estes sintomas podem ser o primeiro sinal de uma reação cutânea grave.
Os efeitos colaterais mais comuns de PREVACID e PREVACID SoluTab incluem: diarréia, dor na área do estômago (abdômen), náusea e constipação.
Estes não são todos os possíveis efeitos colaterais de PREVACID 30mg e PREVACID 30mg SoluTab.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais.
Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
Como devo armazenar PREVACID e PREVACID 30mg SoluTab?
Armazene PREVACID em temperatura ambiente entre 20°C e 25°C (68°F a 77°F).
Mantenha PREVACID 15mg e PREVACID SoluTab e todos os medicamentos fora do alcance das crianças.
Informações gerais sobre o uso seguro e eficaz de PREVACID 15mg e PREVACID SoluTab.
Os medicamentos às vezes são prescritos para outros fins que não os listados em um Guia de Medicamentos. Não use PREVACID ou PREVACID 30mg SoluTab para condições para as quais não foi prescrito. Não dê PREVACID 30mg ou PREVACID SoluTab a outras pessoas, mesmo que tenham os mesmos sintomas que você. Pode prejudicá-los. Você pode pedir ao seu médico ou farmacêutico informações sobre PREVACID 30mg e PREVACID 15mg SoluTab, que foi escrito para profissionais de saúde.
Quais são os ingredientes do PREVACID e do PREVACID SoluTab?
Ingrediente ativo: lansoprazol.
Ingredientes inativos em cápsulas de PREVACID 30mg: esfera de açúcar, sacarose, copolímero de ácido metacrílico, hidroxipropilcelulose de baixa substituição, amido, carbonato de magnésio, talco, polietilenoglicol, dióxido de titânio, polissorbato 80, hidroxipropilcelulose, dióxido de silício coloidal, D&C Red No. 28, FD&C Blue No. 1, e FD&C Vermelho Nº 40.
Apenas cápsula de PREVACID 15 mg: FD&C Verde Nº 3.
Ingredientes inativos em PREVACID 15mg SoluTab: manitol, ácido metacrílico, hidroxipropilcelulose, lactose monohidratada-esfera de celulose microcristalina, trietil citrato, crospovidona, poliacrilato, carbonato de magnésio, aspartame, monoestearato de glicerila, hipromelose, estearato de magnésio, ácido cítrico, dióxido de titânio, talco, aroma artificial de morango, polietilenoglicol, polissorbato 80 e óxido férrico.
PREVACID SoluTab contém 2,5 mg de fenilalanina em cada comprimido de 15 mg e 5,1 mg de fenilalanina em cada comprimido de 30 mg.
INSTRUÇÕES DE USO
PREVACID (prev-a-sid) (lansoprazol) cápsulas de liberação retardada, para uso oral e
Guia de Solução PREVACID (prev-a-sid sol-u-tab) (lansoprazol) comprimidos de desintegração oral de liberação retardada
Importante:
- Tome PREVACID 15mg ou PREVACID 15mg SoluTab antes das refeições.
- Não esmague ou mastigue as cápsulas de PREVACID 15mg ou PREVACID 30mg SoluTab.
- PREVACID ou PREVACID 15mg SoluTab só deve ser usado com os alimentos e sucos listados abaixo.
Cápsulas de liberação retardada PREVACID (cápsulas PREVACID 30mg)
Tomar cápsulas de PREVACID 15mg com certos alimentos:
Você só pode usar compota de maçã, pudim ENSURE, queijo cottage, iogurte ou pêra tensa.
Tomar cápsulas de PREVACID com certos sumos:
Você só pode usar suco de maçã, suco de laranja ou suco de tomate.
Administrar cápsulas de PREVACID através de um tubo nasogástrico (tubo NG) tamanho 16 francês ou maior:
Você só pode usar suco de maçã.
PREVACID 15mg SoluTab comprimidos de desintegração oral de liberação retardada (PREVACID SoluTab)
Para pacientes com problemas para engolir comprimidos, o PREVACID SoluTab pode ser administrado da seguinte forma:
Administrar PREVACID SoluTab com água usando uma seringa oral:
Administrar PREVACID 15mg SoluTab com água através de um tubo nasogástrico (tubo NG) tamanho 8 francês ou maior:
Como devo armazenar PREVACID e PREVACID 30mg SoluTab?
- Armazene as cápsulas PREVACID e PREVACID 15mg SoluTab em temperatura ambiente entre 20°C e 25°C (68°F a 77°F).
Mantenha PREVACID e PREVACID 30mg SoluTab e todos os medicamentos fora do alcance das crianças.
Esta Instrução de Uso foi aprovada pela Food and Drug Administration dos EUA.
