Propecia 1mg, 5mg Finasteride Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Propecia 1mg e como é usado?
Propecia é um medicamento de prescrição usado para tratar os sintomas da hiperplasia prostática benigna (HPB), queda de cabelo de padrão masculino (alopecia androgênica). Propecia pode ser usado sozinho ou com outros medicamentos.
Propecia 1mg pertence a uma classe de medicamentos chamados inibidores da 5-alfa-redutase.
Não se sabe se Propecia 1mg é seguro e eficaz em crianças.
Quais são os possíveis efeitos colaterais do Propecia 5mg?
Propecia 1mg pode causar efeitos colaterais graves, incluindo:
- nódulos mamários,
- dor ou sensibilidade mamária,
- secreção mamilar e
- quaisquer outras alterações mamárias
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns de Propecia 5mg incluem:
- perda de interesse em sexo,
- impotência,
- problemas para ter um orgasmo, e
- ejaculação anormal
Informe o seu médico se tiver algum efeito secundário que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Propecia. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
DESCRIÇÃO
Os comprimidos de PROPECIA (finasterida) contêm finasterida como ingrediente ativo. A finasterida, um composto sintético de 4 azasteróides, é um inibidor específico da 5α-redutase esteróide Tipo II, uma enzima intracelular que converte a testosterona androgênica em 5α-diidrotestosterona (DHT).
nome químico da finasterida é N-terc-Butil-3-oxo-4-aza-5α-androst-1-ene-17β-carboxamida. A fórmula empírica da finasterida é C23H36N2O2 e seu peso molecular é 372,55. Sua fórmula estrutural é:
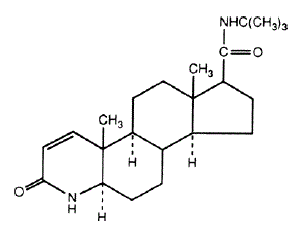
A finasterida é um pó cristalino branco com ponto de fusão próximo a 250°C. É livremente solúvel em clorofórmio e em solventes de álcoois inferiores, mas é praticamente insolúvel em água.
Os comprimidos de PROPECIA (finasterida) são comprimidos revestidos por película para administração oral. Cada comprimido contém 1 mg de finasterida e os seguintes ingredientes inativos: lactose monohidratada, celulose microcristalina, amido pré-gelatinizado, amidoglicolato de sódio, hidroxipropilmetilcelulose, hidroxipropilcelulose, dióxido de titânio, estearato de magnésio, talco, docusato de sódio, óxido férrico amarelo e vermelho férrico. óxido.
INDICAÇÕES
PROPECIA® é indicado para o tratamento da queda de cabelo de padrão masculino (alopecia androgenética) SOMENTE PARA HOMENS.
A eficácia na recessão bitemporal não foi estabelecida.
PROPECIA não é indicado para uso em mulheres.
DOSAGEM E ADMINISTRAÇÃO
PROPECIA pode ser administrado com ou sem refeições.
A dose recomendada de PROPECIA é de um comprimido (1 mg) tomado uma vez ao dia.
Em geral, o uso diário por três meses ou mais é necessário antes que o benefício seja observado. O uso continuado é recomendado para sustentar o benefício, que deve ser reavaliado periodicamente. A retirada do tratamento leva à reversão do efeito em 12 meses.
COMO FORNECIDO
Formas de dosagem e pontos fortes
Os comprimidos de PROPECIA 5mg (1 mg) são comprimidos octogonais castanhos, revestidos por película, convexos com o logotipo “P estilizado” de um lado e PROPECIA 5mg do outro.
PROPECIA Os comprimidos, 1 mg, são comprimidos octogonais castanhos, revestidos por película, convexos com o logótipo “P estilizado” numa das faces e PROPECIA na outra. Eles são fornecidos da seguinte forma:
NDC 78206-152-01 garrafas de 30 (com dessecante) NDC 78206-152-02 Frascos PROPAK de 90 ® (com dessecante).
Armazenamento e manuseio
Armazenar à temperatura ambiente, 15-30°C (59-86°F). Manter o recipiente fechado e proteger da umidade.
As mulheres não devem manusear os comprimidos de PROPECIA esmagados ou partidos quando estiverem grávidas ou possam estar grávidas devido à possibilidade de absorção da finasterida e ao risco potencial subsequente para o feto do sexo masculino. Os comprimidos de PROPECIA 5mg são revestidos e evitarão o contato com o ingrediente ativo durante o manuseio normal, desde que os comprimidos não sejam quebrados ou esmagados [ver AVISOS E PRECAUÇÕES , Uso em populações específicas e Informações de Aconselhamento do Paciente ].
Dist. por: Organon LLC, uma subsidiária da ORGANON & Co., Jersey City, NJ 07302, EUA. Revisado: junho de 2021
EFEITOS COLATERAIS
Experiência de Ensaios Clínicos
Como os ensaios clínicos são conduzidos sob condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparadas às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática clínica.
Estudos clínicos para PROPECIA (finasterida 1 mg) no tratamento da queda de cabelo de padrão masculino
Em três ensaios clínicos controlados para PROPECIA 5mg com duração de 12 meses, 1,4% dos pacientes que tomaram PROPECIA (n=945) foram descontinuados devido a experiências adversas que foram consideradas possivelmente, provavelmente ou definitivamente relacionadas ao medicamento (1,6% para placebo; n=934).
As experiências adversas clínicas que foram relatadas como possivelmente, provavelmente ou definitivamente relacionadas ao medicamento em ≥1% dos pacientes tratados com PROPECIA ou placebo são apresentadas na Tabela 1.
TABELA 1: Experiências Adversas Relacionadas a Medicamentos para PROPECIA (finasterida 1 mg) no Ano 1 (%) PERDA DE CABELO DE PADRÃO MASCULINO
A análise integrada de experiências adversas clínicas mostrou que durante o tratamento com PROPECIA 1mg, 36 (3,8%) de 945 homens relataram uma ou mais dessas experiências adversas em comparação com 20 (2,1%) de 934 homens tratados com placebo (p=0,04) . A resolução ocorreu em homens que descontinuaram a terapia com PROPECIA devido a esses efeitos colaterais e na maioria daqueles que continuaram a terapia. A incidência de cada uma das experiências adversas acima diminuiu para ≤0,3% no quinto ano de tratamento com PROPECIA.
Em um estudo de finasterida 1 mg por dia em homens saudáveis, uma diminuição mediana no volume ejaculado de 0,3 mL (-11%) em comparação com 0,2 mL (-8%) para placebo foi observada após 48 semanas de tratamento. Dois outros estudos mostraram que a finasterida em 5 vezes a dosagem de PROPECIA (5 mg por dia) produziu reduções medianas significativas de aproximadamente 0,5 mL (-25%) em comparação ao placebo no volume ejaculado, mas isso foi reversível após a descontinuação do tratamento.
Nos estudos clínicos com PROPECIA, as incidências de sensibilidade e aumento mamário, reações de hipersensibilidade e dor testicular em pacientes tratados com finasterida não foram diferentes daquelas em pacientes tratados com placebo.
Ensaios Clínicos Controlados e Estudos de Extensão Abertos de Longo Prazo para PROSCAR® (finasterida 5 mg) e AVODART (dutasterida) no tratamento da hiperplasia prostática benigna
No PROSCAR Long-Term Efficacy and Safety Study (PLESS), um estudo clínico controlado de 4 anos, 3.040 pacientes com idades entre 45 e 78 anos com HBP sintomática e próstata aumentada foram avaliados quanto à segurança durante um período de 4 anos (1.524 com PROSCAR 5 mg/dia e 1516 com placebo). 3,7% (57 pacientes) tratados com PROSCAR 5 mg e 2,1% (32 pacientes) tratados com placebo interromperam a terapia como resultado de reações adversas relacionadas à função sexual, que são as reações adversas mais frequentemente relatadas.
A Tabela 2 apresenta as únicas reações adversas clínicas consideradas possivelmente, provavelmente ou definitivamente relacionadas ao medicamento pelo investigador, para as quais a incidência no PROSCAR foi ≥1% e maior que o placebo nos 4 anos do estudo. Nos anos 2-4 do estudo, não houve diferença significativa entre os grupos de tratamento nas incidências de impotência, diminuição da libido e distúrbios da ejaculação.
TABELA 2: Experiências Adversas Relacionadas a Medicamentos para PROSCAR (finasterida 5 mg) HIPERPLASIA PROSTÁTICA BENIGNA
Os perfis de experiência adversa nos estudos de 1 ano, controlados com placebo, de Fase III da HBP e nas extensões abertas de 5 anos com PROSCAR 5 mg e PLESS foram semelhantes.
Não há evidência de aumento das experiências adversas sexuais com o aumento da duração do tratamento com PROSCAR 5 mg. Novos relatos de experiências adversas sexuais relacionadas a drogas diminuíram com a duração da terapia.
Durante o estudo de Terapia Médica de Sintomas Prostáticos (MTOPS) controlado por placebo e comparador de 4 a 6 anos que envolveu 3.047 homens, houve 4 casos de câncer de mama em homens tratados com PROSCAR, mas nenhum caso em homens não tratados com PROSCAR. Durante o estudo PLESS de 4 anos controlado por placebo que envolveu 3.040 homens, houve 2 casos de câncer de mama em homens tratados com placebo, mas nenhum caso foi relatado em homens tratados com PROSCAR.
Durante o Prostate Cancer Prevention Trial (PCPT) de 7 anos controlado por placebo que envolveu 18.882 homens, houve 1 caso de câncer de mama em homens tratados com PROSCAR e 1 caso de câncer de mama em homens tratados com placebo. A relação entre o uso prolongado de finasterida e neoplasia de mama masculina é atualmente desconhecida.
estudo PCPT foi um estudo randomizado, duplo-cego, controlado por placebo de 7 anos que envolveu 18.882 homens saudáveis ≥55 anos de idade com um exame de toque retal normal e um PSA ≤3,0 ng/mL. Os homens receberam PROSCAR (finasterida 5 mg) ou placebo diariamente. Os pacientes foram avaliados anualmente com PSA e toque retal. Biópsias foram realizadas para PSA elevado, um exame de toque retal anormal ou no final do estudo. A incidência de câncer de próstata Gleason score 8-10 foi maior em homens tratados com finasterida (1,8%) do que naqueles tratados com placebo (1,1%). Em um ensaio clínico controlado por placebo de 4 anos com outro inibidor da 5α-redutase [AVODART (dutasterida)], foram observados resultados semelhantes para o câncer de próstata com pontuação de Gleason 8-10 (1% dutasterida versus 0,5% placebo). O significado clínico desses achados em relação ao uso de PROPECIA por homens é desconhecido.
Nenhum benefício clínico foi demonstrado em pacientes com câncer de próstata tratados com PROSCAR. PROSCAR não está aprovado para reduzir o risco de desenvolver câncer de próstata.
Experiência pós-marketing
As seguintes reações adversas foram identificadas durante o uso pós-aprovação de PROPECIA. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento:
Reação de hipersensibilidade: reações de hipersensibilidade como erupção cutânea, prurido, urticária e angioedema (incluindo inchaço dos lábios, língua, garganta e face);
Sistema reprodutivo: disfunção sexual que continuou após a descontinuação do tratamento, incluindo disfunção erétil, distúrbios da libido, distúrbios da ejaculação e distúrbios do orgasmo; infertilidade masculina e/ou má qualidade seminal (normalização ou melhora da qualidade seminal foi relatada após a descontinuação da finasterida); dor testicular; hematospermia.
Neoplasias: câncer de mama masculino;
Distúrbios da mama: sensibilidade e aumento da mama;
Sistema Nervoso/Psiquiátrico: depressão
INTERAÇÕES MEDICAMENTOSAS
Sistema de enzimas metabolizadoras de drogas ligadas ao citocromo P450
Não foram identificadas interações medicamentosas de importância clínica. A finasterida não parece afetar o sistema enzimático de metabolização de drogas ligado ao citocromo P450. Os compostos que foram testados no homem incluem antipirina, digoxina, propranolol, teofilina e varfarina e não foram encontradas interações clinicamente significativas.
Outra terapia concomitante
Embora não tenham sido realizados estudos específicos de interação, doses de finasterida de 1 mg ou mais foram usadas concomitantemente em estudos clínicos com acetaminofeno, ácido acetilsalicílico, α-bloqueadores, analgésicos, inibidores da enzima conversora de angiotensina (ECA), anticonvulsivantes, benzodiazepínicos, betabloqueadores, cálcio -bloqueadores de canais, nitratos cardíacos, diuréticos, antagonistas H2, inibidores da HMG-CoA redutase, inibidores da prostaglandina sintetase (também referidos como AINEs) e anti-infecciosos de quinolonas sem evidência de interações adversas clinicamente significativas.
AVISOS
Incluído como parte do PRECAUÇÕES seção.
PRECAUÇÕES
Exposição de Mulheres - Risco para Feto Masculino
PROPECIA não é indicado para uso em mulheres. As mulheres não devem manusear os comprimidos de PROPECIA esmagados ou partidos quando estiverem grávidas ou possam estar grávidas devido à possibilidade de absorção da finasterida e ao risco potencial subsequente para o feto do sexo masculino. Os comprimidos de PROPECIA são revestidos e evitam o contato com o ingrediente ativo durante o manuseio normal, desde que os comprimidos não tenham sido quebrados ou esmagados. [Ver INDICAÇÕES E USO , CONTRA-INDICAÇÕES , Uso em populações específicas , COMO FORNECIDO / Armazenamento e manuseio e Informações de Aconselhamento do Paciente ]
Efeitos sobre o antígeno específico da próstata (PSA)
Em estudos clínicos com PROPECIA (finasterida, 1 mg) em homens de 18 a 41 anos de idade, o valor médio do antígeno prostático específico (PSA) sérico diminuiu de 0,7 ng/mL na linha de base para 0,5 ng/mL no mês 12. Além disso, em estudos clínicos com PROSCAR (finasterida, 5 mg) quando usado em homens idosos com hiperplasia prostática benigna (HPB), os níveis de PSA são reduzidos em aproximadamente 50%. Outros estudos com PROSCAR mostraram que também pode causar diminuição do PSA sérico na presença de câncer de próstata. Esses achados devem ser levados em consideração para a interpretação adequada do PSA sérico ao avaliar homens tratados com finasterida. Qualquer aumento confirmado do valor mais baixo de PSA durante o uso de PROPECIA pode sinalizar a presença de câncer de próstata e deve ser avaliado, mesmo se os níveis de PSA ainda estiverem dentro da faixa normal para homens que não estejam tomando um inibidor da 5α-redutase. O não cumprimento da terapia com PROPECIA 5mg também pode afetar os resultados do teste de PSA.
Aumento do risco de câncer de próstata de alto grau com inibidores da 5α-redutase
Homens com 55 anos ou mais com toque retal normal e PSA ≤ 3,0 ng/mL na linha de base tomando finasterida 5 mg/dia (5 vezes a dose de PROPECIA) no Prostate Cancer Prevention Trial (PCPT) de 7 anos tiveram um risco aumentado de Gleason pontuação 8-10 câncer de próstata (finasterida 1,8% vs placebo 1,1%). [Ver REAÇÕES ADVERSAS ] Resultados semelhantes foram observados em um ensaio clínico de 4 anos controlado por placebo com outro inibidor da 5α-redutase (dutasterida, AVODART) (1% dutasterida versus 0,5% placebo). Os inibidores da 5α-redutase podem aumentar o risco de desenvolvimento de câncer de próstata de alto grau. Não foi estabelecido se o efeito dos inibidores da 5α-redutase na redução do volume da próstata ou fatores relacionados ao estudo impactaram os resultados desses estudos.
Pacientes pediátricos
PROPECIA não é indicado para uso em pacientes pediátricos [ver Uso em populações específicas ].
Informações de Aconselhamento do Paciente
Aconselhe o paciente a ler o rótulo do paciente aprovado pela FDA ( INFORMAÇÃO DO PACIENTE ).
Exposição de Mulheres - Risco para Feto Masculino
Os médicos devem informar aos pacientes que mulheres grávidas ou que possam estar grávidas não devem manusear comprimidos de PROPECIA esmagados ou quebrados devido à possibilidade de absorção da finasterida e ao risco potencial subsequente para o feto do sexo masculino. Os comprimidos de PROPECIA 5mg são revestidos e evitarão o contato com o ingrediente ativo durante o manuseio normal, desde que os comprimidos não tenham sido quebrados ou esmagados. Se uma mulher grávida ou potencialmente grávida entrar em contato com comprimidos de PROPECIA 1mg esmagados ou quebrados, a área de contato deve ser lavada imediatamente com água e sabão [ver CONTRA-INDICAÇÕES , AVISOS E PRECAUÇÕES , Uso em populações específicas  e COMO FORNECIDO / Armazenamento e manuseio ].
Aumento do risco de câncer de próstata de alto grau
Os pacientes devem ser informados de que houve um aumento no câncer de próstata de alto grau em homens tratados com inibidores da 5α-redutase indicados para tratamento da HBP, em comparação com aqueles tratados com placebo em estudos que analisaram o uso desses medicamentos para prevenir o câncer de próstata [ver AVISOS E PRECAUÇÕES e REAÇÕES ADVERSAS ].
Instruções adicionais
Os médicos devem instruir seus pacientes a relatar imediatamente quaisquer alterações em suas mamas, como nódulos, dor ou secreção mamilar. Alterações mamárias, incluindo aumento mamário, sensibilidade e neoplasia foram relatadas [ver REAÇÕES ADVERSAS ].
Os médicos devem instruir seus pacientes a ler a bula do paciente antes de iniciar a terapia com PROPECIA e lê-la novamente toda vez que a prescrição for renovada, para que estejam cientes das informações atuais para pacientes sobre PROPECIA.
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Nenhuma evidência de efeito tumorigênico foi observada em um estudo de 24 meses em ratos Sprague-Dawley recebendo doses de finasterida de até 160 mg/kg/dia em machos e 320 mg/kg/dia em fêmeas. Essas doses produziram exposições sistêmicas respectivas em ratos de 888 e 2192 vezes aquelas observadas no homem recebendo a dose humana recomendada de 1 mg/dia. Todos os cálculos de exposição foram baseados na AUC calculada (0-24h) para animais e AUC média (0-24h) para o homem (0,05 μg•h/mL).
Em um estudo de carcinogenicidade de 19 meses em camundongos CD-1, um aumento estatisticamente significativo (p≤0,05) na incidência de adenomas testiculares de células de Leydig foi observado em 1824 vezes a exposição humana (250 mg/kg/dia). Em camundongos com 184 vezes a exposição humana, estimada (25 mg/kg/dia) e em ratos com 312 vezes a exposição humana (≥40 mg/kg/dia) foi observado um aumento na incidência de hiperplasia das células de Leydig. Uma correlação positiva entre as alterações proliferativas nas células de Leydig e um aumento nos níveis séricos de LH (2 a 3 vezes acima do controle) foi demonstrada em ambas as espécies de roedores tratadas com altas doses de finasterida. Não foram observadas alterações nas células de Leydig relacionadas à droga em ratos ou cães tratados com finasterida por 1 ano em 240 e 2800 vezes (20 mg/kg/dia e 45 mg/kg/dia, respectivamente), ou em camundongos tratados por 19 meses em 18,4 vezes a exposição humana, estimada (2,5 mg/kg/dia).
Nenhuma evidência de mutagenicidade foi observada em um ensaio de mutagênese bacteriana in vitro, um ensaio de mutagênese em células de mamífero ou em um ensaio de eluição alcalina in vitro. Em um ensaio in vitro de aberrações cromossômicas, usando células de ovário de hamster chinês, houve um leve aumento nas aberrações cromossômicas. Em um ensaio de aberração cromossômica in vivo em camundongos, nenhum aumento relacionado ao tratamento na aberração cromossômica foi observado com finasterida na dose máxima tolerada de 250 mg/kg/dia (1824 vezes a exposição humana), conforme determinado nos estudos de carcinogenicidade.
Em coelhos machos sexualmente maduros tratados com finasterida em 4344 vezes a exposição humana (80 mg/kg/dia) por até 12 semanas, nenhum efeito na fertilidade, contagem de esperma ou volume ejaculado foi observado. Em ratos machos sexualmente maduros tratados com 488 vezes a exposição humana (80 mg/kg/dia), não houve efeitos significativos na fertilidade após 6 ou 12 semanas de tratamento; no entanto, quando o tratamento foi continuado por até 24 ou 30 semanas, houve uma aparente diminuição da fertilidade, fecundidade e uma diminuição significativa associada nos pesos das vesículas seminais e da próstata. Todos estes efeitos foram reversíveis dentro de 6 semanas após a descontinuação do tratamento. Nenhum efeito relacionado ao medicamento nos testículos ou no desempenho de acasalamento foi observado em ratos ou coelhos. Esta diminuição da fertilidade em ratos tratados com finasterida é secundária ao seu efeito nos órgãos sexuais acessórios (próstata e vesículas seminais), resultando na falha na formação de um tampão seminal. O tampão seminal é essencial para a fertilidade normal em ratos, mas não é relevante no homem.
Uso em populações específicas
Gravidez
Gravidez Categoria X [ver CONTRA-INDICAÇÕES ]. PROPECIA 5mg é contraindicado para uso em mulheres que estão ou podem engravidar. PROPECIA 5mg é um inibidor da 5α-redutase Tipo II que previne a conversão da testosterona em 5α-diidrotestosterona (DHT), um hormônio necessário para o desenvolvimento normal da genitália masculina. Em estudos com animais, a finasterida causou desenvolvimento anormal da genitália externa em fetos masculinos. Se este medicamento for usado durante a gravidez, ou se a paciente engravidar enquanto estiver tomando este medicamento, a paciente deve ser informada do risco potencial para o feto masculino.
desenvolvimento genital masculino anormal é uma consequência esperada quando a conversão da testosterona em 5α-diidrotestosterona (DHT) é inibida por inibidores da 5α-redutase. Esses resultados são semelhantes aos relatados em bebês do sexo masculino com deficiência genética de 5α-redutase. As mulheres podem ser expostas à finasterida através do contato com comprimidos de PROPECIA 5mg ou sêmen esmagados ou quebrados de um parceiro masculino tomando PROPECIA. No que diz respeito à exposição da finasterida através da pele, os comprimidos de PROPECIA são revestidos e evitarão o contacto da pele com a finasterida durante o manuseamento normal se os comprimidos não tiverem sido esmagados ou partidos. As mulheres grávidas ou que possam engravidar não devem manusear os comprimidos de PROPECIA 5mg esmagados ou partidos devido à possível exposição de um feto do sexo masculino. Se uma mulher grávida entrar em contato com comprimidos de PROPECIA 1mg esmagados ou quebrados, a área de contato deve ser lavada imediatamente com água e sabão. Com relação à exposição potencial à finasterida através do sêmen, um estudo foi realizado em homens recebendo PROPECIA 1 mg/dia que mediu as concentrações de finasterida no sêmen [ver FARMACOLOGIA CLÍNICA ].
Em um estudo de desenvolvimento embriofetal, ratas grávidas receberam finasterida durante o período de maior organogênese (dias de gestação 6 a 17). Em doses maternas de finasterida oral aproximadamente 1 a 684 vezes a dose humana recomendada (RHD) de 1 mg/dia (com base na AUC em doses animais de 0,1 a 100 mg/kg/dia), houve um aumento dose-dependente na hipospádia que ocorreu em 3,6 a 100% da prole masculina. Os múltiplos de exposição foram estimados usando dados de ratos não prenhes. Dias 16 a 17 de gestação é um período crítico em ratos fetais machos para a diferenciação da genitália externa. Em doses maternas orais de aproximadamente 0,2 vezes a RHD (com base na AUC na dose animal de 0,03 mg/kg/dia), a prole masculina apresentou diminuição do peso prostático e vesicular seminal, atraso na separação prepucial e desenvolvimento transitório do mamilo. A diminuição da distância anogenital ocorreu em descendentes machos de ratas grávidas que receberam aproximadamente 0,02 vezes o RHD (com base na AUC na dose animal de 0,003 mg/kg/dia). Não foram observadas anormalidades na prole feminina exposta a qualquer dose de finasterida no útero.
Não foram observadas anormalidades de desenvolvimento na prole de fêmeas não tratadas acasaladas com ratos machos tratados com finasterida que receberam aproximadamente 488 vezes o RHD (com base na AUC na dose animal de 80 mg/kg/dia). A fertilidade ligeiramente diminuída foi observada na prole masculina após a administração de cerca de 20 vezes o RHD (com base na AUC na dose animal de 3 mg/kg/dia) a ratas durante o final da gestação e lactação. Não foram observados efeitos sobre a fertilidade na descendência feminina nestas condições.
Nenhuma evidência de malformações genitais externas masculinas ou outras anormalidades foram observadas em fetos de coelhos expostos à finasterida durante o período de organogênese principal (dias de gestação 6-18) em doses maternas de até 100 mg/kg/dia (os níveis de exposição à finasterida não foram medidos em coelhos). No entanto, este estudo pode não ter incluído o período crítico para os efeitos da finasterida no desenvolvimento da genitália externa masculina no coelho.
Os efeitos fetais da exposição materna à finasterida durante o período de desenvolvimento embrionário e fetal foram avaliados no macaco rhesus (dias de gestação 20-100), em uma espécie e período de desenvolvimento mais preditivos de efeitos específicos em humanos do que os estudos em ratos e coelhos. A administração intravenosa de finasterida a macacas grávidas em doses tão altas quanto 800 ng/dia (concentração sanguínea máxima estimada de 1,86 ng/mL ou cerca de 930 vezes a maior exposição estimada de mulheres grávidas à finasterida a partir de sêmen de homens tomando 1 mg/dia) resultou em nenhuma anormalidade em fetos masculinos. Para confirmar a relevância do modelo rhesus para o desenvolvimento fetal humano, a administração oral de uma dose de finasterida (2 mg/kg/dia ou aproximadamente 120.000 vezes os níveis sanguíneos mais elevados estimados de finasterida do sêmen de homens tomando 1 mg/dia) para macacas grávidas resultaram em anormalidades genitais externas em fetos do sexo masculino. Nenhuma outra anormalidade foi observada em fetos do sexo masculino e nenhuma anormalidade relacionada à finasterida foi observada em fetos do sexo feminino em qualquer dose.
Mães que amamentam
PROPECIA não é indicado para uso em mulheres.
Não se sabe se a finasterida é excretada no leite humano.
Uso Pediátrico
PROPECIA 1mg não é indicado para uso em pacientes pediátricos.
A segurança e eficácia em pacientes pediátricos não foram estabelecidas.
Uso Geriátrico
Os estudos de eficácia clínica com PROPECIA não incluíram indivíduos com 65 anos ou mais. Com base na farmacocinética da finasterida 5 mg, não é necessário ajuste de dose em idosos para PROPECIA [ver FARMACOLOGIA CLÍNICA ]. No entanto, a eficácia de PROPECIA 1mg em idosos não foi estabelecida.
Insuficiência hepática
Deve-se ter cautela na administração de PROPECIA 5mg em pacientes com anormalidades da função hepática, uma vez que a finasterida é metabolizada extensivamente no fígado. FARMACOLOGIA CLÍNICA ].
Insuficiência renal
Não é necessário ajuste de dose em pacientes com insuficiência renal [ver FARMACOLOGIA CLÍNICA ].
SOBREDOSAGEM
Em estudos clínicos, doses únicas de finasterida até 400 mg e doses múltiplas de finasterida até 80 mg/dia por três meses não resultaram em reações adversas. Até que mais experiência seja obtida, nenhum tratamento específico para superdosagem com finasterida pode ser recomendado.
Letalidade significativa foi observada em camundongos machos e fêmeas em doses orais únicas de 1500 mg/m² (500 mg/kg) e em ratos fêmeas e machos em doses orais únicas de 2360 mg/m² (400 mg/kg) e 5900 mg/m (1000 mg/kg), respectivamente.
CONTRA-INDICAÇÕES
PROPECIA 5mg é contraindicado nos seguintes casos:
- Gravidez. O uso de finasterida é contraindicado em mulheres quando estão ou podem estar grávidas. Devido à capacidade dos inibidores da 5α-redutase Tipo II de inibir a conversão da testosterona em 5α-diidrotestosterona (DHT), a finasterida pode causar anormalidades da genitália externa de um feto masculino de uma mulher grávida que recebe finasterida. Se este medicamento for usado durante a gravidez, ou se ocorrer gravidez enquanto estiver tomando este medicamento, a gestante deve ser informada do risco potencial para o feto masculino. [Ver AVISOS E PRECAUÇÕES , Uso em populações específicas , COMO FORNECIDO / Armazenamento e manuseio e Informações de Aconselhamento do Paciente ] Em ratas, baixas doses de finasterida administradas durante a gravidez produziram anormalidades da genitália externa na prole masculina.
- Hipersensibilidade a qualquer componente deste medicamento.
FARMACOLOGIA CLÍNICA
Mecanismo de ação
A finasterida é um inibidor competitivo e específico da 5α-redutase tipo II, uma enzima intracelular que converte o andrógeno testosterona em DHT. Duas isoenzimas distintas são encontradas em camundongos, ratos, macacos e humanos: Tipo I e II. Cada uma dessas isoenzimas é expressa diferencialmente em tecidos e estágios de desenvolvimento. Em humanos, a 5α-redutase tipo I é predominante nas glândulas sebáceas da maioria das regiões da pele, incluindo couro cabeludo e fígado. A 5α-redutase tipo I é responsável por aproximadamente um terço da DHT circulante. A isoenzima 5α-redutase Tipo II é encontrada principalmente na próstata, vesículas seminais, epidídimos e folículos pilosos, bem como no fígado, e é responsável por dois terços da DHT circulante.
Em humanos, o mecanismo de ação da finasterida é baseado em sua inibição preferencial da isoenzima Tipo II. Usando tecidos nativos (couro cabeludo e próstata), estudos de ligação in vitro examinando o potencial da finasterida para inibir qualquer uma das isoenzimas revelaram uma seletividade de 100 vezes para a 5α-redutase do Tipo II humana sobre a isozima do Tipo I (IC50 = 500 e 4,2 nM para o Tipo I e II, respectivamente). Para ambas as isoenzimas, a inibição pela finasterida é acompanhada pela redução do inibidor a dihidrofinasterida e formação de aduto com NADP+. A renovação do complexo enzimático é lenta (t ½ aproximadamente 30 dias para o complexo enzimático Tipo II e 14 dias para o complexo Tipo I). A inibição da 5α-redutase Tipo II bloqueia a conversão periférica da testosterona em DHT, resultando em reduções significativas nas concentrações de DHT no soro e nos tecidos.
Em homens com perda de cabelo de padrão masculino (alopecia androgenética), o couro cabeludo calvo contém folículos capilares miniaturizados e quantidades aumentadas de DHT em comparação com o couro cabeludo cabeludo. A administração de finasterida diminui as concentrações de DHT no couro cabeludo e no soro nesses homens. As contribuições relativas dessas reduções para o efeito do tratamento da finasterida não foram definidas. Por esse mecanismo, a finasterida parece interromper um fator chave no desenvolvimento da alopecia androgenética em pacientes geneticamente predispostos.
Farmacodinâmica
A finasterida produz uma rápida redução na concentração sérica de DHT, atingindo 65% de supressão em 24 horas após a administração oral com um comprimido de 1 mg. Os níveis circulantes médios de testosterona e estradiol aumentaram aproximadamente 15% em comparação com a linha de base, mas permaneceram dentro da faixa fisiológica.
finasterida não tem afinidade pelo receptor androgênico e não tem efeitos androgênicos, antiandrogênicos, estrogênicos, antiestrogênicos ou progestacionais. Em estudos com finasterida, não foram detectadas alterações clinicamente significativas no hormônio luteinizante (LH), hormônio folículo-estimulante (FSH) ou prolactina. Em voluntários saudáveis, o tratamento com finasterida não alterou a resposta de LH e FSH ao hormônio liberador de gonadotrofina, indicando que o eixo hipotálamo-hipófise-testicular não foi afetado.
A finasterida não teve efeito sobre os níveis circulantes de cortisol, hormônio estimulante da tireoide ou tiroxina, nem afetou o perfil lipídico plasmático (por exemplo, colesterol total, lipoproteínas de baixa densidade, lipoproteínas de alta densidade e triglicerídeos) ou densidade mineral óssea.
Farmacocinética
Absorção
Em um estudo em 15 indivíduos jovens saudáveis do sexo masculino, a biodisponibilidade média dos comprimidos de 1 mg de finasterida foi de 65% (intervalo de 26-170%), com base na razão da área sob a curva (AUC) em relação a uma referência intravenosa (IV) dose. No estado de equilíbrio após a dosagem de 1 mg/dia (n=12), a concentração plasmática máxima de finasterida foi em média de 9,2 ng/mL (intervalo, 4,9-13,7 ng/mL) e foi atingida 1 a 2 horas após a dose; AUC foi de 53 ng•h/mL (intervalo, 20-154 ng•h/mL). A biodisponibilidade da finasterida não foi afetada pelos alimentos.
Distribuição
O volume médio de distribuição no estado de equilíbrio foi de 76 litros (variação, 44-96 litros; n=15). Aproximadamente 90% da finasterida circulante está ligada às proteínas plasmáticas. Há uma fase de acumulação lenta para a finasterida após doses múltiplas.
Descobriu-se que a finasterida atravessa a barreira hematoencefálica.
Os níveis de sêmen foram medidos em 35 homens tomando finasterida 1 mg/dia por 6 semanas. Em 60% (21 de 35) das amostras, os níveis de finasterida eram indetectáveis ( Uso em populações específicas ]
Metabolismo
A finasterida é extensivamente metabolizada no fígado, principalmente através da subfamília de enzimas citocromo P450 3A4. Dois metabólitos, os metabólitos monohidroxilados da cadeia lateral t-butil e os metabólitos do ácido monocarboxílico, foram identificados que não possuem mais de 20% da atividade inibitória da 5α-redutase da finasterida.
Excreção
Após a infusão intravenosa em indivíduos jovens saudáveis (n=15), a depuração plasmática média da finasterida foi de 165 mL/min (intervalo, 70-279 mL/min). A meia-vida terminal média no plasma foi de 4,5 horas (intervalo, 3,3-13,4 horas; n=12). Após uma dose oral de 14C-finasterida no homem (n=6), uma média de 39% (intervalo, 32-46%) da dose foi excretada na urina na forma de metabólitos; 57% (variação, 51-64%) foi excretado nas fezes.
A meia-vida terminal média é de aproximadamente 5 a 6 horas em homens de 18 a 60 anos e 8 horas em homens com mais de 70 anos.
TABELA 3: Parâmetros farmacocinéticos médios (SD) em homens saudáveis (idades 18-26)
TABELA 4: Parâmetros farmacocinéticos médios (SD) não compartimentais após múltiplas doses de 1 mg/dia em homens saudáveis (idades 19-42)
Insuficiência renal
Não é necessário ajuste de dose em pacientes com insuficiência renal. Em pacientes com insuficiência renal crônica, com depuração de creatinina variando de 9,0 a 55 mL/min, AUC, concentração plasmática máxima, meia-vida e ligação proteica após uma dose única de 14C-finasterida foram semelhantes aos obtidos em voluntários saudáveis. A excreção urinária de metabólitos foi diminuída em pacientes com insuficiência renal. Esta diminuição foi associada a um aumento na excreção fecal de metabólitos. As concentrações plasmáticas de metabólitos foram significativamente maiores em pacientes com insuficiência renal (com base em um aumento de 60% na AUC da radioatividade total). No entanto, a finasterida foi tolerada em homens com função renal normal recebendo até 80 mg/dia por 12 semanas, onde a exposição desses pacientes a metabólitos seria presumivelmente muito maior.
Insuficiência hepática
efeito da insuficiência hepática na farmacocinética da finasterida não foi estudado. Deve-se ter cautela na administração de PROPECIA 1mg em pacientes com anormalidades da função hepática, pois a finasterida é extensamente metabolizada no fígado.
Estudos clínicos
Estudos em homens
A eficácia de PROPECIA 1mg foi demonstrada em homens (88% caucasianos) com alopecia androgenética leve a moderada (perda de cabelo de padrão masculino) entre 18 e 41 anos de idade. A fim de prevenir a dermatite seborreica, que pode confundir a avaliação do crescimento capilar nesses estudos, todos os homens, tratados com finasterida ou placebo, foram instruídos a usar um xampu específico, medicamentoso e à base de alcatrão (Neutrogena T/Gel® Shampoo) durante primeiros 2 anos de estudos.
Houve três estudos duplo-cegos, randomizados e controlados por placebo com duração de 12 meses. Os dois endpoints primários foram contagem de cabelo e autoavaliação do paciente; os dois desfechos secundários foram a avaliação do investigador e as classificações das fotografias. Além disso, foram coletadas informações sobre função sexual (com base em um questionário auto-administrado) e crescimento de pêlos no couro cabeludo. Os três estudos foram realizados em 1879 homens com queda de cabelo leve a moderada, mas não completa. Dois dos estudos incluíram homens com queda de cabelo predominantemente leve a moderada no vértice (n=1553). O terceiro inscreveu homens com perda de cabelo leve a moderada na área anterior do couro cabeludo com ou sem calvície no vértice (n = 326).
Estudos em homens com calvície de vértice
Dos homens que completaram os primeiros 12 meses dos dois ensaios de calvície de vértice, 1.215 optaram por continuar em estudos duplo-cegos, controlados por placebo, de extensão de 12 meses. Havia 547 homens recebendo PROPECIA 5mg tanto para o estudo inicial quanto para os primeiros períodos de extensão (até 2 anos de tratamento) e 60 homens recebendo placebo pelos mesmos períodos. Os estudos de extensão continuaram por mais 3 anos, com 323 homens recebendo PROPECIA 5mg e 23 recebendo placebo entrando no quinto ano do estudo.
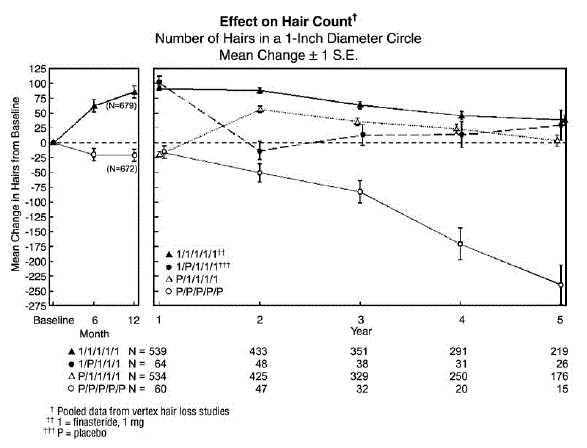
Para avaliar o efeito da descontinuação da terapia, 65 homens receberam PROPECIA 5mg nos primeiros 12 meses seguidos de placebo nos primeiros 12 meses de extensão. Alguns desses homens continuaram em estudos de extensão adicionais e voltaram ao tratamento com PROPECIA 5mg, com 32 homens entrando no quinto ano do estudo. Por último, houve 543 homens que receberam placebo nos primeiros 12 meses seguidos de PROPECIA no primeiro período de extensão de 12 meses. Alguns desses homens continuaram em estudos de extensão adicionais recebendo PROPECIA 5mg, com 290 homens entrando no quinto ano do estudo (veja a Figura 1 abaixo).
As contagens de cabelo foram avaliadas por ampliações fotográficas de uma área representativa de perda de cabelo ativa. Nestes dois estudos em homens com calvície no vértice, foram demonstrados aumentos significativos na contagem de cabelos aos 6 e 12 meses em homens tratados com PROPECIA 5mg, enquanto a perda de cabelo significativa desde a linha de base foi demonstrada naqueles tratados com placebo. Aos 12 meses, houve uma diferença de 107 cabelos em relação ao placebo (p
Os pacientes que mudaram de placebo para PROPECIA (n=425) tiveram uma diminuição na contagem de cabelos no final do período inicial de 12 meses com placebo, seguido por um aumento na contagem de cabelos após 1 ano de tratamento com PROPECIA. Este aumento na contagem de cabelos foi menor (56 cabelos acima da linha de base original) do que o aumento (91 cabelos acima da linha de base original) observado após 1 ano de tratamento em homens inicialmente randomizados para PROPECIA. Embora o aumento na contagem de cabelos, em relação ao início da terapia, tenha sido comparável entre esses dois grupos, uma contagem absoluta de cabelos mais alta foi alcançada em pacientes que iniciaram o tratamento com PROPECIA no estudo inicial. Essa vantagem foi mantida durante os 3 anos restantes dos estudos. Uma mudança de tratamento de PROPECIA 5mg para placebo (n=48) no final dos 12 meses iniciais resultou na reversão do aumento na contagem de cabelos 12 meses depois, aos 24 meses (veja a Figura 1 abaixo).
Aos 12 meses, 58% dos homens no grupo placebo tiveram mais queda de cabelo (definida como qualquer diminuição na contagem de cabelos desde a linha de base), em comparação com 14% dos homens tratados com PROPECIA. Em homens tratados por até 2 anos, 72% dos homens no grupo placebo apresentaram queda de cabelo, em comparação com 17% dos homens tratados com PROPECIA. Aos 5 anos, 100% dos homens no grupo placebo apresentaram queda de cabelo, em comparação com 35% dos homens tratados com PROPECIA.
figura 1
A autoavaliação do paciente foi obtida em cada consulta clínica a partir de um questionário autoadministrado, que incluía perguntas sobre sua percepção do crescimento do cabelo, perda de cabelo e aparência. Esta autoavaliação demonstrou aumento da quantidade de cabelo, diminuição da queda de cabelo e melhora da aparência em homens tratados com PROPECIA. A melhora geral em comparação com o placebo foi observada já em 3 meses (p
avaliação do investigador foi baseada em uma escala de 7 pontos avaliando aumentos ou diminuições no cabelo do couro cabeludo em cada visita do paciente. Esta avaliação mostrou aumentos significativamente maiores no crescimento do cabelo em homens tratados com PROPECIA em comparação com placebo já aos 3 meses (p
Um painel independente classificou as fotografias padronizadas da cabeça de forma cega com base no aumento ou diminuição do cabelo do couro cabeludo usando a mesma escala de 7 pontos da avaliação do investigador. Aos 12 meses, 48% dos homens tratados com PROPECIA tiveram um aumento em comparação com 7% dos homens tratados com placebo. Aos 2 anos, foi demonstrado um aumento no crescimento do cabelo em 66% dos homens tratados com PROPECIA 5mg, em comparação com 7% dos homens tratados com placebo. Aos 5 anos, 48% dos homens tratados com PROPECIA 5mg demonstraram um aumento no crescimento do cabelo, 42% foram classificados como sem alterações (nenhuma progressão visível da perda de cabelo desde a linha de base) e 10% foram classificados como tendo perdido cabelo quando comparados com linha de base. Em comparação, 6% dos homens tratados com placebo demonstraram um aumento no crescimento do cabelo, 19% foram classificados como sem alterações e 75% foram classificados como tendo perdido cabelo em comparação com a linha de base.
Um estudo de 48 semanas, controlado por placebo, projetado para avaliar por fototricograma o efeito de PROPECIA em cabelos totais e em crescimento ativo (anágeno) do couro cabeludo na calvície de vértice recrutou 212 homens com alopecia androgenética. Na linha de base e 48 semanas, as contagens de cabelo total e anágeno foram obtidas em uma área alvo de 1 cm² do couro cabeludo. Os homens tratados com PROPECIA apresentaram aumentos desde a linha de base nas contagens de cabelos totais e anágenos de 7 e 18 cabelos, respectivamente, enquanto os homens tratados com placebo tiveram reduções de 10 e 9 cabelos, respectivamente. Essas mudanças na contagem de cabelos resultaram em uma diferença entre os grupos de 17 cabelos na contagem total de cabelos (p
Outros resultados em estudos de calvície de vértice
Um questionário de função sexual foi auto-administrado por pacientes que participaram dos dois ensaios de calvície de vértice para detectar mudanças mais sutis na função sexual. No mês 12, diferenças estatisticamente significativas em favor do placebo foram encontradas em 3 de 4 domínios (interesse sexual, ereções e percepção de problemas sexuais). No entanto, não foi observada diferença significativa na questão da satisfação geral com a vida sexual.
Em um dos dois estudos de calvície no vértice, os pacientes foram questionados sobre o crescimento de pelos no corpo fora do couro cabeludo. PROPECIA não pareceu afetar os pelos do corpo fora do couro cabeludo.
Estudo em homens com queda de cabelo na região anterior do couro cabeludo
Um estudo de 12 meses de duração, projetado para avaliar a eficácia de PROPECIA 5mg em homens com queda de cabelo na região anterior do couro cabeludo, também demonstrou aumentos significativos na contagem de cabelos em comparação com placebo. Os aumentos na contagem de cabelos foram acompanhados por melhorias na autoavaliação do paciente, avaliação do investigador e classificações baseadas em fotografias padronizadas. A contagem de cabelos foi obtida na área anterior do couro cabeludo médio e não incluiu a área de recessão bitemporal ou a linha anterior do cabelo.
Resumo de estudos clínicos em homens
Os estudos clínicos foram realizados em homens de 18 a 41 anos com graus leves a moderados de alopecia androgenética. Todos os homens tratados com PROPECIA 5mg ou placebo receberam um xampu à base de alcatrão (Neutrogena T/Gel® Shampoo) durante os primeiros 2 anos dos estudos. A melhora clínica foi observada já em 3 meses nos pacientes tratados com PROPECIA 5mg e levou a um aumento líquido na contagem de cabelo no couro cabeludo e crescimento de cabelo. Em estudos clínicos de até 5 anos, o tratamento com PROPECIA 5mg retardou a progressão da queda de cabelo observada no grupo placebo. Em geral, a diferença entre os grupos de tratamento continuou a aumentar ao longo dos 5 anos dos estudos.
Análise étnica de dados clínicos de homens
Em uma análise combinada dos dois estudos sobre calvície no vértice, as alterações médias na contagem de cabelos desde a linha de base foram 91 vs -19 fios (PROPECIA 5mg vs placebo) entre caucasianos (n=1185), 49 vs -27 fios entre negros (n=84) , 53 vs -38 cabelos entre asiáticos (n=17), 67 vs 5 cabelos entre hispânicos (n=45) e 67 vs -15 cabelos entre outros grupos étnicos (n=20). A autoavaliação do paciente mostrou melhora em todos os grupos raciais com o tratamento com PROPECIA, exceto pela satisfação da linha do cabelo frontal e vértice em homens negros, que ficaram satisfeitos em geral.
Estudo em mulheres
Em um estudo envolvendo 137 mulheres na pós-menopausa com alopecia androgenética que foram tratadas com PROPECIA (n=67) ou placebo (n=70) por 12 meses, a eficácia não pôde ser demonstrada. Não houve melhora na contagem de cabelos, autoavaliação do paciente, avaliação do investigador ou classificações de fotografias padronizadas nas mulheres tratadas com PROPECIA quando comparadas com o grupo placebo [ver INDICAÇÕES E USO ].
INFORMAÇÃO DO PACIENTE
PROPECIA (Pro-pee-sha) (finasterida) Comprimidos
PROPECIA® é para uso APENAS por HOMENS e NÃO deve ser usado por mulheres ou crianças.
Leia esta Informação do Paciente antes de começar a tomar PROPECIA 5mg e cada vez que receber uma recarga. Pode haver novas informações. Esta informação não substitui a conversa com seu médico sobre sua condição médica ou tratamento.
O que é PROPECIA 5mg?
PROPECIA 5mg é um medicamento de prescrição utilizado para o tratamento da queda de cabelo de padrão masculino (alopecia androgenética).
Não se sabe se PROPECIA 5mg funciona para uma calvície em ambos os lados e acima da testa (área temporal).
PROPECIA 5mg não deve ser usado por mulheres e crianças.
Quem não deve tomar PROPECIA 5mg?
Não tome PROPECIA 1mg se você:
- estão grávidas ou podem engravidar. PROPECIA pode prejudicar o feto.
- Os comprimidos de PROPECIA 1mg são revestidos e evitarão o contato com o medicamento durante o manuseio, desde que os comprimidos não sejam quebrados ou esmagados. Mulheres grávidas ou que possam engravidar não devem entrar em contato com comprimidos de PROPECIA quebrados ou esmagados. Se uma mulher grávida entrar em contato com comprimidos de PROPECIA 5mg esmagados ou quebrados, lave a área de contato imediatamente com água e sabão. Se uma mulher grávida entrar em contato com o ingrediente ativo de PROPECIA 5mg, um profissional de saúde deve ser consultado.
- Se uma mulher grávida de um bebé do sexo masculino engolir ou entrar em contacto com o medicamento em PROPECIA, o bebé do sexo masculino poderá nascer com órgãos sexuais que não são normais.
- são alérgicos a qualquer um dos ingredientes de PROPECIA. Consulte o final deste folheto para obter uma lista completa dos ingredientes de PROPECIA.
O que devo dizer ao meu médico antes de tomar PROPECIA 5mg?
Antes de tomar PROPECIA 5mg, informe o seu médico se você:
- tem outras condições médicas, incluindo problemas com sua próstata ou fígado
Informe o seu médico sobre todos os medicamentos que toma, incluindo medicamentos prescritos e não prescritos, vitaminas e suplementos de ervas.
Conheça os medicamentos que você toma. Mantenha uma lista deles para mostrar ao seu médico e farmacêutico quando receber um novo medicamento.
Como devo tomar PROPECIA 5mg?
- Tome PROPECIA 5mg exatamente como seu médico lhe disse para tomá-lo.
- Você pode tomar PROPECIA 5mg com ou sem alimentos.
- Se você esquecer de tomar PROPECIA 1mg, não tome um comprimido extra. Basta tomar o próximo comprimido como de costume.
PROPECIA não funcionará mais rápido ou melhor se você tomar mais de uma vez por dia.
Quais são os possíveis efeitos colaterais do PROPECIA?
- diminuição dos níveis de Antígeno Específico da Próstata (PSA) no sangue. PROPECIA pode afetar um exame de sangue chamado PSA (Antígeno Prostático Específico) para o rastreamento do câncer de próstata. Se você fizer um teste de PSA, informe ao seu médico que está tomando PROPECIA porque PROPECIA 1mg diminui os níveis de PSA. As alterações nos níveis de PSA precisarão ser avaliadas pelo seu médico. Qualquer aumento nos níveis de PSA de acompanhamento de seu ponto mais baixo pode sinalizar a presença de câncer de próstata e deve ser avaliado, mesmo que os resultados do teste ainda estejam dentro da faixa normal para homens que não tomam PROPECIA. Você também deve informar seu médico se não estiver tomando PROPECIA 1mg conforme prescrito, pois isso pode afetar os resultados do teste de PSA. Para mais informações, fale com o seu prestador de cuidados de saúde.
- Pode haver um risco aumentado de uma forma mais grave de câncer de próstata em homens que tomam finasterida em 5 vezes a dose de PROPECIA.
Os efeitos colaterais mais comuns de PROPECIA incluem:
- diminuição do desejo sexual
- problemas para obter ou manter uma ereção
- diminuição da quantidade de sêmen
O seguinte foi relatado em uso geral com PROPECIA:
- sensibilidade e aumento mamário. Informe o seu médico sobre quaisquer alterações em seus seios, como nódulos, dor ou secreção mamilar.
- depressão;
- diminuição do desejo sexual que continuou após a interrupção da medicação;
- reações alérgicas incluindo erupção cutânea, comichão, urticária e inchaço dos lábios, língua, garganta e face;
- problemas com a ejaculação que continuaram após a interrupção da medicação;
- dor testicular;
- sangue no sêmen;
- dificuldade em conseguir uma ereção que continuou após a interrupção da medicação;
- infertilidade masculina e/ou má qualidade do sêmen.
- em casos raros, câncer de mama masculino.
Informe o seu médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do PROPECIA. Para mais informações, pergunte ao seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
Como devo armazenar o PROPECIA 1mg?
- Armazene PROPECIA 5mg em temperatura ambiente entre 59°F a 86°F (15°C a 30°C).
- Mantenha PROPECIA em um recipiente fechado e mantenha os comprimidos de PROPECIA 5mg secos (proteger da umidade).
Mantenha PROPECIA e todos os medicamentos fora do alcance das crianças.
Informações gerais sobre o uso seguro e eficaz de PROPECIA.
Às vezes, os medicamentos são prescritos para outros fins que não os listados neste folheto de informações ao paciente. Não use PROPECIA 5mg para uma condição para a qual não foi prescrito. Não dê PROPECIA a outras pessoas, mesmo que tenham os mesmos sintomas que você. Pode prejudicá-los.
Este folheto informativo do paciente resume as informações mais importantes sobre PROPECIA. Se você quiser mais informações, converse com seu médico. Você pode pedir ao seu farmacêutico ou profissional de saúde informações sobre PROPECIA escritas para profissionais de saúde. Para mais informações, ligue para 1-844-674-3200.
Quais são os ingredientes de PROPECIA 1mg?
Princípio ativo: finasterida.
Ingredientes inativos: lactose monohidratada, celulose microcristalina, amido pré-gelatinizado, glicolato de amido sódico, hidroxipropilmetilcelulose, hidroxipropilcelulose, dióxido de titânio, estearato de magnésio, talco, docusato de sódio, óxido férrico amarelo e óxido férrico vermelho.
Esta informação do paciente foi aprovada pela Food and Drug Administration dos EUA.
