Suprax 100mg, 200mg Cefixime Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Suprax 200mg e como é usado?
Suprax (cefixima) para Suspensão Oral é um antibiótico cefalosporínico usado para tratar diversos tipos de infecções causadas por bactérias.
Quais são os efeitos colaterais do Suprax?
Os efeitos colaterais comuns do Suprax 100mg incluem:
- dor de estômago / dor,
- diarréia,
- náusea,
- constipação,
- perda de apetite,
- gás,
- dor de cabeça,
- tontura,
- ansiedade,
- sonolência,
- aumento da micção noturna,
- nariz a pingar,
- dor de garganta,
- tosse, ou
- coceira ou corrimento vaginal.
Informe o seu médico se tiver efeitos secundários raros mas muito graves de Suprax 200 mg, incluindo:
- dor de estômago ou abdominal grave,
- náuseas ou vômitos persistentes,
- olhos ou pele amarelados,
- urina escura,
- cansaço incomum,
- novos sinais de infecção (por exemplo, dor de garganta persistente, febre),
- hematomas ou sangramentos fáceis,
- alteração na quantidade de urina, ou
- alterações mentais/de humor (como confusão).
DESCRIÇÃO
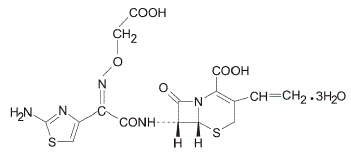
Cefixima é um antibacteriano cefalosporínico semissintético para administração oral. Quimicamente, é (6R,7R)-7-[2-(2-Amino-4-tiazolil)glioxilamido]-8-oxo-3-vinil-5-tia-1-azabiciclo [4.2.0] oct-2 ácido -eno-2-carboxílico, tri-hidrato de 72-(Z)-[O-(carboximetil)oxima].
Peso molecular = 507,50 como o trihidrato. A Fórmula Química é C16H15N5O7S2.3H2O
A fórmula estrutural da cefixima é:
- Os ingredientes inativos contidos em SUPRAX® (cefixima) 400 mg comprimidos USP são: fosfato de cálcio dibásico, hipromelose, lactose monohidratada, estearato de magnésio, celulose microcristalina, polietilenoglicol, amido pré-gelatinizado, dióxido de titânio e triacetina.
- Os ingredientes inativos contidos nas cápsulas de 400 mg de SUPRAX® (cefixima) são: dióxido de silício coloidal, crospovidona, hidroxipropilcelulose de baixa substituição, estearato de magnésio e manitol. O invólucro da cápsula contém os seguintes ingredientes inativos: óxido férrico preto, óxido férrico vermelho, gelatina, hidróxido de potássio, propilenoglicol, goma-laca, lauril sulfato de sódio e dióxido de titânio.
- Os ingredientes inativos contidos em SUPRAX® (cefixima) comprimidos mastigáveis de 100 mg ou 150 mg ou 200 mg são: aspartame, dióxido de silício coloidal, crospovidona, FD&C Red # 40 Aluminum Lake, hidroxipropilcelulose de baixa substituição, estearato de magnésio, manitol, permaseal de sabor fantasia, e sabor de tutti frutti.
- Os ingredientes inativos contidos no pó SUPRAX® (cefixima) para suspensão oral USP são: dióxido de silício coloidal, benzoato de sódio, sabor de morango, sucralose (apenas na dosagem de 500 mg/5 mL), sacarose e goma xantana.
INDICAÇÕES
Infecções não complicadas do trato urinário
SUPRAX é indicado no tratamento de pacientes adultos e pediátricos com seis meses de idade ou mais com infecções não complicadas do trato urinário causadas por isolados sensíveis de Escherichia coli e Proteus mirabilis.
Inflamação na orelha
SUPRAX é indicado no tratamento de pacientes adultos e pediátricos com seis meses de idade ou mais com otite média causada por isolados suscetíveis de Haemophilus influenzae, Moraxella catarrhalis e Streptococcus pyogenes. (Eficácia para Streptococcus pyogenes neste sistema de órgãos foi estudada em menos de 10 infecções.)
Observação
Para pacientes com otite média causada por Streptococcus pneumoniae, a resposta geral foi aproximadamente 10% menor para cefixima do que para o comparador [ver Estudos clínicos ].
Faringite e Amigdalite
SUPRAX é indicado no tratamento de pacientes adultos e pediátricos com seis meses de idade ou maiscom faringite e amigdalite causadas por isolados sensíveis de Streptococcus pyogenes. (Nota: A penicilina é a droga usual de escolha no tratamento de infecções por Streptococcus pyogenes. SUPRAX é geralmente eficaz na erradicação de Streptococcus pyogenes da nasofaringe; no entanto, os dados que estabelecem a eficácia de SUPRAX 100mg na prevenção subsequente da febre reumática não são acessível.)
Exacerbações agudas da bronquite crônica
SUPRAX 200mg é indicado no tratamento de pacientes adultos e pediátricos com seis meses de idade ou mais com exacerbações agudas de bronquite crônica causada por isolados suscetíveis de Streptococcus pneumoniae e Haemophilus influenzae.
Gonorreia não complicada (cervical/uretral)
SUPRAX 100mg é indicado no tratamento de pacientes adultos e pediátricos com seis meses de idade ou mais com gonorreia não complicada (cervical/uretral) causada por isolados sensíveis de Neisseria gonorrhoeae (isolados produtores de penicilinase e não produtores de penicilinase).
Uso
Para reduzir o desenvolvimento de bactérias resistentes a medicamentos e manter a eficácia de SUPRAX 100mg e outros medicamentos antibacterianos, SUPRAX 100mg deve ser usado apenas para tratar infecções comprovadas ou fortemente suspeitas de serem causadas por bactérias suscetíveis. Quando as informações de cultura e suscetibilidade estiverem disponíveis, elas devem ser consideradas na seleção ou modificação da terapia antimicrobiana. Na ausência de tais dados, a epidemiologia local e os padrões de suscetibilidade podem contribuir para a seleção empírica da terapia.
DOSAGEM E ADMINISTRAÇÃO
Adultos
dose recomendada de cefixima é de 400 mg por dia. Este pode ser administrado em comprimido ou cápsula de 400 mg por dia ou o comprimido de 400 mg pode ser dividido e administrado em meio comprimido a cada 12 horas. Para o tratamento de infecções gonocócicas cervicais/uretrais não complicadas, é recomendada uma dose oral única de 400 mg. A cápsula e o comprimido podem ser administrados independentemente dos alimentos.
No tratamento de infecções por Streptococcus pyogenes, uma dose terapêutica de cefixima deve ser administrada por pelo menos 10 dias.
Pacientes pediátricos (6 meses ou mais)
A dose recomendada é de 8 mg/kg/dia da suspensão. Isso pode ser administrado como uma única dose diária ou pode ser administrado em duas doses divididas, como 4 mg/kg a cada 12 horas.
Observação
Uma dose sugerida foi determinada para cada faixa de peso pediátrica. Consulte a Tabela 1. Certifique-se de que todos os pedidos que especificam uma dose em mililitros incluam uma concentração, pois SUPRAX para suspensão oral está disponível em três concentrações diferentes (100 mg/5 mL, 200 mg/5 mL e 500 mg/5 mL).
Crianças com peso superior a 45 kg ou com mais de 12 anos devem ser tratadas com a dose recomendada para adultos. Os comprimidos mastigáveis de SUPRAX (cefixima) devem ser mastigados ou esmagados antes de serem engolidos.
A otite média deve ser tratada com comprimidos mastigáveis ou suspensão. Ensaios clínicos de otite média foram conduzidos com comprimidos mastigáveis ou suspensão, e os comprimidos mastigáveis ou suspensão resultam em níveis sanguíneos de pico mais altos do que o comprimido quando administrado na mesma dose.
Portanto, o comprimido ou cápsula não deve substituir os comprimidos mastigáveis ou a suspensão no tratamento da otite média [ver FARMACOLOGIA CLÍNICA ].
No tratamento de infecções por Streptococcus pyogenes, uma dose terapêutica de cefixima deve ser administrada por pelo menos 10 dias.
Insuficiência renal
SUPRAX 200mg pode ser administrado na presença de insuficiência renal. A dose e o esquema normais podem ser empregados em pacientes com depuração de creatinina de 60 mL/min ou mais. Consulte a Tabela 2 para ajustes de dose para adultos com insuficiência renal. Nem a hemodiálise nem a diálise peritoneal removem quantidades significativas de droga do corpo.
Instruções de reconstituição para suspensão oral
Após reconstituição, a suspensão pode ser mantida por 14 dias em temperatura ambiente ou sob refrigeração, sem perda significativa de potência. Mantenha bem fechado. Agite bem antes de usar. Descarte a porção não utilizada após 14 dias.
COMO FORNECIDO
Formas de dosagem e pontos fortes
SUPRAX está disponível para administração oral nas seguintes formas de dosagem e dosagens:
- Os comprimidos revestidos por película fornecem 400 mg de cefixima como trihidrato. Estes são comprimidos revestidos por película, brancos a esbranquiçados, em forma de cápsula com bordas biseladas e uma ranhura dividida em cada lado. O comprimido é gravado com “SUPRAX” em um lado e “LUPIN” no outro lado.
- As cápsulas fornecem 400 mg de cefixima como trihidrato. São cápsulas tamanho “00EL” com tampa rosa opaca e corpo rosa opaco com “LU” na tampa e “U43” no corpo em tinta preta. As cápsulas contêm pó granular branco a branco amarelado.
- Os comprimidos mastigáveis fornecem 100 mg ou 150 mg ou 200 mg de cefixima como trihidrato. O comprimido de 100 mg é rosa, redondo, gravado com “SUPRAX 100” de um lado e “LUPIN” do outro lado. O comprimido de 150 mg é rosa, redondo, gravado com “SUPRAX 150” de um lado e “LUPIN” do outro lado. O comprimido de 200 mg é rosa, redondo, gravado com “SUPRAX 200” de um lado e “LUPIN” do outro lado.
- pó para suspensão oral, quando reconstituído, fornece 100 mg/5 mL ou 200 mg/5 mL ou 500 mg/5 mL de cefixima na forma de tri-hidrato. Para 100 mg/5 mL e 200 mg/5 mL, o pó tem uma cor esbranquiçada a amarelo pálido e tem sabor de morango. Para 500 mg/5 mL, o pó tem uma cor esbranquiçada a creme e tem sabor de morango.
Armazenamento e manuseio
SUPRAX® está disponível para administração oral nas seguintes formas farmacêuticas, dosagens e embalagens listadas na tabela abaixo:
Fabricado por: Lupin Limited Mandideep 462 046 Índia. Revisado: março de 2018.
EFEITOS COLATERAIS
Experiência de Ensaios Clínicos
Como os ensaios clínicos são conduzidos em condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparadas às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
As reações adversas mais comumente observadas em estudos norte-americanos da formulação de comprimidos foram eventos gastrointestinais, que foram relatados em 30% dos pacientes adultos no regime de duas vezes ao dia ou uma vez ao dia. Cinco por cento (5%) dos pacientes nos ensaios clínicos dos EUA descontinuaram a terapia devido a reações adversas relacionadas ao medicamento. As reações adversas individuais incluíram diarreia 16%, fezes moles ou frequentes 6%, dor abdominal 3%, náuseas 7%, dispepsia 3% e flatulência 4%. A incidência de reações adversas gastrointestinais, incluindo diarreia e fezes moles, em pacientes pediátricos que receberam a suspensão foi comparável à incidência observada em pacientes adultos que receberam comprimidos.
Experiência pós-marketing
As seguintes reações adversas foram relatadas após o uso pós-aprovação de cefixima. As taxas de incidência foram inferiores a 1 em 50 (menos de 2%).
Gastrointestinal
Vários casos documentados de colite pseudomembranosa foram identificados em ensaios clínicos. O início dos sintomas de colite pseudomembranosa pode ocorrer durante ou após a terapia.
Reações de hipersensibilidade
Reações anafiláticas/anafilactóides (incluindo choque e fatalidades), erupções cutâneas, urticária, febre medicamentosa, prurido, angioedema e edema facial. Eritema multiforme, síndrome de Stevens-Johnson e reações semelhantes à doença do soro foram relatados.
Hepático
elevações ransientes em SGPT, SGOT, fosfatase alcalina, hepatite, icterícia.
Renal
Elevações transitórias no BUN ou creatinina, insuficiência renal aguda.
Sistema nervoso central
Dores de cabeça, tonturas, convulsões.
Sistema Hemico e Linfático
Trombocitopenia transitória, leucopenia, neutropenia, prolongamento do tempo de protrombina, LDH elevado, pancitopenia, agranulocitose e eosinofilia.
Testes laboratoriais anormais
Hiperbilirrubinemia.
Outras reações adversas
Prurido genital, vaginite, candidíase, necrólise epidérmica tóxica.
Reações adversas relatadas para medicamentos da classe das cefalosporinas
Reações alérgicas, superinfecção, disfunção renal, nefropatia tóxica, disfunção hepática incluindo colestase, anemia aplástica, anemia hemolítica, hemorragia e colite.
Várias cefalosporinas foram implicadas no desencadeamento de convulsões, particularmente em pacientes com insuficiência renal quando a dosagem não foi reduzida [ver DOSAGEM E ADMINISTRAÇÃO Vejo SOBREDOSAGEM ]. Se ocorrerem convulsões associadas à terapia medicamentosa, o medicamento deve ser descontinuado. A terapia anticonvulsivante pode ser administrada se clinicamente indicada.
INTERAÇÕES MEDICAMENTOSAS
Carbamazepina
Níveis elevados de carbamazepina foram relatados na experiência pós-comercialização quando cefixima é administrada concomitantemente. O monitoramento de drogas pode ser útil na detecção de alterações nas concentrações plasmáticas de carbamazepina.
Varfarina e Anticoagulantes
Aumento do tempo de protrombina, com ou sem sangramento clínico, foi relatado quando cefixima é administrada concomitantemente.
Interações Medicamentos/Testes Laboratoriais
Uma reação falso-positiva para cetonas na urina pode ocorrer com testes usando nitroprussiato, mas não com aqueles que usam nitroferricianeto.
A administração de cefixima pode resultar em uma reação falso-positiva para glicose na urina usando Clinitest®, solução de Benedict ou solução de Fehling. Recomenda-se a utilização de testes de glicose baseados em reações enzimáticas de glicose oxidase (como Clinistix® ou TesTape®). Um teste de Coombs direto falso positivo foi relatado durante o tratamento com outras cefalosporinas; portanto, deve-se reconhecer que um teste de Coombs positivo pode ser devido ao medicamento.
AVISOS
Incluído como parte do PRECAUÇÕES seção.
PRECAUÇÕES
Reações de hipersensibilidade
Reações anafiláticas/anafilactóides (incluindo choque e fatalidades) foram relatadas com o uso de cefixima.
Antes do início da terapia com SUPRAX, deve-se fazer uma investigação cuidadosa para determinar se o paciente teve reações de hipersensibilidade anteriores a cefalosporinas, penicilinas ou outros medicamentos. Se este produto for administrado a pacientes sensíveis à penicilina, deve-se ter cautela porque a hipersensibilidade cruzada entre os antibacterianos beta-lactâmicos foi claramente documentada e pode ocorrer em até 10% dos pacientes com histórico de alergia à penicilina. Se ocorrer uma reação alérgica ao SUPRAX 100mg, interrompa o medicamento.
Diarreia Associada ao Clostridium Difficile
Diarreia associada a Clostridium difficile (CDAD) foi relatada com o uso de quase todos os agentes antibacterianos, incluindo SUPRAX 200mg, e pode variar em gravidade de diarreia leve a colite fatal. O tratamento com agentes antibacterianos altera a flora normal do cólon levando ao crescimento excessivo de C. difficile.
C. difficile produz toxinas A e B que contribuem para o desenvolvimento de CDAD. Isolados produtores de hipertoxina de C. difficile causam aumento da morbidade e mortalidade, pois essas infecções podem ser refratárias à terapia antimicrobiana e podem exigir colectomia. CDAD deve ser considerado em todos os pacientes que apresentam diarreia após o uso de drogas antibacterianas. É necessário um histórico médico cuidadoso, pois foi relatado que a CDAD ocorre mais de dois meses após a administração de agentes antibacterianos.
Se houver suspeita ou confirmação de CDAD, o uso contínuo de drogas antibacterianas não direcionadas contra C. difficile pode precisar ser descontinuado. O manejo adequado de fluidos e eletrólitos, suplementação de proteínas, tratamento com drogas antibacterianas de C. difficile e avaliação cirúrgica devem ser instituídos conforme indicação clínica.
Ajuste de Dose na Insuficiência Renal
dose de SUPRAX 100mg deve ser ajustada em pacientes com insuficiência renal, bem como naqueles submetidos a diálise peritoneal ambulatorial contínua (DPAC) e hemodiálise (HD). Pacientes em diálise devem ser monitorados cuidadosamente [ver DOSAGEM E ADMINISTRAÇÃO ].
Efeitos de coagulação
As cefalosporinas, incluindo SUPRAX 200mg, podem estar associadas a uma queda na atividade da protrombina. Aqueles em risco incluem pacientes com insuficiência renal ou hepática, ou mau estado nutricional, bem como pacientes que recebem um curso prolongado de terapia antimicrobiana e pacientes previamente estabilizados em terapia anticoagulante. O tempo de protrombina deve ser monitorado em pacientes em risco e vitamina K exógena administrada conforme indicado.
Desenvolvimento de bactérias resistentes a drogas
A prescrição de SUPRAX (cefixima) na ausência de uma infecção bacteriana comprovada ou fortemente suspeita é improvável de trazer benefícios ao paciente e aumenta o risco de desenvolvimento de bactérias resistentes aos medicamentos.
Risco em pacientes com fenilcetonúria
fenilalanina pode ser prejudicial para pacientes com fenilcetonúria (PKU). Os comprimidos mastigáveis SUPRAX 200mg contêm aspartame, uma fonte de fenilalanina. Cada dosagem de 100 mg, 150 mg e 200 mg contém 3,3 mg, 5 mg e 6,7 mg de fenilalanina, respectivamente. Antes de prescrever comprimidos mastigáveis SUPRAX em um paciente com PKU, considere a quantidade diária combinada de fenilalanina de todas as fontes, incluindo comprimidos mastigáveis SUPRAX 200mg.
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Não foram realizados estudos ao longo da vida em animais para avaliar o potencial carcinogénico. Cefixima não causou mutações pontuais em bactérias ou células de mamíferos, danos ao DNA ou danos cromossômicos in vitro e não exibiu potencial clastogênico in vivo no teste de micronúcleo de camundongo. Em ratos, a fertilidade e o desempenho reprodutivo não foram afetados pela cefixima em doses até 25 vezes a dose terapêutica do adulto.
Uso em populações específicas
Gravidez
Gravidez Categoria B
Estudos de reprodução foram realizados em camundongos e ratos com doses de até 40 vezes a dose humana e não revelaram evidências de danos ao feto devido à cefixima. Não existem estudos adequados e bem controlados em mulheres grávidas. Como os estudos de reprodução em animais nem sempre são preditivos da resposta humana, este medicamento deve ser usado durante a gravidez somente se for claramente necessário.
Trabalho e entrega
Cefixima não foi estudado para uso durante o trabalho de parto e parto. O tratamento só deve ser administrado se for claramente necessário.
Mães que amamentam
Não se sabe se a cefixima é excretada no leite humano. Deve-se considerar a interrupção temporária da amamentação durante o tratamento com este medicamento.
Uso Pediátrico
A segurança e a eficácia da cefixima em crianças com menos de seis meses de idade não foram estabelecidas. A incidência de reações adversas gastrointestinais, incluindo diarreia e fezes moles, nos pacientes pediátricos que receberam a suspensão, foi comparável à incidência observada em pacientes adultos que receberam os comprimidos.
Uso Geriátrico
Os estudos clínicos não incluíram um número suficiente de indivíduos com 65 anos ou mais para determinar se eles respondem de forma diferente dos indivíduos mais jovens. Outras experiências clínicas relatadas não identificaram diferenças nas respostas entre os pacientes idosos e os mais jovens. Um estudo farmacocinético em idosos detectou diferenças nos parâmetros farmacocinéticos [ver FARMACOLOGIA CLÍNICA ]. Essas diferenças foram pequenas e não indicam necessidade de ajuste posológico do medicamento em idosos.
Insuficiência renal
A dose de cefixima deve ser ajustada em pacientes com insuficiência renal, bem como naqueles submetidos a diálise peritoneal ambulatorial contínua (CAPD) e hemodiálise (HD). Pacientes em diálise devem ser monitorados cuidadosamente [ver DOSAGEM E ADMINISTRAÇÃO ].
SOBREDOSAGEM
lavagem gástrica pode ser indicada; caso contrário, não existe antídoto específico. A cefixima não é removida em quantidades significativas da circulação por hemodiálise ou diálise peritoneal. As reações adversas em um pequeno número de voluntários adultos saudáveis que receberam doses únicas de até 2 g de cefixima não diferiram do perfil observado em pacientes tratados com as doses recomendadas.
CONTRA-INDICAÇÕES
Suprax (cefixima) é contraindicado em pacientes com alergia conhecida a cefixima ou outras cefalosporinas.
FARMACOLOGIA CLÍNICA
Mecanismo de ação
Cefixima é uma droga antibacteriana cefalosporina semissintética [ver Microbiologia ].
Farmacocinética
Os comprimidos mastigáveis SUPRAX 200mg são bioequivalentes à suspensão oral.
Suprax 200mg comprimidos e suspensão, administrados por via oral, são cerca de 40% a 50% absorvidos, administrados com ou sem alimentos; no entanto, o tempo para absorção máxima aumenta aproximadamente 0,8 horas quando administrado com alimentos. Um único comprimido de 200 mg de cefixima produz um pico médio de concentração sérica de aproximadamente 2 mcg/mL (intervalo de 1 a 4 mcg/mL); um único comprimido de 400 mg produz um pico médio de concentração de aproximadamente 3,7 mcg/mL (intervalo de 1,3 a 7,7 mcg/mL). A suspensão oral produz picos de concentração médios aproximadamente 25% a 50% maiores do que os comprimidos, quando testados em voluntários adultos normais. Doses de 200 e 400 mg de suspensão oral produzem concentrações máximas médias de 3 mcg/mL (intervalo de 1 a 4,5 mcg/mL) e 4,6 mcg/mL (intervalo de 1,9 a 7,7 mcg/mL), respectivamente, quando testadas em voluntários adultos normais . A área sob a curva de tempo versus concentração (AUC) é maior em aproximadamente 10% a 25% com a suspensão oral do que com o comprimido após doses de 100 a 400 mg, quando testado em voluntários adultos normais. Este aumento da absorção deve ser levado em consideração se a suspensão oral for substituir o comprimido. Devido à falta de bioequivalência, os comprimidos não devem substituir a suspensão oral no tratamento da otite média [ver DOSAGEM E ADMINISTRAÇÃO ]. Não foram realizados estudos cruzados de comprimido versus suspensão em crianças.
A cápsula de 400 mg é bioequivalente ao comprimido de 400 mg em jejum. No entanto, os alimentos reduzem a absorção após a administração da cápsula em aproximadamente 15% com base na AUC e 25% com base na Cmax.
As concentrações séricas máximas ocorrem entre 2 e 6 horas após a administração oral de um único comprimido de 200 mg, um único comprimido de 400 mg ou 400 mg de suspensão de cefixima. As concentrações séricas máximas ocorrem entre 2 e 5 horas após uma administração única de 200 mg de suspensão. As concentrações séricas máximas ocorrem entre 3 e 8 horas após a administração oral de uma única cápsula de 400 mg.
Distribuição
ligação às proteínas séricas é independente da concentração com uma fração ligada de aproximadamente 65%. Em um estudo de dose múltipla realizado com uma formulação de pesquisa que é menos biodisponível do que o comprimido ou suspensão, houve pouco acúmulo de droga no soro ou na urina após a dosagem por 14 dias. Não estão disponíveis dados adequados sobre os níveis de cefixima no LCR.
Metabolismo e Excreção
Não há evidência de metabolismo da cefixima in vivo. Aproximadamente 50% da dose absorvida é excretada inalterada na urina em 24 horas. Em estudos com animais, observou-se que a cefixima também é excretada na bile em excesso de 10% da dose administrada. A meia-vida sérica da cefixima em indivíduos saudáveis é independente da forma de dosagem e é em média de 3 a 4 horas, mas pode variar até 9 horas em alguns voluntários normais.
Populações Especiais
Geriatria
As AUCs médias no estado de equilíbrio em pacientes idosos são aproximadamente 40% mais altas que as AUCs médias em outros adultos saudáveis. As diferenças nos parâmetros farmacocinéticos entre 12 jovens e 12 idosos que receberam 400 mg de cefixima uma vez ao dia por 5 dias são resumidas como segue:
No entanto, esses aumentos não foram clinicamente significativos [ver DOSAGEM E ADMINISTRAÇÃO ].
Insuficiência renal
Em indivíduos com insuficiência moderada da função renal (depuração de creatinina de 20 a 40 mL/min), a meia-vida sérica média da cefixima é prolongada para 6,4 horas. Na insuficiência renal grave (depuração de creatinina de 5 a 20 mL/min), a meia-vida aumentou para uma média de 11,5 horas. A droga não é eliminada significativamente do sangue por hemodiálise ou diálise peritoneal. No entanto, um estudo indicou que, com doses de 400 mg, os pacientes em hemodiálise têm perfis sanguíneos semelhantes aos indivíduos com depuração de creatinina de 21 a 60 mL/min.
Microbiologia
Mecanismo de ação
Tal como acontece com outras cefalosporinas, a ação bactericida da cefixima resulta da inibição da síntese da parede celular. Cefixima é estável na presença de certas enzimas beta-lactamases. Como resultado, certos organismos resistentes às penicilinas e algumas cefalosporinas devido à presença de betalactamases podem ser suscetíveis à cefixima.
Resistência
A resistência à cefixima em isolados de Haemophilus influenzae e Neisseria gonorrhoeae está mais frequentemente associada a alterações nas proteínas de ligação à penicilina (PBPs). Cefixima pode ter atividade limitada contra Enterobacteriaceae produzindo beta-lactamases de espectro estendido (ESBLs). Espécies de Pseudomonas, espécies de Enterococcus, cepas de estreptococos do Grupo D, Listeria monocytogenes, a maioria das cepas de estafilococos (incluindo cepas resistentes à meticilina), a maioria das cepas de espécies de Enterobacter, a maioria das cepas de Bacteroides fragilis e a maioria das cepas de espécies de Clostridium são resistentes à cefixima.
Actividade antimicrobiana
cefixima demonstrou ser ativa contra a maioria dos isolados dos seguintes microrganismos, tanto in vitro quanto em infecções clínicas [ver INDICAÇÕES ].
Bactérias Gram-positivas
Streptococcus pneumoniae Streptococcus pyogenes
Bactérias Gram-negativas
Escherichia coli Haemophilus influenzae Moraxella catarrhalis Neisseria gonorrhoeae Proteus mirabilis
Os seguintes dados in vitro estão disponíveis, mas seu significado clínico é desconhecido. Pelo menos 90 por cento das seguintes bactérias exibem uma concentração inibitória mínima in vitro (CIM) menor ou igual ao ponto de quebra suscetível para cefixima contra isolados de gênero ou grupo de organismos semelhantes. No entanto, a eficácia da cefixima no tratamento de infecções clínicas causadas por essas bactérias não foi estabelecida em ensaios clínicos adequados e bem controlados.
Bactérias Gram-positivas
Streptococcus agalactiae
Bactérias Gram-negativas
Citrobacter amalonaticus Citrobacter diversus Haemophilus parainfluenzae Klebsiella oxytoca Klebsiella pneumoniae Pasteurella multocida Proteus vulgaris Providencia espécies Salmonella espécies Serratia marcescens Shigella espécies
Teste de suscetibilidade
Para obter informações específicas sobre os critérios interpretativos do teste de suscetibilidade e métodos de teste associados e padrões de controle de qualidade reconhecidos pela FDA para este medicamento, consulte: https://www.fda.gov/STIC.
Estudos clínicos
Ensaios clínicos comparativos de otite média foram conduzidos em cerca de 400 crianças com idades entre 6 meses e 10 anos. Streptococcus pneumoniae foi isolado em 47% dos pacientes, Haemophilus influenzae em 34%, Moraxella catarrhalis em 15% e S. pyogenes em 4%.
taxa de resposta geral de Streptococcus pneumoniae à cefixima foi aproximadamente 10% menor e a de Haemophilus influenzae ou Moraxella catarrhalis aproximadamente 7% maior (12% quando isolados beta-lactamase positivos de H. influenzae são incluídos) do que as taxas de resposta desses organismos a as drogas de controle ativo.
Nesses estudos, os pacientes foram randomizados e tratados com cefixima em regimes de dose de 4 mg/kg duas vezes ao dia ou 8 mg/kg uma vez ao dia, ou com um comparador. Sessenta e nove a 70% dos pacientes em cada grupo tiveram resolução dos sinais e sintomas de otite média quando avaliados 2 a 4 semanas após o tratamento, mas derrame persistente foi encontrado em 15% dos pacientes. Quando avaliados ao final da terapia, 17% dos pacientes que receberam cefixima e 14% dos pacientes que receberam medicamentos comparativos eficazes (18% incluindo aqueles pacientes que tinham Haemophilus influenzae resistente ao medicamento de controle e que receberam o medicamento antibacteriano de controle) foram considerados falhas de tratamento. No seguimento de 2 a 4 semanas, um total de 30%-31% dos pacientes apresentava evidência de falha no tratamento ou doença recorrente.
Resultado bacteriológico da otite média em duas a quatro semanas após a terapia com base na repetição do ouvido médio
INFORMAÇÃO DO PACIENTE
Aconselhar os pacientes de que medicamentos antibacterianos, incluindo cefixima, devem ser usados apenas para tratar infecções bacterianas. Eles não tratam infecções virais (por exemplo, o resfriado comum). Quando a cefixima é prescrita para tratar uma infecção bacteriana, os pacientes devem ser informados de que, embora seja comum sentir-se melhor no início do tratamento, a medicação deve ser tomada exatamente como indicado. Pular doses ou não completar o curso completo da terapia pode: (1) diminuir a eficácia do tratamento imediato e (2) aumentar a probabilidade de que as bactérias desenvolvam resistência e não sejam tratáveis por cefixima para suspensão oral ou comprimidos mastigáveis de cefixima ou outros drogas antibacterianas no futuro.
Aconselhe os pacientes com fenilcetonúria que os comprimidos mastigáveis SUPRAX 200mg contêm aspartame, uma fonte de fenilalanina da seguinte forma: Cada comprimido mastigável SUPRAX contém 3,3 mg, 5 mg e 6,7 mg de fenilalanina por dosagem de 100 mg, 150 mg e 200 mg, respectivamente.
Aconselhe os pacientes que a diarreia é um problema comum causado por medicamentos antibacterianos que geralmente termina quando o medicamento antibacteriano é descontinuado. Às vezes, após o início do tratamento com medicamentos antibacterianos, os pacientes podem desenvolver fezes aquosas e sanguinolentas (com ou sem cólicas estomacais e febre), mesmo dois ou mais meses após a última dose do medicamento antibacteriano. Se isso ocorrer, os pacientes devem entrar em contato com seu médico o mais rápido possível.
