Tricor 160mg, 200mg Fenofibrate Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Tricor e como é usado?
Tricor é um medicamento de prescrição usado para tratar reduzir os sintomas de colesterol e triglicérides (ácidos graxos) no sangue. Tricor pode ser usado sozinho ou com outros medicamentos.
- Tricor pertence a uma classe de medicamentos chamados agentes de ácido fíbrico.
- Não se sabe se Tricor 200mg é seguro e eficaz em crianças
Quais são os possíveis efeitos colaterais do Tricor?
Tricor 200mg pode causar efeitos colaterais graves, incluindo:
- dor de estômago aguda se espalhando para as costas ou omoplata,
- perda de apetite,
- dor de estômago depois de apenas uma refeição,
- amarelecimento da pele ou dos olhos (icterícia),
- febre,
- arrepios,
- fraqueza,
- dor de garganta,
- aftas,
- hematomas ou sangramentos incomuns,
- dor no peito,
- tosse repentina,
- chiado,
- respiração rápida,
- tossindo sangue, e
- inchaço, calor ou vermelhidão em um braço ou perna
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Tricor incluem:
- nariz a pingar,
- espirros, e
- exames laboratoriais anormais
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Tricor. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
DESCRIÇÃO
TRICOR (comprimidos de fenofibrato), é um agente regulador de lipídios disponível na forma de comprimidos para administração oral. Cada comprimido contém 54 mg ou 160 mg de fenofibrato. O nome químico do fenofibrato é ácido 2-[4-(4-clorobenzoil)fenoxi]-2-metil-propanóico, éster 1-metiletílico com a seguinte fórmula estrutural:
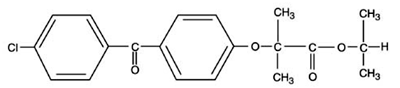
fórmula empírica é C20H21O4Cl e o peso molecular é 360,83; fenofibrato é insolúvel em água. O ponto de fusão é 79-82°C. O fenofibrato é um sólido branco que é estável em condições normais.
Ingredientes inativos
Cada comprimido contém dióxido de silício coloidal, crospovidona, lactose monohidratada, lecitina, celulose microcristalina, álcool polivinílico, povidona, lauril sulfato de sódio, estearil fumarato de sódio, talco, dióxido de titânio e goma xantana. Além disso, os comprimidos individuais de 54 mg contêm D&C Yellow No. 10, FD&C Yellow No. 6, FD&C Blue No. 2.
INDICAÇÕES
Hipercolesterolemia primária ou dislipidemia mista
TRICOR é indicado como terapia adjuvante à dieta para reduzir o colesterol elevado de lipoproteína de baixa densidade (LDL-C), colesterol total (Total-C), triglicerídeos e apolipoproteína B (Apo B) e para aumentar o colesterol de lipoproteína de alta densidade (HDL- C) em pacientes adultos com hipercolesterolemia primária ou dislipidemia mista.
Hipertrigliceridemia grave
TRICOR 200mg também é indicado como terapia adjuvante à dieta para tratamento de pacientes adultos com hipertrigliceridemia grave. Melhorar o controle glicêmico em pacientes diabéticos com quilomicronemia em jejum geralmente evita a necessidade de intervenção farmacológica.
Níveis acentuadamente elevados de triglicerídeos séricos (por exemplo, > 2.000 mg/dL) podem aumentar o risco de desenvolver pancreatite. O efeito da terapia com fenofibrato na redução deste risco não foi adequadamente estudado.
Limitações importantes de uso
O fenofibrato em uma dose equivalente a 145 mg de TRICOR não demonstrou reduzir a morbidade e a mortalidade por doença coronariana em um grande estudo controlado randomizado de pacientes com diabetes mellitus tipo 2 [ver AVISOS E PRECAUÇÕES ].
DOSAGEM E ADMINISTRAÇÃO
considerações gerais
Os pacientes devem ser colocados em uma dieta hipolipemiante apropriada antes de receber TRICOR 160mg e devem continuar esta dieta durante o tratamento com TRICOR. Os comprimidos de TRICOR podem ser administrados independentemente das refeições.
tratamento inicial para a dislipidemia é a terapia dietética específica para o tipo de anormalidade lipoprotéica. O excesso de peso corporal e a ingestão excessiva de álcool podem ser fatores importantes na hipertrigliceridemia e devem ser abordados antes de qualquer terapia medicamentosa. O exercício físico pode ser uma importante medida auxiliar. Doenças que contribuem para a hiperlipidemia, como hipotireoidismo ou diabetes mellitus, devem ser investigadas e tratadas adequadamente. A terapia com estrogênio, diuréticos tiazídicos e betabloqueadores às vezes estão associados a aumentos maciços nos triglicerídeos plasmáticos, especialmente em indivíduos com hipertrigliceridemia familiar. Nesses casos, a descontinuação do agente etiológico específico pode evitar a necessidade de terapia medicamentosa específica para hipertrigliceridemia.
Os níveis lipídicos devem ser monitorados periodicamente e deve-se considerar a redução da dosagem de TRICOR se os níveis lipídicos caírem significativamente abaixo da faixa alvo.
terapia deve ser suspensa em pacientes que não tenham uma resposta adequada após dois meses de tratamento com a dose máxima recomendada de 145 mg uma vez ao dia.
Hipercolesterolemia primária ou dislipidemia mista
A dose inicial de TRICOR 200mg é de 145mg uma vez ao dia.
Hipertrigliceridemia grave
A dose inicial é de 48 a 145 mg por dia. A dosagem deve ser individualizada de acordo com a resposta do paciente e deve ser ajustada, se necessário, após repetidas determinações de lipídios em intervalos de 4 a 8 semanas. A dose máxima é de 145 mg uma vez por dia.
Função Renal Prejudicada
O tratamento com TRICOR 200mg deve ser iniciado na dose de 48mg ao dia em pacientes com insuficiência renal leve a moderada, e aumentado somente após avaliação dos efeitos na função renal e nos níveis lipídicos dessa dose. O uso de TRICOR deve ser evitado em pacientes com insuficiência renal grave [ver Uso em populações específicas e FARMACOLOGIA CLÍNICA ].
Pacientes Geriátricos
A seleção da dose para idosos deve ser feita com base na função renal [ver Uso em populações específicas ].
COMO FORNECIDO
Formas de dosagem e pontos fortes
- Comprimidos amarelos de 48 mg, impressos com as letras de identificação do código “FI”.
- Comprimidos amarelos de 48 mg, impressos com o logotipo “a” e as letras de identificação do código “FI”.
- Comprimidos brancos de 145 mg, impressos com as letras de identificação do código “FO”.
- Comprimidos brancos de 145 mg, impressos com o logotipo “a” e as letras de identificação do código “FO”.
Armazenamento e manuseio
TRICOR® (comprimidos de fenofibrato) está disponível em dois pontos fortes:
48 mg
Comprimidos amarelos, impressos com as letras de identificação do código “FI”, disponíveis em frascos de 90 ( NDC 0074-3173-90).
Comprimidos amarelos, impressos com o logotipo “a” e letras de identificação do código “FI”, disponíveis em frascos de 90 ( NDC 0074-6122-90).
145 mg
Comprimidos brancos, impressos com as letras de identificação do código “FO”, disponíveis em frascos de 90 ( NDC 0074-3189-90).
Comprimidos brancos, impressos com o logotipo “a” e letras de identificação do código “FO”, disponíveis em frascos de 90 ( NDC 0074-6123-90).
Armazenar
Armazenar a 25°C (77°F); excursões permitidas a 15-30°C (59-86°F).
[Consulte a temperatura ambiente controlada da USP]. Manter fora do alcance das crianças. Proteger da umidade.
Fabricado para AbbVie Inc., North Chicago, IL 60064, EUA por Fournier Laboratories Ireland Limited, Anngrove, Carrigtwohill Co. Cork, Irlanda. Revisado: março de 2021
EFEITOS COLATERAIS
As seguintes reações adversas graves estão descritas abaixo e em outras partes da bula:
- Mortalidade e morbidade por doença coronariana [ver AVISOS E PRECAUÇÕES ]
- Hepatoxicidade [ver AVISOS E PRECAUÇÕES ]
- Pancreatite [ver AVISOS E PRECAUÇÕES ]
- Reações de hipersensibilidade [ver AVISOS E PRECAUÇÕES ]
- Doença venotromboembólica [ver AVISOS E PRECAUÇÕES ]
Experiência de Ensaios Clínicos
Como os estudos clínicos são conduzidos em condições muito variadas, as taxas de reações adversas observadas nos estudos clínicos de um medicamento não podem ser comparadas diretamente com as taxas nos estudos clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
Os eventos adversos relatados por 2% ou mais dos pacientes tratados com fenofibrato (e maior que placebo) durante os estudos duplo-cegos controlados por placebo, independentemente da causalidade, estão listados na Tabela 1 abaixo. Os eventos adversos levaram à descontinuação do tratamento em 5,0% dos pacientes tratados com fenofibrato e em 3,0% tratados com placebo. Aumentos nos testes de função hepática foram os eventos mais frequentes, causando descontinuação do tratamento com fenofibrato em 1,6% dos pacientes em estudos duplo-cegos.
Urticária foi observada em 1,1% versus 0%, e erupção cutânea em 1,4% versus 0,8% dos pacientes com fenofibrato e placebo, respectivamente, em estudos controlados.
Aumento das enzimas hepáticas
Em uma análise agrupada de 10 estudos controlados com placebo, aumentos > 3 vezes o limite superior do normal em ALT ocorreram em 5,3% dos pacientes tomando fenofibrato em doses equivalentes a 96 mg a 145 mg TRICOR diariamente versus 1,1% dos pacientes tratados com placebo [Vejo AVISOS E PRECAUÇÕES ]. Em um estudo de 8 semanas, a incidência de elevações de ALT ou AST ≥ 3 vezes o limite superior do normal foi de 13% em pacientes que receberam doses equivalentes a 96 mg a 145 mg de TRICOR diariamente e foi de 0% naqueles que receberam doses equivalentes a 48 mg ou menos TRICOR diariamente ou placebo.
Experiência pós-marketing
As seguintes reações adversas foram identificadas durante o uso pós-aprovação de fenofibrato. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento: mialgia, rabdomiólise, pancreatite, insuficiência renal aguda, espasmo muscular, hepatite, cirrose, aumento bilirrubina total, anemia, artralgia, diminuição da hemoglobina, diminuição do hematócrito, diminuição dos glóbulos brancos, astenia, níveis de HDL-colesterol severamente deprimidos e doença pulmonar intersticial. As reações de fotossensibilidade ocorreram dias a meses após o início; em alguns desses casos, os pacientes relataram uma reação de fotossensibilidade prévia ao cetoprofeno.
INTERAÇÕES MEDICAMENTOSAS
Anticoagulantes cumarínicos
A potencialização dos efeitos anticoagulantes do tipo cumarínico foi observada com o prolongamento do PT/INR.
Deve-se ter cautela quando anticoagulantes cumarínicos são administrados em conjunto com TRICOR. A dosagem dos anticoagulantes deve ser reduzida para manter o TP/INR no nível desejado para evitar complicações hemorrágicas. Determinações freqüentes de PT/INR são aconselháveis até que seja definitivamente determinado que o PT/INR se estabilizou [ver AVISOS E PRECAUÇÕES ].
Imunossupressores
Os imunossupressores, como a ciclosporina e o tacrolimus, podem produzir nefrotoxicidade com diminuição da depuração da creatinina e aumento da creatinina sérica e, como a excreção renal é a principal via de eliminação de medicamentos à base de fibratos, incluindo TRICOR, existe o risco de que uma interação leve à deterioração da função renal. Os benefícios e riscos do uso de TRICOR (comprimidos de fenofibrato) com imunossupressores e outros agentes potencialmente nefrotóxicos devem ser cuidadosamente considerados, e a menor dose efetiva empregada e a função renal monitorada.
Resinas de Ligação de Ácidos Biliares
Como as resinas de ligação aos ácidos biliares podem ligar-se a outros medicamentos administrados concomitantemente, os pacientes devem tomar TRICOR 200 mg pelo menos 1 hora antes ou 4 a 6 horas após uma resina de ligação aos ácidos biliares para evitar impedir sua absorção.
Colchicina
Casos de miopatia, incluindo rabdomiólise, foram relatados com fenofibratos coadministrados com colchicina, e deve-se ter cautela ao prescrever fenofibrato com colchicina.
AVISOS
Incluído como parte do PRECAUÇÕES seção.
PRECAUÇÕES
Mortalidade e Morbidade por Doença Coronariana
O efeito de TRICOR 160mg na morbidade e mortalidade por doença coronariana e mortalidade não cardiovascular não foi estabelecido.
estudo Action to Control Cardiovascular Risk in Diabetes Lipid (ACCORD Lipid) foi um estudo randomizado controlado por placebo de 5.518 pacientes com diabetes mellitus tipo 2 em terapia de base com estatinas tratados com fenofibrato. A duração média do seguimento foi de 4,7 anos. A terapia combinada de fenofibrato e estatina mostrou uma redução não significativa de 8% do risco relativo no desfecho primário de eventos cardiovasculares adversos maiores (ECAM), um composto de infarto do miocárdio não fatal, acidente vascular cerebral não fatal e morte por doença cardiovascular (razão de risco HR] 0,92, IC 95% 0,79-1,08) (p = 0,32) em comparação com a monoterapia com estatina. Em uma análise de subgrupo de gênero, a razão de risco para MACE em homens recebendo terapia combinada versus monoterapia com estatina foi de 0,82 (IC 95% 0,69-0,99), e a razão de risco para MACE em mulheres recebendo terapia combinada versus monoterapia com estatina foi 1,38 (IC 95% 0,98-1,94) (interação p=0,01). O significado clínico deste achado de subgrupo não é claro.
estudo Fenofibrate Intervention and Event Lowering in Diabetes (FIELD) foi um estudo randomizado de 5 anos, controlado por placebo de 9.795 pacientes com diabetes mellitus tipo 2 tratados com fenofibrato. O fenofibrato demonstrou uma redução relativa não significativa de 11% no desfecho primário de eventos de doença coronariana (taxa de risco [HR] 0,89, IC 95% 0,75-1,05, p = 0,16) e uma redução significativa de 11% no desfecho secundário do total eventos de doenças cardiovasculares (HR 0,89 [0,80-0,99], p=0,04). Houve um aumento não significativo de 11% (HR 1,11 [0,95, 1,29], p=0,18) e 19% (HR 1,19 [0,90, 1,57], p=0,22) na mortalidade total e por doença coronariana, respectivamente, com fenofibrato quando comparado ao placebo.
Devido às semelhanças químicas, farmacológicas e clínicas entre TRICOR (comprimidos de fenofibrato), clofibrato e gemfibrozil, os achados adversos em 4 grandes estudos clínicos randomizados e controlados por placebo com esses outros medicamentos de fibrato também podem se aplicar ao TRICOR.
No Coronary Drug Project, um grande estudo de pós-infarto do miocárdio de pacientes tratados por 5 anos com clofibrato, não houve diferença na mortalidade observada entre o grupo clofibrato e o grupo placebo. Houve, no entanto, uma diferença na taxa de colelitíase e colecistite com necessidade de cirurgia entre os dois grupos (3,0% vs. 1,8%).
Em um estudo realizado pela Organização Mundial da Saúde (OMS), 5.000 indivíduos sem doença arterial coronariana conhecida foram tratados com placebo ou clofibrato por 5 anos e acompanhados por mais um ano. Houve uma mortalidade por todas as causas estatisticamente significativa e mais elevada ajustada para a idade no grupo clofibrato em comparação com o grupo placebo (5,70% vs. 3,96%, p =
Helsinki Heart Study foi um grande (n=4081) estudo de homens de meia-idade sem histórico de doença arterial coronariana. Os indivíduos receberam placebo ou gemfibrozil por 5 anos, com uma extensão aberta de 3,5 anos depois. A mortalidade total foi numericamente maior no grupo de randomização gemfibrozil, mas não atingiu significância estatística (p = 0,19, intervalo de confiança de 95% para risco relativo G:P = 0,91-1,64). Embora as mortes por câncer tenham apresentado uma tendência maior no grupo gemfibrozil (p = 0,11), os cânceres (excluindo carcinoma basocelular) foram diagnosticados com igual frequência em ambos os grupos de estudo. Devido ao tamanho limitado do estudo, o risco relativo de morte por qualquer causa não se mostrou diferente do observado nos dados de acompanhamento de 9 anos do estudo da Organização Mundial da Saúde (RR=1,29).
Um componente de prevenção secundária do Helsinki Heart Study recrutou homens de meia-idade excluídos do estudo de prevenção primária por causa de doença coronariana conhecida ou suspeita. Os indivíduos receberam gemfibrozil ou placebo por 5 anos. Embora as mortes cardíacas tenham apresentado tendência maior no grupo gemfibrozil, isso não foi estatisticamente significativo (taxa de risco 2,2, intervalo de confiança de 95%: 0,94-5,05). A taxa de cirurgia da vesícula biliar não foi estatisticamente significativa entre os grupos de estudo, mas teve uma tendência maior no grupo gemfibrozil (1,9% vs. 0,3%, p = 0,07).
Hepatotoxicidade
Lesões hepáticas graves induzidas por drogas (DILI), incluindo transplante de fígado e morte, foram relatadas após a comercialização com TRICOR. DILI foi relatado nas primeiras semanas de tratamento ou após vários meses de terapia e, em alguns casos, reverteu com a descontinuação do tratamento com TRICOR 200mg. Pacientes com DILI apresentaram sinais e sintomas, incluindo urina escura, fezes anormais, icterícia, mal-estar, dor abdominal, mialgia, perda de peso, prurido e náusea. Muitos pacientes apresentaram elevações concomitantes de bilirrubina total, alanina transaminase sérica (ALT) e aspartato transaminase (AST). A DILI foi caracterizada como hepatite hepatocelular, crônica ativa e colestática, e a cirrose ocorreu em associação com hepatite crônica ativa.
Em ensaios clínicos, o fenofibrato em doses equivalentes a 96 mg a 145 mg de TRICOR 160 mg por dia foi associado a aumentos na AST ou ALT séricas. A incidência de aumentos nas transaminases pode estar relacionada à dose [ver REAÇÕES ADVERSAS ].
TRICOR 160mg é contraindicado em pacientes com doença hepática ativa, incluindo aqueles com cirrose biliar primária e anormalidades persistentes inexplicáveis da função hepática [ver CONTRA-INDICAÇÕES ]. Monitore a função hepática do paciente, incluindo ALT, AST e bilirrubina total séricas, na linha de base e periodicamente durante a terapia com TRICOR. Descontinuar TRICOR 200mg se surgirem sinais ou sintomas de lesão hepática ou se os níveis enzimáticos elevados persistirem (ALT ou AST > 3 vezes o limite superior do normal, ou se acompanhado de elevação da bilirrubina). Não reinicie TRICOR 160mg nesses pacientes se não houver explicação alternativa para a lesão hepática.
Miopatia e Rabdomiólise
Os fibratos aumentam o risco de miopatia e têm sido associados à rabdomiólise. O risco de toxicidade muscular grave parece estar aumentado em pacientes idosos e em pacientes com diabetes, insuficiência renal ou hipotireoidismo.
miopatia deve ser considerada em qualquer paciente com mialgias difusas, sensibilidade ou fraqueza muscular e/ou elevações acentuadas dos níveis de creatina fosfoquinase (CPK).
Os pacientes devem ser aconselhados a relatar imediatamente dor muscular inexplicável, sensibilidade ou fraqueza, particularmente se acompanhada de mal-estar ou febre. Os níveis de CPK devem ser avaliados em pacientes que relatam esses sintomas, e a terapia com TRICOR 200 mg deve ser descontinuada se ocorrerem níveis marcadamente elevados de CPK ou se houver suspeita ou diagnóstico de miopatia/miosite.
Dados de estudos observacionais indicam que o risco de rabdomiólise aumenta quando fibratos, em particular gemfibrozil, são coadministrados com uma estatina. A combinação deve ser evitada, a menos que o benefício de alterações adicionais nos níveis lipídicos supere o risco aumentado dessa combinação de medicamentos [ver FARMACOLOGIA CLÍNICA ].
Casos de miopatia, incluindo rabdomiólise, foram relatados com fenofibratos coadministrados com colchicina, e deve-se ter cautela ao prescrever fenofibrato com colchicina [ver INTERAÇÕES MEDICAMENTOSAS ].
Creatinina sérica
Elevações na creatinina sérica foram relatadas em pacientes em uso de fenofibrato. Essas elevações tendem a retornar à linha de base após a descontinuação do fenofibrato. O significado clínico dessas observações é desconhecido. Monitorar a função renal em pacientes com insuficiência renal tomando TRICOR. O monitoramento renal também deve ser considerado para pacientes em uso de TRICOR em risco de insuficiência renal, como idosos e pacientes com diabetes.
Colelitíase
O fenofibrato, como o clofibrato e o gemfibrozil, pode aumentar a excreção de colesterol na bile, levando à colelitíase. Se houver suspeita de colelitíase, são indicados estudos da vesícula biliar. A terapia com TRICOR 160mg deve ser descontinuada se forem encontrados cálculos biliares.

Anticoagulantes cumarínicos
Deve-se ter cautela quando os anticoagulantes cumarínicos são administrados em conjunto com TRICOR 160mg devido à potencialização dos efeitos anticoagulantes do tipo cumarínico no prolongamento do Tempo de Protrombina/Relação Normalizada Internacional (PT/INR). Para prevenir complicações hemorrágicas, o monitoramento frequente de PT/INR e o ajuste da dose do anticoagulante são recomendados até que PT/INR tenha estabilizado [ver INTERAÇÕES MEDICAMENTOSAS ].
Pancreatite
Pancreatite foi relatada em pacientes tomando fenofibrato, gemfibrozil e clofibrato. Essa ocorrência pode representar uma falha de eficácia em pacientes com hipertrigliceridemia grave, um efeito direto da droga ou um fenômeno secundário mediado por cálculos no trato biliar ou formação de lodo com obstrução do ducto biliar comum.
Alterações hematológicas
Foram observadas diminuições leves a moderadas de hemoglobina, hematócrito e glóbulos brancos em pacientes após o início da terapia com fenofibrato. No entanto, estes níveis estabilizam durante a administração a longo prazo. Trombocitopenia e agranulocitose foram relatadas em indivíduos tratados com fenofibrato. Recomenda-se a monitorização periódica das contagens de glóbulos vermelhos e brancos durante os primeiros 12 meses de administração de TRICOR.
Reações de hipersensibilidade
Hipersensibilidade Aguda
Anafilaxia e angioedema foram relatados após a comercialização com fenofibrato. Em alguns casos, as reações foram potencialmente fatais e exigiram tratamento de emergência. Se um paciente desenvolver sinais ou sintomas de uma reação de hipersensibilidade aguda, aconselhe-o a procurar atendimento médico imediato e descontinuar o fenofibrato.
Hipersensibilidade Retardada
Reações adversas cutâneas graves (SCAR), incluindo síndrome de Stevens-Johnson, necrólise epidérmica tóxica e reação medicamentosa com eosinofilia e sintomas sistêmicos (DRESS), foram relatadas após a comercialização, ocorrendo dias a semanas após o início do fenofibrato. Os casos de DRESS foram associados a reações cutâneas (como erupção cutânea ou dermatite esfoliativa) e uma combinação de eosinofilia, febre, envolvimento de órgãos sistêmicos (renal, hepático ou respiratório). Interrompa o fenofibrato e trate os pacientes adequadamente se houver suspeita de SCAR.
Doença Venotromboembólica
No estudo FIELD, embolia pulmonar (EP) e trombose venosa profunda (TVP) foram observadas em taxas mais altas no grupo tratado com fenofibrato do que no grupo tratado com placebo. Dos 9.795 pacientes inscritos no FIELD, havia 4.900 no grupo placebo e 4.895 no grupo fenofibrato. Para TVP, houve 48 eventos (1%) no grupo placebo e 67 (1%) no grupo fenofibrato (p = 0,074); e para PE, houve 32 (0,7%) eventos no grupo placebo e 53 (1%) no grupo fenofibrato (p = 0,022).
No Coronary Drug Project, uma proporção maior do grupo clofibrato apresentou embolia pulmonar ou tromboflebite definitiva ou suspeita fatal ou não fatal do que o grupo placebo (5,2% vs. 3,3% em cinco anos; p
Diminuições paradoxais nos níveis de colesterol HDL
Houve relatos pós-comercialização e de ensaios clínicos de reduções graves nos níveis de colesterol HDL (tão baixos quanto 2 mg/dL) ocorrendo em pacientes diabéticos e não diabéticos iniciados em terapia com fibratos. A diminuição do HDL-C é espelhada por uma diminuição da apolipoproteína A1. Esta diminuição ocorreu dentro de 2 semanas a anos após o início da terapia com fibratos. Os níveis de HDL-C permanecem deprimidos até que a terapia com fibratos seja retirada; a resposta à retirada da terapia com fibratos é rápida e sustentada. O significado clínico desta diminuição do HDL-C é desconhecido. Recomenda-se que os níveis de HDL-C sejam verificados nos primeiros meses após o início da terapia com fibratos. Se for detectado um nível de HDL-C severamente deprimido, a terapia com fibrato deve ser retirada e o nível de HDL-C monitorado até que retorne à linha de base, e a terapia com fibrato não deve ser reiniciada.
Toxicologia não clínica
Carcinogênese e Mutagênese e Prejuízo da Fertilidade
Dois estudos de carcinogenicidade dietética foram realizados em ratos com fenofibrato. No primeiro estudo de 24 meses, ratos Wistar receberam doses de fenofibrato de 10, 45 e 200 mg/kg/dia, aproximadamente 0,3, 1 e 6 vezes a dose humana máxima recomendada (MRHD) de 300 mg de fenofibrato diariamente, equivalente a 145 mg TRICOR 160mg diariamente, com base em comparações da área de superfície corporal. Na dose de 200 mg/kg/dia (6 vezes a MRHD), a incidência de carcinomas hepáticos aumentou significativamente em ambos os sexos. Um aumento estatisticamente significativo de carcinomas pancreáticos foi observado em homens em 1 e 6 vezes a MRHD; um aumento de adenomas pancreáticos e tumores benignos de células intersticiais testiculares foi observado em 6 vezes a MRHD em homens. Em um segundo estudo de carcinogenicidade em ratos de 24 meses em uma cepa diferente de ratos (Sprague-Dawley), doses de 10 e 60 mg/kg/dia (0,3 e 2 vezes a MRHD) produziram aumentos significativos na incidência de adenomas acinares pancreáticos em ambos os sexos e aumentos de tumores de células intersticiais testiculares em homens em 2 vezes a MRHD.
Um estudo de carcinogenicidade de 117 semanas foi realizado em ratos comparando três drogas: fenofibrato 10 e 60 mg/kg/dia (0,3 e 2 vezes a MRHD, com base em comparações de área de superfície corporal), clofibrato (400 mg/kg/dia; 2 vezes a dose humana) e gemfibrozil (250 mg/kg/dia; 2 vezes a dose humana, com base em mg/m² de área de superfície). O fenofibrato aumentou os adenomas acinares pancreáticos em ambos os sexos. Clofibrato aumentou carcinoma hepatocelular e adenomas acinares pancreáticos em homens e nódulos neoplásicos hepáticos em mulheres. O gemfibrozil aumentou os nódulos neoplásicos hepáticos em homens e mulheres, enquanto as três drogas aumentaram os tumores de células intersticiais testiculares em homens.
Em um estudo de 21 meses em camundongos CF-1, fenofibrato 10, 45 e 200 mg/kg/dia (aproximadamente 0,2, 1 e 3 vezes a MRHD, com base em comparações de área de superfície corporal) aumentou significativamente os carcinomas hepáticos em ambos sexos em 3 vezes a MRHD. Em um segundo estudo de 18 meses com 10, 60 e 200 mg/kg/dia, o fenofibrato aumentou significativamente os carcinomas hepáticos em camundongos machos e adenomas hepáticos em camundongos fêmeas em 3 vezes a MRHD.
Estudos de microscopia eletrônica demonstraram proliferação peroxissomal após a administração de fenofibrato ao rato. Um estudo adequado para testar a proliferação de peroxissomos em humanos não foi feito, mas mudanças na morfologia e números dos peroxissomos foram observadas em humanos após o tratamento com outros membros da classe dos fibratos quando as biópsias hepáticas foram comparadas antes e após o tratamento no mesmo indivíduo.
fenofibrato demonstrou ser desprovido de potencial mutagênico nos seguintes testes: Ames, linfoma de camundongo, aberração cromossômica e síntese de DNA não programada em hepatócitos primários de rato.
Em estudos de fertilidade, os ratos receberam doses dietéticas orais de fenofibrato, os machos receberam 61 dias antes do acasalamento e as fêmeas 15 dias antes do acasalamento até o desmame, o que resultou em nenhum efeito adverso na fertilidade em doses de até 300 mg/kg/dia (10 vezes o MRHD, com base em comparações de área de superfície corporal).
Uso em populações específicas
Gravidez
Resumo do risco
Os dados limitados disponíveis sobre o uso de fenofibrato em mulheres grávidas são insuficientes para determinar um risco associado ao medicamento de defeitos congênitos maiores, aborto espontâneo ou desfechos maternos ou fetais adversos. Em estudos de reprodução em animais, nenhuma evidência de toxicidade embriofetal foi observada com a administração oral de fenofibrato em ratos e coelhos durante a organogênese em doses menores ou equivalentes à dose clínica máxima recomendada de 145 mg por dia, com base na área de superfície corporal (mg/ m²). Resultados reprodutivos adversos ocorreram em doses mais altas na presença de toxicidade materna (ver Dados ). TRICOR 200mg deve ser usado durante a gravidez somente se o benefício potencial justificar o risco potencial para o feto.
O risco de fundo estimado de defeitos congênitos graves e aborto espontâneo para a população indicada é desconhecido. Na população geral dos EUA, o risco de fundo estimado de defeitos congênitos graves e aborto espontâneo em gestações clinicamente reconhecidas é de 2-4% e 15-20%, respectivamente.
Dados
Dados de animais
Em ratas grávidas que receberam doses orais de 14, 127 e 361 mg/kg/dia do dia 6-15 da gestação durante o período de organogênese, não foram observados achados adversos de desenvolvimento com 14 mg/kg/dia (menos do que a exposição clínica na dose humana máxima recomendada [MRHD] de 300 mg de fenofibrato por dia, equivalente a 145 mg de TRICOR por dia, com base em comparações da área de superfície corporal). Malformações esqueléticas fetais aumentadas foram observadas em doses maternas tóxicas (361 mg/kg/dia, correspondendo a 12 vezes a exposição clínica na MRHD) que suprimiram significativamente o ganho de peso corporal materno.
Em coelhas grávidas que receberam doses orais de gavagem de 15, 150 e 300 mg/kg/dia a partir do 618º dia de gestação durante o período de organogênese e permitiram o parto, não foram observados achados adversos de desenvolvimento com 15 mg/kg/dia (uma dose que aproxima a exposição clínica no MRHD, com base em comparações da área de superfície corporal). Ninhadas abortadas foram observadas em doses maternas tóxicas (≥ 150 mg/kg/dia, correspondendo a ≥ 10 vezes a exposição clínica na MRHD) que suprimiu o ganho de peso corporal materno.
Em ratas grávidas que receberam doses orais de 15, 75 e 300 mg/kg/dia do 15º dia de gestação até o 21º dia de lactação (desmame), nenhum efeito adverso no desenvolvimento foi observado com 15 mg/kg/dia (menos do que a exposição clínica na MRHD, com base em comparações de área de superfície corporal), apesar da toxicidade materna (diminuição do ganho de peso). Perda pós-implantação foi observada em ≥ 75 mg/kg/dia (≥ 2 vezes a exposição clínica na MRHD) na presença de toxicidade materna (diminuição do ganho de peso). A diminuição da sobrevida dos filhotes foi observada em 300 mg/kg/dia (10 vezes a exposição clínica no MRHD), que foi associada à diminuição do ganho de peso corporal materno/negligência materna.
Lactação
Resumo do risco
Não há informações disponíveis sobre a presença de fenofibrato no leite humano, efeitos da droga no lactente ou efeitos na produção de leite. O fenofibrato está presente no leite de ratos e, portanto, é provável que esteja presente no leite humano. Devido ao potencial de reações adversas graves em bebês amamentados, como interrupção do metabolismo lipídico infantil, as mulheres não devem amamentar durante o tratamento com TRICOR 200 mg e por 5 dias após a dose final [ver CONTRA-INDICAÇÕES ].
Uso Pediátrico
A segurança e a eficácia não foram estabelecidas em pacientes pediátricos.
Uso Geriátrico
Sabe-se que o ácido fenofíbrico é substancialmente excretado pelos rins, e o risco de reações adversas a este medicamento pode ser maior em pacientes com função renal comprometida. A exposição ao ácido fenofíbrico não é influenciada pela idade. Uma vez que os pacientes idosos apresentam maior incidência de insuficiência renal, a seleção da dose para idosos deve ser feita com base na função renal [ver DOSAGEM E ADMINISTRAÇÃO e FARMACOLOGIA CLÍNICA ]. Pacientes idosos com função renal normal não devem necessitar de modificações de dose. Considere monitorar a função renal em pacientes idosos em uso de TRICOR.
Insuficiência renal
O uso de TRICOR 160mg deve ser evitado em pacientes com insuficiência renal grave [ver CONTRA-INDICAÇÕES ]. A redução da dose é necessária em pacientes com insuficiência renal leve a moderada [ver DOSAGEM E ADMINISTRAÇÃO e FARMACOLOGIA CLÍNICA ]. Recomenda-se a monitorização da função renal em doentes com insuficiência renal.
Insuficiência hepática
O uso de TRICOR 200mg não foi avaliado em indivíduos com insuficiência hepática [ver CONTRA-INDICAÇÕES e FARMACOLOGIA CLÍNICA ].
SOBREDOSAGEM
Não há tratamento específico para superdosagem com TRICOR. São indicados cuidados gerais de suporte ao doente, incluindo monitorização dos sinais vitais e observação do estado clínico, caso ocorra uma sobredosagem. Se indicado, a eliminação do fármaco não absorvido deve ser obtida por êmese ou lavagem gástrica; precauções usuais devem ser observadas para manter as vias aéreas. Como o ácido fenofíbrico é altamente ligado às proteínas plasmáticas, a hemodiálise não deve ser considerada.
CONTRA-INDICAÇÕES
TRICOR 200mg é contraindicado em:
- pacientes com insuficiência renal grave, incluindo aqueles em diálise [ver FARMACOLOGIA CLÍNICA ].
- pacientes com doença hepática ativa, incluindo aqueles com cirrose biliar primária e anormalidades persistentes inexplicáveis da função hepática [ver AVISOS E PRECAUÇÕES ].
- pacientes com doença da vesícula biliar preexistente [ver AVISOS E PRECAUÇÕES ].
- mães que amamentam [ver Uso em populações específicas ].
- pacientes com hipersensibilidade conhecida ao fenofibrato ou ácido fenofíbrico [ver AVISOS E PRECAUÇÕES ].
FARMACOLOGIA CLÍNICA
Mecanismo de ação
A parte ativa do TRICOR é o ácido fenofíbrico. Os efeitos farmacológicos do ácido fenofíbrico em animais e humanos foram extensivamente estudados através da administração oral de fenofibrato.
Os efeitos modificadores de lipídios do ácido fenofíbrico observados na prática clínica foram explicados in vivo em camundongos transgênicos e in vitro em culturas de hepatócitos humanos pela ativação do receptor α ativado por proliferador de peroxissoma (PPARα). Por esse mecanismo, o fenofibrato aumenta a lipólise e a eliminação de partículas ricas em triglicerídeos do plasma, ativando a lipoproteína lipase e reduzindo a produção de apoproteína C-III (um inibidor da atividade da lipoproteína lipase).
A diminuição resultante em TG produz uma alteração no tamanho e composição do LDL de partículas pequenas e densas (que são consideradas aterogênicas devido à sua suscetibilidade à oxidação) para grandes partículas flutuantes. Essas partículas maiores têm maior afinidade pelos receptores de colesterol e são catabolizadas rapidamente. A ativação do PPARα também induz um aumento na síntese das apolipoproteínas AI, A-II e HDL-colesterol.
fenofibrato também reduz os níveis séricos de ácido úrico em indivíduos hiperuricêmicos e normais, aumentando a excreção urinária de ácido úrico.
Farmacodinâmica
Vários estudos clínicos demonstraram que níveis elevados de C total, LDL-C e apo B, um complexo de membrana de LDL, estão associados à aterosclerose humana. Da mesma forma, níveis diminuídos de HDL-C e seu complexo de transporte, apolipoproteína A (apo AI e apo AII) estão associados ao desenvolvimento de aterosclerose. Investigações epidemiológicas estabeleceram que a morbimortalidade cardiovascular varia diretamente com o nível de C total, LDL-C e TG, e inversamente com o nível de HDL-C. O efeito independente da elevação do HDL-C ou da redução dos triglicerídeos (TG) sobre o risco de morbidade e mortalidade cardiovascular não foi determinado.
ácido fenofíbrico, o metabólito ativo do fenofibrato, produz reduções no colesterol total, colesterol LDL, apolipoproteína B, triglicerídeos totais e lipoproteína rica em triglicerídeos (VLDL) em pacientes tratados. Além disso, o tratamento com fenofibrato resulta em aumento da lipoproteína de alta densidade (HDL) e apolipoproteínas apoAI e apoAII.
Farmacocinética
As concentrações plasmáticas de ácido fenofíbrico após a administração de três comprimidos de 48 mg ou um de 145 mg são equivalentes sob condições de alimentação a uma cápsula de fenofibrato micronizado de 200 mg.
O fenofibrato é um pró-fármaco da fração química ativa ácido fenofíbrico. O fenofibrato é convertido por hidrólise de éster no corpo em ácido fenofíbrico, que é o constituinte ativo mensurável na circulação.
Absorção
biodisponibilidade absoluta do fenofibrato não pode ser determinada, pois o composto é praticamente insolúvel em meio aquoso adequado para injeção. No entanto, o fenofibrato é bem absorvido no trato gastrointestinal. Após administração oral em voluntários saudáveis, aproximadamente 60% de uma dose única de fenofibrato radiomarcado apareceu na urina, principalmente como ácido fenofíbrico e seu conjugado glucuronato, e 25% foi excretado nas fezes. Os níveis plasmáticos máximos de ácido fenofíbrico ocorrem dentro de 6 a 8 horas após a administração.
A exposição ao ácido fenofíbrico no plasma, medida pela Cmax e AUC, não é significativamente diferente quando uma dose única de 145 mg de fenofibrato é administrada em condições de jejum ou não.
Distribuição
Após doses múltiplas de fenofibrato, o estado de equilíbrio do ácido fenofíbrico é alcançado em 9 dias. As concentrações plasmáticas de ácido fenofíbrico no estado de equilíbrio são aproximadamente o dobro daquelas após uma dose única. A ligação às proteínas séricas foi de aproximadamente 99% em indivíduos normais e hiperlipidêmicos.
Metabolismo
Após administração oral, o fenofibrato é rapidamente hidrolisado por esterases no metabólito ativo, ácido fenofíbrico; nenhum fenofibrato inalterado é detectado no plasma.
O ácido fenofíbrico é primariamente conjugado com o ácido glicurônico e então excretado na urina. Uma pequena quantidade de ácido fenofíbrico é reduzida na porção carbonila a um metabólito benzidrol que é, por sua vez, conjugado com ácido glicurônico e excretado na urina.
Os dados de metabolismo in vivo indicam que nem o fenofibrato nem o ácido fenofíbrico sofrem metabolismo oxidativo (por exemplo, citocromo P450) de forma significativa.
Eliminação
Após absorção, o fenofibrato é excretado principalmente na urina na forma de metabólitos, principalmente ácido fenofíbrico e ácido fenofíbrico glicuronídeo. Após a administração de fenofibrato radiomarcado, aproximadamente 60% da dose apareceu na urina e 25% foi excretada nas fezes.
O ácido fenofíbrico é eliminado com meia-vida de 20 horas, permitindo a administração uma vez ao dia.
Populações Especiais
Geriatria
Em voluntários idosos de 77 a 87 anos de idade, a depuração oral do ácido fenofíbrico após uma dose oral única de fenofibrato foi de 1,2 L/h, comparada a 1,1 L/h em adultos jovens. Isso indica que um regime de dosagem semelhante pode ser usado em idosos com função renal normal, sem aumentar o acúmulo do fármaco ou metabólitos. DOSAGEM E ADMINISTRAÇÃO e Uso em populações específicas ].
Pediatria
A farmacocinética de TRICOR 160mg não foi estudada em populações pediátricas.
Gênero
Nenhuma diferença farmacocinética entre homens e mulheres foi observada para o fenofibrato.
Corrida
influência da raça na farmacocinética do fenofibrato não foi estudada, porém o fenofibrato não é metabolizado por enzimas conhecidas por apresentar variabilidade interétnica.
Insuficiência renal
A farmacocinética do ácido fenofíbrico foi examinada em pacientes com insuficiência renal leve, moderada e grave. Pacientes com insuficiência renal grave (taxa de filtração glomerular estimada [eGFR] DOSAGEM E ADMINISTRAÇÃO ].
Insuficiência hepática
Nenhum estudo farmacocinético foi realizado em pacientes com insuficiência hepática.
Interações medicamentosas
Estudos in vitro utilizando microssomas hepáticos humanos indicam que o fenofibrato e o ácido fenofíbrico não são inibidores das isoformas do citocromo (CYP) P450 CYP3A4, CYP2D6, CYP2E1 ou CYP1A2. São inibidores fracos de CYP2C8, CYP2C19 e CYP2A6 e inibidores leves a moderados de CYP2C9 em concentrações terapêuticas.
A Tabela 2 descreve os efeitos de drogas coadministradas na exposição sistêmica ao ácido fenofíbrico. A Tabela 3 descreve os efeitos do fenofibrato ou ácido fenofíbrico coadministrados em outras drogas.
Estudos clínicos
Hipercolesterolemia primária (familiar e não familiar heterozigótica) e dislipidemia mista
Os efeitos do fenofibrato em uma dose equivalente a 145 mg de TRICOR (comprimidos de fenofibrato) por dia foram avaliados a partir de quatro estudos randomizados, controlados por placebo, duplo-cegos, de grupos paralelos, incluindo pacientes com os seguintes valores médios de lipídios basais: total-C 306,9 mg/dL; LDL-C 213,8 mg/dL; HDL-C 52,3 mg/dL; e triglicéridos 191,0 mg/dL. A terapia com TRICOR 200mg reduziu o LDL-C, o C-Total e a relação LDL-C/HDL-C. A terapia com TRICOR também reduziu os triglicerídeos e aumentou o HDL-C (consulte a Tabela 4).
Em um subconjunto de indivíduos, foram realizadas medições de apo B. O tratamento com TRICOR 200mg reduziu significativamente a apo B da linha de base ao ponto final em comparação com placebo (-25,1% vs. 2,4%, p
Hipertrigliceridemia grave
Os efeitos do fenofibrato nos triglicerídeos séricos foram estudados em dois ensaios clínicos randomizados, duplo-cegos, controlados por placebo de 147 pacientes hipertrigliceridêmicos. Os pacientes foram tratados por oito semanas sob protocolos que diferiram apenas em que um paciente entrou com níveis basais de TG de 500 a 1500 mg/dL, e os demais níveis de TG de 350 a 500 mg/dL. Em pacientes com hipertrigliceridemia e colesterolemia normal com ou sem hiperquilomicronemia, o tratamento com fenofibrato em doses equivalentes a TRICOR 145 mg por dia diminuiu principalmente os triglicerídeos da lipoproteína de muito baixa densidade (VLDL) e o colesterol VLDL. O tratamento de pacientes com triglicerídeos elevados geralmente resulta em aumento do LDL-C (ver Tabela 5).
O efeito de TRICOR 160mg na morbidade e mortalidade cardiovascular não foi determinado.
INFORMAÇÃO DO PACIENTE
Os pacientes devem ser avisados:
- dos potenciais benefícios e riscos do TRICOR.
- não usar TRICOR se houver hipersensibilidade conhecida ao fenofibrato ou ao ácido fenofíbrico.
- de medicamentos que não devem ser tomados em combinação com TRICOR.
- que se estiverem tomando anticoagulantes cumarínicos, TRICOR 160mg pode aumentar seu efeito anticoagulante, e pode ser necessário aumentar o monitoramento.
- continuar a seguir uma dieta modificadora de lipídios adequada enquanto estiver tomando TRICOR.
- tomar TRICOR 160mg uma vez ao dia, independentemente da alimentação, na dose prescrita, engolindo cada comprimido inteiro.
- retornar ao consultório médico para acompanhamento de rotina.
- informar seu médico de todos os medicamentos, suplementos e preparações de ervas que está tomando e qualquer alteração em sua condição médica. Os pacientes também devem ser aconselhados a informar seus médicos que prescrevem um novo medicamento que estão tomando TRICOR.
- informar seu médico sobre sintomas de lesão hepática (por exemplo, icterícia, dor abdominal, náusea, mal-estar, urina escura, fezes anormais, prurido); qualquer dor muscular, sensibilidade ou fraqueza; ou quaisquer outros sintomas novos.
- não amamentar durante o tratamento com TRICOR e por 5 dias após a última dose.
