Tratamento de infecções bacterianas: Bactrim 400/80mg, 800/160mg Trimethoprim Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
Nome da marca: Bactrim
Nome genérico: Sulfametoxazol e Trimetoprim Injeção para Infusão Intravenosa
O que é Bactrim 800mg?
Bactrim (sulfametoxazol e trimetoprima) DS é uma combinação de dois antibióticos usados para tratar infecções do trato urinário, otite média aguda, bronquite, Shigelose, pneumonia por Pneumocystis, diarreia do viajante, Staphylococcus aureus resistente à meticilina (MRSA) e outras bactérias infecções susceptíveis a este antibiótico.
Quais são os efeitos colaterais do Bactrim?
Os efeitos colaterais comuns de Bactrim incluem:
- perda de apetite,
- náusea,
- vômito,
- língua dolorida ou inchada,
- tontura,
- sensação de giro,
- zumbido em seus ouvidos,
- cansaço, ou
- problemas de sono (insônia).
Informe o seu médico se tiver efeitos secundários graves de Bactrim 800mg, incluindo:
- hematomas ou sangramento,
- anemia aplástica,
- icterícia,
- necrose hepática,
- aftas,
- dores nas articulações,
- erupções cutâneas graves,
- coceira, e
- dor de garganta.
DESCRIÇÃO
injeção de BACTRIM™ (trimetoprim e sulfametoxazol), uma solução estéril apenas para infusão intravenosa, é uma combinação de sulfametoxazol, um antimicrobiano de sulfonamida, e trimetoprim, um antibacteriano inibidor da diidrofolato redutase. Cada 5 mL contém 80 mg de trimetoprima (16 mg/mL) e 400 mg de sulfametoxazol (80 mg/mL) compostos com 40% de propilenoglicol, 10% de álcool etílico e 0,3% de dietanolamina; Álcool benzílico a 1% e metabissulfito de sódio a 0,1% adicionados como conservantes, água para injeção e pH ajustado para aproximadamente 10 com hidróxido de sódio.
Trimetoprim é 2,4-diamino-5-(3,4,5-trimetoxibenzil)pirimidina. É um composto branco a amarelo claro, inodoro, amargo, com peso molecular de 290,3 e a seguinte fórmula estrutural:
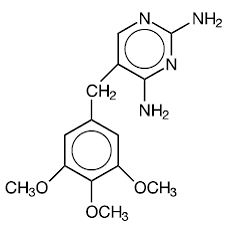
C14H18N4O3 MW 290,3
Sulfametoxazol é N1-(5-metil-3-isoxazolil)sulfanilamida. É um composto quase branco, inodoro e insípido com um peso molecular de 253,28 e a seguinte fórmula estrutural:
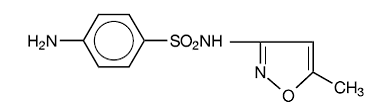
C10H11N3O3S MW 253,28
INDICAÇÕES
Pneumocystis jirovecii Pneumonia
BACTRIM é indicado no tratamento da pneumonia por Pneumocystis jirovecii em adultos e pacientes pediátricos com dois meses de idade ou mais.
Shigelose
BACTRIM 400mg é indicado no tratamento de enterite causada por cepas suscetíveis de Shigella flexneri e Shigella sonnei em adultos e pacientes pediátricos com dois meses de idade ou mais.
Infecções do trato urinário
BACTRIM é indicado no tratamento de infecções graves ou complicadas do trato urinário em adultos e pacientes pediátricos com dois meses de idade ou mais devido a cepas suscetíveis de Escherichia coli, espécies de Klebsiella, espécies de Enterobacter, Morganella morganii, Proteus mirabilis e Proteus vulgaris quando a administração oral de BACTRIM não é viável e quando o organismo não é suscetível a antibacterianos de agente único eficazes no trato urinário.
Uso
Para reduzir o desenvolvimento de bactérias resistentes aos medicamentos e manter a eficácia de BACTRIM e outros medicamentos antibacterianos, BACTRIM deve ser usado apenas para tratar ou prevenir infecções comprovadas ou fortemente suspeitas de serem causadas por bactérias suscetíveis. Quando as informações de cultura e suscetibilidade estiverem disponíveis, elas devem ser consideradas na seleção ou modificação da terapia antibacteriana. Na ausência de tais dados, a epidemiologia local e os padrões de suscetibilidade podem contribuir para a seleção empírica da terapia.
Embora estudos apropriados de cultura e suscetibilidade devam ser realizados, a terapia pode ser iniciada enquanto se aguarda os resultados desses estudos.
DOSAGEM E ADMINISTRAÇÃO
Dosagem em adultos e pacientes pediátricos (dois meses de idade ou mais)
A dose diária máxima recomendada é de 60 mL (960 mg de trimetoprima) por dia.
Modificações de dosagem em pacientes com função renal prejudicada
Quando a função renal está comprometida, deve-se utilizar uma dosagem reduzida, conforme mostrado na Tabela 2.
Instruções importantes de administração
Administrar a solução por infusão intravenosa durante um período de 60 a 90 minutos. Evitar a administração por infusão rápida ou injeção em bolus. NÃO administre BACTRIM 400mg por via intramuscular.
Inspecione visualmente os medicamentos parenterais quanto a partículas e descoloração antes da administração, sempre que a solução e o recipiente permitirem.
Método de preparação
Diluição de Frascos de Dose Única e Múltipla
BACTRIM deve ser diluído. Cada 5 mL deve ser adicionado a 125 mL de dextrose a 5% em água. Após diluir com 5% de dextrose em água, a solução não deve ser refrigerada e deve ser utilizada dentro de 6 horas.
Se for desejada uma diluição de 5 mL por 100 mL de dextrose a 5% em água, ela deve ser usada em até 4 horas. Nos casos em que a restrição de líquidos é desejável, cada 5 mL pode ser adicionado a 75 mL de dextrose a 5% em água. Nestas circunstâncias, a solução deve ser misturada imediatamente antes do uso e deve ser administrada dentro de 2 horas.
Se após inspeção visual houver turvação ou evidência de cristalização após a mistura, a solução deve ser descartada e uma nova solução preparada.
Fazer NÃO misture Bactrim em 5% de dextrose em água com drogas ou soluções no mesmo recipiente.
Frascos de Dose Múltipla (Manuseio)
Após a entrada inicial no frasco, o conteúdo restante deve ser usado dentro de 48 horas.
Sistemas de infusão para administração intravenosa
Os seguintes sistemas de infusão foram testados e considerados satisfatórios: recipientes de vidro de dose unitária; recipientes de policloreto de vinila e poliolefina de dose unitária. Nenhum outro sistema foi testado e, portanto, nenhum outro pode ser recomendado.
COMO FORNECIDO
Formas de dosagem e pontos fortes
BACTRIM está disponível como uma injeção contendo 80 mg/mL de sulfametoxazol e 16 mg/mL de trimetoprima em frascos de dose única de 10 mL e frascos de dose múltipla de 30 mL.
Armazenamento e manuseio
Injeção de BACTRIM™ (sulfametoxazol e trimetoprima) é fornecido da seguinte forma:
Frascos de 10 mL contendo 160 mg de trimetoprima (16 mg/mL) e 800 mg de sulfametoxazol (80 mg/mL) para infusão com dextrose a 5% em água.
Frasco de 10 mL: NDC Frasco 49708-001-4210 mL (Caixa com 10): NDC 49708-001-45
Frascos de dose múltipla de 30 mL , cada 5 mL contendo 80 mg de trimetoprima (16 mg/mL) e 400 mg de sulfametoxazol (80 mg/mL) para infusão com dextrose a 5% em água.
Frasco de 30 mL (Caixa de 1): NDC 49708-002-47
Armazenar à temperatura ambiente (15°C – 30°C ou 59°F – 86°F). NÃO REFRIGERE.
REFERÊNCIAS
1. Winston DJ, Lau WK, Gale RP, Young LS. Trimetoprim-sulfametoxazol para o tratamento da pneumonia por Pneumocystis carinii. Ann Intern Med. Junho de 1980; 92:762-769.
Distribuído por: Sun Pharmaceutical Industries, Inc. Cranbury, NJ 08512. Revisado: julho de 2020
EFEITOS COLATERAIS
As seguintes reações adversas graves são descritas em outras partes da bula:
- Toxicidade embriofetal [ver AVISOS E PRECAUÇÕES ]
- Hipersensibilidade e outras reações fatais [ver AVISOS E PRECAUÇÕES ]
- Trombocitopenia [ver AVISOS E PRECAUÇÕES ]
- Diarreia Associada a Clostridioides difficile [ver AVISOS E PRECAUÇÕES ]
- Sensibilidade ao Sulfito [ver AVISOS E PRECAUÇÕES ]
- Risco associado ao uso concomitante de leucovorina para pneumonia por Pneumocystis jirovecii [ver AVISOS E PRECAUÇÕES ]
- Toxicidade do propilenoglicol [ver AVISOS E PRECAUÇÕES , REAÇÕES ADVERSAS ]
- Reações à infusão [ver AVISOS E PRECAUÇÕES ]
- Hipoglicemia [ver AVISOS E PRECAUÇÕES ]
- Anormalidades eletrolíticas [ver AVISOS E PRECAUÇÕES ]
Experiência de Ensaios Clínicos
Como os ensaios clínicos são conduzidos em condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparadas às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
As reações adversas mais comuns são distúrbios gastrointestinais (náuseas, vômitos e anorexia) e reações alérgicas na pele (como erupção cutânea e urticária).
Reação local, dor e leve irritação na administração intravenosa (IV) são infrequentes. Tromboflebite foi observada.
Experiência pós-marketing
As seguintes reações adversas foram identificadas durante o uso pós-aprovação de BACTRIM. Como essas reações foram relatadas voluntariamente por uma população de tamanho incerto, não é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento:
- Púrpura Trombocitopenia Trombótica
- Púrpura trombocitopênica idiopática
- Prolongamento do intervalo QT resultando em taquicardia ventricular e torsade de pointes
- Acidose metabólica
INTERAÇÕES MEDICAMENTOSAS
Potencial para BACTRIM 400mg para afetar outras drogas
A trimetoprima é um inibidor do transportador CYP2C8 e OCT2. O sulfametoxazol é um inibidor do CYP2C9. Evitar a coadministração de BACTRIM 80mg com medicamentos que sejam substratos de CYP2C8 e 2C9 ou OCT2.
Interações com testes laboratoriais ou diagnósticos
BACTRIM, especificamente o componente trimetoprim, pode interferir com um ensaio de metotrexato sérico determinado pela técnica de proteína de ligação competitiva (CBPA) quando uma diidrofolato redutase bacteriana é usada como proteína de ligação. Nenhuma interferência ocorre, no entanto, se o metotrexato for medido por um radioimunoensaio (RIA).
A presença de BACTRIM também pode interferir no ensaio de reação do picrato alcalino de Jaffe para creatinina, resultando em superestimativas de cerca de 10% na faixa de valores normais.
REFERÊNCIAS
2. Al-Khatib SM, LaPointe N, Kramer JM, Califf RM. O que os médicos devem saber sobre o intervalo QT. JAMA. 2003;289(16):2120-2127.
3. Boyer EW, Stork C, Wang RY. Revisão: A Farmacologia e Toxicologia da Dofetilide. Int J Med Toxicol. 2001;4(2):16.
5. Londres NJ, Garg SJ, Moorthy RS, Cunningham ET. Uveíte induzida por drogas. J Oftálmico Inflamm Infect. 2013;3:43.
6. Marinella MA. Hipercalemia induzida por trimetoprima: Uma análise de casos relatados. Gerontol. 1999;45:209- 212.
7. Margassery S, Bastani B. Hipercalemia com risco de vida e acidose secundária ao tratamento com trimetoprimsulfametoxazol. J. Nephrol. 2001;14(5):410-414.
8. Moh R, et ai. Alterações hematológicas em adultos recebendo um regime HAART contendo zidovudina em combinação com cotrimoxazol na Costa do Marfim. Antivir Ther. 2005;10(5):615-24.
9. Kosoglou T, Rocci ML Jr, Vlasses PH. A trimetoprima altera a disposição da procainamida e da Nacetilprocainamida. Clin Pharmacol Ther. Out 1988;44(4):467-77.
AVISOS
Incluído como parte do PRECAUÇÕES seção.
PRECAUÇÕES
Toxicidade Embrio-Fetal
Alguns estudos epidemiológicos sugerem que a exposição ao BACTRIM durante a gravidez pode estar associada a um risco aumentado de malformações congênitas, particularmente defeitos do tubo neural, malformações cardiovasculares, defeitos do trato urinário, fissuras orais e pé torto. Se BACTRIM 400mg for usado durante a gravidez, ou se a paciente engravidar enquanto estiver tomando este medicamento, a paciente deve ser avisada sobre os riscos potenciais para o feto [ver Uso em populações específicas ].
Hipersensibilidade e outras reações fatais
Fatalidades associadas à administração de sulfonamidas ocorreram devido a reações graves, incluindo síndrome de Stevens-Johnson, necrólise epidérmica tóxica, necrose hepática fulminante, agranulocitose, anemia aplástica e outras discrasias sanguíneas.
As sulfonamidas, incluindo produtos contendo sulfonamidas, como BACTRIM, devem ser descontinuadas ao primeiro aparecimento de erupção cutânea ou qualquer sinal de reação adversa. Sinais clínicos, como erupção cutânea, dor de garganta, febre, artralgia, tosse, falta de ar, palidez, púrpura ou icterícia podem ser indicações precoces de reações graves. Uma erupção cutânea pode ser seguida de reações mais graves, como síndrome de Stevens-Johnson, necrólise epidérmica tóxica, necrose hepática ou distúrbios graves do sangue. Hemogramas completos devem ser feitos frequentemente em pacientes recebendo sulfonamidas. Tosse, falta de ar e infiltrados pulmonares são reações de hipersensibilidade do trato respiratório que foram relatadas em associação com o tratamento com sulfonamidas.
Trombocitopenia
trombocitopenia induzida por BACTRIM pode ser um distúrbio imunomediado. Casos graves de trombocitopenia que são fatais ou com risco de vida foram relatados. Monitorar os pacientes quanto à toxicidade hematológica. A trombocitopenia geralmente desaparece dentro de uma semana após a descontinuação de BACTRIM.
Infecções estreptocócicas e febre reumática
Evitar o uso de BACTRIM no tratamento da faringite estreptocócica. Estudos clínicos documentaram que pacientes com tonsilofaringite estreptocócica β-hemolítica do grupo A têm maior incidência de falha bacteriológica quando tratados com BACTRIM 800mg do que aqueles pacientes tratados com penicilina, como evidenciado pela falha na erradicação deste organismo da área tonsilofaríngea. Portanto, BACTRIM não prevenirá sequelas como a febre reumática.
Diarreia Associada a Clostridioides Difficile
Diarreia associada ao Clostridioides difficile (CDAD) foi relatada com o uso de quase todos os agentes antibacterianos, incluindo BACTRIM 80mg, e pode variar em gravidade de diarreia leve a colite fatal. O tratamento com agentes antibacterianos altera a flora normal do cólon levando ao crescimento excessivo de C. difficile.
C. difficile produz toxinas A e B que contribuem para o desenvolvimento de CDAD. Cepas produtoras de hipertoxina de C. difficile causam aumento da morbidade e mortalidade, pois essas infecções podem ser refratárias à terapia antimicrobiana e podem exigir colectomia. CDAD deve ser considerado em todos os pacientes que apresentam diarreia após o uso de antibacterianos. É necessário um histórico médico cuidadoso, pois foi relatado que a CDAD ocorre mais de dois meses após a administração de agentes antibacterianos.
Se houver suspeita ou confirmação de CDAD, o uso contínuo de antibacterianos não direcionados contra C. difficile pode precisar ser descontinuado. Gerenciamento adequado de fluidos e eletrólitos, suplementação de proteínas, tratamento antibacteriano de
C. difficile, devendo ser instituída avaliação cirúrgica conforme indicação clínica.
Sensibilidade ao Sulfito
BACTRIM 400mg contém metabissulfito de sódio, um sulfito que pode causar reações do tipo alérgico, incluindo sintomas anafiláticos e episódios asmáticos com risco de vida ou menos graves em certas pessoas suscetíveis. A prevalência geral de sensibilidade ao sulfito na população em geral é desconhecida. A sensibilidade ao sulfito é vista com mais frequência em asmáticos do que em não asmáticos.
Toxicidade do álcool benzílico em pacientes pediátricos (“Síndrome de Gasping”)
BACTRIM 160mg contém álcool benzílico como conservante. Reações adversas graves e fatais, incluindo “síndrome de gasping”, podem ocorrer em recém-nascidos e bebês com baixo peso ao nascer tratados com formulações conservadas em álcool benzílico em soluções de infusão, incluindo BACTRIM. A “síndrome de gasping” é caracterizada por depressão do sistema nervoso central, acidose metabólica e respiração ofegante. BACTRIM 160mg é contraindicado em pacientes pediátricos com menos de dois meses de idade [ver CONTRA-INDICAÇÕES ].
Ao prescrever BACTRIM 400mg em pacientes pediátricos (dois meses de idade ou mais), considere a carga metabólica diária combinada de álcool benzílico de todas as fontes, incluindo BACTRIM (contém 10 mg de álcool benzílico por mL) e outros medicamentos contendo álcool benzílico. A quantidade mínima de álcool benzílico na qual podem ocorrer reações adversas graves não é conhecida [ver Uso em populações específicas ].
Risco associado ao uso concomitante de leucovorina para pneumonia por Pneumocystis jirovecii
Falha no tratamento e mortalidade excessiva foram observadas quando BACTRIM foi usado concomitantemente com leucovorina para o tratamento de pacientes HIV positivos com pneumonia por Pneumocystis jirovecii em um estudo randomizado controlado por placebo.4 Evite a coadministração de BACTRIM e leucovorina durante o tratamento de pneumonia por Pneumocystis jirovecii.
Toxicidade do propilenoglicol
BACTRIM contém propilenoglicol como solvente (40% v/v). Quando administrado em doses elevadas como para o tratamento da pneumonia por P. jirovecii e concomitantemente com outros produtos que contenham propilenoglicol, pode ocorrer hiperosmolaridade com acidose metabólica com hiato aniónico, incluindo acidose láctica. A toxicidade do propilenoglicol pode levar a lesão renal aguda, toxicidade do SNC e falência de múltiplos órgãos. Monitorar a ingestão diária total de propilenoglicol de todas as fontes e distúrbios ácido-base. Descontinuar BACTRIM 400mg se houver suspeita de toxicidade do propilenoglicol [ver REAÇÕES ADVERSAS ].
Deficiência de folato
Evitar o uso de BACTRIM 160mg em pacientes com função renal ou hepática comprometida, naqueles com possível deficiência de folato (p. alergias ou asma brônquica.
Alterações hematológicas indicativas de deficiência de ácido fólico podem ocorrer em pacientes idosos ou em pacientes com deficiência de ácido fólico preexistente ou insuficiência renal. Esses efeitos são reversíveis pela terapia com ácido folínico [ver Uso em populações específicas ].
Hemólise
Em indivíduos com deficiência de glicose-6-fosfato desidrogenase, pode ocorrer hemólise. Esta reação é frequentemente relacionada com a dose.
Reações de infusão
Irritação local e inflamação devido à infiltração extravascular da infusão foram observadas com BACTRIM. Se isso ocorrer, a infusão deve ser descontinuada e reiniciada em outro local.
Hipoglicemia
Foram observados casos de hipoglicemia em pacientes não diabéticos tratados com BACTRIM 400mg, ocorrendo geralmente após alguns dias de terapia. Pacientes com disfunção renal, doença hepática, desnutrição ou aqueles que recebem altas doses de BACTRIM 800mg estão particularmente em risco.
Metabolismo da Fenilalanina Prejudicado
Trimetoprim, componente de BACTRIM, foi observado para prejudicar o metabolismo da fenilalanina, mas isso não é significativo em pacientes fenilcetonúricos com restrição dietética adequada.
Porfiria e hipotireoidismo
Como outros medicamentos contendo sulfonamidas, BACTRIM pode precipitar crises de porfiria e hipotireoidismo. Evitar o uso de BACTRIM em pacientes com porfiria ou disfunção tireoidiana.
Risco Potencial no Tratamento da Pneumonia por Pneumocystis jirovecii em Pacientes com Síndrome da Imunodeficiência Adquirida (AIDS)
Pacientes com AIDS podem não tolerar ou responder ao BACTRIM da mesma maneira que pacientes sem AIDS. A incidência de reações adversas, particularmente erupções cutâneas, febre, leucopenia e valores elevados de aminotransferase (transaminase), com a terapia com BACTRIM em pacientes com AIDS que estão sendo tratados para pneumonia por Pneumocystis jirovecii tem sido relatada como muito aumentada em comparação com a incidência normalmente associada à uso de BACTRIM 800mg em pacientes não-AIDS. Se um paciente desenvolver erupção cutânea ou qualquer sinal de reação adversa, reavaliar a terapia com BACTRIM [ver AVISOS E PRECAUÇÕES ].
Evitar a coadministração de BACTRIM 80mg e leucovorina durante o tratamento da pneumonia por Pneumocystis jirovecii [ver AVISOS E PRECAUÇÕES ].
Anormalidades eletrolíticas
alta dosagem de trimetoprima, como usada em pacientes com pneumonia por P. jirovecii, induz um aumento progressivo, mas reversível, das concentrações séricas de potássio em um número substancial de pacientes. Mesmo o tratamento com as doses recomendadas pode causar hipercalemia quando o trimetoprim é administrado a pacientes com distúrbios subjacentes do metabolismo do potássio, com insuficiência renal, ou se medicamentos conhecidos por induzir hipercalemia são administrados concomitantemente. É necessária uma monitorização cuidadosa do potássio sérico nestes doentes.
Hiponatremia grave e sintomática pode ocorrer em pacientes recebendo BACTRIM 800mg, particularmente para o tratamento de pneumonia por P. jirovecii. A avaliação da hiponatremia e a correção adequada são necessárias em pacientes sintomáticos para evitar complicações com risco de vida.
Durante o tratamento, garantir a ingestão adequada de líquidos e débito urinário para prevenir a cristalúria. Pacientes que são “acetiladores lentos” podem ser mais propensos a reações idiossincráticas às sulfonamidas.
Monitoramento de exames laboratoriais
Hemogramas completos devem ser feitos com frequência em pacientes recebendo BACTRIM. Descontinuar BACTRIM 800mg se for observada uma redução significativa na contagem de qualquer elemento sanguíneo formado. Realize análises de urina com exame microscópico cuidadoso e testes de função renal durante a terapia, particularmente para aqueles pacientes com função renal comprometida.
Desenvolvimento de bactérias resistentes a drogas
A prescrição de BACTRIM na ausência de uma infecção bacteriana comprovada ou fortemente suspeita ou de uma indicação profilática provavelmente não trará benefícios ao paciente e aumenta o risco de desenvolvimento de bactérias resistentes aos medicamentos.
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Carcinogênese
O sulfametoxazol não foi carcinogênico quando avaliado em um estudo de 26 semanas em camundongos tumorigênicos (Tg-rasH2) com doses de até 400 mg/kg/dia de sulfametoxazol; equivalente a 2 vezes a exposição sistêmica humana (na dose diária de 800 mg de sulfametoxazol duas vezes ao dia).
Mutagênese
Testes bacterianos de mutação reversa in vitro de acordo com o protocolo padrão não foram realizados com sulfametoxazol e trimetoprima em combinação. Um teste de aberração cromossômica in vitro em linfócitos humanos com sulfametoxazol/trimetoprim foi negativo. Em testes in vitro e in vivo em espécies animais, o sulfametoxazol/trimetoprim não danificou os cromossomos. Os ensaios de micronúcleo in vivo foram positivos após a administração oral de sulfametoxazol/trimetoprim. Observações de leucócitos obtidos de pacientes tratados com sulfametoxazol e trimetoprima não revelaram anormalidades cromossômicas.
Sulfametoxazol sozinho foi positivo em um ensaio bacteriano de mutação reversa in vitro e em ensaios de micronúcleo in vitro usando linfócitos humanos cultivados.
Trimetoprim sozinho foi negativo em ensaios bacterianos de mutação reversa in vitro e em ensaios de aberração cromossômica in vitro com células de ovário ou pulmão de hamster chinês com ou sem ativação S9. Em ensaios in vitro cometa, micronúcleo e danos cromossômicos usando linfócitos humanos cultivados, o trimetoprima foi positivo. Em camundongos após a administração oral de trimetoprima, não foi registrado nenhum dano ao DNA em ensaios cometa de fígado, rim, pulmão, baço ou medula óssea.
Prejuízo da Fertilidade
Não foram observados efeitos adversos na fertilidade ou no desempenho reprodutivo geral em ratos que receberam doses orais de até 350 mg/kg/dia de sulfametoxazol mais 70 mg/kg/dia de trimetoprima, doses aproximadamente duas vezes a dose diária humana recomendada com base na área de superfície corporal .
Uso em populações específicas
Gravidez
Resumo do risco
BACTRIM pode causar danos ao feto se administrado a uma mulher grávida. Alguns estudos epidemiológicos sugerem que a exposição a BACTRIM 400mg durante a gravidez pode estar associada a um risco aumentado de malformações congênitas, particularmente defeitos do tubo neural, anormalidades cardiovasculares, defeitos do trato urinário, fissuras orais e pé torto (ver Dados humanos ).
Um dos 3 estudos em ratos mostrou fenda palatina em doses aproximadamente 5 vezes a dose humana recomendada com base na área de superfície corporal; os outros 2 estudos não mostraram teratogenicidade em doses semelhantes. Estudos em coelhas grávidas mostraram aumento da perda fetal em aproximadamente 6 vezes a dose humana com base na área de superfície corporal (ver Dados de animais ).
risco de fundo estimado de grandes defeitos congênitos e abortos para a população indicada é desconhecido. Na população geral dos EUA, o risco de fundo estimado de defeitos congênitos graves e aborto espontâneo em gestações clinicamente reconhecidas é de 2% a 4% e 15% a 20%, respectivamente. Aconselhe as mulheres grávidas sobre os potenciais danos de BACTRIM 400mg para o feto (ver Considerações Clínicas ).
Considerações Clínicas
Risco Materno e/ou Embrião/Fetal Associado à Doença
A infecção do trato urinário na gravidez está associada a desfechos perinatais adversos, como parto prematuro, baixo peso ao nascer e pré-eclâmpsia, e aumento da mortalidade para a gestante. A pneumonia por P. jirovecii na gravidez está associada ao parto prematuro e aumento da morbimortalidade da gestante. BACTRIM deve ser usado durante a gravidez somente se o benefício potencial justificar o risco potencial para o feto.
Dados
Dados humanos
Embora não existam grandes estudos prospectivos e bem controlados em mulheres grávidas e seus bebês, alguns estudos epidemiológicos retrospectivos sugerem uma associação entre a exposição ao BACTRIM 80mg no primeiro trimestre com um risco aumentado de malformações congênitas, particularmente defeitos do tubo neural, anormalidades cardiovasculares, defeitos do trato, fissuras orais e pé torto. Esses estudos, no entanto, foram limitados pelo pequeno número de casos expostos e pela falta de ajuste para múltiplas comparações estatísticas e fatores de confusão. Esses estudos são ainda mais limitados por vieses de recordação, seleção e informação, e pela generalização limitada de seus achados. Por fim, as medidas de resultados variaram entre os estudos, limitando as comparações entre estudos. Alternativamente, outros estudos epidemiológicos não detectaram associações estatisticamente significativas entre a exposição de BACTRIM 160mg e malformações específicas. Brumfitt e Pursell,10 em um estudo retrospectivo, relataram o desfecho de 186 gestações durante as quais a mãe recebeu placebo ou trimetoprima oral e sulfametoxazol. A incidência de anomalias congênitas foi de 4,5% (3 de 66) naqueles que receberam placebo e 3,3% (4 de 120) naqueles que receberam trimetoprima e sulfametoxazol. Não houve anormalidades nas 10 crianças cujas mães receberam a droga durante o primeiro trimestre. Em uma pesquisa separada, Brumfitt e Pursell também não encontraram anormalidades congênitas em 35 crianças cujas mães receberam trimetoprima e sulfametoxazol por via oral no momento da concepção ou logo após.
Dados de animais
Em ratos, doses orais de 533 mg/kg de sulfametoxazol ou 200 mg/kg de trimetoprima produziram efeitos teratológicos manifestados principalmente como fenda palatina. Estas doses são aproximadamente 5 e 6 vezes a dose diária total humana recomendada com base na área de superfície corporal. Em dois estudos em ratos, não foi observada teratologia quando 512 mg/kg de sulfametoxazol foi usado em combinação com 128 mg/kg de trimetoprima. Em alguns estudos em coelhos, um aumento geral na perda fetal (conceitos mortos e reabsorvidos) foi associado a doses de trimetoprima 6 vezes a dose terapêutica humana com base na área de superfície corporal.
Lactação
Resumo do risco
Os níveis de BACTRIM no leite materno são de aproximadamente 2 a 5% da dose diária recomendada para pacientes pediátricos com mais de dois meses de idade. Não há informações sobre o efeito de BACTRIM no lactente ou o efeito sobre a produção de leite. Devido ao risco potencial de deslocamento de bilirrubina e kernicterus na criança amamentada [ver CONTRA-INDICAÇÕES ], aconselham as mulheres a evitar a amamentação durante o tratamento com BACTRIM.
Uso Pediátrico
BACTRIM é contraindicado em pacientes pediátricos com menos de dois meses de idade devido ao risco potencial de deslocamento de bilirrubina e kernicterus [ver CONTRA-INDICAÇÕES ].
Reações adversas graves, incluindo reações fatais e a “síndrome de gasping”, ocorreram em recém-nascidos prematuros e recém-nascidos de baixo peso na unidade de terapia intensiva neonatal que receberam álcool benzílico como conservante em soluções de infusão. Nesses casos, doses de álcool benzílico de 99 a 234 mg/kg/dia produziram altos níveis de álcool benzílico e seus metabólitos no sangue e na urina (os níveis sanguíneos de álcool benzílico foram de 0,61 a 1,378 mmol/L). As reações adversas adicionais incluíram deterioração neurológica gradual, convulsões, hemorragia intracraniana, anormalidades hematológicas, ruptura da pele, insuficiência hepática e renal, hipotensão, bradicardia e colapso cardiovascular. Bebês prematuros com baixo peso ao nascer podem ter maior probabilidade de desenvolver essas reações porque podem ser menos capazes de metabolizar o álcool benzílico.
Ao prescrever BACTRIM 800mg em pacientes pediátricos, considere a carga metabólica diária combinada de álcool benzílico de todas as fontes, incluindo BACTRIM (BACTRIM 160mg contém 10 mg de álcool benzílico por mL) e outros medicamentos contendo álcool benzílico. A quantidade mínima de álcool benzílico na qual podem ocorrer reações adversas graves não é conhecida [ver AVISOS E PRECAUÇÕES ].
Uso Geriátrico
Os estudos clínicos de BACTRIM não incluíram um número suficiente de indivíduos com 65 anos ou mais para determinar se eles respondem de forma diferente dos indivíduos mais jovens.
Pode haver um risco aumentado de reações adversas graves em pacientes idosos, particularmente quando existem condições complicadas, por exemplo, função renal e/ou hepática prejudicada ou uso concomitante de outros medicamentos. Reações cutâneas graves, supressão generalizada da medula óssea [ver AVISOS E PRECAUÇÕES , REAÇÕES ADVERSAS ], uma diminuição específica das plaquetas (com ou sem púrpura) e hipercalemia são as reações adversas graves mais frequentemente relatadas em pacientes idosos.
Naqueles que receberam concomitantemente certos diuréticos, principalmente tiazidas, foi relatada uma incidência aumentada de trombocitopenia com púrpura. O aumento dos níveis sanguíneos de digoxina pode ocorrer com a terapia concomitante com BACTRIM 80mg, especialmente em pacientes idosos. Os níveis séricos de digoxina devem ser monitorados [ver INTERAÇÕES MEDICAMENTOSAS ].
Alterações hematológicas indicativas de deficiência de ácido fólico podem ocorrer em pacientes idosos. Esses efeitos são reversíveis pela terapia com ácido folínico. Ajustes de dose apropriados devem ser feitos para pacientes com função renal comprometida e a duração do uso deve ser a mais curta possível para minimizar os riscos de reações indesejadas [ver DOSAGEM E ADMINISTRAÇÃO ].
componente trimetoprima de BACTRIM pode causar hipercalemia quando administrado a pacientes com distúrbios subjacentes do metabolismo do potássio, com insuficiência renal ou quando administrado concomitantemente com medicamentos conhecidos por induzir hipercalemia, como inibidores da enzima de conversão da angiotensina. É necessária uma monitorização cuidadosa do potássio sérico nestes doentes. Recomenda-se a descontinuação do tratamento com BACTRIM 160mg para ajudar a diminuir os níveis séricos de potássio.
Os parâmetros farmacocinéticos do sulfametoxazol foram semelhantes para indivíduos geriátricos e adultos mais jovens. A concentração sérica máxima média de trimetoprima foi maior e a depuração renal média de trimetoprima foi menor em indivíduos geriátricos em comparação com indivíduos mais jovens [ver FARMACOLOGIA CLÍNICA ].
REFERÊNCIAS
4. Safrin S, Lee BL, Sande MA. O ácido folínico adjuvante com sulfametoxazol-trimetoprim para pneumonia por Pneumocystis carinii em pacientes com AIDS está associado a um risco aumentado de falha terapêutica e morte. J Infect Dis. Out 1994;170(4):912-7.
10. Brumfitt W, Pursell R. Trimetoprima/Sulfametoxazol no Tratamento de Bacteriúria em Mulheres. J Infect Dis. Nov 1973; 128 (Fornecido): S657-S663.
SOBREDOSAGEM
Agudo
Uma vez que não existe experiência extensa em humanos com doses únicas de BACTRIM 160 mg superiores a 25 mL (400 mg de trimetoprima e 2000 mg de sulfametoxazol), a dose máxima tolerada em humanos é desconhecida.
Os sinais e sintomas de superdosagem relatados com sulfonamidas incluem anorexia, cólica, náusea, vômito, tontura, dor de cabeça, sonolência e inconsciência. Pirexia, hematúria e cristalúria podem ser observadas. Discrasias sanguíneas e icterícia são manifestações tardias potenciais de superdosagem.
Os sinais de sobredosagem aguda com trimetoprima incluem náuseas, vómitos, tonturas, cefaleias, depressão mental, confusão e depressão da medula óssea.
Os princípios gerais de tratamento incluem a administração de fluidos intravenosos se o débito urinário for baixo e a função renal estiver normal. A acidificação da urina aumentará a eliminação renal de trimetoprima. O paciente deve ser monitorado com hemogramas e análises químicas sanguíneas apropriadas, incluindo eletrólitos. Se ocorrer discrasia sanguínea significativa ou icterícia, deve ser instituída terapia específica para essas complicações. A diálise peritoneal não é eficaz e a hemodiálise é apenas moderadamente eficaz na eliminação do trimetoprim e do sulfametoxazol.
Crônica
O uso de BACTRIM 800mg em altas doses e/ou por longos períodos de tempo pode causar depressão da medula óssea manifestada como trombocitopenia, leucopenia e/ou anemia megaloblástica. Se ocorrerem sinais de depressão da medula óssea, o paciente deve receber leucovorina 5 a 15 mg diariamente até que a hematopoiese normal seja restaurada.
CONTRA-INDICAÇÕES
BACTRIM é contraindicado nos seguintes casos:
- Hipersensibilidade conhecida ao trimetoprim ou sulfonamidas [ver AVISOS E PRECAUÇÕES ]
- História de trombocitopenia imune induzida por drogas com uso de trimetoprima e/ou sulfonamidas [ver AVISOS E PRECAUÇÕES ]
- Pacientes com anemia megaloblástica documentada devido à deficiência de folato [ver AVISOS E PRECAUÇÕES ]
- Pacientes pediátricos com menos de dois meses de idade [ver Uso em populações específicas ]
- Dano hepático acentuado [ver AVISOS E PRECAUÇÕES ]
- Insuficiência renal grave quando o estado da função renal não pode ser monitorado [ver AVISOS E PRECAUÇÕES ]
- Administração concomitante com dofetilida2,3 [ver INTERAÇÕES MEDICAMENTOSAS ]
REFERÊNCIAS
2. Al-Khatib SM, LaPointe N, Kramer JM, Califf RM. O que os médicos devem saber sobre o intervalo QT. JAMA. 2003;289(16):2120-2127.
3. Boyer EW, Stork C, Wang RY. Revisão: A Farmacologia e Toxicologia da Dofetilide. Int J Med Toxicol. 2001;4(2):16.
FARMACOLOGIA CLÍNICA
Mecanismo de ação
BACTRIM é um medicamento antimicrobiano [ver Microbiologia ].
Farmacocinética
Após uma infusão intravenosa de 1 hora de uma dose única de 160 mg de trimetoprima e 800 mg de sulfametoxazol em 11 pacientes cujo peso variou de 105 libras a 165 libras (média de 143 libras), as concentrações plasmáticas máximas de trimetoprima e sulfametoxazol foram 3,4 ± 0,3 μg/mL e 46,3 ± 2,7 μg/mL, respectivamente. Após administração intravenosa repetida da mesma dose em intervalos de 8 horas, as concentrações plasmáticas médias imediatamente antes e imediatamente após cada infusão no estado de equilíbrio foram 5,6 ± 0,6 μg/mL e 8,8 ± 0,9 μg/mL para trimetoprima e 70,6 ± 7,3 μg /mL e 105,6 ± 10,9 μg/mL para sulfametoxazol. A meia-vida plasmática média foi de 11,3 ± 0,7 horas para trimetoprima e 12,8 ± 1,8 horas para sulfametoxazol. Todos esses 11 pacientes tinham função renal normal e suas idades variaram de 17 a 78 anos (mediana, 60 anos).11
Estudos farmacocinéticos em crianças e adultos sugerem uma meia-vida de trimetoprima dependente da idade, conforme indicado na Tabela 5.12
Pacientes com função renal gravemente comprometida apresentam um aumento nas meias-vidas de ambos os componentes, exigindo ajuste do regime de dosagem [ver DOSAGEM E ADMINISTRAÇÃO ].
Distribuição
Tanto o trimetoprima quanto o sulfametoxazol existem no sangue como formas não ligadas, ligadas a proteínas e metabolizadas; sulfametoxazol também existe na forma conjugada.
Aproximadamente 44% do trimetoprima e 70% do sulfametoxazol estão ligados às proteínas plasmáticas. A presença de 10 mg por cento de sulfametoxazol no plasma diminui a ligação proteica do trimetoprim em um grau insignificante; trimetoprima não influencia a ligação do sulfametoxazol às proteínas.
Tanto o trimetoprim quanto o sulfametoxazol se distribuem no escarro e no fluido vaginal; O trimetoprima também se distribui nas secreções brônquicas, e ambos passam pela barreira placentária e são excretados no leite materno.
Eliminação
Metabolismo
sulfametoxazol é metabolizado em humanos em pelo menos 5 metabólitos: os metabólitos N4-acetil-, N4-hidroxi-, 5metilhidroxi-, N4-acetil-5-metilhidroxi-sulfametoxazol e um conjugado N-glicuronídeo. A formação do metabólito N4-hidroxi é mediada via CYP2C9.
O trimetoprim é metabolizado in vitro em 11 metabólitos diferentes, dos quais, cinco são adutos de glutationa e seis são metabólitos oxidativos, incluindo os principais metabólitos, 1 e 3-óxidos e os derivados 3 e 4-hidroxi.
As formas livres de trimetoprima e sulfametoxazol são consideradas as formas terapeuticamente ativas. Estudos in vitro sugerem que o trimetoprima é um substrato da P-glicoproteína, OCT1 e OCT2, e que o sulfametoxazol não é um substrato da P-glicoproteína.
Excreção
excreção de trimetoprima e sulfametoxazol ocorre principalmente pelos rins, tanto por filtração glomerular quanto por secreção tubular. As concentrações urinárias de trimetoprima e sulfametoxazol são consideravelmente mais altas do que as concentrações no sangue. A porcentagem da dose excretada na urina durante um período de 12 horas após a administração intravenosa da primeira dose de 240 mg de trimetoprima e 1.200 mg de sulfametoxazol no dia 1 variou de 17% a 42,4% como trimetoprima livre; 7% a 12,7% como sulfametoxazol livre; e 36,7% a 56% como sulfametoxazol total (livre mais o metabólito N4-acetilado). Quando administrados em conjunto como BACTRIM 400mg, nem o trimetoprim nem o sulfametoxazol afetam o padrão de excreção urinária do outro.
Populações Específicas
Pacientes Geriátricos
farmacocinética de sulfametoxazol 800 mg e trimetoprima 160 mg foi estudada em seis indivíduos geriátricos (idade média: 78,6 anos) e seis indivíduos saudáveis jovens (idade média: 29,3 anos) usando uma formulação não aprovada nos EUA. Os valores farmacocinéticos do sulfametoxazol em indivíduos geriátricos foram semelhantes aos observados em indivíduos adultos jovens. A depuração renal média de trimetoprima foi significativamente menor em indivíduos geriátricos em comparação com indivíduos adultos jovens (19 mL/h/kg vs. 55 mL/h/kg). No entanto, após a normalização pelo peso corporal, a depuração corporal total aparente de trimetoprima foi, em média, 19% menor em indivíduos geriátricos em comparação com indivíduos adultos jovens.
Microbiologia
Mecanismo de ação
sulfametoxazol inibe a síntese bacteriana do ácido diidrofólico ao competir com o ácido para-aminobenzóico (PABA). O trimetoprim bloqueia a produção de ácido tetraidrofólico a partir do ácido diidrofólico, ligando-se e inibindo reversivelmente a enzima necessária, a diidrofolato redutase. Assim, sulfametoxazol e trimetoprima bloqueiam duas etapas consecutivas na biossíntese de ácidos nucléicos e proteínas essenciais para muitas bactérias.
Resistência
Estudos in vitro mostraram que a resistência bacteriana se desenvolve mais lentamente com sulfametoxazol e trimetoprima em combinação do que com sulfametoxazol ou trimetoprima isoladamente.
Actividade antimicrobiana
BACTRIM demonstrou ser ativo contra a maioria dos isolados dos seguintes microrganismos, tanto in vitro quanto em infecções clínicas [ver INDICAÇÕES E USO ].
Bactérias Gram-Negativas Aeróbicas
Escherichia coliEspécie de KlebsiellaEspécie de EnterobacterMorganella morganiiProteus mirabilisProteus vulgarisShigella flexneriShigella sonnei
Outros microrganismos
Pneumocystis jirovecii
Os seguintes dados in vitro estão disponíveis, mas seu significado clínico é desconhecido. Pelo menos 90 por cento das seguintes bactérias exibem uma concentração inibitória mínima in vitro (CIM) menor ou igual ao ponto de ruptura suscetível para BACTRIM 160mg contra isolados de gênero ou grupo de organismos semelhantes. No entanto, a eficácia de BACTRIM 400mg no tratamento de infecções clínicas causadas por essas bactérias não foi estabelecida em ensaios clínicos adequados e bem controlados.
Bactérias Gram-positivas Aeróbicas
Streptococcus pneumoniae
Bactérias Gram-Negativas Aeróbicas
Haemophilus influenzae
Teste de suscetibilidade
Para obter informações específicas sobre os critérios interpretativos do teste de suscetibilidade e métodos de teste associados e padrões de controle de qualidade reconhecidos pela FDA para este medicamento, consulte https://www.fda.gov/STIC.
REFERÊNCIAS
11. Grose WE, Bodey GP, Loo TL. Farmacologia Clínica de Trimetoprim-Sulfametoxazol Administrado por Via Intravenosa. Agentes Antimicrobianos Quimioterápicos. Mar 1979;15:447-451.
12. Siber GR, Gorham C, Durbin W, Lesko L, Levin MJ. Farmacologia do Trimetoprim-Sulfametoxazol Intravenoso em Crianças e Adultos. Atual Quimioterapia e Doenças Infecciosas. Sociedade Americana de Microbiologia, Washington, DC 1980; Vol. 1, págs. 691-692.
INFORMAÇÃO DO PACIENTE
Toxicidade Embrião Fetal
Aconselhar as pacientes do sexo feminino com potencial reprodutivo que BACTRIM pode causar danos ao feto e informar seu médico sobre uma gravidez conhecida ou suspeita [ver Uso em populações específicas ].
Lactação
Aconselhe as mulheres que amamentam a evitar a amamentação durante o tratamento com BACTRIM.
Resistência Antibacteriana
Aconselhe os pacientes que os medicamentos antibacterianos, incluindo BACTRIM, devem ser usados apenas para tratar infecções bacterianas. Não trata infecções virais (por exemplo, resfriado comum).
Instruir os pacientes a manter uma ingestão adequada de líquidos para evitar a cristalúria e a formação de cálculos.
Diarréia
Aconselhe os pacientes que a diarreia é um problema comum causado por antibióticos que geralmente termina quando o antibiótico é descontinuado. Às vezes, após o início do tratamento com antibióticos, os pacientes podem desenvolver fezes aquosas e sanguinolentas (com ou sem cólicas estomacais e febre), mesmo dois ou mais meses após a última dose do antibiótico. Se isso ocorrer, os pacientes devem entrar em contato com seu médico o mais rápido possível.
