Ceftin 250mg, 500mg, 125mg Cefuroxime Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Ceftin 500mg e como é usado?
Ceftin 500mg é um medicamento de prescrição usado para tratar os sintomas de infecções bacterianas. Ceftin pode ser usado sozinho ou com outros medicamentos.
Ceftin 250mg é um antibiótico cefalosporínico.
Não se sabe se a Ceftin é segura e eficaz em crianças com menos de 3 meses de idade.
Quais são os possíveis efeitos colaterais da Ceftin?
Ceftin 250mg pode causar efeitos colaterais graves, incluindo:
- dor de estômago severa,
- diarreia (com ou sem sangue),
- amarelecimento da pele ou dos olhos,
- erupção cutânea,
- contusões,
- formigamento ou dormência grave,
- convulsão (convulsões),
- micção difícil ou dolorosa,
- inchaço nos pés, tornozelos, rosto ou língua,
- cansaço,
- falta de ar,
- febre,
- dor de garganta,
- queimando em seus olhos,
- dor na pele com erupção cutânea vermelha ou roxa,
- bolhas na pele e descamação
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns da Ceftin incluem:
- diarréia,
- náusea,
- vômito,
- gosto incomum ou desagradável na boca,
- assaduras em uma criança,
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais da Ceftin. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
DESCRIÇÃO
CEFTIN 500mg comprimidos e CEFTIN para suspensão oral contêm cefuroxima como cefuroxima axetil. CEFTIN é um fármaco antibacteriano cefalosporínico semissintético para administração oral.
O nome químico da cefuroxima axetil (1-(acetiloxi) etil éster de cefuroxima) é (RS)-1-hidroxietil (6R,7R)-7-[2-(2-furil)glioxil-amido]-3-(hidroximetil )-8-oxo-5-tia-1-azabiciclo[4.2.0]-oct-2-eno-2-carboxilato, 72-(Z)-(O-metil-oxima), 1-acetato 3-carbamato. Sua fórmula molecular é C20H22N4O10S e tem um peso molecular de 510,48.
Cefuroxima axetil está na forma amorfa e tem a seguinte fórmula estrutural:
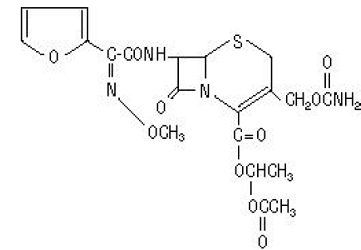
Os comprimidos são revestidos por película e contêm o equivalente a 250 ou 500 mg de cefuroxima como cefuroxima axetil. Os comprimidos contêm os ingredientes inativos dióxido de silício coloidal, croscarmelose sódica, óleo vegetal hidrogenado, hipromelose, metilparabeno, celulose microcristalina, propilenoglicol, propilparabeno, benzoato de sódio, lauril sulfato de sódio e dióxido de titânio.
A suspensão oral, quando reconstituída com água, fornece o equivalente a 125 mg ou 250 mg de cefuroxima (como cefuroxima axetil) por 5 mL. A suspensão oral contém os ingredientes inativos acessulfame de potássio, aspartame, povidona K30, ácido esteárico, sacarose, aroma de tutti-frutti e goma xantana.
INDICAÇÕES
Faringite/Amigdalite
CEFTIN 125mg comprimidos é indicado para o tratamento de pacientes adultos e pacientes pediátricos (13 anos ou mais) com faringite/amigdalite leve a moderada causada por cepas suscetíveis de Streptococcus pyogenes.
CEFTIN 500mg para suspensão oral é indicado para o tratamento de pacientes pediátricos de 3 meses a 12 anos com faringite/amigdalite leve a moderada causada por cepas suscetíveis de Streptococcus pyogenes.
Limitações de uso
- A eficácia de CEFTIN na prevenção da febre reumática não foi estabelecida em ensaios clínicos.
- A eficácia de CEFTIN 125mg no tratamento de cepas de Streptococcus pyogenes resistentes à penicilina não foi demonstrada em ensaios clínicos.
Otite Média Bacteriana Aguda
CEFTIN 125mg comprimidos é indicado para o tratamento de pacientes pediátricos (que podem engolir comprimidos inteiros) com otite média bacteriana aguda causada por cepas suscetíveis de Streptococcus pneumoniae, Haemophilus influenzae (incluindo cepas produtoras de β-lactamase), Moraxella catarrhalis (incluindo β-lactamase cepas produtoras), ou Streptococcus pyogenes.
CEFTIN para suspensão oral é indicado para o tratamento de pacientes pediátricos de 3 meses a 12 anos com otite média bacteriana aguda causada por cepas suscetíveis de Streptococcus pneumoniae, Haemophilus influenzae (incluindo cepas produtoras de β-lactamase), Moraxella catarrhalis (incluindo β-lactamase cepas produtoras), ou Streptococcus pyogenes.
Sinusite Maxilar Bacteriana Aguda
CEFTIN comprimidos é indicado para o tratamento de pacientes adultos e pediátricos (13 anos ou mais) com sinusite maxilar bacteriana aguda leve a moderada causada por cepas suscetíveis de Streptococcus pneumoniae ou Haemophilus influenzae (somente cepas não produtoras de β-lactamase).
CEFTIN 250mg para suspensão oral é indicado para o tratamento de pacientes pediátricos de 3 meses a 12 anos com sinusite maxilar bacteriana aguda leve a moderada causada por cepas suscetíveis de Streptococcus pneumoniae ou Haemophilus influenzae (somente cepas não produtoras de β-lactamase) .
Limitações de uso
eficácia de CEFTIN para infecções sinusais causadas por Haemophilus influenzae ou Moraxella catarrhalis produtora de β-lactamase em pacientes com sinusite maxilar bacteriana aguda não foi estabelecida devido ao número insuficiente desses isolados nos ensaios clínicos [ver Estudos clínicos ].
Exacerbações bacterianas agudas da bronquite crônica
Os comprimidos de CEFTIN são indicados para o tratamento de pacientes adultos e pacientes pediátricos (com 13 anos ou mais) com exacerbações bacterianas agudas leves a moderadas de bronquite crônica causadas por cepas suscetíveis de Streptococcus pneumoniae, Haemophilus influenzae (cepas β-lactamase-negativas), ou Haemophilus para influenzae (estirpes β-lactamase-negativas).
Infecções não complicadas da pele e da estrutura da pele
CEFTIN 250mg comprimidos é indicado para o tratamento de pacientes adultos e pacientes pediátricos (com 13 anos ou mais) com infecções não complicadas da pele e da estrutura da pele causadas por cepas suscetíveis de Staphylococcus aureus (incluindo cepas produtoras de β-lactamase) ou Streptococcus pyogenes.
Infecções não complicadas do trato urinário
CEFTIN 500mg comprimidos é indicado para o tratamento de pacientes adultos e pacientes pediátricos (com 13 anos ou mais) com infecções não complicadas do trato urinário causadas por cepas sensíveis de Escherichia coli ou Klebsiella pneumoniae.
Gonorreia não complicada
CEFTIN comprimidos é indicado para o tratamento de pacientes adultos e pacientes pediátricos (com 13 anos ou mais) com gonorreia não complicada, uretral e endocervical, causada por cepas suscetíveis produtoras e não produtoras de penicilinase de Neisseria gonorrhoeae e gonorreia não complicada, retal, em mulheres , causada por cepas sensíveis de Neisseria gonorrhoeae não produtoras de penicilinase.
Doença de Lyme precoce (eritema migratório)
Os comprimidos de CEFTIN são indicados para o tratamento de pacientes adultos e pacientes pediátricos (com 13 anos ou mais) com doença de Lyme inicial (eritema migratório) causada por cepas suscetíveis de Borrelia burgdorferi.
Impetigo
CEFTIN 250mg para suspensão oral é indicado para o tratamento de pacientes pediátricos de 3 meses a 12 anos com impetigo causado por cepas sensíveis de Staphylococcus aureus (incluindo cepas produtoras de Plactamase) ou Streptococcus pyogenes.
Uso
Para reduzir o desenvolvimento de bactérias resistentes a medicamentos e manter a eficácia de CEFTIN e outros medicamentos antibacterianos, CEFTIN 500mg deve ser usado apenas para tratar ou prevenir infecções comprovadas ou fortemente suspeitas de serem causadas por bactérias suscetíveis. Quando as informações de cultura e suscetibilidade estiverem disponíveis, elas devem ser consideradas na seleção ou modificação da terapia antibacteriana. Na ausência de tais dados, a epidemiologia local e os padrões de suscetibilidade podem contribuir para a seleção empírica da terapia.
DOSAGEM E ADMINISTRAÇÃO
Instruções importantes de administração
- CEFTIN comprimidos e CEFTIN para suspensão oral não são bioequivalentes e, portanto, não são substituíveis na base de miligrama por miligrama [ver FARMACOLOGIA CLÍNICA ].
- Administrar comprimidos ou suspensão oral de CEFTIN conforme descrito nas diretrizes de dosagem apropriadas [ver Dosagem para CEFTIN 500mg Comprimidos, Dosagem Para CEFTIN 250mg Para Suspensão Oral e Preparação e administração de CEFTIN 125mg para suspensão oral ].
- Administrar comprimidos de CEFTIN 500mg com ou sem alimentos.
- Administrar CEFTIN 500mg para suspensão oral com alimentos.
- Pacientes pediátricos (com idade igual ou superior a 13 anos) que não podem engolir os comprimidos de CEFTIN 125mg inteiros devem receber CEFTIN para suspensão oral porque o comprimido tem um sabor amargo forte e persistente quando esmagado [ver Dosagem para comprimidos de CEFTIN ].
Dosagem para comprimidos de CEFTIN 500mg
Administre os comprimidos de CEFTIN 250mg conforme descrito na tabela de diretrizes de dosagem abaixo com ou sem alimentos.
Dosagem para CEFTIN para Suspensão Oral
Administrar CEFTIN para suspensão oral conforme descrito na tabela de diretrizes de dosagem abaixo com alimentos.
Preparação e Administração de CEFTIN para Suspensão Oral
Prepare uma suspensão no momento da dispensa da seguinte forma:
- Agite bem a suspensão oral antes de cada utilização.
- Recoloque a tampa firmemente após cada abertura.
- Armazenar a suspensão reconstituída refrigerada entre 2° e 8°C (36° e 46°F).
- Descarte a suspensão reconstituída após 10 dias.
Dosagem em pacientes com função renal prejudicada
Um ajuste do intervalo de dosagem é necessário para pacientes cuja depuração de creatinina é inferior a 30 mL/min, conforme listado na Tabela 4 abaixo, porque a cefuroxima é eliminada principalmente pelo rim [ver FARMACOLOGIA CLÍNICA ].
COMO FORNECIDO
Formas de dosagem e pontos fortes
Os comprimidos de CEFTIN são comprimidos revestidos por película brancos, em forma de cápsula, disponíveis nas seguintes dosagens:
- 250 mg de cefuroxima (como cefuroxima axetil) com “GX ES7” gravado de um lado e branco do outro lado.
- 500 mg de cefuroxima (como cefuroxima axetil) com “GX EG2” gravado de um lado e branco do outro lado.
CEFTIN para suspensão oral é fornecido na forma de pó seco, branco a esbranquiçado, com sabor de tutti-frutti. Quando reconstituída conforme as instruções, a suspensão fornece o equivalente a 125 mg ou 250 mg de cefuroxima (como cefuroxima axetil) por 5 mL.
Armazenamento e manuseio
Os comprimidos de CEFTIN, 250 mg de cefuroxima (como cefuroxima axetil), são brancos, em forma de cápsula, revestidos por película, gravados com “GX ES7” de um lado e em branco do outro lado, como segue: 20 comprimidos/frasco NDC 0173-0387-00
Os comprimidos de CEFTIN, 500 mg de cefuroxima (como cefuroxima axetil), são brancos, em forma de cápsula, revestidos por película, gravados com “GX EG2” de um lado e branco do outro lado, como segue: 20 comprimidos/frasco NDC 0173-0394-00
Armazene os comprimidos entre 15° e 30°C (59° e 86°F). Recoloque a tampa firmemente após cada abertura.
CEFTIN 500mg para suspensão oral é fornecido como pó seco, branco a esbranquiçado, com sabor de tutti-frutti. Quando reconstituída conforme as instruções, a suspensão fornece o equivalente a 125 mg ou 250 mg de cefuroxima (como cefuroxima axetil) por 5 mL. É fornecido em frascos de vidro âmbar da seguinte forma:
125 mg/5 mL
Suspensão de 100 mL NDC 0173-0740-00
250 mg/5 mL
Suspensão de 50 mL NDC 0173-0741-10 Suspensão de 100 mL NDC 0173-0741-00
Antes da reconstituição, armazene o pó seco entre 2° e 30°C (36° e 86°F).
Após a reconstituição, armazenar imediatamente a suspensão refrigerada entre 2° e 8°C (36° e 46°F). DESCARTE APÓS 10 DIAS.
GlaxoSmithKline, Research Triangle Park, NC 27709. Revisado: outubro de 2017
EFEITOS COLATERAIS
A seguinte reação adversa grave e importante é descrita em mais detalhes na seção de Advertências e Precauções do rótulo:
Reações anafiláticas [ver AVISOS E PRECAUÇÕES ]
Experiência de Ensaios Clínicos
Como os ensaios clínicos são conduzidos sob condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser comparadas diretamente com as taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
Comprimidos
Regimes de dosagem de múltiplas doses com duração de 7 a 10 dias
Em ensaios clínicos de dose múltipla, 912 indivíduos foram tratados com CEFTIN (125 a 500 mg duas vezes ao dia). Note-se que 125 mg duas vezes ao dia não é uma dosagem aprovada. Vinte (2,2%) indivíduos interromperam a medicação devido a reações adversas. Dezessete (85%) dos 20 indivíduos que descontinuaram a terapia o fizeram devido a distúrbios gastrointestinais, incluindo diarréia, náusea, vômito e dor abdominal. A porcentagem de indivíduos tratados com CEFTIN que descontinuaram o medicamento do estudo devido a reações adversas foi semelhante em doses diárias de 1.000, 500 e 250 mg (2,3%, 2,1% e 2,2%, respectivamente). No entanto, a incidência de reações adversas gastrointestinais aumentou com as doses mais altas recomendadas.
As reações adversas na Tabela 5 são para indivíduos (n = 912) tratados com CEFTIN 250mg em ensaios clínicos de dose múltipla.
As seguintes reações adversas ocorreram em menos de 1%, mas em mais de 0,1% dos indivíduos (n = 912) tratados com CEFTIN em ensaios clínicos de dose múltipla.
Distúrbios do sistema imunológico Urticária, língua inchada.
Distúrbios do Metabolismo e Nutrição : Anorexia.
Distúrbios do Sistema Nervoso : Dor de cabeça.
Distúrbios cardíacos : Dor no peito.
Distúrbios Respiratórios : Falta de ar.
Problemas gastrointestinais : Dor abdominal, cólicas abdominais, flatulência, indigestão, úlceras na boca.
Distúrbios da Pele e Tecidos Subcutâneos : Erupção cutânea, coceira.
Distúrbios Renais e Urinários : Disúria.
Distúrbios do Sistema Reprodutivo e da Mama : Vaginite, coceira vulvar.
Distúrbios Gerais e Condições do Local de Administração : Calafrios, sonolência, sede.
Investigações : Teste de Coombs positivo.
Doença de Lyme precoce com regime de 20 dias
Dois estudos multicêntricos avaliaram CEFTIN 500 mg duas vezes ao dia por 20 dias. As experiências adversas relacionadas ao medicamento mais comuns foram diarreia (10,6%), reação de Jarisch-Herxheimer (5,6%) e vaginite (5,4%). Outras experiências adversas ocorreram com frequências comparáveis às relatadas com a administração de 7 a 10 dias.
Regime de dose única para gonorreia não complicada
Em ensaios clínicos usando uma dose única de 1.000 mg de CEFTIN 250 mg, 1.061 indivíduos foram tratados para gonorreia não complicada. As reações adversas na Tabela 6 foram para indivíduos tratados com uma dose única de 1.000 mg de CEFTIN em ensaios clínicos nos EUA.
As seguintes reações adversas ocorreram em menos de 1%, mas em mais de 0,1% dos indivíduos (n = 1.061) tratados com uma dose única de CEFTIN 1.000 mg para gonorreia não complicada em ensaios clínicos nos EUA.
Infecções e Infestações : Candidíase vaginal.
Distúrbios do Sistema Nervoso : Dor de cabeça, tontura, sonolência.
Distúrbios cardíacos : Aperto/dor no peito, taquicardia.
Problemas gastrointestinais : Dor abdominal, dispepsia.
Distúrbios da Pele e Tecidos Subcutâneos : Eritema, erupção cutânea, prurido.
Distúrbios Musculoesqueléticos e do Tecido Conjuntivo : Cãibras musculares, rigidez muscular, espasmo muscular do pescoço, reação tipo trismo.
Distúrbios Renais e Urinários : Sangramento/dor na uretra, dor nos rins.
Distúrbios do Sistema Reprodutivo e da Mama : coceira vaginal, corrimento vaginal.
Suspensão oral
Em ensaios clínicos usando doses múltiplas de CEFTIN 250mg, pacientes pediátricos (96,7% tinham menos de 12 anos) foram tratados com CEFTIN (20 a 30 mg/kg/dia divididos duas vezes ao dia até uma dose máxima de 500 ou 1.000 mg/dia, respectivamente). Onze (1,2%) indivíduos dos EUA descontinuaram a medicação devido a reações adversas. As descontinuações foram principalmente por distúrbios gastrointestinais, geralmente diarreia ou vômito. Treze (1,4%) pacientes pediátricos dos EUA descontinuaram a terapia devido ao sabor e/ou problemas com a administração do medicamento.
As reações adversas na Tabela 7 são para indivíduos dos EUA (n = 931) tratados com CEFTIN em ensaios clínicos de doses múltiplas.
As seguintes reações adversas ocorreram em menos de 1%, mas em mais de 0,1% dos indivíduos dos EUA (n = 931) tratados com CEFTIN para suspensão oral em ensaios clínicos de dose múltipla.
Infecções e Infestações : Infecção gastrointestinal, candidíase, doença viral, infecção respiratória superior, sinusite, infecção do trato urinário.
Distúrbios do Sangue e do Sistema Linfático : Eosinofilia.
Distúrbios psiquiátricos : Hiperatividade, comportamento irritável.
Problemas gastrointestinais : Dor abdominal, flatulência, ptialismo.
Distúrbios da Pele e Tecidos Subcutâneos : Irritação na pele.
Distúrbios Musculoesqueléticos e do Tecido Conjuntivo : Edema articular, artralgia.
Distúrbios do Sistema Reprodutivo e da Mama : Irritação vaginal.
Distúrbios Gerais e Condições do Local de Administração : Tosse, febre.
Investigações : Enzimas hepáticas elevadas, teste de Coombs positivo.
Experiência pós-marketing
As seguintes reações adversas foram identificadas durante o uso pós-aprovação de CEFTIN. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento.
Distúrbios do Sangue e do Sistema Linfático
Anemia hemolítica, leucopenia, pancitopenia, trombocitopenia.
Problemas gastrointestinais
Colite pseudomembranosa [ver AVISOS E PRECAUÇÕES ].
Distúrbios hepatobiliares
Insuficiência hepática incluindo hepatite e colestase, icterícia.
Distúrbios do sistema imunológico
Anafilaxia, reação semelhante à doença do soro.
Investigações
Aumento do tempo de protrombina.
Distúrbios do Sistema Nervoso
Convulsão, encefalopatia.
Distúrbios Renais e Urinários
Disfunção renal.
Distúrbios da Pele e Tecidos Subcutâneos
Angioedema, eritema multiforme, síndrome de Stevens-Johnson, necrólise epidérmica tóxica, urticária.
INTERAÇÕES MEDICAMENTOSAS
Contraceptivos orais
A cefuroxima axetil pode afetar a flora intestinal, levando a uma menor reabsorção de estrogênio e redução da eficácia dos contraceptivos orais combinados de estrogênio/progesterona. Aconselhe os pacientes a considerar medidas contraceptivas suplementares (não hormonais) alternativas durante o tratamento.
Medicamentos que reduzem a acidez gástrica
Medicamentos que reduzem a acidez gástrica podem resultar em menor biodisponibilidade de CEFTIN em comparação com a administração em jejum. A administração de medicamentos que reduzem a acidez gástrica pode anular o efeito alimentar do aumento da absorção de CEFTIN 250mg quando administrado no estado pós-prandial. Administrar CEFTIN pelo menos 1 hora antes ou 2 horas após a administração de antiácidos de ação curta. Antagonistas da histamina-2 (H2) e inibidores da bomba de prótons devem ser evitados.
probenecida
A administração concomitante de probenecida com comprimidos de cefuroxima axetil aumenta as concentrações séricas de cefuroxima [ver FARMACOLOGIA CLÍNICA ]. A coadministração de probenecida com cefuroxima axetil não é recomendada.
Interações Medicamentos/Testes Laboratoriais
Uma reação falso-positiva para glicose na urina pode ocorrer com testes de redução de cobre (por exemplo, solução de Benedict ou Fehling), mas não com testes baseados em enzimas para glicosúria. Como pode ocorrer um resultado falso-negativo no teste de ferricianeto, recomenda-se que o método da glicose oxidase ou hexoquinase seja usado para determinar os níveis de glicose no sangue/plasma em pacientes recebendo cefuroxima axetil. A presença de cefuroxima não interfere na dosagem de creatinina sérica e urinária pelo método do picrato alcalino.
AVISOS
Incluído como parte do PRECAUÇÕES seção.
PRECAUÇÕES
Reações anafiláticas
Reações de hipersensibilidade (anafiláticas) graves e ocasionalmente fatais foram relatadas em pacientes em uso de antibacterianos β-lactâmicos. Essas reações são mais prováveis de ocorrer em indivíduos com histórico de hipersensibilidade a β-lactâmicos e/ou histórico de sensibilidade a múltiplos alérgenos. Houve relatos de indivíduos com histórico de hipersensibilidade à penicilina que apresentaram reações graves quando tratados com cefalosporinas. CEFTIN 500mg é contraindicado em pacientes com hipersensibilidade conhecida a CEFTIN ou a outros antibacterianos β-lactâmicos [ver CONTRA-INDICAÇÕES ]. Antes de iniciar a terapia com CEFTIN, pergunte sobre reações anteriores de hipersensibilidade a penicilinas, cefalosporinas ou outros alérgenos. Se ocorrer uma reação alérgica, descontinuar CEFTIN e instituir a terapia apropriada.
Diarreia Associada ao Clostridium Difficile
Diarreia associada ao Clostridium difficile (CDAD) foi relatada com o uso de quase todos os agentes antibacterianos, incluindo CEFTIN, e pode variar em gravidade de diarreia leve a colite fatal. O tratamento com agentes antibacterianos altera a flora normal do cólon levando ao crescimento excessivo de C. difficile.
C. difficile produz toxinas A e B que contribuem para o desenvolvimento de CDAD. Cepas produtoras de hipertoxina de C. difficile causam aumento da morbidade e mortalidade, pois essas infecções podem ser refratárias à terapia antimicrobiana e podem requerer colectomia. CDAD deve ser considerado em todos os pacientes que apresentam diarreia após o uso de antibióticos. É necessário um histórico médico cuidadoso, pois foi relatado que CDAD ocorre mais de 2 meses após a administração de agentes antibacterianos.
Se houver suspeita ou confirmação de CDAD, o uso contínuo de antibióticos não direcionados contra C. difficile pode precisar ser descontinuado. O manejo adequado de fluidos e eletrólitos, suplementação de proteína, tratamento antibiótico de C. difficile e avaliação cirúrgica devem ser instituídos conforme indicação clínica.
Potencial para supercrescimento microbiano
A possibilidade de superinfecções com patógenos fúngicos ou bacterianos deve ser considerada durante a terapia.
Desenvolvimento de bactérias resistentes a drogas
A prescrição de CEFTIN na ausência de infecção bacteriana comprovada ou fortemente suspeita ou indicação profilática provavelmente não trará benefícios ao paciente e aumenta o risco de desenvolvimento de bactérias resistentes aos medicamentos.
Fenilcetonúria
CEFTIN 125 mg para suspensão oral 125 mg/5 mL contém fenilalanina 11,8 mg por 5 mL (1 colher de chá) de suspensão reconstituída. CEFTIN 250 mg para suspensão oral 250 mg/5 mL contém fenilalanina 25,2 mg por 5 mL (1 colher de chá) de suspensão reconstituída.
Interferência com testes de glicose
Um resultado falso-positivo para glicose na urina pode ocorrer com testes de redução de cobre, e um resultado falso-negativo para glicose no sangue/plasma pode ocorrer com testes de ferricianeto em indivíduos recebendo CEFTIN [ver INTERAÇÕES MEDICAMENTOSAS ].
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Embora não tenham sido realizados estudos ao longo da vida em animais para avaliar o potencial carcinogênico, nenhuma atividade mutagênica foi encontrada para cefuroxima axetil em uma bateria de testes de mutação bacteriana. Resultados positivos foram obtidos em um ensaio de aberração cromossômica in vitro; no entanto, resultados negativos foram encontrados em um teste de micronúcleo in vivo em doses de até 1,5 g/kg. Estudos de reprodução em ratos com doses de até 1.000 mg/kg/dia (9 vezes a dose humana máxima recomendada com base na área de superfície corporal) não revelaram comprometimento da fertilidade.
Uso em populações específicas
Gravidez
Gravidez Categoria B. Não existem estudos adequados e bem controlados em mulheres grávidas. Como os estudos de reprodução em animais nem sempre são preditivos da resposta humana, CEFTIN deve ser usado durante a gravidez somente se for claramente necessário.
Estudos de reprodução foram realizados em camundongos com doses de até 3.200 mg/kg/dia (14 vezes a dose humana máxima recomendada com base na área de superfície corporal) e em ratos com doses de até 1.000 mg/kg/dia (9 vezes a dose máxima recomendada humana baseada na área de superfície corporal) e não revelaram evidência de diminuição da fertilidade ou danos ao feto devido à cefuroxima axetil.
Mães que amamentam
Como a cefuroxima é excretada no leite humano, deve-se ter cautela quando CEFTIN 500mg é administrado a lactantes.
Uso Pediátrico
segurança e eficácia de CEFTIN 250mg foram estabelecidas para pacientes pediátricos de 3 meses a 12 anos para sinusite maxilar bacteriana aguda com base em sua aprovação em adultos. O uso de CEFTIN em pacientes pediátricos é apoiado por dados farmacocinéticos e de segurança em pacientes adultos e pediátricos, e por dados clínicos e microbiológicos de estudos adequados e bem controlados do tratamento de sinusite maxilar bacteriana aguda em adultos e de otite média aguda com efusão em pacientes pediátricos. Também é apoiado pela vigilância de eventos adversos pós-comercialização. [Ver INDICAÇÕES E USO , DOSAGEM E ADMINISTRAÇÃO , REAÇÕES ADVERSAS , FARMACOLOGIA CLÍNICA ]
Uso Geriátrico
Do número total de indivíduos que receberam CEFTIN 250mg em 20 ensaios clínicos, 375 tinham 65 anos ou mais, enquanto 151 tinham 75 anos ou mais. Não foram observadas diferenças globais na segurança ou eficácia entre estes indivíduos e indivíduos adultos mais jovens. A experiência clínica relatada não identificou diferenças nas respostas entre pacientes idosos e adultos mais jovens, mas não pode ser descartada uma maior sensibilidade de alguns indivíduos mais velhos.
A cefuroxima é substancialmente excretada pelos rins e o risco de reações adversas pode ser maior em pacientes com função renal comprometida. Como os pacientes idosos são mais propensos a ter função renal diminuída, deve-se ter cuidado na seleção da dose e pode ser útil monitorar a função renal.
Insuficiência renal
A redução da dose de CEFTIN 125mg é recomendada para pacientes adultos com insuficiência renal grave (clearance de creatinina DOSAGEM E ADMINISTRAÇÃO , FARMACOLOGIA CLÍNICA ].
SOBREDOSAGEM
superdosagem de cefalosporinas pode causar irritação cerebral levando a convulsões ou encefalopatia. Os níveis séricos de cefuroxima podem ser reduzidos por hemodiálise e diálise peritoneal.
CONTRA-INDICAÇÕES
CEFTIN é contraindicado em pacientes com hipersensibilidade conhecida (p. ex., anafilaxia) à CEFTIN ou a outros medicamentos antibacterianos β-lactâmicos (p.
FARMACOLOGIA CLÍNICA
Mecanismo de ação
CEFTIN 250mg é um medicamento antibacteriano [ver Microbiologia ].
Farmacocinética
Absorção
Após administração oral, a cefuroxima axetil é absorvida pelo trato gastrointestinal e rapidamente hidrolisada por esterases inespecíficas na mucosa intestinal e no sangue em cefuroxima. Os parâmetros farmacocinéticos séricos da cefuroxima após a administração de comprimidos de CEFTIN 250mg a adultos são mostrados na Tabela 8.
Efeito alimentar
absorção do comprimido é maior quando tomado após as refeições (a biodisponibilidade absoluta aumenta de 37% para 52%). Apesar dessa diferença na absorção, as respostas clínicas e bacteriológicas dos indivíduos foram independentes da ingestão de alimentos no momento da administração do comprimido em 2 ensaios em que isso foi avaliado.
Todos os ensaios farmacocinéticos e clínicos de eficácia e segurança em indivíduos pediátricos usando a formulação de suspensão foram conduzidos no estado alimentado. Não há dados disponíveis sobre a cinética de absorção da formulação de suspensão quando administrada a pacientes pediátricos em jejum.
Falta de Bioequivalência
suspensão oral não foi bioequivalente a comprimidos quando testada em adultos saudáveis. As formulações de comprimidos e suspensões orais NÃO são substituíveis na base de miligrama-permiligrama. A área sob a curva para a suspensão foi em média 91% daquela do comprimido, e a concentração plasmática máxima para a suspensão foi em média 71% da concentração plasmática máxima dos comprimidos. Portanto, a segurança e a eficácia das formulações de comprimidos e suspensões orais foram estabelecidas em ensaios clínicos separados.
Distribuição
A cefuroxima é distribuída pelos fluidos extracelulares. Aproximadamente 50% da cefuroxima sérica está ligada à proteína.
Metabolismo
A porção axetil é metabolizada em acetaldeído e ácido acético.
Excreção
cefuroxima é excretada inalterada na urina; em adultos, aproximadamente 50% da dose administrada é recuperada na urina em 12 horas. A farmacocinética da cefuroxima em pacientes pediátricos não foi estudada. Até que mais dados estejam disponíveis, a eliminação renal de cefuroxima axetil estabelecida em adultos não deve ser extrapolada para pacientes pediátricos.
Populações Específicas
Insuficiência renal
Em um estudo com 28 adultos com função renal normal ou insuficiência renal grave (clearance de creatinina DOSAGEM E ADMINISTRAÇÃO ].
Pacientes pediátricos
Os parâmetros farmacocinéticos séricos da cefuroxima em pacientes pediátricos que receberam CEFTIN para suspensão oral são mostrados na Tabela 9.
Pacientes Geriátricos
Em um estudo com 20 indivíduos idosos (idade média = 83,9 anos) com depuração de creatinina média de 34,9 mL/min, a meia-vida média de eliminação sérica foi prolongada para 3,5 horas; no entanto, apesar da menor eliminação da cefuroxima em pacientes geriátricos, não é necessário ajuste de dose com base na idade [ver Uso em populações específicas ].
Interações medicamentosas
A administração concomitante de probenecida com comprimidos de cefuroxima axetil aumenta a área de cefuroxima sob a curva de concentração sérica versus tempo e a concentração sérica máxima em 50% e 21%, respectivamente.
Microbiologia
Mecanismo de ação
A cefuroxima axetil é um agente bactericida que atua por inibição da síntese da parede celular bacteriana. A cefuroxima axetil tem actividade na presença de algumas β-lactamases, tanto penicilinases como cefalosporinases, de bactérias gram-negativas e gram-positivas.
Mecanismo de resistência
resistência à cefuroxima axetil ocorre principalmente através da hidrólise pela β-lactamase, alteração das proteínas de ligação à penicilina (PBPs), diminuição da permeabilidade e presença de bombas de efluxo bacteriano.
A suscetibilidade à cefuroxima axetil varia com a geografia e o tempo; os dados locais de suscetibilidade devem ser consultados, se disponíveis. Isolados de H. influenzae beta-lactamase-negativos e resistentes à ampicilina (BLNAR) devem ser considerados resistentes à cefuroxima axetil.
A cefuroxima axetil demonstrou ser ativa contra a maioria dos isolados das seguintes bactérias, tanto in vitro quanto em infecções clínicas [ver INDICAÇÕES E USO ]:
Bactérias Gram-positivas
Staphylococcus aureus (somente isolados sensíveis à meticilina) Streptococcus pneumoniae Streptococcus pyogenes
Bactérias Gram-Negativas
Escherichia colia Klebsiella pneumoniaea Haemophilus influenzae Haemophilus parainfluenzae Moraxella catarrhalis Neisseria gonorrhoeae a Os isolados produtores de β-lactamase (ESBL) de espectro mais estendido e produtores de carbapenemase são resistentes à cefuroxima axetil. Espiroquetas Borrelia Burgdorferi
Os seguintes dados in vitro estão disponíveis, mas seu significado clínico é desconhecido. Pelo menos 90 por cento dos seguintes microrganismos exibem uma concentração inibitória mínima in vitro (CIM) menor ou igual ao ponto de quebra suscetível para cefuroxima axetil de 1 mcg/mL. No entanto, a eficácia da cefuroxima axetil no tratamento de infecções clínicas causadas por esses microrganismos não foi estabelecida em ensaios clínicos adequados e bem controlados.
Bactérias Gram-positivas
Staphylococcus epidermidis (somente isolados sensíveis à meticilina) Staphylococcus saprophyticus (somente isolados sensíveis à meticilina) Streptococcus agalactiae
Bactérias Gram-Negativas
Morganella morganii Proteus inconstans Proteus mirabilis Providencia rettgeri Bactérias anaeróbicas Peptococcus niger
Métodos de teste de suscetibilidade
Quando disponível, o laboratório de microbiologia clínica deve fornecer ao médico os resultados dos testes de suscetibilidade in vitro para medicamentos antimicrobianos usados em hospitais locais e áreas de prática como relatórios periódicos que descrevem o perfil de suscetibilidade de patógenos nosocomiais e adquiridos na comunidade. Esses relatórios devem ajudar o médico a selecionar um medicamento antibacteriano para tratamento.
Técnicas de diluição
Métodos quantitativos são usados para determinar MICs antimicrobianos. Esses MICs fornecem estimativas reprodutíveis da suscetibilidade das bactérias aos compostos antimicrobianos. As CIMs devem ser determinadas usando um método de teste padronizado (caldo ou ágar).1,2 Os valores de CIM devem ser interpretados de acordo com os critérios fornecidos na Tabela 10.2,3
Técnicas de difusão
Os métodos quantitativos que requerem a medição dos diâmetros das zonas também fornecem estimativas reprodutíveis da suscetibilidade das bactérias aos compostos antimicrobianos. O tamanho da zona fornece uma estimativa da suscetibilidade das bactérias aos compostos antimicrobianos. O tamanho da zona deve ser determinado usando um método de teste padronizado.4 Este procedimento usa discos de papel impregnados com 30 mcg de cefuroxima axetil para testar a suscetibilidade dos microrganismos à cefuroxima axetil. Os critérios interpretativos de difusão em disco são fornecidos na Tabela 10.3
A suscetibilidade dos estafilococos à cefuroxima pode ser deduzida a partir do teste apenas de penicilina e cefoxitina ou oxacilina.
A suscetibilidade do Streptococcus pyogenes pode ser deduzida do teste de penicilina.3
Um relatório de “Suscetível” indica que o medicamento antimicrobiano provavelmente inibe o crescimento do patógeno se o medicamento antimicrobiano atingir a concentração geralmente alcançável no local da infecção. Um relatório de “Intermediário” indica que o resultado deve ser considerado ambíguo e, se o microrganismo não for totalmente suscetível a medicamentos alternativos e clinicamente viáveis, o teste deve ser repetido. Esta categoria implica possível aplicabilidade clínica em locais do corpo onde o fármaco está fisiologicamente concentrado ou em situações em que uma alta dosagem do fármaco pode ser usada. Esta categoria também fornece uma zona tampão que evita que pequenos fatores técnicos não controlados causem grandes discrepâncias na interpretação. Um relatório de “Resistente” indica que o medicamento antimicrobiano provavelmente não inibe o crescimento do patógeno se o medicamento antimicrobiano atingir as concentrações normalmente alcançáveis no local da infecção; outra terapia deve ser selecionada.
Controle de qualidade
Os procedimentos de teste de suscetibilidade padronizados exigem o uso de controles laboratoriais para monitorar e garantir a exatidão e precisão dos suprimentos e reagentes usados no ensaio, e as técnicas do indivíduo que realiza o teste.1,2,4 As faixas de CQ para CIM e difusão em disco testes usando o disco de 30 mcg são fornecidos na Tabela 11.3
Estudos clínicos
Sinusite Maxilar Bacteriana Aguda
Um estudo adequado e bem controlado foi realizado em indivíduos com sinusite maxilar bacteriana aguda. Neste estudo, cada sujeito teve um aspirado do seio maxilar coletado por punção do seio antes do início do tratamento para sinusite bacteriana aguda presuntiva. Todos os indivíduos tinham evidência radiográfica e clínica de sinusite maxilar aguda. No estudo, a eficácia clínica de CEFTIN no tratamento de sinusite maxilar aguda foi comparável a um agente antimicrobiano oral contendo um inibidor específico de β-lactamase. No entanto, dados de microbiologia demonstraram que CEFTIN é eficaz no tratamento de sinusite maxilar bacteriana aguda devido apenas a Streptococcus pneumoniae ou Haemophilus influenzae não produtor de β-lactamase. Números insuficientes de isolados de Haemophilus influenzae e Moraxella catarrhalis produtores de β-lactamase foram obtidos neste estudo para avaliar adequadamente a eficácia de CEFTIN no tratamento de sinusite maxilar bacteriana aguda devido a esses 2 organismos.
Este estudo randomizou 317 indivíduos adultos, 132 indivíduos nos EUA e 185 indivíduos na América do Sul. A Tabela 12 mostra os resultados da análise de intenção de tratar.
Neste estudo e em um estudo de punção maxilar de apoio, 15 indivíduos avaliáveis tinham Haemophilus influenzae não produtor de β-lactamase como o patógeno identificado. Destes, 67% (10/15) tiveram esse patógeno erradicado. Dezoito (18) indivíduos avaliáveis tinham Streptococcus pneumoniae como o patógeno identificado. Destes, 83% (15/18) tiveram esse patógeno erradicado.
Doença de Lyme precoce
Dois ensaios adequados e bem controlados foram realizados em indivíduos com doença de Lyme precoce. Todos os indivíduos apresentavam eritema migratório documentado por médico, com ou sem manifestações sistêmicas de infecção. Os indivíduos foram avaliados 1 mês após o tratamento quanto ao sucesso no tratamento da doença de Lyme precoce (Parte I) e 1 ano após o tratamento quanto ao sucesso na prevenção da progressão para as sequelas da doença de Lyme tardia (Parte II).
Um total de 355 indivíduos adultos (181 tratados com cefuroxima axetil e 174 tratados com doxiciclina) foram randomizados nos 2 ensaios, com diagnóstico de doença de Lyme precoce confirmado em 79% (281/355). O diagnóstico clínico de doença de Lyme precoce nesses indivíduos foi validado por 1) leitura cega por especialistas de fotografias, quando disponíveis, da lesão cutânea de eritema migratório pré-tratamento e 2) confirmação sorológica (usando ensaio imunoenzimático [ELISA] e ensaio immunoblot [mancha “Western”]) da presença de anticorpos específicos para Borrelia burgdorferi, o agente etiológico da doença de Lyme. Os dados de eficácia na Tabela 13 são específicos para este subconjunto de pacientes “validados”, enquanto os dados de segurança abaixo refletem toda a população de pacientes para os 2 estudos. Os dados clínicos para indivíduos avaliáveis no subconjunto de pacientes "validados" são mostrados na Tabela 13.
CEFTIN e doxiciclina foram eficazes na prevenção do desenvolvimento de sequelas da doença de Lyme tardia.
Embora a incidência de reações adversas gastrointestinais relacionadas ao medicamento tenha sido semelhante nos 2 grupos de tratamento (cefuroxima axetil - 13%; doxiciclina - 11%), a incidência de diarreia relacionada ao medicamento foi maior no braço de cefuroxima axetil versus no braço de doxiciclina (11 % versus 3%, respectivamente).
REFERÊNCIAS
1. Instituto de Padrões Clínicos e Laboratoriais (CLSI). Métodos para Testes de Susceptibilidade Antimicrobiana de Diluição para Bactérias que Crescem Aerobicamente; Padrão Aprovado - Décima Edição. 2015. Documento CLSI M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pensilvânia 19087, EUA.
2. Instituto de Padrões Clínicos e Laboratoriais (CLSI). Métodos para diluição de antimicrobianos e teste de suscetibilidade de disco para bactérias raramente isoladas ou fastidiosas: diretrizes aprovadas - segunda edição. 2010. Documento CLSI M45-A2, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pensilvânia 19087, EUA.
3. Instituto de Padrões Clínicos e Laboratoriais (CLSI). Padrões de Desempenho para Testes de Susceptibilidade Antimicrobiana; Vigésimo Quinto Suplemento Informativo. 2015. Documento CLSI M100-S25, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pensilvânia 19087, EUA.
4. Instituto de Padrões Clínicos e Laboratoriais (CLSI). Padrões de Desempenho para Testes de Susceptibilidade de Difusão em Disco Antimicrobiano; Norma Aprovada - Décima Segunda Edição. 2015. Documento CLSI M02-A12, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pensilvânia 19087, EUA.
INFORMAÇÃO DO PACIENTE
Reações alérgicas
Informe os pacientes que CEFTIN é uma cefalosporina que pode causar reações alérgicas em alguns indivíduos [ver AVISOS E PRECAUÇÕES ].
Diarreia Associada ao Clostridium Difficile
Informe os pacientes que a diarreia é um problema comum causado por antibacterianos e geralmente termina quando o antibacteriano é descontinuado. Às vezes, após o início do tratamento com antibacterianos, os pacientes podem desenvolver fezes aquosas e sanguinolentas (com ou sem cólicas estomacais e febre), mesmo 2 ou mais meses após a última dose do antibacteriano. Se isso ocorrer, aconselhe os pacientes a entrar em contato com seu médico o mais rápido possível.
Fenilcetonúria
Informe os pacientes e cuidadores que CEFTIN 125mg para suspensão oral contém fenilalanina (um componente do aspartame) [ver AVISOS E PRECAUÇÕES ].
Comprimidos de Esmagamento
Instrua os pacientes a engolir o comprimido inteiro, sem esmagá-lo. Os pacientes que não conseguem engolir o comprimido inteiro devem receber a suspensão oral.
Suspensão oral
Instrua os pacientes a agitar bem a suspensão oral antes de cada uso, armazenar na geladeira e descartar após 10 dias. A suspensão oral deve ser tomada com alimentos.
Resistência a droga
Informe os pacientes que medicamentos antibacterianos, incluindo CEFTIN, devem ser usados apenas para tratar infecções bacterianas. Eles não tratam infecções virais (por exemplo, o resfriado comum). Quando CEFTIN 250mg for prescrito para tratar uma infecção bacteriana, informar ao paciente que, embora seja comum sentir-se melhor logo no início da terapia, a medicação deve ser tomada exatamente como indicado. Pular doses ou não completar o curso completo da terapia pode: (1) diminuir a eficácia do tratamento imediato e (2) aumentar a probabilidade de que as bactérias desenvolvam resistência e não sejam tratáveis com CEFTIN 500mg ou outros medicamentos antibacterianos no futuro .
