Tratamento da depressão: Celexa 10mg, 20mg Citalopram Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Celexa e como é usado?
Celexa é um medicamento de prescrição usado para tratar os sintomas da depressão. Celexa pode ser usado sozinho ou com outros medicamentos.
Celexa 20mg pertence a uma classe de medicamentos chamados antidepressivos, ISRSs.
Quais são os possíveis efeitos colaterais do Celexa?
Celexa pode causar efeitos colaterais graves, incluindo:
- tontura,
- visão embaçada,
- visão de túnel,
- dor ou inchaço nos olhos,
- vendo halos ao redor das luzes,
- dor de cabeça com dor no peito e tontura severa,
- desmaio,
- batimentos cardíacos rápidos ou acelerados,
- músculos muito rígidos (rígidos),
- febre ou febre alta,
- sudorese,
- confusão,
- tremores,
- agitação,
- alucinações,
- reflexos hiperativos,
- náusea,
- vômito,
- diarréia,
- perda de coordenação,
- dor de cabeça,
- fala arrastada,
- fraqueza severa e
- sentindo-se instável
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Celexa 20mg incluem:
- problemas de memória,
- Dificuldade de concentração,
- dor de cabeça,
- sonolência,
- boca seca,
- aumentar a sudorese,
- dormência ou formigamento,
- aumento do apetite,
- náusea,
- diarréia,
- gás,
- batimentos cardíacos acelerados,
- sentindo-se trêmulo,
- problema do sono (insônia),
- sentindo-se cansado,
- sintomas de resfriado (nariz entupido, espirros, dor de garganta),
- alterações de peso e
- dificuldade em ter um orgasmo
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Celexa. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
Suicídio e drogas antidepressivas
Os antidepressivos aumentaram o risco em comparação ao placebo de pensamento e comportamento suicida (suicidalidade) em crianças, adolescentes e adultos jovens em estudos de curto prazo de transtorno depressivo maior (TDM) e outros transtornos psiquiátricos. Qualquer pessoa considerando o uso de Celexa ou qualquer outro antidepressivo em uma criança, adolescente ou adulto jovem deve equilibrar esse risco com a necessidade clínica. Estudos de curto prazo não mostraram um aumento no risco de suicídio com antidepressivos em comparação com placebo em adultos com mais de 24 anos; houve uma redução no risco com antidepressivos em comparação com placebo em adultos com 65 anos ou mais. A depressão e alguns outros transtornos psiquiátricos estão associados ao aumento do risco de suicídio. Pacientes de todas as idades que iniciam terapia antidepressiva devem ser monitorados adequadamente e observados de perto quanto a piora clínica, suicídio ou mudanças incomuns no comportamento. Famílias e cuidadores devem ser alertados sobre a necessidade de observação atenta e comunicação com o pres cridor. Celexa 10mg não está aprovado para uso em pacientes pediátricos. (Consulte ADVERTÊNCIAS: Agravamento clínico e risco de suicídio, INFORMAÇÕES AO PACIENTE e PRECAUÇÕES: Uso pediátrico.)
DESCRIÇÃO
Celexa® (citalopram HBr) é um inibidor seletivo da recaptação da serotonina (ISRS) administrado por via oral com uma estrutura química não relacionada à de outros ISRSs ou de agentes antidepressivos tricíclicos, tetracíclicos ou outros agentes antidepressivos disponíveis. Citalopram HBr é um derivado de ftalano bicíclico racêmico designado (±)-1-(3-dimetilaminopropil)-1-(4-fluorofenil)-1,3-di-hidroisobenzofuran-5-carbonitrila, HBr com a seguinte fórmula estrutural:
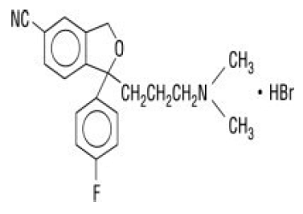
A fórmula molecular é C20H22BrFN2O e seu peso molecular é 405,35.
Citalopram HBr ocorre como um pó fino, branco a esbranquiçado. Citalopram HBr é pouco solúvel em água e solúvel em etanol.
Celexa (bromidrato de citalopram) está disponível apenas na forma de dosagem em comprimidos.
Celexa 10 mg são comprimidos ovais revestidos por película contendo citalopram HBr em dosagens equivalentes a 10 mg de citalopram base. Celexa 20 mg e 40 mg são comprimidos revestidos por película, ovais, ranhurados contendo citalopram HBr em dosagens equivalentes a 20 mg ou 40 mg de citalopram base. Os comprimidos também contêm os seguintes ingredientes inativos: copolividona, amido de milho, crosscarmelose sódica, glicerina, lactose monohidratada, estearato de magnésio, hipromelose, celulose microcristalina, polietilenoglicol e dióxido de titânio. Os óxidos de ferro são usados como corantes nos comprimidos bege (10 mg) e rosa (20 mg).
INDICAÇÕES
CELEXA 20mg é indicado para o tratamento do transtorno depressivo maior (TDM) em adultos [ver Estudos clínicos ].
DOSAGEM E ADMINISTRAÇÃO
Dosagem recomendada
Administrar CELEXA uma vez ao dia, com ou sem alimentos, na dose inicial de 20 mg uma vez ao dia, com um aumento para uma dose máxima de 40 mg uma vez ao dia com intervalo não inferior a uma semana.
Dosagens acima de 40 mg uma vez ao dia não são recomendadas devido ao risco de prolongamento do intervalo QT [ver AVISOS E PRECAUÇÕES ].
Triagem para transtorno bipolar antes de iniciar o CELEXA
Antes de iniciar o tratamento com CELEXA 20mg ou outro antidepressivo, rastreie os pacientes quanto a história pessoal ou familiar de transtorno bipolar, mania ou hipomania [Consulte AVISOS E PRECAUÇÕES ].
Dosagem Recomendada Para Populações Específicas
A dose máxima recomendada de CELEXA 10 mg para pacientes com mais de 60 anos de idade, pacientes com insuficiência hepática e para metabolizadores fracos de CYP2C19 é de 20 mg uma vez ao dia [ver AVISOS E PRECAUÇÕES , FARMACOLOGIA CLÍNICA ].
Modificações de dosagem com uso concomitante de inibidores de CYP2C19
A dose máxima recomendada de CELEXA 20 mg quando usado concomitantemente com um inibidor do CYP2C19 é de 20 mg uma vez ao dia [ver AVISOS E PRECAUÇÕES , INTERAÇÕES MEDICAMENTOSAS ].
Troca de pacientes de ou para um antidepressivo inibidor da monoamina oxidase
Devem decorrer pelo menos 14 dias entre a descontinuação de um antidepressivo inibidor da monoaminoxidase (IMAO) e o início da terapia com CELEXA. Por outro lado, devem decorrer pelo menos 14 dias após a interrupção do CELEXA antes de iniciar um antidepressivo IMAO [ver CONTRA-INDICAÇÕES e AVISOS E PRECAUÇÕES ].
Descontinuando o tratamento com CELEXA
Reações adversas podem ocorrer com a descontinuação de CELEXA [ver AVISOS E PRECAUÇÕES ]. Reduza gradualmente a dosagem em vez de interromper CELEXA abruptamente sempre que possível.
COMO FORNECIDO
Formas de dosagem e pontos fortes
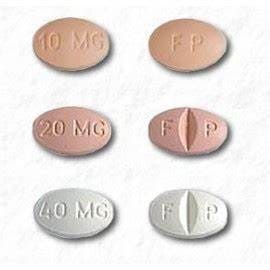
Os comprimidos de CELEXA 10mg estão disponíveis como:
- 10 mg: bege, oval com “FP” impresso de um lado, “10 mg” impresso do outro lado
- 20 mg: rosa, oval, marcado com “F” impresso no lado esquerdo da linha de marcação e “P” impresso no lado direito da linha de marcação, “20 mg” impresso no lado não marcado
- 40 mg: branco, oval, marcado com “F” impresso no lado esquerdo da linha de marcação e “P” impresso no lado direito da linha de marcação, “40 mg” impresso no lado não marcado
CELEXA (citalopram) comprimidos são fornecidos da seguinte forma:
Armazenamento e manuseio
Os comprimidos de CELEXA 10mg devem ser armazenados a 20-25°C (68 a 77°F); excursões permitidas entre 15 e 30°C (59-86°F) [ver Temperatura ambiente controlada USP ].
Distribuído por: Allergan USA, Inc. Revisado: fevereiro de 2022
EFEITOS COLATERAIS
As seguintes reações adversas são discutidas em mais detalhes em outras seções da bula:
- Reações de hipersensibilidade [ver CONTRA-INDICAÇÕES ]
- Pensamentos e comportamentos suicidas em adolescentes e adultos jovens [ver AVISOS E PRECAUÇÕES ]
- Prolongamento do intervalo QT e torsade de pointes [ver AVISOS E PRECAUÇÕES ]
- Síndrome serotoninérgica [ver AVISOS E PRECAUÇÕES ]
- Aumento do risco de sangramento [ver AVISOS E PRECAUÇÕES ]
- Ativação de mania ou hipomania [ver AVISOS E PRECAUÇÕES ]
- Síndrome de descontinuação [ver AVISOS E PRECAUÇÕES ]
- Convulsões [ver AVISOS E PRECAUÇÕES ]
- Glaucoma de ângulo fechado [ver AVISOS E PRECAUÇÕES ]
- Hiponatremia [ver AVISOS E PRECAUÇÕES ]
- Disfunção Sexual [ver AVISOS E PRECAUÇÕES ]
Experiência de Ensaios Clínicos
Como os ensaios clínicos são conduzidos sob condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser comparadas diretamente com as taxas nos estudos clínicos de outro medicamento e podem não refletir as taxas observadas na prática clínica.
segurança de CELEXA 20mg incluiu exposições ao citalopram em pacientes e/ou indivíduos saudáveis de 3 grupos diferentes de estudos: 429 indivíduos saudáveis em estudos de farmacologia clínica/farmacocinética; 4.422 exposições de pacientes em ensaios clínicos controlados e não controlados, correspondendo a aproximadamente 1.370 anos de exposição de pacientes. Houve, além disso, mais de 19.000 exposições de estudos europeus pós-comercialização principalmente abertos. As condições e a duração do tratamento com CELEXA 10mg variaram muito e incluíram (em categorias sobrepostas) estudos abertos e duplo-cegos, estudos de pacientes internados e ambulatoriais, estudos de dose fixa e de titulação de dose e exposição de curto e longo prazo .
Reações Adversas Associadas à Descontinuação do Tratamento
Entre 1.063 pacientes com TDM que receberam CELEXA 10 mg em doses variando de 10 mg a 80 mg uma vez ao dia em estudos controlados por placebo de até 6 semanas de duração, 16% descontinuaram o tratamento devido a uma reação adversa, em comparação com 8% de 446 pacientes recebendo placebo. As reações adversas associadas à descontinuação (ou seja, associadas à descontinuação em pelo menos 1% dos pacientes tratados com CELEXA a uma taxa pelo menos duas vezes maior que a do placebo) são mostradas na Tabela 2.
A Tabela 3 enumera a incidência de reações adversas que ocorreram entre 1.063 pacientes com TDM que receberam CELEXA 20 mg em doses variando de 10 mg a 80 mg uma vez ao dia em estudos controlados por placebo com duração de até 6 semanas.
A reação adversa mais comum que ocorreu em pacientes tratados com CELEXA com incidência de 5% ou mais e pelo menos duas vezes a incidência em pacientes com placebo foi distúrbio de ejaculação (principalmente atraso ejaculatório) em pacientes do sexo masculino (ver Tabela 3).
Reações Adversas Dependentes da Dose
relação potencial entre a dosagem de CELEXA 10 mg e a incidência de reações adversas foi examinada em um estudo de dose fixa em pacientes com MDD recebendo placebo ou CELEXA 10 mg, 20 mg 40 mg ou 60 mg (1,5 vezes a dose máxima recomendada) . Uma resposta positiva à dose (p
Disfunção sexual masculina e feminina com ISRSs
Embora as alterações no desejo sexual, desempenho sexual e satisfação sexual ocorram frequentemente como manifestações de um transtorno psiquiátrico, elas também podem ser consequência do tratamento com ISRS. No entanto, estimativas confiáveis da incidência e gravidade de experiências indesejáveis envolvendo desejo sexual, desempenho e satisfação são difíceis de obter, em parte porque pacientes e profissionais de saúde podem relutar em discuti-las. Assim, as estimativas da incidência de experiência sexual e desempenho indesejáveis citados na rotulagem podem subestimar sua incidência real.
A Tabela 4 mostra a incidência de reações adversas sexuais relatadas por pelo menos 2% dos pacientes do sexo masculino tomando CELEXA 20mg em um conjunto de ensaios clínicos controlados por placebo em pacientes com depressão.
Em pacientes deprimidas do sexo feminino recebendo CELEXA 20mg, a incidência relatada de diminuição da libido e anorgasmia foi de 1,3% (n=638 mulheres) e 1,1% (n=252 mulheres), respectivamente.
Alterações de peso
Os pacientes tratados com CELEXA em estudos controlados apresentaram uma perda de peso de cerca de 0,5 kg em comparação com nenhuma alteração para os pacientes que receberam placebo.
Alterações de ECG
Em um estudo QT completo, CELEXA foi associado a um aumento dependente da dose no intervalo QTc.
Os eletrocardiogramas dos grupos CELEXA (N=802) e placebo (N=241) foram comparados em relação aos valores discrepantes definidos como indivíduos com alterações de QTc acima de 60 mseg em relação à linha de base ou valores absolutos acima de 500 mseg após a dose, e indivíduos com aumento da frequência cardíaca para acima de 100 bpm ou diminui para menos de 50 bpm com uma alteração de 25% da linha de base (outliers taquicárdicos ou bradicárdicos, respectivamente). No grupo CELEXA, 1,9% dos pacientes tiveram uma alteração da linha de base no QTcF >60 mseg em comparação com 1,2% dos pacientes no grupo placebo. Nenhum dos pacientes do grupo placebo apresentou QTcF pós-dose >500 mseg em comparação com 0,5% dos pacientes do grupo CELEXA 10mg. A incidência de valores discrepantes taquicárdicos foi de 0,5% no grupo CELEXA e 0,4% no grupo placebo. A incidência de valores discrepantes bradicárdicos foi de 0,9% no grupo CELEXA 10mg e 0,4% no grupo placebo.
Outras reações adversas observadas durante a avaliação pré-comercialização de CELEXA
lista a seguir de reações adversas não inclui reações que são: 1) incluídas na Tabela 3 ou em outro lugar na bula, 2) para as quais a causa do medicamento era remota, 3) que eram tão gerais que não eram informativas e aquelas que ocorrem apenas em um paciente.
As reações adversas são categorizadas por sistema corporal e listadas em ordem decrescente de frequência de acordo com as seguintes definições: reações adversas frequentes são aquelas que ocorrem em uma ou mais ocasiões em pelo menos 1/100 pacientes; reações adversas infrequentes são aquelas que ocorrem em menos de 1/100 pacientes a 1/1.000 pacientes; reações adversas raras são aquelas que ocorrem em menos de 1/1.000 pacientes.
Cardiovascular - Frequentes: taquicardia, hipotensão postural, hipotensão. Infrequentes: hipertensão, bradicardia, edema (extremidades), angina pectoris, extrassístoles, insuficiência cardíaca, rubor, infarto do miocárdio, acidente vascular cerebral, isquemia do miocárdio. Raros: ataque isquêmico transitório, flebite, fibrilação atrial, parada cardíaca, bloqueio de ramo.
Distúrbios do Sistema Nervoso Central e Periférico -Frequentes: parestesia, enxaqueca. Infrequentes: hipercinesia, vertigem, hipertonia, distúrbio extrapiramidal, cãibras nas pernas, contrações musculares involuntárias, hipocinesia, neuralgia, distonia, marcha anormal, hipoestesia, ataxia. Raros: coordenação anormal, hiperestesia, ptose, estupor.
Distúrbios Endócrinos -Raros: hipotireoidismo, bócio, ginecomastia.
Problemas gastrointestinais -Frequentes: saliva aumentada, flatulência. Infrequentes: gastrite, gastroenterite, estomatite, eructação, hemorroidas, disfagia, ranger de dentes, gengivite, esofagite. Raros: colite, úlcera gástrica, colecistite, colelitíase, úlcera duodenal, refluxo gastroesofágico, glossite, icterícia, diverticulite, hemorragia retal, soluços.
Geral - Pouco frequente : afrontamentos, calafrios, intolerância ao álcool, síncope, sintomas semelhantes aos da gripe. Raros: febre do feno.
Distúrbios Hemicos e Linfáticos -Infrequentes: púrpura, anemia, epistaxe, leucocitose, leucopenia, linfadenopatia. Raros: embolia pulmonar, granulocitopenia, linfocitose, linfopenia, anemia hipocrômica, distúrbio de coagulação, sangramento gengival.
Distúrbios metabólicos e nutricionais -Frequentes: diminuição de peso, aumento de peso. Infrequentes: aumento das enzimas hepáticas, sede, olhos secos, aumento da fosfatase alcalina, tolerância anormal à glicose. Raros: bilirrubinemia, hipocalemia, obesidade, hipoglicemia, hepatite, desidratação.
Distúrbios do sistema musculoesquelético -Infreqüentes: artrite, fraqueza muscular, dor esquelética. Raros: bursite, osteoporose.
Distúrbios psiquiátricos -Frequentes: concentração prejudicada, amnésia, apatia, depressão, aumento do apetite, depressão agravada, tentativa de suicídio, confusão. Infrequentes: aumento da libido, reação agressiva, paroniria, dependência de drogas, despersonalização, alucinação, euforia, depressão psicótica, delírio, reação paranóide, labilidade emocional, reação de pânico, psicose. Raros: reação catatônica, melancolia.
Distúrbios Reprodutivos/Feminino* -Frequentes: amenorréia. Infrequentes: galactorréia, dor mamária, aumento mamário, hemorragia vaginal. (*% com base apenas em indivíduos do sexo feminino: 2955)
Distúrbios do Sistema Respiratório -Frequente: tosse. Infrequentes: bronquite, dispnéia, pneumonia. Raros: asma, laringite, broncoespasmo, pneumonite, escarro aumentado.
Distúrbios da Pele e Apêndices - Frequentes: erupção cutânea, prurido. Infrequentes: reação de fotossensibilidade, urticária, acne, descoloração da pele, eczema, alopecia, dermatite, pele seca, psoríase. Raros: hipertricose, sudorese diminuída, melanose, ceratite, celulite, prurido anal.
Sentidos Especiais - Frequentes: acomodação anormal, alteração do paladar. Infrequentes: zumbido, conjuntivite, dor ocular. Raros: midríase, fotofobia, diplopia, lacrimejamento anormal, catarata, perda do paladar.
Distúrbios do Sistema Urinário - Frequentes: poliúria. Infrequentes: frequência de micção, incontinência urinária, retenção urinária, disúria. Raros: edema facial, hematúria, oligúria, pielonefrite, cálculo renal, dor renal.
Experiência pós-marketing
As seguintes reações adversas foram identificadas durante o uso pós-aprovação de citalopram, o racemato, ou escitalopram, o S-enantiômero do citalopram. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento.
Distúrbios do Sangue e do Sistema Linfático: anemia hemolítica, trombocitopenia, diminuição da protrombina
Distúrbios cardíacos: torsade de pointes, arritmia ventricular, QT prolongado
Distúrbios Endócrinos: hiperprolactinemia
Distúrbios oculares: glaucoma de ângulo fechado
Problemas gastrointestinais: hemorragia gastrointestinal, pancreatite
Distúrbios Gerais e Condições do Local Administrativo: síndrome de abstinência
Distúrbios hepatobiliares: necrose hepática
Distúrbios do sistema imunológico: anafilaxia, reação alérgica
Distúrbios musculoesqueléticos e do tecido conjuntivo: rabdomiólise
Distúrbios do sistema nervoso: convulsão(ões) de grande mal, mioclonia, coreoatetose, discinesia, acatisia, nistagmo
Gravidez, Puerpério e Condições Perinatais: aborto espontâneo
Distúrbios psiquiátricos: delírio
Distúrbios Renais e Urinários: Insuficiência renal aguda
Distúrbios do sistema reprodutor e da mama: priapismo
Distúrbios da Pele e Tecidos Subcutâneos: Síndrome de Stevens Johnson, necrólise epidérmica, angioedema, eritema multiforme, equimose
Distúrbios Vasculares: trombose
INTERAÇÕES MEDICAMENTOSAS
A Tabela 5 apresenta interações medicamentosas clinicamente importantes com CELEXA.
Abuso e Dependência de Drogas
Substância controlada
CELEXA (citalopram HBr) não é uma substância controlada.
Abuso
Estudos em animais sugerem que a responsabilidade de abuso de CELEXA 20mg é baixa. CELEXA não foi sistematicamente estudado em humanos quanto ao seu potencial de abuso, tolerância ou dependência física. A experiência clínica pré-comercialização com CELEXA não revelou qualquer comportamento de procura de medicamentos. No entanto, essas observações não foram sistemáticas e não é possível prever, com base nessa experiência limitada, até que ponto uma droga ativa no SNC será mal utilizada, desviada e/ou abusada depois de comercializada. Consequentemente, os profissionais de saúde devem avaliar cuidadosamente os pacientes com CELEXA 20mg quanto ao histórico de abuso de drogas e acompanhá-los de perto, observando-os quanto a sinais de uso indevido ou abuso (por exemplo, desenvolvimento de tolerância, aumentos de dose, comportamento de busca de drogas).
AVISOS
Incluído como parte do PRECAUÇÕES seção.
PRECAUÇÕES
Pensamentos e Comportamentos Suicidas em Adolescentes e Jovens Adultos
Em análises agrupadas de estudos controlados por placebo de medicamentos antidepressivos (ISRSs e outras classes de antidepressivos) que incluíram aproximadamente 77.000 pacientes adultos e 4.500 pacientes pediátricos, a incidência de pensamentos e comportamentos suicidas em pacientes tratados com antidepressivos com 24 anos ou menos foi maior do que em pacientes tratados com placebo. Houve variação considerável no risco de pensamentos e comportamentos suicidas entre os medicamentos, mas houve um aumento do risco identificado em pacientes jovens para a maioria dos medicamentos estudados. Houve diferenças no risco absoluto de pensamentos e comportamentos suicidas entre as diferentes indicações, com maior incidência em pacientes com TDM. As diferenças droga-placebo no número de casos de pensamentos e comportamentos suicidas por 1.000 pacientes tratados são fornecidas na Tabela 1.
Não se sabe se o risco de pensamentos e comportamentos suicidas em crianças, adolescentes e adultos jovens se estende ao uso a longo prazo, ou seja, além de quatro meses. No entanto, há evidências substanciais de ensaios de manutenção controlados por placebo em adultos com TDM de que os antidepressivos retardam a recorrência da depressão e que a própria depressão é um fator de risco para pensamentos e comportamentos suicidas.
Monitorar todos os pacientes tratados com antidepressivos quanto à piora clínica e surgimento de pensamentos e comportamentos suicidas, especialmente durante os primeiros meses de terapia medicamentosa e em momentos de mudanças de dosagem. Aconselhar os familiares ou cuidadores de pacientes a monitorar mudanças de comportamento e alertar o profissional de saúde. Considere mudar o regime terapêutico, incluindo possivelmente a descontinuação de CELEXA, em pacientes cuja depressão é persistentemente pior, ou que estão experimentando pensamentos ou comportamentos suicidas emergentes.
Prolongamento QT e Torsade De Pointes
CELEXA causa prolongamento do intervalo QTc dependente da dose, uma anormalidade no ECG que tem sido associada a Torsade de Pointes (TdP), taquicardia ventricular e morte súbita, todos observados em notificações pós-comercialização do citalopram [ver REAÇÕES ADVERSAS ].
Devido ao risco de prolongamento do intervalo QTc em doses mais altas de CELEXA 20 mg, recomenda-se que CELEXA não seja administrado em doses acima de 40 mg uma vez ao dia [ver DOSAGEM E ADMINISTRAÇÃO , FARMACOLOGIA CLÍNICA ].
CELEXA deve ser evitado em pacientes com síndrome congênita do QT longo, bradicardia, hipocalemia ou hipomagnesemia, infarto agudo do miocárdio recente ou insuficiência cardíaca descompensada, a menos que os benefícios superem os riscos para um paciente em particular. CELEXA também deve ser evitado em pacientes que estejam tomando outros medicamentos que prolongam o intervalo QTc [ver INTERAÇÕES MEDICAMENTOSAS ]. Esses medicamentos incluem medicamentos antiarrítmicos de classe 1A (por exemplo, quinidina, procainamida) ou classe III (por exemplo, amiodarona, sotalol), medicamentos antipsicóticos (por exemplo, clorpromazina, tioridazina), antibióticos (por exemplo, gatifloxacina, moxifloxacina) ou qualquer outra classe de medicamentos conhecido por prolongar o intervalo QTc (por exemplo, pentamidina, acetato de levometadil, metadona).
A dose de citalopram deve ser limitada em certas populações. A dose máxima deve ser limitada a 20 mg uma vez ao dia em pacientes que são metabolizadores fracos do CYP2C19 ou naqueles pacientes que recebem cimetidina concomitante ou outro inibidor do CYP2C19, uma vez que seriam esperadas exposições mais altas ao citalopram. A dose máxima também deve ser limitada a 20 mg uma vez ao dia em pacientes com insuficiência hepática e em pacientes com mais de 60 anos de idade devido a exposições mais altas esperadas [ver DOSAGEM E ADMINISTRAÇÃO , INTERAÇÕES MEDICAMENTOSAS , Uso em populações específicas , FARMACOLOGIA CLÍNICA ].
monitoramento de eletrólitos e/ou ECG é recomendado em determinadas circunstâncias. Os pacientes considerados para tratamento com CELEXA 20mg que estão em risco de distúrbios eletrolíticos significativos devem ter medições basais de potássio e magnésio séricos com monitoramento periódico. A hipocalemia (e/ou hipomagnesemia) pode aumentar o risco de prolongamento do intervalo QTc e arritmia e deve ser corrigida antes do início do tratamento e monitorada periodicamente. O monitoramento de ECG é recomendado em pacientes para os quais o uso de CELEXA 10mg não é recomendado, a menos que os benefícios superem claramente os riscos para um paciente específico (consulte acima de ). Estes incluem aqueles pacientes com as condições cardíacas mencionadas acima e aqueles que tomam outros medicamentos que podem prolongar o intervalo QTc.
Descontinuar CELEXA 10mg em pacientes que apresentarem medições de QTc persistentes > 500 ms. Se os pacientes tomando CELEXA apresentarem sintomas que possam indicar a ocorrência de arritmias cardíacas, por exemplo, tontura, palpitações ou síncope, o prescritor deve iniciar uma avaliação adicional, incluindo monitoramento cardíaco.
Síndrome da serotonina
ISRSs, incluindo CELEXA 20mg, podem precipitar a síndrome serotoninérgica, uma condição potencialmente fatal. O risco aumenta com o uso concomitante de outros medicamentos serotoninérgicos (incluindo triptanos, antidepressivos tricíclicos, fentanil, lítio, tramadol, triptofano, buspirona, anfetaminas e erva de São João) e com medicamentos que prejudicam o metabolismo da serotonina, ou seja, IMAOs [ver CONTRA-INDICAÇÕES , INTERAÇÕES MEDICAMENTOSAS ]. A síndrome serotoninérgica também pode ocorrer quando esses medicamentos são usados isoladamente. Os sintomas da síndrome serotoninérgica foram observados em 0,1% dos pacientes com MDD tratados com CELEXA 20mg em ensaios clínicos pré-comercialização.
Os sinais e sintomas da síndrome serotoninérgica podem incluir alterações do estado mental (p. rigidez, mioclonia, hiperreflexia, incoordenação), convulsões e sintomas gastrointestinais (p.
O uso concomitante de CELEXA com IMAOs é contraindicado. Além disso, não inicie CELEXA 20mg em um paciente em tratamento com IMAOs, como linezolida ou azul de metileno intravenoso. Nenhum relato envolveu a administração de azul de metileno por outras vias (como comprimidos orais ou injeção local no tecido). Se for necessário iniciar o tratamento com um IMAO, como linezolida ou azul de metileno intravenoso em um paciente tomando CELEXA 10mg, descontinue CELEXA 20mg antes de iniciar o tratamento com o IMAO [ver CONTRA-INDICAÇÕES , INTERAÇÕES MEDICAMENTOSAS ].
Monitore todos os pacientes tomando CELEXA 20mg para o surgimento da síndrome serotoninérgica. Interrompa o tratamento com CELEXA e quaisquer agentes serotoninérgicos concomitantes imediatamente se ocorrerem os sintomas acima e inicie o tratamento sintomático de suporte. Se o uso concomitante de CELEXA com outros medicamentos serotoninérgicos for clinicamente justificado, informe os pacientes sobre o risco aumentado de síndrome serotoninérgica e monitore os sintomas.
Aumento do risco de sangramento
Medicamentos que interferem na inibição da recaptação de serotonina, incluindo CELEXA 20mg, aumentam o risco de eventos hemorrágicos. O uso concomitante de aspirina, anti-inflamatórios não esteroides (AINEs), outros antiplaquetários, varfarina e outros anticoagulantes pode aumentar esse risco. Relatos de casos e estudos epidemiológicos (caso-controle e desenho de coorte) têm demonstrado associação entre o uso de drogas que interferem na recaptação de serotonina e a ocorrência de sangramento gastrointestinal. Eventos de sangramento relacionados a drogas que interferem na recaptação de serotonina variam de equimose, hematoma, epistaxe e petéquias a hemorragias com risco de vida.
Informe os pacientes sobre o risco aumentado de sangramento associado ao uso concomitante de CELEXA 20mg e agentes antiplaquetários ou anticoagulantes. Para pacientes em uso de varfarina, monitore cuidadosamente a razão normalizada internacional [ver INTERAÇÕES MEDICAMENTOSAS ].
Ativação de mania ou hipomania
Em pacientes com transtorno bipolar, o tratamento de um episódio depressivo com CELEXA ou outro antidepressivo pode precipitar um episódio misto/maníaco. Em ensaios clínicos controlados, os pacientes com transtorno bipolar foram excluídos; entretanto, sintomas de mania ou hipomania foram relatados em 0,1% dos pacientes não diagnosticados tratados com CELEXA. Antes de iniciar o tratamento com CELEXA 10mg, rastreie os pacientes para qualquer história pessoal ou familiar de transtorno bipolar, mania ou hipomania [ver DOSAGEM E ADMINISTRAÇÃO ].
Síndrome de descontinuação
As reações adversas após a descontinuação de antidepressivos serotoninérgicos, particularmente após a descontinuação abrupta, incluem: náusea, sudorese, humor disfórico, irritabilidade, agitação, tontura, distúrbios sensoriais (por exemplo, parestesia, como sensações de choque elétrico), tremor, ansiedade, confusão, dor de cabeça, letargia, labilidade emocional, insônia, hipomania, zumbido e convulsões. Recomenda-se uma redução gradual da dosagem em vez de uma interrupção abrupta sempre que possível [ver DOSAGEM E ADMINISTRAÇÃO ].
Convulsões
CELEXA 20mg não foi sistematicamente avaliado em pacientes com distúrbios convulsivos. Pacientes com histórico de convulsões foram excluídos dos estudos clínicos. Nos ensaios clínicos de CELEXA 20mg, ocorreram convulsões em 0,3% dos pacientes tratados com CELEXA (taxa de um paciente por 98 anos de exposição) e 0,5% dos pacientes tratados com placebo (taxa de um paciente por 50 anos de exposição). CELEXA 10mg deve ser prescrito com cautela em pacientes com distúrbios convulsivos.
Glaucoma de ângulo fechado
A dilatação pupilar que ocorre após o uso de muitos medicamentos antidepressivos, incluindo CELEXA, pode desencadear um ataque de fechamento angular em um paciente com ângulos anatomicamente estreitos que não tenha uma iridectomia patente. Evite o uso de antidepressivos, incluindo CELEXA, em pacientes com ângulos anatomicamente estreitos não tratados.
Hiponatremia
hiponatremia pode ocorrer como resultado do tratamento com ISRSs, incluindo CELEXA. Foram notificados casos de sódio sérico inferior a 110 mmol/L. Sinais e sintomas de hiponatremia incluem dor de cabeça, dificuldade de concentração, comprometimento da memória, confusão, fraqueza e instabilidade, o que pode levar a quedas. Sinais e sintomas associados a casos mais graves e/ou agudos incluem alucinação, síncope, convulsão, coma, parada respiratória e morte. Em muitos casos, essa hiponatremia parece ser o resultado da síndrome da secreção inapropriada do hormônio antidiurético (SIADH).
Em pacientes com hiponatremia sintomática, descontinuar CELEXA e instituir intervenção médica apropriada. Pacientes idosos, pacientes em uso de diuréticos e aqueles com depleção de volume podem ter maior risco de desenvolver hiponatremia com ISRSs [ver Uso em populações específicas ].
Disfunção Sexual
O uso de ISRSs, incluindo CELEXA, pode causar sintomas de disfunção sexual [ver REAÇÕES ADVERSAS ]. Em pacientes do sexo masculino, o uso de ISRS pode resultar em atraso ou falha ejaculatória, diminuição da libido e disfunção erétil. Em pacientes do sexo feminino, o uso de ISRS pode resultar em diminuição da libido e orgasmo atrasado ou ausente.
É importante que os prescritores perguntem sobre a função sexual antes do início de CELEXA e perguntem especificamente sobre alterações na função sexual durante o tratamento, porque a função sexual pode não ser relatada espontaneamente. Ao avaliar as alterações na função sexual, é importante obter uma história detalhada (incluindo o momento do início dos sintomas) porque os sintomas sexuais podem ter outras causas, incluindo o transtorno psiquiátrico subjacente. Discutir estratégias de gestão potenciais para apoiar os pacientes na tomada de decisões informadas sobre o tratamento.
Informações de Aconselhamento do Paciente
Aconselhe o paciente a ler o rótulo do paciente aprovado pela FDA ( Guia de Medicação ).
Pensamentos e Comportamentos Suicidas
Aconselhe os pacientes e cuidadores a procurarem o surgimento de tendências suicidas, especialmente no início do tratamento e quando a dosagem for ajustada para cima ou para baixo, e instrua-os a relatar esses sintomas ao profissional de saúde [ver AVISO EM CAIXA , AVISOS E PRECAUÇÕES ].
Prolongamento QT e Torsade De Pointes
Aconselhe os pacientes a consultar seu médico imediatamente se sentirem desmaios, perderem a consciência ou tiverem palpitações cardíacas. Instrua os pacientes a informar seu médico de que estão tomando CELEXA antes de tomar qualquer novo medicamento [ver AVISOS E PRECAUÇÕES , INTERAÇÕES MEDICAMENTOSAS ].
Síndrome da serotonina
Alertar os pacientes sobre o risco de síndrome serotoninérgica, particularmente com o uso concomitante de CELEXA 20mg com outros medicamentos serotoninérgicos, incluindo triptanos, antidepressivos tricíclicos, fentanil, lítio, tramadol, triptofano, buspirona, anfetaminas, Erva de São João e com medicamentos que prejudicam o metabolismo da serotonina (em particular, IMAOs, tanto os destinados a tratar distúrbios psiquiátricos como também outros, como a linezolida). Instrua os pacientes a entrar em contato com seu médico ou se reportar ao pronto-socorro se apresentarem sinais ou sintomas de síndrome serotoninérgica [ver AVISOS E PRECAUÇÕES , INTERAÇÕES MEDICAMENTOSAS ].
Aumento do risco de sangramento
Informe os pacientes sobre o uso concomitante de CELEXA 10mg com aspirina, AINEs, outros medicamentos antiplaquetários, varfarina ou outros anticoagulantes, pois o uso combinado foi associado a um risco aumentado de sangramento. Aconselhe os pacientes a informar seus profissionais de saúde se estiverem tomando ou planejando tomar algum medicamento prescrito ou de venda livre que aumente o risco de sangramento [ver AVISOS E PRECAUÇÕES ].
Ativação de mania ou hipomania
Aconselhe os pacientes e seus cuidadores a observar sinais de ativação de mania/hipomania e instrua-os a relatar tais sintomas ao profissional de saúde [ver AVISOS E PRECAUÇÕES ].
Síndrome de descontinuação
Aconselhe os pacientes a não descontinuar abruptamente CELEXA e a discutir qualquer regime de redução gradual com seu médico. Informe os pacientes que reações adversas podem ocorrer quando CELEXA 20mg é descontinuado [Consulte AVISOS E PRECAUÇÕES ].
Disfunção Sexual
Avise os pacientes que o uso de CELEXA pode causar sintomas de disfunção sexual em pacientes do sexo masculino e feminino. Informe os pacientes que eles devem discutir quaisquer alterações na função sexual e possíveis estratégias de manejo com seu médico [ver AVISOS E PRECAUÇÕES ].
Gravidez
- Aconselhe as pacientes a notificarem seu médico se engravidarem ou pretenderem engravidar durante o tratamento com CELEXA [ver Uso em populações específicas ].
- Aconselhe as pacientes que o uso de CELEXA no final da gravidez pode levar a um risco aumentado de complicações neonatais que requerem hospitalização prolongada, suporte respiratório, alimentação por sonda e/ou hipertensão pulmonar persistente do recém-nascido (HPPRN) [ver Uso em populações específicas ].
- Aconselhe as mulheres que existe um registro de exposição à gravidez que monitora os resultados da gravidez em mulheres expostas ao citalopram durante a gravidez [ver Uso em populações específicas ].
Lactação
Aconselhe as mulheres que amamentam a monitorar os bebês quanto a sedação excessiva, inquietação, agitação, má alimentação e baixo ganho de peso e a procurar atendimento médico se notarem esses sinais [ver Uso em populações específicas ].
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Carcinogênese
Citalopram aumentou a incidência de carcinoma de intestino delgado em ratos tratados por 24 meses com doses de 8 e 24 mg/kg/dia na dieta, que são aproximadamente 2 e 6 vezes a Dose Humana Máxima Recomendada (MRHD) de 40 mg, respectivamente, com base na área de superfície corporal em mg/m². Um nível sem efeito (NOEL) para este achado não foi estabelecido.
Citalopram não aumentou a incidência de tumores em camundongos tratados por 18 meses com doses de até 240 mg/kg/dia na dieta, que é aproximadamente 30 vezes o MRDH de 40 mg com base em mg/m² de área de superfície corporal.
Mutagênese
Citalopram foi mutagênico no ensaio de mutação reversa bacteriana in vitro (teste de Ames) em 2 de 5 cepas bacterianas (Salmonella TA98 e TA1537) na ausência de ativação metabólica. Foi clastogênico no ensaio in vitro de células pulmonares de hamster chinês para aberrações cromossômicas na presença e ausência de ativação metabólica. O citalopram não foi mutagênico no ensaio de mutação genética direta em mamíferos (HPRT) in vitro em células de linfoma de camundongo ou no ensaio de síntese de DNA não programada (UDS) in vitro/in vivo em fígado de rato. Não foi clastogênico no ensaio in vitro de aberrações cromossômicas em linfócitos humanos ou em dois ensaios in vivo de micronúcleos em camundongos.
Prejuízo da Fertilidade
Citalopram foi administrado oralmente a ratos fêmeas e machos em doses de 32, 48 e 72 mg/kg/dia antes e durante o acasalamento e continuando a gestação. Essas doses são aproximadamente 8, 12 e 17 vezes a MRHD de 40 mg com base na área de superfície corporal em mg/m². O acasalamento e a fertilidade diminuíram em doses ≥ 32 mg/kg/dia, que é aproximadamente 8 vezes a MRHD.
A duração da gestação foi aumentada em 48 mg/kg/dia, que é aproximadamente 12 vezes a MRHD.
Uso em populações específicas
Gravidez
Registro de Exposição à Gravidez
Existe um registro de exposição à gravidez que monitora os resultados da gravidez em mulheres expostas a antidepressivos durante a gravidez. Os profissionais de saúde são incentivados a registrar pacientes ligando para o Registro Nacional de Gravidez para Antidepressivos em 1-844-405-6185 ou visitando on-line em https://womensmentalhealth.org/research/pregnancyregistry/antidepressants.
Resumo do risco
Os dados disponíveis de estudos epidemiológicos publicados e relatórios pós-comercialização com o uso de citalopram na gravidez não estabeleceram um risco aumentado de defeitos congênitos graves ou aborto espontâneo. Estudos publicados demonstraram que os níveis de citalopram no sangue do cordão umbilical e no líquido amniótico são semelhantes aos observados no soro materno. Existem riscos de hipertensão pulmonar persistente do recém-nascido (HPPRN) (ver Dados ) e/ou má adaptação neonatal com exposição a inibidores seletivos da recaptação de serotonina (ISRSs), incluindo CELEXA, durante a gravidez. Existem também riscos associados à depressão não tratada na gravidez (ver Considerações Clínicas ).
Em estudos de reprodução animal, o citalopram causou efeitos adversos embrionários/fetais em doses que causaram toxicidade materna (ver Dados ).
risco de fundo estimado de defeitos congênitos graves e aborto espontâneo para a população indicada é desconhecido. Todas as gestações têm um risco histórico de defeitos congênitos, perda ou outros resultados adversos. Na população geral dos EUA, o risco de fundo estimado de grandes defeitos congênitos e aborto nas gestações clinicamente reconhecidas é de 2% a 4% e 15% a 20%, respectivamente.
Considerações Clínicas
Risco Materno e/ou Embrião/Fetal Associado à Doença
As mulheres que descontinuam os antidepressivos durante a gravidez são mais propensas a ter uma recaída de depressão maior do que as mulheres que continuam os antidepressivos. Esse achado é de um estudo longitudinal prospectivo de 201 gestantes com histórico de transtorno depressivo maior que estavam eutímicas e tomavam antidepressivos no início da gravidez. Considere o risco de depressão não tratada ao interromper ou alterar o tratamento com medicação antidepressiva durante a gravidez e pós-parto.
Reações Adversas Fetais/Neonatais
Recém-nascidos expostos a CELEXA e outros ISRSs no final do terceiro trimestre desenvolveram complicações que requerem hospitalização prolongada, suporte respiratório e alimentação por sonda. Tais complicações podem surgir imediatamente após o parto. Os achados clínicos relatados incluíram desconforto respiratório, cianose, apnéia, convulsões, instabilidade de temperatura, dificuldade de alimentação, vômitos, hipoglicemia, hipotonia, hipertonia, hiperreflexia, tremor, nervosismo, irritabilidade e choro constante. Esses achados são consistentes com um efeito tóxico direto dos ISRSs ou possivelmente uma síndrome de descontinuação do medicamento. Deve-se notar que, em alguns casos, o quadro clínico é compatível com síndrome serotoninérgica [ver AVISOS E PRECAUÇÕES ].
Dados
Dados humanos
A exposição durante o final da gravidez aos ISRSs pode aumentar o risco de hipertensão pulmonar persistente do recém-nascido (HPPRN). A HPPN ocorre em 1-2 por 1.000 nascidos vivos na população geral e está associada a uma substancial morbidade e mortalidade neonatal.
Dados de animais
Citalopram foi administrado por via oral a ratas grávidas durante o período de organogênese em doses de 32, 56 e 112 mg/kg/dia, que são aproximadamente 8, 14 e 27 vezes a Dose Humana Máxima Recomendada (MRHD) de 40 mg, com base em mg/m² de área de superfície corporal. Citalopram causou toxicidade materna dos sinais clínicos do SNC e diminuição do ganho de peso na dose de 112 mg/kg/dia, que é 27 vezes a MRHD. Nesta dose tóxica materna, o citalopram diminuiu o crescimento e a sobrevivência embrionário/fetal e aumentou as anomalias fetais (incluindo defeitos cardiovasculares e esqueléticos). O nível de efeito adverso não observado (NOAEL) para toxicidade materna e embriofetal é de 56 mg/kg/dia, que é aproximadamente 14 vezes o MRHD.
Citalopram foi administrado por via oral a coelhas grávidas durante o período de organogênese em doses de até 16 mg/kg/dia, que é aproximadamente 8 vezes a MRHD de 40 mg, com base em mg/m² de área de superfície corporal. Não foi observada toxicidade materna ou embriofetal. O NOAEL para toxicidade materna e embriofetal é de 16 mg/kg/dia, que é aproximadamente 8 vezes o MRHD.
Citalopram foi administrado por via oral a ratas prenhes durante o final da gestação e períodos de lactação em doses de 4,8, 12,8 e 32 mg/kg/dia, que são aproximadamente 1, 3 e 8 vezes a MRHD de 40 mg, com base em mg/m² corporal área de superfície. O citalopram aumentou a mortalidade da prole durante os primeiros 4 dias de nascimento e diminuiu o crescimento da prole na dose de 32 mg/kg/dia, que é aproximadamente 8 vezes a MRHD. O NOAEL para toxicidade no desenvolvimento é de 12,8 mg/kg/dia, que é aproximadamente 3 vezes o MRHD. Em um estudo separado, efeitos semelhantes na mortalidade e no crescimento da prole foram observados quando as mães foram tratadas durante toda a gestação e início da lactação em doses ≥ 24 mg/kg/dia, que é aproximadamente 6 vezes a MRHD. Um NOAEL não foi determinado nesse estudo.
Lactação
Resumo do risco
Dados da literatura publicada relatam a presença de citalopram no leite humano em doses infantis relativas variando entre 0,7 a 9,4% da dosagem ajustada ao peso materno e uma relação leite/plasma variando entre 0,78 a 4,3. Há relatos de crianças amamentadas expostas ao citalopram apresentando irritabilidade, inquietação, sonolência excessiva, diminuição da alimentação e perda de peso (ver Considerações Clínicas ). Não há informações sobre os efeitos do citalopram na produção de leite.
Os benefícios da amamentação para o desenvolvimento e para a saúde devem ser considerados juntamente com a necessidade clínica da mãe de CELEXA 20mg e quaisquer potenciais efeitos adversos na criança amamentada de CELEXA 20mg ou da condição materna subjacente.
Considerações Clínicas
Monitorar os bebês lactantes quanto a reações adversas, como irritabilidade, inquietação, sonolência excessiva, diminuição da alimentação e perda de peso.
Uso Pediátrico
segurança e eficácia de CELEXA não foram estabelecidas em pacientes pediátricos. Dois estudos controlados por placebo em 407 pacientes pediátricos com TDM foram conduzidos com CELEXA 20mg, e os dados não foram suficientes para apoiar o uso em pacientes pediátricos.
Os antidepressivos aumentam o risco de pensamentos e comportamentos suicidas em pacientes pediátricos [ver AVISO EM CAIXA , AVISOS E PRECAUÇÕES ]. Diminuição do apetite e perda de peso foram observadas em associação com o uso de ISRSs em pacientes pediátricos.
Uso Geriátrico
Dos 4.422 pacientes em estudos clínicos de CELEXA 20mg, 1.357 tinham 60 anos ou mais, 1.034 tinham 65 anos ou mais e 457 tinham 75 anos ou mais. Em dois estudos farmacocinéticos, a AUC do citalopram foi aumentada em 23% e 30%, respectivamente, em indivíduos ≥ 60 anos de idade em comparação com indivíduos mais jovens, e sua meia-vida foi aumentada em 30% e 50%, respectivamente [ver FARMACOLOGIA CLÍNICA ]. Portanto, a dose máxima recomendada em pacientes com 60 anos ou mais é menor do que em pacientes mais jovens. DOSAGEM E ADMINISTRAÇÃO , AVISOS E PRECAUÇÕES ].
ISRSs, incluindo CELEXA, foram associados a casos de hiponatremia clinicamente significativa em pacientes idosos, que podem estar em maior risco para esta reação adversa [ver AVISOS E PRECAUÇÕES ].
Insuficiência hepática
O aumento da exposição ao citalopram ocorre em pacientes com insuficiência hepática. A dose máxima recomendada de CELEXA 10mg é menor em pacientes com insuficiência hepática [ver DOSAGEM E ADMINISTRAÇÃO , FARMACOLOGIA CLÍNICA ].
SOBREDOSAGEM
Os seguintes casos foram relatados com superdosagem de Celexa:
- Convulsões, que podem ser retardadas, e estado mental alterado, incluindo coma.
- Toxicidade cardiovascular, que pode ser retardada, incluindo prolongamento do intervalo QRS e QTc, taquiarritmias de complexo largo e torsade de pointes. A hipertensão é mais comumente observada, mas raramente pode ocorrer hipotensão isoladamente ou com co-ingestantes, incluindo álcool.
- Síndrome serotoninérgica (pacientes com superdosagem de múltiplos medicamentos com outros medicamentos proserotonérgicos podem ter um risco maior).
monitoramento cardíaco prolongado é recomendado em ingestas de superdosagem de Celexa devido ao risco de arritmia. A descontaminação gastrointestinal com carvão ativado deve ser considerada em pacientes que se apresentam precocemente após uma superdosagem de Celexa 10mg. Considere entrar em contato com um Centro de Intoxicação (1-800-221-2222) ou um toxicologista médico para recomendações adicionais de gerenciamento de superdosagem.
CONTRA-INDICAÇÕES
CELEXA é contraindicado em pacientes:
- tomar, ou dentro de 14 dias após a interrupção, IMAOs (incluindo IMAOs como linezolida ou azul de metileno intravenoso) devido a um risco aumentado de síndrome serotoninérgica [ver AVISOS E PRECAUÇÕES , INTERAÇÕES MEDICAMENTOSAS ].
- tomando pimozida devido ao risco de prolongamento do intervalo QT [ver INTERAÇÕES MEDICAMENTOSAS ].
- com hipersensibilidade conhecida ao citalopram ou a qualquer um dos ingredientes inativos de CELEXA. As reações incluíram angioedema e anafilaxia [ver REAÇÕES ADVERSAS ].
FARMACOLOGIA CLÍNICA
Mecanismo de ação
mecanismo de ação do citalopram não é claro, mas presume-se que esteja relacionado à potencialização da atividade serotoninérgica no sistema nervoso central (SNC) resultante de sua inibição da recaptação neuronal de serotonina no SNC (5-HT).
Farmacodinâmica
Estudos in vitro e in vivo em animais sugerem que o citalopram é um inibidor seletivo da recaptação de serotonina (ISRS) com efeitos mínimos na recaptação neuronal de norepinefrina (NE) e dopamina (DA).
O citalopram tem nenhuma ou muito baixa afinidade para receptores 5-HT1A, 5-HT2A, dopamina D1 e D2, α1-, α2- e β-adrenérgicos, histamina H1, ácido gama-aminobutírico (GABA), colinérgicos muscarínicos e benzodiazepínicos.
Eletrofisiologia Cardíaca
intervalo QTc (QTcNi) corrigido individualmente foi avaliado em um estudo de dose múltipla, randomizado, controlado por placebo e ativo (moxifloxacina 400 mg) controlado por escalada em 119 indivíduos saudáveis. A diferença média máxima (limite superior do intervalo de confiança unilateral de 95%) em relação ao placebo foi de 8,5 (10,8) e 18,5 (21,0) ms para 20 mg e 60 mg (1,5 vezes a dose máxima recomendada) de citalopram, respectivamente. Com base na relação exposição-resposta estabelecida, a alteração prevista de QTcNi do placebo (limite superior do intervalo de confiança unilateral de 95%) sob a Cmax para a dose de 40 mg é de 12,6 (14,3) ms [ver AVISOS E PRECAUÇÕES ].
Farmacocinética
farmacocinética de dose única e múltipla do citalopram é linear e proporcional à dose em uma faixa de dose de 10 a 40 mg/dia. A biotransformação do citalopram é principalmente hepática, com meia-vida terminal média de cerca de 35 horas. Com a administração de uma vez ao dia, as concentrações plasmáticas no estado de equilíbrio são alcançadas em aproximadamente uma semana. No estado de equilíbrio, espera-se que a extensão do acúmulo de citalopram no plasma, com base na meia-vida, seja 2,5 vezes as concentrações plasmáticas observadas após uma dose única.
Absorção
Após uma dose oral única (comprimido de 40 mg) de citalopram, os níveis sanguíneos de pico ocorrem em cerca de 4 horas. A biodisponibilidade absoluta do citalopram foi de cerca de 80% em relação a uma dose intravenosa, e a absorção não é afetada pelos alimentos.
Distribuição
O volume de distribuição do citalopram é de cerca de 12 L/kg e a ligação do citalopram (CT), demetilcitalopram (DCT) e didemetilcitalopram (DDCT) às proteínas plasmáticas humanas é de cerca de 80%.
Eliminação
Metabolismo
citalopram é metabolizado em demetilcitalopram (DCT), didemetilcitalopram (DDCT), citalopram-N-óxido e um derivado desaminado do ácido propiônico. Em humanos, o citalopram inalterado é o composto predominante no plasma. No estado de equilíbrio, as concentrações dos metabólitos do citalopram, DCT e DDCT, no plasma são aproximadamente metade e um décimo, respectivamente, da droga original. Estudos in vitro mostram que o citalopram é pelo menos 8 vezes mais potente que seus metabólitos na inibição da recaptação da serotonina, sugerindo que os metabólitos avaliados provavelmente não contribuem significativamente para as ações antidepressivas do citalopram.
Estudos in vitro usando microssomas hepáticos humanos indicaram que CYP3A4 e CYP2C19 são as principais isoenzimas envolvidas na N-desmetilação do citalopram.
Excreção
Após administrações intravenosas de citalopram, a fração da droga recuperada na urina como citalopram e DCT foi de cerca de 10% e 5%, respectivamente. A depuração sistêmica do citalopram foi de 330 mL/min, sendo aproximadamente 20% devido à depuração renal.
Populações Específicas
Pacientes Geriátricos
A farmacocinética do citalopram em indivíduos ≥ 60 anos de idade foi comparada com indivíduos mais jovens em dois estudos com voluntários normais. Em um estudo de dose única, a AUC e a meia-vida do citalopram aumentaram nos indivíduos ≥ 60 anos de idade em 30% e 50%, respectivamente, enquanto em um estudo de dose múltipla aumentaram em 23% e 30%, respectivamente [ Vejo DOSAGEM E ADMINISTRAÇÃO , AVISOS E PRECAUÇÕES , Uso em populações específicas ].
Pacientes Masculinos e Femininos
Em três estudos farmacocinéticos (total N=32), a AUC do citalopram em mulheres foi de uma vez e meia a duas vezes a dos homens. Esta diferença não foi observada em cinco outros estudos farmacocinéticos (total N=114). Em estudos clínicos, não foram observadas diferenças nos níveis séricos de citalopram no estado de equilíbrio entre homens (N=237) e mulheres (N=388). Não houve diferenças de gênero na farmacocinética de DCT e DDCT.
Pacientes com Insuficiência Hepática
depuração oral do citalopram foi reduzida em 37% e a meia-vida foi dobrada em pacientes com função hepática reduzida em comparação com indivíduos normais [ver DOSAGEM E ADMINISTRAÇÃO , AVISOS E PRECAUÇÕES , Uso em populações específicas ].
Pacientes com Insuficiência Renal
Em pacientes com insuficiência renal leve a moderada, a depuração oral do citalopram foi reduzida em 17% em comparação com indivíduos normais. Nenhum ajuste de dose para tais pacientes é recomendado. Não há informações disponíveis sobre a farmacocinética do citalopram em pacientes com insuficiência renal grave (clearance de creatinina
Metabolizadores fracos de CYP2C19
Em metabolizadores fracos de CYP2C19, a Cmax e a AUC do citalopram no estado de equilíbrio aumentaram em 68% e 107%, respectivamente [ver DOSAGEM E ADMINISTRAÇÃO , AVISOS E PRECAUÇÕES ].
Metabolizadores fracos de CYP2D6
Os níveis de estado de equilíbrio do citalopram não foram significativamente diferentes em metabolizadores fracos e metabolizadores extensos de CYP2D6.
Estudos de interação medicamentosa
Os dados de inibição enzimática in vitro não revelaram um efeito inibitório do citalopram sobre CYP3A4, -2C9 ou -2E1, mas sugeriram que é um inibidor fraco de CYP1A2, -2D6 e -2C19. Espera-se que o citalopram tenha pouco efeito inibitório no metabolismo in vivo mediado por essas enzimas. No entanto, os dados in vivo para responder a esta questão são limitados.
Inibidores de CYP3A4 e CYP2C19
Uma vez que CYP3A4 e CYP2C19 são as enzimas primárias envolvidas no metabolismo do citalopram, espera-se que inibidores potentes de CYP3A4 (por exemplo, cetoconazol, itraconazol e antibióticos macrolídeos) e inibidores de CYP2C19 (por exemplo, omeprazol, cimetidina) possam diminuir a depuração de citalopram. No entanto, a coadministração de citalopram e o potente inibidor do CYP3A4, cetoconazol, não afetou significativamente a farmacocinética do citalopram. 20 mg/dia é a dose máxima recomendada de citalopram em pacientes que tomam concomitantemente cimetidina ou outro inibidor do CYP2C19, devido ao risco de prolongamento do intervalo QT [ver DOSAGEM E ADMINISTRAÇÃO , AVISOS E PRECAUÇÕES ].
Cimetidina
Em indivíduos que receberam 21 dias de 40 mg/dia de CELEXA 10 mg, a administração combinada de 400 mg de cimetidina duas vezes ao dia por 8 dias resultou em um aumento na AUC e Cmax do citalopram de 43% e 39%, respectivamente [ver DOSAGEM E ADMINISTRAÇÃO , AVISOS E PRECAUÇÕES , INTERAÇÕES MEDICAMENTOSAS ].
Inibidores de CYP2D6
É improvável que a coadministração de um medicamento que inibe o CYP2D6 com citalopram tenha efeitos clinicamente significativos no metabolismo do citalopram, com base nos resultados do estudo em metabolizadores fracos do CYP2D6.
Digoxina
Em indivíduos que receberam 21 dias de 40 mg/dia de CELEXA 20 mg, a administração combinada de CELEXA e digoxina (dose única de 1 mg) não afetou significativamente a farmacocinética do citalopram ou da digoxina.
Lítio
A coadministração de CELEXA (40 mg/dia por 10 dias) e lítio (30 mmol/dia por 5 dias) não teve efeito significativo na farmacocinética de citalopram ou lítio.
Pimozida
Em um estudo controlado, uma dose única de 2 mg de pimozida coadministrada com 40 mg de citalopram administrado uma vez ao dia por 11 dias foi associada a um aumento médio nos valores de QTc de aproximadamente 10 ms em comparação com a pimozida administrada isoladamente. O citalopram não alterou a AUC média ou Cmax da pimozida. O mecanismo dessa interação farmacodinâmica não é conhecido [ver CONTRA-INDICAÇÕES , AVISOS E PRECAUÇÕES ].
Teofilina
A administração combinada de CELEXA (40 mg/dia por 21 dias) e o substrato CYP1A2 teofilina (dose única de 300 mg) não afetou a farmacocinética da teofilina. O efeito da teofilina na farmacocinética do citalopram não foi avaliado.
Varfarina
A administração de 40 mg/dia de CELEXA por 21 dias não afetou a farmacocinética da varfarina, um substrato do CYP3A4. O tempo de protrombina foi aumentado em 5%, cujo significado clínico é desconhecido.
Carbamazepina
administração combinada de CELEXA (40 mg/dia por 14 dias) e carbamazepina (titulada para 400 mg/dia por 35 dias) não afetou significativamente a farmacocinética da carbamazepina, um substrato do CYP3A4. Embora os níveis plasmáticos mínimos de citalopram não tenham sido afetados, dadas as propriedades indutoras de enzimas da carbamazepina, a possibilidade de que a carbamazepina possa aumentar a depuração do citalopram deve ser considerada se os dois medicamentos forem coadministrados.
Triazolam
A administração combinada de CELEXA (titulado para 40 mg/dia por 28 dias) e o substrato CYP3A4 triazolam (dose única de 0,25 mg) não afetou significativamente a farmacocinética do citalopram ou do triazolam.
Cetoconazol
A administração combinada de CELEXA (40 mg) e cetoconazol (200 mg) diminuiu a Cmax e a AUC do cetoconazol em 21% e 10%, respectivamente, e não afetou significativamente a farmacocinética do citalopram.
Metoprolol
administração de 40 mg/dia de CELEXA 20 mg por 22 dias resultou em um aumento de duas vezes nos níveis plasmáticos do bloqueador beta-adrenérgico metoprolol. O aumento dos níveis plasmáticos de metoprolol tem sido associado à diminuição da cardiosseletividade. A coadministração de CELEXA 10mg e metoprolol não teve efeitos clinicamente significativos na pressão arterial ou na frequência cardíaca.
Imipramina e outros antidepressivos tricíclicos (TCAs)
Estudos in vitro sugerem que o citalopram é um inibidor relativamente fraco do CYP2D6. A coadministração de CELEXA (40 mg/dia por 10 dias) com o TCA imipramina (dose única de 100 mg), um substrato para CYP2D6, não afetou significativamente as concentrações plasmáticas de imipramina ou citalopram. No entanto, a concentração do metabólito desipramina da imipramina foi aumentada em aproximadamente 50%. O significado clínico da alteração da desipramina é desconhecido.
Toxicologia e/ou Farmacologia Animal
Alterações da retina em ratos
Alterações patológicas (degeneração/atrofia) foram observadas nas retinas de ratos albinos no estudo de carcinogenicidade de 2 anos com citalopram. Houve um aumento na incidência e gravidade da patologia da retina em ratos machos e fêmeas recebendo 80 mg/kg/dia, que é aproximadamente 19 vezes a MRHD de 40 mg com base em mg/m² de área de superfície corporal. Achados semelhantes não estavam presentes em ratos tratados por dois anos com a dose de 24 mg/kg/dia, em camundongos tratados por 18 meses com doses de até 240 mg/kg/dia ou em cães tratados por um ano com doses de até 20 mg/kg/dia, que são aproximadamente 6, 29 e 17 vezes a MRHD, respectivamente, com base na área de superfície corporal em mg/m².
Estudos adicionais para investigar o mecanismo desta patologia não foram realizados, e o potencial significado deste efeito em humanos não foi estabelecido.
Estudos clínicos
eficácia de CELEXA como tratamento para transtorno depressivo maior foi estabelecida em dois estudos controlados por placebo (de 4 a 6 semanas de duração) em pacientes ambulatoriais adultos (idades de 18 a 66 anos) que atendem aos critérios do DSM-III ou DSM-III-R para depressão maior transtorno (MDD) (Estudos 1 e 2).
estudo 1, um estudo de 6 semanas no qual os pacientes receberam doses fixas de 10 mg de CELEXA de 10 mg, 20 mg, 40 mg e 60 mg por dia, mostrou que CELEXA 40 por dia e 60 mg por dia (1,5 vezes a dose diária máxima recomendada) foi eficaz conforme medido pela pontuação total da Escala de Avaliação de Depressão de Hamilton (HAMD), o desfecho primário de eficácia. A HAMD-17 é uma escala de 17 itens, avaliada pelo clínico, usada para avaliar a gravidade dos sintomas depressivos. As pontuações no HAMD-17 variam de 0 a 52, com pontuações mais altas indicando depressão mais grave. Este estudo não mostrou nenhum efeito claro das doses diárias de 10 mg e 20 mg, e a dose diária de 60 mg não foi mais eficaz do que a dose diária de 40 mg. Devido ao risco de prolongamento do intervalo QTc e arritmias ventriculares, a dose máxima recomendada de CELEXA 10 mg é de 40 mg uma vez ao dia.
No estudo 2, um estudo controlado por placebo de 4 semanas em pacientes com TDM, a dose inicial foi de 20 mg por dia, seguida de titulação até a dose máxima tolerada ou uma dose máxima de 80 mg por dia (2 vezes a dose diária máxima recomendada ). Os pacientes tratados com CELEXA 20mg apresentaram melhora estatisticamente significativamente maior do que os pacientes com placebo na pontuação total HAMD, o desfecho primário de eficácia. Em três estudos adicionais controlados por placebo em pacientes com TDM, a diferença na resposta ao tratamento entre os pacientes que receberam CELEXA e os pacientes que receberam placebo não foi estatisticamente significativa.
Em dois estudos de longo prazo, pacientes com TDM que responderam a CELEXA 10 mg durante as primeiras 6 ou 8 semanas de tratamento agudo foram randomizados para a continuação de CELEXA 10 mg ou placebo. Em um estudo, os pacientes receberam doses fixas de CELEXA 20 mg ou 40 mg por dia e no segundo estudo, os pacientes receberam doses flexíveis de CELEXA 20 mg por dia a 60 mg por dia (1,5 vezes a dose diária máxima recomendada). Em ambos os estudos, os pacientes que receberam tratamento contínuo com CELEXA apresentaram taxas de recaída estatisticamente significativamente mais baixas nos 6 meses subsequentes em comparação com aqueles que receberam placebo. No estudo de dose fixa, a diminuição da taxa de recaída de depressão foi semelhante em pacientes que receberam 20 mg ou 40 mg por dia de CELEXA. Devido ao risco de prolongamento do intervalo QTc e arritmias ventriculares, a dose máxima recomendada de CELEXA 20 mg é de 40 mg uma vez ao dia.
As análises da relação entre o resultado do tratamento e idade, sexo e raça não sugeriram nenhuma resposta diferencial com base nessas características dos pacientes.
INFORMAÇÃO DO PACIENTE
CELEXA® (Suh-leks-uh) (citalopram) Comprimidos, para uso oral
Quais são as informações mais importantes que devo saber sobre CELEXA?
CELEXA 20mg pode causar efeitos colaterais graves, incluindo:
- Aumento do risco de pensamentos e ações suicidas. CELEXA 10mg e outros medicamentos antidepressivos podem aumentar os pensamentos e ações suicidas em algumas crianças, adolescentes e adultos jovens especialmente nos primeiros meses de tratamento ou quando a dose é alterada. CELEXA não é para uso em crianças.
- Depressão e outras doenças mentais são as causas mais importantes de pensamentos e ações suicidas.
Como posso observar e tentar evitar pensamentos e ações suicidas em mim ou em um membro da família?
- Preste muita atenção a quaisquer mudanças, especialmente mudanças repentinas de humor, comportamento, pensamentos ou sentimentos, ou se você desenvolver pensamentos ou ações suicidas. Isso é muito importante quando um medicamento antidepressivo é iniciado ou quando a dose é alterada.
- Ligue para o seu médico imediatamente para relatar mudanças novas ou repentinas no humor, comportamento, pensamentos ou sentimentos.
- Mantenha todas as visitas de acompanhamento com seu médico conforme programado. Ligue para o seu médico entre as visitas, conforme necessário, especialmente se tiver dúvidas sobre os sintomas.
Ligue para o seu médico ou procure ajuda médica de emergência imediatamente se você ou seu familiar tiver algum dos seguintes sintomas, especialmente se eles forem novos, piores ou o preocuparem:
- pensamentos sobre suicídio ou morte
- depressão nova ou pior
- sentindo-se muito agitado ou inquieto
- problemas para dormir (insônia)
- agindo de forma agressiva, com raiva ou violento
- um aumento extremo na atividade ou fala (mania)
- tentativas de suicídio
- ansiedade nova ou pior
- agindo em impulsos perigosos
- ataques de pânico
- irritabilidade nova ou pior
- outras mudanças incomuns no comportamento ou humor
O que é CELEXA?
CELEXA 10mg é um medicamento de prescrição usado para tratar um certo tipo de depressão chamado Transtorno Depressivo Maior (MDD) em adultos.
Não se sabe se CELEXA 10mg é seguro e eficaz para uso em crianças.
Quem não deve tomar CELEXA?
Não tome CELEXA se você:
- tomar um inibidor da monoamina oxidase (IMAO)
- pararam de tomar um IMAO nos últimos 14 dias
- estão sendo tratados com o antibiótico linezolida ou azul de metileno intravenoso
- tome pimozida
- são alérgicos ao citalopram ou a qualquer um dos ingredientes de CELEXA. Consulte o final deste Guia de Medicação para obter uma lista completa dos ingredientes do CELEXA.
Pergunte ao seu médico ou farmacêutico se não tiver certeza se toma um IMAO, incluindo IMAOs como linezolida ou azul de metileno intravenoso.
Não comece a tomar um IMAO por pelo menos 14 dias após parar o tratamento com CELEXA.
Antes de tomar CELEXA, informe o seu médico sobre todas as suas condições médicas, incluindo se você:
- tem ou tem histórico familiar de suicídio, depressão, transtorno bipolar, mania ou hipomania
- tem um ritmo cardíaco anormal chamado prolongamento do intervalo QT
- tem ou teve problemas cardíacos, incluindo ataque cardíaco, insuficiência cardíaca, ritmo cardíaco anormal ou síndrome do QT longo
- tem níveis baixos de potássio, magnésio ou sódio no sangue
- tem ou teve problemas de sangramento
- tem ou teve convulsões (convulsões)
- tem pressão alta no olho (glaucoma)
- tem ou teve problemas renais ou hepáticos
- estão grávidas ou planejam engravidar. CELEXA 20mg pode prejudicar o feto. Tomar CELEXA no final da gravidez pode aumentar o risco de certos problemas no recém-nascido. Converse com seu médico sobre os riscos e benefícios do tratamento da depressão durante a gravidez.
- Informe imediatamente o seu médico se engravidar ou se pensa que pode estar grávida durante o tratamento com CELEXA.
- Existe um registro de gravidez para mulheres expostas ao CELEXA durante a gravidez. O objetivo do registro é coletar informações sobre a saúde das mulheres expostas ao CELEXA e de seus bebês. Se você engravidar durante o tratamento com CELEXA 10mg, converse com seu médico sobre o registro no Registro Nacional de Gravidez para Antidepressivos. Você pode se registrar ligando para 1-844-405-6185 ou visitando on-line em https://womensmentalhealth.org/research/pregnancyregistry/antidepressants.
- está amamentando ou planeja amamentar. Não se sabe se CELEXA passa para o leite materno. Converse com seu médico sobre a melhor maneira de alimentar seu bebê durante o tratamento com CELEXA.
- Se você amamentar durante o tratamento com CELEXA 20mg, ligue para o seu médico imediatamente se o seu bebê desenvolver sonolência ou agitação, ou não estiver se alimentando ou ganhando peso bem.
Informe o seu médico sobre todos os medicamentos que toma, incluindo medicamentos prescritos e de venda livre, vitaminas e suplementos de ervas.
CELEXA 10mg e outros medicamentos podem afetar uns aos outros causando possíveis efeitos colaterais graves. CELEXA pode afetar a forma como outros medicamentos atuam e outros medicamentos podem afetar a forma como CELEXA atua.
Informe especialmente o seu médico se você tomar:
- medicamentos usados para tratar enxaquecas conhecidos como triptanos
- antidepressivos tricíclicos
- fentanil
- lítio
- tramadol
- triptofano
- buspirona
- anfetaminas
- Erva de São João
- medicamentos que podem afetar a coagulação do sangue, como aspirina, anti-inflamatórios não esteroides (AINEs) e varfarina
- diuréticos
- metadona
- gatifloxacina ou moxifloxacina
- medicamentos usados para controlar a sua frequência ou ritmo cardíaco (antiarrítmicos)
- medicamentos usados para tratar distúrbios do humor, ansiedade, psicóticos ou do pensamento, incluindo inibidores seletivos da recaptação da serotonina (ISRSs) e inibidores da recaptação da serotonina norepinefrina (IRSNs)
Pergunte ao seu médico se não tiver certeza se está tomando algum desses medicamentos. Seu médico pode lhe dizer se é seguro tomar CELEXA 10mg com seus outros medicamentos.
Não inicie ou interrompa nenhum outro medicamento durante o tratamento com CELEXA sem falar primeiro com seu médico. Parar CELEXA repentinamente pode causar efeitos colaterais graves. Ver, “Quais são os possíveis efeitos colaterais do CELEXA?”
Conheça os medicamentos que você toma. Mantenha uma lista deles para mostrar ao seu médico e farmacêutico quando receber um novo medicamento.
Como devo tomar CELEXA 10mg?
- Tome CELEXA 20mg exatamente como seu médico lhe disser para tomá-lo. Não altere sua dose ou pare de tomar CELEXA sem primeiro falar com seu médico.
- Seu médico pode precisar alterar a dose de CELEXA até que seja a dose certa para você.
- Tome CELEXA 1 vez por dia com ou sem alimentos.
- Se você tomar muito CELEXA 20mg, ligue para o seu médico ou centro de controle de envenenamento em 1-800-222-1222, ou dirija-se ao pronto-socorro do hospital mais próximo imediatamente.
Quais são os possíveis efeitos colaterais do CELEXA 20mg?
CELEXA pode causar efeitos colaterais graves, incluindo:
- Ver, “Qual é a informação mais importante que devo saber sobre a CELEXA?”
- Problemas de ritmo cardíaco. CELEXA pode causar uma alteração grave no seu batimento cardíaco (batimento cardíaco rápido ou irregular) que pode causar a morte. Informe o seu médico imediatamente se sentir desmaio ou desmaio, ou se tiver uma alteração nos batimentos cardíacos.
- Síndrome serotoninérgica. Tomar CELEXA pode causar um problema potencialmente fatal chamado síndrome serotoninérgica. O risco de desenvolver síndrome serotoninérgica aumenta quando CELEXA 20 mg é tomado com alguns outros medicamentos. Ver, “Quem não deve tomar CELEXA?” Ligue para o seu médico ou dirija-se imediatamente ao pronto-socorro do hospital mais próximo se tiver algum dos seguintes sinais e sintomas da síndrome serotoninérgica:
- agitação
- ver ou ouvir coisas que não são reais (alucinações)
- confusão
- coma
- batimento cardíaco rápido
- alterações da pressão arterial
- tontura
- sudorese
- rubor
- temperatura corporal elevada (hipertermia)
- tremores, músculos rígidos ou espasmos musculares
- perda de coordenação
- convulsões
- náuseas, vômitos, diarreia
- Aumento do risco de sangramento. Tomar CELEXA 20mg com aspirina, anti-inflamatórios não esteroides (AINEs), varfarina ou anticoagulantes podem aumentar esse risco. Informe o seu médico imediatamente sobre qualquer sangramento ou hematoma incomum.
- Episódios maníacos. Episódios maníacos podem ocorrer em pessoas com transtorno bipolar que tomam CELEXA. Os sintomas podem incluir:
- energia muito aumentada
- problemas graves para dormir
- pensamentos descontrolados
- comportamento imprudente
- ideias extraordinariamente grandes
- felicidade excessiva ou irritabilidade
- falando mais ou mais rápido do que o habitual
- Síndrome de descontinuação. Parar repentinamente CELEXA 20mg pode causar efeitos colaterais graves. Seu médico pode querer diminuir sua dose lentamente. Os sintomas podem incluir:
- náusea
- sudorese
- mudanças no seu humor
- dor de cabeça
- irritabilidade e agitação
- cansaço
- tontura
- problemas para dormir
- sensação de choque elétrico (parestesia)
- hipomania
- ansiedade
- zumbido nos ouvidos (zumbido)
- confusão
- convulsões
- Convulsões (convulsões).
- Problemas oculares (glaucoma de ângulo fechado). Muitos medicamentos antidepressivos, incluindo CELEXA, podem causar um certo tipo de problema ocular chamado glaucoma de ângulo fechado. Ligue para o seu médico se tiver alterações na visão ou dor nos olhos.
- Níveis baixos de sódio no sangue (hiponatremia). Níveis baixos de sódio no sangue podem ser graves e podem causar a morte. Os idosos podem estar em maior risco para isso. Informe imediatamente o seu médico se desenvolver quaisquer sinais ou sintomas de níveis baixos de sódio no sangue durante o tratamento com CELEXA. Sinais e sintomas de baixos níveis de sódio no sangue podem incluir:
- dor de cabeça
- Dificuldade de concentração
- alterações de memória
- confusão
- fraqueza e instabilidade nos pés, o que pode levar a quedas
Em casos graves ou mais súbitos, os sinais e sintomas incluem:
-
- alucinações (ver ou ouvir coisas que não são reais)
- desmaio
- convulsões
- coma
- parando de respirar
- morte
- Problemas sexuais (disfunção). Tomar inibidores seletivos de recaptação de serotonina (ISRSs), incluindo CELEXA, pode causar problemas sexuais.
Os sintomas nos homens podem incluir:
- Ejaculação retardada ou incapacidade de ter uma ejaculação
- Diminuição do desejo sexual
- Problemas para obter ou manter uma ereção
Os sintomas em mulheres podem incluir:
- Diminuição do desejo sexual
- Orgasmo retardado ou incapacidade de ter um orgasmo
Fale com o seu médico se desenvolver quaisquer alterações na sua função sexual ou se tiver dúvidas ou preocupações sobre problemas sexuais durante o tratamento com DRIZALMA SPRINKLE. Pode haver tratamentos que seu médico pode sugerir.
O efeito colateral mais comum do CELEXA é a ejaculação retardada.
Estes não são todos os possíveis efeitos colaterais do CELEXA.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
Como devo armazenar o CELEXA?
- Armazene CELEXA em temperatura ambiente entre 20°C e 25°C (68°F a 77°F).
- Mantenha CELEXA 20mg e todos os medicamentos fora do alcance das crianças.
Informações gerais sobre o uso seguro e eficaz de CELEXA
Os medicamentos às vezes são prescritos para outros fins que não os listados em um Guia de Medicamentos. Não use CELEXA 20mg para uma condição para a qual não foi prescrito. Não dê CELEXA a outras pessoas, mesmo que tenham os mesmos sintomas que você. Pode prejudicá-los. Você pode pedir ao seu médico ou farmacêutico informações sobre CELEXA escritas para profissionais de saúde.
Quais são os ingredientes do CELEXA?
Ingrediente ativo: bromidrato de citalopram
Ingredientes inativos: copolividona, amido de milho, crosscarmelose sódica, glicerina, lactose monohidratada, estearato de magnésio, hipromelose, celulose microcristalina, polietilenoglicol, dióxido de titânio e dióxido de ferro para coloração.
Este Guia de Medicação foi aprovado pela Food and Drug Administration dos EUA.
