Cymbalta 20mg, 30mg, 40mg, 60mg Duloxetine Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Cymbalta e como é usado?
Cymbalta é um medicamento de prescrição usado para tratar sintomas de transtorno depressivo maior, dor neuropática periférica diabética, transtorno de ansiedade generalizada, fibromialgia e dor muscular crônica. Cymbalta pode ser usado sozinho ou com outros medicamentos.
- Cymbalta pertence a uma classe de medicamentos chamados antidepressivos, SNRIs, agentes de fibromialgia.
- Não se sabe se Cymbalta é seguro e eficaz em crianças com menos de 7 anos de idade.
Quais são os possíveis efeitos colaterais do Cymbalta 20mg?
Cymbalta pode causar efeitos colaterais graves, incluindo:
- batimentos cardíacos batendo ou vibrando em seu peito,
- tontura,
- contusões fáceis,
- sangramento incomum,
- alterações na visão,
- micção dolorosa ou difícil,
- impotência,
- problemas sexuais,
- dor de estômago superior do lado direito,
- coceira,
- urina escura,
- amarelecimento da pele ou dos olhos (icterícia),
- dor de cabeça,
- confusão,
- fala arrastada,
- fraqueza severa,
- vômito,
- perda de coordenação,
- sentindo-se instável,
- pensamentos descontrolados,
- aumento de energia,
- comportamento imprudente,
- sentindo-se extremamente feliz ou irritado,
- falando mais do que o normal, e
- problemas graves com o sono
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns de Cymbalta incluem:
- sonolência,
- náusea,
- constipação,
- perda de apetite,
- boca seca e
- aumento da sudorese
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Cymbalta. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
AVISO
PENSAMENTOS E COMPORTAMENTOS SUICÍDICOS
Os antidepressivos aumentaram o risco de pensamentos e comportamentos suicidas em crianças, adolescentes e adultos jovens em estudos de curto prazo. Esses estudos não mostraram aumento do risco de pensamentos e comportamentos suicidas com o uso de antidepressivos em pacientes com mais de 24 anos; houve uma redução no risco com o uso de antidepressivos em pacientes com 65 anos ou mais [ver AVISOS E PRECAUÇÕES ].
Em pacientes de todas as idades que iniciam a terapia antidepressiva, monitore atentamente quanto à piora e ao surgimento de pensamentos e comportamentos suicidas. Aconselhar as famílias e cuidadores sobre a necessidade de observação atenta e comunicação com o prescritor [ver AVISOS E PRECAUÇÕES ].
DESCRIÇÃO
CYMBALTA® (cápsulas de liberação retardada de duloxetina) é um inibidor seletivo da recaptação de serotonina e norepinefrina (SSNRI) para administração oral. A sua designação química é cloridrato de (+)-(S)-N-metil-γ-(1-naftiloxi)-2-tiofenopropilamina. A fórmula empírica é C18H19NOS•HCl, que corresponde a um peso molecular de 333,88. A fórmula estrutural é:
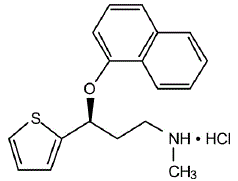
cloridrato de duloxetina é um sólido branco a ligeiramente acastanhado, que é ligeiramente solúvel em água.
Cada cápsula contém pellets com revestimento entérico de 22,4, 33,7 ou 67,3 mg de cloridrato de duloxetina equivalente a 20, 30 ou 60 mg de duloxetina, respectivamente. Esses grânulos com revestimento entérico são projetados para prevenir a degradação do fármaco no ambiente ácido do estômago. Os ingredientes inativos incluem FD&C Blue No. 2, gelatina, hipromelose, succinato de acetato de hidroxipropilmetilcelulose, lauril sulfato de sódio, sacarose, esferas de açúcar, talco, dióxido de titânio e citrato de trietil. As cápsulas de 20 e 60 mg também contêm óxido de ferro amarelo.
INDICAÇÕES
CYMBALTA® é indicado para o tratamento de:
- Transtorno depressivo maior em adultos
- Transtorno de ansiedade generalizada em adultos e pacientes pediátricos com 7 anos de idade ou mais
- Dor neuropática periférica diabética em adultos
- Fibromialgia em adultos e pacientes pediátricos com idade igual ou superior a 13 anos
- dor musculoesquelética crônica em adultos
DOSAGEM E ADMINISTRAÇÃO
Instruções importantes de administração
Administrar CYMBALTA por via oral (com ou sem refeições) e engolir inteiro. Não mastigue ou esmague, e não abra a cápsula de liberação retardada e polvilhe seu conteúdo em alimentos ou misture com líquidos, pois essas ações podem afetar o revestimento entérico. Se uma dose de CYMBALTA 20mg for esquecida, tome a dose esquecida assim que se lembrar. Se estiver quase na hora da próxima dose, pule a dose esquecida e tome a próxima dose no horário regular. Não tome duas doses de CYMBALTA 60mg ao mesmo tempo.
Dosagem para o tratamento do transtorno depressivo maior em adultos
dose inicial recomendada em adultos com TDM é de 40 mg/dia (administrada como 20 mg duas vezes ao dia) a 60 mg/dia (administrada uma vez ao dia ou 30 mg duas vezes ao dia). Para alguns pacientes, pode ser desejável iniciar com 30 mg uma vez ao dia por 1 semana, para permitir que os pacientes ajustem CYMBALTA 30 mg antes de aumentar para 60 mg uma vez ao dia. Embora uma dose de 120 mg/dia tenha se mostrado eficaz, não há evidências de que doses superiores a 60 mg/dia confiram benefícios adicionais. Reavaliar periodicamente para determinar a necessidade de tratamento de manutenção e a dosagem apropriada para tal tratamento.
Dosagem para o tratamento do transtorno de ansiedade generalizada
Dosagem recomendada em adultos com menos de 65 anos de idade
Para a maioria dos adultos com menos de 65 anos de idade com TAG, inicie CYMBALTA 60 mg uma vez ao dia. Para alguns pacientes, pode ser desejável iniciar com 30 mg uma vez ao dia por 1 semana, para permitir que os pacientes ajustem CYMBALTA 40 mg antes de aumentar para 60 mg uma vez ao dia. Embora uma dose de 120 mg uma vez ao dia tenha se mostrado eficaz, não há evidências de que doses superiores a 60 mg/dia confiram benefício adicional. No entanto, se for tomada a decisão de aumentar a dosagem além de 60 mg uma vez ao dia, aumente a dosagem em incrementos de 30 mg uma vez ao dia. Reavaliar periodicamente para determinar a necessidade contínua de tratamento de manutenção e a dosagem apropriada para tal tratamento.
Dosagem Recomendada em Pacientes Geriátricos
Em pacientes geriátricos com TAG, inicie CYMBALTA na dose de 30 mg uma vez ao dia por 2 semanas antes de considerar um aumento para a dose alvo de 60 mg/dia. A partir daí, os pacientes podem se beneficiar de doses acima de 60 mg uma vez ao dia. Se for tomada a decisão de aumentar a dose além de 60 mg uma vez ao dia, aumente a dose em incrementos de 30 mg uma vez ao dia. A dose máxima estudada foi de 120 mg por dia.
Dosagem recomendada em pacientes pediátricos de 7 a 17 anos de idade
Iniciar CYMBALTA 30 mg em pacientes pediátricos de 7 a 17 anos de idade com TAG na dose de 30 mg uma vez ao dia por 2 semanas antes de considerar um aumento para 60 mg uma vez ao dia. A faixa de dosagem recomendada é de 30 a 60 mg uma vez ao dia. Alguns pacientes podem se beneficiar de dosagens acima de 60 mg uma vez ao dia. Se for tomada a decisão de aumentar a dose além de 60 mg uma vez ao dia, aumente a dose em incrementos de 30 mg uma vez ao dia. A dose máxima estudada foi de 120 mg por dia.
Dosagem para o tratamento da dor neuropática periférica diabética em adultos
Administrar 60 mg uma vez ao dia em adultos com dor neuropática periférica diabética. Não há evidências de que doses superiores a 60 mg uma vez ao dia confiram benefícios adicionais significativos e a dosagem mais alta é claramente menos bem tolerada. Para pacientes para os quais a tolerabilidade é uma preocupação, uma dose inicial mais baixa pode ser considerada.
Como o diabetes é frequentemente complicado por doença renal, considerar uma dosagem inicial mais baixa e um aumento gradual na dosagem para pacientes com insuficiência renal [ver Dosagem em pacientes com insuficiência hepática ou insuficiência renal grave e Uso em populações específicas ].
Dosagem para o tratamento da fibromialgia
Dosagem Recomendada em Adultos
dosagem recomendada de CYMBALTA é de 60 mg uma vez ao dia em adultos com fibromialgia. Comece o tratamento com 30 mg uma vez ao dia por 1 semana, para permitir que os pacientes ajustem CYMBALTA 20 mg antes de aumentar para 60 mg uma vez ao dia. Alguns pacientes podem responder à dosagem inicial. Não há evidências de que dosagens superiores a 60 mg/dia confiram benefício adicional, mesmo em pacientes que não respondem a uma dose de 60 mg/dia, e doses mais altas foram associadas a uma maior taxa de reações adversas.
Dosagem recomendada em pacientes pediátricos de 13 a 17 anos de idade
A dose inicial recomendada de CYMBALTA 60mg em pacientes pediátricos de 13-17 anos de idade com fibromialgia é de 30mg uma vez ao dia. A dosagem pode ser aumentada para 60 mg uma vez ao dia com base na resposta e tolerabilidade.
Dosagem para o tratamento da dor musculoesquelética crônica em adultos
dosagem recomendada de CYMBALTA é de 60 mg uma vez ao dia em adultos com dor musculoesquelética crônica. Comece o tratamento com 30 mg uma vez ao dia durante uma semana, para permitir que os pacientes se ajustem ao CYMBALTA antes de aumentar para 60 mg uma vez ao dia. Não há evidências de que doses mais altas confiram benefícios adicionais, mesmo em pacientes que não respondem a uma dose de 60 mg uma vez ao dia, e doses mais altas estão associadas a uma taxa mais alta de reações adversas [ver Estudos clínicos ].
Dosagem em pacientes com insuficiência hepática ou insuficiência renal grave
Evitar o uso em pacientes com doença hepática crônica ou cirrose [ver AVISOS E PRECAUÇÕES e Uso em populações específicas ].
Evitar o uso em pacientes com insuficiência renal grave, TFG AVISOS E PRECAUÇÕES e Uso em populações específicas ].
Descontinuando CYMBALTA
As reações adversas após a descontinuação de CYMBALTA, após descontinuação abrupta ou gradual, incluem: tontura, dor de cabeça, náusea, diarreia, parestesia, irritabilidade, vômito, insônia, ansiedade, hiperidrose e fadiga. Recomenda-se uma redução gradual da dosagem em vez de uma interrupção abrupta sempre que possível [ver AVISOS E PRECAUÇÕES ].
Mudar um paciente para ou de um inibidor da monoamina oxidase (IMAO) destinado a tratar distúrbios psiquiátricos
Devem decorrer pelo menos 14 dias entre a descontinuação de um IMAO destinado a tratar distúrbios psiquiátricos e o início da terapia com CYMBALTA. Por outro lado, pelo menos 5 dias devem ser permitidos após a interrupção de CYMBALTA 60mg antes de iniciar um IMAO destinado a tratar distúrbios psiquiátricos [ver CONTRA-INDICAÇÕES ].
Uso de CYMBALTA com outros IMAOs, como linezolida ou azul de metileno
Não inicie CYMBALTA em um paciente que esteja sendo tratado com linezolida ou azul de metileno intravenoso porque há um risco aumentado de síndrome serotoninérgica. Em um paciente que requer tratamento mais urgente de uma condição psiquiátrica, outras intervenções, incluindo hospitalização, devem ser consideradas [ver CONTRA-INDICAÇÕES ].
Em alguns casos, um paciente que já esteja recebendo terapia com CYMBALTA pode necessitar de tratamento urgente com linezolida ou azul de metileno intravenoso. Se alternativas aceitáveis ao tratamento com linezolida ou azul de metileno intravenoso não estiverem disponíveis e os benefícios potenciais do tratamento com linezolida ou azul de metileno intravenoso forem considerados superiores aos riscos de síndrome serotoninérgica em um determinado paciente, CYMBALTA deve ser interrompido imediatamente e linezolida ou azul de metileno intravenoso pode ser administrado. O paciente deve ser monitorado quanto a sintomas de síndrome serotoninérgica por 5 dias ou até 24 horas após a última dose de linezolida ou azul de metileno intravenoso, o que ocorrer primeiro. A terapia com CYMBALTA pode ser retomada 24 horas após a última dose de linezolida ou azul de metileno intravenoso [ver AVISOS E PRECAUÇÕES ].
risco de administrar azul de metileno por vias não intravenosas (como comprimidos orais ou por injeção local) ou em doses intravenosas muito inferiores a 1 mg/kg com CYMBALTA não é claro. O clínico deve, no entanto, estar ciente da possibilidade de sintomas emergentes da síndrome serotoninérgica com tal uso [ver AVISOS E PRECAUÇÕES ].
COMO FORNECIDO
Formas de dosagem e pontos fortes
CYMBALTA está disponível como cápsulas de liberação retardada:
- 20 mg cápsulas verdes opacas impressas com “Lilly 3235 20mg”
- 30 mg cápsulas brancas e azuis opacas impressas com “Lilly 3240 30mg”
- 60 mg cápsulas verdes e azuis opacas impressas com “Lilly 3270 60mg”
CYMBALTA (cápsulas de liberação retardada de duloxetina) está disponível nos seguintes pontos fortes, cores, impressões e apresentações:
Armazenamento e manuseio
Armazenar a 25°C (77°F); excursões permitidas para 15-30°C (59-86°F) [veja USP Controlled Room Temperature].
Comercializado por: Lilly USA, LLC Indianapolis, IN 46285, USA. Revisado: julho de 2021
EFEITOS COLATERAIS
As seguintes reações adversas graves estão descritas abaixo e em outras partes da bula:
- Pensamentos e Comportamentos Suicidas em Crianças, Adolescentes e Jovens Adultos [ver AVISO DE CAIXA e AVISOS E PRECAUÇÕES ]
- Hepatotoxicidade [ver AVISOS E PRECAUÇÕES ]
- Hipotensão ortostática, quedas e síncope [ver AVISOS E PRECAUÇÕES ]
- Síndrome serotoninérgica [ver AVISOS E PRECAUÇÕES ]
- Aumento do risco de sangramento [ver AVISOS E PRECAUÇÕES ]
- Reações Pele Graves [ver AVISOS E PRECAUÇÕES ]
- Síndrome de descontinuação [ver AVISOS E PRECAUÇÕES ]
- Ativação de Mania/Hipomania [ver AVISOS E PRECAUÇÕES ]
- Glaucoma de Fechamento Angular [ver AVISOS E PRECAUÇÕES ]
- Convulsões [ver AVISOS E PRECAUÇÕES ]
- Aumentos na Pressão Arterial [ver AVISOS E PRECAUÇÕES ]
- Interações Medicamentosas Clinicamente Importantes [ver AVISOS E PRECAUÇÕES ]
- Hiponatremia [ver AVISOS E PRECAUÇÕES ]
- Hesitação e Retenção Urinária [ver AVISOS E PRECAUÇÕES ]
- Disfunção Sexual [ver AVISOS E PRECAUÇÕES ]
Experiência de Ensaios Clínicos
Como os ensaios clínicos são conduzidos em condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparadas às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
As frequências declaradas de reações adversas representam a proporção de pacientes que sofreram, pelo menos uma vez, uma reação adversa emergente do tratamento do tipo listado. Uma reação foi considerada emergente do tratamento se ocorreu pela primeira vez ou piorou durante o tratamento após a avaliação inicial.
Reações Adversas em Adultos
Banco de dados de ensaios clínicos para adultos
Os dados descritos abaixo refletem a exposição a CYMBALTA em estudos adultos controlados por placebo para MDD (N=3779), GAD (N=1018), OA (N=503), CLBP (N=600), DPNP (N=906), e FM (N=1294). A faixa etária nesta população agrupada foi de 17 a 89 anos de idade. Nesta população agrupada, 66%, 61%, 61%, 43% e 94% dos pacientes adultos eram do sexo feminino; e 82%, 73%, 85%, 74% e 86% dos pacientes adultos eram caucasianos nas populações MDD, GAD, OA e CLBP, DPNP e FM, respectivamente. A maioria dos pacientes recebeu doses de CYMBALTA de um total de 60 a 120 mg por dia [ver Estudos clínicos ]. Os dados abaixo não incluem resultados do estudo que avaliou a eficácia de CYMBALTA 30mg para o tratamento de TAG em pacientes ≥65 anos de idade (Estudo GAD-5) [ver Estudos clínicos ]; no entanto, as reações adversas observadas nesta população geriátrica foram geralmente semelhantes às reações adversas na população adulta geral.
Reações adversas que levam à descontinuação do tratamento em estudos controlados por placebo em adultos
Transtorno Depressivo Maior
Aproximadamente 8,4% (319/3779) dos pacientes tratados com CYMBALTA em estudos adultos controlados por placebo para MDD descontinuaram o tratamento devido a uma reação adversa, em comparação com 4,6% (117/2536) dos pacientes tratados com placebo. Náusea (CYMBALTA 1,1%, placebo 0,4%) foi a única reação adversa relatada como motivo para descontinuação e considerada relacionada ao medicamento (ou seja, descontinuação ocorrendo em pelo menos 1% dos pacientes tratados com CYMBALTA e a uma taxa de pelo menos o dobro dos pacientes tratados com placebo).
Distúrbio de ansiedade generalizada
Aproximadamente 13,7% (139/1018) dos pacientes tratados com CYMBALTA em estudos controlados com placebo em adultos para GAD descontinuaram o tratamento devido a uma reação adversa, em comparação com 5% (38/767) para pacientes tratados com placebo. As reações adversas comuns relatadas como motivo para descontinuação e consideradas relacionadas ao medicamento (conforme definido acima) incluíram náusea (CYMBALTA 3,3%, placebo 0,4%) e tontura (CYMBALTA 1,3%, placebo 0,4%).
Dor Neuropática Periférica Diabética
Aproximadamente 12,9% (117/906) dos pacientes tratados com CYMBALTA em estudos controlados com placebo em adultos para DPNP descontinuaram o tratamento devido a uma reação adversa, em comparação com 5,1% (23/448) para pacientes tratados com placebo. Reações adversas comuns relatadas como motivo para descontinuação e consideradas relacionadas ao medicamento (conforme definido acima) incluíram náusea (CYMBALTA 3,5%, placebo 0,7%), tontura (CYMBALTA 1,2%, placebo 0,4%) e sonolência (CYMBALTA 1,1% , placebo 0%).
Fibromialgia
Aproximadamente 17,5% (227/1294) dos pacientes tratados com CYMBALTA em estudos de 3 a 6 meses controlados por placebo em adultos para FM interromperam o tratamento devido a uma reação adversa, em comparação com 10,1% (96/955) para pacientes tratados com placebo . As reações adversas relatadas como motivo para descontinuação e consideradas relacionadas ao medicamento (conforme definido acima) incluíram náusea (CYMBALTA 2,0%, placebo 0,5%), dor de cabeça (CYMBALTA 1,2%, placebo 0,3%), sonolência (CYMBALTA 1,1%, placebo 0%) e fadiga (CYMBALTA 1,1%, placebo 0,1%).
Dor crônica devido à osteoartrite
Aproximadamente 15,7% (79/503) dos pacientes tratados com CYMBALTA em estudos de 13 semanas controlados por placebo em adultos para dor crônica devido à OA interromperam o tratamento devido a uma reação adversa, em comparação com 7,3% (37/508) para placebo- pacientes tratados. As reações adversas relatadas como motivo para descontinuação e consideradas relacionadas ao medicamento (conforme definido acima) incluíram náusea (CYMBALTA 2,2%, placebo 1%).
Dor lombar crônica
Aproximadamente 16,5% (99/600) dos pacientes tratados com CYMBALTA em estudos de 13 semanas controlados por placebo em adultos para DLC interromperam o tratamento devido a uma reação adversa, em comparação com 6,3% (28/441) para pacientes tratados com placebo. As reações adversas relatadas como motivo para descontinuação e consideradas relacionadas ao medicamento (conforme definido acima) incluíram náusea (CYMBALTA 3%, placebo 0,7%) e sonolência (CYMBALTA 1%, placebo 0%).
Reações adversas mais comuns em estudos com adultos
As reações adversas mais comumente observadas em pacientes tratados com CYMBALTA (conforme definido acima) foram:
- Dor Neuropática Periférica Diabética: náuseas, sonolência, diminuição do apetite, constipação, hiperidrose e boca seca.
- Fibromialgia: náuseas, boca seca, constipação, sonolência, diminuição do apetite, hiperidrose e agitação.
- Dor crônica devido à osteoartrite: náusea, fadiga, constipação, boca seca, insônia, sonolência e tontura.
- Dor lombar crônica: náusea, boca seca, insônia, sonolência, constipação, tontura e fadiga.
As reações adversas mais comumente observadas em pacientes tratados com CYMBALTA em todas as populações adultas agrupadas (ou seja, MDD, GAD, DPNP, FM, OA e CLBP) (incidência de pelo menos 5% e pelo menos duas vezes a incidência em tratados com placebo pacientes) foram náuseas, boca seca, sonolência, constipação, diminuição do apetite e hiperidrose.
Tabela 2 mostra a incidência de reações adversas em estudos controlados por placebo para populações adultas aprovadas (ou seja, MDD, GAD, DPNP, FM, OA e CLBP) que ocorreram em 5% ou mais dos pacientes tratados com CYMBALTA e com uma incidência maior do que os pacientes tratados com placebo.
Reações Adversas em Ensaios MDD e GAD Agrupados em Adultos
A Tabela 3 mostra a incidência de reações adversas em estudos adultos controlados por placebo para MDD e GAD que ocorreram em 2% ou mais dos pacientes tratados com CYMBALTA e com uma incidência maior do que os pacientes tratados com placebo.
Reações Adversas nos Ensaios em Adultos DPNP, FM, OA e CLBP
A Tabela 4 mostra a incidência de reações adversas que ocorreram em 2% ou mais dos pacientes tratados com CYMBALTA (determinado antes do arredondamento) na fase aguda de pré-comercialização de ensaios adultos controlados por placebo de DPNP, FM, OA e CLBP e com uma incidência maior do que os pacientes tratados com placebo.
Efeitos sobre a função sexual masculina e feminina em adultos com MDD
Alterações no desejo sexual, desempenho sexual e satisfação sexual ocorrem frequentemente como manifestações de distúrbios psiquiátricos ou diabetes, mas também podem ser consequência do tratamento farmacológico. Como se presume que as reações sexuais adversas são voluntariamente subnotificadas, a Escala de Experiência Sexual do Arizona (ASEX), uma medida validada projetada para identificar reações adversas sexuais, foi usada prospectivamente em 4 ensaios MDD controlados por placebo em adultos (Estudos MDD-1, MDD-2 , MDD-3 e MDD-4) [ver Estudos clínicos ]. A escala ASEX inclui cinco questões que dizem respeito aos seguintes aspectos da função sexual: 1) desejo sexual, 2) facilidade de excitação, 3) capacidade de obter ereção (homens) ou lubrificação (mulheres), 4) facilidade de atingir o orgasmo e 5) satisfação do orgasmo. Números positivos significam uma piora da função sexual desde a linha de base. Números negativos significam uma melhora em relação a um nível basal de disfunção, que é comumente visto em pacientes deprimidos.
Nesses estudos, os pacientes do sexo masculino tratados com CYMBALTA apresentaram significativamente mais disfunção sexual, conforme medido pela pontuação total no ASEX e a capacidade de atingir o orgasmo, do que os pacientes do sexo masculino tratados com placebo (ver ). As pacientes do sexo feminino tratadas com CYMBALTA não apresentaram mais disfunção sexual do que as pacientes do sexo feminino tratadas com placebo, conforme medido pelo escore total ASEX. Os profissionais de saúde devem perguntar rotineiramente sobre possíveis reações adversas sexuais em pacientes tratados com CYMBALTA.
Alterações dos sinais vitais em adultos
Em ensaios clínicos controlados por placebo em populações adultas aprovadas para mudança da linha de base ao ponto final, os pacientes tratados com CYMBALTA tiveram aumentos médios de 0,23 mm Hg na pressão arterial sistólica (PAS) e 0,73 mm Hg na pressão arterial diastólica (PAD) em comparação com as diminuições médias de 1,09 mm Hg em SBP e 0,55 mm Hg em DBP em pacientes tratados com placebo. Não houve diferença significativa na frequência de pressão arterial elevada sustentada (3 visitas consecutivas) [ver AVISOS E PRECAUÇÕES ].
tratamento com CYMBALTA 20mg, por até 26 semanas em estudos controlados por placebo em populações adultas aprovadas, normalmente causou um pequeno aumento na frequência cardíaca para mudança da linha de base ao ponto final em comparação com placebo de até 1,37 batimentos por minuto (aumento de 1,20 batimentos por minuto em pacientes tratados com CYMBALTA, diminuição de 0,17 batimentos por minuto em pacientes tratados com placebo).
Alterações laboratoriais em adultos
O tratamento com CYMBALTA em ensaios clínicos controlados por placebo em populações adultas aprovadas foi associado a pequenos aumentos médios da linha de base ao ponto final em ALT, AST, CPK e fosfatase alcalina; foram observados valores anormais infrequentes, modestos, transitórios e anormais para esses analitos em pacientes tratados com CYMBALTA quando comparados com pacientes tratados com placebo [ver AVISOS E PRECAUÇÕES ]. Bicarbonato, colesterol e potássio anormal (alto ou baixo) foram observados mais frequentemente em pacientes tratados com CYMBALTA em comparação com pacientes tratados com placebo.
Outras reações adversas observadas durante a avaliação do ensaio clínico de CYMBALTA em adultos
A seguir está uma lista de reações adversas relatadas por pacientes tratados com CYMBALTA 40mg em estudos clínicos em adultos. Em ensaios clínicos de todas as populações adultas aprovadas, 34.756 pacientes foram tratados com CYMBALTA. Destes, 27% (9337) tomaram CYMBALTA 60mg por pelo menos 6 meses e 12% (4317) tomaram CYMBALTA por pelo menos um ano. A lista a seguir não pretende incluir reações (1) já listadas nas tabelas anteriores ou em qualquer outro lugar na bula, (2) para as quais a causa do medicamento era remota, (3) que eram tão gerais que não eram informativas, (4) que eram não considerado como tendo implicações clínicas significativas, ou (5) que ocorreu em uma taxa igual ou inferior ao placebo.
As reações são categorizadas por sistema corporal de acordo com as seguintes definições: reações adversas frequentes são aquelas que ocorrem em pelo menos 1/100 pacientes; reações adversas infrequentes são aquelas que ocorrem em 1/100 a 1/1.000 pacientes; reações raras são aquelas que ocorrem em menos de 1/1.000 pacientes.
- Distúrbios cardíacos - Frequentes: palpitações; Infrequentes: infarto do miocárdio, taquicardia e cardiomiopatia de Takotsubo.
- Distúrbios do ouvido e labirinto - Frequentes: vertigens; Infrequentes: dor de ouvido e zumbido.
- Distúrbios Endócrinos - Infrequente: hipotireoidismo.
- Distúrbios oculares - Frequentes: visão turva; Infrequentes: diplopia, olho seco e deficiência visual.
- Problemas gastrointestinais - Frequentes: flatulência; Infrequentes: disfagia, eructação, gastrite, hemorragia gastrointestinal, halitose e estomatite; Raros: úlcera gástrica.
- Distúrbios Gerais e Condições do Local de Administração - Frequentes: calafrios/rigores; Infrequentes: quedas, sensação anormal, sensação de calor e/ou frio, mal-estar e sede; Raros: distúrbios da marcha.
- Infecções e Infestações - Infrequentes: gastroenterite e laringite.
- Investigações Frequentes: aumento de peso, diminuição de peso; Infrequente: aumento do colesterol no sangue.
- Distúrbios do Metabolismo e Nutrição - Infrequentes: desidratação e hiperlipidemia; Raros: dislipidemia.
- Distúrbios Musculoesqueléticos e do Tecido Conjuntivo - Frequentes: dores musculoesqueléticas; Infrequentes: rigidez muscular e espasmos musculares.
- Distúrbios do Sistema Nervoso - Frequentes: disgeusia, letargia e parestesia/hipoestesia; Infrequentes: distúrbios da atenção, discinesia, mioclonia e sono de má qualidade; Raros: disartria.
- Distúrbios psiquiátricos - Frequentes: sonhos anormais e distúrbios do sono; Infrequentes: apatia, bruxismo, desorientação/estado de confusão, irritabilidade, alterações de humor e tentativa de suicídio; Raro: suicídio consumado.
- Distúrbios Renais e Urinários - Frequentes: frequência urinária; Infrequentes: disúria, urgência miccional, noctúria, poliúria e odor urinário anormal.
- Distúrbios do Sistema Reprodutivo e da Mama - Frequentes: anorgasmia/orgasmo anormal; Infrequentes: sintomas da menopausa, disfunção sexual e dor testicular; Raros: distúrbios menstruais.
- Distúrbios Respiratórios, Torácicos e Mediastinais Frequentes: bocejos, dor orofaríngea; Infrequente: aperto na garganta.
- Distúrbios da Pele e Tecidos Subcutâneos - Frequentes: prurido; Infrequentes: suor frio, dermatite de contato, eritema, aumento da tendência a hematomas, sudorese noturna e reação de fotossensibilidade; Raros: equimoses.
- Distúrbios Vasculares - Freqüentes: ondas de calor; Infrequentes: rubor, hipotensão ortostática e frieza periférica.
Reações Adversas Observadas em Ensaios Clínicos Controlados por Placebo em Pacientes Pediátricos
Banco de dados de ensaios clínicos pediátricos
Os dados descritos abaixo refletem a exposição a CYMBALTA (N=567) em pacientes pediátricos de 7 a 18 anos de idade em dois estudos controlados por placebo de 10 semanas em pacientes com MDD (N=341) (Estudos MDD-6 e MDD- 7), um estudo controlado por placebo de 10 semanas em GAD (N = 135) (Estudo GAD-6) e um estudo de 13 semanas em fibromialgia (N = 91). CYMBALTA 60mg não é aprovado para o tratamento de TDM em pacientes pediátricos [ver Uso em populações específicas ]. Dos pacientes tratados com CYMBALTA nesses estudos, 36% tinham 7 a 11 anos de idade (64% tinham entre 12 a 18 anos), 55% eram do sexo feminino e 69% eram caucasianos. Os pacientes receberam 30 a 120 mg de CYMBALTA por dia durante os estudos de tratamento agudo controlados por placebo. Nos ensaios pediátricos de MDD, GAD e fibromialgia com até 40 semanas de duração, houve 988 pacientes pediátricos tratados com CYMBALTA com idades entre 7 e 17 anos (a maioria dos pacientes recebeu 30-120 mg por dia) – 35% tinham 7 a 11 anos de idade (65% tinham 12 a 17 anos) e 56% eram do sexo feminino.
Reações Adversas Mais Comuns em Ensaios Pediátricos
As reações adversas mais comuns (≥5% em pacientes tratados com CYMBALTA e pelo menos duas vezes a incidência de pacientes tratados com placebo) em todas as populações pediátricas agrupadas (MDD, GAD e fibromialgia) foram diminuição do peso, diminuição do apetite, náuseas, vômitos, fadiga e diarreia.
Reações Adversas em Pacientes Pediátricos de 7 a 17 Anos com MDD e GAD
perfil de reações adversas observado em estudos clínicos em pacientes pediátricos de 7 a 18 anos de idade com TDM e TAG foi consistente com o perfil de reações adversas observado em estudos clínicos em adultos. As reações adversas mais comuns (≥5% e duas vezes placebo) observadas nesses ensaios clínicos pediátricos incluíram: náusea, diarreia, diminuição do peso e tontura.
A Tabela 6 fornece a incidência de reações adversas em ensaios pediátricos controlados por placebo para MDD e GAD que ocorreram em mais de 2% dos pacientes tratados com CYMBALTA e com uma incidência maior do que os pacientes tratados com placebo. CYMBALTA não está aprovado no tratamento de TDM em pacientes pediátricos [ver Uso em populações específicas ].
Outras reações adversas que ocorreram com incidência inferior a 2% e foram relatadas por mais pacientes tratados com CYMBALTA do que pacientes tratados com placebo em ensaios clínicos pediátricos de MDD e GAD incluíram: sonhos anormais (incluindo pesadelo), ansiedade, rubor (incluindo fogachos) ), hiperidrose, palpitações, pulso aumentado e tremor (CYMBALTA 20mg não está aprovado para tratar pacientes pediátricos com TDM).
Os sintomas mais comumente relatados após a descontinuação de CYMBALTA 30mg em ensaios clínicos pediátricos de MDD e GAD incluíram dor de cabeça, tontura, insônia e dor abdominal. AVISOS E PRECAUÇÕES ].
Crescimento (Altura e Peso) em Pacientes Pediátricos de 7 a 17 Anos com TAG e MDD
diminuição do apetite e a perda de peso foram observadas em associação com o uso de SSRIs e SNRIs. Pacientes pediátricos tratados com CYMBALTA em estudos clínicos experimentaram uma redução média de 0,1 kg no peso em 10 semanas, em comparação com um ganho médio de peso de aproximadamente 0,9 kg em pacientes pediátricos tratados com placebo. A proporção de pacientes que apresentaram uma diminuição clinicamente significativa no peso (≥3,5%) foi maior no grupo CYMBALTA do que no grupo placebo (16% e 6%, respectivamente). Subsequentemente, durante os períodos de extensão não controlados de 4 a 6 meses, os pacientes tratados com CYMBALTA, em média, tenderam à recuperação para o percentil de peso inicial esperado com base em dados populacionais de pares de idade e sexo.
Em estudos até 9 meses, os pacientes pediátricos tratados com CYMBALTA apresentaram um aumento na altura de 1,7 cm em média (aumento de 2,2 cm em pacientes de 7 a 11 anos de idade e aumento de 1,3 cm em pacientes de 12 a 17 anos de idade). Enquanto o aumento da altura foi observado durante esses estudos, foi observada uma diminuição média de 1% no percentil de altura (diminuição de 2% em pacientes de 7 a 11 anos de idade e aumento de 0,3% em pacientes de 12 a 17 anos de idade). O peso e a altura devem ser monitorados regularmente em pacientes pediátricos tratados com CYMBALTA [ver Uso em populações específicas ].
Reações Adversas em Pacientes Pediátricos de 13 a 17 Anos com Fibromialgia
A Tabela 7 fornece a incidência de reações adversas em um estudo pediátrico controlado por placebo para fibromialgia (Estudo FM-4) que ocorreu em mais de 5% dos pacientes tratados com CYMBALTA 30mg e com incidência maior do que pacientes tratados com placebo [ver Estudos clínicos ].
Experiência pós-marketing
As seguintes reações adversas foram identificadas durante o uso pós-aprovação de CYMBALTA. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento.
As reações adversas relatadas desde a introdução no mercado que foram temporariamente relacionadas à terapia com CYMBALTA 40mg e não mencionadas em outra parte da bula incluem: pancreatite aguda, reação anafilática, agressão e raiva (particularmente no início do tratamento ou após a interrupção do tratamento), edema angioneurótico, glaucoma de ângulo fechado, colite (microscópica ou não especificada), vasculite cutânea (às vezes associada a envolvimento sistêmico), distúrbio extrapiramidal, galactorréia, sangramento ginecológico, alucinações, hiperglicemia, hiperprolactinemia, hipersensibilidade, crise hipertensiva, espasmo muscular, erupção cutânea, síndrome das pernas inquietas, convulsões após a interrupção do tratamento, arritmia supraventricular, zumbido (após a descontinuação do tratamento), trismo e urticária.
INTERAÇÕES MEDICAMENTOSAS
Tanto o CYP1A2 quanto o CYP2D6 são responsáveis pelo metabolismo da duloxetina.
Inibidores de CYP1A2
Quando CYMBALTA 60 mg foi coadministrado com 100 mg de fluvoxamina, um potente inibidor de CYP1A2, em indivíduos do sexo masculino (n=14), a AUC da duloxetina aumentou aproximadamente 6 vezes, a Cmax aumentou cerca de 2,5 vezes e a duloxetina t1/2 foi aumentada. aumentou aproximadamente 3 vezes. Outros medicamentos que inibem o metabolismo do CYP1A2 incluem antimicrobianos cimetidina e quinolonas, como ciprofloxacino e enoxacino [ver AVISOS E PRECAUÇÕES ].
Inibidores de CYP2D6
O uso concomitante de CYMBALTA (40 mg uma vez ao dia) com paroxetina (20 mg uma vez ao dia) aumentou a concentração de duloxetina AUC em cerca de 60%, e maiores graus de inibição são esperados com doses mais altas de paroxetina. Efeitos semelhantes seriam esperados com outros inibidores potentes do CYP2D6 (por exemplo, fluoxetina, quinidina) [ver AVISOS E PRECAUÇÕES ].
Inibição dupla de CYP1A2 e CYP2D6
A administração concomitante de CYMBALTA 40 mg duas vezes ao dia com 100 mg de fluvoxamina, um potente inibidor de CYP1A2, a indivíduos com metabolização fraca de CYP2D6 (n=14) resultou em um aumento de 6 vezes na AUC e Cmax da duloxetina.
Medicamentos que interferem na hemostasia (por exemplo, AINEs, aspirina e varfarina)
liberação de serotonina pelas plaquetas desempenha um papel importante na hemostasia. Estudos epidemiológicos de desenho caso-controle e coorte que demonstraram associação entre o uso de psicofármacos que interferem na recaptação de serotonina e a ocorrência de hemorragia digestiva alta também mostraram que o uso concomitante de AINE ou aspirina pode potencializar esse risco de sangramento. Efeitos anticoagulantes alterados, incluindo sangramento aumentado, foram relatados quando ISRSs ou SNRIs são coadministrados com varfarina. A administração concomitante de varfarina (2-9 mg uma vez ao dia) em condições de estado de equilíbrio com CYMBALTA 60 ou 120 mg uma vez ao dia por até 14 dias em indivíduos saudáveis (n = 15) não alterou significativamente o INR desde o início (alterações médias do INR variaram de 0,05 a +0,07). A farmacocinética total da varfarina (ligada à proteína mais droga livre) (AUCτ,ss, Cmax,ss ou tmax,ss) para R- e S-varfarina não foi alterada pela duloxetina. Devido ao efeito potencial da duloxetina nas plaquetas, os pacientes que recebem terapia com varfarina devem ser cuidadosamente monitorados quando CYMBALTA for iniciado ou descontinuado [ver AVISOS E PRECAUÇÕES ].
Lorazepam
Sob condições de estado de equilíbrio para CYMBALTA (60 mg a cada 12 horas) e lorazepam (2 mg a cada 12 horas), a farmacocinética da duloxetina não foi afetada pela coadministração.
Temazepam
Sob condições de estado de equilíbrio para CYMBALTA (20 mg qhs) e temazepam (30 mg qhs), a farmacocinética da duloxetina não foi afetada pela coadministração.
Medicamentos que afetam a acidez gástrica
CYMBALTA possui um revestimento entérico que resiste à dissolução até atingir um segmento do trato gastrointestinal onde o pH excede 5,5. Em condições extremamente ácidas, CYMBALTA 20mg, desprotegido pelo revestimento entérico, pode sofrer hidrólise para formar naftol. Recomenda-se cautela ao usar CYMBALTA 30mg em pacientes com condições que podem retardar o esvaziamento gástrico (por exemplo, alguns diabéticos). Drogas que elevam o pH gastrointestinal podem levar a uma liberação precoce de duloxetina. No entanto, a coadministração de CYMBALTA 60mg com antiácidos contendo alumínio e magnésio (51 mEq) ou CYMBALTA com famotidina, não teve efeito significativo na taxa ou extensão da absorção de duloxetina após a administração de 40 mg oral.
Drogas Metabolizadas Por CYP1A2
Estudos de interação medicamentosa in vitro demonstram que a duloxetina não induz a atividade do CYP1A2. Portanto, não se prevê um aumento no metabolismo dos substratos do CYP1A2 (por exemplo, teofilina, cafeína) resultante da indução, embora não tenham sido realizados estudos clínicos de indução. A duloxetina é um inibidor da isoforma CYP1A2 em estudos in vitro e, em dois estudos clínicos, o aumento médio (intervalo de confiança de 90%) na AUC da teofilina foi de 7% (1%-15%) e 20% (13%-27%) quando coadministrado com CYMBALTA (60 mg duas vezes ao dia).
Drogas Metabolizadas Por CYP2D6
A duloxetina é um inibidor moderado do CYP2D6. Quando CYMBALTA foi administrado (na dose de 60 mg duas vezes ao dia) em conjunto com uma dose única de 50 mg de desipramina, um substrato do CYP2D6, a AUC da desipramina aumentou 3 vezes [ver AVISOS E PRECAUÇÕES ].
Drogas Metabolizadas pelo CYP2C9
Os resultados dos estudos in vitro demonstram que a duloxetina não inibe a atividade. Em um estudo clínico, a farmacocinética da S-varfarina, um substrato do CYP2C9, não foi significativamente afetada pela duloxetina [ver Medicamentos que interferem na hemostasia (por exemplo, AINEs, aspirina e varfarina) ].
Drogas Metabolizadas pelo CYP3A
Os resultados dos estudos in vitro demonstram que a duloxetina não inibe ou induz a atividade do CYP3A. Portanto, não se prevê um aumento ou diminuição do metabolismo dos substratos do CYP3A (por exemplo, contraceptivos orais e outros agentes esteróides) resultantes da indução ou inibição, embora não tenham sido realizados estudos clínicos.
Drogas Metabolizadas pelo CYP2C19
Os resultados dos estudos in vitro demonstram que a duloxetina não inibe a atividade do CYP2C19 em concentrações terapêuticas. A inibição do metabolismo dos substratos do CYP2C19 não é, portanto, prevista, embora não tenham sido realizados estudos clínicos.
Inibidores da Monoamino Oxidase (IMAO)
[Ver DOSAGEM E ADMINISTRAÇÃO , CONTRA-INDICAÇÕES , e AVISOS E PRECAUÇÕES ].
Drogas serotoninérgicas
[Ver DOSAGEM E ADMINISTRAÇÃO , CONTRA-INDICAÇÕES , e AVISOS E PRECAUÇÕES ].
Álcool
Quando CYMBALTA 40mg e etanol foram administrados com várias horas de intervalo para que as concentrações máximas de cada um coincidissem, CYMBALTA não aumentou o comprometimento das habilidades mentais e motoras causadas pelo álcool.
No banco de dados de ensaios clínicos CYMBALTA, três pacientes tratados com CYMBALTA tiveram lesão hepática manifestada por elevações de ALT e bilirrubina total, com evidência de obstrução. O uso substancial de etanol intercorrente estava presente em cada um desses casos, e isso pode ter contribuído para as anormalidades observadas [ver AVISOS E PRECAUÇÕES ].
Drogas do SNC
[Ver AVISOS E PRECAUÇÕES ].
Drogas Altamente Ligadas à Proteína do Plasma
Como a duloxetina se liga fortemente às proteínas plasmáticas, a administração de CYMBALTA 30mg a um paciente tomando outro medicamento com alta ligação às proteínas pode causar aumento das concentrações livres do outro medicamento, resultando potencialmente em reações adversas. No entanto, a coadministração de CYMBALTA (60 ou 120 mg) com varfarina (2-9 mg), um medicamento altamente ligado a proteínas, não resultou em alterações significativas no INR e na farmacocinética do S-total ou do R- total. varfarina (ligado à proteína mais droga livre) [ver Medicamentos que interferem na hemostasia (por exemplo, AINEs, aspirina e varfarina) ].
Abuso e Dependência de Drogas
Abuso
Em estudos com animais, a duloxetina não demonstrou potencial de abuso do tipo barbitúrico (depressor).
Embora CYMBALTA não tenha sido sistematicamente estudado em humanos por seu potencial de abuso, não houve indicação de comportamento de busca de drogas nos ensaios clínicos. No entanto, não é possível prever com base na experiência pré-comercialização até que ponto um medicamento ativo no SNC será mal utilizado, desviado e/ou abusado uma vez comercializado. Consequentemente, os médicos devem avaliar cuidadosamente os pacientes quanto ao histórico de abuso de drogas e acompanhá-los de perto, observando-os quanto a sinais de uso indevido ou abuso de CYMBALTA (por exemplo, desenvolvimento de tolerância, aumento da dose, comportamento de busca de drogas).
Dependência
Em estudos de dependência de drogas, a duloxetina não demonstrou potencial de produção de dependência em ratos.
AVISOS
Incluído como parte do "PRECAUÇÕES" Seção
PRECAUÇÕES
Pensamentos e Comportamentos Suicidas em Crianças, Adolescentes e Jovens Adultos
Pacientes com transtorno depressivo maior (TDM), adultos e pediátricos, podem apresentar piora de sua depressão e/ou surgimento de ideação e comportamento suicida (suicidalidade) ou mudanças incomuns de comportamento, estejam ou não tomando medicamentos antidepressivos, e isso risco pode persistir até que ocorra remissão significativa. O suicídio é um risco conhecido de depressão e alguns outros distúrbios psiquiátricos, e esses distúrbios são os mais fortes preditores de suicídio. Há uma preocupação de longa data, no entanto, de que os antidepressivos possam ter um papel na indução do agravamento da depressão e do surgimento de tendências suicidas em certos pacientes durante as fases iniciais do tratamento.
Análises combinadas de ensaios de curto prazo controlados por placebo de medicamentos antidepressivos (ISRSs e outros) mostraram que esses medicamentos aumentam o risco de pensamento e comportamento suicida (suicidalidade) em crianças, adolescentes e adultos jovens (idades de 1824) com transtorno depressivo maior. MDD) e outros transtornos psiquiátricos. Estudos de curto prazo não mostraram um aumento no risco de suicídio com antidepressivos em comparação com placebo em adultos com mais de 24 anos; houve uma redução com antidepressivos em comparação com placebo em adultos com 65 anos ou mais.
As análises agrupadas de estudos controlados por placebo em crianças e adolescentes com TDM, transtorno obsessivo compulsivo (TOC) ou outros transtornos psiquiátricos incluíram um total de 24 estudos de curto prazo de 9 medicamentos antidepressivos em mais de 4.400 pacientes. As análises agrupadas de estudos controlados por placebo em adultos com TDM ou outros transtornos psiquiátricos incluíram um total de 295 estudos de curto prazo (duração média de 2 meses) de 11 medicamentos antidepressivos em mais de 77.000 pacientes. Houve variação considerável no risco de suicídio entre as drogas, mas uma tendência de aumento nos pacientes mais jovens para quase todas as drogas estudadas. Houve diferenças no risco absoluto de suicídio entre as diferentes indicações, com maior incidência no TDM. O risco de diferenças (droga versus placebo), no entanto, foi relativamente estável dentro dos estratos de idade e entre as indicações. Essas diferenças de risco (diferença droga-placebo no número de casos de suicídio por 1.000 pacientes tratados) são fornecidas na Tabela 1.
Nenhum suicídio ocorreu em nenhum dos estudos pediátricos do CYMBALTA. Houve suicídios nos estudos de CYMBALTA 20mg em adultos, mas o número não foi suficiente para chegar a qualquer conclusão sobre o efeito de CYMBALTA no suicídio.
Não se sabe se o risco de suicídio se estende ao uso a longo prazo, ou seja, além de vários meses. No entanto, há evidências substanciais de ensaios de manutenção controlados por placebo em adultos com depressão de que o uso de antidepressivos pode retardar a recorrência da depressão.
Todos os pacientes em tratamento com antidepressivos para qualquer indicação devem ser monitorados adequadamente e observados de perto quanto a piora clínica, tendências suicidas e mudanças incomuns de comportamento, especialmente durante os primeiros meses de um curso de terapia medicamentosa, ou em momentos de mudanças de dose, ou aumentos ou diminui.
Os seguintes sintomas, ansiedade, agitação, ataques de pânico, insônia, irritabilidade, hostilidade, agressividade, impulsividade, acatisia (agitação psicomotora), hipomania e mania, foram relatados em pacientes adultos e pediátricos em tratamento com antidepressivos para transtorno depressivo maior. quanto a outras indicações, tanto psiquiátricas como não psiquiátricas. Embora não tenha sido estabelecida uma relação causal entre o surgimento de tais sintomas e o agravamento da depressão e/ou o surgimento de impulsos suicidas, existe a preocupação de que tais sintomas possam representar precursores de tendências suicidas emergentes.
Deve-se considerar a mudança do regime terapêutico, incluindo a possibilidade de descontinuação da medicação, em pacientes cuja depressão é persistentemente pior, ou que estão experimentando tendências suicidas emergentes ou sintomas que podem ser precursores de piora da depressão ou tendências suicidas, especialmente se esses sintomas forem graves, abruptos no início, ou não faziam parte dos sintomas de apresentação do paciente.
Se for tomada a decisão de descontinuar o tratamento, a medicação deve ser diminuída o mais rápido possível, mas com o reconhecimento de que a descontinuação pode estar associada a certos sintomas [ver DOSAGEM E ADMINISTRAÇÃO e Síndrome de descontinuação ] para descrições dos riscos de descontinuação de CYMBALTA.
Familiares e cuidadores de pacientes em tratamento com antidepressivos para transtorno depressivo maior ou outras indicações, tanto psiquiátricas quanto não psiquiátricas, devem ser alertados sobre a necessidade de monitorar os pacientes quanto ao surgimento de agitação, irritabilidade, alterações incomuns de comportamento e outros sintomas descritos acima , bem como o surgimento de tendências suicidas, e relatar tais sintomas imediatamente aos profissionais de saúde. Tal monitoramento deve incluir observação diária por familiares e cuidadores. As prescrições de CYMBALTA devem ser feitas para a menor quantidade de cápsulas compatível com o bom manejo do paciente, a fim de reduzir o risco de superdosagem.
Triagem de pacientes para transtorno bipolar
Um episódio depressivo maior pode ser a apresentação inicial do transtorno bipolar. Acredita-se geralmente (embora não estabelecido em ensaios controlados) que o tratamento de tal episódio com um antidepressivo sozinho pode aumentar a probabilidade de precipitação de um episódio misto/maníaco em pacientes com risco de transtorno bipolar. Não se sabe se algum dos sintomas descritos acima representa tal conversão. No entanto, antes de iniciar o tratamento com um antidepressivo, os pacientes com sintomas depressivos devem ser examinados adequadamente para determinar se estão em risco de transtorno bipolar; essa triagem deve incluir uma história psiquiátrica detalhada, incluindo uma história familiar de suicídio, transtorno bipolar e depressão. Deve-se notar que CYMBALTA não é aprovado para uso no tratamento da depressão bipolar.
Hepatotoxicidade
Houve relatos de insuficiência hepática, algumas vezes fatal, em pacientes tratados com CYMBALTA. Esses casos têm se apresentado como hepatite com dor abdominal, hepatomegalia e elevação das transaminases acima de vinte vezes o limite superior da normalidade (LSN) com ou sem icterícia, refletindo um padrão misto ou hepatocelular de lesão hepática. CYMBALTA 30mg deve ser descontinuado em pacientes que desenvolvem icterícia ou outra evidência de disfunção hepática clinicamente significativa e não deve ser retomado a menos que outra causa possa ser estabelecida.
Casos de icterícia colestática com elevação mínima dos níveis de transaminases também foram relatados. Outros relatos pós-comercialização indicam que transaminases, bilirrubina e fosfatase alcalina elevadas ocorreram em pacientes com doença hepática crônica ou cirrose.
CYMBALTA aumentou o risco de elevação dos níveis séricos de transaminases em ensaios clínicos de programas de desenvolvimento. As elevações das transaminases hepáticas resultaram na descontinuação de 0,3% (92/34.756) dos pacientes tratados com CYMBALTA. Na maioria dos pacientes, o tempo médio para detecção da elevação das transaminases foi de cerca de dois meses. Em estudos controlados por placebo em adultos, para pacientes com valores basais normais e anormais de ALT, a elevação de ALT > 3 vezes o LSN ocorreu em 1,25% (144/11.496) dos pacientes tratados com CYMBALTA em comparação com 0,45% (39/8716) do placebo -pacientes tratados. Em estudos controlados por placebo em adultos usando um desenho de dose fixa, houve evidência de uma relação dose-resposta de CYMBALTA para elevação de ALT e AST >3 vezes o LSN e >5 vezes o LSN, respectivamente.
Como é possível que CYMBALTA e álcool possam interagir para causar lesão hepática ou que CYMBALTA 20mg possa agravar doença hepática preexistente, CYMBALTA não deve ser prescrito a pacientes com uso substancial de álcool ou evidência de doença hepática crônica.
Hipotensão ortostática, quedas e síncope
Hipotensão ortostática, quedas e síncope foram relatados em pacientes tratados com as dosagens recomendadas de CYMBALTA. A síncope e a hipotensão ortostática tendem a ocorrer na primeira semana de terapia, mas podem ocorrer a qualquer momento durante o tratamento com CYMBALTA, particularmente após o aumento da dose. O risco de queda parece estar relacionado ao grau de diminuição ortostática da pressão arterial (PA), bem como outros fatores que podem aumentar o risco subjacente de quedas.
Em uma análise de pacientes de todos os estudos controlados com placebo, os pacientes tratados com CYMBALTA 20mg relataram uma maior taxa de quedas em comparação com os pacientes tratados com placebo. O risco parece estar relacionado à presença de diminuição ortostática da PA. O risco de diminuição da PA pode ser maior em pacientes que tomam medicamentos concomitantes que induzem hipotensão ortostática (como anti-hipertensivos) ou são inibidores potentes do CYP1A2 [ver AVISOS E PRECAUÇÕES e Interações Medicamentosas Clinicamente Importantes ] e em pacientes tomando CYMBALTA 20mg em doses acima de 60mg diariamente. Deve-se considerar a redução da dose ou descontinuação de CYMBALTA em pacientes que apresentarem hipotensão ortostática sintomática, quedas e/ou síncope durante a terapia com CYMBALTA 40mg.
risco de queda também parece ser proporcional ao risco subjacente de quedas de um paciente e parece aumentar de forma constante com a idade. Como os pacientes geriátricos tendem a ter um maior risco subjacente de quedas devido a uma maior prevalência de fatores de risco, como uso de vários medicamentos, comorbidades médicas e distúrbios da marcha, o impacto do aumento da idade por si só não é claro. Quedas com consequências graves, incluindo fraturas e hospitalizações, foram relatadas com o uso de CYMBALTA 30mg [ver REAÇÕES ADVERSAS ].
Síndrome da serotonina
desenvolvimento de uma síndrome serotoninérgica potencialmente fatal foi relatado com SNRIs e SSRIs, incluindo CYMBALTA 60mg, sozinho, mas particularmente com o uso concomitante de outros medicamentos serotoninérgicos (incluindo triptanos, antidepressivos tricíclicos, fentanil, lítio, tramadol, triptofano, buspirona, anfetaminas , e Erva de São João) e com medicamentos que prejudicam o metabolismo da serotonina (em particular, IMAOs, tanto aqueles destinados a tratar distúrbios psiquiátricos quanto outros, como linezolida e azul de metileno intravenoso).
Os sintomas da síndrome serotoninérgica podem incluir alterações do estado mental (p. ex., agitação, alucinações, delírio e coma), instabilidade autonômica (p. mioclonia, hiperreflexia, incoordenação), convulsões e/ou sintomas gastrointestinais (p. Os pacientes devem ser monitorados quanto ao surgimento de síndrome serotoninérgica.
uso concomitante de CYMBALTA 30mg com antidepressivos IMAOs é contraindicado. CYMBALTA 60mg também não deve ser iniciado em pacientes que estejam sendo tratados com IMAOs, como linezolida ou azul de metileno intravenoso. Todos os relatos com azul de metileno que forneceram informações sobre a via de administração envolveram administração intravenosa na faixa de dose de 1 mg/kg a 8 mg/kg. Nenhum relato envolveu a administração de azul de metileno por outras vias (como comprimidos orais ou injeção local no tecido) ou em doses mais baixas. Pode haver circunstâncias em que seja necessário iniciar o tratamento com um IMAO, como linezolida ou azul de metileno intravenoso em um paciente tomando CYMBALTA. CYMBALTA deve ser descontinuado antes de iniciar o tratamento com o IMAO [ver DOSAGEM E ADMINISTRAÇÃO e CONTRA-INDICAÇÕES ].
Se o uso concomitante de CYMBALTA 20mg com outros medicamentos serotoninérgicos, incluindo triptanos, antidepressivos tricíclicos, fentanil, lítio, tramadol, buspirona, triptofano, anfetaminas e Erva de São João for clinicamente justificado, os pacientes devem ser alertados sobre um risco potencial aumentado de síndrome serotoninérgica , particularmente durante o início do tratamento e aumentos de dose. O tratamento com CYMBALTA 60mg e quaisquer agentes serotoninérgicos concomitantes deve ser descontinuado imediatamente se os eventos acima ocorrerem e o tratamento sintomático de suporte deve ser iniciado.
Aumento do risco de sangramento
Medicamentos que interferem na inibição da recaptação da serotonina, incluindo CYMBALTA, podem aumentar o risco de eventos hemorrágicos. Relatos de casos e estudos epidemiológicos (caso-controle e desenho de coorte) têm demonstrado associação entre o uso de drogas que interferem na recaptação de serotonina e a ocorrência de sangramento gastrointestinal. Um estudo pós-comercialização mostrou uma maior incidência de hemorragia pós-parto em mães tomando CYMBALTA. Outros eventos hemorrágicos relacionados ao uso de SSRI e SNRI variaram de equimoses, hematomas, epistaxe e petéquias a hemorragias com risco de vida. O uso concomitante de aspirina, anti-inflamatórios não esteroides (AINEs), varfarina e outros anticoagulantes pode aumentar esse risco.
Informe os pacientes sobre o risco de sangramento associado ao uso concomitante de CYMBALTA e AINEs, aspirina ou outros medicamentos que afetam a coagulação [ver INTERAÇÕES MEDICAMENTOSAS ].
Reações Pele Graves
Reações cutâneas graves, incluindo eritema multiforme e síndrome de Stevens-Johnson (SSJ), podem ocorrer com CYMBALTA. A taxa de notificação de SSJ associada ao uso de CYMBALTA excede a taxa de incidência de base da população geral para esta reação cutânea grave (1 a 2 casos por milhão de pessoas por ano). A taxa de notificação é geralmente aceita como subestimada devido à subnotificação.
CYMBALTA deve ser descontinuado ao primeiro aparecimento de bolhas, erupções cutâneas, erosões da mucosa ou qualquer outro sinal de hipersensibilidade se nenhuma outra etiologia puder ser identificada.
Síndrome de descontinuação
Os sintomas de descontinuação foram sistematicamente avaliados em pacientes tomando CYMBALTA. Após a descontinuação abrupta ou gradual em estudos clínicos controlados por placebo em adultos, os seguintes sintomas ocorreram em 1% ou mais e em uma taxa significativamente maior em pacientes tratados com CYMBALTA em comparação com aqueles que descontinuaram o placebo: tontura, dor de cabeça, náusea, diarreia, parestesia, irritabilidade, vômitos, insônia, ansiedade, hiperidrose e fadiga.
Durante a comercialização de outros SSRIs e SNRIs (inibidores da recaptação de serotonina e norepinefrina), houve relatos espontâneos de eventos adversos que ocorreram após a descontinuação desses medicamentos, particularmente quando abruptos, incluindo o seguinte: humor disfórico, irritabilidade, agitação, tontura, distúrbios sensoriais. ex., parestesias como sensações de choque elétrico), ansiedade, confusão, dor de cabeça, letargia, labilidade emocional, insônia, hipomania, zumbido e convulsões. Embora esses eventos sejam geralmente autolimitados, alguns foram relatados como graves.
Os pacientes devem ser monitorados quanto a esses sintomas ao descontinuar o tratamento com CYMBALTA. Recomenda-se uma redução gradual da dose em vez de uma interrupção abrupta sempre que possível. Se ocorrerem sintomas intoleráveis após a diminuição da dose ou após a descontinuação do tratamento, pode-se considerar a retomada da dose prescrita anteriormente. Subsequentemente, o profissional de saúde pode continuar a diminuir a dose, mas a uma taxa mais gradual [ver DOSAGEM E ADMINISTRAÇÃO ].
Ativação de mania/hipomania
Em estudos controlados por placebo em adultos em pacientes com TDM, a ativação de mania ou hipomania foi relatada em 0,1% (4/3779) dos pacientes tratados com CYMBALTA e 0,04% (1/2536) dos pacientes tratados com placebo. Nenhuma ativação de mania ou hipomania foi relatada em estudos controlados por placebo de DPNP, GAD, fibromialgia ou dor musculoesquelética crônica. A ativação de mania ou hipomania foi relatada em uma pequena proporção de pacientes com transtornos do humor que foram tratados com outros medicamentos comercializados eficazes no tratamento do transtorno depressivo maior. Assim como com esses outros agentes, CYMBALTA 60mg deve ser usado com cautela em pacientes com história de mania.
Glaucoma de ângulo fechado
A dilatação pupilar que ocorre após o uso de muitos medicamentos antidepressivos, incluindo CYMBALTA, pode desencadear um ataque de fechamento angular em um paciente com ângulos anatomicamente estreitos que não tenha uma iridectomia patente.
Convulsões
CYMBALTA não foi sistematicamente avaliado em pacientes com distúrbios convulsivos, e esses pacientes foram excluídos dos estudos clínicos. Em ensaios clínicos controlados por placebo em adultos, ocorreram convulsões/convulsões em 0,02% (3/12.722) dos doentes tratados com CYMBALTA 60 mg e 0,01% (1/9513) dos doentes tratados com placebo. CYMBALTA deve ser prescrito com cuidado em pacientes com histórico de convulsões.
Aumento da Pressão Arterial
Em estudos clínicos controlados por placebo em adultos em populações adultas aprovadas, desde a linha de base até o desfecho, o tratamento com CYMBALTA foi associado a aumentos médios de 0,5 mm Hg na pressão arterial sistólica e 0,8 mm Hg na pressão arterial diastólica em comparação com reduções médias de 0,6 mm Hg sistólica e 0,3 mm Hg diastólica em pacientes tratados com placebo. Não houve diferença significativa na frequência de pressão arterial elevada sustentada (3 visitas consecutivas). Em um estudo de farmacologia clínica projetado para avaliar os efeitos de CYMBALTA 60mg em vários parâmetros, incluindo pressão arterial em doses supraterapêuticas com titulação acelerada da dose, houve evidência de aumentos na pressão arterial em decúbito dorsal em doses de até 200 mg duas vezes ao dia (aproximadamente 3,3 vezes a dosagem máxima recomendada). Na dose mais alta de 200 mg duas vezes ao dia, o aumento na frequência cardíaca média foi de 5,0 a 6,8 batimentos e os aumentos na pressão arterial média foram de 4,7 a 6,8 mm Hg (sistólica) e 4,5 a 7 mm Hg (diastólica) até 12 horas após a dosagem .
pressão arterial deve ser medida antes do início do tratamento e periodicamente medida durante todo o tratamento [ver REAÇÕES ADVERSAS ].
Interações Medicamentosas Clinicamente Importantes
Tanto o CYP1A2 quanto o CYP2D6 são responsáveis pelo metabolismo do CYMBALTA.
Potencial para outras drogas afetarem CYMBALTA
Inibidores de CYP1A2
A coadministração de CYMBALTA 40mg com inibidores potentes do CYP1A2 deve ser evitada [ver INTERAÇÕES MEDICAMENTOSAS ].
Inibidores de CYP2D6
Como o CYP2D6 está envolvido no metabolismo do CYMBALTA, o uso concomitante de CYMBALTA com inibidores potentes do CYP2D6 resultaria e resulta em concentrações mais altas (em média de 60%) de CYMBALTA [ver INTERAÇÕES MEDICAMENTOSAS ].
Potencial para CYMBALTA 30mg para afetar outras drogas
Drogas Metabolizadas pelo CYP2D6
coadministração de CYMBALTA 20mg com medicamentos que são extensivamente metabolizados pelo CYP2D6 e que têm um índice terapêutico estreito, incluindo certos antidepressivos (antidepressivos tricíclicos [ATC], como nortriptilina, amitriptilina e imipramina), fenotiazinas e antiarrítmicos do tipo 1C (por exemplo, propafenona, flecainida), devem ser abordados com cautela. As concentrações plasmáticas de TCA podem precisar ser monitoradas e a dose de TCA pode precisar ser reduzida se um TCA for coadministrado com CYMBALTA. Devido ao risco de arritmias ventriculares graves e morte súbita potencialmente associada a níveis plasmáticos elevados de tioridazina, CYMBALTA 30mg e tioridazina não devem ser coadministrados [ver INTERAÇÕES MEDICAMENTOSAS ].
Outras interações medicamentosas clinicamente importantes
Álcool
O uso de CYMBALTA 40 mg concomitantemente com a ingestão excessiva de álcool pode estar associado a lesão hepática grave. Por esta razão, CYMBALTA 60mg não deve ser prescrito para pacientes com uso substancial de álcool [ver Hepatotoxicidade e INTERAÇÕES MEDICAMENTOSAS ].
Drogas que Agem no SNC
Devido aos efeitos primários de CYMBALTA no SNC, ele deve ser usado com cautela quando administrado em combinação ou em substituição a outros medicamentos de ação central, incluindo aqueles com mecanismo de ação semelhante. Interações Medicamentosas Clinicamente Importantes e INTERAÇÕES MEDICAMENTOSAS ].
Hiponatremia
A hiponatremia pode ocorrer como resultado do tratamento com ISRSs e SNRIs, incluindo CYMBALTA. Em muitos casos, essa hiponatremia parece ser o resultado da síndrome da secreção inapropriada do hormônio antidiurético (SIADH). Casos com sódio sérico inferior a 110 mmol/L foram relatados com o uso de CYMBALTA 40mg e pareceram ser reversíveis quando CYMBALTA foi descontinuado. Pacientes geriátricos podem estar em maior risco de desenvolver hiponatremia com SSRIs e SNRIs. Além disso, pacientes em uso de diuréticos ou com depleção de volume podem estar em maior risco [ver Uso em populações específicas ]. A descontinuação de CYMBALTA deve ser considerada em pacientes com hiponatremia sintomática e intervenção médica apropriada deve ser instituída.
Sinais e sintomas de hiponatremia incluem dor de cabeça, dificuldade de concentração, comprometimento da memória, confusão, fraqueza e instabilidade, o que pode levar a quedas. Casos mais graves e/ou agudos têm sido associados a alucinações, síncope, convulsão, coma, parada respiratória e morte.
Uso em pacientes com doenças concomitantes
A experiência clínica com CYMBALTA em pacientes com doenças sistêmicas concomitantes é limitada. Não há informações sobre o efeito que as alterações na motilidade gástrica podem ter na estabilidade do revestimento entérico de CYMBALTA. Em condições extremamente ácidas, CYMBALTA, desprotegido pelo revestimento entérico, pode sofrer hidrólise para formar naftol. Recomenda-se cautela no uso de CYMBALTA em pacientes com condições que podem retardar o esvaziamento gástrico (por exemplo, alguns diabéticos).
CYMBALTA 30mg não foi sistematicamente avaliado em pacientes com história recente de infarto do miocárdio ou doença arterial coronariana instável. Os pacientes com esses diagnósticos foram geralmente excluídos dos estudos clínicos durante os testes de pré-comercialização do produto.
Insuficiência hepática
Evitar o uso em pacientes com doença hepática crônica ou cirrose [ver DOSAGEM E ADMINISTRAÇÃO , Hepatotoxicidade , e Uso em populações específicas ].
Insuficiência Renal Grave
Evitar o uso em pacientes com insuficiência renal grave, TFG DOSAGEM E ADMINISTRAÇÃO e Uso em populações específicas ].
Controle glicêmico em pacientes com diabetes
Conforme observado em estudos com DPNP, o tratamento com CYMBALTA 30mg piorou o controle glicêmico em alguns pacientes com diabetes. Em três ensaios clínicos de CYMBALTA para o tratamento da dor neuropática associada à neuropatia periférica diabética [ver Estudos clínicos ], a duração média do diabetes foi de aproximadamente 12 anos, a glicemia de jejum média basal foi de 176 mg/dL e a hemoglobina A1c basal média (HbA1c) foi de 7,8%. Na fase de tratamento agudo de 12 semanas desses estudos, CYMBALTA foi associado a um pequeno aumento na glicemia de jejum média em comparação ao placebo. Na fase de extensão desses estudos, que durou até 52 semanas, a glicemia média em jejum aumentou 12 mg/dL no grupo CYMBALTA 40mg e diminuiu 11,5 mg/dL no grupo de cuidados de rotina. HbA1c aumentou 0,5% no grupo CYMBALTA 40mg e 0,2% no grupo de cuidados de rotina.
Hesitação e retenção urinária
CYMBALTA 60mg está em uma classe de medicamentos conhecidos por afetar a resistência uretral. Se sintomas de hesitação urinária se desenvolverem durante o tratamento com CYMBALTA 20mg, deve-se considerar a possibilidade de que possam estar relacionados ao medicamento.
Na experiência pós-comercialização, foram observados casos de retenção urinária. Em alguns casos de retenção urinária associada ao uso de CYMBALTA 60mg, foi necessária hospitalização e/ou cateterismo.
Disfunção Sexual
O uso de SNRIs, incluindo CYMBALTA 60mg, pode causar sintomas de disfunção sexual [ver REAÇÕES ADVERSAS ]. Em pacientes do sexo masculino, o uso de SNRI pode resultar em atraso ou falha ejaculatória, diminuição da libido e disfunção erétil. Em pacientes do sexo feminino, o uso de SNRI pode resultar em diminuição da libido e orgasmo atrasado ou ausente.
É importante que os prescritores perguntem sobre a função sexual antes do início de CYMBALTA 40mg e perguntem especificamente sobre alterações na função sexual durante o tratamento, porque a função sexual pode não ser relatada espontaneamente. Ao avaliar as alterações na função sexual, é importante obter uma história detalhada (incluindo o momento do início dos sintomas) porque os sintomas sexuais podem ter outras causas, incluindo o transtorno psiquiátrico subjacente. Discutir estratégias de gestão potenciais para apoiar os pacientes na tomada de decisões informadas sobre o tratamento.
Informação de Aconselhamento do Paciente
Aconselhe o paciente a ler o rótulo do paciente aprovado pela FDA ( Guia de Medicação ).
Pensamentos e Comportamentos Suicidas
Aconselhe os pacientes, seus familiares e seus cuidadores a procurar o surgimento de ideação e comportamento suicida, especialmente durante o tratamento e quando a dose for ajustada para cima ou para baixo e instrua-os a relatar esses sintomas ao seu médico [ver AVISO DE CAIXA e AVISOS E PRECAUÇÕES ].
Administração
Aconselhe os pacientes a engolir CYMBALTA 20mg inteiro e a não mastigar, esmagar ou abrir a cápsula (não borrifar o conteúdo nos alimentos ou misturado com líquidos), pois essas ações podem afetar o revestimento entérico.
Hepatotoxicidade
Informe os pacientes que problemas hepáticos graves, às vezes fatais, foram relatados em pacientes tratados com CYMBALTA. Instrua os pacientes a conversar com seu médico se desenvolverem coceira, dor na parte superior direita da barriga, urina escura ou pele/olhos amarelos enquanto estiver tomando CYMBALTA, que podem ser sinais de problemas no fígado. Instrua os pacientes a conversar com seu médico sobre o consumo de álcool. O uso de CYMBALTA com ingestão excessiva de álcool pode estar associado a lesão hepática grave [ver AVISOS E PRECAUÇÕES ].
Álcool
Embora CYMBALTA não aumente o comprometimento das habilidades mentais e motoras causadas pelo álcool, o uso de CYMBALTA concomitantemente com a ingestão pesada de álcool pode estar associado a lesão hepática grave [ver AVISOS E PRECAUÇÕES e INTERAÇÕES MEDICAMENTOSAS ].
Hipotensão ortostática, quedas e síncope
Aconselhar os pacientes sobre o risco de hipotensão ortostática, quedas e síncope, especialmente durante o período de uso inicial e subsequente aumento da dose, e em associação com o uso concomitante de medicamentos que possam potencializar o efeito ortostático de CYMBALTA [ver AVISOS E PRECAUÇÕES ].
Síndrome da serotonina
Alertar os pacientes sobre o risco de síndrome serotoninérgica com o uso concomitante de CYMBALTA 30mg e outros agentes serotoninérgicos, incluindo triptanos, antidepressivos tricíclicos, fentanil, lítio, tramadol, buspirona, triptofano, anfetaminas e erva de São João [ver CONTRA-INDICAÇÕES , AVISOS E PRECAUÇÕES , e INTERAÇÕES MEDICAMENTOSAS ]. Aconselhar os pacientes sobre os sinais e sintomas associados à síndrome serotoninérgica que podem incluir alterações do estado mental (por exemplo, agitação, alucinações, delírio e coma), instabilidade autonômica (por exemplo, taquicardia, pressão arterial instável, tontura, sudorese, rubor, hipertermia), alterações neuromusculares (por exemplo, tremor, rigidez, mioclonia, hiperreflexia, incoordenação), convulsões e/ou sintomas gastrointestinais (por exemplo, náusea, vômito, diarreia). Aconselhe os pacientes a procurar atendimento médico imediatamente se apresentarem esses sintomas.
Aumento do risco de sangramento
Alertar os pacientes sobre o uso concomitante de CYMBALTA 30mg e AINEs, aspirina, varfarina ou outros medicamentos que afetem a coagulação, pois o uso combinado de psicotrópicos que interferem na recaptação de serotonina e esses agentes tem sido associado a um risco aumentado de sangramento [ver AVISOS E PRECAUÇÕES e Uso em populações específicas ].
Reações Pele Graves
Alerte os pacientes que CYMBALTA pode causar reações cutâneas graves. Isso pode precisar ser tratado em um hospital e pode ser fatal. Aconselhe os pacientes a ligar para o médico imediatamente ou obter ajuda de emergência se tiverem bolhas na pele, erupções cutâneas, feridas na boca, urticária ou qualquer outra reação alérgica [ver AVISOS E PRECAUÇÕES ].
Descontinuação do tratamento
Instruir os pacientes que a descontinuação de CYMBALTA 30mg pode estar associada a sintomas como tontura, dor de cabeça, náuseas, diarreia, parestesia, irritabilidade, vômitos, insônia, ansiedade, hiperidrose e fadiga, e devem ser aconselhados a não alterar o regime posológico ou interromper tomando CYMBALTA sem consultar seu médico [ver AVISOS E PRECAUÇÕES ].
Ativação de mania ou hipomania
Triagem adequada de pacientes com sintomas depressivos quanto ao risco de transtorno bipolar (por exemplo, história familiar de suicídio, transtorno bipolar e depressão) antes de iniciar o tratamento com CYMBALTA. Aconselhe os pacientes a relatar quaisquer sinais ou sintomas de uma reação maníaca, como aumento de energia, problemas graves para dormir, pensamentos acelerados, comportamento imprudente, falar mais ou mais rápido do que o habitual, ideias excepcionalmente grandiosas e felicidade ou irritabilidade excessivas [ver AVISOS E PRECAUÇÕES ].
Glaucoma de ângulo fechado
Avise os pacientes que tomar CYMBALTA 40mg pode causar dilatação pupilar leve, que em indivíduos suscetíveis, pode levar a um episódio de glaucoma de ângulo fechado. O glaucoma pré-existente é quase sempre o glaucoma de ângulo aberto porque o glaucoma de ângulo fechado, quando diagnosticado, pode ser tratado definitivamente com iridectomia. O glaucoma de ângulo aberto não é um fator de risco para o glaucoma de ângulo fechado. Os pacientes podem desejar ser examinados para determinar se são suscetíveis ao fechamento do ângulo e realizar um procedimento profilático (por exemplo, iridectomia), se forem suscetíveis [ver AVISOS E PRECAUÇÕES ].
Convulsões
Aconselhe os pacientes a informarem seu médico se tiverem histórico de transtorno convulsivo [ver AVISOS E PRECAUÇÕES ].
Efeitos sobre a pressão arterial
Alertar os pacientes de que CYMBALTA 60mg pode causar aumento da pressão arterial [ver AVISOS E PRECAUÇÕES ].
Medicamentos Concomitantes
Aconselhe os pacientes a informarem seu médico se estiverem tomando, ou planejam tomar, qualquer prescrição ou medicamentos de venda livre, uma vez que existe potencial para interações [ver DOSAGEM E ADMINISTRAÇÃO , CONTRA-INDICAÇÕES , AVISOS E PRECAUÇÕES , e INTERAÇÕES MEDICAMENTOSAS ].
Hiponatremia
Avise os pacientes que hiponatremia foi relatada como resultado do tratamento com SNRIs e SSRIs, incluindo CYMBALTA. Aconselhe os pacientes sobre os sinais e sintomas de hiponatremia [ver AVISOS E PRECAUÇÕES ].

Doenças Concomitantes
Aconselhe os pacientes a informar seu médico sobre todas as suas condições médicas [ver AVISOS E PRECAUÇÕES ].
Hesitação e retenção urinária
CYMBALTA está em uma classe de medicamentos que podem afetar a micção. Instrua os pacientes a consultar seu médico se desenvolverem algum problema com o fluxo de urina [ver AVISOS E PRECAUÇÕES ].
Disfunção Sexual
Avise os pacientes que o uso de CYMBALTA 40mg pode causar sintomas de disfunção sexual em pacientes do sexo masculino e feminino. Informe os pacientes que eles devem discutir quaisquer alterações na função sexual e possíveis estratégias de manejo com seu médico [ver AVISOS E PRECAUÇÕES ].
Gravidez
- Aconselhe as mulheres a notificarem o seu médico se engravidarem ou pretendem engravidar durante o tratamento com CYMBALTA.
- Aconselhar as mulheres grávidas ou pacientes que pretendem engravidar que o uso de CYMBALTA 40mg durante o mês anterior ao parto pode aumentar o risco de hemorragia pós-parto e pode aumentar o risco de complicações neonatais que requerem hospitalização prolongada, suporte respiratório e alimentação por sonda.
- Aconselhar as mulheres grávidas que há risco de recaída com a descontinuação dos antidepressivos.
- Avisar as pacientes de que existe um registro de exposição à gravidez que monitora os resultados da gravidez em mulheres expostas à duloxetina durante a gravidez [ver Uso em populações específicas ].
Lactação
Aconselhe as mulheres que amamentam usando CYMBALTA 30mg a monitorar os bebês quanto à sedação, alimentação inadequada e ganho de peso insuficiente e a procurar atendimento médico se notarem esses sinais [ver Uso em populações específicas ].
Interferência com o desempenho psicomotor
CYMBALTA 30mg pode estar associado a sedação e tontura. Portanto, alerte os pacientes sobre a operação de máquinas perigosas, incluindo automóveis, até que tenham certeza razoável de que a terapia com CYMBALTA não afeta sua capacidade de realizar tais atividades.
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Carcinogênese
A duloxetina foi administrada na dieta de camundongos e ratos por 2 anos.
Em camundongos fêmeas recebendo duloxetina a 140 mg/kg/dia (3 vezes a dose humana máxima recomendada (MRHD) de 120 mg/dia administrada a crianças na base de mg/m2), houve um aumento na incidência de adenomas hepatocelulares e carcinomas. A dose sem efeito foi de 50 mg/kg/dia (1 vez a MRHD administrada a crianças). A incidência de tumor não foi aumentada em camundongos machos recebendo duloxetina em doses de até 100 mg/kg/dia (2 vezes o MRHD administrado a crianças).
Em ratos, doses dietéticas de duloxetina até 27 mg/kg/dia em fêmeas (1 vez a MRHD administrada a crianças) e até 36 mg/kg/dia em machos (1,4 vezes a MRHD administrada a crianças) não aumentaram a incidência de tumores.
Mutagênese
duloxetina não foi mutagênica no ensaio de mutação reversa bacteriana in vitro (teste de Ames) e não foi clastogênica em um teste de aberração cromossômica in vivo em células de medula óssea de camundongo. Além disso, a duloxetina não foi genotóxica em um ensaio de mutação genética direta de mamífero in vitro em células de linfoma de camundongo ou em um ensaio de síntese de DNA não programada (UDS) in vitro em hepatócitos primários de rato e não induziu troca de cromátides irmãs na medula óssea de hamster chinês in vivo .
Prejuízo da Fertilidade
A duloxetina administrada oralmente a ratos machos ou fêmeas antes e durante o acasalamento em doses de até 45 mg/kg/dia (3 vezes a MRHD administrada a adolescentes na base de mg/m2) não alterou o acasalamento ou a fertilidade.
Uso em populações específicas
Gravidez
Registro de Exposição à Gravidez
Existe um registro de exposição na gravidez que monitora os resultados da gravidez em mulheres expostas a CYMBALTA durante a gravidez. Para se inscrever, entre em contato com o Registro de Gravidez CYMBALTA em 1-866-814-6975 ou www.cymbalta 20mgpregnancyregistry.com.
Resumo do risco
Dados de um estudo de coorte retrospectivo pós-comercialização indicam que o uso de duloxetina no mês anterior ao parto pode estar associado a um risco aumentado de hemorragia pós-parto. Dados da literatura publicada e de um estudo de coorte retrospectivo pós-comercialização não identificaram um risco claro associado ao medicamento de grandes defeitos congênitos ou outros resultados adversos de desenvolvimento (ver Dados ). Existem riscos associados à depressão e fibromialgia não tratadas na gravidez e à exposição a SNRIs e SSRIs, incluindo CYMBALTA, durante a gravidez (ver Considerações Clínicas ).
Em ratos e coelhos tratados com duloxetina durante o período de organogênese, os pesos fetais diminuíram, mas não houve evidência de efeitos no desenvolvimento em doses de até 3 e 6 vezes, respectivamente, a dose humana máxima recomendada (MRHD) de 120 mg/dia administrada para adolescentes em mg/m2. Quando a duloxetina foi administrada oralmente a ratas grávidas durante a gestação e lactação, o peso dos filhotes ao nascimento e a sobrevivência dos filhotes até 1 dia pós-parto foram reduzidos em uma dose 2 vezes a MRHD administrada a adolescentes na base de mg/m2. Nesta dose, foram observados comportamentos dos filhotes consistentes com aumento da reatividade, como aumento da resposta de sobressalto ao ruído e diminuição da habituação da atividade locomotora. O crescimento pós-desmame não foi afetado negativamente.
risco de fundo estimado de defeitos congênitos graves e aborto espontâneo para a população indicada é desconhecido. Todas as gestações têm um risco histórico de defeitos congênitos, perda ou outros resultados adversos. Na população geral dos EUA, o risco de fundo estimado de defeitos congênitos graves e aborto espontâneo em gestações clinicamente reconhecidas é de 2 a 4% e 15 a 20%, respectivamente.
Considerações Clínicas
Risco materno e/ou embrionário/fetal associado à doença
As mulheres que descontinuam os antidepressivos durante a gravidez são mais propensas a ter uma recaída de depressão maior do que as mulheres que continuam os antidepressivos. Esse achado é de um estudo prospectivo, longitudinal, que acompanhou 201 gestantes com histórico de transtorno depressivo maior, eutímicas e em uso de antidepressivos no início da gravidez. Considere o risco de depressão não tratada ao interromper ou alterar o tratamento com medicação antidepressiva durante a gravidez e pós-parto.
Gestantes com fibromialgia apresentam risco aumentado de desfechos maternos e infantis adversos, incluindo ruptura prematura de membranas, parto prematuro, pequeno para a idade gestacional, restrição de crescimento intrauterino, ruptura placentária e trombose venosa. Não se sabe se esses desfechos maternos e fetais adversos são resultado direto da fibromialgia ou de outros fatores comórbidos.
Reações Adversas Maternas
O uso de duloxetina no mês anterior ao parto pode estar associado a um risco aumentado de hemorragia pós-parto [ver AVISOS E PRECAUÇÕES ].
Reação Adversa Fetal/Neonatal
Recém-nascidos expostos a CYMBALTA e outros SNRIs ou SSRIs no final do terceiro trimestre desenvolveram complicações que requerem hospitalização prolongada, suporte respiratório e alimentação por sonda. Tais complicações podem surgir imediatamente após o parto. Os achados clínicos relatados incluíram desconforto respiratório, cianose, apnéia, convulsões, instabilidade de temperatura, dificuldade de alimentação, vômitos, hipoglicemia, hipotonia, hipertonia, hiperreflexia, tremor, nervosismo, irritabilidade e choro constante. Esses achados são consistentes com um efeito tóxico direto dos SNRIs ou SSRIs, ou possivelmente, uma síndrome de descontinuação da droga. Deve-se notar que, em alguns casos, o quadro clínico é compatível com síndrome serotoninérgica [ver AVISOS E PRECAUÇÕES ].
Dados
Dados humanos
Dados de um estudo de coorte retrospectivo pós-comercialização baseado em alegações encontraram um risco aumentado de hemorragia pós-parto entre 955 mulheres grávidas expostas à duloxetina no último mês de gravidez em comparação com 4.128.460 mulheres grávidas não expostas (risco relativo ajustado: 1,53; IC 95%: 1,08-2,18 ). O mesmo estudo não encontrou um aumento clinicamente significativo no risco de defeitos congênitos graves na comparação de 2.532 mulheres expostas à duloxetina no primeiro trimestre de gravidez com 1.284.827 mulheres não expostas após ajuste para vários fatores de confusão. As limitações metodológicas incluem possível confusão residual, classificação errônea da exposição e dos resultados, falta de medidas diretas da gravidade da doença e falta de informações sobre uso de álcool, nutrição e exposições a medicamentos de venda livre.
Dados de animais
Em estudos de reprodução em animais, a duloxetina demonstrou ter efeitos adversos no desenvolvimento embrio/fetal e pós-natal.
Quando a duloxetina foi administrada por via oral a ratas e coelhas grávidas durante o período de organogênese, não houve evidência de malformações ou variações de desenvolvimento em doses de até 45 mg/kg/dia [3 e 6 vezes, respectivamente, a MRHD de 120 mg/dia administrado a adolescentes na base de mg/m2]. No entanto, os pesos fetais foram reduzidos com esta dose, com uma dose sem efeito de 10 mg/kg/dia (aproximadamente igual à MRHD em ratos e 2 vezes a MRHD em coelhos).
Quando a duloxetina foi administrada oralmente a ratas grávidas durante a gestação e lactação, a sobrevivência dos filhotes até 1 dia pós-parto e os pesos corporais dos filhotes ao nascimento e durante o período de lactação foram reduzidos na dose de 30 mg/kg/dia (2 vezes o MRHD administrado para adolescentes na base de mg/m2); a dose sem efeito foi de 10 mg/kg/dia. Além disso, comportamentos consistentes com aumento da reatividade, como aumento da resposta de sobressalto ao ruído e diminuição da habituação da atividade locomotora, foram observados em filhotes após a exposição materna a 30 mg/kg/dia. O crescimento pós-desmame e o desempenho reprodutivo da progênie não foram afetados negativamente pelo tratamento materno com duloxetina.
Lactação
Resumo do risco
Dados da literatura publicada relatam a presença de duloxetina no leite humano (ver Dados ). Há relatos de sedação, má alimentação e baixo ganho de peso em bebês expostos à duloxetina através do leite materno (ver Considerações Clínicas ). Não existem dados sobre o efeito da duloxetina na produção de leite.
Os benefícios do aleitamento materno para o desenvolvimento e para a saúde devem ser considerados juntamente com a necessidade clínica de CYMBALTA da mãe e quaisquer efeitos adversos potenciais do CYMBALTA na criança amamentada ou da condição materna subjacente.
Considerações Clínicas
Bebês expostos a CYMBALTA devem ser monitorados quanto à sedação, má alimentação e baixo ganho de peso.
Dados
A disposição de CYMBALTA 60mg foi estudada em 6 mulheres lactantes com pelo menos 12 semanas de pós-parto e que optaram por desmamar seus bebês. As mulheres receberam 40 mg de CYMBALTA 60 mg duas vezes ao dia por 3,5 dias. O pico de concentração medido no leite materno ocorreu em média 3 horas após a dose. A quantidade de CYMBALTA no leite materno foi de aproximadamente 7 mcg/dia durante essa dose; a dose infantil diária estimada foi de aproximadamente 2 mcg/kg/dia, que é menos de 1% da dose materna. A presença de metabólitos de CYMBALTA 40mg no leite materno não foi examinada.
Uso Pediátrico
segurança e eficácia de CYMBALTA 60mg foram estabelecidas para o tratamento do transtorno de ansiedade generalizada (TAG) em pacientes de 7 a 17 anos de idade e para o tratamento da síndrome da fibromialgia juvenil em pacientes de 13 a 17 anos de idade. A segurança e a eficácia de CYMBALTA 20mg não foram estabelecidas em pacientes pediátricos com transtorno depressivo maior (TDM), dor neuropática periférica diabética ou dor musculoesquelética crônica.
Os antidepressivos aumentaram o risco de pensamentos e comportamentos suicidas em pacientes pediátricos. Monitore todos os pacientes pediátricos em tratamento com antidepressivos quanto à piora clínica e surgimento de pensamentos e comportamentos suicidas, especialmente durante os primeiros meses de tratamento, ou em momentos de mudanças de dosagem [ver AVISOS E PRECAUÇÕES ]. Realizar monitoramento regular de peso e crescimento em pacientes pediátricos tratados com CYMBALTA [ver REAÇÕES ADVERSAS ].
Distúrbio de ansiedade generalizada
uso de CYMBALTA para o tratamento de TAG em pacientes de 7 a 17 anos de idade é apoiado por um estudo controlado por placebo de 10 semanas (GAD-6). O estudo incluiu 272 pacientes pediátricos com TAG, dos quais 47% tinham 7 a 11 anos de idade (53% tinham 12 a 17 anos de idade). CYMBALTA demonstrou superioridade em relação ao placebo, medida pela maior melhora na Escala de Avaliação de Ansiedade Pediátrica (PARS) para pontuação de gravidade GAD [ver Estudos clínicos ].
A segurança e eficácia de CYMBALTA 20mg para o tratamento de TAG em pacientes pediátricos com menos de 7 anos de idade não foram estabelecidas.
Fibromialgia
O uso de CYMBALTA para o tratamento da fibromialgia em pacientes de 13 a 17 anos de idade é apoiado por um estudo controlado por placebo de 13 semanas em 184 pacientes com síndrome de fibromialgia juvenil (Estudo FM-4). CYMBALTA mostrou melhora em relação ao placebo no desfecho primário, mudança da linha de base para o final do tratamento no Inventário Breve de Dor (BPI) - Formulário Curto Modificado: Classificação da gravidade da dor média em 24 horas da versão para adolescentes [consulte Estudos clínicos ].
segurança e eficácia de CYMBALTA para o tratamento da fibromialgia em pacientes com menos de 13 anos de idade não foram estabelecidas.
Transtorno Depressivo Maior
A segurança e eficácia de CYMBALTA não foram estabelecidas em pacientes pediátricos para o tratamento de MDD.
A eficácia de CYMBALTA não foi demonstrada em dois estudos controlados por placebo de 10 semanas com 800 pacientes pediátricos de 7 a 17 anos com MDD (MDD-6 e MDD-7). Nem CYMBALTA nem um controle ativo (aprovado para tratamento de MDD pediátrico) foi superior ao placebo.
As reações adversas observadas com mais frequência nos ensaios clínicos pediátricos do MDD incluíram náusea, dor de cabeça, diminuição do peso e dor abdominal. A diminuição do apetite e a perda de peso foram observadas em associação com o uso de SSRIs e SNRIs.
Dados de toxicologia de animais juvenis
administração de duloxetina a ratos jovens do dia 21 pós-natal (desmame) até o dia 90 pós-natal (adulto) resultou em diminuição do peso corporal que persistiu até a idade adulta, mas se recuperou quando o tratamento medicamentoso foi descontinuado; maturação sexual ligeiramente atrasada (~1,5 dias) nas fêmeas, sem qualquer efeito sobre a fertilidade; e atraso no aprendizado de uma tarefa complexa na vida adulta, o que não foi observado após a interrupção do tratamento medicamentoso. Esses efeitos foram observados na dose alta de 45 mg/kg/dia (2 vezes a MRHD, para uma criança); o nível sem efeito foi de 20 mg/kg/dia (≈1 vezes o MRHD, para uma criança).
Uso Geriátrico
Exposição geriátrica em ensaios clínicos pré-comercialização de CYMBALTA
- Dos 2.418 pacientes em estudos de MDD, 6% (143) tinham 65 anos de idade ou mais.
- Dos 1.041 pacientes nos estudos de LBC, 21% (221) tinham 65 anos ou mais.
- Dos 487 pacientes em estudos de OA, 41% (197) tinham 65 anos de idade ou mais.
- Dos 1.074 pacientes nos estudos DPNP, 33% (357) tinham 65 anos ou mais.
- Dos 1.761 pacientes em estudos de FM, 8% (140) tinham 65 anos de idade ou mais.
Nos estudos MDD, GAD, DPNP, FM, OA e CLBP, não foram observadas diferenças gerais na segurança ou eficácia entre esses pacientes e pacientes adultos mais jovens, e outras experiências clínicas relatadas não identificaram diferenças nas respostas entre esses pacientes geriátricos e os mais jovens. pacientes adultos, mas a maior sensibilidade de alguns pacientes mais velhos não pode ser descartada.
ISRSs e SNRIs, incluindo CYMBALTA, foram associados a hiponatremia clinicamente significativa em pacientes geriátricos, que podem estar em maior risco para esta reação adversa [ver AVISOS E PRECAUÇÕES ].
Em uma análise de dados de todos os estudos controlados com placebo, os pacientes tratados com CYMBALTA relataram uma maior taxa de quedas em comparação com os pacientes tratados com placebo. O risco aumentado parece ser proporcional ao risco subjacente de quedas de um paciente. O risco subjacente parece aumentar de forma constante com a idade. Como os pacientes geriátricos tendem a ter uma maior prevalência de fatores de risco para quedas, como medicamentos, comorbidades médicas e distúrbios da marcha, o impacto do aumento da idade por si só nas quedas durante o tratamento com CYMBALTA 30mg não é claro. Quedas com consequências graves, incluindo fraturas ósseas e hospitalizações, foram relatadas com o uso de CYMBALTA [ver AVISOS E PRECAUÇÕES e REAÇÕES ADVERSAS ].
farmacocinética da duloxetina após uma dose única de 40 mg foi comparada em mulheres idosas saudáveis (65 a 77 anos) e mulheres saudáveis de meia-idade (32 a 50 anos). Não houve diferença na Cmax, mas a AUC da duloxetina foi um pouco (cerca de 25%) mais alta e a meia-vida cerca de 4 horas mais longa nas mulheres idosas. As análises farmacocinéticas da população sugerem que os valores típicos de depuração diminuem em aproximadamente 1% para cada ano de idade entre 25 e 75 anos; mas a idade como fator preditivo representa apenas uma pequena porcentagem da variabilidade entre pacientes. Não é necessário ajuste de dose com base na idade do paciente adulto.
Gênero
A meia-vida da duloxetina é semelhante em homens e mulheres. Não é necessário ajuste de dose com base no sexo.
Condição de fumante
A biodisponibilidade da duloxetina (AUC) parece ser reduzida em cerca de um terço em fumantes. Modificações de dosagem não são recomendadas para fumantes.
Corrida
Nenhum estudo farmacocinético específico foi realizado para investigar os efeitos da raça.
Insuficiência hepática
Pacientes com insuficiência hepática clinicamente evidente apresentam diminuição do metabolismo e eliminação da duloxetina. Após uma dose única de 20 mg de CYMBALTA 20 mg, 6 pacientes cirróticos com insuficiência hepática moderada (Child-Pugh Classe B) tiveram uma depuração plasmática média de duloxetina cerca de 15% da de indivíduos saudáveis da mesma idade e sexo, com um aumento de 5 vezes na exposição média (AUC). Embora a Cmax tenha sido semelhante à normal nos pacientes cirróticos, a meia-vida foi cerca de 3 vezes maior [ver DOSAGEM E ADMINISTRAÇÃO e AVISOS E PRECAUÇÕES ].
Insuficiência Renal Grave
Dados limitados estão disponíveis sobre os efeitos de CYMBALTA 40mg em pacientes com doença renal terminal (ESRD). Após uma dose única de 60 mg de CYMBALTA 20 mg, os valores de Cmax e AUC foram aproximadamente 100% maiores em pacientes com insuficiência renal terminal recebendo hemodiálise intermitente crônica do que em indivíduos com função renal normal. A meia-vida de eliminação, no entanto, foi semelhante em ambos os grupos. As AUCs dos principais metabólitos circulantes, 4-hidroxiduloxetina glicuronídeo e 5-hidroxi, 6metoxiduloxetina sulfato, amplamente excretados na urina, foram aproximadamente 7 a 9 vezes maiores e espera-se que aumentem ainda mais com doses múltiplas. As análises farmacocinéticas da população sugerem que graus leves a moderados de insuficiência renal (CrCl estimado 30-80 mL/min) não têm efeito significativo na depuração aparente da duloxetina [ver DOSAGEM E ADMINISTRAÇÃO e AVISOS E PRECAUÇÕES ].
SOBREDOSAGEM
Sinais e sintomas
Na experiência pós-comercialização, foram relatados desfechos fatais para superdosagens agudas de CYMBALTA 60mg, principalmente com superdosagens mistas, mas também apenas com CYMBALTA 20mg, incluindo 1.000 mg de CYMBALTA (aproximadamente 8,3 vezes a dose máxima recomendada). Os sinais e sintomas de sobredosagem (CYMBALTA isoladamente ou com fármacos mistos) incluíram sonolência, coma, síndrome serotoninérgica, convulsões, síncope, taquicardia, hipotensão, hipertensão e vómitos.
Gerenciamento de overdose
Não há antídoto específico para uma superdosagem de CYMBALTA 60mg, mas se ocorrer síndrome serotoninérgica, tratamento específico (como ciproheptadina e/ou controle de temperatura) pode ser considerado.
Em caso de superdosagem aguda com CYMBALTA 30mg, o tratamento deve consistir nas medidas gerais empregadas no manejo da superdosagem com qualquer droga, como assegurar vias aéreas adequadas, oxigenação e ventilação e monitoramento do ritmo cardíaco e dos sinais vitais. A lavagem gástrica com sonda orogástrica de grande calibre com proteção adequada das vias aéreas, se necessário, pode ser indicada se realizada logo após a ingestão ou em pacientes sintomáticos. A indução de vômito não é recomendada.
O carvão ativado pode ser útil para limitar a absorção da duloxetina no trato gastrointestinal. A administração de carvão ativado demonstrou diminuir a AUC e a Cmax da duloxetina em uma média de um terço, embora alguns pacientes tenham um efeito limitado do carvão ativado. Devido ao grande volume de distribuição da duloxetina, diurese forçada, diálise, hemoperfusão e exsanguíneotransfusão provavelmente não serão benéficas.
No manejo da superdosagem, a possibilidade de envolvimento de vários medicamentos deve ser considerada. Um cuidado específico envolve pacientes com overdose de CYMBALTA 60mg e antidepressivos tricíclicos. Nesse caso, a diminuição da depuração do tricíclico original e/ou de seu metabólito ativo pode aumentar a possibilidade de sequelas clinicamente significativas e prolongar o tempo necessário para observação médica rigorosa [ver AVISOS E PRECAUÇÕES e INTERAÇÕES MEDICAMENTOSAS ].
Considere entrar em contato com um centro de controle de intoxicações (1-800-222-1222 ou www.poison.org) para obter informações adicionais sobre o tratamento de superdosagem.
CONTRA-INDICAÇÕES
O uso de IMAOs destinados ao tratamento de distúrbios psiquiátricos com CYMBALTA 40mg ou dentro de 5 dias após a interrupção do tratamento com CYMBALTA é contraindicado devido ao risco aumentado de síndrome serotoninérgica. O uso de CYMBALTA dentro de 14 dias após a interrupção de um IMAO destinado a tratar distúrbios psiquiátricos é contraindicado [ver DOSAGEM E ADMINISTRAÇÃO e AVISOS E PRECAUÇÕES ].
Iniciar CYMBALTA 30mg em um paciente que está sendo tratado com IMAOs, como linezolida ou azul de metileno intravenoso, também é contraindicado devido ao risco aumentado de síndrome serotoninérgica [ver DOSAGEM E ADMINISTRAÇÃO e AVISOS E PRECAUÇÕES ].
FARMACOLOGIA CLÍNICA
Mecanismo de ação
Embora os mecanismos exatos do antidepressivo, das ações inibitórias centrais da dor e ansiolíticas da duloxetina em humanos sejam desconhecidos, acredita-se que essas ações estejam relacionadas à sua potencialização da atividade serotoninérgica e noradrenérgica no SNC.
Farmacodinâmica
Estudos pré-clínicos mostraram que a duloxetina é um potente inibidor da recaptação neuronal de serotonina e norepinefrina e um inibidor menos potente da recaptação de dopamina. A duloxetina não tem afinidade significativa para receptores dopaminérgicos, adrenérgicos, colinérgicos, histaminérgicos, opióides, glutamato e GABA in vitro. A duloxetina não inibe a monoamina oxidase (MAO).
CYMBALTA está em uma classe de medicamentos conhecidos por afetar a resistência uretral [ver AVISOS E PRECAUÇÕES ].
Eletrofisiologia Cardíaca
efeito de CYMBALTA 160 mg e 200 mg administrados duas vezes ao dia (2,7 e 3,3 vezes a dose máxima recomendada, respectivamente) até o estado de equilíbrio foi avaliado em um estudo cruzado, randomizado, duplo-cego e de duas vias em 117 mulheres adultas saudáveis. Não foi detectado prolongamento do intervalo QT. CYMBALTA 40mg parece estar associado a um encurtamento do intervalo QT dependente da concentração, mas não clinicamente significativo.
Farmacocinética
A duloxetina tem uma meia-vida de eliminação de cerca de 12 horas (intervalo de 8 a 17 horas) e sua farmacocinética é proporcional à dose ao longo da faixa terapêutica. As concentrações plasmáticas em estado estacionário são normalmente alcançadas após 3 dias de administração. A eliminação da duloxetina ocorre principalmente através do metabolismo hepático envolvendo duas isoenzimas P450, CYP1A2 e CYP2D6.
Absorção
Após administração oral de CYMBALTA 30mg, o cloridrato de duloxetina é bem absorvido. Há um atraso médio de 2 horas até o início da absorção (Tlag), com concentrações plasmáticas máximas (Cmax) de duloxetina ocorrendo 6 horas após a dose. Há um atraso de 3 horas na absorção e um aumento de um terço na depuração aparente da duloxetina após uma dose noturna em comparação com uma dose matinal.
Efeito dos Alimentos
Os alimentos não afetam a Cmax da duloxetina, mas atrasam o tempo para atingir o pico de concentração de 6 a 10 horas e diminuem marginalmente a extensão da absorção (AUC) em cerca de 10%.
Distribuição
O volume aparente de distribuição é em média de cerca de 1.640 L. A duloxetina liga-se fortemente (>90%) às proteínas do plasma humano, ligando-se principalmente à albumina e à glicoproteína α1-ácida. A interação entre a duloxetina e outros medicamentos altamente ligados às proteínas não foi totalmente avaliada. A ligação da duloxetina às proteínas plasmáticas não é afetada por insuficiência renal ou hepática.
Eliminação
Metabolismo
biotransformação e a eliminação da duloxetina em humanos foram determinadas após a administração oral de duloxetina marcada com 14C. A duloxetina compreende cerca de 3% do total de material radiomarcado no plasma, indicando que sofre extenso metabolismo para numerosos metabólitos. As principais vias de biotransformação para a duloxetina envolvem a oxidação do anel naftil seguida de conjugação e posterior oxidação. Tanto o CYP1A2 quanto o CYP2D6 catalisam a oxidação do anel naftil in vitro. Os metabólitos encontrados no plasma incluem 4-hidroxiduloxetina glicuronídeo e 5hidroxi, 6-metoxiduloxetina sulfato.
Excreção
Muitos metabólitos adicionais foram identificados na urina, alguns representando apenas vias de eliminação menores. Apenas vestígios (
Populações Específicas
Pacientes pediátricos
A concentração plasmática de duloxetina no estado de equilíbrio foi comparável em pacientes pediátricos de 7 a 17 anos de idade e em pacientes adultos. A concentração média de duloxetina no estado de equilíbrio foi aproximadamente 30% menor nesta população pediátrica em relação aos pacientes adultos. As concentrações plasmáticas de duloxetina no estado de equilíbrio previstas pelo modelo em pacientes pediátricos de 7 a 17 anos de idade estavam principalmente dentro da faixa de concentração observada em pacientes adultos e não excederam a faixa de concentração em adultos.
Estudos clínicos
Visão geral dos ensaios clínicos
A eficácia de CYMBALTA 60mg foi estabelecida nas seguintes populações em estudos adequados e bem controlados:
Transtorno Depressivo Maior (TDM)
4 de curto prazo (Estudos MDD-1, MDD-2, MDD-3 e MDD-4) e 1 ensaio de manutenção (Estudo MDD-5) em adultos [ver Transtorno Depressivo Maior em Adultos ].
Transtorno de Ansiedade Generalizada (TAG)
3 estudos de curto prazo em adultos (estudos GAD-1, GAD-2 e GAD-3), 1 estudo de manutenção em adultos (estudo GAD-4), 1 estudo de curto prazo em pacientes geriátricos (estudo GAD-5), e 1 estudo de curto prazo em pacientes pediátricos de 7 a 17 anos de idade (Estudo GAD-6) [ver Distúrbio de ansiedade generalizada ].
Dor Neuropática Periférica Diabética (DPNP)
Dois ensaios de 12 semanas em adultos (Estudos DPNP-1 e DPNP-2) [ver Dor Neuropática Periférica Diabética em Adultos ].
Fibromialgia (FM)
Dois ensaios em adultos (um de 3 meses de duração e um de 6 meses de duração) (Estudos FM-1 e FM-2) e um ensaio de 13 semanas em pacientes pediátricos de 13 a 17 anos de idade (Estudo FM-4) [ver Fibromialgia ].
Dor Musculoesquelética Crônica
Dois estudos de 12 a 13 semanas em pacientes adultos com dor lombar crônica (CLBP) (Estudos CLBP-1 e CLBP-3) e um estudo de 13 semanas em pacientes adultos com dor crônica devido à osteoartrite (OA) (Estudo OA -1) [ver Dor musculoesquelética crônica em adultos ].
Além disso, um resumo dos seguintes estudos que não demonstraram eficácia são apresentados abaixo: Estudo FM-3 (um estudo de 16 semanas em pacientes adultos com fibromialgia), Estudo CLBP-2 (um estudo de 13 semanas em pacientes adultos com DLC) e Estudo OA-2 (um estudo de 13 semanas em pacientes adultos com dor crônica devido à OA).
Transtorno Depressivo Maior em Adultos
A eficácia de CYMBALTA como tratamento para TDM em adultos foi estabelecida em 4 estudos randomizados, duplo-cegos, controlados por placebo, de dose fixa em pacientes ambulatoriais adultos (18 a 83 anos) que atendem aos critérios do DSM-IV para TDM:
- Nos estudos MDD-1 e MDD-2, os pacientes foram randomizados para CYMBALTA 60 mg uma vez ao dia (N=123 e N=128, respectivamente) ou placebo (N=122 e N=139, respectivamente) por 9 semanas
- No Estudo MDD-3, os pacientes foram randomizados para CYMBALTA 20 ou 40 mg duas vezes ao dia (N=86 e N=91, respectivamente) ou placebo (N=89) por 8 semanas
- No Estudo MDD-4, os pacientes foram randomizados para CYMBALTA 40 ou 60 mg duas vezes ao dia (N=95 e N=93, respectivamente) ou placebo (N=93) por 8 semanas.
Em todos os quatro ensaios, CYMBALTA 40mg demonstrou superioridade em relação ao placebo, conforme medido pela melhora na pontuação total da Escala de Avaliação de Depressão de Hamilton (HAMD-17) de 17 itens (ver ). Não há evidências de que doses superiores a 60 mg/dia confiram benefícios adicionais.
Em todos esses ensaios clínicos, as análises da relação entre o resultado do tratamento e a idade, sexo e raça não sugeriram nenhuma resposta diferencial com base nessas características dos pacientes.
Estudo MDD-1 CYMBALTA (60 mg/dia)b Placebo 21,5 (4,10) 21,1 (3,71) -10,9 (0,70) -6,1 (0,69) -4,9 (-6,8, -2,9) --
No estudo MDD-5, 533 pacientes adultos que atendem aos critérios do DSM-IV para MDD receberam CYMBALTA 60 mg uma vez ao dia durante uma fase inicial de tratamento aberto de 12 semanas. Duzentos e setenta e oito pacientes que responderam ao tratamento de rótulo aberto [definido como atendendo aos seguintes critérios nas semanas 10 e 12: pontuação total HAMD-17 ≤9, impressões clínicas globais de gravidade (CGI-S) ≤2, e não preenchendo os critérios do DSM-IV para MDD] foram aleatoriamente designados para a continuação de CYMBALTA na mesma dosagem (N = 136) ou placebo (N = 142) por 6 meses.
No estudo MDD-5, os pacientes que receberam CYMBALTA tiveram um tempo estatisticamente significativamente maior para recaída da depressão do que os pacientes que receberam placebo (ver figura 1 ). A recaída foi definida como um aumento no escore CGI-S de ≥2 pontos em comparação com o obtido na semana 12, bem como atender aos critérios do DSM-IV para TDM em 2 visitas consecutivas com pelo menos 2 semanas de intervalo, onde o intervalo de 2 semanas critério temporal teve que ser satisfeito apenas na segunda visita.
Figura 1: Proporção Cumulativa de Pacientes Adultos com Recaída de MDD (Estudo MDD-5)
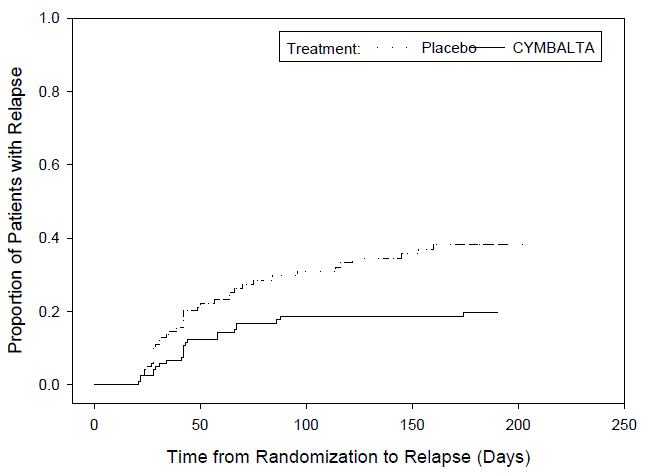
Distúrbio de ansiedade generalizada
Ensaios de GAD em adultos (incluindo pacientes geriátricos)
A eficácia de CYMBALTA 20mg no tratamento do transtorno de ansiedade generalizada (TAG) foi estabelecida em 1 estudo randomizado de dose fixa, duplo-cego, controlado por placebo e 2 estudos de dose flexível, randomizado, duplo-cego, controlado por placebo em pacientes ambulatoriais adultos entre 18 e 83 anos de idade preenchendo os critérios do DSM-IV para TAG (estudos GAD-1, GAD-2 e GAD-3, respectivamente).
Nos estudos GAD-1 e GAD-2, a dose inicial foi de 60 mg uma vez ao dia (a redução da titulação para 30 mg uma vez ao dia foi permitida por razões de tolerabilidade; a dose pode ser aumentada para 60 mg uma vez ao dia). Quinze por cento dos pacientes foram titulados para baixo. O estudo GAD-3 teve uma dose inicial de 30 mg uma vez ao dia por 1 semana antes de aumentar para 60 mg uma vez ao dia.
Os estudos GAD-2 e GAD-3 envolveram a titulação da dose com doses de CYMBALTA variando de 60 mg uma vez ao dia a 120 mg uma vez ao dia (N = 168 e N = 162) em comparação com placebo (N = 159 e N = 161) durante 10- período de tratamento de uma semana. A dosagem média para completadores no ponto final nestes estudos foi de 104,8 mg/dia. O estudo GAD-1 avaliou doses de 60 mg de CYMBALTA de 60 mg uma vez ao dia (N = 168) e 120 mg uma vez ao dia (N = 170) em comparação com placebo (N = 175) durante um período de tratamento de 9 semanas. Embora uma dose de 120 mg/dia tenha se mostrado eficaz, não há evidências de que doses superiores a 60 mg/dia confiram benefício adicional.
Em todos os 3 estudos, CYMBALTA demonstrou superioridade em relação ao placebo, medida pela maior melhora na pontuação total da Escala de Ansiedade de Hamilton (HAM-A) (ver ) e pela pontuação de comprometimento funcional global da Escala de Incapacidade de Sheehan (SDS). O SDS é uma medida composta da extensão dos sintomas emocionais que perturbam o funcionamento do paciente em 3 domínios da vida: trabalho/escola, vida social/atividades de lazer e vida familiar/responsabilidades domésticas.
No estudo GAD-4, 887 pacientes que preencheram os critérios do DSM-IV-TR para TAG receberam CYMBALTA 60 mg a 120 mg uma vez ao dia durante uma fase inicial de tratamento aberto de 26 semanas. Quatrocentos e vinte e nove pacientes que responderam ao tratamento aberto [definido como atendendo aos seguintes critérios nas semanas 24 e 26: uma diminuição da pontuação total HAM-A inicial em pelo menos 50% para uma pontuação não superior a 11, e um escore de Impressões Clínicas Globais de Melhoria (CGI-Melhoria) de 1 ou 2] foram aleatoriamente designados para a continuação de CYMBALTA 30mg na mesma dosagem (N=216) ou placebo (N=213) e foram observados quanto à recaída. Dos pacientes randomizados, 73% estavam em estado de resposta por pelo menos 10 semanas. A recaída foi definida como um aumento no escore de gravidade CGI de pelo menos 2 pontos para um escore ≥4 e um diagnóstico MINI (Mini-International Neuropsychiatric Interview) de TAG (excluindo duração), ou descontinuação devido à falta de eficácia. Os pacientes que tomaram CYMBALTA tiveram um tempo estatisticamente significativamente maior para recidiva do TAG do que os pacientes que tomaram placebo (ver Figura 2 ).
As análises de subgrupo não indicaram que houvesse diferenças nos resultados do tratamento em função da idade ou sexo.
Teste GAD em pacientes geriátricos
A eficácia de CYMBALTA no tratamento de pacientes ≥65 anos de idade com TAG foi estabelecida em um estudo de 10 semanas de dose flexível, randomizado, duplo-cego, controlado por placebo em adultos ≥65 anos de idade que atendem aos critérios do DSM-IV para GAD (Estudo GAD-5). No Estudo GAD-5, a dose inicial foi de 30 mg uma vez ao dia por 2 semanas antes de outros aumentos de dose em incrementos de 30 mg nas semanas de tratamento 2, 4 e 7 até 120 mg uma vez ao dia serem permitidos com base no julgamento do investigador da resposta clínica e tolerabilidade. A dosagem média para pacientes que completaram a fase aguda de tratamento de 10 semanas foi de 51 mg. Os pacientes tratados com CYMBALTA (N = 151) demonstraram melhora significativamente maior em comparação com placebo (N = 140) na alteração média da linha de base ao ponto final, conforme medido pela pontuação total HAM-A (consulte ).
Teste GAD em pacientes pediátricos de 7 a 17 anos
eficácia de CYMBALTA no tratamento de pacientes pediátricos de 7 a 17 anos de idade com TAG foi estabelecida em 1 ensaio clínico randomizado de dose flexível, duplo-cego, controlado por placebo em pacientes ambulatoriais pediátricos com TAG (com base nos critérios do DSM-IV) (Estudo GAD-6).
No Estudo GAD-6, a dosagem inicial foi de 30 mg uma vez ao dia durante 2 semanas. Outros aumentos de dosagem em incrementos de 30 mg até 120 mg uma vez ao dia foram permitidos com base no julgamento do investigador da resposta clínica e tolerabilidade. A dosagem média para pacientes que completaram a fase de tratamento de 10 semanas foi de 57,6 mg/dia. Neste estudo, CYMBALTA (N=135) demonstrou superioridade em relação ao placebo (N=137) desde a linha de base até o desfecho, conforme medido pela maior melhora na Escala de Avaliação de Ansiedade Pediátrica (PARS) para o escore de gravidade do GAD (ver ).
Figura 2: Proporção Cumulativa de Pacientes Adultos com Recaída de GAD (Estudo GAD-4)
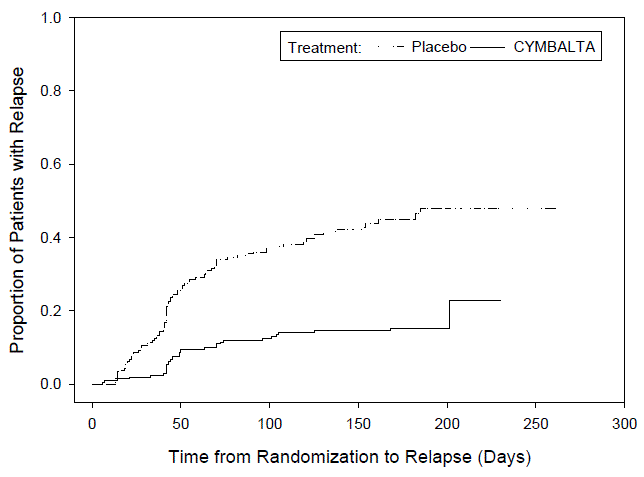
Dor Neuropática Periférica Diabética em Adultos
eficácia de CYMBALTA 30mg para o tratamento da dor neuropática associada à neuropatia periférica diabética em adultos foi estabelecida em 2 estudos randomizados, de 12 semanas, duplo-cegos, controlados por placebo, de dose fixa em pacientes adultos com dor neuropática periférica diabética (DPNP ) por pelo menos 6 meses (Estudo DPNP-1 e Estudo DPNP-2). Esses estudos envolveram um total de 791 pacientes, dos quais 592 (75%) completaram os estudos. Os pacientes inscritos tinham diabetes mellitus tipo I ou II com diagnóstico de polineuropatia sensório-motora simétrica distal dolorosa por pelo menos 6 meses. Os pacientes tinham um escore de dor inicial ≥4 em uma escala de 11 pontos variando de 0 (sem dor) a 10 (pior dor possível). Os pacientes foram permitidos até 4 gramas de paracetamol por dia conforme necessário para a dor, além de CYMBALTA. Os pacientes registraram sua dor diariamente em um diário.
Ambos os estudos compararam CYMBALTA 60 mg uma vez ao dia ou 60 mg duas vezes ao dia com placebo. O estudo DPNP-1 comparou adicionalmente CYMBALTA 20 mg com placebo. Um total de 457 pacientes (342 CYMBALTA, 115 placebo) foram inscritos no Estudo DPNP-1 e um total de 334 pacientes (226 CYMBALTA, 108 placebo) foram inscritos no Estudo DPNP-2.
tratamento com CYMBALTA 60 mg uma ou duas vezes ao dia melhorou estatisticamente significativamente os escores de dor médios do ponto final desde o início e aumentou a proporção de pacientes com pelo menos uma redução de 50% nos escores de dor desde o início. Para vários graus de melhora na dor desde a linha de base até o desfecho do estudo, as Figuras 3 e 4 mostram a fração de pacientes que alcançaram esse grau de melhora nos Estudos DPNP-1 e DPNP-2, respectivamente. Os números são cumulativos, de modo que os pacientes cuja alteração da linha de base é, por exemplo, 50%, também são incluídos em todos os níveis de melhora abaixo de 50%. Os pacientes que não completaram o estudo receberam 0% de melhora. Alguns pacientes experimentaram uma diminuição da dor logo na primeira semana, que persistiu durante todo o estudo.
Figura 3: Porcentagem de pacientes adultos com DPNP que atingem vários níveis de alívio da dor conforme medido pela gravidade média da dor em 24 horas (estudo DPNP-1)
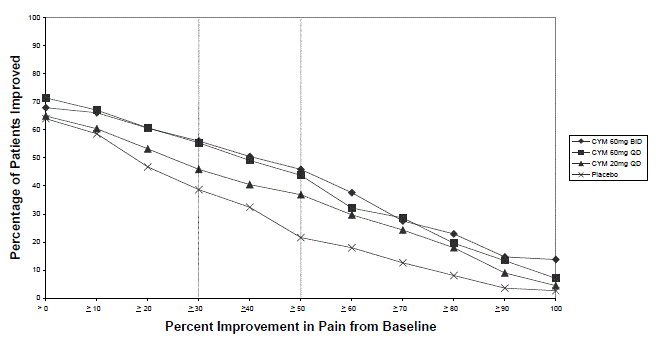
Figura 4: Porcentagem de pacientes adultos com DPNP que atingem vários níveis de alívio da dor conforme medido pela gravidade média da dor em 24 horas (estudo DPNP-2)
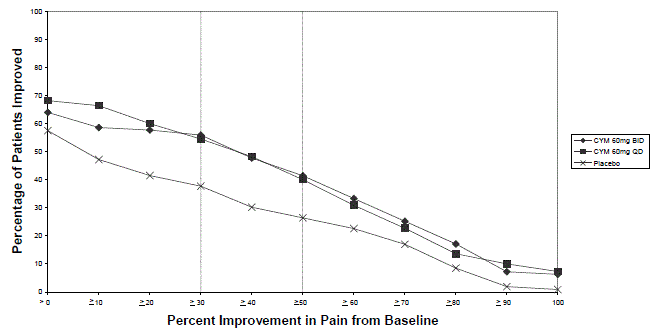
Fibromialgia
Ensaios adultos na fibromialgia
eficácia de CYMBALTA para o tratamento da fibromialgia em adultos foi estabelecida em dois estudos randomizados, duplo-cegos, controlados por placebo, de dose fixa em pacientes adultos que atendem aos critérios do American College of Rheumatology para fibromialgia (uma história de dor generalizada por 3 meses , e dor presente em 11 ou mais dos 18 locais específicos de pontos sensíveis). O estudo FM-1 teve três meses de duração e envolveu apenas pacientes do sexo feminino. O estudo FM-2 teve seis meses de duração e envolveu pacientes do sexo masculino e feminino. Aproximadamente 25% dos participantes tinham um diagnóstico comórbido de TDM. Os estudos FM1 e FM-2 inscreveram um total de 874 pacientes, dos quais 541 (62%) completaram os estudos. Um total de 354 pacientes (234 CYMBALTA 40mg, 120 placebo) foram inscritos no Estudo FM-1 e um total de 520 pacientes (376 CYMBALTA, 144 placebo) foram inscritos no Estudo FM-2 (5% homens, 95% mulheres). Os pacientes tinham um escore de dor inicial de 6,5 em uma escala de 11 pontos variando de 0 (sem dor) a 10 (pior dor possível).
Os estudos FM-1 e FM-2 compararam CYMBALTA 60 mg uma vez ao dia ou 120 mg ao dia (administrado em doses divididas no Estudo FM-1 e como dose única diária no Estudo FM-2) com placebo. O estudo FM-2 comparou adicionalmente CYMBALTA 20 mg com placebo durante os três meses iniciais de um estudo de seis meses.
tratamento com CYMBALTA 60 mg ou 120 mg por dia melhorou estatisticamente significativamente os escores de dor médios do ponto final desde a linha de base e aumentou a proporção de pacientes com uma redução de pelo menos 50% na pontuação de dor desde a linha de base. A redução da dor foi observada em pacientes com e sem MDD comórbida. No entanto, o grau de redução da dor pode ser maior em pacientes com TDM comórbido. Para vários graus de melhora na dor desde a linha de base até o desfecho do estudo, as Figuras 5 e 6 mostram a fração de pacientes que alcançaram esse grau de melhora nos Estudos FM-1 e FM-2, respectivamente. Os números são cumulativos para que os pacientes cuja alteração da linha de base seja, por exemplo, 50%, também sejam incluídos em todos os níveis de melhora abaixo de 50%. Os pacientes que não completaram o estudo receberam 0% de melhora. Alguns pacientes experimentaram uma diminuição da dor logo na primeira semana, que persistiu durante todo o estudo. A melhora também foi demonstrada em medidas de função (Fibromialgia Impact Questionnaires) e impressão global de mudança do paciente (PGI). Nenhum dos estudos demonstrou um benefício de 120 mg em comparação com 60 mg, e uma dosagem mais alta foi associada a mais reações adversas e descontinuações prematuras do tratamento.
Figura 5: Porcentagem de pacientes adultos com fibromialgia que atingem vários níveis de alívio da dor no ponto final do estudo, medido pela gravidade média da dor em 24 horas (estudo FM-1)
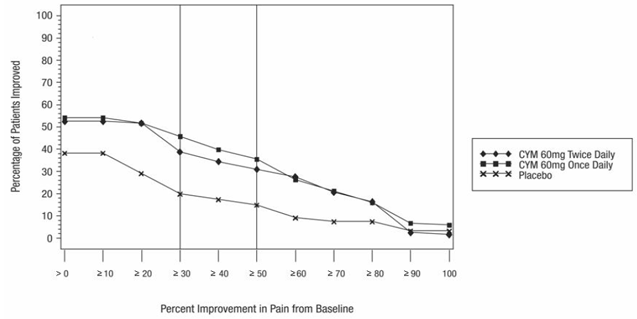
Figura 6: Porcentagem de pacientes adultos com fibromialgia que atingem vários níveis de alívio da dor no ponto final do estudo, conforme medido pela gravidade média da dor em 24 horas (estudo FM-2)
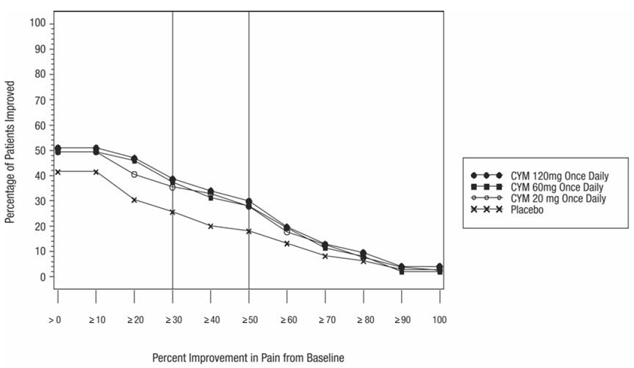
Além disso, o benefício da titulação em não respondedores a CYMBALTA a 60 mg/dia foi avaliado em um estudo separado (Estudo FM-3). Pacientes adultos foram inicialmente tratados com CYMBALTA 60 mg uma vez ao dia por oito semanas de forma aberta. Subsequentemente, os que completaram esta fase foram randomizados para tratamento duplo-cego com CYMBALTA em 60 mg uma vez ao dia ou 120 mg uma vez ao dia. Os respondedores foram definidos como pacientes que tiveram pelo menos uma redução de 30% no escore de dor desde o início no final do tratamento de 8 semanas. Os pacientes que não responderam em 8 semanas não tiveram maior probabilidade de atender aos critérios de resposta ao final de 60 semanas de tratamento se titulados às cegas para CYMBALTA 120 mg, em comparação com aqueles que continuaram cegamente com CYMBALTA 60 mg.
Ensaio Pediátrico na Fibromialgia
CYMBALTA foi estudado em 184 pacientes pediátricos com idades entre 13 e 17 anos com síndrome de fibromialgia juvenil em um estudo controlado por placebo de 13 semanas (Estudo FM-4). No Estudo FM-4, 149 (81%) pacientes completaram o estudo. CYMBALTA (N=91) foi iniciado na dose de 30 mg uma vez ao dia por uma semana e titulado para 60 mg uma vez ao dia por 12 semanas, conforme tolerado. A dosagem média para pacientes que completaram a fase de tratamento de 12 semanas foi de 49 mg/dia. CYMBALTA mostrou melhora em relação ao placebo no desfecho primário [mudança da linha de base para o final do tratamento no Brief Pain Inventory (BPI) – Modified Short Form: Adolescent Version 24-hour average pain selection] com um valor p de 0,052 de a análise primária pré-especificada e valores de p variando de 0,011-0,020 de análises de sensibilidade que atribuíram valores basais a avaliações ausentes de alguns pacientes que não completaram o estudo por vários motivos. Os pacientes tinham um BPI basal de 5,7. Para vários graus de melhora na dor desde a linha de base até o desfecho do estudo, a Figura 7 mostra a fração de pacientes que alcançaram esse grau de melhora no Estudo FM-4.
Figura 7: Porcentagem de pacientes pediátricos de 13 a 17 anos com síndrome de fibromialgia juvenil que atingem vários níveis de alívio da dor na semana 12 (estudo FM-4)a
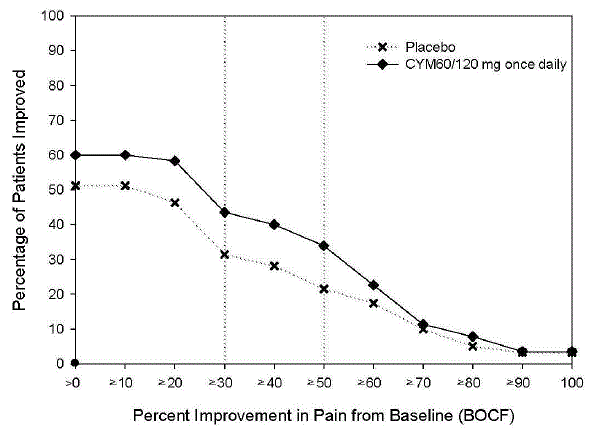
Dor Musculoesquelética Crônica em Adultos
CYMBALTA é indicado para o tratamento da dor musculoesquelética crônica em adultos. Isso foi estabelecido em ensaios em pacientes adultos com dor lombar crônica e dor crônica devido à osteoartrite.
Ensaios em dor lombar crônica em adultos
A eficácia de CYMBALTA 60mg na dor lombar crônica (DLC) em adultos foi avaliada em dois ensaios clínicos randomizados, duplo-cegos, controlados por placebo com duração de 13 semanas (Estudos CLBP-1 e CLBP-2) e um de 12 -semanas de duração (CLBP-3). Os estudos CLBP-1 e CLBP-3 demonstraram eficácia de CYMBALTA no tratamento de CLBP. Os pacientes em todos os estudos não apresentaram sinais de radiculopatia ou estenose espinhal.
Estudo CLBP-1
Duzentos e trinta e seis pacientes adultos (N=115 em CYMBALTA 40mg, N=121 em placebo) inscritos e 182 (77%) completaram a fase de tratamento de 13 semanas. Após 7 semanas de tratamento, pacientes tratados com CYMBALTA com menos de 30% de redução na dor média diária e que foram capazes de tolerar 60 mg uma vez ao dia tiveram sua dosagem de CYMBALTA, de forma duplo-cega, aumentada para 120 mg uma vez ao dia para o restante do julgamento. Os pacientes tiveram uma classificação média de dor na linha de base de 6 em uma escala de classificação numérica variando de 0 (sem dor) a 10 (pior dor possível). Após 13 semanas de tratamento, os pacientes que tomaram CYMBALTA 60-120 mg por dia tiveram uma redução da dor significativamente maior em comparação com os pacientes que tomaram placebo. A randomização foi estratificada pelo status inicial de uso de AINEs dos pacientes. As análises de subgrupos não indicaram que havia diferenças nos resultados do tratamento em função do uso de AINEs.
Estudo CLBP-2
Quatrocentos e quatro pacientes foram randomizados para receber doses fixas de CYMBALTA 60 mg por dia ou um placebo correspondente (N = 59 em CYMBALTA 20 mg, N = 116 em CYMBALTA 60 mg, N = 112 em CYMBALTA 120 mg, N = 117 em placebo) e 267 (66%) completaram todo o estudo de 13 semanas. Após 13 semanas de tratamento, nenhuma das três dosagens de CYMBALTA 30mg apresentou diferença estatisticamente significativa na redução da dor em comparação ao placebo.
Estudo CLBP-3
Quatrocentos e um pacientes foram randomizados para receber doses fixas de CYMBALTA 60 mg por dia ou placebo (N=198 em CYMBALTA 20mg, N=203 em placebo), e 303 (76%) completaram o estudo. Os pacientes tiveram uma classificação média de dor na linha de base de 6 em uma escala de classificação numérica variando de 0 (sem dor) a 10 (pior dor possível). Após 12 semanas de tratamento, os pacientes que tomaram CYMBALTA 60 mg por dia apresentaram redução da dor significativamente maior em comparação com os pacientes que tomaram placebo.
Para vários graus de melhora na dor desde a linha de base até o desfecho do estudo, as Figuras 8 e 9 mostram a fração de pacientes nos Estudos CLBP-1 e CLBP-3 alcançando esse grau de melhora, respectivamente. Os números são cumulativos, de modo que os pacientes cuja alteração da linha de base é, por exemplo, 50%, também são incluídos em todos os níveis de melhora abaixo de 50%. Os pacientes que não completaram o estudo receberam o valor de 0% de melhora.
Figura 8: Porcentagem de pacientes adultos com CLBP que atingem vários níveis de alívio da dor conforme medido pela gravidade média da dor em 24 horas (estudo CLBP-1)
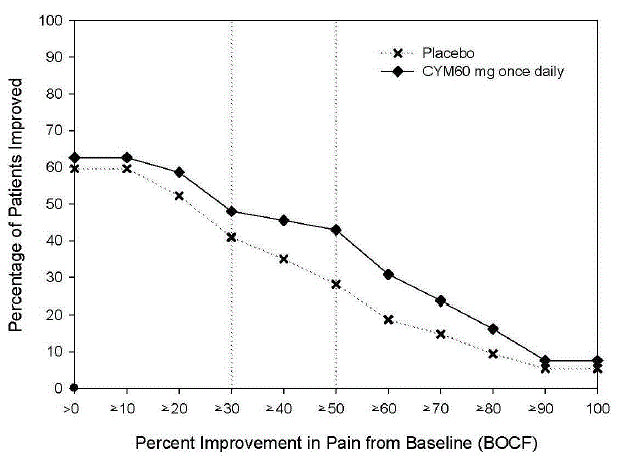
Figura 9: Porcentagem de pacientes adultos com CLBP que atingem vários níveis de alívio da dor conforme medido pela gravidade média da dor em 24 horas (estudo CLBP-3)
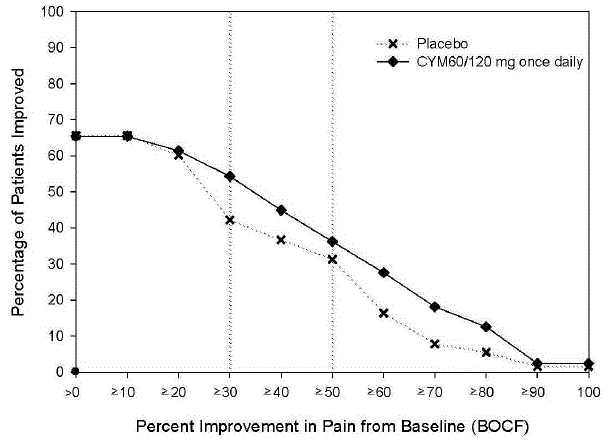
Ensaios em dor crônica devido à osteoartrite em adultos
eficácia de CYMBALTA na dor crônica devido à osteoartrite (OA) em adultos foi avaliada em 2 ensaios clínicos randomizados, duplo-cegos, controlados por placebo de 13 semanas de duração (Estudo OA-1 e Estudo OA-2). Todos os pacientes em ambos os ensaios preencheram os critérios clínicos e radiográficos do ACR para classificação da OA idiopática do joelho. A randomização foi estratificada pelo status inicial de uso de AINEs dos pacientes.
Os pacientes designados para CYMBALTA iniciaram o tratamento em ambos os estudos com uma dose de 30 mg uma vez ao dia durante uma semana. Após a primeira semana, a dose de CYMBALTA foi aumentada para 60 mg uma vez ao dia. Após 7 semanas de tratamento com CYMBALTA 60 mg uma vez ao dia, no Estudo OA-1, pacientes com resposta subótima ao tratamento (
Estudo OA-1
Duzentos e cinquenta e seis pacientes (N=128 em CYMBALTA 30mg, N=128 em placebo) inscritos e 204 (80%) completaram o estudo. Os pacientes tiveram uma classificação média de dor na linha de base de 6 em uma escala de classificação numérica variando de 0 (sem dor) a 10 (pior dor possível). Após 13 semanas de tratamento, os pacientes que tomaram CYMBALTA 20mg tiveram redução da dor significativamente maior do que os pacientes que tomaram placebo. As análises de subgrupos não indicaram que havia diferenças nos resultados do tratamento em função do uso de AINEs.
Estudo OA-2
Duzentos e trinta e um pacientes (N=111 em CYMBALTA 30mg, N=120 em placebo) inscritos e 173 (75%) completaram o estudo. Os pacientes tiveram uma dor média inicial de 6 em uma escala de classificação numérica variando de 0 (sem dor) a 10 (pior dor possível). Após 13 semanas de tratamento, os pacientes que tomaram CYMBALTA 20mg não apresentaram uma redução da dor significativamente maior do que os pacientes que tomaram placebo.
No Estudo OA-1, para vários graus de melhora na dor desde a linha de base até o desfecho do estudo, a Figura 10 mostra a fração de pacientes que alcançaram esse grau de melhora. O valor é cumulativo, de modo que os pacientes cuja alteração da linha de base é, por exemplo, 50%, também são incluídos em todos os níveis de melhora abaixo de 50%. Os pacientes que não completaram o estudo receberam o valor de 0% de melhora.
Figura 10: Porcentagem de pacientes adultos com OA que atingem vários níveis de alívio da dor conforme medido pela gravidade média da dor em 24 horas (estudo OA-1)
INFORMAÇÃO DO PACIENTE
Cymbalta® [sim-BALL-tah] (cápsulas de liberação retardada de duloxetina)
Leia este Guia de Medicação antes de começar a tomar Cymbalta® e cada vez que receber uma recarga. Pode haver novas informações. Esta informação não substitui a conversa com seu médico sobre sua condição médica ou tratamento.
Converse com seu médico sobre:
- todos os riscos e benefícios do tratamento com medicamentos antidepressivos
- todas as opções de tratamento para depressão ou outra doença mental grave
Qual é a informação mais importante que devo saber sobre medicamentos antidepressivos, depressão, outras doenças mentais graves e pensamentos ou ações suicidas?
- Preste muita atenção a quaisquer mudanças de humor, comportamento, ações, pensamentos ou sentimentos, especialmente mudanças repentinas. Isso é muito importante quando um medicamento antidepressivo é iniciado ou quando a dose é alterada.
- Ligue para o seu médico imediatamente para relatar mudanças novas ou repentinas no humor, comportamento, pensamentos ou sentimentos.
- Mantenha todas as visitas de acompanhamento com seu médico conforme programado. Ligue para o seu médico entre as visitas, conforme necessário, especialmente se tiver dúvidas sobre os sintomas.
Ligue para o seu médico imediatamente se tiver algum dos seguintes sintomas ou sentimentos, especialmente se forem novos, piores ou se preocuparem. Em caso de emergência, ligue para o 911.
- tentativas de suicídio
- agindo em impulsos perigosos
- agindo de forma agressiva, com raiva ou violento
- pensamentos sobre suicídio ou morte
- depressão nova ou pior
- ansiedade nova ou pior
- ataques de pânico
- sentindo-se muito agitado ou inquieto
- irritabilidade nova ou pior
- problemas para dormir
- um aumento extremo na atividade ou fala (mania)
- outras mudanças incomuns no comportamento ou humor
O que mais eu preciso saber sobre medicamentos antidepressivos?
- Nunca interrompa um medicamento antidepressivo sem primeiro falar com um profissional de saúde. Parar um medicamento antidepressivo de repente pode causar outros sintomas.
- Os antidepressivos são medicamentos usados para tratar a depressão e outras doenças. É importante discutir todos os riscos de tratar a depressão e também os riscos de não tratá-la. Os pacientes devem discutir todas as opções de tratamento com seu médico, não apenas o uso de antidepressivos.
- medicamentos antidepressivos têm outros efeitos colaterais. Converse com seu médico sobre os efeitos colaterais do medicamento prescrito para você ou seu familiar.
- Medicamentos antidepressivos podem interagir com outros medicamentos. Conheça todos os medicamentos que você ou seu familiar toma. Mantenha uma lista de todos os medicamentos para mostrar ao seu médico. Não inicie novos medicamentos sem primeiro consultar seu médico.
O que é Cymbalta 60mg?
Cymbalta é um medicamento de prescrição usado para tratar um certo tipo de depressão chamado Transtorno Depressivo Maior (MDD). Cymbalta 20mg pertence a uma classe de medicamentos conhecidos como SNRIs (inibidores da recaptação de orserotonina-norepinefrina).
Cymbalta 60mg também é usado para tratar ou gerenciar:
- Transtorno de Ansiedade Generalizada (TAG)
- Dor Neuropática Periférica Diabética (DPNP)
- Fibromialgia (FM)
- Dor Musculoesquelética Crônica
Quem não deve tomar Cymbalta?
Não tome Cymbalta 20mg se você:
- tomar um Inibidor da Monoamino Oxidase (IMAO). Pergunte ao seu médico ou farmacêutico se não tiver certeza se você toma um IMAO, incluindo o antibiótico linezolida ou azul de metileno intravenoso.
- Não tome um IMAO dentro de 5 dias após a interrupção de Cymbalta, a menos que seja instruído a fazê-lo pelo seu médico.
- Não inicie Cymbalta se você parou de tomar um IMAO nos últimos 14 dias, a menos que seja orientado pelo seu médico.
As pessoas que tomam Cymbalta 60mg próximo a um IMAO podem ter um problema sério chamado Síndrome de Serotonina (ver “Quais são os possíveis efeitos colaterais de Cymbalta 60mg?”).
O que devo dizer ao meu médico antes de tomar Cymbalta?
Antes de iniciar Cymbalta, informe o seu médico se você:
- tem problemas cardíacos ou pressão alta
- tem diabetes (o tratamento com Cymbalta 40mg torna mais difícil para algumas pessoas com diabetes controlar o açúcar no sangue)
- tem problemas de fígado
- tem problemas renais
- tem glaucoma
- tem ou teve convulsões ou convulsões
- tem transtorno bipolar ou mania
- tem baixos níveis de sódio no sangue
- atrasou o esvaziamento do estômago
- tem ou teve problemas de sangramento
- estão grávidas ou planejam engravidar. Cymbalta pode prejudicar o feto. Converse com seu médico sobre o risco para o feto se você tomar Cymbalta durante a gravidez.
- Informe imediatamente o seu médico se engravidar ou se pensa estar grávida durante o tratamento com Cymbalta.
- Se você engravidar enquanto estiver tomando Cymbalta 30mg, converse com seu médico sobre o registro no Registro de Gravidez Cymbalta. Você pode se registrar ligando para 1-866-8146975 ou visitando www.cymbalta 40mgpregnancyregistry.com. O objetivo deste registro é monitorar os resultados da gravidez em mulheres que foram tratadas com Cymbalta em qualquer momento durante a gravidez.
- está amamentando ou planeja amamentar. Cymbalta passa para o leite materno e pode prejudicar seu bebê. Converse com seu médico sobre a melhor maneira de alimentar seu bebê enquanto estiver tomando Cymbalta.
Informe o seu médico sobre todos os medicamentos que toma, incluindo medicamentos prescritos e de venda livre, vitaminas e suplementos de ervas. Cymbalta e alguns medicamentos podem interagir entre si, podem não funcionar tão bem ou podem causar efeitos colaterais graves.
Informe especialmente o seu médico se você tomar:
- triptanos usados para tratar a enxaqueca
- medicamentos usados para tratar distúrbios do humor, ansiedade, psicóticos ou do pensamento, incluindo tricíclicos, lítio, buspirona, ISRSs, SNRIs ou IMAOs
- tramadol e fentanil
- anfetaminas
- cimetidina
- os antibióticos ciprofloxacina, enoxacina
- medicamento para tratar a frequência cardíaca irregular (como propafenona, flecainida, quinidina)
- teofilina
- o diluente de sangue varfarina (Coumadin, Jantoven)
- anti-inflamatório não esteróide (AINE) (como ibuprofeno, naproxeno ou aspirina).
- suplementos de venda livre, como triptofano ou erva de São João
- tioridazina (Mellaril). Mellaril juntamente com Cymbalta pode causar problemas graves de ritmo cardíaco ou morte súbita.
Peça ao seu médico uma lista desses medicamentos se não tiver certeza.
Não tome Cymbalta com qualquer outro medicamento que contenha duloxetina.
Como devo tomar Cymbalta 60mg?
- Tome Cymbalta exatamente como seu médico lhe disser para tomá-lo. Seu médico pode precisar alterar a dose de Cymbalta 20mg até que seja a dose certa para você.
- Engula Cymbalta inteiro. Não mastigue ou esmague Cymbalta.
- Não abra a cápsula e salpique em alimentos ou misture com líquidos. A abertura da cápsula pode afetar o funcionamento do Cymbalta.
- Cymbalta pode ser tomado com ou sem alimentos.
- Se você esquecer de uma dose de Cymbalta 30mg, tome a dose esquecida assim que se lembrar. Se estiver quase na hora da próxima dose, pule a dose esquecida e tome a próxima dose no horário regular. Não tome duas doses de Cymbalta 30mg ao mesmo tempo.
- Se você tomar muito Cymbalta, ligue para o seu médico ou centro de controle de envenenamento em 1800-222-1222 imediatamente ou obtenha tratamento de emergência.
- Ao mudar de outro antidepressivo para Cymbalta, seu médico pode querer diminuir a dose do antidepressivo inicial primeiro para evitar efeitos colaterais.
O que devo evitar ao tomar Cymbalta?
- Cymbalta pode causar sonolência ou afetar sua capacidade de tomar decisões, pensar com clareza ou reagir rapidamente. Você não deve dirigir, operar máquinas pesadas ou fazer outras atividades perigosas até saber como Cymbalta o afeta.
- O uso de Cymbalta concomitantemente com a ingestão excessiva de álcool pode estar associado a lesão hepática grave. Evite o uso pesado de álcool enquanto estiver tomando Cymbalta.
Quais são os possíveis efeitos colaterais do Cymbalta?
Cymbalta 30mg pode causar efeitos colaterais graves, incluindo: Consulte “Qual é a informação mais importante que devo saber sobre Cymbalta?”
Os possíveis efeitos colaterais comuns em pessoas que tomam Cymbalta 20mg incluem:
Os sintomas nos homens podem incluir:
Os sintomas em mulheres podem incluir:
Fale com o seu médico se desenvolver quaisquer alterações na sua função sexual ou se tiver dúvidas ou preocupações sobre problemas sexuais durante o tratamento com CYMBALTA. Pode haver tratamentos que o seu médico possa sugerir.
- coceira
- dor abdominal superior direita
- urina escura
- pele ou olhos amarelos
- fígado aumentado
- aumento das enzimas hepáticas
- aumentar sua pressão arterial.
- diminuir a pressão arterial quando estiver em pé e causar tonturas ou desmaios, principalmente ao iniciar Cymbalta pela primeira vez ou ao aumentar a dose.
- aumentam o risco de quedas, principalmente em idosos.
- agitação, alucinações, coma ou outras alterações no estado mental
- problemas de coordenação ou espasmos musculares (reflexos hiperativos)
- batimentos cardíacos acelerados, pressão arterial alta ou baixa
- sudorese ou febre
- náuseas, vômitos ou diarreia
- rigidez muscular
- tontura
- rubor
- tremor
- convulsões
- ansiedade
- irritabilidade
- sentir-se cansado ou problemas para dormir
- dor de cabeça
- sudorese
- tontura
- sensações de choque elétrico
- vômito ou náusea
- diarréia
- energia muito aumentada
- problemas graves para dormir
- pensamentos descontrolados
- comportamento imprudente
- ideias extraordinariamente grandes
- felicidade excessiva ou irritabilidade
- falando mais ou mais rápido do que o habitual
Apenas algumas pessoas estão em risco para esses problemas. Você pode querer se submeter a um exame oftalmológico para ver se está em risco e receber tratamento preventivo, se estiver.
- dor nos olhos
- mudanças na visão
- inchaço ou vermelhidão dentro ou ao redor do olho
- dor de cabeça
- fraqueza ou sensação instável
- confusão, problemas de concentração ou pensamento ou problemas de memória
- diminuição do fluxo de urina
- incapaz de passar qualquer urina
- ejaculação atrasada ou incapacidade de ter uma ejaculação
- diminuição do desejo sexual
- problemas para obter ou manter uma ereção
- diminuição do desejo sexual
- orgasmo atrasado ou incapacidade de ter um orgasmo
Os efeitos colaterais mais comuns de Cymbalta 20mg incluem:
- náusea
- boca seca
- sonolência
- fadiga
- constipação
- perda de apetite
- aumento da sudorese
- tontura
Os possíveis efeitos colaterais comuns em crianças e adolescentes que tomam Cymbalta 20mg incluem:
- náusea
- peso reduzido
- tontura
Os efeitos colaterais em adultos também podem ocorrer em crianças e adolescentes que tomam Cymbalta. Crianças e adolescentes devem ter altura e peso monitorados durante o tratamento.
Informe o seu médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Cymbalta. Para mais informações, pergunte ao seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais para 1800-FDA-1088.
Como devo armazenar Cymbalta 40mg?
Armazene o Cymbalta em temperatura ambiente entre 20°C e 25°C (68°F a 77°F).
Mantenha Cymbalta e todos os medicamentos fora do alcance das crianças.
Informações gerais sobre o uso seguro e eficaz de Cymbalta.
Medicamentos às vezes são prescritos para outros fins que não os listados em um Guia de Medicamentos. Não use Cymbalta para uma condição para a qual não foi prescrito. Não dê Cymbalta 20mg a outras pessoas, mesmo que tenham os mesmos sintomas que você. Pode prejudicá-los.
Este Guia de Medicação resume as informações mais importantes sobre Cymbalta. Se você quiser mais informações, converse com seu médico. Você pode pedir ao seu médico ou farmacêutico informações sobre Cymbalta escritas para profissionais de saúde.
Para mais informações, ligue para 1-800-545-5979.
Quais são os ingredientes de Cymbalta 30mg?
Princípio ativo: cloridrato de duloxetina
Ingredientes inativos:
FD&C Blue No. 2, gelatina, hipromelose, succinato de acetato de hidroxipropilmetilcelulose, lauril sulfato de sódio, sacarose, esferas de açúcar, talco, dióxido de titânio e citrato de trietil. As cápsulas de 20 e 60 mg também contêm óxido de ferro amarelo.
Este Guia de Medicação foi aprovado pela Food and Drug Administration dos EUA.
