Famvir 250mg, 500mg Famciclovir Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Famvir e como é usado?
Famvir é um medicamento de prescrição usado para tratar os sintomas de Herpes Zoster Agudo (Zoster), Herpes Labial e Herpes Genital. Famvir 250mg pode ser usado sozinho ou com outros medicamentos.
Famvir 250mg pertence a uma classe de medicamentos chamados Antivirais, Outros.
Não se sabe se Famvir é seguro e eficaz em crianças com menos de 18 anos de idade.
Quais são os possíveis efeitos colaterais do Famvir 250mg?
Famvir 250mg pode causar efeitos colaterais graves, incluindo:
- confusão,
- pouca ou nenhuma micção,
- inchaço nos pés ou tornozelos,
- cansaço, e
- falta de ar
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns de Famvir 500mg incluem:
- dor de cabeça, e
- náusea
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Famvir. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
DESCRIÇÃO
O ingrediente ativo dos comprimidos de FAMVIR 500mg é o famciclovir, um pró-fármaco administrado por via oral do agente antiviral penciclovir. Quimicamente, o famciclovir é conhecido como diacetato de 2-[2-(2-amino-9H-purin-9-il)etil]-1,3-propanodiol. Sua fórmula molecular é C14H19N5O4; seu peso molecular é 321,3. É um derivado sintético acíclico da guanina e tem a seguinte estrutura
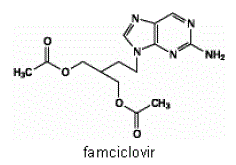
O fanciclovir é um sólido branco a amarelo pálido. É livremente solúvel em acetona e metanol e pouco solúvel em etanol e isopropanol. A 25°C, o fanciclovir é inicialmente solúvel (>25% p/v) em água, mas precipita rapidamente como o monohidrato pouco solúvel (2%-3% p/v). O fanciclovir não é higroscópico abaixo de 85% de umidade relativa. Os coeficientes de partição são: octanol/água (pH 4,8) P=1,09 e tampão octanol/fosfato (pH 7,4) P=2,08.
Os comprimidos de FAMVIR 250 mg contêm 125 mg, 250 mg ou 500 mg de famciclovir, juntamente com os seguintes ingredientes inativos: hidroxipropilcelulose, hidroxipropilmetilcelulose, lactose, estearato de magnésio, polietilenoglicóis, amidoglicolato de sódio e dióxido de titânio.
INDICAÇÕES
Pacientes Adultos Imunocompetentes
Herpes labial (feridas frias)
FAMVIR é indicado para o tratamento de herpes labial recorrente.
Herpes genital
Episódios recorrentes:
FAMVIR é indicado para o tratamento de episódios recorrentes de herpes genital. A eficácia do FAMVIR quando iniciado mais de 6 horas após o início dos sintomas ou lesões não foi estabelecida.
Terapia supressiva:
FAMVIR 250mg é indicado para terapia supressiva crônica de episódios recorrentes de herpes genital. A eficácia e segurança de FAMVIR para a supressão de herpes genital recorrente além de 1 ano não foram estabelecidas.
Herpes Zoster (zona)
FAMVIR 500mg é indicado para o tratamento do herpes zoster. A eficácia de FAMVIR quando iniciado mais de 72 horas após o início do exantema não foi estabelecida.
Pacientes adultos infectados pelo HIV
Herpes Orolabial ou Genital Recorrente
FAMVIR é indicado para o tratamento de episódios recorrentes de herpes orolabial ou genital em adultos infectados pelo HIV. A eficácia do FAMVIR quando iniciado mais de 48 horas após o início dos sintomas ou lesões não foi estabelecida.
Limitação de uso
A eficácia e segurança de FAMVIR não foram estabelecidas para:
- Pacientes
- Pacientes com primeiro episódio de herpes genital
- Pacientes com zoster oftálmico
- Pacientes imunocomprometidos, exceto para o tratamento de herpes orolabial ou genital recorrente em pacientes infectados pelo HIV
- Pacientes negros e afro-americanos com herpes genital recorrente
DOSAGEM E ADMINISTRAÇÃO
FAMVIR 500mg pode ser tomado com ou sem alimentos.
Recomendação de dosagem em pacientes adultos imunocompetentes
Herpes labial (feridas frias)
dosagem recomendada de FAMVIR 500mg para o tratamento de herpes labial recorrente é de 1500mg em dose única. A terapia deve ser iniciada ao primeiro sinal ou sintoma de herpes labial (por exemplo, formigamento, coceira, ardor, dor ou lesão).
Herpes genital
Episódios recorrentes
A dosagem recomendada de FAMVIR para o tratamento de episódios recorrentes de herpes genital é de 1.000 mg duas vezes ao dia por 1 dia. A terapia deve ser iniciada ao primeiro sinal ou sintoma de um episódio recorrente (por exemplo, formigamento, coceira, queimação, dor ou lesão).
Terapia supressiva
A dosagem recomendada de FAMVIR 500mg para terapia supressiva crônica de episódios recorrentes de herpes genital é de 250mg duas vezes ao dia.
Herpes Zoster (zona)
A dosagem recomendada de FAMVIR 250mg para o tratamento do herpes zoster é de 500mg a cada 8 horas por 7 dias. A terapia deve ser iniciada assim que o herpes zoster for diagnosticado.
Recomendação de dosagem em pacientes adultos infectados pelo HIV
Herpes Orolabial ou Genital Recorrente
dosagem recomendada de FAMVIR para o tratamento de herpes orolabial ou genital recorrente em pacientes infectados pelo HIV é de 500 mg duas vezes ao dia por 7 dias. A terapia deve ser iniciada ao primeiro sinal ou sintoma de um episódio recorrente (por exemplo, formigamento, coceira, queimação, dor ou lesão).
Recomendação de dosagem em pacientes com insuficiência renal
As recomendações de dosagem para pacientes adultos com insuficiência renal são fornecidas na Tabela 1 [ver Uso em populações específicas , FARMACOLOGIA CLÍNICA ].
COMO FORNECIDO
Formas de dosagem e pontos fortes
Os comprimidos FAMVIR estão disponíveis em 3 dosagens:
- 125 mg: Branco, redondo, revestido por película, biconvexo, com bordas biseladas, gravado com “FAMVIR” de um lado e “125” do outro lado
- 250 mg: Branco, redondo, revestido por película, biconvexo, com bordas biseladas, gravado com “FAMVIR” de um lado e “250” do outro lado
- 500 mg: Branco, revestido por película oval, biconvexo, gravado com “FAMVIR” de um lado e “500” do outro lado
Armazenamento e manuseio
FAMVIR os comprimidos são fornecidos como comprimidos revestidos por película da seguinte forma: 125 mg em frascos de 30; 250 mg em frascos de 30; 500 mg em frascos de 30 e embalagens unitárias de 50 (destinadas apenas a uso institucional).
- Comprimido de FAMVIR 125 mg: Revestido por película branco, redondo, biconvexo, com extremidades biseladas, com a gravação “FAMVIR” numa das faces e “125” na outra. 125 mg 30's NDC 0078-0366-15
- FAMVIR 250 mg comprimido : Branco, redondo, revestido por película, biconvexo, bordas biseladas, gravado com “FAMVIR” de um lado e “250” do outro. 250 mg 30's NDC 0078-0367-15
- FAMVIR 500 mg comprimido : Branco, revestido por película oval, biconvexo, gravado com “FAMVIR” de um lado e “500” do outro. 500 mg 30's NDC 0078-0368-15 500 mg SUP 50's NDC 0078-0368-64
Armazenar a 25°C (77°F); excursões permitidas para 15-30°C (59-86°F) [veja USP Controlled Room Temperature].
Distribuído por: Novartis Pharmaceuticals Corporation, East Hanover, Nova Jersey 07936. Revisado: setembro de 2016
EFEITOS COLATERAIS
insuficiência renal aguda é discutida com mais detalhes em outras seções do rótulo [ver AVISOS E PRECAUÇÕES ].
Os eventos adversos mais comuns relatados em pelo menos 1 indicação por >10% dos pacientes adultos tratados com FAMVIR 250mg são cefaléia e náusea.
Experiência de Ensaios Clínicos em Pacientes Adultos
Como os ensaios clínicos são conduzidos sob condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser comparadas diretamente com as taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
Pacientes imunocompetentes
A segurança de FAMVIR 250mg foi avaliada em estudos clínicos controlados por placebo e ativo envolvendo 816 pacientes tratados com FAMVIR com herpes zoster (FAMVIR, 250 mg três vezes ao dia a 750 mg três vezes ao dia); 163 pacientes tratados com FAMVIR com herpes genital recorrente (FAMVIR, 1000 mg duas vezes ao dia); 1.197 pacientes com herpes genital recorrente tratados com FAMVIR 250mg como terapia supressiva (125 mg uma vez ao dia a 250 mg três vezes ao dia) dos quais 570 pacientes receberam FAMVIR (aberto e/ou duplo-cego) por pelo menos 10 meses; e 447 pacientes tratados com FAMVIR com herpes labial (FAMVIR 500mg, 1500mg uma vez ao dia ou 750mg duas vezes ao dia). A Tabela 2 lista os eventos adversos selecionados.
Tabela 3 lista anormalidades laboratoriais selecionadas em ensaios de supressão de herpes genital.
Pacientes infectados pelo HIV
Em pacientes infectados pelo HIV, os eventos adversos mais frequentemente relatados para FAMVIR (500 mg duas vezes ao dia; n=150) e aciclovir (400 mg, 5x/dia; n=143), respectivamente, foram cefaleia (17% vs. 15% ), náuseas (11% vs. 13%), diarreia (7% vs. 11%), vômitos (5% vs. 4%), fadiga (4% vs. 2%) e dor abdominal (3% vs. 6%).
Experiência pós-marketing
Os eventos adversos listados abaixo foram relatados durante o uso pós-aprovação de FAMVIR. Como esses eventos são relatados voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento:
Distúrbios do sangue e do sistema linfático : Trombocitopenia
Distúrbios hepatobiliares : Testes anormais de função hepática, icterícia colestática
Distúrbios do sistema imunológico : Choque anafilático, reação anafilática
Distúrbios do sistema nervoso : Tonturas, sonolência, convulsão
Distúrbios psiquiátricos Confusão (incluindo delírio, desorientação e estado confusional ocorrendo predominantemente em idosos), alucinações
Distúrbios da pele e tecido subcutâneo : Urticária, eritema multiforme, síndrome de Stevens-Johnson, necrólise epidérmica tóxica, angioedema (p.
Distúrbios cardíacos : Palpitações
INTERAÇÕES MEDICAMENTOSAS
Potencial para FAMVIR 250mg para afetar outros medicamentos
A farmacocinética da digoxina no estado de equilíbrio não foi alterada pela administração concomitante de doses múltiplas de famciclovir (500 mg três vezes ao dia). Nenhum efeito clinicamente significativo na farmacocinética da zidovudina, seu metabólito zidovudina glicuronídeo ou emtricitabina foi observado após uma dose oral única de 500 mg de famciclovir coadministrado com zidovudina ou emtricitabina.
Um estudo in vitro utilizando microssomas hepáticos humanos sugere que o famciclovir não é um inibidor das enzimas CYP3A4.
Potencial para outros medicamentos afetarem o penciclovir
Não foram observadas alterações clinicamente significativas na farmacocinética do penciclovir após a administração de dose única de 500 mg de fanciclovir após pré-tratamento com doses múltiplas de alopurinol, cimetidina, teofilina, zidovudina, prometazina, quando administrados logo após um antiácido (hidróxido de magnésio e alumínio), ou concomitantemente com emtricitabina. Nenhum efeito clinicamente significativo na farmacocinética do penciclovir foi observado após a administração de doses múltiplas (três vezes ao dia) de fanciclovir (500 mg) com doses múltiplas de digoxina.
O uso concomitante com probenecida ou outras drogas eliminadas significativamente pela secreção tubular renal ativa pode resultar em aumento das concentrações plasmáticas de penciclovir.
conversão de 6-desoxi penciclovir em penciclovir é catalisada pela aldeído oxidase. Interações com outras drogas metabolizadas por esta enzima e/ou inibindo esta enzima podem ocorrer. Os estudos clínicos de interação do famciclovir com cimetidina e prometazina, inibidores in vitro da aldeído oxidase, não mostraram efeitos relevantes na formação do penciclovir. O raloxifeno, um potente inibidor da aldeído oxidase in vitro, pode diminuir a formação de penciclovir. No entanto, não foi realizado um estudo clínico de interação medicamentosa para determinar a magnitude da interação entre penciclovir e raloxifeno.
AVISOS
Incluído como parte do "PRECAUÇÕES" Seção
PRECAUÇÕES
Insuficiência renal aguda
Casos de insuficiência renal aguda foram relatados em pacientes com doença renal subjacente que receberam doses inadequadamente altas de FAMVIR para seu nível de função renal. A redução da dose é recomendada ao administrar FAMVIR a pacientes com insuficiência renal [ver DOSAGEM E ADMINISTRAÇÃO , Uso em populações específicas ].
Informações de Aconselhamento do Paciente
Aconselhe o paciente a ler o rótulo do paciente aprovado pela FDA (Informações ao Paciente).
Não há evidências de que FAMVIR afete a capacidade do paciente de dirigir ou operar máquinas. No entanto, os pacientes que apresentarem tontura, sonolência, confusão ou outros distúrbios do sistema nervoso central enquanto estiverem tomando FAMVIR 500mg devem evitar dirigir ou operar máquinas.
Como FAMVIR contém lactose (FAMVIR 125 mg, 250 mg e 500 mg comprimidos contêm lactose 26,9 mg, 53,7 mg e 107,4 mg, respectivamente), pacientes com problemas hereditários raros de intolerância à galactose, deficiência grave de lactase ou má absorção de glicose-galactose devem ser aconselhados a discutir com seu médico antes de tomar FAMVIR.
Herpes labial (feridas frias)
Os pacientes devem ser aconselhados a iniciar o tratamento ao primeiro sinal ou sintoma de recorrência de herpes labial (por exemplo, formigamento, coceira, queimação, dor ou lesão). Os pacientes devem ser instruídos que o tratamento para herpes labial não deve exceder 1 dose. Os pacientes devem ser informados de que FAMVIR não é uma cura para herpes labial.
Herpes genital
Os pacientes devem ser informados de que FAMVIR não é uma cura para herpes genital. Não há dados avaliando se o FAMVIR impedirá a transmissão da infecção para outras pessoas. Como o herpes genital é uma doença sexualmente transmissível, os pacientes devem evitar o contato com lesões ou relações sexuais quando lesões e/ou sintomas estiverem presentes para evitar a infecção dos parceiros. O herpes genital é frequentemente transmitido na ausência de sintomas através da disseminação viral assintomática. Portanto, os pacientes devem ser aconselhados a usar práticas sexuais mais seguras.
Se a terapia episódica para herpes genital recorrente for indicada, os pacientes devem ser aconselhados a iniciar a terapia ao primeiro sinal ou sintoma de um episódio.
Não existem dados sobre a segurança ou eficácia da terapia supressiva crônica com duração superior a 1 ano.
Herpes Zoster (zona)
Não existem dados sobre o tratamento iniciado mais de 72 horas após o início da erupção cutânea zoster. Os pacientes devem ser aconselhados a iniciar o tratamento o mais rápido possível após o diagnóstico de herpes zoster.
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Carcinogênese
Estudos de carcinogenicidade dietética de dois anos com fanciclovir foram conduzidos em ratos e camundongos. Um aumento na incidência de adenocarcinoma mamário (um tumor comum em animais desta cepa) foi observado em ratas recebendo a dose alta de 600 mg/kg/dia (1,1 a 4,5x a exposição sistêmica humana na dose oral diária total recomendada variando entre 500 mg e 2000 mg, com base na área sob as comparações da curva de concentração plasmática [24 h AUC] para penciclovir). Não foram relatados aumentos na incidência de tumores em ratos machos tratados com doses de até 240 mg/kg/dia (0,7 a 2,7x a AUC humana), ou em camundongos machos e fêmeas em doses de até 600 mg/kg/dia (0,3 a 1,2x a AUC humana).
Mutagênese
famciclovir e o penciclovir (o metabólito ativo do famciclovir) foram testados quanto ao potencial genotóxico em uma bateria de ensaios in vitro e in vivo. Fanciclovir e penciclovir foram negativos em testes in vitro para mutações genéticas em bactérias (S. typhimurium e E. coli) e síntese de DNA não programada em células HeLa 83 de mamíferos (em doses de até 10.000 e 5.000 mcg/placa, respectivamente). O famciclovir também foi negativo no ensaio de linfoma em camundongo L5178Y (5.000 mcg/mL), no teste de micronúcleo em camundongo in vivo (4.800 mg/kg) e no estudo letal dominante em ratos (5.000 mg/kg). O famciclovir induziu aumentos na poliploidia em linfócitos humanos in vitro na ausência de dano cromossômico (1200 mcg/mL). O penciclovir foi positivo no ensaio de linfoma de camundongo L5178Y para mutação genética/aberrações cromossômicas, com e sem ativação metabólica (1000 mcg/mL). Em linfócitos humanos, o penciclovir causou aberrações cromossômicas na ausência de ativação metabólica (250 mcg/mL). O penciclovir causou um aumento da incidência de micronúcleos na medula óssea de camundongos in vivo quando administrado por via intravenosa em doses altamente tóxicas para a medula óssea (500 mg/kg), mas não quando administrado por via oral.
Prejuízo da Fertilidade
Toxicidade testicular foi observada em ratos, camundongos e cães após administração repetida de fanciclovir ou penciclovir. As alterações testiculares incluíram atrofia dos túbulos seminíferos, redução na contagem de espermatozóides e/ou aumento da incidência de espermatozóides com morfologia anormal ou motilidade reduzida. O grau de toxicidade para a reprodução masculina foi relacionado à dose e duração da exposição. Em ratos machos, observou-se diminuição da fertilidade após 10 semanas de administração de 500 mg/kg/dia (1,4 a 5,7x a AUC humana). O nível de efeito não observável para esperma e toxicidade testicular em ratos após administração crônica (26 semanas) foi de 50 mg/kg/dia (0,15 a 0,6x a exposição sistêmica humana com base em comparações de AUC). A toxicidade testicular foi observada após a administração crônica a camundongos (104 semanas) e cães (26 semanas) em doses de 600 mg/kg/dia (0,3 a 1,2x a AUC humana) e 150 mg/kg/dia (1,3 a 5,1x a AUC humana). AUC humana), respectivamente.
fanciclovir não teve efeito sobre o desempenho reprodutivo geral ou fertilidade em ratas em doses de até 1.000 mg/kg/dia (2,7 a 10,8 vezes a AUC humana).
Dois estudos controlados por placebo em um total de 130 homens saudáveis com perfil de esperma normal durante um período basal de 8 semanas e herpes genital recorrente recebendo FAMVIR oral (250 mg duas vezes ao dia) (n=66) ou placebo (n=64) A terapia por 18 semanas não mostrou evidências de efeitos significativos na contagem, motilidade ou morfologia dos espermatozoides durante o tratamento ou durante um acompanhamento de 8 semanas.
Uso em populações específicas
Gravidez
Gravidez Categoria B
Após a administração oral, o famciclovir (pró-fármaco) é convertido em penciclovir (fármaco ativo). Não existem estudos adequados e bem controlados sobre o uso de fanciclovir ou penciclovir em mulheres grávidas. Não foram observados efeitos adversos no desenvolvimento embriofetal em estudos de reprodução animal utilizando fanciclovir e penciclovir em doses superiores à dose humana máxima recomendada (MRHD) e exposição humana. Como os estudos de reprodução em animais nem sempre são preditivos da resposta humana, o fanciclovir deve ser usado durante a gravidez somente se necessário.
Em estudos de reprodução em animais, ratas e coelhas grávidas receberam fanciclovir oral em doses (até 1.000 mg/kg/dia) que forneceram 2,7 a 10,8 vezes (ratos) e 1,4 a 5,4 vezes (coelhos) a exposição sistêmica humana com base na AUC. Não foram observados efeitos adversos no desenvolvimento embriofetal. Em outros estudos, ratas e coelhas grávidas receberam fanciclovir intravenoso em doses (360 mg/kg/dia) 1,5 a 6 vezes (ratos) e (120 mg/kg/dia) 1,1 a 4,5 vezes (coelhos) ou penciclovir em doses (80 mg/kg/dia) 0,3 a 1,3 vezes (ratos) e (60 mg/kg/dia) 0,5 a 2,1 vezes (coelhos) a MRHD com base em comparações da área de superfície corporal. Não foram observados efeitos adversos no desenvolvimento embriofetal.
Relatório de Exposição à Gravidez
Para monitorar os resultados materno-fetais de mulheres grávidas expostas ao FAMVIR 500mg, a Novartis Pharmaceuticals Corporation mantém um sistema FAMVIR Pregnancy Reporting. Os médicos são incentivados a relatar seus pacientes ligando para 1-888-NOW-NOVA (669-6682).
Mães que amamentam
Não se sabe se o fanciclovir (pró-fármaco) ou o penciclovir (fármaco ativo) são excretados no leite humano. Após a administração oral de famciclovir a ratas lactantes, o penciclovir foi excretado no leite materno em concentrações superiores às observadas no plasma. Não existem dados sobre a segurança de FAMVIR 250mg em lactentes. FAMVIR 500mg não deve ser usado em lactantes, a menos que os benefícios potenciais superem os riscos potenciais associados ao tratamento.
Uso Pediátrico
A eficácia de FAMVIR 250mg não foi estabelecida em pacientes pediátricos. O perfil farmacocinético e a segurança do famciclovir (grânulos experimentais misturados com OraSweet® ou comprimidos) foram estudados em 3 estudos abertos.
Estudo 1 foi um estudo farmacocinético e de segurança de dose única em bebês de 1 mês a
Estudo 2 foi um estudo aberto, farmacocinético de dose única, de segurança de dose múltipla de grânulos experimentais de famciclovir misturados com OraSweet em crianças de 1 a
Um total de 100 pacientes foram incluídos na parte de segurança de dose múltipla do estudo; 47 indivíduos com infecção ativa ou latente por HSV e 53 indivíduos com varicela. Pacientes com infecção ativa ou latente por HSV receberam fanciclovir duas vezes ao dia por 7 dias. A dose diária de fanciclovir variou de 150 mg a 500 mg duas vezes ao dia, dependendo do peso corporal do paciente. Pacientes com varicela receberam fanciclovir três vezes ao dia por 7 dias. A dose diária de fanciclovir variou de 150 mg a 500 mg três vezes ao dia, dependendo do peso corporal do paciente. Os eventos adversos clínicos e anormalidades nos testes laboratoriais observados neste estudo foram semelhantes aos observados em adultos. Os dados disponíveis são insuficientes para apoiar o uso de fanciclovir para o tratamento de crianças de 1 a
Catapora
eficácia do fanciclovir no tratamento da varicela não foi estabelecida em pacientes pediátricos ou adultos. O famciclovir é aprovado para o tratamento do herpes zoster em pacientes adultos. No entanto, a extrapolação dos dados de eficácia de adultos com herpes zoster para crianças com varicela não seria apropriado. Embora a varicela e o herpes zoster sejam causados pelo mesmo vírus, as doenças são diferentes.
Herpes genital
A informação clínica sobre herpes genital em crianças é limitada. Portanto, os dados de eficácia de adultos não podem ser extrapolados para esta população. Além disso, o fanciclovir não foi estudado em crianças de 1 a
Herpes labial
Não há dados farmacocinéticos e de segurança em crianças de 1 a
Estudo 3 foi um estudo aberto de braço único para avaliar a farmacocinética, segurança e atividade antiviral de uma dose única de 1.500 mg (três comprimidos de 500 mg) de famciclovir em crianças de 12 a
Em um estudo de fase 3 em adultos no qual os pacientes receberam uma dose única de 1.500 mg de famciclovir ou placebo, o tempo médio de cura entre os pacientes com lesões não abortadas foi de 4,4 dias no grupo de fanciclovir 1.500 mg de dose única e 6,2 dias no grupo de dose única de famciclovir. grupo placebo. É importante notar que no estudo de adultos o tratamento foi iniciado pelos pacientes dentro de 1 hora após o início dos sintomas [ver Estudos clínicos ]. Com base nos resultados de eficácia do Estudo 3, o fanciclovir não é recomendado em crianças de 12 a
Uso Geriátrico
Dos 816 pacientes com herpes zoster em estudos clínicos que foram tratados com FAMVIR, 248 (30,4%) tinham ≥65 anos de idade e 103 (13%) tinham ≥75 anos de idade. Não foram observadas diferenças globais na incidência ou tipos de eventos adversos entre pacientes mais jovens e mais velhos. Dos 610 pacientes com herpes simples recorrente (tipo 1 ou tipo 2) em estudos clínicos que foram tratados com FAMVIR 500mg, 26 (4,3%) tinham >65 anos de idade e 7 (1,1%) tinham >75 anos de idade. Os estudos clínicos de FAMVIR 500mg em pacientes com herpes genital recorrente não incluíram um número suficiente de indivíduos com 65 anos ou mais para determinar se eles respondem de forma diferente em comparação com indivíduos mais jovens.
Nenhum ajuste de dose de fanciclovir com base na idade é recomendado, a menos que a função renal esteja comprometida. DOSAGEM E ADMINISTRAÇÃO , FARMACOLOGIA CLÍNICA ]. Em geral, deve-se ter cautela apropriada na administração e monitoramento de FAMVIR 250mg em pacientes idosos, refletindo a maior frequência de diminuição da função renal e uso concomitante de outros medicamentos.
Pacientes com Insuficiência Renal
A depuração plasmática aparente, a depuração renal e a constante da taxa de eliminação plasmática do penciclovir diminuíram linearmente com reduções na função renal. Após a administração de uma dose oral única de 500 mg de fanciclovir (n=27) a voluntários saudáveis e a voluntários com vários graus de insuficiência renal (CLCR variou de 6,4 a 138,8 mL/min), foram obtidos os seguintes resultados (Tabela 4):
Em um estudo de doses múltiplas de famciclovir realizado em indivíduos com graus variados de insuficiência renal (n=18), a farmacocinética do penciclovir foi comparável àquelas após doses únicas.
Um ajuste de dose é recomendado para pacientes com insuficiência renal [ver DOSAGEM E ADMINISTRAÇÃO ].
Pacientes com Insuficiência Hepática
Insuficiência hepática leve ou moderada (hepatite crônica [n=6], abuso crônico de etanol [n=8] ou cirrose biliar primária [n=1]) não teve efeito sobre a extensão da disponibilidade (AUC) do penciclovir após uma dose única de 500 mg de fanciclovir. No entanto, houve uma diminuição de 44% na concentração plasmática máxima média de penciclovir (Cmax) e o tempo para a concentração plasmática máxima (tmax) foi aumentado em 0,75 horas em pacientes com insuficiência hepática em comparação com voluntários normais. Nenhum ajuste de dose é recomendado para pacientes com insuficiência hepática leve ou moderada. A farmacocinética do penciclovir não foi avaliada em pacientes com insuficiência hepática grave. A conversão do famciclovir no metabólito ativo penciclovir pode ser prejudicada nesses pacientes, resultando em concentrações plasmáticas mais baixas de penciclovir e, portanto, possivelmente, uma diminuição da eficácia do famciclovir. FARMACOLOGIA CLÍNICA ].
Pacientes negros e afro-americanos
Em um estudo randomizado, duplo-cego, controlado por placebo, realizado em 304 adultos imunocompetentes negros e afro-americanos com herpes genital recorrente, não houve diferença no tempo médio de cura entre os pacientes que receberam FAMVIR ou placebo. Em geral, o perfil de reações adversas foi semelhante ao observado em outros ensaios clínicos FAMVIR para pacientes adultos [ver REAÇÕES ADVERSAS ]. A relevância desses resultados do estudo para outras indicações em pacientes negros e afro-americanos é desconhecida [ver Estudos clínicos ].
SOBREDOSAGEM
Deve ser administrada terapia sintomática e de suporte apropriada. O penciclovir é removido por hemodiálise.
CONTRA-INDICAÇÕES
FAMVIR 250mg é contraindicado em pacientes com hipersensibilidade conhecida ao produto, seus componentes ou Denavir® (creme de penciclovir).
FARMACOLOGIA CLÍNICA
Mecanismo de ação
O fanciclovir é um pró-fármaco administrado por via oral do agente antiviral penciclovir [ver Microbiologia ].
Farmacocinética
fanciclovir é o análogo diacetil 6-desoxi do composto antiviral ativo penciclovir. Após administração oral, o fanciclovir sofre um metabolismo rápido e extenso em penciclovir e pouco ou nenhum fanciclovir é detectado no plasma ou na urina. O penciclovir é predominantemente eliminado inalterado pelo rim. Portanto, a dose de FAMVIR 500mg precisa ser ajustada em pacientes com diferentes graus de insuficiência renal [ver DOSAGEM E ADMINISTRAÇÃO ].
Farmacocinética em Adultos
Absorção e Biodisponibilidade:
A biodisponibilidade absoluta do penciclovir é de 77 ± 8%, conforme determinado após a administração de uma dose oral de 500 mg de fanciclovir e uma dose intravenosa de 400 mg de penciclovir em 12 indivíduos saudáveis do sexo masculino.
As concentrações de penciclovir aumentaram proporcionalmente à dose em um intervalo de dose de fanciclovir de 125 mg a 1.000 mg administrado como dose única. A Tabela 5 mostra os parâmetros farmacocinéticos médios do penciclovir após administração única de FAMVIR a voluntários saudáveis do sexo masculino.
Após administração oral de dose única de 500 mg de fanciclovir a 7 pacientes com herpes zoster, a AUC (média ± SD), Cmax e tmax foram 12,1±1,7 mcg h/mL, 4,0±0,7 mcg/mL e 0,7±0,2 horas , respectivamente. A AUC do penciclovir foi aproximadamente 35% maior em pacientes com herpes zoster em comparação com voluntários saudáveis. Parte dessa diferença pode ser devido a diferenças na função renal entre os 2 grupos.
Não há acúmulo de penciclovir após a administração de 500 mg de fanciclovir três vezes ao dia por 7 dias.
Cmax do penciclovir diminuiu aproximadamente 50% e o tmax foi atrasado em 1,5 horas quando uma formulação em cápsula de famciclovir foi administrada com alimentos (o conteúdo nutricional era de aproximadamente 910 Kcal e 26% de gordura). Não houve efeito na extensão da disponibilidade (AUC) do penciclovir. Houve uma diminuição de 18% na Cmax e um atraso no tmax de cerca de 1 hora quando o fanciclovir foi administrado 2 horas após uma refeição em comparação com a sua administração 2 horas antes de uma refeição. Como não houve efeito na extensão da disponibilidade sistêmica do penciclovir, FAMVIR 250mg pode ser tomado independentemente das refeições.
Distribuição:
O volume de distribuição (Vdβ) foi de 1,08±0,17 L/kg em 12 indivíduos saudáveis do sexo masculino após uma dose intravenosa única de penciclovir a 400 mg administrada como uma infusão intravenosa de 1 hora. O penciclovir liga-se
Metabolismo:
Após administração oral, o famciclovir é desacetilado e oxidado para formar penciclovir. Os metabólitos inativos incluem 6-desoxi penciclovir, penciclovir monoacetilado e 6-desoxi monoacetilado penciclovir (5%, INTERAÇÕES MEDICAMENTOSAS ].
Eliminação:
Aproximadamente 94% da radioatividade administrada foi recuperada na urina em 24 horas (83% da dose foi excretada nas primeiras 6 horas) após a administração de 5 mg/kg de penciclovir radiomarcado como uma infusão de 1 hora a 3 voluntários saudáveis do sexo masculino. O penciclovir foi responsável por 91% da radioatividade excretada na urina.
Após a administração oral de uma dose única de 500 mg de fanciclovir radiomarcado a 3 voluntários saudáveis do sexo masculino, 73% e 27% da radioatividade administrada foi recuperada na urina e nas fezes em 72 horas, respectivamente. O penciclovir foi responsável por 82% e o 6-desoxi penciclovir foi responsável por 7% da radioatividade excretada na urina. Aproximadamente 60% da dose radiomarcada administrada foi coletada na urina nas primeiras 6 horas.
Após administração intravenosa de penciclovir em 48 voluntários saudáveis do sexo masculino, a depuração plasmática total média ± DP do penciclovir foi de 36,6±6,3 L/h (0,48±0,09 L/h/kg). A depuração renal do penciclovir foi responsável por 74,5±8,8% da depuração plasmática total.
depuração renal do penciclovir após a administração oral de uma dose única de 500 mg de fanciclovir a 109 voluntários saudáveis do sexo masculino foi de 27,7±7,6 L/h. A secreção tubular ativa contribui para a eliminação renal do penciclovir.
A meia-vida de eliminação plasmática do penciclovir foi de 2,0±0,3 horas após a administração intravenosa de penciclovir em 48 voluntários saudáveis do sexo masculino e de 2,3±0,4 horas após a administração oral de 500 mg de fanciclovir em 124 voluntários saudáveis do sexo masculino. A meia-vida em 17 pacientes com herpes zoster foi de 2,8±1,0 horas e 2,7±1,0 horas após doses únicas e repetidas, respectivamente.
Populações Especiais
Pacientes Geriátricos
Com base na comparação de estudos cruzados, a AUC do penciclovir foi 40% maior e a depuração renal do penciclovir foi 22% menor em indivíduos idosos (n=18, idade 65-79 anos) em comparação com indivíduos mais jovens. Parte dessa diferença pode ser devido a diferenças na função renal entre os 2 grupos. Nenhum ajuste de dose de fanciclovir com base na idade é recomendado, a menos que a função renal esteja comprometida. DOSAGEM E ADMINISTRAÇÃO , Uso em populações específicas ]
Pacientes com Insuficiência Renal
Em indivíduos com vários graus de insuficiência renal, a depuração plasmática aparente, a depuração renal e a constante da taxa de eliminação plasmática do penciclovir diminuíram linearmente com reduções na função renal, após doses únicas e repetidas. Uso em populações específicas ]. Um ajuste de dose é recomendado para pacientes com insuficiência renal [ver DOSAGEM E ADMINISTRAÇÃO ].
Pacientes com Insuficiência Hepática
A insuficiência hepática leve ou moderada não teve efeito sobre a extensão da disponibilidade (AUC) do penciclovir [ver Uso em populações específicas ]. Nenhum ajuste de dose é recomendado para pacientes com insuficiência hepática leve ou moderada. O efeito da insuficiência hepática grave na farmacocinética do penciclovir não foi avaliado.
Pacientes infectados pelo HIV
Após a administração oral de uma dose única de 500 mg de fanciclovir a pacientes HIV-positivos, os parâmetros farmacocinéticos do penciclovir foram comparáveis aos observados em indivíduos saudáveis.
Gênero
farmacocinética do penciclovir foi avaliada em 18 voluntários saudáveis do sexo masculino e 18 saudáveis do sexo feminino após administração oral de dose única de 500 mg de fanciclovir. A AUC do penciclovir foi de 9,3±1,9 mcg h/mL e 11,1±2,1 mcg h/mL em homens e mulheres, respectivamente. A depuração renal do penciclovir foi de 28,5±8,9 L/h e 21,8±4,3 L/h, respectivamente. Essas diferenças foram atribuídas a diferenças na função renal entre os 2 grupos. Não é recomendado nenhum ajuste de dose de fanciclovir com base no sexo.
Corrida
Uma avaliação retrospectiva foi realizada para comparar os parâmetros farmacocinéticos obtidos em indivíduos negros e caucasianos após administração única e repetida de fanciclovir 500 mg uma vez ao dia, duas vezes ao dia ou três vezes ao dia. Os dados de um estudo em voluntários saudáveis (dose única), um estudo em indivíduos com vários graus de insuficiência renal (dose única e repetida) e um estudo em indivíduos com insuficiência hepática (dose única) não indicaram diferenças significativas na farmacocinética de penciclovir entre indivíduos negros e caucasianos.
Microbiologia
Mecanismo de ação
famciclovir é uma pró-droga do penciclovir, que demonstrou atividade inibitória contra o vírus herpes simplex tipos 1 (HSV-1) e 2 (HSV-2) e o vírus varicela zoster (VZV). Em células infectadas com HSV-1, HSV-2 ou VZV, a timidina quinase viral fosforila o penciclovir a uma forma monofosfato que, por sua vez, é convertida por quinases celulares na forma ativa penciclovir trifosfato. Estudos bioquímicos demonstram que o trifosfato de penciclovir inibe a DNA polimerase do HSV-2 competitivamente com o trifosfato de desoxiguanosina. Consequentemente, a síntese de DNA viral do herpes e, portanto, a replicação são seletivamente inibidas. O trifosfato de penciclovir tem meia-vida intracelular de 10 horas em HSV-1-, 20 horas em HSV-2 e 7 horas em células infectadas com VZV cultivadas em cultura. No entanto, o significado clínico da meia-vida intracelular é desconhecido.
Atividade antiviral
Em estudos de cultura de células, o penciclovir é inibitório para os seguintes vírus do herpes: HSV-1, HSV-2 e VZV. A atividade antiviral do penciclovir contra cepas do tipo selvagem cultivadas em fibroblastos de prepúcio humano foi avaliada com um ensaio de redução de placa e coloração com cristal violeta 3 dias após a infecção para HSV e 10 dias após a infecção para VZV. Os valores médios de EC50 de penciclovir contra isolados laboratoriais e clínicos de HSV-1, HSV-2 e VZV foram 2 μM (intervalo de 1,2 a 2,4 μM, n=7), 2,6 μM (intervalo de 1,6 a 11 μM, n=6) , e 34 μM (intervalo de 6,7 a 71 μM, n=6), respectivamente.
Resistência
Mutantes de HSV e VZV resistentes ao penciclovir podem resultar de mutações nos genes virais da timidina quinase (TK) e da DNA polimerase. Mutações no gene TK viral podem levar à perda completa da atividade de TK (TK negativo), níveis reduzidos de atividade de TK (TK parcial) ou alteração na capacidade do TK viral de fosforilar a droga sem uma perda equivalente na capacidade de fosforilar timidina (TK alterada). Os valores médios de EC50 observados em um ensaio de redução de placa com HSV-1, HSV-2 e VZV resistentes ao penciclovir foram 69 μM (intervalo de 14 a 115 μM, n=6), 46 μM (intervalo de 4 a >395 μM, n= 9) e 92 μM (intervalo de 51 a 148 μM, n=4), respectivamente. A possibilidade de resistência viral ao penciclovir deve ser considerada em pacientes que não respondem ou apresentam eliminação viral recorrente durante a terapia.
Resistência cruzada
Foi observada resistência cruzada entre os inibidores da DNA polimerase do HSV. Os mutantes resistentes ao aciclovir mais comumente encontrados que são negativos para TK também são resistentes ao penciclovir.
Estudos clínicos
Herpes labial (feridas frias)
Um estudo randomizado, duplo-cego, controlado por placebo foi realizado em 701 adultos imunocompetentes com herpes labial recorrente. Os pacientes iniciaram a terapia por conta própria dentro de 1 hora do primeiro início dos sinais ou sintomas de um episódio recorrente de herpes labial com FAMVIR 1.500 mg em dose única (n=227), FAMVIR 750 mg duas vezes ao dia (n=220) ou placebo (n= 254) por 1 dia. O tempo médio para cicatrização entre pacientes com lesões não abortadas (progredindo além do estágio de pápula) foi de 4,4 dias no grupo de dose única de FAMVIR 1500 mg (n=152) em comparação com 6,2 dias no grupo placebo (n=168) . A diferença média no tempo de cicatrização entre os grupos tratados com placebo e FAMVIR 1500 mg foi de 1,3 dias (IC 95%: 0,6–2,0). Não foram observadas diferenças na proporção de pacientes com lesões abortadas (não progredindo além do estágio de pápula) entre os pacientes que receberam FAMVIR 250mg ou placebo: 33% para FAMVIR 1500 mg em dose única e 34% para placebo. O tempo médio para perda da dor e sensibilidade foi de 1,7 dias em pacientes tratados com FAMVIR 1500 mg em dose única versus 2,9 dias em pacientes tratados com placebo.
Herpes genital
Episódios recorrentes
Um estudo randomizado, duplo-cego, controlado por placebo foi realizado em 329 adultos imunocompetentes com herpes genital recorrente. Os pacientes iniciaram a terapia dentro de 6 horas do primeiro sinal ou sintoma de um episódio recorrente de herpes genital com FAMVIR 1.000 mg duas vezes ao dia (n=163) ou placebo (n=166) por 1 dia. O tempo médio de cicatrização entre pacientes com lesões não abortadas (progredindo além do estágio de pápula) foi de 4,3 dias em pacientes tratados com FAMVIR (n=125) em comparação com 6,1 dias em pacientes tratados com placebo (n=145). A diferença mediana no tempo de cicatrização entre os grupos tratados com placebo e FAMVIR foi de 1,2 dias (IC 95%: 0,5 a 2,0). Vinte e três por cento dos pacientes tratados com FAMVIR tiveram lesões abortadas (sem desenvolvimento de lesões além do eritema) versus 13% em pacientes tratados com placebo. O tempo médio para a perda de todos os sintomas (por exemplo, formigamento, coceira, queimação, dor ou sensibilidade) foi de 3,3 dias em pacientes tratados com FAMVIR versus 5,4 dias em pacientes tratados com placebo.
Um estudo randomizado (2:1), duplo-cego, controlado por placebo foi realizado em 304 adultos imunocompetentes negros e afro-americanos com herpes genital recorrente. Os pacientes iniciaram a terapia dentro de 6 horas após o primeiro sinal ou sintoma de um episódio recorrente de herpes genital com FAMVIR 1.000 mg duas vezes ao dia (n=206) ou placebo (n=98) por 1 dia. O tempo médio de cicatrização entre os pacientes com lesões não abortadas foi de 5,4 dias nos pacientes tratados com FAMVIR (n=152) em comparação com 4,8 dias nos pacientes tratados com placebo (n=78). A diferença mediana no tempo de cicatrização entre os grupos tratados com placebo e FAMVIR foi de -0,26 dias (IC 95%: -0,98 a 0,40).
Terapia supressiva
Dois estudos randomizados, duplo-cegos, controlados por placebo, de 12 meses foram conduzidos em 934 adultos imunocompetentes com histórico de 6 ou mais recorrências de episódios de herpes genital por ano. As comparações incluíram FAMVIR 125 mg três vezes ao dia, 250 mg duas vezes ao dia, 250 mg três vezes ao dia e placebo. Aos 12 meses, 60% a 65% dos pacientes ainda estavam recebendo FAMVIR e 25% estavam recebendo tratamento com placebo. As taxas de recorrência aos 6 e 12 meses em pacientes tratados com a dose de 250 mg duas vezes ao dia são mostradas na Tabela 6.
Os pacientes tratados com FAMVIR tiveram aproximadamente 1/5 do número médio de recorrências em comparação com os pacientes tratados com placebo. Doses mais altas de FAMVIR 250mg não foram associadas a um aumento na eficácia.
Herpes Orolabial ou Genital Recorrente em Pacientes Infectados pelo HIV
Um estudo randomizado, duplo-cego comparou fanciclovir 500 mg duas vezes ao dia por 7 dias (n = 150) com aciclovir oral 400 mg 5 vezes ao dia por 7 dias (n = 143) em pacientes infectados pelo HIV com herpes orolabial ou genital recorrente tratados dentro de 48 horas do início da lesão. Aproximadamente 40% dos pacientes apresentaram contagem de CD4+ abaixo de 200 células/mm3, 54% dos pacientes apresentaram lesões anogenitais e 35% lesões orolabiais. A terapia com fanciclovir foi comparável ao aciclovir oral na redução da formação de novas lesões e no tempo para a cicatrização completa.
Herpes Zoster (zona)
Dois estudos randomizados, duplo-cegos, 1 controlado por placebo e 1 controlado por ativo, foram conduzidos em 964 adultos imunocompetentes com herpes zoster não complicado. O tratamento foi iniciado dentro de 72 horas após o aparecimento da primeira lesão e continuou por 7 dias.
No estudo controlado por placebo, 419 pacientes foram tratados com FAMVIR 500 mg três vezes ao dia (n=138), FAMVIR 750 mg três vezes ao dia (n=135) ou placebo (n=146). O tempo médio para formação de crostas foi de 5 dias entre os pacientes tratados com FAMVIR 500 mg em comparação com 7 dias nos pacientes tratados com placebo. Os tempos para formação de crostas completas, perda de vesículas, perda de úlceras e perda de crostas foram menores para os pacientes tratados com FAMVIR 500 mg do que para os pacientes tratados com placebo na população geral do estudo. Os efeitos de FAMVIR 500mg foram maiores quando a terapia foi iniciada dentro de 48 horas do início do exantema; também foi mais profunda em pacientes com 50 anos de idade ou mais. Entre os 65,2% dos pacientes com pelo menos 1 cultura viral positiva, os pacientes tratados com FAMVIR tiveram uma duração mediana de disseminação viral mais curta do que os pacientes tratados com placebo (1 dia e 2 dias, respectivamente).
Não houve diferenças gerais na duração da dor antes da cicatrização da erupção entre os grupos tratados com FAMVIR e placebo. Além disso, não houve diferença na incidência de dor após a cicatrização da erupção (neuralgia pós-herpética) entre os grupos de tratamento. Nos 186 pacientes (44,4% da população total do estudo) que desenvolveram neuralgia pós-herpética, a duração média da neuralgia pós-herpética foi menor nos pacientes tratados com FAMVIR 500 mg do que naqueles tratados com placebo (63 dias e 119 dias, respectivamente). Nenhuma eficácia adicional foi demonstrada com doses mais altas de FAMVIR.
No estudo com controle ativo, 545 pacientes foram tratados com 1 de 3 doses de FAMVIR três vezes ao dia ou com aciclovir 800 mg cinco vezes ao dia. Os tempos até a formação de crostas da lesão completa e os tempos até a perda da dor aguda foram comparáveis para todos os grupos e não houve diferenças estatisticamente significativas no tempo até a perda da neuralgia pós-herpética entre os grupos FAMVIR e tratados com aciclovir.
INFORMAÇÃO DO PACIENTE
FAMVIR® (Fam'-veer) (famciclovir) Comprimidos
Leia estas Informações do Paciente antes de começar a tomar FAMVIR e sempre que receber uma recarga. Pode haver novas informações. Esta informação não substitui a conversa com seu médico sobre sua condição médica ou tratamento.
O que é o FAMVIR?
Famvir é um medicamento antiviral de prescrição usado para:
- tratar surtos de herpes labial (bolhas de febre) em adultos saudáveis
- tratar surtos de herpes genital em adultos saudáveis
- diminuir o número de surtos de herpes genital em adultos saudáveis
- tratar surtos de lesões de herpes simples dentro ou ao redor da boca, genitais e área anal em pessoas infectadas com HIV
- tratar as telhas (herpes zoster) em adultos com sistema imunológico normal
Não se sabe se FAMVIR 500mg é seguro e eficaz em crianças menores de 18 anos.
FAMVIR 250mg não é uma cura para herpes. Não se sabe se o FAMVIR pode impedir a propagação do herpes para outras pessoas. Se você é sexualmente ativo, pode transmitir herpes para seu parceiro, mesmo que esteja tomando FAMVIR. O herpes pode ser transmitido mesmo se você não tiver sintomas ativos. Você deve continuar praticando sexo seguro para diminuir as chances de espalhar herpes genital para outras pessoas. Não tenha contato sexual com seu parceiro durante um surto de herpes genital ou se tiver algum sintoma de herpes genital. Use um preservativo feito de látex ou poliuretano quando tiver um contato sexual. Peça ao seu médico mais informações sobre práticas sexuais mais seguras.
Quem não deve tomar FAMVIR?
Não tome FAMVIR 250mg se você é alérgico a algum de seus componentes ou ao Denavir® (creme de penciclovir). Consulte o final deste folheto de informações ao paciente para obter uma lista completa dos ingredientes do FAMVIR.
O que devo dizer ao meu médico antes de tomar FAMVIR 500mg?
Antes de começar a tomar FAMVIR 500mg, informe o seu médico se você:
- tem problemas renais ou hepáticos
- tem um problema genético raro com intolerância à galactose, deficiência grave de lactase ou não absorve glicose-galactose (má absorção)
- está grávida ou planejando engravidar. Não se sabe se FAMVIR 250mg prejudicará o feto
- Relatórios de exposição à gravidez: A Novartis Pharmaceuticals Corporation coleta relatórios de gravidez que são relatados voluntariamente. Em caso de gravidez, converse com seu médico sobre como relatar sua gravidez
- está amamentando ou planeja amamentar
Informe o seu médico sobre todos os medicamentos que você toma, incluindo medicamentos prescritos e não prescritos, vitaminas e suplementos de ervas. Informe especialmente o seu médico se você tomar:
- quaisquer outros medicamentos e produtos que você usa para tratar surtos de herpes
- probenecida (Probalan)
Conheça os medicamentos que você toma. Mantenha uma lista deles com você para mostrar ao seu médico e farmacêutico sempre que receber um novo medicamento.
Como devo tomar o FAMVIR?
- Tome FAMVIR exatamente como prescrito
- Seu médico lhe dirá quantos FAMVIR tomar e quando tomá-los. A sua dose de FAMVIR 250mg e a frequência com que a toma pode ser diferente dependendo da sua condição
- Famvir pode ser tomado com ou sem alimentos
- É importante que você termine todo o medicamento conforme prescrito, mesmo que comece a se sentir melhor
- Seus sintomas podem continuar mesmo depois de terminar todo o seu FAMVIR. Isso não significa que você precise de mais medicamentos, pois você já terminou um ciclo completo de FAMVIR 500mg e ele continuará a funcionar em seu corpo. Converse com seu médico se tiver alguma dúvida sobre sua condição e seu tratamento
Quais são os possíveis efeitos colaterais do FAMVIR 250mg?
Os efeitos colaterais mais comuns de FAMVIR 500mg incluem:
- dor de cabeça
- náusea
Converse com seu médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do FAMVIR. Peça mais informações ao seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA1088.
Como devo armazenar o FAMVIR 500mg?
- Armazene o FAMVIR em temperatura ambiente entre 15°C e 30°C (59°F e 86°F).
Mantenha FAMVIR e todos os medicamentos fora do alcance das crianças.
Informações gerais sobre o FAMVIR
Às vezes, os medicamentos são prescritos para outros fins que não os listados nos folhetos de informações ao paciente. Não use FAMVIR para uma condição para a qual não foi prescrito. Não dê FAMVIR 500mg a outras pessoas, mesmo que tenham os mesmos sintomas que você. Pode prejudicá-los.
Este folheto resume as informações mais importantes sobre o FAMVIR. Se você quiser mais informações, converse com seu médico. Seu médico ou farmacêutico pode fornecer informações sobre FAMVIR 500mg que são escritas para profissionais de saúde. Para obter mais informações, acesse www.FAMVIR.com ou ligue para 1-888-669-6682.
Quais são os ingredientes do FAMVIR?
Ingrediente ativo: fanciclovir
Ingredientes inativos: hidroxipropilcelulose, hidroxipropilmetilcelulose, lactose, estearato de magnésio, polietilenoglicóis, glicolato de amido sódico e dióxido de titânio
