Levaquin 250mg, 500mg, 750mg Levofloxacin Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Levaquin 750mg e como é usado?
Levaquin é um medicamento de prescrição usado para tratar os sintomas de várias infecções bacterianas. Levaquin pode ser usado sozinho ou com outros medicamentos.
Levaquin 500mg pertence a uma classe de medicamentos chamados Fluoroquinolonas.
Não se sabe se Levaquin é seguro e eficaz em crianças com duração de tratamento superior a 14 dias.
Quais são os possíveis efeitos colaterais do Levaquin 500mg?
Levaquin 750mg pode causar efeitos colaterais graves, incluindo:
- dor de cabeça,
- fome,
- sudorese,
- irritabilidade,
- tontura,
- náusea,
- ritmo cardíaco acelerado,
- sentindo-se ansioso ou trêmulo,
- dormência ou formigamento nas mãos, braços, pernas ou pés,
- fraqueza nos braços, mãos, pernas ou pés,
- dor ardente nos braços, mãos, pernas ou pés,
- alterações graves de humor ou de comportamento,
- nervosismo,
- confusão,
- agitação,
- paranóia,
- alucinações,
- problemas de memória,
- dificuldade de concentração,
- pensamentos de suicídio,
- ruptura do tendão,
- dor repentina,
- inchaço,
- contusões,
- ternura,
- rigidez,
- problemas de movimento,
- um som de estalo ou estalo em qualquer uma de suas articulações,
- dor de estômago severa,
- diarreia aquosa ou sanguinolenta,
- vibrando em seu peito,
- falta de ar,
- erupção cutânea,
- problemas respiratórios,
- convulsões (convulsões),
- fortes dores de cabeça,
- problemas de visão,
- dor atrás de seus olhos,
- dor de estômago superior,
- perda de apetite,
- urina escura,
- fezes cor de barro e
- amarelecimento da pele ou dos olhos (icterícia)
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Levaquin 250mg incluem:
- náusea,
- constipação,
- diarréia,
- dor de cabeça,
- tontura, e
- problemas para dormir
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Levaquin. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
AVISO
REAÇÕES ADVERSAS GRAVES, INCLUINDO TENDINITE, RUPTURA DE TENDÃO, NEUROPATIA PERIFÉRICA, EFEITOS DO SISTEMA NERVOSO CENTRAL E EXACERBAÇÃO DE MIASTENIA GRAVIS
- As fluoroquinolonas, incluindo LEVAQUIN®, foram associadas a reações adversas graves incapacitantes e potencialmente irreversíveis que ocorreram em conjunto [ver ADVERTÊNCIAS E PRECAUÇÕES], incluindo:
- Tendinite e ruptura de tendão [ver ADVERTÊNCIAS E PRECAUÇÕES]
- Neuropatia periférica [ver ADVERTÊNCIAS E PRECAUÇÕES]
- Efeitos no sistema nervoso central [ver ADVERTÊNCIAS E PRECAUÇÕES]
Descontinue LEVAQUIN® imediatamente e evite o uso de fluoroquinolonas, incluindo LEVAQUIN®, em pacientes que apresentarem qualquer uma dessas reações adversas graves [ver ADVERTÊNCIAS E PRECAUÇÕES]
- Fluoroquinolonas, incluindo LEVAQUIN®, podem exacerbar a fraqueza muscular em pacientes com miastenia gravis. Evite LEVAQUIN® em pacientes com história conhecida de miastenia gravis [ver AVISOS E PRECAUÇÕES ].
- Como as fluoroquinolonas, incluindo LEVAQUIN®, foram associadas a reações adversas graves [ver AVISOS E PRECAUÇÕES ], reserve LEVAQUIN® para uso em pacientes que não têm opções alternativas de tratamento para as seguintes indicações:
- Infecção do trato urinário não complicada [ver INDICAÇÕES ]
- Exacerbação bacteriana aguda da bronquite crônica [ver INDICAÇÕES ]
- Sinusite bacteriana aguda [ver INDICAÇÕES ].
DESCRIÇÃO
Os comprimidos LEVAQUIN® são agentes antibacterianos sintéticos para administração oral. Quimicamente, a levofloxacina, uma carboxiquinolona fluorada quiral, é o enantiômero (-)-(S) puro da substância racêmica ofloxacina. O nome químico é (-)-(S)-9-fluoro-2,3-di-hidro-3-metil-10-(4-metil-1-piperazinil)-7-oxo-7H-pirido[1,2, ácido 3-des]-1,4-benzoxazina-6-carboxílico hemi-hidratado.
Figura 1: A Estrutura Química da Levofloxacina
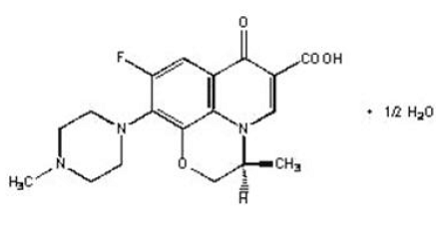
fórmula empírica é C18H20FN3O4 · ½ H2O e o peso molecular é 370,38. A levofloxacina é um cristal ou pó cristalino branco-amarelado claro a branco-amarelado. A molécula existe como um zwitterion nas condições de pH no intestino delgado.
Os dados demonstram que de pH 0,6 a 5,8, a solubilidade da levofloxacina é essencialmente constante (aproximadamente 100 mg/mL). A levofloxacina é considerada solúvel a livremente solúvel nesta faixa de pH, conforme definido pela nomenclatura da USP. Acima de pH 5,8, a solubilidade aumenta rapidamente até seu máximo em pH 6,7 (272 mg/mL) e é considerada livremente solúvel nesta faixa. Acima de pH 6,7, a solubilidade diminui e atinge um valor mínimo (cerca de 50 mg/mL) a um pH de aproximadamente 6,9.
A levofloxacina tem o potencial de formar compostos de coordenação estáveis com muitos íons metálicos. Este potencial de quelação in vitro tem a seguinte ordem de formação: Al+3>Cu+2>Zn+2>Mg+2>Ca+2.
LEVAQUIN® Tablets está disponível na forma de comprimidos revestidos por película e contém os seguintes ingredientes inativos:
- 250 mg (expresso na forma anidra): crospovidona, hipromelose, estearato de magnésio, celulose microcristalina, polietilenoglicol, polissorbato 80, óxido de ferro vermelho sintético e dióxido de titânio.
- 500 mg (expresso na forma anidra): crospovidona, hipromelose, estearato de magnésio, celulose microcristalina, polietilenoglicol, polissorbato 80, óxidos de ferro sintéticos vermelhos e amarelos e dióxido de titânio.
- 750 mg (expresso na forma anidra): crospovidona, hipromelose, estearato de magnésio, celulose microcristalina, polietilenoglicol, polissorbato 80, dióxido de titânio.
INDICAÇÕES
Pneumonia nosocomial
LEVAQUIN® é indicado em pacientes adultos para o tratamento de pneumonia nosocomial por Staphylococcus aureus sensível à meticilina, Pseudomonas aeruginosa, Serratia marcescens, Escherichia coli, Klebsiella pneumoniae, Haemophilus influenzae ou Streptococcus pneumoniae. A terapia adjuvante deve ser usada conforme clinicamente indicado. Quando a Pseudomonas aeruginosa é um patógeno documentado ou presumível, recomenda-se a terapia combinada com um β-lactâmico antipseudomonas [ver Estudos clínicos ].
Pneumonia adquirida na comunidade
Regime de tratamento de 7 a 14 dias
LEVAQUIN® é indicado em pacientes adultos para o tratamento de pneumonia adquirida na comunidade devido a Staphylococcus aureus sensível à meticilina, Streptococcus pneumoniae (incluindo Streptococcus pneumoniae multirresistente [MDRSP]), Haemophilus influenzae, Haemophilus parainfluenzae, Klebsiella pneumoniae, Moraxella catarrhalis , Chlamydophila pneumoniae, Legionella pneumophila ou Mycoplasma pneumoniae [ver DOSAGEM E ADMINISTRAÇÃO e Estudos clínicos ].
Os isolados de MDRSP são isolados resistentes a dois ou mais dos seguintes antibacterianos: penicilina (CIM ≥2 mcg/mL), cefalosporinas de 2ª geração, por exemplo, cefuroxima, macrolídeos, tetraciclinas e trimetoprima/sulfametoxazol.
Pneumonia adquirida na comunidade
Regime de Tratamento de 5 Dias
LEVAQUIN® é indicado em pacientes adultos para o tratamento de pneumonia adquirida na comunidade por Streptococcus pneumoniae (excluindo isolados multirresistentes [MDRSP]), Haemophilus influenzae, Haemophilus parainfluenzae, Mycoplasma pneumoniae ou Chlamydophila pneumoniae [ver DOSAGEM E ADMINISTRAÇÃO e Estudos clínicos ].
Infecções complicadas da pele e da estrutura da pele
LEVAQUIN® é indicado em pacientes adultos para o tratamento de infecções complicadas da pele e estruturas da pele devido a Staphylococcus aureus, Enterococcus faecalis, Streptococcus pyogenes ou Proteus mirabilis suscetível à meticilina [ver Estudos clínicos ].
Infecções não complicadas da pele e da estrutura da pele
LEVAQUIN® é indicado em pacientes adultos para o tratamento de infecções não complicadas da pele e estruturas da pele (leve a moderada), incluindo abscessos, celulite, furúnculos, impetigo, piodermite, infecções de feridas devido a Staphylococcus aureus ou Streptococcus pyogenes sensível à meticilina.
Prostatite Bacteriana Crônica
LEVAQUIN® é indicado em pacientes adultos para o tratamento de prostatite bacteriana crônica por Escherichia coli, Enterococcus faecalis ou Staphylococcus epidermidis sensível à meticilina [ver Estudos clínicos ].
Antraz por inalação (pós-exposição)
LEVAQUIN® é indicado para antraz por inalação (pós-exposição) para reduzir a incidência ou progressão da doença após exposição a Bacillus anthracis aerossolizado em adultos e pacientes pediátricos, com 6 meses de idade ou mais [ver DOSAGEM E ADMINISTRAÇÃO ]. A eficácia do LEVAQUIN® baseia-se nas concentrações plasmáticas alcançadas em humanos, um desfecho substituto razoavelmente provável para prever o benefício clínico.
LEVAQUIN® não foi testado em humanos para prevenção pós-exposição de antraz por inalação. A segurança de LEVAQUIN® em adultos por períodos de terapia superiores a 28 dias ou em pacientes pediátricos por períodos de terapia superiores a 14 dias não foi estudada. A terapia prolongada com LEVAQUIN® deve ser usada apenas quando o benefício supera o risco [ver Estudos clínicos ].
Praga
LEVAQUIN® é indicado para o tratamento da peste, incluindo peste pneumônica e septicêmica, devido à Yersinia pestis (Y. pestis) e profilaxia da peste em adultos e pacientes pediátricos, a partir de 6 meses de idade [ver DOSAGEM E ADMINISTRAÇÃO ].
Os estudos de eficácia do LEVAQUIN® não puderam ser conduzidos em humanos com peste por razões éticas e de viabilidade. Portanto, a aprovação desta indicação foi baseada em um estudo de eficácia realizado em animais [ver Estudos clínicos ].
Infecções complicadas do trato urinário
Regime de Tratamento de 5 Dias
LEVAQUIN® é indicado em pacientes adultos para o tratamento de infecções complicadas do trato urinário causadas por Escherichia coli, Klebsiella pneumoniae ou Proteus mirabilis [ver Estudos clínicos ].
Infecções complicadas do trato urinário
Regime de Tratamento de 10 Dias
LEVAQUIN® é indicado em pacientes adultos para o tratamento de infecções complicadas do trato urinário (leve a moderada) causadas por Enterococcus faecalis, Enterobacter cloacae, Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis ou Pseudomonas aeruginosa [ver Estudos clínicos ].
Pielonefrite aguda
Regime de tratamento de 5 ou 10 dias
LEVAQUIN® é indicado em pacientes adultos para o tratamento de pielonefrite aguda causada por Escherichia coli, incluindo casos com bacteremia concomitante [ver Estudos clínicos ].
Infecções não complicadas do trato urinário
LEVAQUIN® é indicado em pacientes adultos para o tratamento de infecções não complicadas do trato urinário (leve a moderada) causadas por Escherichia coli, Klebsiella pneumoniae ou Staphylococcus saprophyticus.
Como as fluoroquinolonas, incluindo LEVAQUIN®, foram associadas a reações adversas graves [ver AVISOS E PRECAUÇÕES e para alguns pacientes a infecção não complicada do trato urinário é autolimitada, reserve LEVAQUIN® para o tratamento de infecções não complicadas do trato urinário em pacientes que não têm opções alternativas de tratamento.
Exacerbação Bacteriana Aguda da Bronquite Crônica
LEVAQUIN® é indicado em pacientes adultos para o tratamento da exacerbação bacteriana aguda da bronquite crônica (ABECB) devido a Staphylococcus aureus, Streptococcus pneumoniae, Haemophilus influenzae, Haemophilus parainfluenzae ou Moraxella catarrhalis suscetível à meticilina.
Como as fluoroquinolonas, incluindo LEVAQUIN®, foram associadas a reações adversas graves [ver AVISOS E PRECAUÇÕES ] e para alguns pacientes o ABECB é autolimitado, reserve LEVAQUIN® para o tratamento do ABECB em pacientes que não têm opções alternativas de tratamento.
Sinusite Bacteriana Aguda
Regimes de tratamento de 5 dias e 10 a 14 dias
LEVAQUIN® é indicado em pacientes adultos para o tratamento de sinusite bacteriana aguda (SAB) por Streptococcus pneumoniae, Haemophilus influenzae ou Moraxella catarrhalis [ver Estudos clínicos ].
Como as fluoroquinolonas, incluindo LEVAQUIN®, foram associadas a reações adversas graves [ver AVISOS E PRECAUÇÕES e para alguns pacientes o ABS é autolimitado, reserve LEVAQUIN® para o tratamento do ABS em pacientes que não têm opções alternativas de tratamento.
Uso
Para reduzir o desenvolvimento de bactérias resistentes a medicamentos e manter a eficácia de LEVAQUIN® e outros medicamentos antibacterianos, LEVAQUIN® deve ser usado apenas para tratar ou prevenir infecções comprovadamente ou fortemente suspeitas de serem causadas por bactérias suscetíveis. Quando as informações de cultura e suscetibilidade estiverem disponíveis, elas devem ser consideradas na seleção ou modificação da terapia antibacteriana. Na ausência de tais dados, a epidemiologia local e os padrões de suscetibilidade podem contribuir para a seleção empírica da terapia.
Teste de cultura e suscetibilidade
Cultura apropriada e testes de suscetibilidade devem ser realizados antes do tratamento para isolar e identificar os organismos causadores da infecção e determinar sua suscetibilidade à levofloxacina. Microbiologia ]. A terapia com LEVAQUIN® pode ser iniciada antes que os resultados desses testes sejam conhecidos; uma vez que os resultados estejam disponíveis, a terapia apropriada deve ser selecionada.
Assim como outras drogas desta classe, alguns isolados de Pseudomonas aeruginosa podem desenvolver resistência rapidamente durante o tratamento com LEVAQUIN®. A cultura e os testes de suscetibilidade realizados periodicamente durante a terapia fornecerão informações sobre a suscetibilidade contínua dos patógenos ao agente antimicrobiano e também o possível surgimento de resistência bacteriana.
DOSAGEM E ADMINISTRAÇÃO
Dosagem de comprimidos LEVAQUIN® em pacientes adultos com depuração de creatinina ≥ 50 mL/minuto
A dose usual de LEVAQUIN® Comprimidos é de 250 mg, 500 mg ou 750 mg administrados por via oral a cada 24 horas, conforme indicado pela infecção e descrito na Tabela 1.
Essas recomendações se aplicam a pacientes com clearance de creatinina ≥ 50 mL/minuto. Para pacientes com depuração de creatinina inferior a 50 mL/min, são necessários ajustes no regime de dosagem [ver Ajuste de Dosagem em Adultos com Insuficiência Renal ].
Dosagem de comprimidos LEVAQUIN® em pacientes pediátricos com antraz inalatório ou peste
A dosagem de LEVAQUIN® Comprimidos para antraz inalatório (pós-exposição) e peste em pacientes pediátricos com peso igual ou superior a 30 kg está descrita abaixo na Tabela 2. LEVAQUIN® Comprimidos não pode ser administrado a pacientes com peso inferior a 30 kg devido às limitações da força disponível. Formulações alternativas de levofloxacina podem ser consideradas para pacientes pediátricos com peso inferior a 30 kg.
Ajuste de Dosagem em Adultos com Insuficiência Renal
Administrar LEVAQUIN® com cautela em pacientes com insuficiência renal. Observação clínica cuidadosa e estudos laboratoriais apropriados devem ser realizados antes e durante a terapia, pois a eliminação da levofloxacina pode ser reduzida nesses pacientes.
Em pacientes com insuficiência renal (clearance de creatinina inferior a 50 mL/min), é necessário ajustar o regime posológico para evitar o acúmulo de levofloxacino devido à diminuição da depuração. Uso em populações específicas ]. Nenhum ajuste é necessário para pacientes com depuração de creatinina maior ou igual a 50 mL/minuto.
A Tabela 3 mostra como ajustar a dose com base na depuração de creatinina.
Interação Medicamentosa Com Agentes Quelantes
Antiácidos, Sucralfato, Cátions Metálicos, Multivitaminas
Os comprimidos de LEVAQUIN® devem ser administrados pelo menos duas horas antes ou duas horas depois de antiácidos contendo magnésio, alumínio, bem como sucralfato, cátions metálicos como ferro e preparações multivitamínicas com comprimidos mastigáveis/tamponados de zinco ou didanosina ou o pó pediátrico para solução oral [Vejo INTERAÇÕES MEDICAMENTOSAS e INFORMAÇÃO DO PACIENTE ].
Instruções de administração
LEVAQUIN® Comprimidos pode ser administrado independentemente da alimentação.
Hidratação Para Pacientes Recebendo Comprimidos LEVAQUIN®
A hidratação adequada de pacientes recebendo LEVAQUIN® deve ser mantida para evitar a formação de urina altamente concentrada. Cristalúria e cilindrúria foram relatadas com quinolonas [ver REAÇÕES ADVERSAS e INFORMAÇÃO DO PACIENTE ].
COMO FORNECIDO
Formas de dosagem e pontos fortes
COMPRIMIDOS, revestidos por película, em forma de cápsula
- Comprimidos cor de terracota de 250 mg, impressos com "250" de um lado e "LEVAQUIN" do outro lado
- Comprimidos de 500 mg de pêssego, impressos com "500" de um lado e "LEVAQUIN" do outro lado
- Comprimidos brancos de 750 mg, impressos com "750" de um lado e "LEVAQUIN" do outro lado
Armazenamento e manuseio
Os comprimidos LEVAQUIN® são fornecidos em comprimidos revestidos em forma de cápsula de 250, 500 e 750 mg.
LEVAQUIN® Comprimidos são embalados em garrafas nas seguintes configurações:
- Os comprimidos de 250 mg são cor-de-rosa terracota e estão impressos: "LEVAQUIN®" de um lado e "250" do outro lado
- garrafas de 50 ( NDC 50458-920-50)
- Os comprimidos de 500 mg são pêssego e estão impressos: "LEVAQUIN®" de um lado e "500" do outro lado
- garrafas de 50 ( NDC 50458-925-50)
- Os comprimidos de 750 mg são brancos e estão impressos "LEVAQUIN®" de um lado e "750" do outro lado
- garrafas de 20 ( NDC 50458-930-20)
Os comprimidos LEVAQUIN® devem ser armazenados de 15° a 30°C (59° a 86°F) em recipientes bem fechados.
Fabricado por: Ingrediente Ativo Fabricado no Japão. Revisado: julho de 2018
EFEITOS COLATERAIS
Reações adversas graves e importantes
As seguintes reações adversas graves e importantes a medicamentos são discutidas em mais detalhes em outras seções da rotulagem:
- Reações adversas graves incapacitantes e potencialmente irreversíveis [consulte AVISOS E PRECAUÇÕES ]
- Tendinite e Ruptura de Tendão [ver AVISOS E PRECAUÇÕES ]
- Neuropatia periférica [ver AVISOS E PRECAUÇÕES ]
- Efeitos do Sistema Nervoso Central [ver AVISOS E PRECAUÇÕES ]
- Exacerbação da Miastenia Gravis [ver AVISOS E PRECAUÇÕES ]
- Outras reações graves e às vezes fatais [ver AVISOS E PRECAUÇÕES ]
- Reações de hipersensibilidade [ver AVISOS E PRECAUÇÕES ]
- Hepatotoxicidade [ver AVISOS E PRECAUÇÕES ]
- Diarreia Associada a Clostridium difficile [ver AVISOS E PRECAUÇÕES ]
- Prolongamento do intervalo QT [ver AVISOS E PRECAUÇÕES ]
- Distúrbios musculoesqueléticos em pacientes pediátricos [ver AVISOS E PRECAUÇÕES ]
- Distúrbios da Glicose no Sangue [ver AVISOS E PRECAUÇÕES ]
- Fotossensibilidade/fototoxicidade [ver AVISOS E PRECAUÇÕES ]
- Desenvolvimento de Bactérias Resistentes a Medicamentos [ver AVISOS E PRECAUÇÕES ]
Cristalúria e cilindrúria foram relatadas com quinolonas, incluindo LEVAQUIN®. Portanto, a hidratação adequada de pacientes recebendo LEVAQUIN® deve ser mantida para evitar a formação de urina altamente concentrada [ver DOSAGEM E ADMINISTRAÇÃO ].
Experiência de Ensaio Clínico
Como os ensaios clínicos são conduzidos em condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparadas às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
Os dados descritos abaixo refletem a exposição ao LEVAQUIN® em 7.537 pacientes em 29 ensaios clínicos de Fase 3 agrupados. A população estudada tinha idade média de 50 anos (aproximadamente 74% da população tinha INDICAÇÕES ]. Os pacientes receberam doses de LEVAQUIN® de 750 mg uma vez ao dia, 250 mg uma vez ao dia ou 500 mg uma ou duas vezes ao dia.
A duração do tratamento foi geralmente de 3 a 14 dias, e o número médio de dias em terapia foi de 10 dias.
A incidência geral, tipo e distribuição de reações adversas foi semelhante em pacientes que receberam doses de LEVAQUIN® de 750 mg uma vez ao dia, 250 mg uma vez ao dia e 500 mg uma ou duas vezes ao dia.
descontinuação de LEVAQUIN® devido a reações adversas ao medicamento ocorreu em 4,3% dos pacientes em geral, 3,8% dos pacientes tratados com as doses de 250 mg e 500 mg e 5,4% dos pacientes tratados com a dose de 750 mg. As reações adversas medicamentosas mais comuns que levaram à descontinuação com as doses de 250 e 500 mg foram gastrointestinais (1,4%), principalmente náuseas (0,6%); vômitos (0,4%); tontura (0,3%); e cefaleia (0,2%). As reações adversas medicamentosas mais comuns que levaram à descontinuação da dose de 750 mg foram gastrointestinais (1,2%), principalmente náuseas (0,6%), vômitos (0,5%); tontura (0,3%); e cefaleia (0,3%).
As reações adversas que ocorrem em ≥1% dos pacientes tratados com LEVAQUIN® e reações adversas menos comuns, ocorrendo em 0,1 a
Em ensaios clínicos usando terapia de dose múltipla, anormalidades oftalmológicas, incluindo catarata e opacidades lenticulares múltiplas, foram observadas em pacientes submetidos a tratamento com quinolonas, incluindo LEVAQUIN®. A relação dos medicamentos com esses eventos não está estabelecida atualmente.
Experiência pós-marketing
A Tabela 6 lista as reações adversas que foram identificadas durante o uso pós-aprovação de LEVAQUIN®. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento.
INTERAÇÕES MEDICAMENTOSAS
Agentes de quelação
Antiácidos, Sucralfato, Cátions Metálicos, Multivitaminas
Embora a quelação por cátions bivalentes seja menos acentuada do que com outras fluoroquinolonas, a administração concomitante de LEVAQUIN® Comprimidos com antiácidos contendo magnésio ou alumínio, bem como sucralfato, cátions metálicos como ferro e preparações multivitamínicas com zinco podem interferir na absorção gastrointestinal de levofloxacina, resultando em níveis sistêmicos consideravelmente abaixo do desejado. Comprimidos com antiácidos contendo magnésio, alumínio, bem como sucralfato, cátions metálicos como ferro e preparações multivitamínicas com zinco ou didanosina podem interferir substancialmente na absorção gastrointestinal da levofloxacina, resultando em níveis sistêmicos consideravelmente abaixo do desejado. Esses agentes devem ser tomados pelo menos duas horas antes ou duas horas após a administração oral de LEVAQUIN®.
Varfarina
Nenhum efeito significativo de LEVAQUIN® nas concentrações plasmáticas máximas, AUC e outros parâmetros de disposição para R- e S-varfarina foi detectado em um estudo clínico envolvendo voluntários saudáveis. Da mesma forma, nenhum efeito aparente da varfarina na absorção e eliminação da levofloxacina foi observado. No entanto, houve relatos durante a experiência pós-comercialização em pacientes de que LEVAQUIN® potencializa os efeitos da varfarina. Elevações do tempo de protrombina no contexto de uso concomitante de varfarina e LEVAQUIN® têm sido associadas a episódios de sangramento. O tempo de protrombina, a razão normalizada internacional (INR) ou outros testes de anticoagulação adequados devem ser monitorados de perto se LEVAQUIN® for administrado concomitantemente com varfarina. Os pacientes também devem ser monitorados para evidência de sangramento [ver REAÇÕES ADVERSAS e INFORMAÇÃO DO PACIENTE ].
Agentes Antidiabéticos
Distúrbios da glicemia, incluindo hiperglicemia e hipoglicemia, foram relatados em pacientes tratados concomitantemente com fluoroquinolonas e um agente antidiabético. Portanto, o monitoramento cuidadoso da glicemia é recomendado quando esses agentes são coadministrados [ver AVISOS E PRECAUÇÕES , REAÇÕES ADVERSAS , e INFORMAÇÃO DO PACIENTE ].
Medicamentos anti-inflamatórios não esteroides
A administração concomitante de um anti-inflamatório não esteroidal com uma fluoroquinolona, incluindo LEVAQUIN®, pode aumentar o risco de estimulação do SNC e convulsões [ver AVISOS E PRECAUÇÕES ].
Teofilina
Nenhum efeito significativo de LEVAQUIN® nas concentrações plasmáticas, AUC e outros parâmetros de disposição da teofilina foi detectado em um estudo clínico envolvendo voluntários saudáveis. Da mesma forma, nenhum efeito aparente da teofilina na absorção e eliminação da levofloxacina foi observado. No entanto, a administração concomitante de outras fluoroquinolonas com teofilina resultou em meia-vida de eliminação prolongada, níveis séricos elevados de teofilina e um aumento subsequente no risco de reações adversas relacionadas à teofilina na população de pacientes. Portanto, os níveis de teofilina devem ser monitorados de perto e ajustes de dosagem apropriados devem ser feitos quando LEVAQUIN® é coadministrado. Reações adversas, incluindo convulsões, podem ocorrer com ou sem elevação dos níveis séricos de teofilina [ver AVISOS E PRECAUÇÕES ].
Ciclosporina
Nenhum efeito significativo de LEVAQUIN® nas concentrações plasmáticas máximas, AUC e outros parâmetros de disposição da ciclosporina foi detectado em um estudo clínico envolvendo voluntários saudáveis. No entanto, níveis séricos elevados de ciclosporina foram relatados na população de pacientes quando coadministrados com algumas outras fluoroquinolonas. A Cmax e ke da levofloxacina foram ligeiramente mais baixas, enquanto a Tmax e t1/2 foram ligeiramente mais longas na presença de ciclosporina do que as observadas em outros estudos sem medicação concomitante. As diferenças, no entanto, não são consideradas clinicamente significativas. Portanto, não é necessário ajuste de dose para LEVAQUIN® ou ciclosporina quando administrados concomitantemente.
Digoxina
Nenhum efeito significativo de LEVAQUIN® nas concentrações plasmáticas máximas, AUC e outros parâmetros de disposição para digoxina foi detectado em um estudo clínico envolvendo voluntários saudáveis. A cinética de absorção e eliminação de levofloxacina foi semelhante na presença ou ausência de digoxina. Portanto, não é necessário ajuste de dose para LEVAQUIN® ou digoxina quando administrados concomitantemente.
Probenecida e Cimetidina
Não foi observado efeito significativo da probenecida ou da cimetidina na Cmax da levofloxacina em um estudo clínico envolvendo voluntários saudáveis. A AUC e t1/2 da levofloxacina foram maiores enquanto CL/F e CLR foram menores durante o tratamento concomitante de LEVAQUIN® com probenecida ou cimetidina em comparação com LEVAQUIN® sozinho. No entanto, essas alterações não justificam o ajuste da dose de LEVAQUIN® quando probenecida ou cimetidina são coadministrados.
Interações com testes laboratoriais ou diagnósticos
Algumas fluoroquinolonas, incluindo LEVAQUIN®, podem produzir resultados falso-positivos de triagem de urina para opiáceos usando kits de imunoensaio disponíveis comercialmente. A confirmação de rastreios de opiáceos positivos por métodos mais específicos pode ser necessária.
AVISOS
Incluído como parte do "PRECAUÇÕES" Seção
PRECAUÇÕES
Reações adversas graves incapacitantes e potencialmente irreversíveis, incluindo tendinite e ruptura de tendão, neuropatia periférica e efeitos no sistema nervoso central
As fluoroquinolonas, incluindo LEVAQUIN®, têm sido associadas a reações adversas graves incapacitantes e potencialmente irreversíveis de diferentes sistemas corporais que podem ocorrer em conjunto no mesmo paciente. As reações adversas comumente observadas incluem tendinite, ruptura de tendão, artralgia, mialgia, neuropatia periférica e efeitos no sistema nervoso central (alucinações, ansiedade, depressão, insônia, fortes dores de cabeça e confusão). Essas reações podem ocorrer dentro de horas a semanas após o início do LEVAQUIN®. Pacientes de qualquer idade ou sem fatores de risco pré-existentes apresentaram essas reações adversas [ver Tendinite e ruptura de tendão, neuropatia periférica, efeitos no sistema nervoso central ].
Descontinue LEVAQUIN® imediatamente aos primeiros sinais ou sintomas de qualquer reação adversa grave. Além disso, evite o uso de fluoroquinolonas, incluindo LEVAQUIN®, em pacientes que sofreram alguma dessas reações adversas graves associadas às fluoroquinolonas.
Tendinite e Ruptura de Tendão
As fluoroquinolonas, incluindo LEVAQUIN®, têm sido associadas a um risco aumentado de tendinite e ruptura de tendão em todas as idades [ver Reações adversas graves incapacitantes e potencialmente irreversíveis, incluindo tendinite e ruptura de tendão, neuropatia periférica e efeitos no sistema nervoso central e REAÇÕES ADVERSAS ]. Essa reação adversa envolve mais frequentemente o tendão de Aquiles e também foi relatada com o manguito rotador (ombro), a mão, o bíceps, o polegar e outros locais do tendão. Tendinite ou ruptura de tendão podem ocorrer horas ou dias após o início do LEVAQUIN® ou até vários meses após a conclusão da terapia com fluoroquinolonas. Tendinite e ruptura de tendão podem ocorrer bilateralmente.
risco de desenvolver tendinite associada à fluoroquinolona e ruptura de tendão é maior em pacientes com mais de 60 anos de idade, naqueles em uso de corticosteróides e em pacientes com transplante de rim, coração ou pulmão. Outros fatores que podem aumentar independentemente o risco de ruptura do tendão incluem atividade física extenuante, insuficiência renal e distúrbios anteriores do tendão, como artrite reumatóide. Tendinite e ruptura de tendão foram relatadas em pacientes tomando fluoroquinolonas que não apresentam os fatores de risco acima. Descontinue LEVAQUIN® imediatamente se o paciente sentir dor, inchaço, inflamação ou ruptura de um tendão. Os pacientes devem ser aconselhados a descansar ao primeiro sinal de tendinite ou ruptura de tendão e a entrar em contato com seu médico sobre a mudança para um antimicrobiano não quinolona. Evite LEVAQUIN® em pacientes com histórico de distúrbios do tendão ou ruptura do tendão [ver REAÇÕES ADVERSAS e INFORMAÇÃO DO PACIENTE ].
Neuropatia periférica
As fluoroquinolonas, incluindo LEVAQUIN®, foram associadas a um risco aumentado de neuropatia periférica. Casos de polineuropatia axonal sensitiva ou sensório-motora afetando axônios pequenos e/ou grandes resultando em parestesias, hipoestesias, disestesias e fraqueza foram relatados em pacientes recebendo fluoroquinolonas, incluindo LEVAQUIN®. Os sintomas podem ocorrer logo após o início de LEVAQUIN® e podem ser irreversíveis em alguns pacientes [ver Reações adversas graves incapacitantes e potencialmente irreversíveis, incluindo tendinite e ruptura de tendão, neuropatia periférica e efeitos no sistema nervoso central e REAÇÕES ADVERSAS ].
Descontinue LEVAQUIN® imediatamente se o paciente apresentar sintomas de neuropatia, incluindo dor, queimação, formigamento, dormência e/ou fraqueza ou outras alterações de sensação, incluindo toque leve, dor, temperatura, sensação de posição e sensação vibratória. Evite fluoroquinolonas, incluindo LEVAQUIN®, em pacientes que já apresentaram neuropatia periférica [ver REAÇÕES ADVERSAS e INFORMAÇÃO DO PACIENTE ].
Efeitos do sistema nervoso central
As fluoroquinolonas, incluindo LEVAQUIN®, foram associadas a um risco aumentado de efeitos no sistema nervoso central (SNC), incluindo convulsões, psicoses tóxicas, aumento da pressão intracraniana (incluindo pseudotumor cerebral). As fluoroquinolonas também podem causar estimulação do sistema nervoso central, o que pode levar a tremores, inquietação, ansiedade, tontura, confusão, alucinações, paranóia, depressão, pesadelos e insônia. Pensamentos suicidas e tentativa ou suicídio consumado também podem ocorrer, especialmente em pacientes com histórico médico de depressão ou um fator de risco subjacente para depressão. Estas reações podem ocorrer após a primeira dose. Se essas reações ocorrerem em pacientes recebendo LEVAQUIN®, descontinuar LEVAQUIN® e instituir medidas apropriadas. Assim como com outras fluoroquinolonas, LEVAQUIN® deve ser usado com cautela em pacientes com distúrbio conhecido ou suspeito do sistema nervoso central (SNC) que possa predispô-los a convulsões ou diminuir o limiar convulsivo (por exemplo, arteriosclerose cerebral grave, epilepsia) ou na presença de outros fatores de risco que podem predispô-los a convulsões ou diminuir o limiar convulsivo (por exemplo, certas terapias medicamentosas, disfunção renal). [Vejo REAÇÕES ADVERSAS , INTERAÇÕES MEDICAMENTOSAS , e INFORMAÇÃO DO PACIENTE ].
Exacerbação da Miastenia Gravis
Fluoroquinolonas, incluindo LEVAQUIN®, têm atividade de bloqueio neuromuscular e podem exacerbar a fraqueza muscular em pacientes com miastenia gravis. Reações adversas graves pós-comercialização, incluindo mortes e necessidade de suporte ventilatório, foram associadas ao uso de fluoroquinolonas em pacientes com miastenia gravis. Evite LEVAQUIN® em pacientes com história conhecida de miastenia gravis [ver REAÇÕES ADVERSAS e INFORMAÇÃO DO PACIENTE ].
Outras reações adversas graves e às vezes fatais
Outras reações adversas graves e algumas vezes fatais, algumas por hipersensibilidade e outras por etiologia incerta, foram raramente relatadas em pacientes recebendo terapia com fluoroquinolonas, incluindo LEVAQUIN®. Esses eventos podem ser graves e geralmente ocorrem após a administração de doses múltiplas. As manifestações clínicas podem incluir um ou mais dos seguintes:
- febre, erupção cutânea ou reações dermatológicas graves (por exemplo, necrólise epidérmica tóxica, síndrome de Stevens-Johnson);
- vasculite; artralgia; mialgia; doença do soro;
- pneumonite alérgica;
- nefrite intersticial; insuficiência ou insuficiência renal aguda;
- hepatite; icterícia; necrose ou falência hepática aguda;
- anemia, incluindo hemolítica e aplástica; trombocitopenia, incluindo púrpura trombocitopênica trombótica; leucopenia; agranulocitose; pancitopenia; e/ou outras anormalidades hematológicas.
Descontinuar LEVAQUIN® imediatamente ao primeiro aparecimento de erupção cutânea, icterícia ou qualquer outro sinal de hipersensibilidade e instituir medidas de suporte [ver REAÇÕES ADVERSAS e INFORMAÇÃO DO PACIENTE ].
Reações de hipersensibilidade
Hipersensibilidade grave e ocasionalmente fatal e/ou reações anafiláticas foram relatadas em pacientes recebendo terapia com fluoroquinolonas, incluindo LEVAQUIN®. Estas reações ocorrem frequentemente após a primeira dose. Algumas reações foram acompanhadas por colapso cardiovascular, hipotensão/choque, convulsão, perda de consciência, formigamento, angioedema (incluindo língua, laringe, garganta ou edema/inchaço facial), obstrução das vias aéreas (incluindo broncoespasmo, falta de ar e desconforto), dispneia, urticária, prurido e outras reações cutâneas graves. LEVAQUIN® deve ser descontinuado imediatamente ao primeiro aparecimento de erupção cutânea ou qualquer outro sinal de hipersensibilidade. Reações graves de hipersensibilidade aguda podem exigir tratamento com epinefrina e outras medidas de ressuscitação, incluindo oxigênio, fluidos intravenosos, anti-histamínicos, corticosteroides, aminas pressoras e manejo das vias aéreas, conforme clinicamente indicado [ver REAÇÕES ADVERSAS e INFORMAÇÃO DO PACIENTE ].
Hepatotoxicidade
Relatos pós-comercialização de hepatotoxicidade grave (incluindo hepatite aguda e eventos fatais) foram recebidos para pacientes tratados com LEVAQUIN®. Nenhuma evidência de hepatotoxicidade grave associada à droga foi detectada em ensaios clínicos de mais de 7.000 pacientes. A hepatotoxicidade grave geralmente ocorreu dentro de 14 dias após o início da terapia e a maioria dos casos ocorreu dentro de 6 dias. A maioria dos casos de hepatotoxicidade grave não foi associada à hipersensibilidade [ver Outras reações adversas graves e às vezes fatais ].
A maioria dos relatos de hepatotoxicidade fatal ocorreu em pacientes com 65 anos de idade ou mais e a maioria não estava associada à hipersensibilidade. LEVAQUIN® deve ser descontinuado imediatamente se o paciente desenvolver sinais e sintomas de hepatite [ver REAÇÕES ADVERSAS e INFORMAÇÃO DO PACIENTE ].
Diarreia Associada ao Clostridium Difficile
Diarreia associada ao Clostridium difficile (CDAD) foi relatada com o uso de quase todos os agentes antibacterianos, incluindo LEVAQUIN®, e pode variar em gravidade de diarreia leve a colite fatal. O tratamento com agentes antibacterianos altera a flora normal do cólon levando ao crescimento excessivo de C. difficile.
C. difficile produz toxinas A e B que contribuem para o desenvolvimento de CDAD. Cepas produtoras de hipertoxina de C. difficile causam aumento da morbidade e mortalidade, pois essas infecções podem ser refratárias à terapia antimicrobiana e podem exigir colectomia. CDAD deve ser considerado em todos os pacientes que apresentam diarreia após o uso de antibióticos. É necessário um histórico médico cuidadoso, pois foi relatado que a CDAD ocorre mais de dois meses após a administração de agentes antibacterianos.
Se houver suspeita ou confirmação de CDAD, o uso contínuo de antibióticos não direcionados contra C. difficile pode precisar ser descontinuado. O manejo adequado de fluidos e eletrólitos, suplementação proteica, tratamento antibiótico de C. difficile e avaliação cirúrgica devem ser instituídos conforme clinicamente indicado [ver REAÇÕES ADVERSAS e INFORMAÇÃO DO PACIENTE ].
Prolongamento do intervalo QT
Algumas fluoroquinolonas, incluindo LEVAQUIN®, foram associadas ao prolongamento do intervalo QT no eletrocardiograma e a casos infrequentes de arritmia. Casos raros de torsade de pointes foram relatados espontaneamente durante a vigilância pós-comercialização em pacientes recebendo fluoroquinolonas, incluindo LEVAQUIN®. LEVAQUIN® deve ser evitado em pacientes com prolongamento conhecido do intervalo QT, pacientes com hipocalemia não corrigida e pacientes recebendo agentes antiarrítmicos Classe IA (quinidina, procainamida) ou Classe III (amiodarona, sotalol). Pacientes idosos podem ser mais suscetíveis aos efeitos associados ao medicamento no intervalo QT [ver REAÇÕES ADVERSAS , Uso em populações específicas , e INFORMAÇÃO DO PACIENTE ].
Distúrbios musculoesqueléticos em pacientes pediátricos e efeitos artropáticos em animais
LEVAQUIN® é indicado em pacientes pediátricos (6 meses de idade ou mais) apenas para a prevenção de antraz inalatório (pós-exposição) e para peste [ver INDICAÇÕES ]. Uma incidência aumentada de distúrbios musculoesqueléticos (artralgia, artrite, tendinopatia e anormalidade da marcha) em comparação com os controles foi observada em pacientes pediátricos recebendo LEVAQUIN® [ver Uso em populações específicas ].
Em ratos e cães imaturos, a administração oral e intravenosa de levofloxacina resultou em aumento da osteocondrose. O exame histopatológico das articulações de sustentação de peso de cães imaturos tratados com levofloxacina revelou lesões persistentes da cartilagem. Outras fluoroquinolonas também produzem erosões semelhantes nas articulações de sustentação de peso e outros sinais de artropatia em animais imaturos de várias espécies. Farmacologia Animal ].
Distúrbios da glicose no sangue
Assim como com outras fluoroquinolonas, distúrbios da glicemia, incluindo hiper e hipoglicemia sintomática, foram relatados com LEVAQUIN®, geralmente em pacientes diabéticos recebendo tratamento concomitante com um agente hipoglicemiante oral (por exemplo, gliburida) ou com insulina. Nestes doentes, recomenda-se a monitorização cuidadosa da glicemia. Se ocorrer uma reação hipoglicêmica em um paciente em tratamento com LEVAQUIN®, LEVAQUIN® deve ser descontinuado e a terapia apropriada deve ser iniciada imediatamente [ver REAÇÕES ADVERSAS , INTERAÇÕES MEDICAMENTOSAS e INFORMAÇÃO DO PACIENTE ].
Fotossensibilidade/Fototoxicidade
Reações de fotossensibilidade/fototoxicidade moderadas a graves, a última das quais pode se manifestar como reações exageradas de queimadura solar (por exemplo, queimação, eritema, exsudação, vesículas, bolhas, edema) envolvendo áreas expostas à luz (tipicamente a face, área em "V" do pescoço , superfícies extensoras dos antebraços, dorso das mãos), pode ser associada ao uso de fluoroquinolonas após exposição ao sol ou à luz UV. Portanto, a exposição excessiva a essas fontes de luz deve ser evitada. A terapia medicamentosa deve ser descontinuada se ocorrer fotossensibilidade/fototoxicidade [ver REAÇÕES ADVERSAS e INFORMAÇÃO DO PACIENTE ].
Desenvolvimento de bactérias resistentes a drogas
A prescrição de LEVAQUIN® na ausência de infecção bacteriana comprovada ou fortemente suspeita ou indicação profilática provavelmente não trará benefícios ao paciente e aumenta o risco de desenvolvimento de bactérias resistentes aos medicamentos [ver INFORMAÇÃO DO PACIENTE ].
Informações de Aconselhamento do Paciente
Aconselhe o paciente a ler o rótulo do paciente aprovado pela FDA ( Guia de Medicação ).
Reações Adversas Graves
Aconselhe os pacientes a parar de tomar LEVAQUIN® se apresentarem uma reação adversa e a ligar para seu médico para aconselhamento sobre a conclusão do tratamento completo com outro medicamento antibacteriano.
Informe os pacientes sobre as seguintes reações adversas graves que foram associadas ao uso de LEVAQUIN® ou outras fluoroquinolonas:
- Reações adversas graves incapacitantes e potencialmente irreversíveis que podem ocorrer juntas: Informe os pacientes que reações adversas graves incapacitantes e potencialmente irreversíveis, incluindo tendinite e ruptura de tendão, neuropatias periféricas e efeitos no sistema nervoso central, foram associadas ao uso de LEVAQUIN® e podem ocorrer juntas no mesmo paciente. Informe os pacientes para parar de tomar LEVAQUIN® imediatamente se apresentarem uma reação adversa e ligar para o seu médico.
- Tendinite e Ruptura de Tendão: Instrua os pacientes a entrar em contato com seu médico se sentirem dor, inchaço ou inflamação de um tendão, ou fraqueza ou incapacidade de usar uma de suas articulações; descansar e abster-se de exercícios; e descontinuar o tratamento LEVAQUIN®. Os sintomas podem ser irreversíveis. O risco de doença grave do tendão com fluoroquinolonas é maior em pacientes mais velhos, geralmente com mais de 60 anos de idade, em pacientes em uso de corticosteróides e em pacientes com transplantes de rim, coração ou pulmão.
- Neuropatias Periféricas: Informe os pacientes que neuropatias periféricas foram associadas ao uso de levofloxacino, os sintomas podem ocorrer logo após o início da terapia e podem ser irreversíveis. Se surgirem sintomas de neuropatia periférica, incluindo dor, queimação, formigamento, dormência e/ou fraqueza, interrompa imediatamente LEVAQUIN® e diga-lhes para entrar em contato com seu médico.
- Efeitos do sistema nervoso central (por exemplo, convulsões, tonturas, vertigens, aumento da pressão intracraniana): Informe os pacientes que convulsões foram relatadas em pacientes recebendo fluoroquinolonas, incluindo levofloxacina. Instrua os pacientes a notificar seu médico antes de tomar este medicamento se tiverem histórico de convulsões. Informe aos pacientes que eles devem saber como reagem ao LEVAQUIN® antes de operar um automóvel ou máquina ou se envolver em outras atividades que exijam agilidade mental e coordenação. Instrua os pacientes a notificar seu médico se ocorrer dor de cabeça persistente com ou sem visão turva.
- Exacerbação da Miastenia Gravis: Instrua os pacientes a informar seu médico sobre qualquer história de miastenia gravis. Instrua os pacientes a notificarem seu médico se apresentarem quaisquer sintomas de fraqueza muscular, incluindo dificuldades respiratórias.
- Reações de hipersensibilidade: Informar os pacientes que a levofloxacina pode causar reações de hipersensibilidade, mesmo após uma dose única, e descontinuar o medicamento ao primeiro sinal de erupção cutânea, urticária ou outras reações cutâneas, batimentos cardíacos acelerados, dificuldade em engolir ou respirar, qualquer inchaço sugestivo de angioedema. por exemplo, inchaço dos lábios, língua, face, aperto na garganta, rouquidão) ou outros sintomas de uma reação alérgica.
- Hepatotoxicidade: Informe os pacientes que hepatotoxicidade grave (incluindo hepatite aguda e eventos fatais) foi relatada em pacientes tomando LEVAQUIN®. Instrua os pacientes a informar seu médico se apresentarem quaisquer sinais ou sintomas de lesão hepática, incluindo: perda de apetite, náusea, vômito, febre, fraqueza, cansaço, sensibilidade no quadrante superior direito, coceira, amarelecimento da pele e dos olhos, movimentos intestinais de cor clara ou urina de cor escura.
- Diarréia: diarreia é um problema comum causado por antibióticos que geralmente termina quando o antibiótico é descontinuado. Às vezes, após o início do tratamento com antibióticos, os pacientes podem desenvolver fezes aquosas e sanguinolentas (com ou sem cólicas estomacais e febre), mesmo dois ou mais meses após a última dose do antibiótico. Se isso ocorrer, instrua os pacientes a entrar em contato com seu médico o mais rápido possível.
- Prolongamento do intervalo QT: Instruir os pacientes a informar seu médico sobre qualquer história pessoal ou familiar de prolongamento do intervalo QT ou condições pró-arrítmicas, como hipocalemia, bradicardia ou isquemia miocárdica recente; se estiverem tomando qualquer agente antiarrítmico Classe IA (quinidina, procainamida) ou Classe III (amiodarona, sotalol). Instrua os pacientes a notificar seu médico se apresentarem quaisquer sintomas de prolongamento do intervalo QT, incluindo palpitações cardíacas prolongadas ou perda de consciência.
- Distúrbios Musculoesqueléticos em Pacientes Pediátricos: Instrua os pais a informar o médico de seus filhos se a criança tiver um histórico de problemas relacionados às articulações antes de tomar este medicamento. Informe os pais de pacientes pediátricos para notificar o médico de seus filhos sobre quaisquer problemas relacionados às articulações que ocorram durante ou após a terapia com levofloxacina [ver AVISOS E PRECAUÇÕES e Uso em populações específicas ].
- Fotossensibilidade/Fototoxicidade: Informe os pacientes que fotossensibilidade/fototoxicidade foram relatadas em pacientes recebendo fluoroquinolonas. Informe os pacientes para minimizar ou evitar a exposição à luz solar natural ou artificial (camas de bronzeamento artificial ou tratamento UVA/B) enquanto estiver tomando fluoroquinolonas. Se os pacientes precisarem ficar ao ar livre enquanto estiverem usando fluoroquinolonas, instrua-os a usar roupas folgadas que protejam a pele da exposição ao sol e discuta outras medidas de proteção solar com seu médico. Se ocorrer uma reação do tipo queimadura solar ou erupção cutânea, instrua os pacientes a entrar em contato com seu médico.
Resistência Antibacteriana
Medicamentos antibacterianos, incluindo LEVAQUIN®, devem ser usados apenas para tratar infecções bacterianas. Eles não tratam infecções virais (por exemplo, o resfriado comum). Quando LEVAQUIN® é prescrito para tratar uma infecção bacteriana, os pacientes devem ser informados de que, embora seja comum sentir-se melhor no início do tratamento, a medicação deve ser tomada exatamente como indicado. Pular doses ou não completar o curso completo da terapia pode (1) diminuir a eficácia do tratamento imediato e (2) aumentar a probabilidade de que as bactérias desenvolvam resistência e não sejam tratáveis por LEVAQUIN® ou outros medicamentos antibacterianos no futuro.
Administração com alimentos, líquidos e medicamentos concomitantes
Os pacientes devem ser informados de que LEVAQUIN® Comprimidos pode ser tomado com ou sem alimentos. Os comprimidos devem ser tomados à mesma hora todos os dias.
Os pacientes devem beber bastante líquidos enquanto estiverem tomando LEVAQUIN® para evitar a formação de urina altamente concentrada e a formação de cristais na urina.
Antiácidos contendo magnésio ou alumínio, bem como sucralfato, cátions metálicos como ferro e preparações multivitamínicas com zinco ou didanosina devem ser tomados pelo menos duas horas antes ou duas horas após a administração oral de LEVAQUIN®.
Interações medicamentosas com insulina, hipoglicemiantes orais e varfarina
Os pacientes devem ser informados de que se forem diabéticos e estiverem sendo tratados com insulina ou um agente hipoglicemiante oral e ocorrer uma reação hipoglicêmica, eles devem descontinuar LEVAQUIN® e consultar um médico.
Os pacientes devem ser informados de que a administração concomitante de varfarina e LEVAQUIN® foi associada a aumentos da Razão Normalizada Internacional (INR) ou do tempo de protrombina e episódios clínicos de sangramento. Os pacientes devem notificar seu médico se estiverem tomando varfarina, ser monitorados quanto a evidências de sangramento e também ter seus testes de anticoagulação monitorados de perto enquanto estiverem tomando varfarina concomitantemente.
Estudos de peste e antraz
Os pacientes que receberam LEVAQUIN® para essas condições devem ser informados de que os estudos de eficácia não podem ser realizados em humanos por razões éticas e de viabilidade. Portanto, a aprovação para essas condições foi baseada em estudos de eficácia realizados em animais.
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Em um bioensaio ao longo da vida em ratos, a levofloxacina não exibiu potencial carcinogênico após administração dietética diária por 2 anos; a dose mais alta (100 mg/kg/dia) foi 1,4 vezes a dose humana mais alta recomendada (750 mg) com base na área de superfície corporal relativa. A levofloxacina não encurtou o tempo para o desenvolvimento de tumores de pele induzidos por UV em camundongos albinos sem pêlo (Skh-1) em qualquer nível de dose de levofloxacina e, portanto, não foi fotocarcinogênico nas condições deste estudo. As concentrações dérmicas de levofloxacino nos camundongos sem pêlo variaram de 25 a 42 mcg/g no nível de dose mais alto de levofloxacino (300 mg/kg/dia) usado no estudo de fotocarcinogenicidade. Em comparação, as concentrações dérmicas de levofloxacina em indivíduos humanos recebendo 750 mg de LEVAQUIN® foram em média de aproximadamente 11,8 mcg/g em Cmax.
levofloxacina não foi mutagênica nos seguintes ensaios: ensaio de mutação bacteriana Ames (S. typhimurium e E. coli), ensaio de mutação direta CHO/HGPRT, teste de micronúcleo de camundongo, teste letal dominante de camundongo, ensaio de síntese de DNA não programado em rato e cromátide irmã de camundongo ensaio de troca. Foi positivo nos ensaios de aberração cromossômica in vitro (linha celular CHL) e troca de cromátides irmãs (linha celular CHL/IU).
A levofloxacina não causou prejuízo na fertilidade ou no desempenho reprodutivo em ratos em doses orais tão altas quanto 360 mg/kg/dia, correspondendo a 4,2 vezes a dose humana mais alta recomendada com base na área de superfície corporal relativa e doses intravenosas tão altas quanto 100 mg/kg/ dia, correspondendo a 1,2 vezes a dose humana mais alta recomendada com base na área de superfície corporal relativa.
Uso em populações específicas
Gravidez
Gravidez Categoria C
levofloxacina não foi teratogênica em ratos em doses tão altas quanto 810 mg/kg/dia, o que corresponde a 9,4 vezes a dose oral humana mais alta recomendada com base na área de superfície corporal relativa. A dose oral de 810 mg/kg/dia em ratos causou diminuição do peso corporal fetal e aumento da mortalidade fetal. Não foi observada teratogenicidade quando os coelhos receberam doses oralmente tão altas quanto 50 mg/kg/dia, o que corresponde a 1,1 vezes a dose oral humana mais alta recomendada com base na área de superfície corporal relativa.
No entanto, não existem estudos adequados e bem controlados em mulheres grávidas. LEVAQUIN® deve ser usado durante a gravidez somente se o benefício potencial justificar o risco potencial para o feto.
Mães que amamentam
Com base em dados de outras fluoroquinolonas e dados muito limitados sobre LEVAQUIN®, pode-se presumir que a levofloxacina será excretada no leite humano. Devido ao potencial de reações adversas graves de LEVAQUIN® em lactentes, deve-se decidir entre descontinuar a amamentação ou descontinuar o medicamento, levando em consideração a importância do medicamento para a mãe.
Uso Pediátrico
As quinolonas, incluindo a levofloxacina, causam artropatia e osteocondrose em animais juvenis de várias espécies. [Vejo AVISOS E PRECAUÇÕES e Farmacologia Animal ].
Antraz por inalação (pós-exposição)
A levofloxacina é indicada em pacientes pediátricos com 6 meses de idade ou mais, para antraz por inalação (pós-exposição). A avaliação risco-benefício indica que a administração de levofloxacina a pacientes pediátricos é apropriada. A segurança da levofloxacina em pacientes pediátricos tratados por mais de 14 dias não foi estudada [ver INDICAÇÕES , DOSAGEM E ADMINISTRAÇÃO e Estudos clínicos ].
Praga
levofloxacina é indicada em pacientes pediátricos, a partir de 6 meses de idade, para tratamento de peste, incluindo peste pneumônica e septicêmica por Yersinia pestis (Y. pestis) e profilaxia para peste. Os estudos de eficácia do LEVAQUIN® não puderam ser conduzidos em humanos com peste pneumônica por razões éticas e de viabilidade. Portanto, a aprovação desta indicação foi baseada em um estudo de eficácia realizado em animais. A avaliação risco-benefício indica que a administração de levofloxacino a pacientes pediátricos é apropriada [ver INDICAÇÕES , DOSAGEM E ADMINISTRAÇÃO e Estudos clínicos ].
A segurança e eficácia de LEVAQUIN® em pacientes pediátricos com idade inferior a seis meses não foram estabelecidas.
Farmacocinética após administração intravenosa
farmacocinética da levofloxacina após uma dose intravenosa única foi investigada em pacientes pediátricos com idade variando de seis meses a 16 anos. Os pacientes pediátricos eliminaram a levofloxacina mais rapidamente do que os pacientes adultos, resultando em exposições plasmáticas mais baixas do que os adultos para uma determinada dose de mg/kg [ver FARMACOLOGIA CLÍNICA e Estudos clínicos ].
Dosagem em pacientes pediátricos com antraz por inalação ou peste
Para a dosagem recomendada de LEVAQUIN® em comprimidos em pacientes pediátricos com antraz inalatório ou peste, consulte DOSAGEM E ADMINISTRAÇÃO . LEVAQUIN® Comprimidos não pode ser administrado a pacientes pediátricos com peso inferior a 30 kg devido às limitações das dosagens disponíveis. Formulações alternativas de levofloxacina podem ser consideradas para pacientes pediátricos com peso inferior a 30 kg.
Reações adversas
Em ensaios clínicos, 1.534 pacientes pediátricos (6 meses a 16 anos de idade) foram tratados com LEVAQUIN® oral e intravenoso. Pacientes pediátricos de 6 meses a 5 anos de idade receberam LEVAQUIN® 10 mg/kg duas vezes ao dia e pacientes pediátricos com mais de 5 anos de idade receberam 10 mg/kg uma vez ao dia (máximo de 500 mg por dia) por aproximadamente 10 dias. Os comprimidos LEVAQUIN® só podem ser administrados a pacientes pediátricos com antraz por inalação (pós-exposição) ou peste com peso igual ou superior a 30 kg devido às limitações das dosagens disponíveis [ver DOSAGEM E ADMINISTRAÇÃO ].
Um subconjunto de pacientes pediátricos nos ensaios clínicos (1340 tratados com LEVAQUIN® e 893 não tratados com fluoroquinolona) inscritos em um estudo prospectivo de vigilância de longo prazo para avaliar a incidência de distúrbios musculoesqueléticos definidos pelo protocolo (artralgia, artrite, tendinopatia, anormalidade da marcha ) durante 60 dias e 1 ano após a primeira dose do medicamento em estudo. Pacientes pediátricos tratados com LEVAQUIN® tiveram uma incidência significativamente maior de distúrbios musculoesqueléticos quando comparados às crianças não tratadas com fluoroquinolona, conforme ilustrado na Tabela 7. LEVAQUIN® Comprimidos só pode ser administrado a pacientes pediátricos com antraz inalatório (pós-exposição) ou peste com peso igual ou superior a 30 kg devido às limitações das forças disponíveis [ver DOSAGEM E ADMINISTRAÇÃO ].
artralgia foi o distúrbio musculoesquelético mais frequente em ambos os grupos de tratamento. A maioria dos distúrbios musculoesqueléticos em ambos os grupos envolveu múltiplas articulações de sustentação de peso. Os distúrbios foram moderados em 8/46 (17%) crianças e leves em 35/46 (76%) pacientes pediátricos tratados com LEVAQUIN® e a maioria foi tratada com analgésicos. O tempo médio para resolução foi de 7 dias para pacientes pediátricos tratados com LEVAQUIN® e 9 para crianças não tratadas com fluoroquinolona (aproximadamente 80% resolvido em 2 meses em ambos os grupos). Nenhum paciente pediátrico teve um distúrbio grave ou grave e todos os distúrbios musculoesqueléticos foram resolvidos sem sequelas.
Vômitos e diarreia foram as reações adversas mais frequentemente relatadas, ocorrendo em frequência semelhante em pacientes pediátricos tratados com LEVAQUIN® e não tratados com fluoroquinolona.
Além das reações adversas relatadas em pacientes pediátricos em estudos clínicos, reações adversas relatadas em adultos durante os estudos clínicos ou experiência pós-comercialização [ver REAÇÕES ADVERSAS ] também pode ocorrer em pacientes pediátricos.
Uso Geriátrico
Pacientes geriátricos correm maior risco de desenvolver distúrbios graves do tendão, incluindo ruptura do tendão, ao serem tratados com uma fluoroquinolona, como LEVAQUIN®. Este risco é ainda maior em pacientes recebendo terapia concomitante com corticosteróides. A tendinite ou ruptura do tendão pode envolver o tendão de Aquiles, mão, ombro ou outros locais e pode ocorrer durante ou após a conclusão da terapia; foram relatados casos que ocorreram até vários meses após o tratamento com fluoroquinolona. Deve-se ter cuidado ao prescrever LEVAQUIN® a pacientes idosos, especialmente aqueles em uso de corticosteroides. Os pacientes devem ser informados sobre este efeito colateral potencial e aconselhados a descontinuar LEVAQUIN® e entrar em contato com seu médico se ocorrerem quaisquer sintomas de tendinite ou ruptura de tendão [ver AVISO DE CAIXA ; AVISOS E PRECAUÇÕES ; e REAÇÕES ADVERSAS ].
Nos ensaios clínicos de Fase 3, 1.945 pacientes tratados com LEVAQUIN® (26%) tinham ≥ 65 anos de idade. Destes, 1.081 pacientes (14%) tinham entre 65 e 74 anos e 864 pacientes (12%) tinham 75 anos ou mais. Não foram observadas diferenças globais na segurança ou eficácia entre estes indivíduos e indivíduos mais jovens, mas não se pode excluir uma maior sensibilidade de alguns indivíduos mais velhos.
Casos graves e às vezes fatais de hepatotoxicidade foram relatados após a comercialização em associação com LEVAQUIN®. A maioria dos relatos de hepatotoxicidade fatal ocorreu em pacientes com 65 anos de idade ou mais e a maioria não estava associada à hipersensibilidade. LEVAQUIN® deve ser descontinuado imediatamente se o paciente desenvolver sinais e sintomas de hepatite [ver AVISOS E PRECAUÇÕES ].
Pacientes idosos podem ser mais suscetíveis aos efeitos associados ao medicamento no intervalo QT. Portanto, deve-se ter precaução ao usar LEVAQUIN® com medicamentos concomitantes que podem resultar em prolongamento do intervalo QT (por exemplo, antiarrítmicos Classe IA ou Classe III) ou em pacientes com fatores de risco para torsade de pointes (por exemplo, prolongamento QT conhecido, hipocalemia) [ver AVISOS E PRECAUÇÕES ].
As propriedades farmacocinéticas da levofloxacina em adultos jovens e idosos não diferem significativamente quando a depuração da creatinina é levada em consideração. No entanto, como o fármaco é substancialmente excretado pelos rins, o risco de reações tóxicas a esse fármaco pode ser maior em pacientes com função renal comprometida. Como os pacientes idosos são mais propensos a ter função renal diminuída, deve-se ter cuidado na seleção da dose e pode ser útil monitorar a função renal [ver FARMACOLOGIA CLÍNICA ].
Insuficiência renal
depuração da levofloxacina é substancialmente reduzida e a meia-vida de eliminação plasmática é substancialmente prolongada em pacientes com insuficiência renal (depuração de creatinina DOSAGEM E ADMINISTRAÇÃO ].
Insuficiência hepática
Não foram realizados estudos farmacocinéticos em pacientes com insuficiência hepática. Devido à extensão limitada do metabolismo da levofloxacina, não se espera que a farmacocinética da levofloxacina seja afetada pela insuficiência hepática.
SOBREDOSAGEM
Em caso de sobredosagem aguda, o estômago deve ser esvaziado. O paciente deve ser observado e mantida hidratação adequada. O levofloxacino não é removido eficientemente por hemodiálise ou diálise peritoneal.
LEVAQUIN® apresenta um baixo potencial de toxicidade aguda. Camundongos, ratos, cães e macacos exibiram os seguintes sinais clínicos após receberem uma única dose alta de LEVAQUIN®: ataxia, ptose, diminuição da atividade locomotora, dispneia, prostração, tremores e convulsões. Doses superiores a 1500 mg/kg por via oral e 250 mg/kg IV produziram mortalidade significativa em roedores.
CONTRA-INDICAÇÕES
LEVAQUIN® é contraindicado em pessoas com hipersensibilidade conhecida à levofloxacina ou a outros antibacterianos de quinolona [ver AVISOS E PRECAUÇÕES ].
FARMACOLOGIA CLÍNICA
Mecanismo de ação
A levofloxacina é um membro da classe das fluoroquinolonas de agentes antibacterianos. veja Microbiologia ].
Farmacocinética
Os parâmetros farmacocinéticos médios ± SD da levofloxacina determinados em condições únicas e de estado estacionário após a administração dos comprimidos orais estão resumidos na Tabela 8.
farmacocinética da levofloxacina é linear e previsível após regimes de dosagem oral ou IV únicos e múltiplos. As condições de estado estacionário são alcançadas dentro de 48 horas após um regime de dosagem de 500 mg ou 750 mg uma vez ao dia. As concentrações plasmáticas médias ± SD de pico e vale alcançadas após vários regimes de dosagem oral uma vez ao dia foram aproximadamente 5,7 ± 1,4 e 0,5 ± 0,2 mcg/mL após as doses de 500 mg e 8,6 ± 1,9 e 1,1 ± 0,4 mcg/mL após as doses de 750 mg doses de mg, respectivamente. As concentrações plasmáticas médias ± SD de pico e vale alcançadas após vários regimes IV uma vez ao dia foram de aproximadamente 6,4 ± 0,8 e 0,6 ± 0,2 mcg/mL após as doses de 500 mg e 12,1 ± 4,1 e 1,3 ± 0,71 mcg/mL após as doses de 750 mg doses, respectivamente.
Absorção
levofloxacina é rápida e essencialmente completamente absorvida após administração oral. As concentrações plasmáticas máximas são geralmente atingidas uma a duas horas após a administração oral. A biodisponibilidade absoluta da levofloxacina de um comprimido de 500 mg e de um comprimido de 750 mg de LEVAQUIN® é de aproximadamente 99%, demonstrando a absorção oral completa da levofloxacina. Após uma dose intravenosa única de LEVAQUIN® em voluntários saudáveis, a concentração plasmática média ± DP máxima atingida foi de 6,2 ± 1,0 mcg/mL após uma dose de 500 mg infundida durante 60 minutos e 11,5 ± 4,0 mcg/mL após uma dose de 750 mg infundida durante 90 minutos. A administração oral de uma dose de 500 mg de LEVAQUIN® com alimentos prolonga o tempo até o pico de concentração em aproximadamente 1 hora e diminui o pico de concentração em aproximadamente 14% após o comprimido e aproximadamente 25% após a administração da solução oral. Portanto, LEVAQUIN® Comprimidos pode ser administrado independentemente da alimentação.
perfil de concentração plasmática de levofloxacino após administração IV é semelhante e comparável em extensão de exposição (AUC) ao observado para LEVAQUIN® Comprimidos quando doses iguais (mg/mg) são administradas. Portanto, as vias de administração oral e IV podem ser consideradas intercambiáveis.
Distribuição
volume médio de distribuição da levofloxacina geralmente varia de 74 a 112 L após doses únicas e múltiplas de 500 mg ou 750 mg, indicando ampla distribuição nos tecidos corporais. A levofloxacina atinge seus níveis máximos nos tecidos da pele e no líquido da bolha de indivíduos saudáveis aproximadamente 3 horas após a administração. A razão AUC da biópsia do tecido da pele para o plasma é de aproximadamente 2 e a razão AUC do líquido da bolha para o plasma é de aproximadamente 1 após a administração oral múltipla uma vez ao dia de doses de 750 mg e 500 mg de LEVAQUIN®, respectivamente, em indivíduos saudáveis. A levofloxacina também penetra bem nos tecidos pulmonares. As concentrações no tecido pulmonar foram geralmente 2 a 5 vezes maiores do que as concentrações plasmáticas e variaram de aproximadamente 2,4 a 11,3 mcg/g durante um período de 24 horas após uma dose oral única de 500 mg.
In vitro, em uma faixa clinicamente relevante (1 a 10 mcg/mL) de concentrações séricas/plasmáticas de levofloxacina, a levofloxacina é de aproximadamente 24 a 38% ligada às proteínas séricas em todas as espécies estudadas, conforme determinado pelo método de diálise de equilíbrio. A levofloxacina liga-se principalmente à albumina sérica em humanos. A ligação da levofloxacina às proteínas séricas é independente da concentração do fármaco.
Eliminação
Metabolismo
levofloxacina é estereoquimicamente estável no plasma e na urina e não se inverte metabolicamente em seu enantiômero, D-ofloxacina. A levofloxacina sofre metabolismo limitado em humanos e é excretada principalmente como fármaco inalterado na urina. Após a administração oral, aproximadamente 87% de uma dose administrada foi recuperada como fármaco inalterado na urina em 48 horas, enquanto menos de 4% da dose foi recuperada nas fezes em 72 horas. Menos de 5% de uma dose administrada foi recuperada na urina como metabólitos desmetil e N-óxido, os únicos metabólitos identificados em humanos. Esses metabólitos têm pouca atividade farmacológica relevante.
Excreção
levofloxacina é excretada em grande parte como fármaco inalterado na urina. A meia-vida de eliminação plasmática terminal média da levofloxacina varia de aproximadamente 6 a 8 horas após doses únicas ou múltiplas de levofloxacina administradas por via oral ou intravenosa. A depuração corporal total aparente média e a depuração renal variam de aproximadamente 144 a 226 mL/min e 96 a 142 mL/min, respectivamente. A depuração renal superior à taxa de filtração glomerular sugere que a secreção tubular de levofloxacina ocorre em adição à sua filtração glomerular. A administração concomitante de cimetidina ou probenecida resulta em aproximadamente 24% e 35% de redução na depuração renal de levofloxacino, respectivamente, indicando que a secreção de levofloxacino ocorre no túbulo proximal renal. Não foram encontrados cristais de levofloxacina em nenhuma das amostras de urina recentemente coletadas de indivíduos que receberam LEVAQUIN®.
Populações Específicas
Pacientes Geriátricos
Não existem diferenças significativas na farmacocinética da levofloxacina entre indivíduos jovens e idosos quando os indivíduos' as diferenças na depuração da creatinina são levadas em consideração. Após uma dose oral de 500 mg de LEVAQUIN® em idosos saudáveis (66-80 anos de idade), a meia-vida de eliminação plasmática terminal média da levofloxacina foi de cerca de 7,6 horas, em comparação com aproximadamente 6 horas em adultos mais jovens. A diferença foi atribuída à variação no estado da função renal dos indivíduos e não foi considerada clinicamente significativa. A absorção do fármaco parece não ser afetada pela idade. O ajuste da dose de LEVAQUIN® com base apenas na idade não é necessário [ver Uso em populações específicas ].
Pacientes pediátricos
farmacocinética da levofloxacina após uma dose intravenosa única de 7 mg/kg foi investigada em pacientes pediátricos com idade variando de 6 meses a 16 anos. Os pacientes pediátricos eliminaram a levofloxacina mais rapidamente do que os pacientes adultos, resultando em exposições plasmáticas mais baixas do que os adultos para uma determinada dose de mg/kg. Análises farmacocinéticas subsequentes previram que um regime de dosagem de 8 mg/kg a cada 12 horas (não exceder 250 mg por dose) para pacientes pediátricos de 6 meses a 17 anos de idade atingiria exposições plasmáticas em estado de equilíbrio comparáveis (AUC0-24 e Cmax) a aqueles observados em pacientes adultos administrados 500 mg de levofloxacina uma vez a cada 24 horas. Os comprimidos LEVAQUIN® só podem ser administrados a pacientes pediátricos com antraz por inalação (pós-exposição) ou peste com peso igual ou superior a 30 kg devido às limitações das dosagens disponíveis [ver DOSAGEM E ADMINISTRAÇÃO ].
Sujeitos Masculinos e Femininos
Não existem diferenças significativas na farmacocinética da levofloxacina entre indivíduos do sexo masculino e feminino quando os indivíduos' as diferenças na depuração da creatinina são levadas em consideração. Após uma dose oral de 500 mg de LEVAQUIN® em indivíduos saudáveis do sexo masculino, a meia-vida de eliminação plasmática terminal média da levofloxacina foi de cerca de 7,5 horas, em comparação com aproximadamente 6,1 horas em indivíduos do sexo feminino. Esta diferença foi atribuída à variação no estado da função renal dos indivíduos do sexo masculino e feminino e não se acredita ser clinicamente significativa. A absorção do fármaco parece não ser afetada pelo sexo dos sujeitos. O ajuste de dose com base apenas no sexo não é necessário.
Grupos raciais ou étnicos
O efeito da raça na farmacocinética da levofloxacina foi examinado através de uma análise covariável realizada em dados de 72 indivíduos: 48 brancos e 24 não brancos. A depuração corporal total aparente e o volume aparente de distribuição não foram afetados pela raça dos indivíduos.
Pacientes com Insuficiência Renal
depuração da levofloxacina é substancialmente reduzida e a meia-vida de eliminação plasmática é substancialmente prolongada em pacientes adultos com função renal comprometida (depuração de creatinina DOSAGEM E ADMINISTRAÇÃO e Uso em populações específicas ].
Pacientes com Insuficiência Hepática
Não foram realizados estudos farmacocinéticos em pacientes com insuficiência hepática. Devido à extensão limitada do metabolismo da levofloxacina, não se espera que a farmacocinética da levofloxacina seja afetada pela insuficiência hepática [ver Uso em populações específicas ].
Pacientes com infecção bacteriana
A farmacocinética da levofloxacina em pacientes com infecções bacterianas graves adquiridas na comunidade é comparável àquela observada em indivíduos saudáveis.
Estudos de interação medicamentosa
potencial de interações medicamentosas farmacocinéticas entre LEVAQUIN® e antiácidos, varfarina, teofilina, ciclosporina, digoxina, probenecida e cimetidina foi avaliado [ver INTERAÇÕES MEDICAMENTOSAS ].
Microbiologia
Mecanismo de ação
A levofloxacina é o isômero L do racemato, ofloxacina, um agente antimicrobiano quinolona. A atividade antibacteriana da ofloxacina reside principalmente no isômero L. O mecanismo de ação da levofloxacina e de outros antimicrobianos fluoroquinolonas envolve a inibição da topoisomerase bacteriana IV e da DNA girase (ambas topoisomerases do tipo II), enzimas necessárias para a replicação, transcrição, reparo e recombinação do DNA.
Resistência
A resistência à fluoroquinolona pode surgir através de mutações em regiões definidas da DNA girase ou topoisomerase IV, denominadas Regiões Determinantes de Resistência à Quinolona (QRDRs), ou através de efluxo alterado.
As fluoroquinolonas, incluindo a levofloxacina, diferem na estrutura química e no modo de ação dos aminoglicosídeos, macrolídeos e antibióticos β-lactâmicos, incluindo as penicilinas. As fluoroquinolonas podem, portanto, ser ativas contra bactérias resistentes a esses antimicrobianos.
A resistência à levofloxacina devido a mutação espontânea in vitro é uma ocorrência rara (intervalo: 10-9 a 10-10). Foi observada resistência cruzada entre a levofloxacina e algumas outras fluoroquinolonas, alguns microrganismos resistentes a outras fluoroquinolonas podem ser sensíveis à levofloxacina.
Actividade antimicrobiana
A levofloxacina tem atividade in vitro contra bactérias Gram-negativas e Gram-positivas.
A levofloxacina demonstrou ser ativa contra a maioria dos isolados das seguintes bactérias, tanto in vitro quanto em infecções clínicas, conforme descrito em ver INDICAÇÕES :
Bactérias Aeróbicas
Bactérias Gram-positivas
Enterococcus faecalisStaphylococcus aureus (isolados suscetíveis à meticilina)Staphylococcus epidermidis (isolados suscetíveis à meticilina)Staphylococcus saprophyticusStreptococcus pneumoniae (incluindo isolados resistentes a múltiplas drogas [MDRSP]1)Streptococcus pyogenes
Bactérias Gram-Negativas
Enterobacter cloacaeEscherichia coliHaemophilus influenzaeHaemophilus parainfluenzaeKlebsiella pneumoniaeLegionella pneumophilaMoraxella catarrhalisProteus mirabilisPseudomonas aeruginosaSerratia marcescens
Outros microrganismos
Chlamydophila pneumoniaeMycoplasma pneumoniae
Os seguintes dados in vitro estão disponíveis, mas seu significado clínico é desconhecido: A levofloxacina exibe concentrações inibitórias mínimas in vitro (valores de CIM) de 2 mcg/mL ou menos contra a maioria (≥90%) dos isolados dos seguintes microrganismos; entretanto, a segurança e eficácia de LEVAQUIN® no tratamento de infecções clínicas causadas por essas bactérias não foram estabelecidas em ensaios clínicos adequados e bem controlados.
Isolados de MDRSP (Streptococcus pneumoniae resistente a múltiplas drogas) são isolados resistentes a dois ou mais dos seguintes antibióticos: penicilina (CIM ≥2 mcg/mL), cefalosporinas de 2ª geração, por exemplo, cefuroxima; macrolídeos, tetraciclinas e trimetoprima/sulfametoxazol.
Bactérias Aeróbicas
Bactérias Gram-positivas
Staphylococcus haemolyticus Estreptococo beta-hemolítico (Grupo C/F) Estreptococo beta-hemolítico (Grupo G)Streptococcus agalactiaeStreptococcus milleriStreptococcus do grupo ViridansBacillus anthracis
Bactérias Gram-Negativas
Acinetobacter baumanniiAcinetobacter lwoffiiBordetella pertussisCitrobacter koseriCitrobacter freundiiEnterobacter aerogenesEnterobacter sakazakiiKlebsiella oxytocaMorganella morganiiPantoea agglomeransProteus vulgarisProvidencia rettgeriProvidencia stuartiiPseudomonas fluorescensYersinia pestis
Bactérias anaeróbicas
Bactérias Gram-positivas
Clostridium perfringens
Testes de suscetibilidade
Para obter informações específicas sobre os critérios interpretativos do teste de suscetibilidade e métodos de teste associados e padrões de controle de qualidade reconhecidos pela FDA para este medicamento, consulte: https://www.fda.gov/STIC.
Toxicologia e/ou Farmacologia Animal
levofloxacina e outras quinolonas demonstraram causar artropatia em animais imaturos da maioria das espécies testadas [ver AVISOS E PRECAUÇÕES ]. Em cães imaturos (4-5 meses de idade), doses orais de 10 mg/kg/dia por 7 dias e doses intravenosas de 4 mg/kg/dia por 14 dias de levofloxacina resultaram em lesões artropáticas. A administração de doses orais de 300 mg/kg/dia por 7 dias e doses intravenosas de 60 mg/kg/dia por 4 semanas produziu artropatia em ratos juvenis. Cães beagle de três meses de idade tratados oralmente com levofloxacina a 40 mg/kg/dia exibiram artrotoxicidade clinicamente grave resultando no término da dosagem no Dia 8 de uma rotina de dosagem de 14 dias. Efeitos clínicos musculoesqueléticos leves, na ausência de efeitos patológicos ou histopatológicos grosseiros, resultaram do nível de dose mais baixo de 2,5 mg/kg/dia (aproximadamente 0,2 vezes a dose pediátrica com base em comparações de AUC). Sinovite e lesões da cartilagem articular foram observadas nos níveis de dose de 10 e 40 mg/kg (aproximadamente 0,7 vezes e 2,4 vezes a dose pediátrica, respectivamente, com base em comparações de AUC). A patologia macroscópica da cartilagem articular e a histopatologia persistiram até o final do período de recuperação de 18 semanas para aqueles cães dos níveis de dose de 10 e 40 mg/kg/dia.
Quando testado em um bioensaio de inchaço da orelha de camundongo, a levofloxacina exibiu fototoxicidade semelhante em magnitude à ofloxacina, mas menos fototoxicidade do que outras quinolonas.
Embora a cristalúria tenha sido observada em alguns estudos intravenosos em ratos, os cristais urinários não são formados na bexiga, estando presentes somente após a micção e não estão associados à nefrotoxicidade.
Em camundongos, o efeito estimulador do SNC das quinolonas é aumentado pela administração concomitante de anti-inflamatórios não esteróides.
Em cães, a levofloxacina administrada a 6 mg/kg ou mais por injeção intravenosa rápida produziu efeitos hipotensores. Esses efeitos foram considerados relacionados à liberação de histamina.
Estudos in vitro e in vivo em animais indicam que a levofloxacina não é um indutor enzimático nem um inibidor na faixa de concentração plasmática terapêutica humana; portanto, não se prevêem interações relacionadas à enzima metabolizadora de drogas com outras drogas ou agentes.
Estudos clínicos
Pneumonia nosocomial
Pacientes adultos com pneumonia nosocomial documentada clínica e radiologicamente foram incluídos em um estudo multicêntrico, randomizado e aberto comparando LEVAQUIN® intravenoso (750 mg uma vez ao dia) seguido de LEVAQUIN® oral (750 mg uma vez ao dia) por um total de 7 a 15 dias para imipenem/cilastatina intravenosa (500-1000 mg a cada 6-8 horas por dia) seguido de ciprofloxacina oral (750 mg a cada 12 horas por dia) por um total de 7-15 dias. Os pacientes tratados com LEVAQUIN® receberam uma média de 7 dias de terapia intravenosa (intervalo: 1–16 dias); os pacientes tratados com comparador receberam uma média de 8 dias de terapia intravenosa (intervalo: 1-19 dias).
Em geral, na população avaliada clínica e microbiologicamente, a terapia adjuvante foi iniciada empiricamente no início do estudo em 56 de 93 (60,2%) pacientes no braço LEVAQUIN® e 53 de 94 (56,4%) pacientes no braço comparador. A duração média da terapia adjuvante foi de 7 dias no braço LEVAQUIN® e 7 dias no comparador. Em pacientes clinicamente e microbiologicamente avaliáveis com infecção documentada por Pseudomonas aeruginosa, 15 de 17 (88,2%) receberam ceftazidima (N = 11) ou piperacilina/tazobactam (N = 4) no braço LEVAQUIN® e 16 de 17 (94,1%) receberam um aminoglicosídeo no braço comparador. No geral, em pacientes avaliados clínica e microbiologicamente, a vancomicina foi adicionada ao regime de tratamento de 37 de 93 (39,8%) pacientes no braço LEVAQUIN® e 28 de 94 (29,8%) pacientes no braço comparador para suspeita de resistência à meticilina por S. infecção aureus.
As taxas de sucesso clínico em pacientes clinicamente e microbiologicamente avaliáveis na visita pós-terapia (desfecho primário do estudo avaliado no dia 3-15 após a conclusão da terapia) foram de 58,1% para LEVAQUIN® e 60,6% para o comparador. O IC de 95% para a diferença das taxas de resposta (LEVAQUIN® menos comparador) foi [-17,2, 12,0]. As taxas de erradicação microbiológica na visita pós-terapia foram de 66,7% para LEVAQUIN® e 60,6% para comparador. O IC de 95% para a diferença das taxas de erradicação (LEVAQUIN® menos comparador) foi [-8,3, 20,3]. O sucesso clínico e as taxas de erradicação microbiológica por patógeno são detalhados na Tabela 9.
Pneumonia adquirida na comunidade
Regime de tratamento de 7 a 14 dias
Pacientes adultos internados e ambulatoriais com diagnóstico de pneumonia bacteriana adquirida na comunidade foram avaliados em 2 estudos clínicos principais. No primeiro estudo, 590 pacientes foram incluídos em um estudo prospectivo, multicêntrico, randomizado, não cego, comparando LEVAQUIN® 500 mg uma vez ao dia por via oral ou intravenosa por 7 a 14 dias com ceftriaxona 1 a 2 gramas por via intravenosa uma vez ou em doses igualmente divididas duas vezes ao dia seguido de cefuroxima axetil 500 mg por via oral duas vezes ao dia por um total de 7 a 14 dias. Os pacientes designados para tratamento com o regime de controle foram autorizados a receber eritromicina (ou doxiciclina se intolerantes à eritromicina) se uma infecção por patógenos atípicos fosse suspeita ou comprovada. As avaliações clínicas e microbiológicas foram realizadas durante o tratamento, 5 a 7 dias após a terapia e 3 a 4 semanas após a terapia. O sucesso clínico (cura mais melhora) com LEVAQUIN® em 5 a 7 dias pós-terapia, variável primária de eficácia neste estudo, foi superior (95%) ao grupo controle (83%). O IC de 95% para a diferença das taxas de resposta (LEVAQUIN® menos comparador) foi [-6, 19]. No segundo estudo, 264 pacientes foram incluídos em um estudo prospectivo, multicêntrico e não comparativo de 500 mg de LEVAQUIN® administrado por via oral ou intravenosa uma vez ao dia por 7 a 14 dias. O sucesso clínico para pacientes clinicamente avaliáveis foi de 93%. Para ambos os estudos, a taxa de sucesso clínico em pacientes com pneumonia atípica por Chlamydophila pneumoniae, Mycoplasma pneumoniae e Legionella pneumophila foi de 96%, 96% e 70%, respectivamente. As taxas de erradicação microbiológica em ambos os estudos são apresentadas na Tabela 10.
Pneumonia adquirida na comunidade devido a Streptococcus Pneumoniae multirresistente
LEVAQUIN® foi eficaz para o tratamento de pneumonia adquirida na comunidade causada por Streptococcus pneumoniae multirresistente (MDRSP). Os isolados de MDRSP são isolados resistentes a dois ou mais dos seguintes antibacterianos: penicilina (CIM ≥2 mcg/mL), cefalosporinas de 2ª geração (por exemplo, cefuroxima, macrolídeos, tetraciclinas e trimetoprima/sulfametoxazol). De 40 pacientes microbiologicamente avaliáveis com isolados de MDRSP, 38 pacientes (95,0%) obtiveram sucesso clínico e bacteriológico no pós-terapia. As taxas de sucesso clínico e bacteriano são mostradas na Tabela 11.
Nem todos os isolados foram resistentes a todas as classes de antimicrobianos testadas. As taxas de sucesso e erradicação estão resumidas na Tabela 12.
Pneumonia adquirida na comunidade
Regime de Tratamento de 5 Dias
Para avaliar a segurança e eficácia da dose mais alta e do curso mais curto de LEVAQUIN®, 528 adultos ambulatoriais e hospitalizados com pneumonia adquirida na comunidade leve a grave determinada clínica e radiologicamente foram avaliados em um estudo duplo-cego, randomizado, prospectivo e multicêntrico comparando LEVAQUIN ® 750 mg, IV ou oral, todos os dias por cinco dias ou LEVAQUIN® 500 mg IV ou oral, todos os dias por 10 dias.
As taxas de sucesso clínico (cura mais melhora) na população clinicamente avaliável foram de 90,9% no grupo LEVAQUIN® 750 mg e 91,1% no grupo LEVAQUIN® 500 mg. O IC de 95% para a diferença das taxas de resposta (LEVAQUIN® 750 menos LEVAQUIN® 500) foi [-5,9, 5,4]. Na população clinicamente avaliável (31-38 dias após a inscrição) pneumonia foi observada em 7 de 151 pacientes no grupo LEVAQUIN® 750 mg e 2 de 147 pacientes no grupo LEVAQUIN® 500 mg. Dado os pequenos números observados, a significância desse achado não pode ser determinada estatisticamente. A eficácia microbiológica do regime de 5 dias foi documentada para infecções listadas na Tabela 13.
Sinusite Bacteriana Aguda
Regimes de tratamento de 5 dias e 10 a 14 dias
LEVAQUIN® é aprovado para o tratamento de sinusite bacteriana aguda (SAB) usando 750 mg por via oral × 5 dias ou 500 mg por via oral uma vez ao dia × 10–14 dias. Para avaliar a segurança e eficácia de um curso curto de alta dose de LEVAQUIN®, 780 adultos ambulatoriais com sinusite bacteriana aguda determinada clínica e radiologicamente foram avaliados em um estudo duplo-cego, randomizado, prospectivo e multicêntrico comparando LEVAQUIN® 750 mg por via oral uma vez ao dia por cinco dias para LEVAQUIN® 500 mg por via oral uma vez ao dia por 10 dias.
As taxas de sucesso clínico (definidas como resolução completa ou parcial dos sinais e sintomas pré-tratamento de ABS a tal ponto que nenhum tratamento antibiótico adicional foi considerado necessário) na população avaliável microbiologicamente foi de 91,4% (139/152) no LEVAQUIN® Grupo 750 mg e 88,6% (132/149) no grupo LEVAQUIN® 500 mg na visita de teste de cura (TOC) (IC de 95% [-4,2, 10,0] para LEVAQUIN® 750 mg menos LEVAQUIN® 500 mg) .
As taxas de sucesso clínico por patógeno na população microbiologicamente avaliável que teve amostras obtidas por punção antral na entrada do estudo mostraram resultados comparáveis para os regimes de cinco e dez dias na visita de teste de cura 22 dias após o tratamento (consulte a Tabela 14) .
Infecções complicadas da pele e da estrutura da pele
Trezentos e noventa e nove pacientes foram inscritos em um estudo aberto, randomizado e comparativo para infecções complicadas da pele e da estrutura da pele. Os pacientes foram randomizados para receber LEVAQUIN® 750 mg uma vez ao dia (IV seguido de oral) ou um comparador aprovado por uma mediana de 10 ± 4,7 dias. Como é esperado em infecções complicadas da pele e da estrutura da pele, os procedimentos cirúrgicos foram realizados nos grupos LEVAQUIN® e comparadores. A cirurgia (incisão e drenagem ou desbridamento) foi realizada em 45% dos pacientes tratados com LEVAQUIN® e em 44% dos pacientes tratados com comparador, pouco antes ou durante o tratamento com antibióticos e fez parte integrante da terapia para esta indicação.
Entre aqueles que puderam ser avaliados clinicamente 2 a 5 dias após a conclusão do medicamento do estudo, as taxas gerais de sucesso (melhoradas ou curadas) foram 116/138 (84,1%) para pacientes tratados com LEVAQUIN® e 106/132 (80,3%) para pacientes tratados com o comparador.
As taxas de sucesso variaram com o tipo de diagnóstico, variando de 68% em pacientes com úlceras infectadas a 90% em pacientes com feridas infectadas e abscessos. Essas taxas foram equivalentes às observadas com medicamentos comparadores.
Prostatite Bacteriana Crônica
Pacientes adultos com diagnóstico clínico de prostatite e resultados de cultura microbiológica de amostras de urina coletadas após massagem prostática (VB3) ou amostras de secreção prostática expressa (EPS) obtidas através do procedimento de Meares-Stamey foram incluídos em um estudo multicêntrico, randomizado e duplo-cego comparando oral LEVAQUIN® 500 mg, uma vez ao dia por um total de 28 dias para ciprofloxacina oral 500 mg, duas vezes ao dia por um total de 28 dias. O endpoint primário de eficácia foi a eficácia microbiológica em pacientes microbiologicamente avaliáveis. Um total de 136 e 125 pacientes microbiologicamente avaliáveis foram inscritos nos grupos LEVAQUIN® e ciprofloxacina, respectivamente. A taxa de erradicação microbiológica por infecção do paciente em 5-18 dias após a conclusão da terapia foi de 75,0% no grupo LEVAQUIN® e 76,8% no grupo ciprofloxacina (IC de 95% [-12,58, 8,98] para LEVAQUIN® menos ciprofloxacina). As taxas gerais de erradicação para patógenos de interesse são apresentadas na Tabela 15.
As taxas de erradicação de S. epidermidis quando encontradas com outros co-patógenos são consistentes com as taxas observadas em isolados puros.
As taxas de sucesso clínico (cura + melhora sem necessidade de antibioticoterapia adicional) na população microbiologicamente avaliável 5-18 dias após a conclusão da terapia foram de 75,0% para pacientes tratados com LEVAQUIN® e 72,8% para pacientes tratados com ciprofloxacina (IC 95% [- 8,87, 13,27] para LEVAQUIN® menos ciprofloxacina). As taxas de sucesso clínico a longo prazo (24-45 dias após a conclusão da terapia) foram de 66,7% para os pacientes tratados com LEVAQUIN® e de 76,9% para os pacientes tratados com ciprofloxacina (IC de 95% [-23,40, 2,89] para LEVAQUIN® menos ciprofloxacina).
Infecções complicadas do trato urinário e pielonefrite aguda
Regime de Tratamento de 5 Dias
Para avaliar a segurança e eficácia da dose mais alta e do curso mais curto de LEVAQUIN®, 1.109 pacientes com ITUc e AP foram inscritos em um ensaio clínico randomizado, duplo-cego e multicêntrico realizado nos EUA de novembro de 2004 a abril de 2006 comparando LEVAQUIN® 750 mg IV ou oral uma vez ao dia por 5 dias (546 pacientes) com ciprofloxacina 400 mg IV ou 500 mg por via oral duas vezes ao dia por 10 dias (563 pacientes). Pacientes com PA complicada por doenças renais subjacentes ou condições como obstrução completa, cirurgia, transplante, infecção concomitante ou malformação congênita foram excluídos. A eficácia foi medida pela erradicação bacteriológica do(s) organismo(s) de linha de base na visita pós-terapia em pacientes com um patógeno identificado na linha de base. A visita pós-terapia (teste de cura) ocorreu 10 a 14 dias após a última dose ativa de LEVAQUIN® e 5 a 9 dias após a última dose de ciprofloxacina ativa.
As taxas gerais de cura bacteriológica para LEVAQUIN® e controle na visita de teste de cura (TOC) para o grupo de todos os pacientes com um patógeno documentado na linha de base (intenção modificada de tratar ou mITT) e o grupo de pacientes na população mITT que seguiram de perto o protocolo (Microbiologicamente Avaliado) estão resumidos na Tabela 16.
As taxas de erradicação microbiológica na população microbiologicamente avaliável no TOC para patógenos individuais recuperados de pacientes randomizados para tratamento com LEVAQUIN® são apresentadas na Tabela 17.
Infecções complicadas do trato urinário e pielonefrite aguda
Regime de Tratamento de 10 Dias
Para avaliar a segurança e eficácia da dose de 250 mg, regime de 10 dias de LEVAQUIN®, 567 pacientes com ITU não complicada, ITU leve a moderada e PA leve a moderada foram incluídos em um estudo multicêntrico, randomizado, duplo-cego ensaio clínico conduzido nos EUA de junho de 1993 a janeiro de 1995 comparando LEVAQUIN® 250 mg VO 1 vez ao dia por 10 dias (285 pacientes) com ciprofloxacina 500 mg VO 2 vezes ao dia por 10 dias (282 pacientes). Pacientes com patógeno resistente, ITU recorrente, mulheres acima de 55 anos e com cateter de demora foram inicialmente excluídos, antes da alteração do protocolo que ocorreu após 30% da inscrição. A eficácia microbiológica foi medida pela erradicação bacteriológica do(s) organismo(s) de linha de base em 1-12 dias após a terapia em pacientes com um patógeno identificado na linha de base.
As taxas gerais de cura bacteriológica para LEVAQUIN® e controle na visita de teste de cura (TOC) para o grupo de todos os pacientes com um patógeno documentado na linha de base (intenção modificada de tratar ou mITT) e o grupo de pacientes na população mITT que seguiram de perto o protocolo (Microbiologicamente Avaliado) estão resumidos na Tabela 18.
Antraz por inalação (pós-exposição)
A eficácia de LEVAQUIN® para esta indicação é baseada nas concentrações plasmáticas alcançadas em humanos, um desfecho substituto com probabilidade razoável de prever o benefício clínico. LEVAQUIN® não foi testado em humanos para prevenção pós-exposição de antraz por inalação. As concentrações plasmáticas médias de LEVAQUIN® associadas a uma melhora estatisticamente significativa na sobrevida em relação ao placebo no modelo de antraz inalatório em macaco rhesus são alcançadas ou excedidas em pacientes adultos e pediátricos que recebem os regimes de dosagem oral e intravenosa recomendados [ver INDICAÇÕES e DOSAGEM E ADMINISTRAÇÃO ].
farmacocinética da levofloxacina foi avaliada em pacientes adultos e pediátricos. A concentração plasmática máxima média (± DP) no estado de equilíbrio em adultos humanos recebendo 500 mg por via oral ou intravenosa uma vez ao dia é de 5,7 ± 1,4 e 6,4 ± 0,8 mcg/mL, respectivamente; e a exposição plasmática total correspondente (AUC) é 47,5 ± 6,7 e 54,6 ± 11,1 mcg.h/mL, respectivamente. Os parâmetros farmacocinéticos previstos no estado de equilíbrio em pacientes pediátricos com idade variando de 6 meses a 17 anos recebendo 8 mg/kg por via oral a cada 12 horas (não excedendo 250 mg por dose) foram calculados para serem comparáveis aos observados em adultos recebendo 500 mg por via oral uma vez ao dia [ver FARMACOLOGIA CLÍNICA ].
Os comprimidos LEVAQUIN® só podem ser administrados a pacientes pediátricos com antraz por inalação (pós-exposição) ou peste com peso igual ou superior a 30 kg devido às limitações das dosagens disponíveis [ver DOSAGEM E ADMINISTRAÇÃO ].
Em adultos, a segurança de LEVAQUIN® para tratamentos com duração de até 28 dias está bem caracterizada. No entanto, as informações relativas ao uso prolongado de 500 mg por dia até 60 dias são limitadas. A terapia prolongada com LEVAQUIN® em adultos só deve ser usada quando o benefício supera o risco.
Em pacientes pediátricos, a segurança da levofloxacina para tratamentos com duração superior a 14 dias não foi estudada. Um aumento da incidência de eventos adversos musculoesqueléticos (artralgia, artrite, tendinopatia, anormalidade da marcha) em comparação com controles foi observado em estudos clínicos com duração de tratamento de até 14 dias. Os dados de segurança a longo prazo, incluindo efeitos na cartilagem, após a administração de levofloxacina a pacientes pediátricos são limitados [ver AVISOS E PRECAUÇÕES e Uso em populações específicas ].
Foi realizado um estudo em animais controlado por placebo em macacos rhesus expostos a uma dose média inalada de 49 LD50 (~2,7 × 106) esporos (intervalo 17 – 118 LD50) de B. anthracis (estirpe Ames). A concentração inibitória mínima (CIM) de levofloxacina para a cepa de antraz usada neste estudo foi de 0,125 mcg/mL. Nos animais estudados, as concentrações plasmáticas médias de levofloxacina alcançadas no Tmax esperado (1 hora pós-dose) após administração oral até o estado de equilíbrio variaram de 2,79 a 4,87 mcg/mL. As concentrações mínimas no estado estacionário 24 horas após a dose variaram de 0,107 a 0,164 mcg/mL. A AUC0-24 no estado estacionário médio (SD) foi de 33,4 ± 3,2 mcg.h/mL (intervalo de 30,4 a 36,0 mcg.h/mL). A mortalidade devido ao antraz para animais que receberam um regime de 30 dias de LEVAQUIN® oral a partir de 24 horas após a exposição foi significativamente menor (1/10), em comparação com o grupo placebo (9/10) [P = 0,0011, 2 lados Fisher 39;s Teste Exato]. O único animal tratado com levofloxacina que morreu de antraz o fez após o período de administração do medicamento de 30 dias.
Praga
Os estudos de eficácia do LEVAQUIN® não puderam ser conduzidos em humanos com peste pneumônica por razões éticas e de viabilidade. Portanto, a aprovação desta indicação foi baseada em um estudo de eficácia realizado em animais.
As concentrações plasmáticas médias de LEVAQUIN® associadas a uma melhora estatisticamente significativa na sobrevida em relação ao placebo em um modelo de peste pneumônica de macaco verde africano são alcançadas ou excedidas em pacientes adultos e pediátricos recebendo os regimes de dosagem oral e intravenosa recomendados [ver INDICAÇÕES e DOSAGEM E ADMINISTRAÇÃO ].
farmacocinética da levofloxacina foi avaliada em pacientes adultos e pediátricos. A concentração plasmática máxima média (± DP) no estado de equilíbrio em adultos humanos recebendo 500 mg por via oral ou intravenosa uma vez ao dia é de 5,7 ± 1,4 e 6,4 ± 0,8 mcg/mL, respectivamente; e a exposição plasmática total correspondente (AUC0-24) é 47,5 ± 6,7 e 54,6 ± 11,1 mcg.h/mL, respectivamente. Os parâmetros farmacocinéticos previstos no estado de equilíbrio em pacientes pediátricos com idade variando de 6 meses a 17 anos recebendo 8 mg/kg por via oral a cada 12 horas (não excedendo 250 mg por dose) foram calculados para serem comparáveis aos observados em adultos recebendo 500 mg por via oral uma vez ao dia [ver FARMACOLOGIA CLÍNICA ]. Os comprimidos LEVAQUIN® só podem ser administrados a pacientes pediátricos com antraz por inalação (pós-exposição) ou peste com peso igual ou superior a 30 kg devido às limitações das dosagens disponíveis [ver DOSAGEM E ADMINISTRAÇÃO ].
Foi realizado um estudo em animais controlado por placebo em macacos verdes africanos expostos a uma dose média inalada de 65 LD (intervalo de 3 a 145 LD50) de Yersinia pestis (estirpe CO92). A concentração inibitória mínima (CIM) de levofloxacina para a cepa de Y. pestis utilizada neste estudo foi de 0,03 mcg/mL. As concentrações plasmáticas médias de levofloxacina alcançadas ao final de uma única infusão de 30 minutos variaram de 2,84 a 3,50 mcg/mL em macacos verdes africanos. As concentrações mínimas em 24 horas após a dose variaram de
INFORMAÇÃO DO PACIENTE
LEVAQUIN® (Deixe ah kwin) (levofloxacina) comprimidos
Qual é a informação mais importante que devo saber sobre LEVAQUIN 500mg?
LEVAQUIN 500mg, um antibiótico fluoroquinolona, pode causar sérios efeitos colaterais. Alguns desses efeitos colaterais graves podem ocorrer ao mesmo tempo e resultar em morte.
Se você tiver algum dos seguintes efeitos colaterais graves enquanto estiver tomando LEVAQUIN 500mg, você deve parar de tomar LEVAQUIN imediatamente e procurar ajuda médica imediatamente.
- Problemas de tendão podem acontecer em pessoas de todas as idades que tomam LEVAQUIN. Os tendões são cordões de tecido resistentes que conectam os músculos aos ossos. Alguns problemas de tendão incluem:
- dor
- inchaço
- lágrimas e inchaço dos tendões, incluindo a parte de trás do tornozelo (Aquiles), ombro, mão ou outros locais do tendão.
- O risco de ter problemas nos tendões enquanto toma LEVAQUIN é maior se:
- tem mais de 60 anos
- teve um transplante de rim, coração ou pulmão.
- Problemas nos tendões podem ocorrer em pessoas que não apresentam os fatores de risco acima quando tomam LEVAQUIN.
- Outras razões que podem aumentar o risco de problemas nos tendões podem incluir:
- atividade física ou exercício
- falência renal
- problemas de tendão no passado, como em pessoas com artrite reumatóide (AR)
- Pare de tomar LEVAQUIN imediatamente e procure ajuda médica imediatamente ao primeiro sinal de dor no tendão, inchaço ou inflamação. Evite fazer exercícios e usar a área afetada.
- A área mais comum de dor e inchaço é o tendão de Aquiles na parte de trás do tornozelo. Isso também pode acontecer com outros tendões. Você pode precisar de um antibiótico diferente que não seja uma fluoroquinolona para tratar sua infecção.
- A ruptura do tendão pode ocorrer enquanto você estiver tomando ou após terminar de tomar LEVAQUIN. Rupturas de tendão podem ocorrer dentro de horas ou dias após o uso de LEVAQUIN e ocorreram até vários meses após as pessoas terem terminado de tomar sua fluoroquinolona.
- Pare de tomar LEVAQUIN 750mg imediatamente e procure ajuda médica imediatamente se tiver algum dos seguintes sinais ou sintomas de ruptura do tendão:
- ouvir ou sentir um estalo ou estalo em uma área do tendão
- hematomas logo após uma lesão em uma área do tendão
- incapaz de mover a área afetada ou suportar peso
- dor
- queimando
- formigamento
- dormência
- fraqueza
O dano do nervo pode ser permanente.
- convulsões
- ouvir vozes, ver coisas ou sentir coisas que não estão lá (alucinações)
- sinta-se inquieto
- tremores
- sente-se ansioso ou nervoso
- confusão
- depressão
- problemas para dormir
- pesadelos
- sentir-se tonto ou tonto
- sentir-se mais desconfiado (paranóia)
- pensamentos ou atos suicidas
- dores de cabeça que não desaparecem, com ou sem visão turva
O que é LEVAQUIN?
LEVAQUIN 500mg é um medicamento antibiótico fluoroquinolona usado em adultos com 18 anos ou mais para tratar certas infecções causadas por certos germes chamados bactérias. Essas infecções bacterianas incluem:
- pneumonia nosocomial
- pneumonia adquirida na comunidade
- infecções da pele, complicadas e não complicadas
- infecção crônica da próstata
- germes de antraz por inalação
- praga
- infecções do trato urinário, complicadas e não complicadas
- infecção renal aguda (pielonefrite)
- infecção sinusal aguda
- agravamento agudo ou bronquite crônica
Estudos de LEVAQUIN para uso no tratamento de peste e antraz foram feitos apenas em animais, porque peste e antraz não podiam ser estudados em pessoas.
LEVAQUIN não deve ser usado em pacientes com infecções não complicadas do trato urinário, exacerbação bacteriana aguda de bronquite crônica ou sinusite bacteriana aguda se houver outras opções de tratamento disponíveis.
LEVAQUIN 750mg comprimidos também é usado para tratar crianças que pesam pelo menos 66 libras (ou pelo menos 30 kg) e podem ter inalado germes de antraz, ter peste ou ter sido expostas a germes da peste. Não se sabe se LEVAQUIN é seguro e eficaz em crianças com menos de 6 meses de idade.
A segurança e eficácia em crianças tratadas com LEVAQUIN® por mais de 14 dias não são conhecidas.
Quem não deve tomar LEVAQUIN 750mg?
Não tome LEVAQUIN: se já teve uma reação alérgica grave a um antibiótico conhecido como fluoroquinolona, ou se é alérgico à levofloxacina ou a qualquer um dos componentes de LEVAQUIN. Consulte o final deste folheto para obter uma lista completa dos ingredientes do LEVAQUIN.
Antes de tomar LEVAQUIN, informe o seu médico sobre todas as suas condições médicas, incluindo se você:
- tem problemas de tendão; LEVAQUIN 250mg não deve ser usado em pessoas com histórico de problemas nos tendões.
- tem um problema que causa fraqueza muscular (miastenia gravis); LEVAQUIN não deve ser utilizado em pessoas com história conhecida de miastenia gravis.
- tem problemas no sistema nervoso central, como convulsões (epilepsia).
- tem problemas nervosos; LEVAQUIN 250mg não deve ser usado em pacientes com histórico de um problema nervoso chamado neuropatia periférica.
- tem ou alguém da sua família tem batimentos cardíacos irregulares, especialmente uma condição chamada "prolongamento do intervalo QT".
- tem baixo nível de potássio no sangue (hipocalemia).
- tem problemas ósseos.
- tem problemas nas articulações, incluindo artrite reumatóide (AR).
- tem problemas renais. Você pode precisar de uma dose menor de LEVAQUIN se seus rins não funcionarem bem.
- tem problemas de fígado.
- tem diabetes ou problemas com baixo nível de açúcar no sangue (hipoglicemia).
- estão grávidas ou planejam engravidar. Não se sabe se LEVAQUIN 750mg irá prejudicar o feto.
- está amamentando ou planeja amamentar. Não se sabe se LEVAQUIN passa para o leite materno. Você e seu médico devem decidir se você vai tomar LEVAQUIN 250mg ou amamentar. Você não deve fazer ambos.
Informe o seu médico sobre todos os medicamentos que toma, incluindo medicamentos prescritos e de venda livre, vitaminas e suplementos de ervas.
LEVAQUIN e outros medicamentos podem afetar uns aos outros causando efeitos colaterais.
Informe especialmente o seu médico se você tomar:
- um medicamento esteróide.
- um medicamento antipsicótico.
- um antidepressivo tricíclico.
- uma pílula de água (diurético).
- certos medicamentos podem impedir que LEVAQUIN 750mg funcione corretamente. Tome LEVAQUIN® 2 horas antes ou 2 horas depois de tomar estes medicamentos ou suplementos:
- um antiácido, multivitamínico ou outros medicamentos ou suplementos que contenham magnésio, alumínio, ferro ou zinco
- sucralfato (Carafate®)
- didanosina (Videx®, Videx® EC)
- um anticoagulante (varfarina, Coumadin, Jantoven).
- um medicamento antidiabético oral ou insulina.
- um AINE (medicamento anti-inflamatório não esteróide). Muitos medicamentos comuns para alívio da dor são AINEs. Tomar um AINE enquanto toma LEVAQUIN 250 mg ou outras fluoroquinolonas pode aumentar o risco de convulsões e efeitos no sistema nervoso central.
- teofilina (Theo-24®, Elixophyllin®, Theochron®, Uniphyl®, Theolair®).
- um medicamento para controlar a sua frequência ou ritmo cardíaco (antiarrítmicos).
Pergunte ao seu médico se não tiver certeza se algum dos seus medicamentos está listado acima. Conheça os medicamentos que você toma. Mantenha uma lista de seus medicamentos e mostre-a ao seu médico e farmacêutico quando receber um novo medicamento.
Como devo tomar LEVAQUIN 500mg?
- Tome LEVAQUIN exatamente como seu médico lhe disse para tomá-lo.
- Tome LEVAQUIN 750mg aproximadamente à mesma hora todos os dias.
- Beba muitos líquidos enquanto toma LEVAQUIN.
- LEVAQUIN pode ser tomado com ou sem alimentos.
- Se você esquecer de uma dose de LEVAQUIN 500mg, tome-a assim que se lembrar. Não tome mais de 1 dose em 1 dia.
- Não pule nenhuma dose de LEVAQUIN 750mg ou pare de tomá-lo, mesmo que comece a se sentir melhor, até terminar o tratamento prescrito, a menos que:
- você tem problemas de tendão. Ver "Qual é a informação mais importante que devo saber sobre LEVAQUIN 500mg?".
- você tem um problema nervoso. Ver "Quais são os possíveis efeitos colaterais do LEVAQUIN?".
- você tem um problema no sistema nervoso central. Ver "Quais são os possíveis efeitos colaterais do LEVAQUIN 750mg?".
- você tem uma reação alérgica grave. Ver "Quais são os possíveis efeitos colaterais do LEVAQUIN 250mg?".
- seu médico lhe diz para parar de tomar LEVAQUIN.
Tomar todas as suas doses de LEVAQUIN 500mg ajudará a garantir que todas as bactérias sejam mortas. Tomar todas as suas doses de LEVAQUIN 250mg irá ajudá-lo a diminuir a chance de que as bactérias se tornem resistentes a LEVAQUIN. Se sua infecção não melhorar enquanto você toma LEVAQUIN 750mg, isso pode significar que as bactérias que causam sua infecção podem ser resistentes a LEVAQUIN. Se a infecção não melhorar, ligue para o seu médico. Se a sua infecção não melhorar, LEVAQUIN e outros medicamentos antibióticos semelhantes podem não funcionar para você no futuro.
- Se você tomar LEVAQUIN demais, ligue para o seu médico ou procure ajuda médica imediatamente.
O que devo evitar ao tomar LEVAQUIN 500mg?
- LEVAQUIN pode causar tonturas e vertigens. Não faça dirigir, operar máquinas ou realizar outras atividades que exijam atenção ou coordenação mental até saber como LEVAQUIN o afeta.
- Evite lâmpadas solares, camas de bronzeamento e tente limitar seu tempo ao sol. LEVAQUIN 750mg pode tornar a sua pele sensível ao sol (fotossensibilidade) e à luz de lâmpadas solares e câmaras de bronzeamento. Você pode ter queimaduras solares graves, bolhas ou inchaço da pele. Se tiver algum destes sintomas enquanto estiver a tomar LEVAQUIN, contacte o seu médico imediatamente. Você deve usar um protetor solar e usar um chapéu e roupas que cubram a pele se tiver que ficar na luz solar.
Quais são os possíveis efeitos colaterais do LEVAQUIN 750mg?
LEVAQUIN 750mg pode causar efeitos colaterais graves, incluindo:
- Ver "Qual é a informação mais importante que devo saber sobre LEVAQUIN 250mg?"
- Reações alérgicas graves.
Reações alérgicas podem ocorrer em pessoas que tomam fluoroquinolonas, incluindo LEVAQUIN 500mg, mesmo após apenas 1 dose. Pare de tomar LEVAQUIN 500mg e procure ajuda médica de emergência imediatamente se tiver algum dos seguintes sintomas de uma reação alérgica grave:
- urticária
- dificuldade para respirar ou engolir
- inchaço dos lábios, língua, rosto
- aperto na garganta, rouquidão
- batimento cardíaco acelerado
- desmaiar
- erupção cutânea
erupção cutânea pode ocorrer em pessoas tomando LEVAQUIN 500mg, mesmo após apenas 1 dose. Pare de tomar LEVAQUIN 250mg ao primeiro sinal de erupção cutânea e ligue imediatamente para o seu médico. A erupção cutânea pode ser um sinal de uma reação mais grave ao LEVAQUIN.
- Danos no fígado (hepatotoxicidade): A hepatotoxicidade pode ocorrer em pessoas que tomam LEVAQUIN®. Ligue para o seu médico imediatamente se tiver sintomas inexplicáveis, como:
- náusea ou vômito
- dor de estômago
- febre
- fraqueza
- dor ou sensibilidade abdominal
- coceira
- cansaço incomum
- perda de apetite
- movimentos intestinais de cor clara
- urina de cor escura
- amarelecimento da pele ou do branco dos olhos
Pare de tomar LEVAQUIN 750mg e informe o seu médico imediatamente se tiver amarelamento da pele ou da parte branca dos olhos, ou se tiver urina escura. Estes podem ser sinais de uma reação grave ao LEVAQUIN (um problema no fígado).
- Infecção intestinal (colite pseudomembranosa) colite pseudomembranosa pode ocorrer com muitos antibióticos, incluindo LEVAQUIN. Ligue para o seu médico imediatamente se tiver diarreia aquosa, diarreia que não desaparece ou fezes com sangue. Você pode ter cólicas estomacais e febre. A colite pseudomembranosa pode ocorrer 2 ou mais meses após o término do antibiótico.
- Alterações graves do ritmo cardíaco (prolongamento do intervalo QT e torsades depointes) Informe o seu médico imediatamente se tiver uma alteração no seu batimento cardíaco (batimento cardíaco rápido ou irregular) ou se desmaiar. LEVAQUIN 250mg pode causar um problema cardíaco raro conhecido como prolongamento do intervalo QT. Esta condição pode causar um batimento cardíaco anormal e pode ser muito perigoso. As chances de isso acontecer são maiores nas pessoas:
- que são idosos
- com história familiar de intervalo QT prolongado
- com baixo teor de potássio no sangue (hipocalemia)
- que tomam certos medicamentos para controlar o ritmo cardíaco (antiarrítmicos)
- Problemas comuns Aumento da chance de problemas com articulações e tecidos ao redor das articulações em crianças pode acontecer. Informe o profissional de saúde do seu filho se ele tiver algum problema nas articulações durante ou após o tratamento com LEVAQUIN.
- Alterações no açúcar no sangue As pessoas que tomam LEVAQUIN e outros medicamentos fluoroquinolonas com medicamentos antidiabéticos orais ou com insulina podem apresentar níveis baixos de açúcar no sangue (hipoglicemia) e níveis elevados de açúcar no sangue (hiperglicemia). Siga as instruções do seu médico sobre com que frequência verificar o açúcar no sangue. Se você tem diabetes e tem baixo nível de açúcar no sangue enquanto estiver tomando LEVAQUIN, pare de tomar LEVAQUIN 500mg e ligue para o seu médico imediatamente. Seu medicamento antibiótico pode precisar ser alterado.
- Sensibilidade à luz solar (fotossensibilidade) Ver "O que devo evitar ao tomar LEVAQUIN?" Os efeitos colaterais mais comuns de LEVAQUIN 250mg incluem:
- náusea
- dor de cabeça
- diarréia
- insônia
- constipação
- tontura
Em crianças de 6 meses ou mais que tomam LEVAQUIN para tratar a doença do antraz ou peste, vômitos também são comuns.
LEVAQUIN pode causar resultados falso-positivos de triagem de urina para opiáceos quando o teste é feito com alguns kits comercialmente disponíveis. Um resultado positivo deve ser confirmado usando um teste mais específico. Estes não são todos os possíveis efeitos colaterais do LEVAQUIN.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA pelo telefone 1-800-FDA-1088.
Como devo armazenar o LEVAQUIN 250mg?
- Armazene LEVAQUIN 500mg em temperatura ambiente entre 59°F a 86°F (15°C a 30°C).
- Manter LEVAQUIN 500mg em recipiente bem fechado.
Informações gerais sobre o uso seguro e eficaz de LEVAQUIN.
Os medicamentos às vezes são prescritos para outros fins que não os listados em um Guia de Medicamentos. Não use LEVAQUIN para uma condição para a qual não foi prescrito. Não dê LEVAQUIN 500mg a outras pessoas, mesmo que tenham os mesmos sintomas que você. Pode prejudicá-los. Este Guia de Medicação resume as informações mais importantes sobre LEVAQUIN. Se você quiser mais informações sobre LEVAQUIN 750mg, fale com seu médico. Você pode pedir ao seu médico ou farmacêutico informações sobre LEVAQUIN 500mg que foi escrito para profissionais de saúde.
Quais são os ingredientes de LEVAQUIN 500mg?
Ingrediente ativo: levofloxacina
Ingredientes inativos : crospovidona, hipromelose, estearato de magnésio, celulose microcristalina, polietilenoglicol, polissorbato 80, dióxido de titânio.
Os comprimidos de LEVAQUIN 250 mg também contêm óxido de ferro vermelho sintético.
Os comprimidos de LEVAQUIN 500 mg também contêm óxido de ferro vermelho sintético e óxido de ferro amarelo sintético.
Este Guia de Medicação foi aprovado pela Food and Drug Administration dos EUA
