Omnicef 300mg Cefdinir Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Omnicef e como é usado?
Omnicef (cefdinir) é um antibiótico cefalosporínico usado para tratar muitos tipos diferentes de infecções causadas por bactérias. A marca Omnicef é descontinuada nos EUA. Omnicef está disponível na forma genérica.
Quais são os efeitos colaterais do Omnicef?
Os efeitos colaterais comuns de Omnicef 300mg incluem:
- diarréia,
- náusea,
- vômito,
- dor de estômago,
- indigestão,
- dor de cabeça,
- tontura,
- assaduras em uma criança tomando cefdinir líquido,
- coceira, ou
- erupção cutânea,
Observação: Esta lista pode não incluir todos os efeitos colaterais possíveis.
Para reduzir o desenvolvimento de bactérias resistentes a medicamentos e manter a eficácia de OMNICEF 300mg e outros medicamentos antibacterianos, OMNICEF deve ser usado apenas para tratar ou prevenir infecções comprovadas ou fortemente suspeitas de serem causadas por bactérias.
DESCRIÇÃO
As cápsulas de OMNICEF (cefdinir) e OMNICEF (cefdinir) para suspensão oral contêm o ingrediente ativo cefdinir, uma cefalosporina semissintética de espectro estendido, para administração oral. Quimicamente, cefdinir é [6R-[6α, 7β (Z)]]-7-[[(2-amino-4-tiazolil)(hidroxiimino)acetil]amino]3-etenil-8-oxo-5-tia-1 ácido -azabiciclo[4.2.0]oct-2-eno-2-carboxílico. O cefdinir é um sólido branco a ligeiramente amarelo acastanhado. É ligeiramente solúvel em ácido clorídrico diluído e moderadamente solúvel em tampão fosfato 0,1 M pH 7,0. A fórmula empírica é C14H13N5O5S2 e o peso molecular é 395,42. Cefdinir tem a fórmula estrutural mostrada abaixo:
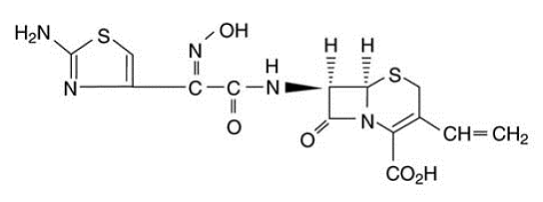
As cápsulas OMNICEF 300mg contêm 300 mg de cefdinir e os seguintes ingredientes inativos: carboximetilcelulose cálcio, NF; estearato de polioxil 40, NF; e estearato de magnésio, NF. Os invólucros das cápsulas contêm FD&C Blue #1; FD&C Vermelho #40; D&C Vermelho #28; dióxido de titânio, NF; gelatina, NF; dióxido de silício, NF; e lauril sulfato de sódio, NF.
OMNICEF 300mg para Suspensão Oral, após reconstituição, contém 125 mg de cefdinir por 5 mL ou 250 mg de cefdinir por 5 mL e os seguintes ingredientes inativos: sacarose, NF; ácido cítrico, USP; citrato de sódio, USP; benzoato de sódio, NF; goma xantana, NF; goma de guar, NF; sabores artificiais de morango e creme; dióxido de silício, NF; e estearato de magnésio, NF.
INDICAÇÕES
Para reduzir o desenvolvimento de bactérias resistentes a medicamentos e manter a eficácia de OMNICEF 300mg e outros medicamentos antibacterianos, OMNICEF 300mg deve ser usado apenas para tratar ou prevenir infecções comprovadamente ou fortemente suspeitas de serem causadas por bactérias suscetíveis. Quando as informações de cultura e suscetibilidade estiverem disponíveis, elas devem ser consideradas na seleção ou modificação da terapia antibacteriana. Na ausência de tais dados, a epidemiologia local e os padrões de suscetibilidade podem contribuir para a seleção empírica da terapia.
OMNICEF (cefdinir) cápsulas e OMNICEF (cefdinir) para suspensão oral são indicados para o tratamento de pacientes com infecções leves a moderadas causadas por cepas sensíveis dos microrganismos designados nas condições listadas abaixo.
Adultos e Adolescentes
Pneumonia adquirida na comunidade
causada por Haemophilus influenzae (incluindo cepas produtoras de β-lactamase), Haemophilus parainfluenzae (incluindo cepas produtoras de β-lactamase), Streptococcus pneumoniae (somente cepas sensíveis à penicilina) e Moraxella catarrhalis (incluindo cepas produtoras de β-lactamase) (ver Estudos clínicos ).
Exacerbações agudas da bronquite crônica
causada por Haemophilus influenzae (incluindo cepas produtoras de β-lactamase), Haemophilus parainfluenzae (incluindo cepas produtoras de β-lactamase), Streptococcus pneumoniae (somente cepas sensíveis à penicilina) e Moraxella catarrhalis (incluindo cepas produtoras de β-lactamase).
Sinusite Maxilar Aguda
causada por Haemophilus influenzae (incluindo cepas produtoras de β-lactamase), Streptococcus pneumoniae (somente cepas sensíveis à penicilina) e Moraxella catarrhalis (incluindo cepas produtoras de βlactamase).
NOTA: Para informações sobre o uso em pacientes pediátricos, consulte Uso Pediátrico e DOSAGEM E ADMINISTRAÇÃO .
Faringite/Amigdalite
causada por Streptococcus pyogenes (ver Estudos clínicos ).
NOTA: Cefdinir é eficaz na erradicação de S. pyogenes da orofaringe. No entanto, o cefdinir não foi estudado para a prevenção da febre reumática após faringite/amigdalite por S. pyogenes. Apenas a penicilina intramuscular demonstrou ser eficaz na prevenção da febre reumática.
Infecções não complicadas da pele e da estrutura da pele
causada por Staphylococcus aureus (incluindo cepas produtoras de β-lactamase) e Streptococcus pyogenes.
Pacientes pediátricos
Otite Média Bacteriana Aguda causada por Haemophilus influenzae (incluindo cepas produtoras de β-lactamase), Streptococcus pneumoniae (somente cepas sensíveis à penicilina) e Moraxella catarrhalis (incluindo cepas produtoras de β-lactamase).
Faringite/Amigdalite
causada por Streptococcus pyogenes (ver Estudos clínicos ).
NOTA: Cefdinir é eficaz na erradicação de S. pyogenes da orofaringe. No entanto, o cefdinir não foi estudado para a prevenção da febre reumática após faringite/amigdalite por S. pyogenes. Apenas a penicilina intramuscular demonstrou ser eficaz na prevenção da febre reumática.
Infecções não complicadas da pele e da estrutura da pele
causada por Staphylococcus aureus (incluindo cepas produtoras de β-lactamase) e Streptococcus pyogenes.
DOSAGEM E ADMINISTRAÇÃO
(Vejo INDICAÇÕES E USO por Patógenos indicados )
Cápsulas
A dosagem recomendada e a duração do tratamento para infecções em adultos e adolescentes estão descritas na tabela a seguir; a dose diária total para todas as infecções é de 600 mg. A dosagem uma vez ao dia por 10 dias é tão eficaz quanto a dosagem BID. A dosagem de uma vez ao dia não foi estudada em pneumonia ou infecções de pele; portanto, as cápsulas de OMNICEF devem ser administradas duas vezes ao dia nessas infecções. As cápsulas de OMNICEF podem ser tomadas independentemente das refeições.
Adultos e Adolescentes (A partir de 13 anos)
PóPara Suspensão Oral
dosagem recomendada e a duração do tratamento para infecções em pacientes pediátricos estão descritas na tabela a seguir; a dose diária total para todas as infecções é de 14 mg/kg, até uma dose máxima de 600 mg por dia. A dosagem uma vez ao dia por 10 dias é tão eficaz quanto a dosagem BID. A dosagem de uma vez ao dia não foi estudada em infecções de pele; portanto, OMNICEF 300mg para Suspensão Oral deve ser administrado duas vezes ao dia nesta infecção. OMNICEF para Suspensão Oral pode ser administrado independentemente das refeições.
Pacientes pediátricos (idade de 6 meses a 12 anos)
OMNICEF PARA SUSPENSÃO ORAL TABELA DE DOSAGEM PEDIÁTRICA
Pacientes com Insuficiência Renal
Para pacientes adultos com clearance de creatinina
depuração de creatinina é difícil de medir em pacientes ambulatoriais. No entanto, a seguinte fórmula pode ser usada para estimar a depuração de creatinina (CLcr) em pacientes adultos. Para que as estimativas sejam válidas, os níveis de creatinina sérica devem refletir os níveis de estado de equilíbrio da função renal.
onde a depuração de creatinina está em mL/min, a idade está em anos, o peso está em quilogramas e a creatinina sérica está em mg/dL.4
A seguinte fórmula pode ser usada para estimar a depuração de creatinina em pacientes pediátricos:
CLcr = K × comprimento ou altura do corpo/creatinina sérica
onde K = 0,55 para pacientes pediátricos com mais de 1 ano5 e 0,45 para lactentes (até 1 ano)6.
Na equação acima, a depuração de creatinina está em mL/min/1,73 m², o comprimento ou altura do corpo está em centímetros e a creatinina sérica está em mg/dL.
Para pacientes pediátricos com depuração de creatinina
Pacientes em hemodiálise
hemodiálise remove o cefdinir do corpo. Em pacientes mantidos em hemodiálise crônica, o regime posológico inicial recomendado é de 300 mg ou 7 mg/kg em dias alternados.
Ao final de cada sessão de hemodiálise, devem ser administrados 300 mg (ou 7 mg/kg). As doses subsequentes (300 mg ou 7 mg/kg) são então administradas em dias alternados.
Instruções para misturar Omnicef 300mg para suspensão oral
Após a mistura, a suspensão pode ser armazenada à temperatura ambiente (25°C/77°F). O recipiente deve ser mantido bem fechado e a suspensão deve ser bem agitada antes de cada administração. A suspensão pode ser usada por 10 dias, após os quais qualquer porção não utilizada deve ser descartada.
COMO FORNECIDO
Cápsulas OMNICEF , contendo 300 mg de cefdinir, na forma de cápsulas de lavanda e turquesa impressas com o nome do produto, estão disponíveis da seguinte forma:
60 cápsulas/garrafa NDC 0074-3769-60 Embalagem OMNI-PAC™ de 3 unidades de uso, 5 dias, 10 cápsulas NDC 0074-3769-30
OMNICEF 300mg para Suspensão Oral é uma formulação em pó de cor creme que, quando reconstituída conforme indicado, contém 125 mg de cefdinir/5 mL ou 250 mg de cefdinir/5 mL. As suspensões reconstituídas têm cor creme e sabor a morango. O pó está disponível da seguinte forma:
125 mg/5 mL
frascos de 60 ml NDC 0074-3771-60 Frascos de 100 mL NDC 0074-3771-13 Frascos de 250 mg/5 mL de 60 mL NDC 0074-6151-60 Frascos de 100 mL NDC 0074-6151-13
Armazene as cápsulas e o pó não suspenso a 25°C (77°F); excursões permitidas para 15°-30°C (59°-86°F) [veja USP Controlled Room Temperature]. Uma vez reconstituída, a suspensão oral pode ser armazenada em temperatura ambiente controlada por 10 dias.
Fabricado por: CEPH International Corporation Carolina, Porto Rico 00986. Para: AbbVie Inc., North Chicago, IL 60064, EUA, sob licença de: Astellas Pharma Inc. Tóquio, Japão. Revisado em novembro de 2015
EFEITOS COLATERAIS
Eventos adversos
Ensaios Clínicos - Cápsulas OMNICEF (pacientes adultos e adolescentes)
Em ensaios clínicos, 5.093 pacientes adultos e adolescentes (3.841 americanos e 1.252 não americanos) foram tratados com a dose recomendada de cápsulas de cefdinir (600 mg/dia). A maioria dos eventos adversos foi leve e autolimitada. Nenhuma morte ou incapacidade permanente foi atribuída ao cefdinir. Cento e quarenta e sete de 5.093 (3%) pacientes descontinuaram a medicação devido a eventos adversos considerados pelos investigadores como possivelmente, provavelmente ou definitivamente associados à terapia com cefdinir. As descontinuações foram principalmente por distúrbios gastrointestinais, geralmente diarréia ou náusea. Dezenove de 5.093 (0,4%) pacientes foram descontinuados devido a erupções cutâneas relacionadas à administração de cefdinir.
Nos EUA, os seguintes eventos adversos foram considerados pelos investigadores como possivelmente, provavelmente ou definitivamente relacionados às cápsulas de cefdinir em ensaios clínicos de dose múltipla (N = 3841 pacientes tratados com cefdinir):
EVENTOS ADVERSOS ASSOCIADOS A CÁPSULAS DE CEFDINIR US ENSAIOS EM PACIENTES ADULTOS E ADOLESCENTES (N = 3841)a
As seguintes alterações de valor laboratorial de possível significado clínico, independentemente da relação com a terapia com cefdinir, foram observadas durante os ensaios clínicos realizados nos EUA:
MUDANÇAS DE VALOR DE LABORATÓRIO OBSERVADAS COM CÁPSULAS DE CEFDINIR US ENSAIOS EM PACIENTES ADULTOS E ADOLESCENTES (N = 3841)
Ensaios Clínicos - OMNICEF Para Suspensão Oral (Pacientes Pediátricos)
Em ensaios clínicos, 2.289 pacientes pediátricos (1.783 americanos e 506 não americanos) foram tratados com a dose recomendada de suspensão de cefdinir (14 mg/kg/dia). A maioria dos eventos adversos foi leve e autolimitada. Nenhuma morte ou incapacidade permanente foi atribuída ao cefdinir. Quarenta de 2.289 (2%) pacientes descontinuaram a medicação devido a eventos adversos considerados pelos investigadores como possivelmente, provavelmente ou definitivamente associados à terapia com cefdinir. As descontinuações foram principalmente por distúrbios gastrointestinais, geralmente diarreia. Cinco dos 2.289 (0,2%) pacientes foram descontinuados devido a erupções cutâneas relacionadas à administração de cefdinir.
Nos EUA, os seguintes eventos adversos foram considerados pelos investigadores como possivelmente, provavelmente ou definitivamente relacionados à suspensão de cefdinir em ensaios clínicos de dose múltipla (N = 1.783 pacientes tratados com cefdinir):
EVENTOS ADVERSOS ASSOCIADOS À SUSPENSÃO DE CEFDINIR NOS ENSAIOS EM PACIENTES PEDIÁTRICOS (N = 1783)a
NOTA: Em pacientes tratados com cefdinir e controle, as taxas de diarreia e erupção cutânea foram maiores nos pacientes pediátricos mais jovens. A incidência de diarreia em pacientes tratados com cefdinir ≤ 2 anos de idade foi de 17% (95/557) em comparação com 4% (51/1226) naqueles > 2 anos. A incidência de erupções cutâneas (principalmente assaduras em pacientes mais jovens) foi de 8% (43/557) em pacientes ≤ 2 anos de idade em comparação com 1% (8/1226) naqueles > 2 anos de idade.
As seguintes alterações de valor laboratorial de possível significado clínico, independentemente da relação com a terapia com cefdinir, foram observadas durante os ensaios clínicos realizados nos EUA:
ALTERAÇÕES DE VALORES LABORATORIAIS DE POSSÍVEL SIGNIFICAÇÃO CLÍNICA OBSERVADAS COM A SUSPENSÃO DE CEFDINIR EM ENSAIOS DOS EUA EM PACIENTES PEDIÁTRICOS (N = 1783)
Experiência pós-marketing
As seguintes experiências adversas e testes laboratoriais alterados, independentemente de sua relação com cefdinir, foram relatados durante extensa experiência pós-comercialização, começando com a aprovação no Japão em 1991: choque, anafilaxia com casos raros de fatalidade, edema facial e laríngeo, sensação de asfixia, reações semelhantes à doença do soro, conjuntivite, estomatite, síndrome de Stevens-Johnson, necrólise epidérmica tóxica, dermatite esfoliativa, eritema multiforme, eritema nodoso, hepatite aguda, colestase, hepatite fulminante, insuficiência hepática, icterícia, aumento da amilase, enterocolite aguda, diarreia sanguinolenta, colite hemorrágica, melena, colite pseudomembranosa, pancitopenia, granulocitopenia, leucopenia, trombocitopenia, púrpura trombocitopênica idiopática, anemia hemolítica, insuficiência respiratória aguda, ataque asmático, pneumonia induzida por drogas, pneumonia eosinofílica, pneumonia intersticial idiopática, febre, insuficiência renal aguda, nefropatia, tendência a sangramento, coagulação disfuncional ordem, coagulação intravascular disseminada, sangramento GI superior, úlcera péptica, íleo, perda de consciência, vasculite alérgica, possível interação cefdinir-diclofenaco, insuficiência cardíaca, dor torácica, infarto do miocárdio, hipertensão, movimentos involuntários e rabdomiólise.
Eventos Adversos da Classe das Cefalosporinas
Os seguintes eventos adversos e testes laboratoriais alterados foram relatados para antibióticos da classe das cefalosporinas em geral:
Reações alérgicas, anafilaxia, síndrome de Stevens-Johnson, eritema multiforme, necrólise epidérmica tóxica, disfunção renal, nefropatia tóxica, disfunção hepática incluindo colestase, anemia aplástica, anemia hemolítica, hemorragia, teste falso-positivo para glicose urinária, neutropenia, pancitopenia e agranulocitose . Os sintomas de colite pseudomembranosa podem começar durante ou após o tratamento com antibióticos (ver AVISOS ).
Várias cefalosporinas foram implicadas no desencadeamento de convulsões, particularmente em pacientes com insuficiência renal quando a dosagem não foi reduzida (ver DOSAGEM E ADMINISTRAÇÃO e SUPERDOSAGEM ). Se ocorrerem convulsões associadas à terapia medicamentosa, o medicamento deve ser descontinuado. A terapia anticonvulsivante pode ser administrada se clinicamente indicada.
INTERAÇÕES MEDICAMENTOSAS
Antiácidos (contendo alumínio ou magnésio)
administração concomitante de cápsulas de 300 mg de cefdinir com 30 mL de suspensão de Maalox® TC reduz a taxa (Cmax) e a extensão (AUC) de absorção em aproximadamente 40%. O tempo para atingir Cmax também é prolongado em 1 hora. Não há efeitos significativos na farmacocinética do cefdinir se o antiácido for administrado 2 horas antes ou 2 horas após o cefdinir. Se forem necessários antiácidos durante a terapia com OMNICEF 300mg, OMNICEF 300mg deve ser tomado pelo menos 2 horas antes ou depois do antiácido.
probenecida
Tal como acontece com outros antibióticos β-lactâmicos, a probenecida inibe a excreção renal de cefdinir, resultando em uma duplicação aproximada da AUC, um aumento de 54% nos níveis plasmáticos de pico de cefdinir e um prolongamento de 50% na t½ de eliminação aparente.
Suplementos de ferro e alimentos fortificados com ferro
administração concomitante de cefdinir com um suplemento terapêutico de ferro contendo 60 mg de ferro elementar (como FeSO4) ou vitaminas suplementadas com 10 mg de ferro elementar reduziu a extensão da absorção em 80% e 31%, respectivamente. Se suplementos de ferro forem necessários durante a terapia com OMNICEF 300mg, OMNICEF deve ser tomado pelo menos 2 horas antes ou depois do suplemento.
O efeito de alimentos altamente fortificados com ferro elementar (principalmente cereais matinais fortificados com ferro) na absorção de cefdinir não foi estudado.
A fórmula infantil fortificada com ferro administrada concomitantemente (2,2 mg de ferro elementar/6 oz) não tem efeito significativo na farmacocinética do cefdinir. Portanto, OMNICEF para Suspensão Oral pode ser administrado com fórmula infantil fortificada com ferro.
Houve relatos de fezes avermelhadas em pacientes recebendo cefdinir. Em muitos casos, os pacientes também estavam recebendo produtos contendo ferro. A cor avermelhada deve-se à formação de um complexo não absorvível entre o cefdinir ou seus produtos de degradação e o ferro no trato gastrointestinal.
Interações Medicamentos/Testes Laboratoriais
Uma reação falso-positiva para cetonas na urina pode ocorrer com testes usando nitroprussiato, mas não com aqueles que usam nitroferricianido. A administração de cefdinir pode resultar em uma reação falso-positiva para glicose na urina usando Clinitest®, solução de Benedict ou solução de Fehling. Recomenda-se a utilização de testes de glicose baseados em reações enzimáticas de glicose oxidase (como Clinistix® ou Tes-Tape®). As cefalosporinas são conhecidas por ocasionalmente induzir um teste de Coombs direto positivo.
AVISOS
ANTES DA INSTITUIÇÃO DA TERAPIA COM OMNICEF (CEFDINIR), DEVE-SE FAZER UMA PESQUISA CUIDADOSA PARA DETERMINAR SE O PACIENTE TEVE REAÇÕES ANTERIORES DE HIPERSENSIBILIDADE A CEFDINIR, OUTRAS CEFALOSPORINAS, PENICILINAS OU OUTRAS DROGAS. SE O CEFDINIR DEVE SER ADMINISTRADO A PACIENTES SENSÍVEIS À PENICILINA, CUIDADO DEVE SER EXECUTADO, POIS A HIPERSENSIBILIDADE CRUZADA ENTRE ANTIBIÓTICOS β-LACTAM FOI CLARAMENTE DOCUMENTADA E PODE OCORRER EM ATÉ 10% DOS PACIENTES COM HISTÓRICO DE ALERGIA À PENICILINA. SE OCORRER UMA REAÇÃO ALÉRGICA AO CEFDINIR, O MEDICAMENTO DEVE SER DESCONTINUADO. REAÇÕES DE HIPERSENSIBILIDADE AGUDAS GRAVES PODEM REQUER TRATAMENTO COM EPINEFRINA E OUTRAS MEDIDAS DE EMERGÊNCIA, INCLUINDO OXIGÊNIO, LÍQUIDOS INTRAVENOSOS, ANTI-HISTAMÍNICOS INTRAVENOSOS, CORTICOSTEROIDES, AMINAS PRESSORA E MANEJO DAS VIAS RESPIRATÓRIAS, CONFORME INDICADO CLÍNICAMENTE.
Diarreia associada a Clostridium difficile (CDAD) foi relatada com o uso de quase todos os agentes antibacterianos, incluindo OMNICEF, e pode variar em gravidade de diarreia leve a colite fatal. O tratamento com agentes antibacterianos altera a flora normal do cólon levando ao crescimento excessivo de C. difficile.
C. difficile produz toxinas A e B que contribuem para o desenvolvimento de CDAD. Cepas produtoras de hipertoxina de C. difficile causam aumento da morbidade e mortalidade, pois essas infecções podem ser refratárias à terapia antimicrobiana e podem exigir colectomia. CDAD deve ser considerado em todos os pacientes que apresentam diarreia após o uso de antibacterianos. É necessário um histórico médico cuidadoso, pois foi relatado que a CDAD ocorre mais de dois meses após a administração de agentes antibacterianos.
Se houver suspeita ou confirmação de CDAD, o uso contínuo de antibacterianos não direcionados contra C. difficile pode precisar ser descontinuado. O manejo adequado de fluidos e eletrólitos, suplementação proteica, tratamento antibacteriano de C. difficile e avaliação cirúrgica devem ser instituídos conforme indicação clínica.
PRECAUÇÕES
Em geral
A prescrição de OMNICEF 300mg na ausência de infecção bacteriana comprovada ou fortemente suspeita ou indicação profilática provavelmente não trará benefícios ao paciente e aumenta o risco de desenvolvimento de bactérias resistentes aos medicamentos.
Tal como acontece com outros antibióticos de amplo espectro, o tratamento prolongado pode resultar no possível surgimento e crescimento excessivo de organismos resistentes. A observação cuidadosa do paciente é essencial. Se ocorrer superinfecção durante a terapia, uma terapia alternativa apropriada deve ser administrada.
Cefdinir, assim como outros antimicrobianos de amplo espectro (antibióticos), deve ser prescrito com cautela em indivíduos com histórico de colite.
Em pacientes com insuficiência renal transitória ou persistente (clearance de creatinina DOSAGEM E ADMINISTRAÇÃO ).
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
O potencial carcinogênico do cefdinir não foi avaliado. Não foram observados efeitos mutagênicos no ensaio de mutação reversa bacteriana (Ames) ou no ensaio de mutação pontual no locus da hipoxantina-guanina fosforibosiltransferase (HGPRT) em células pulmonares de hamster chinês V79. Nenhum efeito clastogênico foi observado in vitro no ensaio de aberração cromossômica estrutural em células pulmonares de hamster chinês V79 ou in vivo no ensaio de micronúcleo em medula óssea de camundongo. Em ratos, a fertilidade e o desempenho reprodutivo não foram afetados pelo cefdinir em doses orais de até 1.000 mg/kg/dia (70 vezes a dose humana com base em mg/kg/dia, 11 vezes com base em mg/m²/dia).
Gravidez
Efeitos teratogênicos
Gravidez Categoria B
cefdinir não foi teratogênico em ratos em doses orais de até 1.000 mg/kg/dia (70 vezes a dose humana com base em mg/kg/dia, 11 vezes com base em mg/m²/dia) ou em coelhos em doses orais de até 10 mg/kg/dia (0,7 vezes a dose humana com base em mg/kg/dia, 0,23 vezes com base em mg/m²/dia). A toxicidade materna (diminuição do ganho de peso corporal) foi observada em coelhos na dose máxima tolerada de 10 mg/kg/dia sem efeitos adversos na prole. A diminuição do peso corporal ocorreu em fetos de ratos com ≥ 100 mg/kg/dia e na prole de ratos com ≥ 32 mg/kg/dia. Não foram observados efeitos nos parâmetros reprodutivos maternos ou na sobrevivência, desenvolvimento, comportamento ou função reprodutiva da prole.
No entanto, não existem estudos adequados e bem controlados em mulheres grávidas. Como os estudos de reprodução em animais nem sempre são preditivos da resposta humana, este medicamento deve ser usado durante a gravidez somente se for claramente necessário.
Trabalho e entrega
Cefdinir não foi estudado para uso durante o trabalho de parto e parto.
Mães que amamentam
Após a administração de doses únicas de 600 mg, o cefdinir não foi detectado no leite materno humano.
Uso Pediátrico
A segurança e eficácia em recém-nascidos e lactentes com menos de 6 meses de idade não foram estabelecidas. O uso de cefdinir para o tratamento de sinusite maxilar aguda em pacientes pediátricos (6 meses a 12 anos) é apoiado por evidências de estudos adequados e bem controlados em adultos e adolescentes, a fisiopatologia semelhante da sinusite aguda em pacientes adultos e pediátricos, e dados farmacocinéticos comparativos na população pediátrica.
Uso Geriátrico
A eficácia é comparável em pacientes geriátricos e adultos mais jovens. Embora o cefdinir tenha sido bem tolerado em todas as faixas etárias, em ensaios clínicos, pacientes geriátricos apresentaram uma taxa menor de eventos adversos, incluindo diarreia, do que adultos mais jovens. O ajuste de dose em pacientes idosos não é necessário, a menos que a função renal esteja marcadamente comprometida (ver DOSAGEM E ADMINISTRAÇÃO ).
SOBREDOSAGEM
Informações sobre superdosagem de cefdinir em humanos não estão disponíveis. Em estudos de toxicidade aguda em roedores, uma dose oral única de 5600 mg/kg não produziu efeitos adversos. Sinais e sintomas tóxicos após superdosagem com outros antibióticos β-lactâmicos incluem náuseas, vômitos, desconforto epigástrico, diarreia e convulsões. A hemodiálise remove o cefdinir do corpo. Isso pode ser útil no caso de uma reação tóxica grave por superdosagem, principalmente se a função renal estiver comprometida.
CONTRA-INDICAÇÕES
OMNICEF (cefdinir) é contraindicado em pacientes com alergia conhecida à classe de antibióticos das cefalosporinas.
FARMACOLOGIA CLÍNICA
Farmacocinética e Metabolismo de Fármacos
Absorção
Biodisponibilidade oral
As concentrações plasmáticas máximas de cefdinir ocorrem 2 a 4 horas após a administração da cápsula ou suspensão. As concentrações plasmáticas de cefdinir aumentam com a dose, mas os aumentos são menos proporcionais à dose de 300 mg (7 mg/kg) para 600 mg (14 mg/kg). Após a administração da suspensão a adultos saudáveis, a biodisponibilidade do cefdinir é de 120% em relação às cápsulas. A biodisponibilidade estimada das cápsulas de cefdinir é de 21% após a administração de uma dose de cápsula de 300 mg e de 16% após a administração de uma dose de cápsula de 600 mg. A biodisponibilidade absoluta estimada da suspensão de cefdinir é de 25%. A suspensão oral de cefdinir de 250 mg/5 mL demonstrou ser bioequivalente à concentração de 125 mg/5 mL em adultos saudáveis em jejum.
Efeito dos Alimentos
Cmax e a AUC do cefdinir das cápsulas são reduzidas em 16% e 10%, respectivamente, quando administrado com uma refeição rica em gordura. Em adultos que receberam a suspensão oral de 250 mg/5 mL com uma refeição rica em gordura, a Cmax e a AUC do cefdinir são reduzidas em 44% e 33%, respectivamente. A magnitude dessas reduções provavelmente não é clinicamente significativa porque os estudos de segurança e eficácia da suspensão oral em pacientes pediátricos foram realizados sem levar em consideração a ingestão de alimentos. Portanto, cefdinir pode ser tomado independentemente da alimentação.
Cápsulas de Cefdinir
As concentrações plasmáticas de cefdinir e os valores dos parâmetros farmacocinéticos após a administração de doses orais únicas de 300 e 600 mg de cefdinir a indivíduos adultos são apresentados na tabela a seguir:
Valores médios (± SD) dos parâmetros farmacocinéticos de cefdinir plasmático após administração de cápsulas a indivíduos adultos
Suspensão Cefdinir
As concentrações plasmáticas de cefdinir e os valores dos parâmetros farmacocinéticos após a administração de doses orais únicas de 7 e 14 mg/kg de cefdinir a pacientes pediátricos (6 meses a 12 anos) são apresentados na tabela a seguir:
Valores médios (± SD) dos parâmetros farmacocinéticos de cefdinir plasmático após administração de suspensão a pacientes pediátricos
Dosagem múltipla
O cefdinir não se acumula no plasma após administração uma ou duas vezes ao dia em indivíduos com função renal normal.
Distribuição
O volume médio de distribuição (Vdarea) do cefdinir em indivíduos adultos é de 0,35 L/kg (± 0,29); em indivíduos pediátricos (idade 6 meses-12 anos), cefdinir Vdarea é de 0,67 L/kg (± 0,38). O cefdinir liga-se 60% a 70% às proteínas plasmáticas em adultos e crianças; a ligação é independente da concentração.
Bolha na pele
Em indivíduos adultos, foram observadas concentrações medianas (intervalo) máximas de cefdinir no líquido da bolha de 0,65 (0,33-1,1) e 1,1 (0,49-1,9) μg/mL 4 a 5 horas após a administração de doses de 300 e 600 mg, respectivamente. Os valores médios (± SD) de Cmax e AUC (0-∞) do blister foram 48% (± 13) e 91% (± 18) dos valores plasmáticos correspondentes.
Tecido da amígdala
Em pacientes adultos submetidos à tonsilectomia eletiva, as respectivas concentrações medianas de cefdinir no tecido da amígdala 4 horas após a administração de doses únicas de 300 e 600 mg foram 0,25 (0,220,46) e 0,36 (0,22-0,80) μg/g. As concentrações médias nos tecidos das amígdalas foram 24% (± 8) das concentrações plasmáticas correspondentes.
Tecido Sinusal
Em pacientes adultos submetidos à cirurgia eletiva dos seios maxilares e etmoidais, as respectivas concentrações medianas de cefdinir no tecido sinusal 4 horas após a administração de doses únicas de 300 e 600 mg foram
Tecido pulmonar
Em pacientes adultos submetidos à broncoscopia diagnóstica, as respectivas concentrações medianas de cefdinir na mucosa brônquica 4 horas após a administração de doses únicas de 300 e 600 mg foram 0,78 (
Líquido do Ouvido Médio
Em 14 pacientes pediátricos com otite média bacteriana aguda, as respectivas concentrações medianas de cefdinir no líquido da orelha média 3 horas após a administração de doses únicas de 7 e 14 mg/kg foram 0,21 (
LCR
Não estão disponíveis dados sobre a penetração do cefdinir no líquido cefalorraquidiano humano.
Metabolismo e Excreção
cefdinir não é significativamente metabolizado. A atividade é principalmente devido ao fármaco original. O cefdinir é eliminado principalmente por excreção renal com uma meia-vida de eliminação plasmática média (t½) de 1,7 (± 0,6) horas. Em indivíduos saudáveis com função renal normal, a depuração renal é de 2,0 (± 1,0) mL/min/kg, e a depuração oral aparente é de 11,6 (± 6,0) e 15,5 (± 5,4) mL/min/kg após doses de 300 e 600 -mg, respectivamente. A porcentagem média da dose recuperada inalterada na urina após doses de 300 e 600 mg é de 18,4% (± 6,4) e 11,6% (± 4,6), respectivamente. A depuração do cefdinir é reduzida em pacientes com disfunção renal (ver Populações Especiais - Pacientes com Insuficiência Renal ).
Como a excreção renal é a via de eliminação predominante, a dosagem deve ser ajustada em pacientes com função renal marcadamente comprometida ou que estejam em hemodiálise (ver DOSAGEM E ADMINISTRAÇÃO ).
Populações Especiais
Pacientes com Insuficiência Renal
farmacocinética do cefdinir foi investigada em 21 indivíduos adultos com vários graus de função renal. As diminuições na taxa de eliminação do cefdinir, na depuração oral aparente (CL/F) e na depuração renal foram aproximadamente proporcionais à redução na depuração da creatinina (CLcr). Como resultado, as concentrações plasmáticas de cefdinir foram maiores e persistiram por mais tempo em indivíduos com insuficiência renal do que naqueles sem insuficiência renal. Em indivíduos com CLcr entre 30 e 60 mL/min, a Cmax e t½ aumentaram aproximadamente 2 vezes e a AUC aproximadamente 3 vezes. Em indivíduos com CLcr DOSAGEM E ADMINISTRAÇÃO ).
Hemodiálise
farmacocinética do cefdinir foi estudada em 8 indivíduos adultos submetidos a hemodiálise. A diálise (duração de 4 horas) removeu 63% do cefdinir do corpo e reduziu o t½ de eliminação aparente de 16 (± 3,5) para 3,2 (± 1,2) horas. O ajuste da dose é recomendado nesta população de pacientes (ver DOSAGEM E ADMINISTRAÇÃO ).
Doença hepática
Como o cefdinir é eliminado predominantemente por via renal e não é metabolizado de forma apreciável, não foram realizados estudos em pacientes com insuficiência hepática. Não se espera que o ajuste de dose seja necessário nesta população.
Pacientes Geriátricos
efeito da idade na farmacocinética do cefdinir após uma dose única de 300 mg foi avaliado em 32 indivíduos de 19 a 91 anos de idade. A exposição sistêmica ao cefdinir foi substancialmente aumentada em indivíduos mais velhos (N = 16), Cmax em 44% e AUC em 86%. Este aumento foi devido a uma redução na depuração do cefdinir. O volume aparente de distribuição também foi reduzido, portanto não foram observadas alterações apreciáveis no t½ de eliminação aparente (idosos: 2,2 ± 0,6 horas vs jovens: 1,8 ± 0,4 horas). Como a depuração de cefdinir mostrou estar relacionada principalmente a alterações na função renal e não à idade, os pacientes idosos não precisam de ajuste de dose, a menos que tenham função renal marcadamente comprometida (depuração de creatinina Pacientes com Insuficiência Renal, acima ).
Gênero e raça
Os resultados de uma meta-análise de farmacocinética clínica (N = 217) não indicaram impacto significativo de sexo ou raça na farmacocinética do cefdinir.
Microbiologia
Mecanismo de ação
Tal como acontece com outras cefalosporinas, a atividade bactericida do cefdinir resulta da inibição da síntese da parede celular. O cefdinir é estável na presença de algumas enzimas β-lactamases, mas não todas. Como resultado, muitos organismos resistentes às penicilinas e algumas cefalosporinas são suscetíveis ao cefdinir.
Mecanismo de Resistência
A resistência ao cefdinir é principalmente através da hidrólise por algumas β-lactamases, alteração das proteínas de ligação à penicilina (PBPs) e diminuição da permeabilidade. Cefdinir é inativo contra a maioria das cepas de Enterobacter spp., Pseudomonas spp., Enterococcus spp., estreptococos resistentes à penicilina e estafilococos resistentes à meticilina. As cepas de H. influenzae β-lactamase negativas, resistentes à ampicilina (BLNAR) são tipicamente não suscetíveis ao cefdinir.
Actividade antimicrobiana
O cefdinir demonstrou ser ativo contra a maioria das cepas dos seguintes microrganismos, tanto in vitro quanto em infecções clínicas, conforme descrito em INDICAÇÕES E USO .
Bactérias Gram-positivas
Staphylococcus aureus (somente cepas sensíveis à meticilina) Streptococcus pneumoniae (somente cepas sensíveis à penicilina) Streptococcus pyogenes
Bactérias Gram-Negativas
Haemophilus influenzae Haemophilus parainfluenzae Moraxella catarrhalis
Os seguintes dados in vitro estão disponíveis, mas seu significado clínico é desconhecido.
Cefdinir exibe in vitro concentrações inibitórias mínimas (MICs) de 1 mcg/mL ou menos contra (≥ 90%) cepas dos seguintes microrganismos; no entanto, a segurança e a eficácia do cefdinir no tratamento de infecções clínicas causadas por esses microrganismos não foram estabelecidas em ensaios clínicos adequados e bem controlados.
Bactérias Gram-positivas
Staphylococcus epidermidis (somente cepas sensíveis à meticilina) Streptococcus agalactiae Estreptococos do grupo Viridans
Bactérias Gram-Negativas
Citrobacter koseri Escherichia coli Klebsiella pneumoniae Proteus mirabilis
Métodos de teste de suscetibilidade
Quando disponível, o laboratório de microbiologia clínica deve fornecer relatórios periódicos que descrevam o perfil de suscetibilidade regional/local de potenciais patógenos nosocomiais e adquiridos na comunidade. Esses relatórios devem ajudar o médico a selecionar um medicamento antibacteriano para tratamento.
Técnicas de diluição
Métodos quantitativos são usados para determinar as concentrações inibitórias mínimas antimicrobianas (MICs). Esses MICs fornecem estimativas da suscetibilidade das bactérias aos compostos antimicrobianos. As CIMs devem ser determinadas usando um método de teste padronizado1 (caldo e/ou ágar). Os valores de CIM devem ser interpretados de acordo com os critérios fornecidos na Tabela 1.
Técnicas de difusão
Os métodos quantitativos que requerem a medição dos diâmetros das zonas também fornecem estimativas reprodutíveis da suscetibilidade das bactérias aos compostos antimicrobianos. O tamanho da zona deve ser determinado usando um método padronizado.2 O procedimento usa discos de papel impregnados com 5 mcg de cefdinir para testar a suscetibilidade das bactérias. Os critérios interpretativos de difusão de disco são fornecidos na Tabela 1.
A suscetibilidade dos estafilococos ao cefdinir pode ser deduzida a partir do teste de penicilina e cefoxitina ou oxacilina. Os estafilococos sensíveis à oxacilina (cefoxitina) podem ser considerados sensíveis ao cefdinir.3
Um relatório de "Susceptível" indica que o antimicrobiano provavelmente inibe o crescimento do patógeno se o composto antimicrobiano atingir as concentrações no local da infecção necessárias para inibir o crescimento do patógeno. Um relatório de “Intermediário” indica que o resultado deve ser considerado ambíguo e, se o microrganismo não for totalmente suscetível a medicamentos alternativos e clinicamente viáveis, o teste deve ser repetido. Esta categoria implica possível aplicabilidade clínica em locais do corpo onde o fármaco está fisiologicamente concentrado ou em situações em que uma alta dosagem do fármaco pode ser usada. Esta categoria também fornece uma zona tampão que evita que pequenos fatores técnicos não controlados causem grandes discrepâncias na interpretação. Um relatório de “Resistente” indica que o antimicrobiano provavelmente não inibirá o crescimento do patógeno se o composto antimicrobiano atingir as concentrações normalmente alcançáveis no local da infecção; outra terapia deve ser selecionada.
Controle de qualidade
Os procedimentos de teste de suscetibilidade padronizados exigem o uso de controles laboratoriais para monitorar e garantir a exatidão e precisão dos suprimentos e reagentes usados no ensaio, e as técnicas do indivíduo que realiza o teste.1,2,3 O pó de cefdinir padrão deve fornecer a seguinte faixa dos valores de CIM conforme observado na Tabela 2. Para a técnica de difusão usando um disco de 5 mcg, os critérios da Tabela 2 devem ser alcançados.
Estudos clínicos
Pneumonia Bacteriana Adquirida na Comunidade
Em um estudo duplo-cego controlado em adultos e adolescentes realizado nos EUA, o cefdinir BID foi comparado com cefaclor 500 mg TID. Usando avaliação estrita e critérios de resposta microbiológica/clínica 6 a 14 dias após a terapia, foram obtidas as seguintes taxas de cura clínica, taxas de erradicação microbiológica presumida e resultados estatísticos:
Estudo de Pneumonia Adquirida na Comunidade dos EUA Cefdinir vs Cefaclor
Em um segundo estudo controlado e cego para o investigador em adultos e adolescentes conduzido principalmente na Europa, cefdinir BID foi comparado com amoxicilina/clavulanato 500/125 mg TID. Usando critérios rigorosos de avaliação e resposta clínica 6 a 14 dias após a terapia, foram obtidas as seguintes taxas de cura clínica, taxas de erradicação microbiológica presumida e resultados estatísticos:
Estudo de Pneumonia Adquirida na Comunidade Europeia Cefdinir vs Amoxicilina/Clavulanato
Faringite/amigdalite estreptocócica
Em quatro estudos controlados realizados nos Estados Unidos, o cefdinir foi comparado com 10 dias de penicilina em pacientes adultos, adolescentes e pediátricos. Dois estudos (um em adultos e adolescentes, o outro em pacientes pediátricos) compararam 10 dias de cefdinir QD ou BID com penicilina 250 mg ou 10 mg/kg QID. Usando avaliação estrita e critérios de resposta microbiológica/clínica 5 a 10 dias após a terapia, foram obtidas as seguintes taxas de cura clínica, taxas de erradicação microbiológica e resultados estatísticos:
Estudos de faringite/amigdalite Cefdinir (10 dias) vs Penicilina (10 dias)
Dois estudos (um em adultos e adolescentes, o outro em pacientes pediátricos) compararam 5 dias de cefdinir BID com 10 dias de penicilina 250 mg ou 10 mg/kg QID. Usando avaliação estrita e critérios de resposta microbiológica/clínica 4 a 10 dias após a terapia, foram obtidas as seguintes taxas de cura clínica, taxas de erradicação microbiológica e resultados estatísticos:
Estudos de faringite/amigdalite Cefdinir (5 dias) vs Penicilina (10 dias)
REFERÊNCIAS
1. Instituto de Padrões Clínicos e Laboratoriais (CLSI). Métodos para Testes de Susceptibilidade Antimicrobiana de Diluição para Bactérias que Crescem Aerobicamente; Norma Aprovada – Décima Edição. Documento CLSI M07-A10 [2015], Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pensilvânia 19087, EUA.
2. Instituto de Padrões Clínicos e Laboratoriais (CLSI). Padrões de Desempenho para Testes de Susceptibilidade de Difusão em Disco Antimicrobiano; Norma Aprovada – Décima Segunda Edição. Documento CLSI M02-A12 [2015], Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pensilvânia 19087, EUA.
3. Instituto de Padrões Clínicos e Laboratoriais (CLSI). Padrões de Desempenho para Testes de Susceptibilidade Antimicrobiana; Vigésimo Quinto Suplemento Informativo, Documento CLSI M100-S25 [2015], Instituto de Padrões Clínicos e Laboratoriais, 950 West Valley Road, Suite 2500, Wayne, Pensilvânia 19087, EUA.
4. Cockcroft DW, Gault MH. Predição da depuração da creatinina a partir da creatinina sérica. Nephron 1976;16:31-41.
5. Schwartz GJ, Haycock GB, Edelmann CM, Spitzer A. Uma estimativa simples da taxa de filtração glomerular em crianças derivada do comprimento do corpo e da creatinina plasmática. Pediatria 1976;58:259-63.
6. Schwartz GJ, Feld LG, Langford DJ. Uma estimativa simples da taxa de filtração glomerular em recém-nascidos a termo durante o primeiro ano de vida. J Pediatrics 1984;104:849-54.
INFORMAÇÃO DO PACIENTE
Os pacientes devem ser informados de que os medicamentos antibacterianos, incluindo OMNICEF 300mg, devem ser usados apenas para tratar infecções bacterianas. Eles não tratam infecções virais (por exemplo, o resfriado comum). Quando OMNICEF 300mg é prescrito para tratar uma infecção bacteriana, os pacientes devem ser informados de que, embora seja comum sentir-se melhor no início do tratamento, a medicação deve ser tomada exatamente como indicado. Pular doses ou não completar o curso completo da terapia pode (1) diminuir a eficácia do tratamento imediato e (2) aumentar a probabilidade de que as bactérias desenvolvam resistência e não sejam tratáveis por OMNICEF 300mg ou outros medicamentos antibacterianos no futuro.
Antiácidos contendo magnésio ou alumínio interferem na absorção do cefdinir. Se este tipo de antiácido for necessário durante a terapia com OMNICEF 300mg, OMNICEF deve ser tomado pelo menos 2 horas antes ou depois do antiácido.
Suplementos de ferro, incluindo multivitamínicos que contêm ferro, interferem na absorção de cefdinir. Se suplementos de ferro forem necessários durante a terapia com OMNICEF 300mg, OMNICEF deve ser tomado pelo menos 2 horas antes ou depois do suplemento.
A fórmula infantil fortificada com ferro não interfere significativamente na absorção de cefdinir. Portanto, OMNICEF 300mg para Suspensão Oral pode ser administrado com fórmula infantil fortificada com ferro.
Pacientes diabéticos e cuidadores devem estar cientes de que a suspensão oral contém 2,86 g de sacarose por colher de chá.
A diarreia é um problema comum causado por antibióticos que geralmente termina quando o antibiótico é descontinuado. Às vezes, após o início do tratamento com antibióticos, os pacientes podem desenvolver fezes aquosas e sanguinolentas (com ou sem cólicas estomacais e febre), mesmo dois ou mais meses após a última dose do antibiótico. Se isso ocorrer, os pacientes devem entrar em contato com seu médico o mais rápido possível.
