Pentasa 400mg Mesalamine Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Pentasa e como é usado?
Pentasa é um medicamento de prescrição utilizado para tratar os sintomas da colite ulcerosa. Pentasa 400mg pode ser usado sozinho ou com outros medicamentos.
Pentasa pertence a uma classe de medicamentos chamados derivados do ácido 5-aminossalicílico.
Não se sabe se Pentasa é seguro e eficaz em crianças com mais de 5 anos de idade.
Quais são os possíveis efeitos colaterais do Pentasa?
Pentasa pode causar efeitos colaterais graves, incluindo:
- dor de estômago severa,
- cólicas estomacais,
- diarreia sanguinolenta,
- febre,
- dor de cabeça,
- erupção cutânea,
- fezes com sangue ou alcatrão,
- tossindo sangue,
- vômito que parece borra de café,
- pouca ou nenhuma micção,
- micção dolorosa ou difícil,
- inchaço nos pés ou tornozelos,
- sensação de cansaço ou falta de ar,
- perda de apetite,
- dor de estômago superior,
- cansaço,
- hematomas ou sangramentos fáceis,
- urina escura,
- fezes cor de barro e
- amarelecimento da pele ou olhos
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns de Pentasa 400mg incluem:
- náusea,
- vômito,
- dor de estômago,
- diarréia,
- indigestão,
- gás,
- dor de cabeça,
- erupção cutânea, e
- testes de função hepática anormais
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Pentasa. Para mais informações, consulte seu médico ou farmacêutico.
DESCRIÇÃO
PENTASA (mesalamina) para administração oral é uma formulação de liberação controlada de mesalamina, um agente anti-inflamatório de aminosalicilato para uso gastrointestinal.
Quimicamente, a mesalamina é o ácido 5-amino-2-hidroxibenzóico. Tem um peso molecular de 153,14.
A fórmula estrutural é:
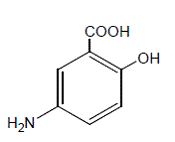
Cada cápsula de 250 mg contém 250 mg de mesalamina. Ele também contém os seguintes ingredientes inativos: monoglicerídeo acetilado, óleo de rícino, dióxido de silício coloidal, etilcelulose, hidroxipropilmetilcelulose, amido, ácido esteárico, açúcar, talco e cera branca. O invólucro da cápsula contém D&C Yellow #10, FD&C Blue #1, FD&C Green #3, gelatina, dióxido de titânio e outros ingredientes.
Cada cápsula de 500 mg contém 500 mg de mesalamina. Ele também contém os seguintes ingredientes inativos: monoglicerídeo acetilado, óleo de rícino, dióxido de silício coloidal, etilcelulose, hidroxipropilmetilcelulose, amido, ácido esteárico, açúcar, talco e cera branca. O invólucro da cápsula contém FD&C Blue #1, gelatina, dióxido de titânio e outros ingredientes.
INDICAÇÕES
PENTASA 400mg é indicado para a indução da remissão e para o tratamento de pacientes adultos com colite ulcerativa leve a moderadamente ativa.
DOSAGEM E ADMINISTRAÇÃO
A dosagem recomendada para a indução da remissão e o tratamento sintomático da colite ulcerativa leve a moderadamente ativa em adultos é de 1 g (4 cápsulas de PENTASA 250 mg ou 2 cápsulas de PENTASA 500 mg) 4 vezes ao dia para uma dose diária total de 4 g. A duração do tratamento em estudos controlados foi de até 8 semanas.
As cápsulas de PENTASA podem ser engolidas inteiras ou, alternativamente, a cápsula pode ser aberta e todo o conteúdo polvilhado em compota de maçã ou iogurte. Todo o conteúdo deve ser consumido imediatamente. As cápsulas e o conteúdo das cápsulas não devem ser esmagados ou mastigados.
Beba uma quantidade adequada de líquidos.
A segurança e eficácia de PENTASA 400mg em pacientes pediátricos não foram estabelecidas.
COMO FORNECIDO
PENTASA liberação prolongada 250 mg as cápsulas são fornecidas em frascos de 240 cápsulas ( NDC 54092-189-81). Cada cápsula verde e azul contém 250 mg de mesalamina em esferas de liberação prolongada. As cápsulas de liberação prolongada de PENTASA são identificadas com um logotipo pentagonal em forma de estrela e o número 2010 na parte verde e S429 250 mg na parte azul das cápsulas.
PENTASA liberação prolongada 500 mg as cápsulas são fornecidas em frascos de 120 cápsulas ( NDC 54092-191-12). Cada cápsula azul contém 500 mg de mesalamina em esferas de liberação prolongada. As cápsulas de liberação prolongada PENTASA 400mg são identificadas com um logotipo pentagonal starburst e S429 500 mg nas cápsulas.
Armazenar a 25°C (77°F); excursões permitidas de 15°C a 30°C (59°F a 86°F) [consulte Temperatura ambiente controlada pela USP].
Para relatar REAÇÕES ADVERSAS SUSPEITAS, entre em contato com a Takeda Pharmaceuticals em 1800-828-2088 ou FDA em 1-800-FDA-1088 ou www.fda.gov/medwatch.
Distribuído por: Takeda Pharmaceuticals America, Inc. Lexington, MA 02421, EUA. Revisado: novembro de 2021
EFEITOS COLATERAIS
Em ensaios clínicos nacionais e estrangeiros combinados, mais de 2.100 pacientes com colite ulcerativa ou doença de Crohn receberam terapia com PENTASA. Geralmente, a terapia com PENTASA foi bem tolerada. Os eventos mais comuns (ou seja, maior ou igual a 1%) foram diarreia (3,4%), cefaleia (2,0%), náusea (1,8%), dor abdominal (1,7%), dispepsia (1,6%), vômito (1,5 %) e erupção cutânea (1,0%).
Em dois estudos domésticos controlados por placebo envolvendo mais de 600 pacientes com colite ulcerativa, os eventos adversos foram menores em pacientes tratados com PENTASA (mesalamina) do que no grupo placebo (PENTASA 14% vs placebo 18%) e não foram relacionados à dose. Os eventos que ocorrem em mais de 1% são mostrados na tabela abaixo. Destes, apenas náuseas e vômitos foram mais frequentes no grupo PENTASA. A retirada da terapia devido a eventos adversos foi mais comum com placebo do que com PENTASA (7% vs 4%).
As medições laboratoriais clínicas não mostraram tendências anormais significativas para qualquer teste, incluindo medição da função hematológica, hepática e renal.
Os seguintes eventos adversos, apresentados pelo sistema do corpo, foram relatados com pouca frequência (ou seja, menos de 1%) durante os ensaios de colite ulcerativa doméstica e doença de Crohn. Em muitos casos, a relação com a PENTASA não foi estabelecida.
Gastrointestinal: distensão abdominal, anorexia, constipação, úlcera duodenal, disfagia, eructação, úlcera esofágica, incontinência fecal, aumento de GGTP, sangramento GI, aumento de fosfatase alcalina, aumento de LDH, úlcera bucal, monilíase oral, pancreatite, sangramento retal, aumento de SGOT, aumento de SGPT, anormalidades nas fezes (mudança de cor ou textura), sede
Dermatológico: acne, alopecia, pele seca, eczema, eritema nodoso, alterações nas unhas, fotossensibilidade, prurido, sudorese, urticária
Sistema nervoso: depressão, tontura, insônia, sonolência, parestesia
Cardiovascular: palpitações, pericardite, vasodilatação
Outro: albuminúria, amenorreia, aumento da amilase, artralgia, astenia, dor mamária, conjuntivite, equimose, edema, febre, hematúria, hipomenorreia, síndrome do tipo Kawasaki, cãibras nas pernas, líquen plano, aumento da lipase, mal-estar, menorragia, metrorragia, mialgia, infiltrados pulmonares , trombocitemia, trombocitopenia, frequência urinária
Uma semana após a conclusão de um estudo de colite ulcerativa de 8 semanas, um homem de 72 anos, sem história prévia de problemas pulmonares, desenvolveu dispneia. O paciente foi posteriormente diagnosticado com fibrose pulmonar intersticial sem eosinofilia por um médico e bronquiolite obliterante com pneumonite em organização por um segundo médico. Não foi estabelecida uma relação causal entre este evento e a terapia com mesalamina.
Relatos de casos publicados e/ou vigilância espontânea pós-comercialização descreveram casos infrequentes de pericardite, miocardite fatal, dor torácica e anormalidades da onda T, pneumonite de hipersensibilidade, pancreatite, síndrome nefrótica, nefrite intersticial, hepatite, anemia aplástica, pancitopenia, leucopenia, agranulocitose ou anemia durante o tratamento com mesalamina. A anemia pode fazer parte da apresentação clínica da doença inflamatória intestinal. Reações alérgicas, que podem envolver eosinofilia, podem ser observadas em conexão com a terapia com PENTASA 400mg.
Relatórios de pós-comercialização
Os seguintes eventos foram identificados durante o uso pós-aprovação da marca PENTASA de mesalamina na prática clínica. Por serem relatados voluntariamente por uma população de tamanho desconhecido, não é possível fazer estimativas de frequência. Esses eventos foram escolhidos para inclusão devido a uma combinação de gravidade, frequência de notificação ou potencial conexão causal com mesalamina:
Gastrointestinal: Relatos de hepatotoxicidade, incluindo enzimas hepáticas elevadas (SGOT/AST, SGPT/ALT, GGT, LDH, fosfatase alcalina, bilirrubina), hepatite, icterícia, icterícia colestática, cirrose e possível dano hepatocelular, incluindo necrose hepática e insuficiência hepática. Alguns desses casos foram fatais. Um caso de síndrome do tipo Kawasaki que incluiu alterações da função hepática também foi relatado.
Outro: reação anafilática, SSJ/NET, DRESS, AGEP, pleurisia/pleurite, pneumonite, granulocitopenia, lúpus eritematoso sistêmico, síndrome do tipo lúpus, insuficiência renal aguda, doença pulmonar intersticial, pneumonite de hipersensibilidade (incluindo pneumonite intersticial, alveolite alérgica, pneumonite eosinofílica), insuficiência renal crônica, diabetes insípido nefrogênico, nefrolitíase, hipertensão intracraniana, angioedema e oligospermia (reversível).
INTERAÇÕES MEDICAMENTOSAS
Não foram realizadas investigações de interações entre PENTASA 400mg e outras drogas; no entanto, as seguintes interações medicamentosas foram relatadas para produtos contendo mesalamina:
Agentes nefrotóxicos, incluindo anti-inflamatórios não esteroides
O uso concomitante de mesalamina com agentes nefrotóxicos conhecidos, incluindo anti-inflamatórios não esteroides (AINEs), pode aumentar o risco de nefrotoxicidade. Monitorar pacientes em uso de drogas nefrotóxicas quanto a alterações na função renal e reações adversas relacionadas à mesalamina.

Azatioprina ou 6-Mercaptopurina
O uso concomitante de mesalamina com azatioprina ou 6-mercaptopurina e/ou qualquer outro medicamento conhecido por causar mielotoxicidade pode aumentar o risco de distúrbios sanguíneos, insuficiência da medula óssea e complicações associadas. Se o uso concomitante de PENTASA e azatioprina ou 6-mercaptopurina não puder ser evitado, monitore exames de sangue, incluindo contagem completa de células sanguíneas e contagem de plaquetas.
AVISOS
Nenhuma informação fornecida
PRECAUÇÕES
Insuficiência renal
Insuficiência renal, incluindo doença de lesão mínima, nefrite intersticial aguda e crônica e insuficiência renal foram relatadas em pacientes que receberam PENTASA ou outros produtos que contêm mesalamina ou são convertidos em mesalamina.
Sabe-se que a mesalamina é substancialmente excretada pelos rins e o risco de reações adversas pode ser maior em pacientes com função renal comprometida. Avalie a função renal em todos os pacientes antes do início e periodicamente durante a terapia com PENTASA. Avaliar os riscos e benefícios do uso de PENTASA em pacientes com insuficiência renal conhecida ou história de doença renal ou em uso concomitante de medicamentos nefrotóxicos.
Síndrome de intolerância aguda induzida por mesalamina
A mesalamina tem sido associada a uma síndrome de intolerância aguda que pode ser difícil de distinguir de um surto de doença inflamatória intestinal. Os sintomas incluem cólicas, dor abdominal aguda, diarreia sanguinolenta e, às vezes, febre, dor de cabeça e erupção cutânea. Monitorar os pacientes quanto ao agravamento desses sintomas durante o tratamento. Se houver suspeita de síndrome de intolerância aguda, interrompa imediatamente o tratamento com PENTASA.
Reações de hipersensibilidade
Reações de hipersensibilidade foram relatadas em pacientes tomando sulfassalazina. Alguns pacientes podem ter uma reação semelhante ao PENTASA ou a outros compostos que contenham ou sejam convertidos em mesalamina.
Assim como com a sulfassalazina, as reações de hipersensibilidade induzidas pela mesalamina podem se apresentar como envolvimento de órgãos internos, incluindo miocardite, pericardite, nefrite, hepatite, pneumonite e anormalidades hematológicas. Avaliar os pacientes imediatamente se houver sinais ou sintomas de reação de hipersensibilidade. Descontinuar PENTASA se uma etiologia alternativa para os sinais e sintomas não puder ser estabelecida.
Insuficiência Hepática
Houve relatos de insuficiência hepática em pacientes com doença hepática pré-existente que receberam outros produtos contendo mesalamina. Avaliar os riscos e benefícios do uso de PENTASA 400mg em pacientes com insuficiência hepática conhecida.
Reações Adversas Cutâneas Graves
Reações adversas cutâneas graves, como síndrome de Stevens-Johnson (SSJ) e necrólise epidérmica tóxica (NET), reação medicamentosa com eosinofilia e sintomas sistêmicos (DRESS) e pustulose exantemática generalizada aguda (PEGA) foram relatadas com o uso de mesalamina (Vejo REAÇÕES ADVERSAS ). Descontinuar PENTASA aos primeiros sinais ou sintomas de reações adversas cutâneas graves ou outros sinais de hipersensibilidade e considerar uma avaliação adicional.
Fotossensibilidade
Pacientes com doenças de pele pré-existentes, como dermatite atópica e eczema atópico, relataram reações de fotossensibilidade mais graves. Aconselhe os pacientes a evitar a exposição ao sol, usar roupas de proteção e usar um protetor solar de amplo espectro quando estiver ao ar livre.
Nefrolitíase
Casos de nefrolitíase foram relatados com o uso de mesalamina, incluindo cálculos com 100% de conteúdo de mesalamina. Os cálculos contendo mesalamina são radiotransparentes e indetectáveis por radiografia padrão ou tomografia computadorizada (TC). Garantir hidratação adequada durante o tratamento.
Interferência com testes de laboratório
O uso de mesalamina pode levar a resultados de teste falsamente elevados ao medir normetanefrina urinária por cromatografia líquida com detecção eletroquímica devido à semelhança nos cromatogramas de normetanefrina e do principal metabólito da mesalamina, ácido N-acetil-5-aminossalicílico (N-Ac-5-ASA ). Considere um ensaio alternativo e seletivo para normetanefrina.
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Em um estudo de carcinogenicidade dietética de mesalamina de 104 semanas, camundongos CD-1 foram tratados com doses de até 2.500 mg/kg/dia e não foi tumorigênico. Para uma pessoa de 50 kg de estatura média (1,46 m2 de área de superfície corporal), isso representa 2,5 vezes a dose humana recomendada com base na área de superfície corporal (2960 mg/m2/dia). Em um estudo de carcinogenicidade dietética de 104 semanas em ratos Wistar, mesalamina até uma dose de 800 mg/kg/dia não foi tumorigênica. Esta dose representa 1,5 vezes a dose humana recomendada com base na área de superfície corporal.
Nenhuma evidência de mutagenicidade foi observada em um teste de Ames in vitro e em um teste de micronúcleo em camundongos in vivo.
Não foram observados efeitos na fertilidade ou no desempenho reprodutivo em ratos machos ou fêmeas em doses orais de mesalamina de até 400 mg/kg/dia (0,8 vezes a dose humana recomendada com base na área de superfície corporal).
Anormalidades no sêmen e infertilidade em homens, que foram relatadas em associação com sulfassalazina, não foram observadas com PENTASA 400mg cápsulas durante estudos clínicos controlados.
Gravidez
Efeitos teratogênicos
Dados publicados de meta-análises, estudos de coorte e séries de casos sobre o uso de mesalamina durante a gravidez não informaram de forma confiável uma associação com mesalamina e defeitos congênitos maiores, aborto espontâneo ou resultados maternos ou fetais adversos. Não há evidências claras de que a exposição à mesalamina no início da gravidez esteja associada a um risco aumentado de malformações congênitas maiores, incluindo malformações cardíacas. Os estudos epidemiológicos publicados têm importantes limitações metodológicas que dificultam a interpretação dos dados, incluindo a incapacidade de controlar fatores de confusão, como doença materna subjacente, uso materno de medicamentos concomitantes e falta de informações sobre a dose e a duração do uso de produtos de mesalamina. PENTASA só deve ser usado durante a gravidez se os benefícios superarem os riscos.
Em estudos de reprodução animal, a administração oral de mesalamina durante a organogênese em ratas prenhas em doses de até 1.000 mg/kg/dia (5.900 mg/m²) e coelhos em doses de 800 mg/kg/dia (6.856 mg/m²) não revelou evidências de efeitos teratogênicos ou danos ao feto devido à mesalamina.
O risco de fundo estimado de grandes defeitos congênitos e aborto para as populações indicadas é desconhecido. Todas as gestações têm um risco histórico de defeitos congênitos, perda ou outros resultados adversos. Na população geral dos EUA, o risco de fundo estimado de grandes defeitos congênitos e abortos em gestações clinicamente reconhecidas é de 2% a 4% e 15% a 20%, respectivamente.
Efeitos não teratogênicos
Os dados publicados sugerem que o aumento da atividade da doença está associado ao risco de desenvolver resultados adversos na gravidez em mulheres com colite ulcerativa. Os resultados adversos da gravidez incluem parto prematuro (antes de 37 semanas de gestação), bebês com baixo peso ao nascer (menos de 2.500 g) e bebês pequenos para a idade gestacional ao nascer.
Mães que amamentam
Dados da literatura publicada relatam a presença de mesalamina e seu metabólito, ácido N-acetil-5-aminossalicílico no leite humano em pequenas quantidades com doses infantis relativas (RID) de 0,1% ou menos para mesalamina. O significado clínico disso não foi determinado e há experiência limitada de mulheres que amamentam usando mesalamina.
Há relatos de diarreia observada em lactentes amamentados expostos à mesalamina. O efeito de PENTASA 400mg na produção de leite é desconhecido. Tenha cuidado se PENTASA 400mg for administrado a uma lactante e monitore bebês amamentados quanto à diarreia.
Em estudos de lactação publicados, as doses maternas de mesalamina de várias formulações e produtos orais e retais variaram de 500 mg a 4,8 g diariamente. A concentração média de mesalamina no leite variou de não detectável a 0,5 mg/L. A concentração média de ácido N-acetil-5-aminossalicílico no leite variou de 0,2 a 9,3 mg/L. Com base nessas concentrações, as dosagens diárias estimadas para um bebê amamentado exclusivamente são de 0 a 0,075 mg/kg/dia de mesalamina (RID 0% a 0,1%) e 0,03 a 1,4 mg/kg/dia de N-acetil-5-aminosalicílico ácido.
Uso Pediátrico
A segurança e eficácia de PENTASA em pacientes pediátricos não foram estabelecidas.
Uso Geriátrico
Os ensaios clínicos de PENTASA 400mg não incluíram um número suficiente de pacientes com 65 anos ou mais para determinar se eles respondem de forma diferente dos pacientes mais jovens. Relatos de estudos clínicos não controlados e sistemas de notificação pós-comercialização sugeriram uma maior incidência de discrasias sanguíneas (ou seja, agranulocitose, neutropenia e pancitopenia) em pacientes recebendo produtos contendo mesalamina, como PENTASA 400mg, que tinham 65 anos ou mais em comparação com pacientes mais jovens. Monitore as contagens completas de células sanguíneas e plaquetas em pacientes idosos durante o tratamento com PENTASA.
Em geral, considere a maior frequência de diminuição da função hepática, renal ou cardíaca e de doença concomitante ou outra terapia medicamentosa em pacientes idosos ao prescrever PENTASA.
SOBREDOSAGEM
PENTASA 400mg é um aminosalicilato, podendo ocorrer sintomas de toxicidade salicilato, tais como: náuseas, vômitos, dor abdominal, taquipneia, hiperpneia, zumbido e sintomas neurológicos (cefaleia, tontura, confusão, convulsões). A intoxicação grave com salicilatos pode causar desequilíbrio eletrolítico e do pH sanguíneo e, potencialmente, danos a outros órgãos (por exemplo, rins e fígado).
Tratamento de superdosagem
Não há antídoto específico para overdose de mesalamina; no entanto, a terapia convencional para a toxicidade do salicilato pode ser benéfica no caso de superdosagem aguda e pode incluir descontaminação do trato gastrointestinal para evitar absorção adicional. Corrija o desequilíbrio hidroeletrolítico pela administração de terapia intravenosa apropriada e mantenha a função renal adequada.
CONTRA-INDICAÇÕES
PENTASA é contraindicado em pacientes com hipersensibilidade conhecida ou suspeita a salicilatos, aminosalicilatos ou a qualquer componente deste medicamento.
FARMACOLOGIA CLÍNICA
sulfassalazina é dividida por ação bacteriana no cólon em sulfapiridina (SP) e mesalamina (5-ASA). A dose oral usual de sulfassalazina para colite ulcerativa ativa em adultos é de 2 a 4 g por dia em doses divididas. Quatro gramas de sulfasalazina fornecem 1,6 g de mesalamina livre ao cólon.
O mecanismo de ação da mesalamina (e sulfassalazina) não é totalmente compreendido, mas parece ser um efeito anti-inflamatório tópico nas células epiteliais do cólon. A produção mucosa de metabólitos do ácido araquidônico (AA), tanto pelas vias da ciclooxigenase (isto é, prostanóides) quanto pelas vias da lipoxigenase (isto é, leucotrienos (LTs) e ácidos hidroxieicosatetraenóicos (HETEs), está aumentada em pacientes com colite ulcerativa, e é possível que a mesalamina diminua a inflamação bloqueando a ciclooxigenase e inibindo a produção de prostaglandina (PG) no cólon.
Farmacocinética Humana e Metabolismo
Absorção
PENTASA é uma formulação de liberação prolongada, revestida com etilcelulose, de mesalamina projetada para liberar quantidades terapêuticas de mesalamina em todo o trato gastrointestinal. Com base nos dados de excreção urinária, 20% a 30% da mesalamina em PENTASA é absorvida. Em contraste, quando a mesalamina é administrada oralmente como uma suspensão aquosa não formulada de 1 g, a mesalamina é absorvida em aproximadamente 80%.
concentração plasmática de mesalamina atingiu um pico de aproximadamente 1 mcg/mL 3 horas após uma dose de 1 g de PENTASA e diminuiu de maneira bifásica. A literatura descreve uma meia-vida terminal média de 42 minutos para mesalamina após administração intravenosa. Devido à liberação e absorção contínuas de mesalamina de PENTASA por todo o trato gastrointestinal, a meia-vida de eliminação verdadeira não pode ser determinada após administração oral. O ácido N-acetil-5-aminossalicílico, o principal metabólito da mesalamina (ácido 5-aminossalicílico), atingiu o pico em aproximadamente 3 horas a 1,8 mcg/mL, e sua concentração seguiu um declínio bifásico. As atividades farmacológicas do ácido N-acetil-5-aminosalicílico são desconhecidas e outros metabólitos não foram identificados.
farmacocinética oral da mesalamina não foi linear quando as cápsulas de PENTASA foram administradas de 250 mg a 1 g quatro vezes ao dia, com as concentrações plasmáticas de mesalamina em estado de equilíbrio aumentando cerca de nove vezes, de 0,14 mcg/mL para 1,21 mcg/mL, sugerindo metabolismo de primeira passagem saturável. A farmacocinética do ácido N-acetil-5-aminosalicílico foi linear.
Eliminação
Cerca de 130 mg de mesalamina livre foram recuperados nas fezes após uma dose única de 1 g de PENTASA 400 mg, que foi comparável aos 140 mg de mesalamina recuperados da dose equivalente molar do comprimido de sulfassalazina de 2,5 g. A eliminação de mesalamina livre e salicilatos nas fezes aumentou proporcionalmente com a dose de PENTASA. O ácido N-acetil-5-aminossalicílico foi o composto primário excretado na urina (19% a 30%) após a administração de PENTASA 400mg.
Testes clínicos
Em dois estudos randomizados, duplo-cegos, controlados por placebo, dose-resposta (UC-1 e UC-2) de 625 pacientes com colite ulcerativa ativa leve a moderada, PENTASA 400mg, em uma dose oral de 4 g/dia administrado 1 g quatro vezes ao dia, produziu melhora consistente nos parâmetros de eficácia primários identificados prospectivamente, PGA, Tx F e SI, conforme mostrado na tabela abaixo.
A dose de 4 g de PENTASA também proporcionou melhora consistente nos parâmetros secundários de eficácia, ou seja, a frequência de idas ao banheiro, consistência das fezes, sangramento retal, dor abdominal/retal e urgência. A dose de 4 g de PENTASA induziu remissão avaliada por parâmetros endoscópicos e sintomáticos.
Em alguns pacientes, a dose de 2 g de PENTASA 400mg foi observada para melhorar os parâmetros de eficácia medidos. No entanto, a dose de 2 g deu resultados inconsistentes nos parâmetros primários de eficácia nos dois ensaios adequados e bem controlados.
INFORMAÇÃO DO PACIENTE
Nenhuma informação fornecida. Por favor, consulte o PRECAUÇÕES seção.
