Prandin 0.5mg, 1mg, 2mg Repaglinide Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Prandin 2mg e como é usado?
Prandin 1mg é um medicamento de prescrição usado para tratar os sintomas do Diabetes Mellitus tipo 2. Prandin pode ser usado sozinho ou com outros medicamentos.
Prandin pertence a uma classe de medicamentos chamados antidiabéticos, derivados de maglitinidas.
Não se sabe se Prandin 1mg é seguro e eficaz em crianças.
Quais são os possíveis efeitos colaterais do Prandin?
Prandin pode causar efeitos colaterais graves, incluindo:
- urticária,
- dificuldade para respirar,
- inchaço do rosto, lábios, língua ou garganta,
- dor intensa na parte superior do estômago se espalhando para as costas,
- náusea,
- vômito,
- ritmo cardíaco acelerado,
- pele pálida ou amarelada,
- urina de cor escura,
- febre,
- confusão,
- fraqueza,
- dor de garganta,
- queimando em seus olhos,
- dor na pele e
- seguido por uma erupção cutânea vermelha ou roxa que se espalha (especialmente no rosto ou na parte superior do corpo) e causa bolhas e descamação
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Prandin incluem:
- Baixo teor de açúcar no sangue,
- náusea,
- diarréia,
- dor de cabeça,
- dor nas costas,
- dores nas articulações e
- sintomas de resfriado (nariz entupido, espirros, dor de garganta)
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Prandin. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
DESCRIÇÃO
PRANDIN (repaglinida) é um medicamento oral redutor de glicose no sangue da classe das glinidas. A repaglinida, ácido S(+)2-etoxi-4(2((3-metil-1-(2-(1piperidinil)fenil)-butil)amino)-2-oxoetil)benzóico, não está quimicamente relacionado à insulina sulfonilureia oral secretagogos.
Fórmula Estrutural da Repaglinida
A repaglinida é um pó branco a esbranquiçado com fórmula molecular C27H36N2O4 e peso molecular de 452,6. Os comprimidos de PRANDIN contêm 0,5 mg, 1 mg ou 2 mg de repaglinida. Além disso, cada comprimido contém os seguintes ingredientes inativos: hidrogenofosfato de cálcio (anidro), celulose microcristalina, amido de milho, polacrilina potássica, povidona, glicerol (85%), estearato de magnésio, meglumina e poloxâmero. Os comprimidos de 1 mg e 2 mg contêm óxidos de ferro (amarelo e vermelho, respectivamente) como corantes.
INDICAÇÕES
PRANDIN é indicado como adjuvante à dieta e exercícios para melhorar o controle glicêmico em adultos com diabetes mellitus tipo 2.
Limitação de uso
PRANDIN não deve ser utilizado em doentes com diabetes mellitus tipo 1 ou no tratamento da cetoacidose diabética.
DOSAGEM E ADMINISTRAÇÃO
Dosagem e Administração Recomendadas
A dose inicial recomendada para pacientes cuja HbA1c é inferior a 8% é de 0,5 mg por via oral antes de cada refeição. Para pacientes cuja HbA1c é de 8% ou mais, a dose inicial é de 1 ou 2 mg por via oral antes de cada refeição.
O intervalo de dose recomendado é de 0,5 mg a 4 mg antes das refeições, com uma dose diária máxima de 16 mg. A dose do paciente deve ser dobrada até 4 mg com cada refeição até que o controle glicêmico satisfatório seja alcançado. Deve decorrer pelo menos uma semana para avaliar a resposta após cada ajuste de dose.
Instrua os pacientes a tomar PRANDIN dentro de 30 minutos antes das refeições. PRANDIN 2mg pode ser administrado 2, 3 ou 4 vezes ao dia em resposta a mudanças no padrão alimentar do paciente.
Em pacientes que pulam refeições, instrua os pacientes a pular a dose programada de PRANDIN 1mg para reduzir o risco de hipoglicemia. Em pacientes que apresentam hipoglicemia, a dose de PRANDIN 1mg deve ser reduzida [ver AVISOS E PRECAUÇÕES ].
Pacientes com Insuficiência Renal Grave
Em pacientes com insuficiência renal grave (ClCr = 20 a 40 mL/min) iniciar PRANDIN 0,5 mg por via oral antes de cada refeição. Titular gradualmente a dose, se necessário, para atingir o controle glicêmico.
Modificações de dose para interações medicamentosas
Ajustes de dose são recomendados em pacientes tomando concomitantemente inibidores potentes de CYP3A4 ou CYP2C8 ou indutores potentes de CYP3A4 ou CYP2C8 [ver INTERAÇÕES MEDICAMENTOSAS , FARMACOLOGIA CLÍNICA ].
O uso concomitante com gemfibrozil é contraindicado [ver CONTRA-INDICAÇÕES ].
Evite o uso concomitante de PRANDIN 2mg com clopidogrel. Se o uso concomitante não puder ser evitado, inicie PRANDIN com 0,5 mg antes de cada refeição e não exceda a dose diária total de 4 mg [ver INTERAÇÕES MEDICAMENTOSAS , FARMACOLOGIA CLÍNICA ].
Não exceda uma dose diária total de 6 mg de PRANDIN 2 mg em pacientes recebendo ciclosporina [ver INTERAÇÕES MEDICAMENTOSAS , FARMACOLOGIA CLÍNICA ].
COMO FORNECIDO
Formas de dosagem e pontos fortes
- Comprimidos de 1 mg (comprimidos amarelos, redondos, biconvexos, gravados com “745” de um lado e 'C' do outro lado)
- Comprimidos de 2 mg (comprimidos rosa, redondos, biconvexos, gravados com “747” de um lado e 'C' do outro lado)
Prandim (repaglinida) comprimidos, 1 mg , são fornecidos na forma de comprimidos amarelos, redondos, biconvexos, gravados com “745” numa das faces e “C” na outra face. Eles estão disponíveis da seguinte forma:
Garrafas de 100 NDC 60846-882-01
Prandim (repaglinida) comprimidos, 2 mg , são fornecidos sob a forma de comprimidos cor-de-rosa, redondos, biconvexos, gravados com “747” numa das faces e “C” na outra face. Eles estão disponíveis da seguinte forma:
Garrafas de 100 NDC 60846-884-01
Armazene de 20° a 25°C (68° a 77°F) [consulte Temperatura ambiente controlada pela USP]. Proteger da umidade. Mantenha as garrafas bem fechadas.
Dispensar em recipientes apertados com fechos de segurança.
Distribuído por: Amneal Specialty, uma divisão da Amneal Pharmaceuticals LLC Bridgewater, NJ 08807. Revisado: março de 2019
EFEITOS COLATERAIS
seguinte reação adversa grave também é descrita em outra parte da bula:
Hipoglicemia [ver AVISOS E PRECAUÇÕES ]
Experiência de Ensaios Clínicos
Como os ensaios clínicos são conduzidos sob projetos amplamente variados, as taxas de reações adversas relatadas em um ensaio clínico podem não ser facilmente comparadas às taxas relatadas em outro ensaio clínico e podem não refletir as taxas realmente observadas na prática clínica.
PRANDIN 1mg foi administrado a 2.931 indivíduos durante os ensaios clínicos. Aproximadamente 1.500 desses indivíduos com diabetes tipo 2 foram tratados por pelo menos 3 meses, 1.000 por pelo menos 6 meses e 800 por pelo menos 1 ano. A maioria desses indivíduos (1.228) recebeu PRANDIN em um dos cinco estudos controlados por ativos de 1 ano. Ao longo de um ano, 13% dos pacientes com PRANDIN 1mg foram descontinuados devido a reações adversas. As reações adversas mais comuns que levaram à retirada foram hiperglicemia, hipoglicemia e sintomas relacionados.
Tabela 1 lista as reações adversas comuns para pacientes com PRANDIN em comparação com placebo em estudos com duração de 12 a 24 semanas.
Hipoglicemia
Em ensaios clínicos com PRANDIN 1mg, a hipoglicemia é a reação adversa mais comumente observada. Hipoglicemia leve ou moderada ocorreu em 31% dos pacientes tratados com PRANDIN 1mg e 7% dos pacientes tratados com placebo [ver AVISOS E PRECAUÇÕES ].
Hipoglicemia foi relatada em 16% de 1.228 pacientes com PRANDIN, 20% de 417 pacientes com gliburida e 19% de 81 pacientes com glipizida em estudos controlados de 1 ano. Dos pacientes tratados com PRANDIN com hipoglicemia sintomática, nenhum desenvolveu coma ou necessitou de hospitalização.
Em um estudo controlado por placebo de 24 semanas, os pacientes que nunca haviam recebido terapia com agentes hipoglicemiantes orais e os pacientes com HbA1c abaixo de 8% no início do estudo apresentaram maior frequência de hipoglicemia.
Ganho de peso
Não houve ganho médio de peso corporal quando os pacientes previamente tratados com hipoglicemiantes orais foram trocados para PRANDIN. O ganho de peso médio em pacientes tratados com PRANDIN 0,5mg e não tratados previamente com sulfonilureias foi de 3,3%.
Eventos Cardiovasculares
A incidência de eventos adversos cardiovasculares graves totais, incluindo isquemia, foi maior para PRANDIN (51/1228 ou 4%) do que para medicamentos de sulfonilureia (13/498 ou 3%) em ensaios clínicos comparadores controlados.
Sete ensaios clínicos controlados incluíram a terapia combinada PRANDIN com insulina NPH (n=431), formulações de insulina isoladas (n=388) ou outras combinações (sulfonilureia mais insulina NPH ou PRANDIN 1mg mais metformina) (n=120). Houve seis eventos adversos graves de isquemia miocárdica em pacientes tratados com PRANDIN 0,5 mg mais insulina NPH de dois estudos, e um evento em pacientes usando formulações de insulina isoladas de outro estudo [ver AVISOS E PRECAUÇÕES ].
Terapia combinada com tiazolidinedionas
Hipoglicemia
Durante os ensaios clínicos de tratamento de 24 semanas da terapia combinada PRANDIN-rosiglitazona ou PRANDIN-pioglitazona (um total de 250 pacientes em terapia combinada), ocorreu hipoglicemia (glicemia
Edema Periférico e Insuficiência Cardíaca
Edema periférico foi relatado em 12 de 250 (4,8%) pacientes em terapia combinada com PRANDIN-tiazolidinediona e 3 de 124 (2,4%) pacientes em monoterapia com tiazolidinediona, sem casos relatados nesses estudos para monoterapia com PRANDIN. Houve relatos em 2 de 250 pacientes (0,8%) tratados com terapia com PRANDIN-tiazolidinediona de episódios de edema com insuficiência cardíaca congestiva. Ambos os pacientes tinham história prévia de doença arterial coronariana e se recuperaram após tratamento com diuréticos. Não foram relatados casos comparáveis nos grupos de tratamento em monoterapia.
Ganho de peso
Os aumentos médios de peso associados à terapia combinada, PRANDIN e pioglitazona foram de 5,5 kg, 0,3 kg e 2,0 kg, respectivamente. Os aumentos médios de peso associados à terapia combinada, PRANDIN e rosiglitazona foram de 4,5 kg, 1,3 kg e 3,3 kg, respectivamente.
Eventos Adversos Infrequentes (
Eventos adversos clínicos ou laboratoriais menos comuns observados em ensaios clínicos incluíram enzimas hepáticas elevadas, trombocitopenia, leucopenia e reações anafilactóides.
Experiência pós-marketing
As seguintes reações adversas adicionais foram identificadas durante o uso pós-aprovação de PRANDIN. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, geralmente não é possível estimar com segurança sua frequência ou uma relação causal com a exposição ao medicamento.
- Alopecia
- Anemia hemolítica
- Pancreatite
- Síndrome de Stevens-Johnson
- Disfunção hepática grave, incluindo icterícia e hepatite
INTERAÇÕES MEDICAMENTOSAS
Interações medicamentosas clinicamente importantes com PRANDIN
Tabela 3 inclui uma lista de medicamentos com interações medicamentosas clinicamente importantes quando administrados concomitantemente com PRANDIN 1mg e instruções para prevenção ou manejo.
AVISOS
Incluído como parte do "PRECAUÇÕES" Seção
PRECAUÇÕES
Hipoglicemia
Todas as glinidas, incluindo PRANDIN 0,5mg, podem causar hipoglicemia [ver REAÇÕES ADVERSAS ]. A hipoglicemia grave pode causar convulsões, pode ser fatal ou causar a morte. A hipoglicemia pode prejudicar a capacidade de concentração e o tempo de reação; isso pode colocar um indivíduo e outros em risco em situações em que essas habilidades são importantes (por exemplo, dirigir ou operar outras máquinas).
A hipoglicemia pode acontecer de repente e os sintomas podem diferir em cada indivíduo e mudar ao longo do tempo no mesmo indivíduo. A percepção sintomática da hipoglicemia pode ser menos pronunciada em pacientes com diabetes de longa data, em pacientes com doença nervosa diabética, em pacientes em uso de medicamentos que bloqueiam o sistema nervoso simpático (p. INTERAÇÕES MEDICAMENTOSAS ], ou em pacientes que apresentam hipoglicemia recorrente.
Os fatores que podem aumentar o risco de hipoglicemia incluem alterações no padrão das refeições (por exemplo, conteúdo de macronutrientes), alterações no nível de atividade física, alterações na medicação coadministrada [ver INTERAÇÕES MEDICAMENTOSAS ], e uso concomitante com outros agentes antidiabéticos. Pacientes com insuficiência renal ou hepática podem apresentar maior risco de hipoglicemia [ver Uso em populações específicas ].
Os pacientes devem administrar PRANDIN 0,5 mg antes das refeições e ser instruídos a pular a dose de PRANDIN se uma refeição for omitida. Em pacientes que apresentam hipoglicemia, a dose de PRANDIN deve ser reduzida [ver DOSAGEM E ADMINISTRAÇÃO ]. Pacientes e cuidadores devem ser educados para reconhecer e controlar a hipoglicemia. A auto-monitorização da glicemia desempenha um papel essencial na prevenção e gestão da hipoglicemia. Em pacientes com maior risco de hipoglicemia e pacientes com consciência sintomática reduzida de hipoglicemia, recomenda-se aumentar a frequência de monitoramento da glicose no sangue.
Reações Adversas Cardiovasculares Graves com Uso Concomitante com NPH-insulina
Em sete estudos controlados, houve seis eventos adversos graves de isquemia miocárdica em pacientes tratados com PRANDIN 0,5 mg mais insulina NPH de dois estudos, e um evento em pacientes usando formulações de insulina isoladas de outro estudo [ver REAÇÕES ADVERSAS ]. PRANDIN não é indicado para uso em combinação com a insulina NPH.
Resultados Macrovasculares
Não houve estudos clínicos estabelecendo evidências conclusivas de redução do risco macrovascular com PRANDIN.

Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Em um estudo de carcinogenicidade de 104 semanas em ratos com doses de até 120 mg/kg/dia, que é aproximadamente 60 vezes a exposição clínica em uma base de mg/m2, as incidências de adenomas benignos da tireoide e fígado aumentaram em ratos machos. Nenhuma evidência de carcinogenicidade foi encontrada em ratos fêmeas. As incidências mais altas de tumores de tireoide e fígado em ratos machos não foram observadas em doses mais baixas de 30 mg/kg/dia e 60 mg/kg/dia, respectivamente (que são mais de 15 e 30 vezes, respectivamente, as exposições clínicas em mg/m2 base). Em um estudo de carcinogenicidade de 104 semanas em camundongos com doses de até 500 mg/kg/dia, nenhuma evidência de carcinogenicidade foi encontrada em camundongos (que é aproximadamente 125 vezes a exposição clínica em mg/m2).
repaglinida não foi genotóxica em uma bateria de estudos in vivo e in vitro: mutagênese bacteriana (teste de Ames), ensaio de mutação celular direta in vitro em células V79 (HGPRT), ensaio de aberração cromossômica in vitro em linfócitos humanos, síntese de DNA não programada e replicante em fígado de rato e testes de micronúcleo de rato e rato in vivo.
Em um estudo de fertilidade em ratos, a repaglinida foi administrada a ratos machos e fêmeas em doses de até 300 e 80 mg/kg/dia, respectivamente. Não foram observados efeitos adversos na fertilidade (que são mais de 40 vezes a exposição clínica em mg/m2).
Uso em populações específicas
Gravidez
Resumo do risco
Dados limitados sobre o uso de PRANDIN e repaglinida em mulheres grávidas são insuficientes para informar um risco associado ao medicamento para defeitos congênitos graves ou aborto espontâneo. Existem riscos para a mãe e o feto associados ao diabetes mal controlado na gravidez [ver Considerações Clínicas ].
repaglidina demonstrou não ser teratogénica em estudos com animais (ratos e coelhos). Embriotoxicidade, desenvolvimento anormal dos membros em fetos de ratos foi observada em ratas expostas a altas doses no último estágio da gravidez.
O risco de fundo estimado de defeitos congênitos maiores é de 6% a 10% em mulheres com diabetes pré-gestacional com HbA1c >7 e foi relatado como sendo tão alto quanto 20% a 25% em mulheres com HbA1c >10. O risco de fundo estimado de aborto para a população indicada é desconhecido. Na população geral dos EUA, o risco de fundo estimado de defeitos congênitos graves e aborto espontâneo em gestações clinicamente reconhecidas é de 2% a 4% e 15% a 20%, respectivamente.
Considerações Clínicas
Risco materno e/ou embrio/fetal associado à doença
diabetes mal controlado na gravidez aumenta o risco materno de cetoacidose diabética, pré-eclâmpsia, abortos espontâneos, parto prematuro, natimorto e complicações no parto. O diabetes mal controlado aumenta o risco fetal de grandes defeitos congênitos, natimortos e morbidade relacionada à macrossomia.
Dados
Dados humanos
Não existem dados adequados sobre os riscos de desenvolvimento associados ao uso de PRANDIN 2mg em mulheres grávidas.
Dados de animais
repaglinida não foi teratogénica em ratos ou coelhos em doses 40 vezes (ratos) e aproximadamente 0,8 vezes (coelhos) a exposição clínica (com base em mg/m2) durante a gravidez. Filhotes de ratas expostas à repaglinida em 15 vezes a exposição clínica em mg/m2 durante os dias 17 a 22 de gestação e durante a lactação desenvolveram deformidades esqueléticas não teratogênicas consistindo em encurtamento, espessamento e flexão do úmero durante o período pós-natal. Este efeito não foi observado em doses até 2,5 vezes a exposição clínica (em uma base de mg/m2) nos dias 1 a 22 de gravidez ou em doses mais altas administradas durante os dias 1 a 16 de gravidez.
Lactação
Resumo do risco
Não há informações sobre a presença de PRANDIN 0,5mg no leite humano, os efeitos no lactente ou os efeitos na produção de leite. A repaglinida foi detectada em leite de rato, embora, devido a diferenças específicas da espécie na fisiologia da lactação, os dados em animais podem não prever com segurança os níveis da droga no leite humano. Os benefícios do aleitamento materno para o desenvolvimento e para a saúde devem ser considerados juntamente com a necessidade clínica de PRANDIN da mãe e quaisquer efeitos adversos potenciais do PRANDIN no lactente ou de condições maternas subjacentes.
Considerações Clínicas
Embora não se saiba se a repaglinida é excretada no leite humano, alguns agentes orais são excretados por esta via. Como o potencial de hipoglicemia em lactentes pode existir e devido aos efeitos sobre os animais em amamentação, deve-se decidir se PRANDIN deve ser descontinuado em lactantes ou se as mães devem descontinuar a amamentação. Se Prandin for descontinuado e se a dieta por si só for inadequada para controlar a glicemia, a terapia com insulina deve ser considerada.
Dados
Em estudos de reprodução em ratos, níveis mensuráveis de repaglinida foram detectados no leite materno das mães e níveis reduzidos de glicose no sangue foram observados nos filhotes. Estudos de promoção cruzada indicaram que as alterações esqueléticas [ver Gravidez ] pode ser induzida em filhotes de controle amamentados por mães tratadas, embora isso tenha ocorrido em menor grau do que os filhotes tratados no útero.
Uso Pediátrico
A segurança e a eficácia não foram estabelecidas em pacientes pediátricos.
Uso Geriátrico
Em estudos clínicos de 24 semanas ou mais de duração, 415 pacientes tinham mais de 65 anos de idade e nenhum paciente tinha mais de 75 anos de idade. Em estudos controlados com ativos de um ano, não foram observadas diferenças na eficácia ou eventos adversos entre esses indivíduos e aqueles com menos de 65 anos. Não houve aumento na frequência ou gravidade da hipoglicemia em indivíduos mais velhos, mas maior sensibilidade de alguns indivíduos mais velhos a A terapia com PRANDIN 0,5mg não pode ser descartada.
Insuficiência renal
Estudos farmacocinéticos de repaglinida foram realizados em pacientes com insuficiência renal leve a moderada (ClCr = 40 a 80 mL/min) e insuficiência renal grave (ClCr = 20 a 40 mL/min). Não é necessário ajuste de dose inicial em pacientes com disfunção renal leve a moderada. No entanto, pacientes com insuficiência renal grave devem iniciar o tratamento com PRANDIN com a dose de 0,5 mg e ser cuidadosamente titulados [ver DOSAGEM E ADMINISTRAÇÃO ].
Não foram realizados estudos em pacientes com depuração de creatinina abaixo de 20 mL/min ou pacientes com insuficiência renal que necessitam de hemodiálise.
Insuficiência hepática
Um estudo de dose única foi realizado em 12 pacientes com doença hepática crônica. Pacientes com comprometimento moderado a grave da função hepática apresentaram concentrações séricas mais altas e prolongadas. Portanto, PRANDIN 0,5mg deve ser usado com cautela em pacientes com função hepática prejudicada. Podem ser necessários intervalos mais longos entre os ajustes de dose para permitir uma avaliação completa da resposta.
SOBREDOSAGEM
Reações hipoglicêmicas graves com coma, convulsão ou outro comprometimento neurológico podem ocorrer e constituem emergências médicas que requerem hospitalização imediata. Os sintomas de hipoglicemia sem perda de consciência ou achados neurológicos devem ser tratados agressivamente com glicose oral e ajustes na dosagem do medicamento e/ou nos padrões de refeições. O monitoramento cuidadoso pode continuar até que o médico tenha certeza de que o paciente está fora de perigo. Os pacientes devem ser monitorados de perto por um período mínimo de 24 a 48 horas, pois a hipoglicemia pode recorrer após aparente recuperação clínica. Não há evidências de que o PRANDIN seja dialisável por hemodiálise.
CONTRA-INDICAÇÕES
PRANDIN é contraindicado em pacientes com:
- Uso concomitante de gemfibrozil [ver INTERAÇÕES MEDICAMENTOSAS ]
- Hipersensibilidade conhecida à repaglinida ou a qualquer ingrediente inativo
FARMACOLOGIA CLÍNICA
Mecanismo de ação
repaglinida reduz os níveis de glicose no sangue, estimulando a liberação de insulina do pâncreas. Essa ação depende do funcionamento das células beta (ß) nas ilhotas pancreáticas. A liberação de insulina é dependente de glicose e diminui em baixas concentrações de glicose.
A repaglinida fecha os canais de potássio dependentes de ATP na membrana das células ß ligando-se a locais caracterizáveis. Este bloqueio dos canais de potássio despolariza a célula ß, o que leva a uma abertura dos canais de cálcio. O aumento do influxo de cálcio resultante induz a secreção de insulina. O mecanismo do canal iônico é altamente seletivo para o tecido com baixa afinidade para o coração e o músculo esquelético.
Farmacodinâmica
Um estudo de dose-resposta de quatro semanas, duplo-cego e controlado por placebo foi realizado em 138 pacientes com diabetes tipo 2 usando doses variando de 0,25 (dose não aprovada) a 4 mg tomadas com cada uma das três refeições. A terapia com PRANDIN resultou na redução da glicose proporcional à dose em toda a faixa de dose. Os níveis de insulina no plasma aumentaram após as refeições e reverteram para a linha de base antes da próxima refeição. A maior parte do efeito de redução da glicemia em jejum foi demonstrada dentro de 1 a 2 semanas.
Em um estudo duplo-cego, controlado por placebo, de titulação de dose de 3 meses, as doses de PRANDIN 0,5 mg ou placebo para cada paciente foram aumentadas semanalmente de 0,25 mg (dose não aprovada) até 0,5, 1 e 2 mg, até um máximo de 4 mg, até atingir um nível de glicemia de jejum (FPG)
dosagem de PRANDIN 0,5 mg em relação à liberação de insulina relacionada à refeição foi estudada em três ensaios, incluindo 58 pacientes. O controle glicêmico foi mantido durante um período em que a refeição e o padrão de dosagem foram variados (2, 3 ou 4 refeições por dia; antes das refeições x 2, 3 ou 4) em comparação com um período de 3 refeições regulares e 3 doses por dia ( antes das refeições x 3). O efeito de redução da glicose no sangue não diferiu quando PRANDIN 0,5 mg foi administrado no início de uma refeição, 15 minutos antes ou 30 minutos antes da refeição.
Farmacocinética
Os parâmetros farmacocinéticos da repaglinida obtidos de um estudo cruzado de dose única em indivíduos saudáveis e de um estudo de dose múltipla, paralelo, de proporcionalidade de dose (0,5, 1, 2 e 4 mg) em pacientes com diabetes tipo 2 estão resumidos nas Tabelas 5 e 6. Estes dados indicam que a repaglinida não se acumulou no soro. A depuração da repaglinida oral não se alterou no intervalo de dose de 0,5 a 4 mg, indicando uma relação linear entre a dose e os níveis plasmáticos do fármaco.
Absorção
Após administração oral, a repaglinida é completamente absorvida pelo trato gastrointestinal. Após doses orais únicas e múltiplas em indivíduos saudáveis ou em pacientes, os níveis plasmáticos máximos da droga (Cmax) ocorrem dentro de 1 hora (Tmax). A repaglinida é eliminada da corrente sanguínea com meia-vida de aproximadamente 1 hora. A biodisponibilidade absoluta média é de 56%. Quando a repaglinida foi administrada com alimentos, o Tmax médio não foi alterado, mas a Cmax e a AUC médias (área sob a curva de tempo/concentração plasmática) diminuíram 20% e 12,4%, respectivamente.
Distribuição
Após administração intravenosa (IV) em indivíduos saudáveis, o volume de distribuição no estado de equilíbrio (Vss) foi de 31 L e a depuração corporal total (CL) foi de 38 L/h. A ligação às proteínas e à albumina do soro humano foi superior a 98%.
Metabolismo e eliminação
repaglinida é completamente metabolizada por biotransformação oxidativa e conjugação direta com ácido glicurônico após uma dose intravenosa ou oral. Os principais metabólitos são um ácido dicarboxílico oxidado (M2), a amina aromática (M1) e o acil glicuronídeo (M7). O sistema enzimático do citocromo P-450, especificamente 2C8 e 3A4, demonstrou estar envolvido na N-desalquilação da repaglinida em M2 e na oxidação adicional em M1. Os metabolitos não contribuem para o efeito hipoglicemiante da repaglinida. Dentro de 96 horas após a administração de 14C-repaglinida como dose oral única, aproximadamente 90% do marcador radioativo foi recuperado nas fezes e aproximadamente 8% na urina. Apenas 0,1% da dose é eliminada na urina como composto original. O metabólito principal (M2) representou 60% da dose administrada. Menos de 2% do fármaco original foi recuperado nas fezes. A repaglinida parece ser um substrato para o transportador hepático ativo (proteína transportadora de ânions orgânicos OATP1B1).
Variabilidade da Exposição
AUC da repaglinida após doses múltiplas de 0,25 a 4 mg com cada refeição varia bastante. Os coeficientes de variação intraindividual e interindividual foram de 36% e 69%, respectivamente. A AUC acima da faixa de dose terapêutica incluiu 69 a 1.005 ng/mL*h, mas a exposição de AUC de até 5.417 ng/mL*h foi alcançada em estudos de aumento de dose sem consequências adversas aparentes.
Populações Específicas
Geriátrico
Voluntários saudáveis foram tratados com um regime de 2 mg de PRANDIN 0,5 mg tomado antes de cada uma das 3 refeições. Não houve diferenças significativas na farmacocinética da repaglinida entre o grupo de pacientes Uso em populações específicas ].
Gênero
Uma comparação da farmacocinética em homens e mulheres mostrou que a AUC na faixa de dose de 0,5 mg a 4 mg era 15% a 70% maior em mulheres com diabetes tipo 2. Essa diferença não se refletiu na frequência de episódios de hipoglicemia (homens: 16%; mulheres: 17%) ou outros eventos adversos.
Corrida
Não foram realizados estudos farmacocinéticos para avaliar os efeitos da raça, mas em um estudo de 1 ano nos EUA em pacientes com diabetes tipo 2, o efeito de redução da glicose no sangue foi comparável entre caucasianos (n=297) e afro-americanos (n= 33). Em um estudo de dose-resposta nos EUA, não houve diferença aparente na exposição (AUC) entre caucasianos (n=74) e hispânicos (n=33).
Insuficiência renal
farmacocinética de dose única e de estado de equilíbrio da repaglinida foi comparada entre pacientes com diabetes tipo 2 e função renal normal (CrCl > 80 mL/min), insuficiência renal leve a moderada (CrCl = 40 a 80 mL/min) e grave comprometimento da função renal (CrCl = 20 a 40 mL/min). Tanto a AUC quanto a Cmax da repaglinida foram semelhantes em pacientes com função renal normal e leve a moderadamente comprometida (valores médios 56,7 ng/mL*h vs 57,2 ng/mL*hr e 37,5 ng/mL vs 37,7 ng/mL, respectivamente). com função renal gravemente reduzida apresentaram valores médios de AUC e Cmax elevados (98,0 ng/mL*h e 50,7 ng/mL, respectivamente), mas este estudo mostrou apenas uma correlação fraca entre os níveis de repaglinida e a depuração de creatinina.
Insuficiência hepática
Um estudo aberto de dose única foi conduzido em 12 indivíduos saudáveis e 12 pacientes com doença hepática crônica (DCL) classificada pela escala Child-Pugh e depuração de cafeína. Pacientes com comprometimento moderado a grave da função hepática apresentaram concentrações séricas mais altas e mais prolongadas de repaglinida total e não ligada do que indivíduos saudáveis (AUCsaudável: 91,6 ng/mL*h; pacientes com AUCCLD: 368,9 ng/mL*h; Cmax, saudável: 46,7 ng/mL; Cmax, pacientes CLD: 105,4 ng/mL). A AUC foi estatisticamente correlacionada com a depuração da cafeína. Nenhuma diferença nos perfis de glicose foi observada entre os grupos de pacientes.
Interações Medicamentosas
Estudos de interação medicamentosa realizados em voluntários saudáveis mostram que PRANDIN 0,5 mg não teve efeito clinicamente relevante nas propriedades farmacocinéticas da digoxina, teofilina ou varfarina. A coadministração de cimetidina com PRANDIN 1mg não alterou significativamente a absorção e eliminação de repaglinida.
Além disso, os seguintes medicamentos foram estudados em voluntários saudáveis com a coadministração de PRANDIN.
Estudos clínicos
Ensaios de monoterapia
Um estudo duplo-cego, controlado por placebo, foi realizado em 362 pacientes tratados por 24 semanas. A HbA1c para os grupos tratados com PRANDIN (grupos de 1 e 4 mg combinados) no final do estudo foi diminuída em comparação com o grupo tratado com placebo em pacientes virgens de tratamento e em pacientes previamente tratados com hipoglicemiantes orais em 2,1% e 1,7%, respectivamente. Neste estudo de dose fixa, os pacientes que nunca haviam recebido tratamento com agentes hipoglicemiantes orais e pacientes com HbA1c abaixo de 8% no início do estudo apresentaram maior redução da glicose no sangue.
Testes de combinação
PRANDIN em combinação com metformina
PRANDIN foi estudado em combinação com metformina em 83 pacientes não controlados satisfatoriamente com exercícios, dieta e metformina isoladamente. A dosagem de PRANDIN 2mg foi titulada por 4 a 8 semanas, seguida por um período de manutenção de 3 meses. A terapia combinada com PRANDIN 1mg e metformina resultou em melhora estatisticamente significativa na HbA1c e glicemia de jejum (FPG) em comparação com PRANDIN 2mg ou monoterapia com metformina (Tabela 8). Neste estudo, onde a dosagem de metformina foi mantida constante, a terapia combinada de PRANDIN e metformina mostrou efeitos poupadores de dose em relação ao PRANDIN. A melhora na HbA1c e FPG do grupo de combinação foi alcançada com uma dosagem diária de PRANDIN 0,5mg mais baixa do que no grupo de monoterapia com PRANDIN (Tabela 8).
PRANDIN 1mg em combinação com pioglitazona
Um regime de terapia combinada de PRANDIN e pioglitazona (N=123) foi comparado com PRANDIN sozinho (N=61) e pioglitazona sozinho (N=62) em um estudo de 24 semanas que envolveu 246 pacientes previamente tratados com monoterapia com sulfonilureia ou metformina (HbA1c > 7,0%). A dosagem de PRANDIN 1mg foi titulada durante as primeiras 12 semanas, seguida por um período de manutenção de 12 semanas. A terapia de combinação resultou em melhora estatisticamente significativa na HbA1c e FPG em comparação com a monoterapia (Figura 1). As alterações da linha de base para completadores em FPG (mg/dL) e HbA1c (%), respectivamente, foram: -39,8 mg/dL e -0,1% para PRANDIN, -35,3 mg/dL e -0,1% para pioglitazona e -92,4 mg/ dL e -1,9% para a combinação. Neste estudo, onde a dosagem de pioglitazona foi mantida constante, o grupo de terapia combinada mostrou efeitos poupadores de dose em relação ao PRANDIN (ver Figura 1 Legenda). A melhora na HbA1c e FPG do grupo de combinação foi alcançada com uma dosagem diária de PRANDIN mais baixa do que no grupo de monoterapia com PRANDIN.
Figura 1: PRANDIN em combinação com pioglitazona: valores de HbA1c
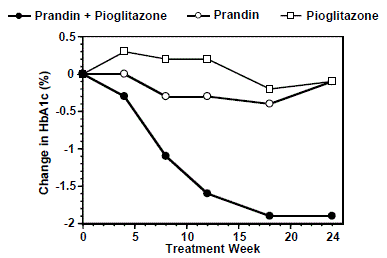
LENDA
Valores de HbA1c por semana de estudo para pacientes que completaram o estudo (combinação, N = 101; PRANDIN 1mg, N = 35, pioglitazona, N = 26). Indivíduos com FPG acima de 270 mg/dL foram retirados do estudo.
Dose de pioglitazona: fixada em 30 mg/dia; Dose final mediana de PRANDIN 1mg: 6 mg/dia para combinação e 10 mg/dia para monoterapia.
PRANDIN em combinação com Rosiglitazona
Um regime de terapia combinada de PRANDIN e rosiglitazona foi comparado à monoterapia com qualquer agente sozinho em um estudo de 24 semanas que envolveu 252 pacientes previamente tratados com sulfonilureia ou metformina (HbA1c > 7,0%). A terapia de combinação resultou em melhora estatisticamente significativa em HbA1c e FPG em comparação com a monoterapia (Tabela 9 abaixo). Os efeitos glicêmicos da terapia de combinação foram poupadores de dose em relação à dosagem diária total de 1 mg de PRANDIN e à dosagem diária total de rosiglitazona (ver Legenda da Tabela 9). A melhora na HbA1c e FPG do grupo de terapia combinada foi alcançada com menor dose diária de PRANDIN 1mg e rosiglitazona, em comparação com os respectivos grupos de monoterapia.
INFORMAÇÃO DO PACIENTE
Hipoglicemia
Informar os pacientes que PRANDIN 2mg pode causar hipoglicemia e instruir os pacientes e seus cuidadores sobre os procedimentos de autogestão, incluindo monitoramento da glicose e controle da hipoglicemia. Informe os pacientes que sua capacidade de concentração e reação pode ser prejudicada como resultado da hipoglicemia. Em pacientes com maior risco de hipoglicemia e pacientes com consciência sintomática reduzida de hipoglicemia, recomenda-se o aumento da frequência de monitoramento da glicose no sangue [ver AVISOS E PRECAUÇÕES ].
Administração
Instrua os pacientes a tomar PRANDIN 0,5 mg dentro de 30 minutos antes das refeições. Instrua os pacientes a pular a dose de PRANDIN quando uma refeição for omitida [ver DOSAGEM E ADMINISTRAÇÃO ].
Interações medicamentosas
Discutir potenciais interações medicamentosas com os pacientes e informá-los sobre potenciais interações medicamentosas com PRANDIN [ver INTERAÇÕES MEDICAMENTOSAS ].
