Proscar 5mg Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Proscar 5mg e como é usado?
Proscar é um medicamento de prescrição usado para tratar os sintomas da Hiperplasia Prostática Benigna e Alopecia Androgênica. Este medicamento é para uso apenas em homens. Proscar 5mg pode ser usado sozinho ou com outros medicamentos.
Proscar pertence a uma classe de medicamentos chamados inibidores da 5-alfa-redutase.
Não se sabe se Proscar 5mg é seguro e eficaz em crianças.
Quais são os possíveis efeitos colaterais do Proscar 5mg?
Proscar pode causar efeitos colaterais graves, incluindo:
- náusea grave ou contínua,
- dificuldade para respirar,
- inchaço do rosto, lábios, língua ou garganta,
- nódulos mamários,
- dor ou sensibilidade mamária,
- secreção mamilar e
- outras alterações mamárias
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Proscar incluem:
- perda de interesse em sexo,
- impotência,
- problemas para ter um orgasmo, e
- ejaculação anormal
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Proscar. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
DESCRIÇÃO
PROSCAR (finasterida), um composto sintético de 4-azasteróides, é um inibidor específico do esteróide Tipo II 5α-redutase, uma enzima intracelular que converte o andrógeno testosterona em 5α-diidrotestosterona (DHT).
Finasterida é 4-azaandrost-1-eno-17-carboxamida, N-(1,1-dimetiletil)-3-oxo-,(5α,17ß)-. A fórmula empírica da finasterida é C23H36N2O2 e seu peso molecular é 372,55. Sua fórmula estrutural é:
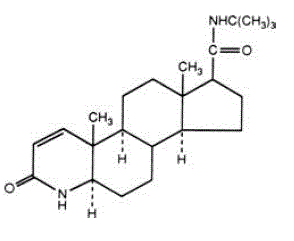
A finasterida é um pó cristalino branco com ponto de fusão próximo a 250°C. É livremente solúvel em clorofórmio e em solventes de álcoois inferiores, mas é praticamente insolúvel em água.
Os comprimidos de PROSCAR (finasterida) para administração oral são comprimidos revestidos por película que contêm 5 mg de finasterida e os seguintes ingredientes inativos: lactose hidratada, celulose microcristalina, amido pré-gelatinizado, amidoglicolato de sódio, hidroxipropilcelulose LF, hidroxipropilmetilcelulose, dióxido de titânio, estearato de magnésio , talco, docusato de sódio, laca de alumínio FD&C Blue 2 e óxido de ferro amarelo.
INDICAÇÕES
Monoterapia
PROSCAR® é indicado para o tratamento da hiperplasia prostática benigna (HPB) sintomática em homens com próstata aumentada para:
- Melhorar os sintomas
- Reduz o risco de retenção urinária aguda
- Reduzir o risco da necessidade de cirurgia, incluindo ressecção transuretral da próstata (RTU) e prostatectomia.
Combinação com alfa-bloqueador
PROSCAR 5mg administrado em combinação com o alfabloqueador doxazosina é indicado para reduzir o risco de progressão sintomática da HBP (um aumento confirmado de ≥4 pontos no escore de sintomas da American Urological Association (AUA)).
Limitações de uso
PROSCAR não está aprovado para a prevenção do câncer de próstata.
DOSAGEM E ADMINISTRAÇÃO
PROSCAR pode ser administrado com ou sem refeições.
Monoterapia
A dose recomendada de PROSCAR é um comprimido (5 mg) tomado uma vez ao dia [ver Estudos clínicos ].
Combinação com alfa-bloqueador
A dose recomendada de PROSCAR é um comprimido (5 mg) tomado uma vez ao dia em combinação com o alfa-bloqueador doxazosina [ver Estudos clínicos ].
COMO FORNECIDO
Formas de dosagem e pontos fortes
Comprimidos revestidos por película azuis, modificados em forma de maçã, de 5 mg, com o código MSD 72 de um lado e PROSCAR 5 mg do outro.
Armazenamento e manuseio
Nº 3094 - PROSCAR comprimidos 5 mg são comprimidos revestidos por película azuis, modificados em forma de maçã, com o código MSD 72 de um lado e PROSCAR do outro. Eles são fornecidos da seguinte forma:
NDC 0006-0072-31 unidade de uso frascos de 30 NDC 0006-0072-58 unidade de uso frascos de 100.
Armazenamento e manuseio
Armazenar em temperatura ambiente abaixo de 30°C (86°F). Proteger da luz e manter o recipiente bem fechado.
As mulheres não devem manusear comprimidos de PROSCAR 5mg esmagados ou quebrados quando estão grávidas ou podem estar grávidas devido à possibilidade de absorção da finasterida e ao risco potencial subsequente para o feto do sexo masculino. AVISOS E PRECAUÇÕES  e Uso em populações específicas ].
Distribuído por: Merck Sharp & Dohme Corp., uma subsidiária da MERCK & CO.,INC., Whitehouse Station, NJ 08889, EUA. Revisado: junho de 2021
EFEITOS COLATERAIS
Experiência de Ensaios Clínicos
Como os ensaios clínicos são conduzidos sob condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparadas às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática clínica.
Estudo controlado por placebo de 4 anos (PLESS)
No PLESS, 1.524 pacientes tratados com PROSCAR e 1.516 pacientes tratados com placebo foram avaliados quanto à segurança durante um período de 4 anos. As reações adversas mais frequentemente notificadas foram relacionadas com a função sexual. 3,7% (57 pacientes) tratados com PROSCAR 5mg e 2,1% (32 pacientes) tratados com placebo interromperam a terapia como resultado de reações adversas relacionadas à função sexual, que são as reações adversas mais frequentemente relatadas.
Tabela 1 apresenta as únicas reações adversas clínicas consideradas possivelmente, provavelmente ou definitivamente relacionadas ao medicamento pelo investigador, para as quais a incidência do PROSCAR 5mg foi ≥1% e maior que o placebo ao longo dos 4 anos do estudo. Nos anos 2-4 do estudo, não houve diferença significativa entre os grupos de tratamento nas incidências de impotência, diminuição da libido e distúrbios da ejaculação.
Estudos de Fase III e Extensões Abertas de 5 Anos
O perfil de experiência adversa nos estudos de Fase III de 1 ano, controlados por placebo, as extensões abertas de 5 anos e PLESS foram semelhantes.
Estudo de Terapia Médica de Sintomas Prostáticos (MTOPS)
No estudo MTOPS, 3.047 homens com HBP sintomática foram randomizados para receber PROSCAR 5 mg/dia (n=768), doxazosina 4 ou 8 mg/dia (n=756), a combinação de PROSCAR 5 mg/dia e doxazosina 4 ou 8 mg/dia (n=786), ou placebo (n=737) por 4 a 6 anos. [Ver um Estudos clínicos .]
As taxas de incidência de experiências adversas relacionadas a medicamentos relatadas por ≥2% dos pacientes em qualquer grupo de tratamento no estudo MTOPS estão listadas na Tabela 2.
Os efeitos adversos individuais que ocorreram com mais frequência no grupo de combinação em comparação com qualquer droga isoladamente foram: astenia, hipotensão postural, edema periférico, tontura, diminuição da libido, rinite, ejaculação anormal, impotência e função sexual anormal (ver Tabela 2). Destes, a incidência de ejaculação anormal em pacientes recebendo terapia combinada foi comparável à soma das incidências desta experiência adversa relatada para as duas monoterapias.
A terapia combinada com finasterida e doxazosina não foi associada a nenhuma nova experiência clínica adversa.
Quatro pacientes no MTOPS relataram a experiência adversa de câncer de mama. Três desses pacientes estavam em uso apenas de finasterida e um estava em terapia combinada. [Ver um Dados de longo prazo .]
estudo MTOPS não foi projetado especificamente para fazer comparações estatísticas entre grupos para experiências adversas relatadas. Além disso, comparações diretas de dados de segurança entre o estudo MTOPS e estudos anteriores de agentes únicos podem não ser apropriadas com base em diferenças na população de pacientes, dosagem ou regime de dose e outros elementos de procedimento e de desenho do estudo.
Dados de longo prazo
Câncer de próstata de alto grau
O estudo PCPT foi um estudo randomizado, duplo-cego, controlado por placebo de 7 anos que envolveu 18.882 homens ≥55 anos de idade com um exame de toque retal normal e um PSA ≤3,0 ng/mL. Os homens receberam PROSCAR (finasterida 5 mg) ou placebo diariamente. Os pacientes foram avaliados anualmente com PSA e toque retal. Biópsias foram realizadas para PSA elevado, um exame de toque retal anormal ou no final do estudo. A incidência de câncer de próstata com pontuação de Gleason 8-10 foi maior em homens tratados com finasterida (1,8%) do que naqueles tratados com placebo (1,1%) [ver INDICAÇÕES  e AVISOS E PRECAUÇÕES ]. Em um ensaio clínico de 4 anos controlado por placebo com outro inibidor da 5α-redutase (dutasterida, AVODART), foram observados resultados semelhantes para o câncer de próstata com pontuação de Gleason 8-10 (1% dutasterida versus 0,5% placebo).
Nenhum benefício clínico foi demonstrado em pacientes com câncer de próstata tratados com PROSCAR.
Câncer de mama
Durante o estudo MTOPS de 4 a 6 anos controlado por placebo e comparador que envolveu 3.047 homens, houve 4 casos de câncer de mama em homens tratados com finasterida, mas nenhum caso em homens não tratados com finasterida. Durante o estudo PLESS de 4 anos, controlado por placebo, que envolveu 3.040 homens, houve 2 casos de câncer de mama em homens tratados com placebo, mas nenhum caso em homens tratados com finasterida. Durante o Prostate Cancer Prevention Trial (PCPT) de 7 anos controlado por placebo que envolveu 18.882 homens, houve 1 caso de câncer de mama em homens tratados com finasterida e 1 caso de câncer de mama em homens tratados com placebo. A relação entre o uso prolongado de finasterida e neoplasia de mama masculina é atualmente desconhecida.
Função Sexual
Não há evidência de aumento das experiências adversas sexuais com o aumento da duração do tratamento com PROSCAR. Novos relatos de experiências adversas sexuais relacionadas a drogas diminuíram com a duração da terapia.
Experiência pós-marketing
Os seguintes eventos adversos adicionais foram relatados na experiência pós-comercialização com PROSCAR. Como esses eventos são relatados voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento:
- reações de hipersensibilidade, como prurido, urticária e angioedema (incluindo inchaço dos lábios, língua, garganta e face)
- dor testicular
- hematospermia
- disfunção sexual que continuou após a descontinuação do tratamento, incluindo disfunção erétil, diminuição da libido e distúrbios da ejaculação (por exemplo, redução do volume ejaculado). Esses eventos foram relatados raramente em homens tomando PROSCAR para o tratamento da HBP. A maioria dos homens era mais velha e estava tomando medicamentos concomitantes e/ou tinha comorbidades. O papel independente de PROSCAR 5mg nesses eventos é desconhecido.
- infertilidade masculina e/ou baixa qualidade seminal foram relatadas raramente em homens tomando PROSCAR 5mg para o tratamento da HBP. A normalização ou melhora da má qualidade seminal foi relatada após a descontinuação da finasterida. O papel independente do PROSCAR nesses eventos é desconhecido.
- depressão
- câncer de mama masculino.
O seguinte evento adverso adicional relacionado à disfunção sexual que continuou após a descontinuação do tratamento foi relatado na experiência pós-comercialização com finasterida em doses mais baixas usadas para tratar a calvície masculina. Como o evento é relatado voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento:
- distúrbios do orgasmo
INTERAÇÕES MEDICAMENTOSAS
Sistema de enzimas metabolizadoras de drogas ligadas ao citocromo P450
Não foram identificadas interações medicamentosas de importância clínica. A finasterida não parece afetar o sistema enzimático de metabolização do fármaco ligado ao citocromo P450. Os compostos que foram testados no homem incluíram antipirina, digoxina, propranolol, teofilina e varfarina e não foram encontradas interações clinicamente significativas.
Outra terapia concomitante
Embora não tenham sido realizados estudos específicos de interação, PROSCAR 5mg foi usado concomitantemente em estudos clínicos com acetaminofeno, ácido acetilsalicílico, α-bloqueadores, inibidores da enzima conversora de angiotensina (ECA), analgésicos, anticonvulsivantes, agentes bloqueadores beta-adrenérgicos, diuréticos, cálcio bloqueadores de canal, nitratos cardíacos, inibidores da HMG-CoA redutase, drogas anti-inflamatórias não esteróides (AINEs), benzodiazepinas, antagonistas H2 e anti-infecciosos de quinolonas sem evidência de interações adversas clinicamente significativas.
AVISOS
Incluído como parte do "PRECAUÇÕES" Seção
PRECAUÇÕES
Efeitos sobre o antígeno específico da próstata (PSA) e o uso do PSA na detecção do câncer de próstata
Em estudos clínicos, PROSCAR reduziu a concentração sérica de PSA em aproximadamente 50% em seis meses de tratamento. Essa diminuição é previsível em toda a faixa de valores de PSA em pacientes com HBP sintomática, embora possa variar em indivíduos.
Para interpretação de PSAs seriados em homens tomando PROSCAR, uma nova linha de base de PSA deve ser estabelecida pelo menos seis meses após o início do tratamento e o PSA monitorado periodicamente a partir de então. Qualquer aumento confirmado do valor mais baixo de PSA enquanto estiver em uso de PROSCAR 5mg pode sinalizar a presença de câncer de próstata e deve ser avaliado, mesmo se os níveis de PSA ainda estiverem dentro da faixa normal para homens que não estejam tomando um inibidor da 5α redutase. O não cumprimento da terapia PROSCAR também pode afetar os resultados do teste de PSA. Para interpretar um valor isolado de PSA em pacientes tratados com PROSCAR 5mg por seis meses ou mais, os valores de PSA devem ser duplicados para comparação com os valores normais em homens não tratados. Esses ajustes preservam a utilidade do PSA para detectar câncer de próstata em homens tratados com PROSCAR.
PROSCAR também pode causar diminuição do PSA sérico na presença de câncer de próstata.
proporção de PSA livre para total (percentagem de PSA livre) permanece constante mesmo sob a influência de PROSCAR. Se os médicos optarem por usar a porcentagem de PSA livre como auxiliar na detecção de câncer de próstata em homens submetidos à terapia com finasterida, nenhum ajuste em seu valor parece necessário.
Aumento do risco de câncer de próstata de alto grau
Homens com 55 anos ou mais com toque retal normal e PSA ≤ 3,0 ng/mL na linha de base tomando finasterida 5 mg/dia no Prostate Cancer Prevention Trial (PCPT) de 7 anos tiveram um risco aumentado de Gleason score 8-10 câncer de próstata (finasterida 1,8% vs placebo 1,1%). [Ver um INDICAÇÕES  e REAÇÕES ADVERSAS .] Resultados semelhantes foram observados em um ensaio clínico de 4 anos controlado por placebo com outro inibidor da 5α-redutase (dutasterida, AVODART) (1% dutasterida versus 0,5% placebo). Os inibidores da 5α redutase podem aumentar o risco de desenvolvimento de câncer de próstata de alto grau. Não foi estabelecido se o efeito dos inibidores da 5α-redutase para reduzir o volume da próstata ou fatores relacionados ao estudo impactaram os resultados desses estudos.
Exposição de mulheres
Risco para o Feto Masculino
PROSCAR é contraindicado em mulheres grávidas e em mulheres que possam estar grávidas e não indicado para uso em mulheres. Com base em estudos em animais e no mecanismo de ação, PROSCAR 5mg pode causar desenvolvimento anormal da genitália externa em fetos do sexo masculino se administrado a mulheres grávidas. Mulheres grávidas ou potencialmente grávidas não devem manusear comprimidos de PROSCAR 5mg esmagados ou quebrados. Os comprimidos de PROSCAR 5mg são revestidos e evitarão o contato com o ingrediente ativo durante o manuseio normal, desde que os comprimidos não tenham sido quebrados ou esmagados. Se uma mulher grávida entrar em contato com comprimidos de PROSCAR 5mg esmagados ou quebrados, a área de contato deve ser lavada imediatamente com água e sabão. [Ver um CONTRA-INDICAÇÕES ,UMA Uso em populações específicas ,UMA FARMACOLOGIA CLÍNICA , e COMO FORNECIDO .]
Pacientes pediátricos e mulheres
PROSCAR não é indicado para uso em pacientes pediátricos [ver Uso em populações específicas  e FARMACOLOGIA CLÍNICA ] ou fêmeas [veja também AVISOS E PRECAUÇÕES ,UMA Uso em populações específicas ,UMA FARMACOLOGIA CLÍNICA , e COMO FORNECIDO ].
Efeito nas características do sêmen
tratamento com PROSCAR por 24 semanas para avaliar os parâmetros do sêmen em voluntários saudáveis do sexo masculino não revelou efeitos clinicamente significativos na concentração, mobilidade, morfologia ou pH do esperma. Foi observada uma diminuição mediana de 0,6 mL (22,1%) no volume ejaculado com uma redução concomitante no total de espermatozóides por ejaculado. Esses parâmetros permaneceram dentro da faixa normal e foram reversíveis após a descontinuação da terapia com um tempo médio para retornar à linha de base de 84 semanas.
Consideração de outras condições urológicas
Antes de iniciar o tratamento com PROSCAR 5mg, deve-se considerar outras condições urológicas que possam causar sintomas semelhantes. Além disso, o câncer de próstata e a HPB podem coexistir.
Pacientes com grande volume urinário residual e/ou fluxo urinário severamente diminuído devem ser cuidadosamente monitorados para uropatia obstrutiva. Esses pacientes podem não ser candidatos à terapia com finasterida.
Informações de Aconselhamento do Paciente
Aconselhe o paciente a ler o rótulo do paciente aprovado pela FDA ( INFORMAÇÃO DO PACIENTE ).
Aumento do risco de câncer de próstata de alto grau
Os pacientes devem ser informados de que houve um aumento do câncer de próstata de alto grau em homens tratados com inibidores da 5α-redutase indicados para tratamento da HBP, incluindo PROSCAR 5mg, em comparação com aqueles tratados com placebo em estudos que analisaram o uso desses medicamentos para prevenir a próstata câncer [ver INDICAÇÕES ,UMA AVISOS E PRECAUÇÕES , e REAÇÕES ADVERSAS ].
Exposição de Fêmeas - Risco para Feto Masculino
Os médicos devem informar aos pacientes que mulheres grávidas ou que possam estar grávidas não devem manusear comprimidos de PROSCAR esmagados ou quebrados devido à possibilidade de absorção da finasterida e ao risco potencial subsequente para o feto masculino. Os comprimidos de PROSCAR são revestidos e evitam o contato com o ingrediente ativo durante o manuseio normal, desde que os comprimidos não tenham sido quebrados ou esmagados. Se uma mulher grávida ou potencialmente grávida entrar em contato com comprimidos de PROSCAR esmagados ou quebrados, a área de contato deve ser lavada imediatamente com água e sabão [ver CONTRA-INDICAÇÕES ,UMA AVISOS E PRECAUÇÕES ,UMA Uso em populações específicas  e COMO FORNECIDO ].
Instruções adicionais
Os médicos devem informar os pacientes que o volume de ejaculação pode diminuir em alguns pacientes durante o tratamento com PROSCAR. Esta diminuição não parece interferir com a função sexual normal. No entanto, impotência e diminuição da libido podem ocorrer em pacientes tratados com PROSCAR [ver REAÇÕES ADVERSAS ].
Os médicos devem instruir seus pacientes a relatar imediatamente quaisquer alterações em suas mamas, como nódulos, dor ou secreção mamilar. Alterações mamárias, incluindo aumento mamário, sensibilidade e neoplasia foram relatadas [ver REAÇÕES ADVERSAS ].
Os médicos devem instruir seus pacientes a ler a bula do paciente antes de iniciar a terapia com PROSCAR 5mg e reler sempre que a prescrição for renovada, para que estejam cientes das informações atuais para os pacientes sobre PROSCAR.
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Carcinogênese
Nenhuma evidência de efeito tumorigênico foi observada em um estudo de 24 meses em ratos Sprague-Dawley recebendo doses de finasterida de até 160 mg/kg/dia em machos e 320 mg/kg/dia em fêmeas. Essas doses produziram exposições sistêmicas respectivas em ratos de 111 e 274 vezes aquelas observadas no homem recebendo a dose humana recomendada de 5 mg/dia. Todos os cálculos de exposição foram baseados na AUC calculada (0-24 h) para animais e AUC média (0-24 h) para o homem (0,4 μg•h/mL).
Em um estudo de carcinogenicidade de 19 meses em camundongos CD-1, um aumento estatisticamente significativo (p≤0,05) na incidência de adenomas testiculares de células de Leydig foi observado em 228 vezes a exposição humana (250 mg/kg/dia). Em camundongos com 23 vezes a exposição humana, estimada (25 mg/kg/dia) e em ratos com 39 vezes a exposição humana (40 mg/kg/dia) foi observado um aumento na incidência de hiperplasia das células de Leydig. Uma correlação positiva entre as alterações proliferativas nas células de Leydig e um aumento nos níveis séricos de LH (2 a 3 vezes acima do controle) foi demonstrada em ambas as espécies de roedores tratadas com altas doses de finasterida. Não foram observadas alterações nas células de Leydig relacionadas à droga em ratos ou cães tratados com finasterida por 1 ano em 30 e 350 vezes (20 mg/kg/dia e 45 mg/kg/dia, respectivamente) ou em camundongos tratados por 19 meses em 2,3 vezes a exposição humana, estimada (2,5 mg/kg/dia).
Mutagênese
Nenhuma evidência de mutagenicidade foi observada em um ensaio de mutagênese bacteriana in vitro, um ensaio de mutagênese em células de mamífero, ou em um ensaio de eluição alcalina in vitro. Em um ensaio de aberrações cromossômicas in vitro, usando células de ovário de hamster chinês, houve um leve aumento nas aberrações cromossômicas. Estas concentrações correspondem a 4.000-5.000 vezes os níveis plasmáticos de pico no homem com uma dose total de 5 mg. Em um ensaio de aberração cromossômica in vivo em camundongos, nenhum aumento relacionado ao tratamento na aberração cromossômica foi observado com finasterida na dose máxima tolerada de 250 mg/kg/dia (228 vezes a exposição humana) conforme determinado nos estudos de carcinogenicidade.
Prejuízo da Fertilidade
Em coelhos machos sexualmente maduros tratados com finasterida em 543 vezes a exposição humana (80 mg/kg/dia) por até 12 semanas, nenhum efeito sobre a fertilidade, contagem de esperma ou volume ejaculado foi observado. Em ratos machos sexualmente maduros tratados com 61 vezes a exposição humana (80 mg/kg/dia), não houve efeitos significativos na fertilidade após 6 ou 12 semanas de tratamento; no entanto, quando o tratamento foi continuado por até 24 ou 30 semanas, houve uma aparente diminuição da fertilidade, fecundidade e uma diminuição significativa associada nos pesos das vesículas seminais e da próstata. Todos estes efeitos foram reversíveis dentro de 6 semanas após a descontinuação do tratamento. Nenhum efeito relacionado ao medicamento nos testículos ou no desempenho de acasalamento foi observado em ratos ou coelhos. Esta diminuição da fertilidade em ratos tratados com finasterida é secundária ao seu efeito nos órgãos sexuais acessórios (próstata e vesículas seminais), resultando na falha na formação de um tampão seminal. O tampão seminal é essencial para a fertilidade normal em ratos e não é relevante no homem.
Uso em populações específicas
Gravidez
Resumo do risco
PROSCAR é contraindicado em mulheres grávidas e não é indicado para uso em mulheres. Com base em estudos em animais e no mecanismo de ação, PROSCAR 5mg pode causar desenvolvimento anormal da genitália externa em um feto masculino se administrado a uma mulher grávida [ver AVISOS E PRECAUÇÕES  e FARMACOLOGIA CLÍNICA ].
Em um estudo de desenvolvimento embriofetal em ratos, houve um aumento dependente da dose na hipospádia que ocorreu em 3,6 a 100% da prole masculina de ratas grávidas que receberam finasterida oral durante o período de organogênese principal em doses aproximadamente 0,1 a 86 vezes o máximo dose humana recomendada (MRHD) de 5 mg/dia (com base na AUC em doses animais de 0,1 a 100 mg/kg/dia).
Pesos prostático e vesicular seminal diminuídos, separação prepucial retardada e desenvolvimento transitório do mamilo também foram observados na prole masculina em doses maternas orais aproximadamente 0,03 vezes a MRHD (com base na AUC na dose animal de 0,03 mg/kg/dia), juntamente com diminuição da distância anogenital na prole masculina em doses maternas orais aproximadamente 0,003 vezes a MRHD (com base na AUC na dose animal de 0,003 mg/kg/dia).
PROSCAR é um inibidor da 5α-redutase Tipo II que previne a conversão da testosterona em 5α-diidrotestosterona (DHT), um hormônio necessário para o desenvolvimento normal da genitália masculina. Se este medicamento for usado durante a gravidez, ou se a paciente engravidar enquanto estiver tomando este medicamento, a paciente deve ser informada do risco potencial para o feto masculino.
desenvolvimento genital masculino anormal é uma consequência esperada quando a conversão da testosterona em 5α-diidrotestosterona (DHT) é inibida por inibidores da 5α-redutase. Esses resultados são semelhantes aos relatados em bebês do sexo masculino com deficiência genética de 5α-redutase. As mulheres podem ser expostas à finasterida através do contato com comprimidos de PROSCAR esmagados ou quebrados ou sêmen de um parceiro masculino tomando PROSCAR. Com relação à exposição à finasterida através da pele, os comprimidos de PROSCAR 5mg são revestidos e evitarão o contato da pele com a finasterida durante o manuseio normal se os comprimidos não tiverem sido esmagados ou quebrados. Mulheres grávidas ou potencialmente grávidas não devem manusear comprimidos de PROSCAR 5mg esmagados ou quebrados devido à possível exposição de um feto do sexo masculino. Com relação à potencial exposição à finasterida através do sêmen, três estudos foram conduzidos que mediram as concentrações de finasterida no sêmen em homens recebendo PROSCAR 5 mg/dia. Nesses estudos, a maior quantidade de finasterida no sêmen foi estimada em 50 a 100 vezes menor do que a dose de finasterida (5 μg) que não teve efeito sobre os níveis circulantes de DHT em homens. Dados  e FARMACOLOGIA CLÍNICA ].
Dados
Dados humanos
Em 2 estudos de indivíduos saudáveis (n=69) recebendo PROSCAR 5 mg/dia por 6-24 semanas, as concentrações de finasterida no sêmen variaram de indetectáveis ( FARMACOLOGIA CLÍNICA ].
Dados de animais
Em um estudo de desenvolvimento embriofetal, ratas grávidas receberam finasterida durante o período de maior organogênese (dias de gestação 6 a 17). Em doses maternas de finasterida oral aproximadamente 0,1 a 86 vezes a dose humana máxima recomendada (MRHD) de 5 mg/dia (com base na AUC em doses animais de 0,1 a 100 mg/kg/dia), houve um aumento dependente da dose na hipospádia que ocorreu em 3,6 a 100% da prole masculina. Os múltiplos de exposição foram estimados usando dados de ratos não prenhes. Dias 16 a 17 de gestação é um período crítico em ratos fetais machos para a diferenciação da genitália externa. Em doses maternas orais de aproximadamente 0,03 vezes a MRHD (com base na AUC na dose animal de 0,03 mg/kg/dia), a prole masculina apresentou diminuição do peso prostático e vesicular seminal, atraso na separação prepucial e desenvolvimento transitório do mamilo. A distância anogenital diminuída ocorreu em descendentes machos de ratas grávidas que receberam aproximadamente 0,003 vezes a MRHD (com base na AUC na dose animal de 0,003 mg/kg/dia). Não foram observadas anormalidades na prole do sexo feminino em qualquer dose materna de finasterida.
Não foram observadas anormalidades de desenvolvimento na prole de fêmeas não tratadas acasaladas com ratos machos tratados com finasterida que receberam aproximadamente 61 vezes a MRHD (com base na AUC na dose animal de 80 mg/kg/dia). A fertilidade ligeiramente diminuída foi observada na prole masculina após a administração de cerca de 3 vezes a MRHD (com base na AUC na dose animal de 3 mg/kg/dia) a ratas durante o final da gestação e lactação. Não foram observados efeitos sobre a fertilidade na descendência feminina nestas condições.
Nenhuma evidência de malformações genitais externas masculinas ou outras anormalidades foram observadas em fetos de coelhos expostos à finasterida durante o período de organogênese principal (dias de gestação 6-18) em doses orais maternas de até 100 mg/kg/dia, (os níveis de exposição à finasterida não foram medido em coelhos). No entanto, este estudo pode não ter incluído o período crítico para os efeitos da finasterida no desenvolvimento da genitália externa masculina no coelho.
Os efeitos fetais da exposição materna à finasterida durante o período de desenvolvimento embrionário e fetal foram avaliados no macaco rhesus (dias de gestação 20-100), em uma espécie e período de desenvolvimento mais preditivos de efeitos específicos em humanos do que os estudos em ratos e coelhos. A administração intravenosa de finasterida a macacas grávidas em doses tão altas quanto 800 ng/dia (concentração sanguínea máxima estimada de 1,86 ng/mL ou cerca de 143 vezes a maior exposição estimada de fêmeas grávidas à finasterida a partir de sêmen de homens tomando 5 mg/dia) resultou em nenhuma anormalidade em fetos masculinos. Para confirmar a relevância do modelo rhesus para o desenvolvimento fetal humano, a administração oral de uma dose de finasterida (2 mg/kg/dia ou aproximadamente 18.000 vezes os níveis sanguíneos mais elevados estimados de finasterida do sêmen de homens tomando 5 mg/dia) para macacas grávidas resultaram em anormalidades genitais externas em fetos do sexo masculino. Nenhuma outra anormalidade foi observada em fetos do sexo masculino e nenhuma anormalidade relacionada à finasterida foi observada em fetos do sexo feminino em qualquer dose.
Lactação
Resumo do risco
PROSCAR não é indicado para uso em mulheres.
Fêmeas e Machos com Potencial Reprodutivo
Infertilidade
Mulheres
PROSCAR não é indicado para uso em mulheres.
Machos
O tratamento com PROSCAR por 24 semanas para avaliar os parâmetros do sêmen em voluntários saudáveis do sexo masculino não revelou efeitos clinicamente significativos na concentração, mobilidade, morfologia ou pH do esperma. Foi observada uma diminuição mediana de 0,6 mL (22,1%) no volume ejaculado com uma redução concomitante no total de espermatozóides por ejaculado. Esses parâmetros permaneceram dentro da faixa normal e foram reversíveis após a descontinuação da terapia com um tempo médio para retornar à linha de base de 84 semanas [ver AVISOS E PRECAUÇÕES ].
Houve relatos pós-comercialização de infertilidade masculina e/ou baixa qualidade seminal; normalização ou melhora da qualidade seminal foi relatada após a descontinuação da finasterida [ver REAÇÕES ADVERSAS ].
Uso Pediátrico
PROSCAR 5mg não é indicado para uso em pacientes pediátricos.
A segurança e eficácia em pacientes pediátricos não foram estabelecidas.
Uso Geriátrico
Do número total de indivíduos incluídos no PLESS, 1480 e 105 indivíduos tinham 65 anos ou mais e 75 anos ou mais, respectivamente. Não foram observadas diferenças globais na segurança ou eficácia entre estes indivíduos e indivíduos mais jovens, e outras experiências clínicas relatadas não identificaram diferenças nas respostas entre pacientes idosos e mais jovens. Nenhum ajuste de dose é necessário em idosos [ver FARMACOLOGIA CLÍNICA  e Estudos clínicos ].
Insuficiência hepática
Deve-se ter cautela na administração de PROSCAR em pacientes com anormalidades da função hepática, pois a finasterida é metabolizada extensivamente no fígado. FARMACOLOGIA CLÍNICA ].
Insuficiência renal
Nenhum ajuste de dose é necessário em pacientes com insuficiência renal [ver FARMACOLOGIA CLÍNICA ].
SOBREDOSAGEM
Os pacientes receberam doses únicas de PROSCAR 5mg até 400 mg e doses múltiplas de PROSCAR 5mg até 80 mg/dia por três meses sem efeitos adversos. Até que mais experiência seja obtida, nenhum tratamento específico para superdosagem com PROSCAR pode ser recomendado.
Letalidade significativa foi observada em camundongos machos e fêmeas em doses orais únicas de 1500 mg/m2 (500 mg/kg) e em ratos fêmeas e machos em doses orais únicas de 2360 mg/m2 (400 mg/kg) e 5900 mg/m2 (1000 mg/kg), respectivamente.
CONTRA-INDICAÇÕES
PROSCAR é contraindicado nos seguintes casos:
- Hipersensibilidade a qualquer componente deste medicamento.
- Gravidez. O uso de finasterida é contraindicado em mulheres quando estão ou podem estar grávidas. Devido à capacidade dos inibidores da 5α-redutase Tipo II de inibir a conversão da testosterona em 5α-diidrotestosterona (DHT), a finasterida pode causar anormalidades da genitália externa de um feto masculino de uma mulher grávida que recebe finasterida. Se este medicamento for usado durante a gravidez, ou se ocorrer gravidez enquanto estiver tomando este medicamento, a mulher grávida deve ser informada do risco potencial para o feto masculino. [Veja também AVISOS E PRECAUÇÕES ,UMA Uso em populações específicas , e COMO FORNECIDO .] Em ratas, baixas doses de finasterida administradas durante a gravidez produziram anormalidades da genitália externa na prole masculina.
FARMACOLOGIA CLÍNICA
Mecanismo de ação
desenvolvimento e aumento da próstata é dependente do potente andrógeno, 5α-diidrotestosterona (DHT). A 5α-redutase tipo II metaboliza a testosterona em DHT na próstata, fígado e pele. DHT induz efeitos androgênicos ligando-se a receptores androgênicos nos núcleos celulares desses órgãos.
A finasterida é um inibidor competitivo e específico da 5α-redutase Tipo II com a qual forma lentamente um complexo enzimático estável. A rotatividade deste complexo é extremamente lenta (t½ ~ 30 dias). Isto foi demonstrado tanto in vivo como in vitro. A finasterida não tem afinidade para o receptor androgênico. No homem, os metabólitos esteróides 5α reduzidos no sangue e na urina são diminuídos após a administração de finasterida.
Farmacodinâmica
No homem, uma dose oral única de 5 mg de PROSCAR produz uma rápida redução na concentração sérica de DHT, com efeito máximo observado 8 horas após a primeira dose. A supressão de DHT é mantida durante todo o intervalo de dosagem de 24 horas e com a continuação do tratamento. A dosagem diária de PROSCAR de 5 mg/dia por até 4 anos demonstrou reduzir a concentração sérica de DHT em aproximadamente 70%. O nível circulante médio de testosterona aumentou em aproximadamente 10-20%, mas permaneceu dentro da faixa fisiológica. Em um estudo separado em homens saudáveis tratados com finasterida 1 mg por dia (n=82) ou placebo (n=69), os níveis circulantes médios de testosterona e estradiol aumentaram aproximadamente 15% em comparação com os valores basais, mas permaneceram dentro da alcance fisiológico.
Em pacientes recebendo PROSCAR 5 mg/dia, foram observados aumentos de cerca de 10% no hormônio luteinizante (LH) e hormônio folículo-estimulante (FSH), mas os níveis permaneceram dentro da faixa normal. Em voluntários saudáveis, o tratamento com PROSCAR 5mg não alterou a resposta de LH e FSH ao hormônio liberador de gonadotrofina, indicando que o eixo hipotálamo-hipófise-testicular não foi afetado.
Em pacientes com HBP, PROSCAR não tem efeito sobre os níveis circulantes de cortisol, prolactina, hormônio estimulante da tireoide ou tiroxina. Nenhum efeito clinicamente significativo foi observado no perfil lipídico plasmático (isto é, colesterol total, lipoproteínas de baixa densidade, lipoproteínas de alta densidade e triglicérides) ou densidade mineral óssea.
Homens adultos com deficiência de 5α-redutase tipo II herdada geneticamente também têm níveis reduzidos de DHT. Exceto pelos defeitos urogenitais associados presentes ao nascimento, nenhuma outra anormalidade clínica relacionada à deficiência de 5α-redutase Tipo II foi observada nesses indivíduos. Esses indivíduos têm uma pequena próstata ao longo da vida e não desenvolvem HBP.
Em pacientes com HBP tratados com finasterida (1-100 mg/dia) por 7-10 dias antes da prostatectomia, um conteúdo de DHT aproximadamente 80% menor foi medido no tecido prostático removido na cirurgia, comparado ao placebo; a concentração tecidual de testosterona foi aumentada em até 10 vezes em relação aos níveis pré-tratamento, em relação ao placebo. O conteúdo intraprostático de PSA também foi diminuído.
Em voluntários saudáveis do sexo masculino tratados com PROSCAR 5mg por 14 dias, a descontinuação da terapia resultou no retorno dos níveis de DHT aos níveis pré-tratamento em aproximadamente 2 semanas. Em pacientes tratados por três meses, o volume da próstata, que diminuiu em aproximadamente 20%, retornou ao valor basal após aproximadamente três meses de descontinuação da terapia.
Farmacocinética
Absorção
Em um estudo com 15 indivíduos jovens saudáveis, a biodisponibilidade média dos comprimidos de 5 mg de finasterida foi de 63% (intervalo de 34-108%), com base na razão da área sob a curva (AUC) em relação a uma dose de referência intravenosa (IV) . A concentração plasmática máxima de finasterida foi em média de 37 ng/mL (intervalo, 27-49 ng/mL) e foi atingida 1-2 horas após a dose. A biodisponibilidade da finasterida não foi afetada pelos alimentos.
Distribuição
volume médio de distribuição no estado de equilíbrio foi de 76 litros (intervalo, 44-96 litros). Aproximadamente 90% da finasterida circulante está ligada às proteínas plasmáticas. Há uma fase de acumulação lenta para a finasterida após doses múltiplas. Após administração de 5 mg/dia de finasterida por 17 dias, as concentrações plasmáticas de finasterida foram 47 e 54% maiores do que após a primeira dose em homens de 45 a 60 anos (n=12) e ≥70 anos (n=12) , respectivamente. As concentrações médias de vale após 17 dias de dosagem foram 6,2 ng/mL (intervalo, 2,49,8 ng/mL) e 8,1 ng/mL (intervalo, 1,8-19,7 ng/mL), respectivamente, nos dois grupos etários. Embora o estado de equilíbrio não tenha sido alcançado neste estudo, a concentração plasmática mínima média em outro estudo em pacientes com HPB (idade média, 65 anos) recebendo 5 mg/dia foi de 9,4 ng/mL (intervalo, 7,1-13,3 ng/mL; n= 22) após mais de um ano de dosagem.
A finasterida demonstrou atravessar a barreira hematoencefálica, mas não parece se distribuir preferencialmente no LCR.
Em 2 estudos de indivíduos saudáveis (n=69) recebendo PROSCAR 5 mg/dia por 6-24 semanas, as concentrações de finasterida no sêmen variaram de indetectáveis ( Uso em populações específicas ].
Metabolismo
A finasterida é extensivamente metabolizada no fígado, principalmente através da subfamília de enzimas citocromo P450 3A4. Dois metabólitos, os metabólitos monohidroxilados da cadeia lateral t-butil e os metabólitos do ácido monocarboxílico, foram identificados que não possuem mais de 20% da atividade inibitória da 5α-redutase da finasterida.
Excreção
Em indivíduos jovens saudáveis (n=15), a depuração plasmática média da finasterida foi de 165 mL/min (intervalo, 70.279 mL/min) e a meia-vida média de eliminação no plasma foi de 6 horas (intervalo, 3-16 horas). Após uma dose oral de 14C-finasterida no homem (n=6), uma média de 39% (variação, 32-46%) da dose foi excretada na urina na forma de metabólitos; 57% (variação, 51-64%) foi excretado nas fezes.
meia-vida terminal média da finasterida em indivíduos ≥70 anos de idade foi de aproximadamente 8 horas (variação, 6-15 horas; n=12), comparada com 6 horas (variação, 4-12 horas; n=12) em indivíduos 45-60 anos de idade. Como resultado, a AUC média (0-24 h) após 17 dias de administração foi 15% maior em indivíduos ≥70 anos de idade do que em indivíduos com 45-60 anos de idade (p=0,02).
Pediátrico
A farmacocinética da finasterida não foi investigada em pacientes
A finasterida não é indicada para uso em pacientes pediátricos [ver AVISOS E PRECAUÇÕES ,UMA Uso em populações específicas ].
Gênero
A finasterida não é indicada para uso em mulheres [ver CONTRA-INDICAÇÕES ,UMA AVISOS E PRECAUÇÕES ,UMA Uso em populações específicas , e COMO FORNECIDO ].
Geriátrico
Não é necessário ajuste de dose em idosos. Embora a taxa de eliminação da finasterida esteja diminuída em idosos, esses achados não têm significância clínica. [Ver um Farmacocinética  e Uso em populações específicas .]
Corrida
O efeito da corrida na farmacocinética da finasterida não foi estudado.
Insuficiência hepática
efeito da insuficiência hepática na farmacocinética da finasterida não foi estudado. Deve-se ter cautela na administração de PROSCAR 5mg em pacientes com anormalidades da função hepática, pois a finasterida é metabolizada extensivamente no fígado. Insuficiência renal
Não é necessário ajuste de dose em pacientes com insuficiência renal. Em pacientes com insuficiência renal crônica, com depuração de creatinina variando de 9,0 a 55 mL/min, a AUC, concentração plasmática máxima, meia-vida e ligação proteica após dose única de 14C-finasterida foram semelhantes aos valores obtidos em voluntários saudáveis. A excreção urinária de metabólitos foi diminuída em pacientes com insuficiência renal. Esta diminuição foi associada a um aumento na excreção fecal de metabólitos. As concentrações plasmáticas de metabólitos foram significativamente maiores em pacientes com insuficiência renal (com base em um aumento de 60% na AUC da radioatividade total). No entanto, a finasterida foi bem tolerada em pacientes com HPB com função renal normal recebendo até 80 mg/dia por 12 semanas, onde a exposição desses pacientes a metabólitos seria presumivelmente muito maior.
Estudos clínicos
Monoterapia
PROSCAR 5 mg/dia foi inicialmente avaliado em pacientes com sintomas de HBP e próstata aumentada por toque retal em dois estudos de 1 ano, placebo-controlados, randomizados, duplo-cegos e suas extensões abertas de 5 anos.
PROSCAR 5mg foi ainda avaliado no PROSCAR Long-Term Efficacy and Safety Study (PLESS), um estudo multicêntrico, duplo-cego, randomizado, controlado por placebo, de 4 anos. 3.040 pacientes com idades entre 45 e 78 anos, com sintomas moderados a graves de HBP e próstata aumentada ao toque retal, foram randomizados para o estudo (1.524 para finasterida, 1.516 para placebo) e 3.016 pacientes foram avaliados quanto à eficácia. 1.883 pacientes completaram o estudo de 4 anos (1.000 no grupo finasterida, 883 no grupo placebo).
Efeito na pontuação dos sintomas
Os sintomas foram quantificados por meio de um escore semelhante ao da American Urological Association Symptom Score, que avaliou tanto sintomas obstrutivos (diminuição do tamanho e força do jato, sensação de esvaziamento incompleto da bexiga, micção atrasada ou interrompida) quanto sintomas irritativos (noctúria, frequência diurna, necessidade para forçar ou empurrar o fluxo de urina) classificando em uma escala de 0 a 5 para seis sintomas e uma escala de 0 a 4 para um sintoma, para uma pontuação total possível de 34.
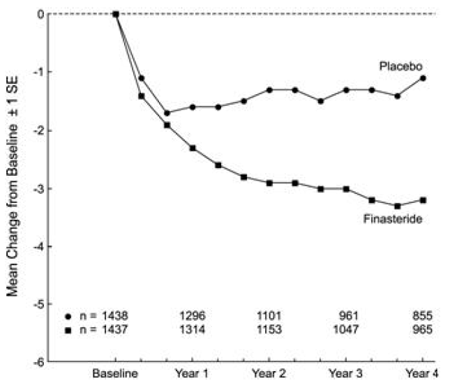
Os pacientes em PLESS apresentaram sintomas moderados a graves no início do estudo (média de aproximadamente 15 pontos em uma escala de 0-34 pontos). Os pacientes randomizados para PROSCAR que permaneceram em terapia por 4 anos tiveram uma diminuição média (± 1 DP) na pontuação dos sintomas de 3,3 (± 5,8) pontos em comparação com 1,3 (± 5,6) pontos no grupo placebo. (Consulte a Figura 1.) Uma melhora estatisticamente significativa na pontuação dos sintomas foi evidente em 1 ano em pacientes tratados com PROSCAR versus placebo (-2,3 vs -1,6), e essa melhora continuou até o ano 4.
Figura 1 Pontuação de Sintomas no PLESS
Os resultados observados em estudos anteriores foram comparáveis aos observados no PLESS. Embora uma melhora precoce dos sintomas urinários tenha sido observada em alguns pacientes, um teste terapêutico de pelo menos 6 meses foi geralmente necessário para avaliar se uma resposta benéfica no alívio dos sintomas foi alcançada. A melhora nos sintomas da HBP foi observada durante o primeiro ano e mantida por mais 5 anos de estudos de extensão abertos.
Efeito na retenção urinária aguda e na necessidade de cirurgia
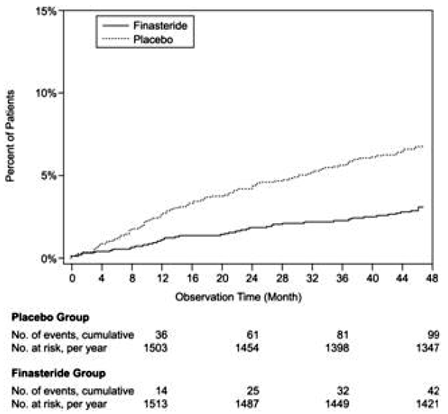
No PLESS, a eficácia também foi avaliada avaliando as falhas do tratamento. A falha do tratamento foi definida prospectivamente como eventos urológicos relacionados à HPB ou deterioração clínica, falta de melhora e/ou necessidade de terapia alternativa. Eventos urológicos relacionados à HBP foram definidos como intervenção cirúrgica urológica e retenção urinária aguda com necessidade de cateterismo. A informação completa do evento estava disponível para 92% dos pacientes. A tabela a seguir (Tabela 5) resume os resultados.
Comparado ao placebo, o PROSCAR foi associado a um risco significativamente menor de retenção urinária aguda ou a necessidade de cirurgia relacionada à HBP [13,2% para placebo versus 6,6% para PROSCAR; 51% de redução no risco, 95% CI: (34 a 63%)]. Comparado com placebo, PROSCAR 5mg foi associado a um risco significativamente menor para cirurgia [10,1% para placebo vs 4,6% para PROSCAR; 55% de redução no risco, 95% CI: (37 a 68%)] e com um risco significativamente menor de retenção urinária aguda [6,6% para placebo vs 2,8% para PROSCAR; redução de risco de 57%, IC 95%: (34 a 72%)]; veja as Figuras 2 e 3.
Figura 2 Porcentagem de pacientes submetidos a cirurgia para HBP, incluindo RTUP
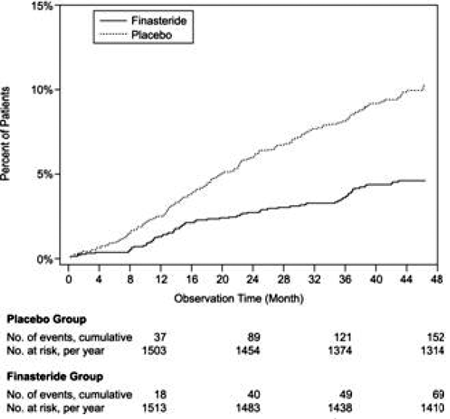
Figura 3 Porcentagem de pacientes que desenvolvem retenção urinária aguda (espontânea e precipitada)
Efeito na taxa máxima de fluxo urinário
Nos pacientes em PLESS que permaneceram em terapia durante o estudo e tiveram dados de fluxo urinário avaliáveis, PROSCAR 5mg aumentou a taxa de fluxo urinário máximo em 1,9 mL/s em comparação com 0,2 mL/s no grupo placebo.
Houve uma clara diferença entre os grupos de tratamento na taxa de fluxo urinário máximo em favor de PROSCAR 5mg no mês 4 (1,0 vs 0,3 mL/s), que foi mantida durante todo o estudo. Nos estudos anteriores de 1 ano, o aumento na taxa de fluxo urinário máximo foi comparável ao PLESS e foi mantido durante o primeiro ano e durante mais 5 anos de estudos de extensão abertos.
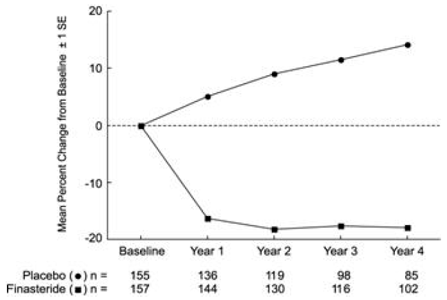
Efeito no volume da próstata
No PLESS, o volume da próstata foi avaliado anualmente por ressonância magnética (RM) em um subconjunto de pacientes. Em pacientes tratados com PROSCAR 5mg que permaneceram em terapia, o volume da próstata foi reduzido em comparação com a linha de base e placebo ao longo dos 4 anos de estudo. PROSCAR diminuiu o volume da próstata em 17,9% (de 55,9 cc no início do estudo para 45,8 cc em 4 anos) em comparação com um aumento de 14,1% (de 51,3 cc para 58,5 cc) no grupo placebo (p
Os resultados observados em estudos anteriores foram comparáveis aos observados no PLESS. O volume médio da próstata no início do estudo variou entre 40-50 cc. A redução do volume da próstata foi observada durante o primeiro ano e mantida ao longo de mais cinco anos de estudos de extensão abertos.
Figura 4 Volume da próstata em PLESS
Volume da próstata como preditor de resposta terapêutica
Uma meta-análise combinando dados de 1 ano de sete estudos duplo-cegos, controlados por placebo de desenho semelhante, incluindo 4.491 pacientes com HBP sintomática, demonstrou que, em pacientes tratados com PROSCAR, a magnitude da resposta dos sintomas e o grau de melhora na A taxa de fluxo urinário foi maior em pacientes com próstata aumentada no início do estudo.
Combinação com Terapia Alfa-Bloqueadora
Estudo de Terapia Médica de Sintomas Prostáticos (MTOPS) foi um estudo duplo-cego, randomizado, controlado por placebo, multicêntrico, de 4 a 6 anos (média de 5 anos) em 3.047 homens com HBP sintomática, que foram randomizados para receber PROSCAR 5 mg/dia (n=768), doxazosina 4 ou 8 mg/dia (n=756), a combinação de PROSCAR 5 mg/dia e doxazosina 4 ou 8 mg/dia (n=786), ou placebo (n=737 ). Todos os participantes foram submetidos a titulação semanal de doxazosina (ou seu placebo) de 1 a 2 a 4 a 8 mg/dia. Apenas aqueles que toleraram o nível de dose de 4 ou 8 mg foram mantidos em doxazosina (ou seu placebo) no estudo. A dose final tolerada do participante (4 mg ou 8 mg) foi administrada a partir do final da semana 4. A dose final de doxazosina foi administrada uma vez por dia, ao deitar.
idade média dos pacientes na randomização foi de 62,6 anos (±7,3 anos). Os pacientes eram caucasianos (82%), afro-americanos (9%), hispânicos (7%), asiáticos (1%) ou nativos americanos (
desfecho primário foi uma medida composta da primeira ocorrência de qualquer um dos cinco desfechos a seguir: aumento confirmado de ≥ 4 pontos desde a linha de base no escore de sintomas, retenção urinária aguda, insuficiência renal relacionada à HBP (aumento de creatinina), infecções recorrentes do trato urinário ou urosepse ou incontinência. Comparado ao placebo, o tratamento com PROSCAR 5mg, doxazosina ou terapia combinada resultou em uma redução no risco de experimentar um desses cinco eventos em 34% (p=0,002), 39% (p
maioria dos eventos (274 de 351; 78%) foi um aumento confirmado de ≥4 pontos na pontuação dos sintomas, referido como progressão da pontuação dos sintomas. O risco de progressão do escore de sintomas foi reduzido em 30% (p=0,016), 46% (p
Figura 5 Incidência cumulativa de um aumento de 4 pontos na pontuação de sintomas AUA por grupo de tratamento
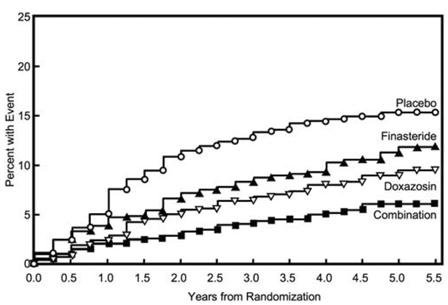
O tratamento com PROSCAR 5mg, doxazosina ou a combinação de PROSCAR com doxazosina reduziu a pontuação média dos sintomas da linha de base no ano 4. A Tabela 7 fornece a alteração média da linha de base para a pontuação dos sintomas da AUA por grupo de tratamento para pacientes que permaneceram em terapia por quatro anos.
Os resultados do MTOPS são consistentes com os achados do estudo de 4 anos controlado por placebo PLESS [ver Monoterapia ] em que o tratamento com PROSCAR reduz o risco de retenção urinária aguda e a necessidade de cirurgia relacionada à HBP. No MTOPS, o risco de desenvolver retenção urinária aguda foi reduzido em 67% em pacientes tratados com PROSCAR em comparação com pacientes tratados com placebo (0,8% para PROSCAR e 2,4% para placebo). Além disso, o risco de necessitar de terapia invasiva relacionada à HBP foi reduzido em 64% em pacientes tratados com PROSCAR em comparação com pacientes tratados com placebo (2,0% para PROSCAR 5mg e 5,4% para placebo).
Resumo de estudos clínicos
Os dados desses estudos, mostrando melhora nos sintomas relacionados à HBP, redução na falha do tratamento (eventos urológicos relacionados à HBP), aumento das taxas máximas de fluxo urinário e diminuição do volume da próstata, sugerem que o PROSCAR interrompe o processo de doença da HBP em homens com aumento da próstata.
INFORMAÇÃO DO PACIENTE
Nenhuma informação fornecida. Por favor, consulte o AVISOS E PRECAUÇÕES seção.
