Vantin 200mg, 100mg Cefpodoxime Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Vantin 100mg e como é usado?
Vantin 100mg é um medicamento de prescrição usado para tratar os sintomas de várias infecções bacterianas, como bronquite, pneumonia, sinusite, faringite, amigdalite, infecções do trato urinário, infecções de pele e gonorreia. Vantin 200mg pode ser usado sozinho ou com outros medicamentos.
Vantin pertence a uma classe de medicamentos chamados Cafalosporinas, 3ª Geração.
Não se sabe se Vantin é seguro e eficaz em crianças com menos de 2 meses de idade.
Quais são os possíveis efeitos colaterais do Vantin 200mg?
Vantin pode causar efeitos colaterais graves, incluindo:
- urticária,
- dificuldade para respirar,
- inchaço do rosto, lábios, língua ou garganta,
- febre,
- dor de garganta,
- queimando em seus olhos,
- dor de pele,
- erupção cutânea vermelha ou roxa que se espalha e causa bolhas e descamação,
- dor de estômago severa,
- diarreia aquosa ou sanguinolenta,
- glândulas inchadas,
- dores nas articulações,
- mal-estar geral,
- batimentos cardíacos acelerados,
- vibrando em seu peito,
- falta de ar e
- apreensão
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Vantin incluem:
- coceira ou corrimento vaginal,
- assaduras em uma criança usando este medicamento,
- náusea,
- vômito,
- diarréia,
- dor de estômago e
- dor de cabeça
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Vantin. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
Para reduzir o desenvolvimento de bactérias resistentes aos medicamentos e manter a eficácia de VANTIN 100mg e outros medicamentos antibacterianos, VANTIN 100mg deve ser usado apenas para tratar ou prevenir infecções comprovadas ou fortemente suspeitas de serem causadas por bactérias.
DESCRIÇÃO
A cefpodoxima proxetil é um antibiótico semi-sintético de amplo espectro administrado por via oral da classe das cefalosporinas. O nome químico é (RS)-1(isopropoxicarboniloxi) etil (+)-(6R,7R)-7-[2-(2-amino-4-tiazolil)-2-{(Z)metoxiimino}acetamido]-3 -metoximetil-8-oxo-5-tia-1-azabiciclo[4.2.0]oct-2-eno-2-carboxilato. Sua fórmula empírica é C21H27N5O9S2 e sua fórmula estrutural está representada abaixo:
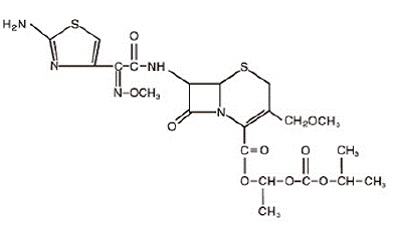
O peso molecular da cefpodoxima proxetil é 557,6.
cefpodoxima proxetil é uma pró-droga; seu metabólito ativo é a cefpodoxima. Todas as doses de cefpodoxima proxetil neste folheto são expressas em termos da fração ativa de cefpodoxima. O medicamento é fornecido tanto na forma de comprimidos revestidos por película quanto em grânulos aromatizados para suspensão oral.
Vantin comprimidos contém cefpodoxima proxetil equivalente a 100 mg ou 200 mg de atividade de cefpodoxima e os seguintes ingredientes inativos: carboximetilcelulose cálcica, cera de carnaúba, FD&C Amarelo nº 6, hidroxipropilcelulose, hipromelose, lactose hidratada, estearato de magnésio, propilenoglicol, lauril sulfato de sódio e dióxido de titânio. Além disso, os comprimidos revestidos por película de 100 mg contêm D&C Yellow No. 10 e os comprimidos revestidos por película de 200 mg contêm FD&C Red No. 40.
Cada 5 mL de VANTIN Suspensão Oral contém cefpodoxima proxetil equivalente a 50 mg ou 100 mg de atividade de cefpodoxima após a constituição e os seguintes ingredientes inativos: aromas artificiais, hidroxianisol butilado (BHA), carboximetilcelulose sódica, celulose microcristalina, carragenina, ácido cítrico, coloidal dióxido de silício, croscarmelose sódica, hidroxipropilcelulose, lactose, maltodextrina, aromatizantes naturais, alginato de propilenoglicol, citrato de sódio, benzoato de sódio, amido, sacarose e óleo vegetal.
INDICAÇÕES
Cefpodoxima proxetil é indicado para o tratamento de pacientes com infecções leves a moderadas causadas por cepas suscetíveis dos microrganismos designados nas condições listadas abaixo.
As dosagens recomendadas, as durações da terapia e as populações de pacientes aplicáveis variam entre essas infecções. Consulte DOSAGEM E ADMINISTRAÇÃO para recomendações específicas. Otite média aguda causada por Streptococcus pneumoniae (excluindo cepas resistentes à penicilina), Streptococcus pyogenes, Haemophilus influenzae (incluindo cepas produtoras de beta-lactamase) ou Moraxella (Branhamella) catarrhalis (incluindo cepas produtoras de beta-lactamase).
Faringite e/ou amigdalite por Streptococcus pyogenes.
NOTA: Apenas a penicilina por via intramuscular de administração demonstrou ser eficaz na profilaxia da febre reumática. Cefpodoxima proxetil é geralmente eficaz na erradicação de estreptococos da orofaringe. No entanto, os dados que estabelecem a eficácia da cefpodoxima proxetil para a profilaxia da febre reumática subsequente não estão disponíveis.
Pneumonia adquirida na comunidade causada por S. pneumoniae ou H. Influenzae (incluindo cepas produtoras de beta-lactamase).
Exacerbação bacteriana aguda da bronquite crônica causada por S. pneumoniae, H. influenzae (somente cepas não produtoras de betalactamase) ou M. catarrhalis. Os dados são insuficientes neste momento para estabelecer a eficácia em pacientes com exacerbações bacterianas agudas de bronquite crônica causada por cepas de H. influenzae produtoras de beta-lactamase.
Gonorreia uretral e cervical aguda não complicada causada por Neisseria gonorrhoeae (incluindo cepas produtoras de penicilinase).
Infecções anorretais agudas e não complicadas em mulheres devido a Neisseria gonorrhoeae (incluindo cepas produtoras de penicilinase).
NOTA: A eficácia da cefpodoxima no tratamento de pacientes do sexo masculino com infecções retais causadas por N. gonorrhoeae não foi estabelecida. Os dados não suportam o uso de cefpodoxima proxetil no tratamento de infecções faríngeas por N. gonorrhoeae em homens ou mulheres.
Infecções não complicadas da pele e da estrutura da pele causada por Staphylococcus aureus (incluindo cepas produtoras de penicilinase) ou Streptococcus pyogenes. Os abscessos devem ser drenados cirurgicamente conforme indicação clínica.
NOTA: Em ensaios clínicos, o tratamento bem sucedido de infecções não complicadas da pele e da estrutura da pele foi relacionado com a dose. A dose terapêutica efetiva para infecções de pele foi maior do que as utilizadas em outras indicações recomendadas. (Ver DOSAGEM E ADMINISTRAÇÃO .)
Sinusite maxilar aguda causada por Haemophilus influenzae (incluindo cepas produtoras de beta-lactamase), Streptococcus pneumoniae e Moraxella catarrhalis.
Infecções não complicadas do trato urinário (cistite) causada por Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis ou Staphylococcus saprophyticus.
NOTA: Ao considerar o uso de cefpodoxima proxetil no tratamento da cistite, as taxas mais baixas de erradicação bacteriana da cefpodoxima proxetil devem ser ponderadas contra as taxas de erradicação aumentadas e os diferentes perfis de segurança de algumas outras classes de agentes aprovados. (Ver Estudos clínicos seção.)
Amostras apropriadas para exame bacteriológico devem ser obtidas a fim de isolar e identificar os organismos causadores e determinar sua suscetibilidade à cefpodoxima. A terapia pode ser instituída enquanto se aguarda os resultados desses estudos. Uma vez que esses resultados estejam disponíveis, a terapia antimicrobiana deve ser ajustada de acordo.
Para reduzir o desenvolvimento de bactérias resistentes aos medicamentos e manter a eficácia de VANTIN 100mg e outros medicamentos antibacterianos, VANTIN 200mg deve ser usado apenas para tratar ou prevenir infecções comprovadas ou fortemente suspeitas de serem causadas por bactérias suscetíveis. Quando as informações de cultura e suscetibilidade estiverem disponíveis, elas devem ser consideradas na seleção ou modificação da terapia antibacteriana. Na ausência de tais dados, a epidemiologia local e os padrões de suscetibilidade podem contribuir para a seleção empírica da terapia.
DOSAGEM E ADMINISTRAÇÃO
(Ver INDICAÇÕES E USO para patógenos indicados.)
Comprimidos revestidos por película
Os comprimidos de Vantin devem ser administrados por via oral com alimentos para aumentar a absorção. (Ver FARMACOLOGIA CLÍNICA .)
As dosagens recomendadas, as durações do tratamento e a população de pacientes aplicável estão descritas na tabela a seguir:
Adultos e adolescentes (a partir de 12 anos)
Grânulos para Suspensão Oral
Vantin Suspensão Oral pode ser administrado independentemente da alimentação. As dosagens recomendadas, as durações do tratamento e as populações de pacientes aplicáveis estão descritas na tabela a seguir:
Adultos e adolescentes (a partir de 12 anos)
Lactentes e pacientes pediátricos (idade de 2 meses a 12 anos)
Pacientes com Disfunção Renal
Para pacientes com insuficiência renal grave (depuração de creatinina
Quando apenas o nível de creatinina sérica estiver disponível, a fórmula a seguir (com base no sexo, peso e idade do paciente) pode ser usada para estimar a depuração de creatinina (mL/min). Para que esta estimativa seja válida, o nível de creatinina sérica deve representar um estado de equilíbrio da função renal.
Homens (mL/min): Peso (kg) x (140 - idade)/72 x creatinina sérica (mg/100 mL)
Mulheres (mL/min) : 0,85 x acima do valor
Pacientes com cirrose
farmacocinética da cefpodoxima em pacientes cirróticos (com ou sem ascite) é semelhante à de indivíduos saudáveis. O ajuste de dose não é necessário nesta população.
Preparação da Suspensão
Instruções Constitucionais para Suspensão Oral
Após a mistura, a suspensão deve ser armazenada em geladeira, 2° a 8°C (36° a 46°F). Agite bem antes de usar. Mantenha o recipiente bem fechado. A mistura pode ser usada por 14 dias. Descarte a porção não utilizada após 14 dias.
COMO FORNECIDO
Comprimidos Vantin estão disponíveis nas seguintes dosagens (equivalente à cefpodoxima), cores e tamanhos:
100 mg (laranja claro, elíptico, gravado com U3617)
Garrafas de 20 NDC 0009-3617-01 Garrafas de 100 NDC 0009-3617-02 Embalagens de dose unitária de 100 NDC 0009-3617-03
200 mg (vermelho coral, elíptico, gravado com U3618)
Garrafas de 20 NDC 0009-3618-01 Garrafas de 100 NDC 0009-3618-02
200 mg (vermelho coral, elíptico, gravado com U3618)
Pacotes de dose unitária de 100 NDC 0009-3618-03
Armazene os comprimidos em temperatura ambiente controlada de 20° a 25°C (68° a 77°F) [ver USP ].
Recoloque a tampa firmemente após cada abertura. Proteja os pacotes de dose unitária da umidade excessiva.
ANTIN 200mg Suspensão Oral fornece o equivalente a 50 mg ou 100 mg de cefpodoxima por 5 mL de suspensão (quando constituído conforme indicado) e está disponível no sabor creme de limão nos seguintes tamanhos:
50 mg/5 mL
Suspensão de 100 mL NDC 0009-3531-01 Suspensão de 75 mL NDC 0009-3531-02 Suspensão de 50 mL NDC 0009-3531-03
100 mg/5 mL
Suspensão de 100 mL NDC 0009-3615-01 Suspensão de 75 mL NDC 0009-3615-02 Suspensão de 50 mL NDC 0009-3615-03
Armazene os grânulos não suspensos em temperatura ambiente controlada de 20° a 25°C (68° a 77°F) [consulte USP ].
As instruções de mistura estão incluídas no rótulo. Após a mistura, a suspensão deve ser armazenada em geladeira, de 2° a 8°C (36° a 46°F). Agite bem antes de usar. Mantenha o recipiente bem fechado. A mistura pode ser usada por 14 dias. Descarte a porção não utilizada após 14 dias.
Distribuído por: Pharmacia & Upjohn Company, Division of Pfizer Inc., NY, NY 10017. Revisado: agosto de 2016
EFEITOS COLATERAIS
Testes clínicos
Comprimidos revestidos por película (dose múltipla)
Em ensaios clínicos usando várias doses de comprimidos revestidos por película de cefpodoxima proxetil, 4.696 pacientes foram tratados com as dosagens recomendadas de cefpodoxima (100 a 400 mg a cada 12 horas). Não houve mortes ou incapacidades permanentes relacionadas à toxicidade do medicamento. Cento e vinte e nove (2,7%) pacientes interromperam a medicação devido a eventos adversos possivelmente ou provavelmente relacionados à toxicidade do medicamento. Noventa e três (52%) dos 178 pacientes que descontinuaram a terapia (com ou sem relação com a terapia medicamentosa) o fizeram por causa de distúrbios gastrointestinais, náuseas, vômitos ou diarreia. A porcentagem de pacientes tratados com cefpodoxima proxetil que descontinuaram o medicamento do estudo devido a eventos adversos foi significativamente maior na dose de 800 mg por dia do que na dose de 400 mg por dia ou na dose de 200 mg por dia. Os eventos adversos possivelmente ou provavelmente relacionados à cefpodoxima em ensaios clínicos de dose múltipla (N = 4.696 pacientes tratados com cefpodoxima) foram:
Incidência maior que 1%
Diarréia 7,0%
Diarréia ou fezes moles foram relacionadas à dose: diminuindo de 10,4% dos pacientes que receberam 800 mg por dia para 5,7% para aqueles que receberam 200 mg por dia. Dos pacientes com diarréia, 10% tinham organismo C. difficile ou toxina nas fezes. (Ver AVISOS .)
Náusea 3,3% Infecções fúngicas vaginais 1,0% Infecções vulvovaginais 1,3% Dor abdominal 1,2% Dor de cabeça 1,0%
Incidência inferior a 1%
Por sistema corporal em ordem decrescente
Estudos clínicos
Eventos Adversos Pensados Possivelmente ou Provavelmente Relacionados à Cefpodoxima Proxetil que Ocorreram em Menos de 1% dos Pacientes (N=4696)
Corpo - infecções fúngicas, distensão abdominal, mal-estar, fadiga, astenia, febre, dor torácica, dor nas costas, calafrios, dor generalizada, exames microbiológicos anormais, monilíase, abscesso, reação alérgica, edema facial, infecções bacterianas, infecções parasitárias, edema localizado, dor localizada .
Cardiovascular - insuficiência cardíaca congestiva, enxaqueca, palpitações, vasodilatação, hematoma, hipertensão, hipotensão.
Digestivo - vômitos, dispepsia, boca seca, flatulência, diminuição do apetite, constipação, monilíase oral, anorexia, eructação, gastrite, úlceras na boca, distúrbios gastrointestinais, distúrbios retais, distúrbios da língua, distúrbios dentários, aumento da sede, lesões orais, tenesmo, garganta seca, dor de dente .
Hemico e Linfático - anemia.
Metabólico e Nutricional - desidratação, gota, edema periférico, aumento de peso.
Musculoesquelético - mialgia.
Nervoso - tonturas, insónia, sonolência, ansiedade, tremores, nervosismo, enfarte cerebral, alteração dos sonhos, diminuição da concentração, confusão, pesadelos, parestesia, vertigens.
Respiratório - asma, tosse, epistaxe, rinite, sibilos, bronquite, dispneia, derrame pleural, pneumonia, sinusite.
Pele - urticária, erupção cutânea, prurido no local de não aplicação, diaforese, erupção maculopapular, dermatite fúngica, descamação, pele seca no local de não aplicação, queda de cabelo, erupção cutânea vesiculobolhosa, queimadura solar.
Sentidos Especiais - alterações do paladar, irritação ocular, perda do paladar, zumbido.
Urogenital - hematúria, infecções do trato urinário, metrorragia, disúria, frequência urinária, noctúria, infecção peniana, proteinúria, dor vaginal.
Grânulos para suspensão oral (dose múltipla)
Em ensaios clínicos usando doses múltiplas de grânulos de cefpodoxima proxetil para suspensão oral, 2.128 pacientes pediátricos (93% dos quais tinham menos de 12 anos de idade) foram tratados com as dosagens recomendadas de cefpodoxima (10 mg/kg/dia a cada 24 horas ou Q 12 horas para uma dose máxima equivalente para adultos). Não houve mortes ou incapacidades permanentes em nenhum dos pacientes nestes estudos. Vinte e quatro pacientes (1,1%) descontinuaram a medicação devido a eventos adversos possivelmente ou provavelmente relacionados ao medicamento do estudo. Principalmente, essas descontinuações foram por distúrbios gastrointestinais, geralmente diarréia, vômito ou erupções cutâneas.
Os eventos adversos possivelmente ou provavelmente relacionados ou de relação desconhecida com cefpodoxima proxetil para suspensão oral em ensaios clínicos de dose múltipla (N = 2.128 pacientes tratados com cefpodoxima) foram:
Incidência maior que 1%
Diarréia 6,0% A incidência de diarréia em bebês e crianças pequenas (1 mês a 2 anos) foi de 12,8%. Assaduras/erupções cutâneas fúngicas 2,0% (inclui monilíase) A incidência de assaduras em bebês e crianças pequenas foi de 8,5%. Outras erupções cutâneas 1,8% Vômitos 2,3%
Incidência inferior a 1%
Corpo: Dor abdominal localizada, cólica abdominal, dor de cabeça, monilia, dor abdominal generalizada, astenia, febre, infecção fúngica.
Digestivo: Náusea, monilia, anorexia, boca seca, estomatite, colite pseudomembranosa.
Hemico e Linfático: Trombocitemia, teste de Coombs direto positivo, eosinofilia, leucocitose, leucopenia, tempo de tromboplastina parcial prolongado, púrpura trombocitopênica.
Metabólico e Nutricional: Aumento do SGPT.
Músculo-Esquelético: Mialgia.
Nervoso: Alucinação, hipercinesia, nervosismo, sonolência.
Respiratório: Epistaxe, rinite.

Pele: Monilíase cutânea, urticária, dermatite fúngica, acne, dermatite esfoliativa, erupção maculopapular.
Sentidos Especiais: Perversão do gosto.
Comprimidos revestidos por película (dose única)
Em ensaios clínicos usando um Dose única dos comprimidos revestidos por película de cefpodoxima proxetil, 509 pacientes foram tratados com a dose recomendada de cefpodoxima (200 mg). Não houve mortes ou incapacidades permanentes relacionadas à toxicidade da droga nesses estudos.
Os eventos adversos possivelmente ou provavelmente relacionados à cefpodoxima em ensaios clínicos de dose única realizados nos Estados Unidos foram:
Incidência maior que 1%
Náusea 1,4% Diarréia 1,2%
Incidência inferior a 1%
Sistema Nervoso Central: tontura, dor de cabeça, síncope. Dermatológico: Erupção cutânea. Genital: Vaginite. Gastrintestinais: Dor abdominal. Psiquiátrico: Ansiedade.
Alterações laboratoriais
Alterações laboratoriais significativas que foram relatadas em pacientes adultos e pediátricos em ensaios clínicos de cefpodoxima proxetil, independentemente da relação medicamentosa, foram:
Hepático: Aumentos transitórios de AST (SGOT), ALT (SGPT), GGT, fosfatase alcalina, bilirrubina e LDH.
Hematologico: Eosinofilia, leucocitose, linfocitose, granulocitose, basofilia, monocitose, trombocitose, hemoglobina diminuída, hematócrito diminuído, leucopenia, neutropenia, linfocitopenia, trombocitopenia, trombocitemia, teste de Coombs positivo e PT e PT prolongados.
Química do soro: Hiperglicemia, hipoglicemia, hipoalbuminemia, hipoproteinemia, hipercalemia e hiponatremia.
Renal: Aumento de BUN e creatinina.
A maioria dessas anormalidades foram transitórias e não clinicamente significativas.
Experiência pós-marketing
As seguintes reações adversas graves foram relatadas: reações alérgicas incluindo síndrome de Stevens-Johnson, necrólise epidérmica tóxica, eritema multiforme e reações semelhantes à doença do soro, colite pseudomembranosa, diarreia sanguinolenta com dor abdominal, colite ulcerativa, retorragia com hipotensão, choque anafilático, lesão hepática, exposição in utero com aborto espontâneo, nefrite purpúrica, infiltrado pulmonar com eosinofilia e dermatite palpebral.
Uma morte foi atribuída à colite pseudomembranosa e coagulação intravascular disseminada.
Rotulagem de Classe de Cefalosporina
Além das reações adversas listadas acima que foram observadas em pacientes tratados com cefpodoxima proxetil, as seguintes reações adversas e testes laboratoriais alterados foram relatados para antibióticos da classe das cefalosporinas:
Reações Adversas e Testes Laboratoriais Anormais: Disfunção renal, nefropatia tóxica, disfunção hepática incluindo colestase, anemia aplástica, anemia hemolítica, reação semelhante à doença do soro, hemorragia, agranulocitose e pancitopenia.
Várias cefalosporinas foram implicadas no desencadeamento de convulsões, particularmente em pacientes com insuficiência renal quando a dosagem não foi reduzida. (Ver DOSAGEM E ADMINISTRAÇÃO e SUPERDOSAGEM .) Se ocorrerem convulsões associadas à terapia medicamentosa, a droga deve ser descontinuada. A terapia anticonvulsivante pode ser administrada se clinicamente indicada.
INTERAÇÕES MEDICAMENTOSAS
Antiácidos
A administração concomitante de altas doses de antiácidos (bicarbonato de sódio e hidróxido de alumínio) ou bloqueadores H2 reduz os níveis plasmáticos de pico em 24% a 42% e a extensão da absorção em 27% a 32%, respectivamente. A taxa de absorção não é alterada por esses medicamentos concomitantes. Anticolinérgicos orais (por exemplo, propantelina) retardam os níveis plasmáticos de pico (aumento de 47% no Tmax), mas não afetam a extensão da absorção (AUC).
probenecida
Tal como acontece com outros antibióticos beta-lactâmicos, a excreção renal de cefpodoxima foi inibida pela probenecida e resultou em um aumento de aproximadamente 31% na AUC e de 20% nos níveis plasmáticos de pico de cefpodoxima.
Drogas Nefrotóxicas
Embora a nefrotoxicidade não tenha sido observada quando a cefpodoxima proxetil foi administrada isoladamente, recomenda-se o monitoramento cuidadoso da função renal quando a cefpodoxima proxetil é administrada concomitantemente com compostos de potencial nefrotóxico conhecido.
Interações Medicamentos/Testes Laboratoriais
As cefalosporinas, incluindo a cefpodoxima proxetil, são conhecidas por ocasionalmente induzir um teste de Coombs direto positivo.
AVISOS
ANTES DE INSTITUIR A TERAPIA COM CEFPODOXIME PROXETIL, DEVE-SE FAZER CUIDADOSA CONSULTA PARA DETERMINAR SE O PACIENTE TEVE REAÇÕES ANTERIORES DE HIPERSENSIBILIDADE À CEFPODOXIME, OUTRAS CEFALOSPORINAS, PENICILINAS OU OUTRAS DROGAS. SE A CEFPODOXIME DEVE SER ADMINISTRADA A PACIENTES SENSÍVEIS À PENICILINA, DEVE-SE TER CUIDADO, POIS A HIPERSENSIBILIDADE CRUZADA ENTRE ANTIBIÓTICOS BETA-LACTAM FOI CLARAMENTE DOCUMENTADA E PODE OCORRER EM ATÉ 10% DOS PACIENTES COM HISTÓRICO DE ALERGIA À PENICILINA. SE OCORRER UMA REAÇÃO ALÉRGICA A CEFPODOXIME PROXETIL, INTERROMPA O MEDICAMENTO. REAÇÕES DE HIPERSENSIBILIDADE AGUDAS GRAVES PODEM REQUER TRATAMENTO COM EPINEFRINA E OUTRAS MEDIDAS DE EMERGÊNCIA, INCLUINDO OXIGÊNIO, LÍQUIDOS INTRAVENOSOS, ANTI-HISTAMINO INTRAVENOSO E TRATAMENTO DAS VIAS RESPIRATÓRIAS, CONFORME INDICADO CLÍNICAMENTE.
Diarreia associada a Clostridium difficile (CDAD) foi relatada com o uso de quase todos os agentes antibacterianos, incluindo Vantin, e pode variar em gravidade de diarreia leve a colite fatal. O tratamento com agentes antibacterianos altera a flora normal do cólon levando ao crescimento excessivo de C. difficile.
C. difficile produz toxinas A e B que contribuem para o desenvolvimento de CDAD. Cepas produtoras de hipertoxina de C. difficile causam aumento da morbidade e mortalidade, pois essas infecções podem ser refratárias à terapia antimicrobiana e podem exigir colectomia. CDAD deve ser considerado em todos os pacientes que apresentam diarreia após o uso de antibióticos. É necessário um histórico médico cuidadoso, pois foi relatado que a CDAD ocorre mais de dois meses após a administração de agentes antibacterianos.
Se houver suspeita ou confirmação de CDAD, o uso contínuo de antibióticos não direcionados contra C. difficile pode precisar ser descontinuado. O manejo adequado de fluidos e eletrólitos, suplementação de proteína, tratamento antibiótico de C. difficile e avaliação cirúrgica devem ser instituídos conforme indicação clínica.
Um esforço conjunto para monitorar C. difficile em pacientes tratados com cefpodoxima com diarréia foi realizado devido a um aumento da incidência de diarréia associada a C. difficile em ensaios iniciais em indivíduos normais. C. difficile organismos ou toxina foi relatado em 10% dos pacientes adultos tratados com cefpodoxima com diarréia; entretanto, nenhum diagnóstico específico de colite pseudomembranosa foi feito nesses pacientes.
Na experiência pós-comercialização fora dos Estados Unidos, foram recebidos relatos de colite pseudomembranosa associada ao uso de cefpodoxima proxetil.
PRECAUÇÕES
Em geral
Em pacientes com redução transitória ou persistente do débito urinário devido à insuficiência renal, a dose diária total de cefpodoxima proxetil deve ser reduzida porque podem ocorrer concentrações séricas altas e prolongadas de antibióticos nesses indivíduos após as doses usuais. A cefpodoxima, como outras cefalosporinas, deve ser administrada com cautela a pacientes recebendo tratamento concomitante com diuréticos potentes. (Ver DOSAGEM E ADMINISTRAÇÃO .)
Assim como com outros antibióticos, o uso prolongado de cefpodoxima proxetil pode resultar em crescimento excessivo de organismos não suscetíveis. A avaliação repetida da condição do paciente é essencial. Se ocorrer superinfecção durante a terapia, medidas apropriadas devem ser tomadas.
A prescrição de VANTIN na ausência de uma infecção bacteriana comprovada ou fortemente suspeita ou uma indicação profilática provavelmente não trará benefícios ao paciente e aumenta o risco de desenvolvimento de bactérias resistentes aos medicamentos.
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Não foram realizados estudos de carcinogênese animal de longo prazo com cefpodoxima proxetil. Os estudos de mutagênese da cefpodoxima, incluindo o teste de Ames com e sem ativação metabólica, o teste de aberração cromossômica, o ensaio de síntese de DNA não programada, a recombinação mitótica e conversão gênica, o ensaio de mutação genética direta e o teste de micronúcleo in vivo, foram todos negativos. Não foram observados efeitos adversos na fertilidade ou na reprodução quando 100 mg/kg/dia ou menos (2 vezes a dose humana com base em mg/m²) foi administrado oralmente a ratos.
Gravidez
Efeitos teratogênicos
A cefpodoxima proxetil não foi teratogênica nem embriocida quando administrada a ratos durante a organogênese em doses de até 100 mg/kg/dia (2 vezes a dose humana baseada em mg/m²) ou a coelhos em doses de até 30 mg/kg/dia (1 -2 vezes a dose humana com base em mg/m²).
No entanto, não existem estudos adequados e bem controlados sobre o uso de cefpodoxima proxetil em mulheres grávidas. Como os estudos de reprodução em animais nem sempre são preditivos da resposta humana, este medicamento deve ser usado durante a gravidez somente se for claramente necessário.
Trabalho e entrega
A cefpodoxima proxetil não foi estudada para uso durante o trabalho de parto e parto. O tratamento só deve ser administrado se for claramente necessário.
Mães que amamentam
A cefpodoxima é excretada no leite humano. Em um estudo com 3 mulheres lactantes, os níveis de cefpodoxima no leite humano foram 0%, 2% e 6% dos níveis séricos concomitantes em 4 horas após uma dose oral de 200 mg de cefpodoxima proxetil. Às 6 horas após a administração, os níveis eram 0%, 9% e 16% dos níveis séricos concomitantes. Devido ao potencial de reações graves em lactentes, deve-se decidir entre descontinuar a amamentação ou descontinuar o medicamento, levando em consideração a importância do medicamento para a mãe.
Uso Pediátrico
A segurança e eficácia em lactentes com menos de 2 meses de idade não foram estabelecidas.
Uso Geriátrico
Dos 3.338 pacientes em estudos clínicos de dose múltipla de comprimidos revestidos por película de cefpodoxima proxetil, 521 (16%) tinham 65 anos ou mais, enquanto 214 (6%) tinham 75 anos ou mais. Não foram observadas diferenças globais na eficácia ou segurança entre os pacientes idosos e os mais jovens. Em indivíduos geriátricos saudáveis com função renal normal, a meia-vida da cefpodoxima no plasma foi em média de 4,2 horas e a recuperação urinária foi em média de 21% após a administração de uma dose de 400 mg a cada 12 horas por 15 dias. Outros parâmetros farmacocinéticos permaneceram inalterados em relação aos observados em indivíduos saudáveis mais jovens.
Não é necessário ajuste de dose em pacientes idosos com função renal normal.
SOBREDOSAGEM
Em estudos de toxicidade aguda em roedores, uma dose oral única de 5 g/kg não produziu efeitos adversos.
Em caso de reação tóxica grave por superdosagem, a hemodiálise ou a diálise peritoneal podem ajudar na remoção da cefpodoxima do corpo, principalmente se a função renal estiver comprometida.
Os sintomas tóxicos após uma overdose de antibióticos beta-lactâmicos podem incluir náuseas, vômitos, desconforto epigástrico e diarreia.
CONTRA-INDICAÇÕES
A cefpodoxima proxetil é contraindicada em pacientes com alergia conhecida à cefpodoxima ou ao grupo de antibióticos das cefalosporinas.
FARMACOLOGIA CLÍNICA
Absorção e Excreção
A cefpodoxima proxetil é uma pró-droga que é absorvida pelo trato gastrointestinal e desesterificada em seu metabólito ativo, a cefpodoxima. Após a administração oral de 100 mg de cefpodoxima proxetil a indivíduos em jejum, aproximadamente 50% da dose de cefpodoxima administrada foi absorvida sistemicamente. Acima do intervalo de dosagem recomendado (100 a 400 mg), aproximadamente 29 a 33% da dose administrada de cefpodoxima foi excretada inalterada na urina em 12 horas. Há metabolismo mínimo da cefpodoxima in vivo.
Efeitos dos alimentos
extensão da absorção (AUC média) e a concentração plasmática máxima média aumentaram quando os comprimidos revestidos por película foram administrados com alimentos. Após uma dose de comprimido de 200 mg tomado com alimentos, a AUC foi 21 a 33% maior do que em condições de jejum, e a concentração plasmática máxima foi de 3,1 mcg/mL em indivíduos alimentados versus 2,6 mcg/mL em indivíduos em jejum. O tempo para atingir o pico de concentração não foi significativamente diferente entre os indivíduos alimentados e em jejum.
Quando uma dose de 200 mg da suspensão foi tomada com alimentos, a extensão da absorção (AUC média) e a concentração plasmática máxima média em indivíduos alimentados não foram significativamente diferentes dos indivíduos em jejum, mas a taxa de absorção foi mais lenta com alimentos (aumento de 48% em Tmax).
Farmacocinética de Comprimidos Revestidos por Película de Cefpodoxima Proxetil
Acima da faixa de dosagem recomendada (100 a 400 mg), a taxa e a extensão da absorção da cefpodoxima exibiram dependência da dose; A Cmax e AUC normalizadas pela dose diminuíram até 32% com o aumento da dose. Acima da faixa de dosagem recomendada, o Tmax foi de aproximadamente 2 a 3 horas e o T½ variou de 2,09 a 2,84 horas. A Cmax média foi de 1,4 mcg/mL para a dose de 100 mg, 2,3 mcg/mL para a dose de 200 mg e 3,9 mcg/mL para a dose de 400 mg. Em pacientes com função renal normal, não foram observados acúmulo nem alterações significativas em outros parâmetros farmacocinéticos após múltiplas doses orais de até 400 mg a cada 12 horas.
NÍVEIS PLASMA DE CEFPODOXIME (mcg/mL) EM ADULTOS EM JEJUM APÓS ADMINISTRAÇÃO DE COMPRIMIDOS REVESTIDOS POR PELÍCULA (Dose única)
Farmacocinética da suspensão de Cefpodoxima Proxetil
Em indivíduos adultos, uma dose de 100 mg de suspensão oral produziu um pico médio de concentração de cefpodoxima de aproximadamente 1,5 mcg/mL (intervalo: 1,1 a 2,1 mcg/mL), que é equivalente ao relatado após a administração do comprimido de 100 mg. O tempo para atingir o pico da concentração plasmática e a área sob a curva de concentração plasmática-tempo (AUC) para a suspensão oral também foram equivalentes aos produzidos com comprimidos revestidos por película em adultos após uma dose oral de 100 mg.
A farmacocinética da cefpodoxima foi investigada em 29 pacientes com idades entre 1 e 17 anos. Cada paciente recebeu uma única dose oral de 5 mg/kg de suspensão oral de cefpodoxima. Amostras de plasma e urina foram coletadas por 12 horas após a dosagem. Os níveis plasmáticos relatados a partir deste estudo são os seguintes:
NÍVEIS PLASMA DE CEFPODOXIME (mcg/mL) EM PACIENTES EM JEJUM (1 A 17 ANOS DE IDADE) APÓS ADMINISTRAÇÃO DE SUSPENSÃO
Distribuição
A ligação proteica da cefpodoxima varia de 22 a 33% no soro e de 21 a 29% no plasma.
Bolha na pele
Após a administração de doses múltiplas a cada 12 horas por 5 dias de 200 mg ou 400 mg de cefpodoxima proxetil, a concentração média máxima de cefpodoxima no líquido da bolha cutânea foi em média de 1,6 e 2,8 mcg/mL, respectivamente. Os níveis de cefpodoxima no fluido da bolha cutânea 12 horas após a dosagem foram em média de 0,2 e 0,4 mcg/mL para os regimes de dose múltipla de 200 mg e 400 mg, respectivamente.
Tecido da amígdala
Após um único comprimido revestido por película oral de 100 mg de cefpodoxima proxetil, a concentração média máxima de cefpodoxima no tecido da amígdala foi em média de 0,24 mcg/g 4 horas após a administração e 0,09 mcg/g 7 horas após a administração. O equilíbrio foi alcançado entre o plasma e o tecido da amígdala dentro de 4 horas após a dosagem. Nenhuma detecção de cefpodoxima no tecido tonsilar foi relatada 12 horas após a dosagem. Esses resultados demonstraram que as concentrações de cefpodoxima excederam a CIM90 de S. pyogenes por pelo menos 7 horas após a dosagem de 100 mg de cefpodoxima proxetil.
Tecido pulmonar
Após um único comprimido revestido por película oral de 200 mg de cefpodoxima proxetil, a concentração média máxima de cefpodoxima no tecido pulmonar foi de 0,63 mcg/g em 3 horas após a administração, 0,52 mcg/g em 6 horas após a administração e 0,19 mcg/g 12 horas após a administração. Os resultados deste estudo indicaram que a cefpodoxima penetrou no tecido pulmonar e produziu concentrações sustentadas da droga por pelo menos 12 horas após a dosagem em níveis que excederam a CIM90 para S. pneumoniae e H. influenzae.
LCR
Não estão disponíveis dados adequados sobre os níveis de cefpodoxima no LCR.
Efeitos da diminuição da função renal
A eliminação da cefpodoxima é reduzida em pacientes com insuficiência renal moderada a grave (depuração de creatinina PRECAUÇÕES e DOSAGEM E ADMINISTRAÇÃO .) Em indivíduos com comprometimento leve da função renal (depuração de creatinina de 50 a 80 mL/min), a meia-vida plasmática média da cefpodoxima foi de 3,5 horas. Em indivíduos com insuficiência renal moderada (depuração de creatinina de 30 a 49 mL/min) ou grave (depuração de creatinina de 5 a 29 mL/min), a meia-vida aumentou para 5,9 e 9,8 horas, respectivamente. Aproximadamente 23% da dose administrada foi eliminada do corpo durante um procedimento padrão de hemodiálise de 3 horas.
Efeito do Insuficiência Hepática (cirrose)
A absorção foi um pouco diminuída e a eliminação inalterada em pacientes com cirrose. O T½ médio de cefpodoxima e a depuração renal em pacientes cirróticos foram semelhantes aos obtidos em estudos de indivíduos saudáveis. A ascite não pareceu afetar os valores em indivíduos cirróticos. Nenhum ajuste de dose é recomendado nesta população de pacientes.
Farmacocinética em Idosos
Indivíduos idosos não necessitam de ajustes de dose, a menos que tenham função renal diminuída. (Ver PRECAUÇÕES .) Em indivíduos geriátricos saudáveis, a meia-vida da cefpodoxima no plasma foi em média de 4,2 horas (vs 3,3 em indivíduos mais jovens) e a recuperação urinária foi em média de 21% após a administração de uma dose de 400 mg a cada 12 horas. Outros parâmetros farmacocinéticos (Cmax, AUC e Tmax) permaneceram inalterados em relação aos observados em indivíduos jovens saudáveis.
Microbiologia
Mecanismo de ação
A cefpodoxima é um agente bactericida que atua por inibição da síntese da parede celular bacteriana. A cefpodoxima tem atividade na presença de algumas beta-lactamases, tanto penicilinases quanto cefalosporinases, de bactérias Gram-negativas e Gram-positivas.
Mecanismo de resistência
A resistência à cefpodoxima é principalmente através da hidrólise pela beta-lactamase, alteração das proteínas de ligação à penicilina (PBPs) e diminuição da permeabilidade.
A cefpodoxima demonstrou ser ativa contra a maioria dos isolados das seguintes bactérias, tanto in vitro quanto em infecções clínicas, conforme descrito na seção Indicações e Uso (1):
Bactérias Gram-positivas
Staphylococcus aureus (cepas suscetíveis à meticilina, incluindo aquelas que produzem penicilinases) Staphylococcus saprophyticus Streptococcus pneumoniae (excluindo isolados resistentes à penicilina) Streptococcus pyogenes
Bactérias Gram-negativas
Escherichia coli Klebsiella pneumoniae Proteus mirabilis Haemophilus influenzae (incluindo isolados produtores de beta-lactamase) Moraxella catarrhalis Neisseria gonorrhoeae (incluindo isolados produtores de penicilinase)
Os seguintes dados in vitro estão disponíveis, mas seu significado clínico é desconhecido. Pelo menos 90 por cento dos seguintes microrganismos exibem uma concentração inibitória mínima in vitro (CIM) menor ou igual ao ponto de interrupção suscetível para Cefpodoxima. No entanto, a eficácia da Cefpodoxima no tratamento de infecções clínicas causadas por esses microrganismos não foi estabelecida em ensaios clínicos adequados e bem controlados.
Bactérias Gram-positivas
Streptococcus agalactiae Streptococcus spp. (Grupos C, F, G)
Bactérias Gram-negativas
Citrobacter diversus Klebsiella oxytoca Proteus vulgaris Providencia rettgeri Haemophilus parainfluenzae
Bactérias Gram-positivas Anaeróbias
Peptostreptococcus magnus
Métodos de teste de suscetibilidade
Quando disponível, o laboratório de microbiologia clínica deve fornecer ao médico os resultados dos testes de suscetibilidade in vitro para medicamentos antimicrobianos usados em hospitais residentes como relatórios periódicos que descrevem o perfil de suscetibilidade de patógenos nosocomiais e adquiridos na comunidade. Esses relatórios devem ajudar o médico a selecionar um medicamento antibacteriano para tratamento.
Técnicas de diluição
Os métodos quantitativos são usados para determinar as concentrações inibitórias mínimas antimicrobianas (MICs). Esses MICs fornecem estimativas da suscetibilidade das bactérias aos compostos antimicrobianos. As CIMs devem ser determinadas usando um método de teste padronizado. Os valores de CIM devem ser interpretados de acordo com os critérios fornecidos na Tabela 1.
Técnicas de difusão
Os métodos quantitativos que requerem a medição dos diâmetros das zonas também fornecem estimativas reprodutíveis da suscetibilidade das bactérias aos compostos antimicrobianos. O tamanho da zona fornece uma estimativa da suscetibilidade das bactérias aos compostos antimicrobianos. O tamanho da zona deve ser determinado usando um método de teste padronizado. Este procedimento utiliza discos de papel impregnados com 10 mcg de Cefpodoxima para testar a suscetibilidade dos microrganismos à Cefpodoxima. Os critérios interpretativos de difusão de disco são fornecidos na Tabela 1.
Um relatório de Suscetível indica que o antimicrobiano provavelmente inibe o crescimento do patógeno se o composto antimicrobiano atingir a concentração no local da infecção necessária para inibir o crescimento do patógeno. Um relatório de Intermediário indica que o resultado deve ser considerado ambíguo e, se o microrganismo não for totalmente suscetível a medicamentos alternativos e clinicamente viáveis, o teste deve ser repetido. Esta categoria implica possível aplicabilidade clínica em locais do corpo onde o fármaco está fisiologicamente concentrado ou em situações em que uma alta dosagem do fármaco pode ser usada. Esta categoria também fornece uma zona tampão que evita que pequenos fatores técnicos não controlados causem grandes discrepâncias na interpretação. Um relatório de Resistente indica que o antimicrobiano provavelmente não inibirá o crescimento do patógeno se o composto antimicrobiano atingir as concentrações normalmente alcançáveis no local da infecção; outra terapia deve ser selecionada.
Controle de qualidade
Procedimentos padronizados de teste de suscetibilidade requerem o uso de controles laboratoriais para monitorar e garantir a exatidão e precisão dos suprimentos e reagentes usados no ensaio, e as técnicas do indivíduo que realiza o teste1,2,3. O pó de cefpodoxima padrão deve fornecer a seguinte faixa de valores de MIC observados na Tabela 2. Para a técnica de difusão usando o disco de 10 mcg, os critérios da Tabela 2 devem ser alcançados.
Testes clínicos
Cistite
Em dois estudos duplo-cegos, randomizados, comparativos 2:1 realizados em adultos nos Estados Unidos, a cefpodoxima proxetil foi comparada a outros antibióticos beta-lactâmicos. Nesses estudos, as seguintes taxas de erradicação bacteriana foram obtidas em 5 a 9 dias após a terapia:
Nesses estudos, as taxas de cura clínica e de erradicação bacteriana da cefpodoxima proxetil foram comparáveis às dos agentes comparadores; entretanto, as taxas de cura clínica e de erradicação bacteriológica foram menores do que aquelas observadas com algumas outras classes de agentes aprovados para cistite.
Estudos de otite média aguda
Em estudos controlados de otite média aguda realizados nos Estados Unidos, onde foram encontradas taxas significativas de organismos produtores de betalactamase, a cefpodoxima proxetil foi comparada à cefixima. Nesses estudos, usando critérios de avaliação muito rigorosos e critérios de resposta microbiológica e clínica no seguimento de 4 a 21 dias após a terapia, foram obtidos os seguintes resultados presumíveis de erradicação bacteriana/sucesso clínico (curado e melhorado).
REFERÊNCIAS
1. Instituto de Padrões Clínicos e Laboratoriais (CLSI). Métodos para Testes de Susceptibilidade Antimicrobiana de Diluição para Bactérias que Crescem Aerobicamente; Norma Aprovada - Nona Edição. Documento CLSI M07-A9, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, EUA, 2012.
2. Instituto de Padrões Clínicos e Laboratoriais (CLSI). Padrões de Desempenho para Testes de Susceptibilidade Antimicrobiana; Vigésimo terceiro suplemento informativo, documento CLSI M100-S23. Documento CLSI M100-S23, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, EUA, 2013.
3. Instituto de Padrões Clínicos e Laboratoriais (CLSI). Padrões de Desempenho para Testes de Susceptibilidade de Difusão em Disco Antimicrobiano; Padrão aprovado - Documento CLSI da décima primeira edição M02-A11, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, EUA, 2012.
INFORMAÇÃO DO PACIENTE
Os pacientes devem ser informados de que os medicamentos antibacterianos, incluindo ANTIN, devem ser usados apenas para tratar infecções bacterianas. Eles não tratam infecções virais (por exemplo, o resfriado comum). Quando Vantin é prescrito para tratar uma infecção bacteriana, os pacientes devem ser informados de que, embora seja comum sentir-se melhor no início do tratamento, a medicação deve ser tomada exatamente como indicado. Pular doses ou não completar o curso completo da terapia pode (1) diminuir a eficácia do tratamento imediato e (2) aumentar a probabilidade de que as bactérias desenvolvam resistência e não sejam tratáveis por ANTIN ou outros medicamentos antibacterianos no futuro.
A diarreia é um problema comum causado por antibióticos que geralmente termina quando o antibiótico é descontinuado. Às vezes, após o início do tratamento com antibióticos, os pacientes podem desenvolver fezes aquosas e sanguinolentas (com ou sem cólicas estomacais e febre), mesmo dois ou mais meses após a última dose do antibiótico. Se isso ocorrer, os pacientes devem entrar em contato com seu médico o mais rápido possível.
