Zofran 4mg, 8mg Ondansetron Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Zofran e como é usado?
Zofran 4mg é um medicamento de prescrição usado como profilaxia e para tratar sintomas de náuseas e vômitos devido a certos medicamentos ou no pós-operatório. Zofran 8mg pode ser usado sozinho ou com outros medicamentos.
Zofran pertence a uma classe de medicamentos chamados Antieméticos, Antagonista Seletivo de 5-HT3.
Não se sabe se Zofran 4mg é seguro e eficaz em crianças menores de 1 mês de idade.
Quais são os possíveis efeitos colaterais do Zofran?
Zofran pode causar efeitos colaterais graves, incluindo:
- constipação severa,
- dor de estômago,
- inchaço,
- dor de cabeça com dor no peito e tontura severa,
- desmaio,
- batimentos cardíacos rápidos ou acelerados,
- amarelecimento da pele ou dos olhos (icterícia)
- visão embaçada,
- perda temporária da visão,
- agitação,
- alucinações,
- febre,
- batimentos cardíacos rápidos,
- reflexos hiperativos,
- náusea,
- vômito,
- diarréia,
- perda de coordenação e
- desmaio
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Zofran incluem:
- diarréia,
- constipação,
- sonolência e
- sensação de cansaço
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Zofran. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
DESCRIÇÃO
ingrediente ativo dos comprimidos de ZOFRAN 4mg e da solução oral de ZOFRAN é o cloridrato de ondansetrona na forma dihidratada, a forma racêmica de ondansetrona e um agente bloqueador seletivo do tipo de receptor 5-HT3 da serotonina. Quimicamente é (±) 1, 2, 3, 9-tetrahidro-9-metil-3-[(2-metil-1H-imidazol-1-il)metil]-4H-carbazol-4-ona, monocloridrato, di-hidratado . Tem a seguinte fórmula estrutural:
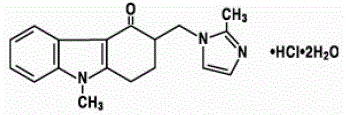
A fórmula empírica é C18H19N3O·HCl·2H2O, representando um peso molecular de 365,9.
O cloridrato de ondansetrona dihidratado é um pó branco a esbranquiçado que é solúvel em água e solução salina normal.
O ingrediente ativo dos comprimidos de desintegração oral de ZOFRAN 4mg ODT é a base de ondansetrona, a forma racêmica de ondansetrona, e um agente bloqueador seletivo do tipo receptor de serotonina 5-HT3. Quimicamente é (±) 1, 2, 3, 9tetra-hidro-9-metil-3-[(2-metil-1H-imidazol-1-il)metil]-4H-carbazol-4-ona. Tem a seguinte fórmula estrutural:
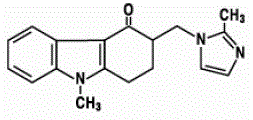
fórmula empírica é C18H19N3O representando um peso molecular de 293,4.
Cada comprimido de 4 mg de ZOFRAN 8 mg para administração oral contém cloridrato de ondansetrom dihidratado equivalente a 4 mg de ondansetrom. Cada comprimido de 8 mg de ZOFRAN 8 mg para administração oral contém dihidrato de cloridrato de ondansetrom equivalente a 8 mg de ondansetrom. Cada comprimido também contém os ingredientes inativos hipromelose, óxido de ferro amarelo (apenas comprimido de 8 mg), lactose, estearato de magnésio, celulose microcristalina, amido pré-gelatinizado, triacetina e dióxido de titânio.
Cada comprimido de desintegração oral de 4 mg de ZOFRAN 8 mg ODT para administração oral contém 4 mg de base de ondansetrom. Cada comprimido de desintegração oral de 8 mg de ZOFRAN 4 mg ODT para administração oral contém 8 mg de base de ondansetrom. Cada comprimido de ZOFRAN ODT também contém os ingredientes inativos aspartame, gelatina, manitol, metilparabeno sódico, propilparabeno sódico e aroma de morango. Os comprimidos de ZOFRAN ODT são uma formulação de ondansetrona administrada por via oral, liofilizada, que se desintegra na língua e não requer água para ajudar na dissolução ou deglutição.
Cada 5 mL de solução oral de ZOFRAN contém 5 mg de cloridrato de ondansetrom di-hidratado equivalente a 4 mg de ondansetrom. ZOFRAN 8mg solução oral contém os ingredientes inativos ácido cítrico anidro, água purificada, benzoato de sódio, citrato de sódio, sorbitol e aroma de morango.
INDICAÇÕES
ZOFRAN é indicado para a prevenção de náuseas e vômitos associados a:
- quimioterapia de câncer altamente emetogênica, incluindo cisplatina maior ou igual a 50 mg/m²
- cursos iniciais e repetidos de quimioterapia para câncer moderadamente emetogênico
- radioterapia em pacientes que recebem irradiação corporal total, fração única de alta dose no abdome ou frações diárias no abdome
ZOFRAN também é indicado para a prevenção de náuseas e/ou vômitos pós-operatórios.
DOSAGEM E ADMINISTRAÇÃO
Dosagem
Os regimes de dosagem recomendados para pacientes adultos e pediátricos estão descritos na Tabela 1 e na Tabela 2, respectivamente. Doses correspondentes de comprimidos de ZOFRAN, comprimidos de desintegração oral de ZOFRAN ODT® e solução oral de ZOFRAN podem ser usadas alternadamente.
Dosagem em Insuficiência Hepática
Em pacientes com insuficiência hepática grave (escore de Child-Pugh de 10 ou mais), não exceda uma dose diária total de 8 mg [ver Uso em populações específicas , FARMACOLOGIA CLÍNICA ].
Instruções de administração para comprimidos de desintegração oral ZOFRAN ODT
Não tente empurrar os comprimidos de desintegração oral de ZOFRAN ODT através do suporte de alumínio. Com as mãos secas, RETIRE o revestimento de 1 blister e remova suavemente o comprimido. Coloque IMEDIATAMENTE o comprimido de desintegração oral de ZOFRAN 4mg ODT no topo da língua, onde ele se dissolverá em segundos, depois engula com saliva. A administração com líquido não é necessária.
COMO FORNECIDO
Formas de dosagem e pontos fortes
comprimidos de ZOFRAN são comprimidos ovais, revestidos por película, gravados com “Zofran” num dos lados e estão disponíveis nas seguintes dosagens:
- 4 mg - comprimido branco com “4” gravado no outro lado.
- 8 mg - comprimido amarelo com “8” gravado no outro lado.
ZOFRAN ODT Os comprimidos de desintegração oral são comprimidos brancos, redondos e plano-convexos disponíveis nas seguintes dosagens:
- 4 mg - gravado com “Z4” em um lado.
- 8 mg - gravado com “Z8” em um lado.
ZOFRAN 4mg solução oral 4 mg/5 mL, é um líquido límpido, incolor a amarelo claro com odor característico de morango disponível em frasco de 50 mL.
Armazenamento e manuseio
Comprimidos ZOFRAN
4 mg (cloridrato de ondansetrona di-hidratado equivalente a 4 mg de ondansetrona), são comprimidos revestidos por película brancos, ovais, gravados com “Zofran” de um lado e “4” do outro em frascos de 30 comprimidos (NDC 0078-0675-15). ).
Armazenar entre 2°C e 30°C (36°F e 86°F). Proteja da luz. Dispensar em recipiente hermético e resistente à luz, conforme definido na USP.
8 mg (cloridrato de ondansetrona dihidratado equivalente a 8 mg de ondansetrona), são comprimidos revestidos por película amarelos, ovais, gravados com “Zofran” de um lado e “8” do outro em frascos de 30 comprimidos (NDC 0078-0676-15). ).
Armazenar entre 2°C e 30°C (36°F e 86°F). Proteja da luz. Dispensar em recipiente hermético e resistente à luz, conforme definido na USP.
ZOFRAN 8mg ODT comprimidos de desintegração oral
4 mg (como 4 mg de base de ondansetrom) são comprimidos brancos, redondos e plano-convexos com a gravação “Z4” de um lado em embalagens de dose unitária de 30 comprimidos (NDC 0078-0679-19).
mg (como 8 mg de base de ondansetrom) são comprimidos brancos, redondos e plano-convexos com a gravação “Z8” de um lado em embalagens de dose unitária de 30 comprimidos (NDC 0078-0680-19).
Armazenar entre 2°C e 30°C (36°F e 86°F).
Solução Oral ZOFRAN 4mg
um líquido límpido, incolor a amarelo claro com odor característico de morango, contém 5 mg de cloridrato de ondansetrona dihidratado equivalente a 4 mg de ondansetrona por 5 mL em frascos de vidro âmbar de 50 mL com tampas resistentes a crianças (NDC 0078-0677-22) .
Armazene na vertical entre 15°C e 30°C (59°F e 86°F). Proteja da luz. Armazene as garrafas na vertical em caixas de papelão.
Distribuído por: Novartis Pharmaceuticals Corporation East Hanover, Nova Jersey 07936. Revisado: abril de 2021
EFEITOS COLATERAIS
As seguintes reações adversas clinicamente significativas são descritas em outras partes da bula:
- Reações de hipersensibilidade [ver AVISOS E PRECAUÇÕES ]
- Prolongamento do intervalo QT [ver AVISOS E PRECAUÇÕES ]
- Síndrome serotoninérgica [ver AVISOS E PRECAUÇÕES ]
- Mascaramento de íleo progressivo e distensão gástrica [ver AVISOS E PRECAUÇÕES ]
Experiência de Ensaios Clínicos
Como os ensaios clínicos são conduzidos sob condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser comparadas diretamente com as taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
As seguintes reações adversas foram relatadas em estudos clínicos de pacientes tratados com ondansetrona, o ingrediente ativo de ZOFRAN. A relação causal com a terapia com ZOFRAN não foi clara em muitos casos.
Prevenção de náuseas e vômitos induzidos por quimioterapia
As reações adversas mais comuns relatadas em mais ou igual a 4% de 300 adultos que receberam uma dose única de 24 mg de ZOFRAN 4 mg por via oral em 2 estudos para a prevenção de náuseas e vômitos associados à quimioterapia altamente emetogênica (cisplatina maior ou igual a 50 mg /m²) foram: cefaleia (11%) e diarreia (4%).
As reações adversas mais comuns relatadas em 4 estudos em adultos para a prevenção de náuseas e vômitos associados à quimioterapia moderadamente emetogênica (principalmente regimes baseados em ciclofosfamida) são mostradas na Tabela 3.
Reações Adversas Menos Comuns
Sistema nervoso central
Reações extrapiramidais (menos de 1% dos pacientes).
Hepático
Os valores de aspartato transaminase (AST) e/ou alanina transaminase (ALT) excederam duas vezes o limite superior do normal em aproximadamente 1% a 2% de 723 pacientes que receberam ZOFRAN 8mg e quimioterapia à base de ciclofosfamida em ensaios clínicos nos EUA. Os aumentos foram transitórios e não pareceram estar relacionados com a dose ou duração da terapia. Na exposição repetida, ocorreram elevações transitórias semelhantes nos valores das transaminases em alguns cursos, mas não ocorreu doença hepática sintomática. O papel da quimioterapia do câncer nessas alterações bioquímicas não é claro.
Insuficiência hepática e morte foram relatadas em pacientes com câncer recebendo medicamentos concomitantes, incluindo quimioterapia citotóxica potencialmente hepatotóxica e antibióticos. A etiologia da insuficiência hepática não é clara.
Tegumentar
Erupção cutânea (aproximadamente 1% dos pacientes).
Outros (menos de 2%)
Anafilaxia, broncoespasmo, taquicardia, angina, hipocalemia, alterações eletrocardiográficas, eventos oclusivos vasculares e convulsões do tipo grande mal. Exceto para broncoespasmo e anafilaxia, a relação com ZOFRAN 4mg não é clara.
Prevenção de náuseas e vômitos induzidos por radiação
As reações adversas mais comuns (maior ou igual a 2%) relatadas em pacientes que receberam ZOFRAN e radioterapia concomitante foram semelhantes às relatadas em pacientes que receberam ZOFRAN e quimioterapia concomitante e foram cefaleia, constipação e diarreia.
Prevenção de náuseas e vômitos pós-operatórios
As reações adversas mais comuns relatadas em adultos em estudos de prevenção de náuseas e vômitos pós-operatórios são mostradas na Tabela 4. Nesses estudos, os pacientes estavam recebendo múltiplas medicações perioperatórias e pós-operatórias concomitantes em ambos os grupos de tratamento.
Em um estudo cruzado com 25 indivíduos, dor de cabeça foi relatada em 6 indivíduos que receberam ZOFRAN 8mg ODT comprimido desintegrante oral com água (24%) em comparação com 2 indivíduos administrados ZOFRAN 8mg ODT comprimido desintegrante oral sem água (8%).
Experiência pós-marketing
As seguintes reações adversas foram identificadas durante o uso pós-aprovação de ondansetrona. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento.
Cardiovascular
Arritmias (incluindo taquicardia ventricular e supraventricular, contrações ventriculares prematuras e fibrilação atrial), bradicardia, alterações eletrocardiográficas (incluindo bloqueio cardíaco de segundo grau, prolongamento do intervalo QT/QTc e depressão do segmento ST), palpitações e síncope. Raramente e predominantemente com ondansetrona intravenosa, foram relatadas alterações transitórias do ECG, incluindo prolongamento do intervalo QT.
Em geral
Lavagem
Casos raros de reações de hipersensibilidade, algumas vezes graves (por exemplo, reações anafiláticas, angioedema, broncoespasmo, falta de ar, hipotensão, edema laríngeo, estridor) também foram relatados. Laringoespasmo, choque e parada cardiorrespiratória ocorreram durante reações alérgicas em pacientes que receberam ondansetrona injetável.
Hepatobiliar
Anormalidades das enzimas hepáticas.
Respiratório Inferior
Soluços.
Neurologia
Crise oculogírica, aparecendo isoladamente, assim como com outras reações distônicas.
Pele
Urticária, síndrome de Stevens-Johnson e necrólise epidérmica tóxica.
Distúrbios oculares
Casos de cegueira transitória, predominantemente durante a administração intravenosa, foram relatados. Esses casos de cegueira transitória foram relatados para resolver dentro de alguns minutos até 48 horas.
INTERAÇÕES MEDICAMENTOSAS
Drogas serotoninérgicas
síndrome serotoninérgica (incluindo estado mental alterado, instabilidade autonômica e sintomas neuromusculares) foi descrita após o uso concomitante de antagonistas do receptor 5-HT3 e outras drogas serotoninérgicas, incluindo ISRSs e SNRIs. Monitorar o surgimento da síndrome serotoninérgica. Se ocorrerem sintomas, descontinue ZOFRAN 4mg e inicie tratamento de suporte [ver AVISOS E PRECAUÇÕES ].
Drogas que Afetam Enzimas do Citocromo P-450
A ondansetrona não parece induzir ou inibir o sistema enzimático de metabolização de drogas do citocromo P-450 no fígado. FARMACOLOGIA CLÍNICA ]. Como o ondansetrom é metabolizado pelas enzimas hepáticas metabolizadoras de drogas do citocromo P450 (CYP3A4, CYP2D6, CYP1A2), os indutores ou inibidores dessas enzimas podem alterar a depuração e, portanto, a meia-vida do ondansetrom. Em pacientes tratados com indutores potentes de CYP3A4 (ou seja, fenitoína, carbamazepina e rifampicina), a depuração de ondansetrona foi significativamente aumentada e as concentrações sanguíneas de ondansetrona diminuíram. No entanto, com base nos dados disponíveis, nenhum ajuste de dose de ZOFRAN 8mg é recomendado para pacientes em uso desses medicamentos [ver FARMACOLOGIA CLÍNICA ].
Tramadol
Embora nenhuma interação farmacocinética entre ondansetrona e tramadol tenha sido observada, dados de 2 pequenos estudos indicam que, quando usado em conjunto, ZOFRAN 8mg pode aumentar a administração de tramadol controlada pelo paciente. Monitore os pacientes para garantir o controle adequado da dor quando o ondansetrom é administrado com tramadol.
Quimioterapia
A carmustina, o etoposídeo e a cisplatina não afetam a farmacocinética do ondansetrom.
Em um estudo cruzado em 76 pacientes pediátricos, ondansetrona intravenosa não aumentou as concentrações sistêmicas de metotrexato em altas doses.
Alfentanil e Atracúrio
ZOFRAN 4mg não altera os efeitos depressores respiratórios produzidos pelo alfentanil ou o grau de bloqueio neuromuscular produzido pelo atracúrio. As interações com anestésicos gerais ou locais não foram estudadas.
Abuso e Dependência de Drogas
Estudos em animais mostraram que a ondansetrona não é discriminada como um benzodiazepínico nem substitui os benzodiazepínicos em estudos de dependência direta.
AVISOS
Incluído como parte do PRECAUÇÕES seção.
PRECAUÇÕES
Reações de hipersensibilidade
Reações de hipersensibilidade, incluindo anafilaxia e broncoespasmo, foram relatadas em pacientes que exibiram hipersensibilidade a outros antagonistas seletivos do receptor 5-HT3. Se ocorrerem reações de hipersensibilidade, interrompa o uso de ZOFRAN; trate prontamente de acordo com o padrão de cuidados e monitore até que os sinais e sintomas desapareçam [ver CONTRA-INDICAÇÕES ].
Prolongamento QT
Alterações no eletrocardiograma (ECG), incluindo prolongamento do intervalo QT, foram observadas em pacientes recebendo ondansetrona. Além disso, casos pós-comercialização de Torsade de Pointes foram relatados em pacientes usando ZOFRAN. Evite ZOFRAN 8mg em pacientes com síndrome congênita do QT longo. O monitoramento do ECG é recomendado em pacientes com anormalidades eletrolíticas (p. FARMACOLOGIA CLÍNICA ].
Síndrome da serotonina
desenvolvimento da síndrome serotoninérgica foi relatado apenas com antagonistas do receptor 5-HT3. A maioria dos relatos foi associada ao uso concomitante de drogas serotoninérgicas (por exemplo, inibidores seletivos de recaptação de serotonina (ISRSs), inibidores de recaptação de serotonina e norepinefrina (IRSNs), inibidores da monoaminoxidase, mirtazapina, fentanil, lítio, tramadol e azul de metileno intravenoso). Alguns dos casos relatados foram fatais. A síndrome serotoninérgica que ocorre com superdosagem de ZOFRAN 4mg isoladamente também foi relatada. A maioria dos relatos de síndrome serotoninérgica relacionada ao uso de antagonistas do receptor 5-HT3 ocorreu em uma unidade de recuperação pós-anestésica ou em um centro de infusão.
Os sintomas associados à síndrome serotoninérgica podem incluir a seguinte combinação de sinais e sintomas: alterações do estado mental (p. , sintomas neuromusculares (por exemplo, tremor, rigidez, mioclonia, hiperreflexia, incoordenação), convulsões, com ou sem sintomas gastrointestinais (por exemplo, náusea, vômito, diarreia). Os pacientes devem ser monitorados quanto ao surgimento de síndrome serotoninérgica, especialmente com o uso concomitante de ZOFRAN 4mg e outras drogas serotoninérgicas. Se ocorrerem sintomas de síndrome serotoninérgica, descontinuar ZOFRAN e iniciar tratamento de suporte. Os pacientes devem ser informados sobre o risco aumentado de síndrome serotoninérgica, especialmente se ZOFRAN for usado concomitantemente com outros medicamentos serotoninérgicos [ver INTERAÇÕES MEDICAMENTOSAS , SUPERDOSAGEM ].
Mascaramento de íleo progressivo e distensão gástrica
uso de ZOFRAN em pacientes após cirurgia abdominal ou em pacientes com náuseas e vômitos induzidos por quimioterapia pode mascarar um íleo progressivo e/ou distensão gástrica. Monitorar a atividade intestinal diminuída, particularmente em pacientes com fatores de risco para obstrução gastrointestinal.
ZOFRAN 8mg não é um medicamento que estimule o peristaltismo gástrico ou intestinal. Não deve ser utilizado no lugar da aspiração nasogástrica.
Fenilcetonúria
Pacientes fenilcetonúricos devem ser informados de que ZOFRAN ODT comprimidos de desintegração oral contém fenilalanina (um componente do aspartame). Cada comprimido de desintegração oral de 4 mg e 8 mg contém menos de 0,03 mg de fenilalanina.
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Efeitos carcinogênicos não foram observados em estudos de 2 anos em ratos e camundongos com doses orais de ondansetrona de até 10 mg/kg por dia e 30 mg/kg por dia, respectivamente (aproximadamente 4 e 6 vezes a dose oral máxima recomendada em humanos de 24 mg por dia, com base na área de superfície corporal).
Ondansetrom não foi mutagênico em testes padrão de mutagenicidade.
A administração oral de ondansetrom até 15 mg/kg por dia (aproximadamente 6 vezes a dose oral humana máxima recomendada de 24 mg por dia, com base na área de superfície corporal) não afetou a fertilidade ou o desempenho reprodutivo geral de ratos machos e fêmeas.
Uso em populações específicas
Gravidez
Resumo do risco
Estudos epidemiológicos publicados sobre a associação entre o uso de ondansetrom e grandes defeitos congênitos relataram achados inconsistentes e têm importantes limitações metodológicas que impedem conclusões sobre a segurança do uso de ondansetrom na gravidez (ver Dados ). Os dados pós-comercialização disponíveis não identificaram risco de aborto associado ao medicamento ou desfechos maternos adversos. Estudos reprodutivos em ratos e coelhos não mostraram evidências de danos ao feto quando o ondansetrom foi administrado durante a organogênese em aproximadamente 6 e 24 vezes a dose oral humana máxima recomendada de 24 mg/dia, com base na área de superfície corporal, respectivamente (ver Dados ).
risco de fundo de defeitos congênitos graves e aborto para a população indicada é desconhecido. Todas as gestações têm um risco histórico de defeitos congênitos, abortos espontâneos ou outros resultados adversos. Na população geral dos EUA, o risco de fundo estimado de grandes defeitos congênitos e abortos em gestações clinicamente reconhecidas é de 2% a 4% e 15% a 20%, respectivamente.
Dados
Dados humanos
Os dados disponíveis sobre o uso de ondansetrona em mulheres grávidas de vários estudos epidemiológicos publicados impedem uma avaliação do risco associado ao medicamento de resultados fetais adversos devido a importantes limitações metodológicas, incluindo a incerteza se as mulheres que prescreveram realmente tomaram o medicamento, o uso concomitante de outros medicamentos ou tratamentos, viés de memória e outros fatores de confusão não ajustados.
exposição à ondansetrona in utero não foi associada a malformações congênitas maiores em análises agregadas. Um grande estudo de coorte retrospectivo examinou 1.970 mulheres que receberam prescrição de ondansetrona durante a gravidez e não relatou associação entre exposição a ondansetrona e malformações congênitas maiores, aborto espontâneo, natimorto, parto prematuro, bebês de baixo peso ao nascer ou bebês pequenos para a idade gestacional.
Dois grandes estudos de coorte retrospectivos e um estudo de caso-controle avaliaram a exposição à ondansetrona no primeiro trimestre e o risco de defeitos cardiovasculares com achados inconsistentes. Os riscos relativos (RR) variaram de 0,97 (IC 95% 0,86 a 1,10) a 1,62 (IC 95% 1,04, 2,54). Uma análise de subconjunto em um dos estudos de coorte observou que o ondansetron estava especificamente associado a defeitos do septo cardíaco (RR 2,05, IC 95% 1,19, 3,28); entretanto, essa associação não foi confirmada em outros estudos.
Vários estudos avaliaram o ondansetron e o risco de fissuras orais com achados inconsistentes. Um estudo de coorte retrospectivo de 1,8 milhão de gestações no banco de dados Medicaid dos EUA mostrou um risco aumentado de fissuras orais entre 88.467 gestações nas quais ondansetron oral foi prescrito no primeiro trimestre (RR 1,24, IC 95% 1,03, 1,48), mas nenhuma associação foi relatados com ondansetrona intravenosa em 23.866 gestações (RR 0,95, IC 95% 0,63, 1,43). No subgrupo de mulheres que receberam ambas as formas de administração, o RR foi de 1,07 (IC 95% 0,59, 1,93). Dois estudos de caso-controle, usando dados de programas de vigilância de defeitos congênitos, relataram associações conflitantes entre o uso materno de ondansetrona e fenda palatina isolada (OR 1,6 [IC 95% 1,1, 2,3] e 0,5 [IC 95% 0,3, 1,0]). Não se sabe se a exposição ao ondansetron in utero nos casos de fenda palatina ocorreu durante o período de formação do palato (o palato é formado entre a 6ª e a 9ª semanas de gravidez).
Dados de animais
Em estudos de desenvolvimento embriofetal em ratos e coelhos, animais prenhes receberam doses orais de ondansetrona de até 15 mg/kg/dia e 30 mg/kg/dia, respectivamente, durante o período de organogênese. Com exceção de uma ligeira diminuição no ganho de peso corporal materno nos coelhos, não houve efeitos significativos de ondansetron nos animais maternos ou no desenvolvimento da prole. Em doses de 15 mg/kg/dia em ratos e 30 mg/kg/dia em coelhos, a margem de exposição materna foi de aproximadamente 6 e 24 vezes a dose oral humana máxima recomendada de 24 mg/dia, respectivamente, com base na área de superfície corporal. .
Em um estudo de toxicidade de desenvolvimento pré e pós-natal, ratas grávidas receberam doses orais de ondansetrona de até 15 mg/kg/dia do dia 17 da gestação ao dia 21 da ninhada. nenhum efeito sobre as ratas grávidas e o desenvolvimento pré e pós-natal de sua prole, incluindo o desempenho reprodutivo da geração F1 acasalada. Com uma dose de 15 mg/kg/dia em ratos, a margem de exposição materna foi aproximadamente 6 vezes a dose oral humana máxima recomendada de 24 mg/dia, com base na área de superfície corporal.
Lactação
Resumo do risco
Não se sabe se o ondansetrom está presente no leite humano. Não há dados sobre os efeitos de ZOFRAN 8mg no lactente ou os efeitos na produção de leite. No entanto, foi demonstrado que o ondansetron está presente no leite de ratos. Quando um fármaco está presente no leite animal, é provável que o fármaco esteja presente no leite humano.
Os benefícios do aleitamento materno para o desenvolvimento e para a saúde devem ser considerados juntamente com a necessidade clínica da mãe de ZOFRAN 4mg e quaisquer potenciais efeitos adversos no lactente de ZOFRAN ou da condição materna subjacente.
Uso Pediátrico
A segurança e a eficácia de ZOFRAN administrado por via oral foram estabelecidas em pacientes pediátricos com 4 anos ou mais para a prevenção de náuseas e vômitos associados à quimioterapia para câncer moderadamente emetogênica. O uso de ZOFRAN 4mg nestes grupos etários é apoiado por evidências de estudos adequados e bem controlados de ZOFRAN em adultos com dados adicionais de 3 estudos abertos, não controlados, fora dos EUA em 182 pacientes pediátricos de 4 a 18 anos com câncer que receberam uma variedade de regimes de cisplatina ou não cisplatina [ver DOSAGEM E ADMINISTRAÇÃO , Estudos clínicos ].
Informações adicionais sobre o uso de ondansetrona em pacientes pediátricos podem ser encontradas nas informações de prescrição de ZOFRAN Injetável.
segurança e eficácia de ZOFRAN 4mg administrado por via oral não foram estabelecidas em pacientes pediátricos para:
- prevenção de náuseas e vômitos associados à quimioterapia altamente emetogênica do câncer
- prevenção de náuseas e vômitos associados à radioterapia
- prevenção de náuseas e/ou vômitos pós-operatórios
Uso Geriátrico
Do número total de indivíduos inscritos em náuseas e vômitos induzidos por quimioterapia e pós-operatório de câncer em ensaios clínicos controlados nos EUA e no exterior, para os quais houve análises de subgrupos, 938 (19%) tinham 65 anos ou mais.
Não foram observadas diferenças globais na segurança ou eficácia entre indivíduos com 65 anos de idade e indivíduos mais velhos e mais jovens. Uma redução na depuração e um aumento na meia-vida de eliminação foram observados em pacientes com mais de 75 anos em comparação com indivíduos mais jovens [ver FARMACOLOGIA CLÍNICA ]. Houve um número insuficiente de pacientes com mais de 75 anos de idade nos ensaios clínicos para permitir conclusões de segurança ou eficácia nesta faixa etária. Outras experiências clínicas relatadas não identificaram diferenças nas respostas entre idosos e pacientes mais jovens, mas não se pode descartar uma maior sensibilidade de alguns indivíduos mais velhos. Não é necessário ajuste de dose em pacientes idosos.
Insuficiência hepática
Não é necessário ajuste de dose em pacientes com insuficiência hepática leve ou moderada.
Em pacientes com insuficiência hepática grave, a depuração é reduzida e o volume aparente de distribuição é aumentado, resultando em um aumento significativo na meia-vida do ondansetrom. Portanto, não exceda uma dose diária total de 8 mg em pacientes com insuficiência hepática grave (escore de Child-Pugh de 10 ou mais) [ver DOSAGEM E ADMINISTRAÇÃO , FARMACOLOGIA CLÍNICA ].
Insuficiência renal
Nenhum ajuste de dose é recomendado para pacientes com qualquer grau de insuficiência renal (leve, moderada ou grave). Não há experiência além da administração de ondansetrom no primeiro dia [ver FARMACOLOGIA CLÍNICA ].
SOBREDOSAGEM
Não há antídoto específico para superdosagem de ondansetrom. Os pacientes devem ser tratados com terapia de suporte apropriada.
Além das reações adversas listadas acima, as seguintes reações adversas foram descritas no contexto de superdosagem de ondansetrom: “Cegueira súbita” (amaurose) de 2 a 3 minutos de duração mais constipação grave ocorreu em um paciente que recebeu 72 mg de ondansetrona intravenosa em dose única. Hipotensão (e desmaio) ocorreu em um paciente que tomou 48 mg de comprimidos de ZOFRAN. Após a infusão de 32 mg em um período de apenas 4 minutos, foi observado um episódio vasovagal com bloqueio cardíaco transitório de segundo grau. Em todos os casos, as reações adversas desapareceram completamente.
Casos pediátricos consistentes com síndrome serotoninérgica foram relatados após superdosagem oral inadvertida de ondansetrom (ingestão superior a 5 mg por kg) em crianças pequenas. Os sintomas relatados incluíram sonolência, agitação, taquicardia, taquipneia, hipertensão, rubor, midríase, sudorese, movimentos mioclônicos, nistagmo horizontal, hiperreflexia e convulsão. Os pacientes necessitaram de cuidados de suporte, incluindo intubação em alguns casos, com recuperação completa sem sequelas em 1 a 2 dias.
CONTRA-INDICAÇÕES
ZOFRAN é contraindicado em pacientes:
- conhecida por ter hipersensibilidade (por exemplo, anafilaxia) ao ondansetrona ou a qualquer um dos componentes da formulação [ver REAÇÕES ADVERSAS ]
- recebendo apomorfina concomitante devido ao risco de hipotensão profunda e perda de consciência
FARMACOLOGIA CLÍNICA
Mecanismo de ação
Ondansetron é um antagonista seletivo do receptor 5-HT3. Embora seu mecanismo de ação não tenha sido totalmente caracterizado, a ondansetrona não é um antagonista do receptor de dopamina. Os receptores de serotonina do tipo 5-HT3 estão presentes tanto perifericamente nas terminações nervosas vagais quanto centralmente na zona de gatilho quimiorreceptora da área postrema. Não é certo se a ação antiemética do ondansetron é mediada centralmente, perifericamente ou em ambos os locais. No entanto, a quimioterapia citotóxica parece estar associada à liberação de serotonina das células enterocromafins do intestino delgado. Em humanos, a excreção urinária de ácido 5-hidroxiindolacético (5-HIAA) aumenta após a administração de cisplatina em paralelo com o início do vômito. A serotonina liberada pode estimular os aferentes vagais através dos receptores 5-HT3 e iniciar o reflexo do vômito.
Farmacodinâmica
Em indivíduos saudáveis, doses intravenosas únicas de 0,15 mg/kg de ondansetrona não tiveram efeito sobre a motilidade esofágica, motilidade gástrica, pressão do esfíncter esofágico inferior ou tempo de trânsito do intestino delgado. A administração de ondansetrona por vários dias demonstrou retardar o trânsito colônico em indivíduos saudáveis. O ondansetrom não tem efeito sobre as concentrações de plasmaprolactina.
Eletrofisiologia Cardíaca
prolongamento do intervalo QTc foi estudado em um estudo cruzado duplo-cego, de dose única intravenosa, controlado por placebo e positivo, em 58 indivíduos saudáveis. A diferença média máxima (limite de confiança superior de 95%) no QTcF do placebo após a correção da linha de base foi de 19,5 (21,8) milissegundos e 5,6 (7,4) milissegundos após 15 minutos de infusões intravenosas de 32 mg e 8 mg de injeção de ondansetrona, respectivamente. Uma relação exposição-resposta significativa foi identificada entre a concentração de ondansetron e ΔΔQTcF. Usando a relação exposição-resposta estabelecida, 24 mg infundidos por via intravenosa durante 15 minutos tiveram um ΔΔQTcF médio previsto (intervalo de previsão superior de 95%) de 14,0 (16,3) milissegundos. Em contraste, 16 mg infundidos por via intravenosa durante 15 minutos usando o mesmo modelo tiveram um ΔΔQTcF médio previsto (intervalo de previsão superior de 95%) de 9,1 (11,2) milissegundos. Neste estudo, a dose de 8 mg infundida durante 15 minutos não prolongou o intervalo QT em qualquer extensão clinicamente relevante.
Farmacocinética
Absorção
ondansetrona é absorvida no trato gastrointestinal e sofre algum metabolismo de primeira passagem. A biodisponibilidade média em indivíduos saudáveis, após a administração de um único comprimido de 8 mg, é de aproximadamente 56%.
A exposição sistêmica ao ondansetrom não aumenta proporcionalmente à dose. A área sob a curva (AUC) de um comprimido de 16 mg foi 24% maior do que o previsto a partir de uma dose de comprimido de 8 mg. Isso pode refletir alguma redução do metabolismo de primeira passagem em doses orais mais altas.
Efeitos dos alimentos
A biodisponibilidade também é ligeiramente aumentada pela presença de alimentos.
Distribuição
A ligação de ondansetrona às proteínas plasmáticas medida in vitro foi de 70% a 76% na faixa de concentração de 10 a 500 ng/mL. A droga circulante também se distribui nos eritrócitos.
Eliminação
Metabolismo e Excreção
ondansetrona é extensivamente metabolizada em humanos, com aproximadamente 5% de uma dose radiomarcada recuperada da urina como composto original. Os metabólitos são observados na urina. A via metabólica primária é a hidroxilação no anel indol seguida pela conjugação subsequente de glicuronídeos ou sulfatos.
Estudos de metabolismo in vitro mostraram que o ondansetrom é um substrato para as enzimas hepáticas humanas do citocromo P-450, incluindo CYP1A2, CYP2D6 e CYP3A4. Em termos de volume global de ondansetron, CYP3A4 desempenhou o papel predominante. Devido à multiplicidade de enzimas metabólicas capazes de metabolizar ondansetrom, é provável que a inibição ou perda de uma enzima (p.
Embora alguns metabólitos não conjugados tenham atividade farmacológica, eles não são encontrados no plasma em concentrações que possam contribuir significativamente para a atividade biológica do ondansetrom.
Populações Específicas
Idade: População Geriátrica
Uma redução na depuração e um aumento na meia-vida de eliminação são observados em pacientes com mais de 75 anos em comparação com indivíduos mais jovens [ver Uso em populações específicas ].
Sexo
Diferenças de gênero foram mostradas na disposição de ondansetrona administrado em dose única. A extensão e a taxa de absorção são maiores nas mulheres do que nos homens. A depuração mais lenta em mulheres, um volume de distribuição aparente menor (ajustado para o peso) e uma biodisponibilidade absoluta mais alta resultaram em concentrações plasmáticas de ondansetrom mais altas. Estas concentrações plasmáticas mais elevadas podem ser explicadas em parte pelas diferenças de peso corporal entre homens e mulheres. Não se sabe se essas diferenças relacionadas ao sexo foram clinicamente importantes. Informações farmacocinéticas mais detalhadas estão contidas nas Tabelas 5 e 6.
Insuficiência renal
Não se espera que a insuficiência renal influencie significativamente a depuração total de ondansetrona, uma vez que a depuração renal representa apenas 5% da depuração total. No entanto, a depuração plasmática média de ondansetrona foi reduzida em cerca de 50% em pacientes com insuficiência renal grave (depuração de creatinina inferior a 30 mL/min). A redução na depuração foi variável e não consistente com um aumento na meia-vida [ver Uso em populações específicas ].
Insuficiência hepática
Em pacientes com insuficiência hepática leve a moderada, a depuração é reduzida em 2 vezes e a meia-vida média é aumentada para 11,6 horas em comparação com 5,7 horas em indivíduos saudáveis. Em pacientes com insuficiência hepática grave (pontuação de Child-Pugh de 10 ou mais), a depuração é reduzida de 2 a 3 vezes e o volume aparente de distribuição é aumentado com um aumento resultante na meia-vida para 20 horas [ver DOSAGEM E ADMINISTRAÇÃO , Uso em populações específicas ].
Estudos de interação medicamentosa
Indutores CYP 3A4
eliminação do ondansetrom pode ser afetada pelos indutores do citocromo P-450. Em um estudo farmacocinético de 16 pacientes epilépticos mantidos cronicamente com indutores do CYP3A4, carbamazepina ou fenitoína, foi observada uma redução na AUC, Cmax e t½ de ondansetrona. Isso resultou em um aumento significativo na depuração de ondansetrona. No entanto, este aumento não é considerado clinicamente relevante [ver INTERAÇÕES MEDICAMENTOSAS ].
Agentes quimioterápicos
Carmustina, etoposido e cisplatina não afetam a farmacocinética do ondansetrona [ver INTERAÇÕES MEDICAMENTOSAS ].
Antiácidos
A administração concomitante de antiácidos não altera a absorção do ondansetrom.
Estudos clínicos
Prevenção de náuseas e vômitos induzidos por quimioterapia
Quimioterapia Altamente Emetogênica
Em 2 ensaios randomizados, duplo-cegos, de monoterapia, uma dose oral única de 24 mg de ZOFRAN foi superior a um controle placebo histórico relevante na prevenção de náuseas e vômitos associados à quimioterapia altamente emetogênica do câncer, incluindo cisplatina maior ou igual a 50 mg/m². A administração de esteróides foi excluída destes ensaios clínicos. Mais de 90% dos pacientes que receberam uma dose de cisplatina maior ou igual a 50 mg/m² no comparador histórico de placebo, apresentaram vômitos na ausência de terapia antiemética.
primeiro estudo comparou doses orais de ondansetrona 24 mg como dose única, 8 mg a cada 8 horas para 2 doses e 32 mg como dose única em 357 pacientes adultos com câncer recebendo regimes de quimioterapia contendo cisplatina maior ou igual a 50 mg/m² . A primeira dose ou dose única foi administrada 30 minutos antes da quimioterapia. Um total de 66% dos pacientes no grupo de ondansetrona 24 mg uma vez ao dia, 55% no grupo de ondansetrona 8 mg duas vezes ao dia e 55% no grupo de ondansetrona 32 mg uma vez ao dia, completaram o período experimental de 24 horas com 0 episódios eméticos e sem medicação antiemética de resgate, o desfecho primário de eficácia. Cada um dos 3 grupos de tratamento mostrou ser estatisticamente significativamente superior a um controle placebo histórico.
No mesmo estudo, 56% dos pacientes que receberam uma dose oral única de 24 mg de ondansetrona não sentiram náusea durante o período de 24 horas, em comparação com 36% dos pacientes no grupo de 8 mg de ondansetrona oral duas vezes ao dia. P = 0,001) e 50% no grupo oral de ondansetrona 32 mg uma vez ao dia. Os regimes de dosagem de ZOFRAN 8 mg duas vezes ao dia e 32 mg uma vez ao dia não são recomendados para a prevenção de náuseas e vômitos associados à quimioterapia altamente emetogênica [ver DOSAGEM E ADMINISTRAÇÃO ].
Em um segundo estudo, foi confirmada a eficácia de uma dose oral única de 24 mg de ZOFRAN 4 mg para a prevenção de náuseas e vômitos associados à quimioterapia de câncer altamente emetogênico, incluindo cisplatina maior ou igual a 50 mg/m².
Quimioterapia moderadamente emetogênica
Um estudo randomizado, controlado por placebo e duplo-cego foi realizado nos EUA em 67 pacientes recebendo um regime de quimioterapia à base de ciclofosfamida contendo doxorrubicina. A primeira dose de 8 mg de ZOFRAN 8mg foi administrada 30 minutos antes do início da quimioterapia, com uma dose subsequente 8 horas após a primeira dose, seguida de 8 mg de ZOFRAN 8mg duas vezes ao dia por 2 dias após o término da quimioterapia.ZOFRAN foi significativamente mais eficaz do que o placebo na prevenção do vômito. A resposta ao tratamento baseou-se no número total de episódios eméticos durante o período experimental de 3 dias. Os resultados deste ensaio estão resumidos na Tabela 7.
Em um estudo duplo-cego nos EUA em 336 pacientes recebendo um regime de quimioterapia à base de ciclofosfamida contendo metotrexato ou doxorrubicina, Zofran 8 mg administrado duas vezes ao dia foi tão eficaz quanto Zofran 8 mg administrado 3 vezes ao dia na prevenção de náuseas e vômitos. ZOFRAN 8 mg três vezes ao dia não é um regime recomendado para o tratamento de quimioterapia moderadamente emetogênica [ver DOSAGEM E ADMINISTRAÇÃO ].
A resposta ao tratamento baseou-se no número total de episódios eméticos durante o período experimental de 3 dias. Consulte a Tabela 8 para obter detalhes dos regimes de dosagem estudados e resultados deste estudo.
Retratamento
Em ensaios de braço único, 148 pacientes que receberam quimioterapia à base de ciclofosfamida foram tratados novamente com ZOFRAN 8 mg três vezes ao dia durante a quimioterapia subsequente para um total de 396 ciclos de retratamento. Não ocorreram episódios eméticos em 314 (79%) dos ciclos de retratamento e apenas 1 a 2 episódios eméticos ocorreram em 43 (11%) dos ciclos de retratamento.
Ensaios Pediátricos
Três estudos abertos, de braço único, fora dos EUA foram realizados com 182 pacientes pediátricos com idades entre 4 e 18 anos com câncer que receberam uma variedade de regimes de cisplatina ou não. A dose inicial de injeção de ZOFRAN 4mg variou de 0,04 a 0,87 mg por kg (dose total de 2,16 mg a 12 mg) seguida pela administração de doses orais de ZOFRAN 4mg variando de 4 a 24 mg diariamente por 3 dias. Nesses estudos, 58% dos 170 pacientes avaliáveis tiveram resposta completa (sem episódios eméticos) no Dia 1. Em 2 estudos, as taxas de resposta ao ZOFRAN 4 mg três vezes ao dia em pacientes com menos de 12 anos foi semelhante ao ZOFRAN 8 mg três vezes ao dia em pacientes de 12 a 18 anos. A prevenção de vômitos nesses pacientes pediátricos foi essencialmente a mesma que em adultos.
Náuseas e vômitos induzidos por radiação
Irradiação Corporal Total
Em um estudo randomizado, controlado por placebo, duplo-cego em 20 pacientes, 8 mg de ZOFRAN administrados 1,5 horas antes de cada fração de radioterapia por 4 dias foi significativamente mais eficaz que o placebo na prevenção de vômitos induzidos por irradiação total do corpo. A irradiação total do corpo consistiu em 11 frações (120 cGy por fração) ao longo de 4 dias para um total de 1.320 cGy. Os pacientes receberam 3 frações por 3 dias, depois 2 frações no Dia 4.
Radioterapia de Fração de Alta Dose Única
Em um estudo duplo-cego com controle ativo em 105 pacientes que receberam radioterapia de alta dose única (800 a 1.000 cGy) em um tamanho de campo anterior ou posterior maior ou igual a 80 cm² do abdome, ZOFRAN 4mg foi significativamente mais eficaz do que a metoclopramida no que diz respeito ao controle completo da emese (0 episódios eméticos). Os pacientes receberam a primeira dose de ZOFRAN (8 mg) ou metoclopramida (10 mg) 1 a 2 horas antes da radioterapia. Se a radioterapia foi administrada pela manhã, 8 mg de ZOFRAN 8mg ou 10 mg de metoclopramida foram administrados no final da tarde e repetidos novamente antes de dormir. Se a radioterapia foi administrada à tarde, os pacientes tomaram 8 mg de ZOFRAN 4 mg ou 10 mg de metoclopramida apenas uma vez antes de dormir. Os pacientes continuaram as doses de medicação oral três vezes ao dia por 3 dias.
Radioterapia Fracionada Diária
Em um estudo duplo-cego com controle ativo em 135 pacientes que receberam um curso de 1 a 4 semanas de radioterapia fracionada (doses de 180 cGy) em um tamanho de campo maior ou igual a 100 cm² do abdome, ZOFRAN 4mg foi significativamente mais eficaz do que a proclorperazina no que diz respeito ao controle completo da emese (0 episódios eméticos). Os pacientes receberam a primeira dose de ZOFRAN (8 mg) ou proclorperazina (10 mg) 1 a 2 horas antes da primeira fração de radioterapia diária, com doses subsequentes de 8 mg aproximadamente a cada 8 horas em cada dia de radioterapia.
Náuseas e vômitos pós-operatórios
Em 2 estudos duplo-cegos, controlados por placebo (um realizado nos EUA e outro fora dos EUA) em 865 mulheres submetidas a procedimentos cirúrgicos hospitalares, ZOFRAN 16 mg em dose única ou placebo foi administrado uma hora antes da indução de tratamento geral balanceado. anestesia (barbitúricos, opióides, óxido nitroso, bloqueio neuromuscular e isoflurano ou enflurano suplementar), ZOFRAN comprimidos foi significativamente mais eficaz do que placebo na prevenção de náuseas e vômitos pós-operatórios.
Não foram realizados ensaios em machos.
INFORMAÇÃO DO PACIENTE
Prolongamento QT
Informe os pacientes que ZOFRAN pode causar arritmias cardíacas graves, como prolongamento do intervalo QT. Instrua os pacientes a informar imediatamente seu médico se perceberem uma mudança na frequência cardíaca, se sentirem tonturas ou se tiverem um episódio de síncope [ver AVISOS E PRECAUÇÕES ].
Reações de hipersensibilidade
Informe os pacientes que ZOFRAN 4mg pode causar reações de hipersensibilidade, algumas tão graves quanto anafilaxia e broncoespasmo. Instruir os pacientes a relatar imediatamente quaisquer sinais e sintomas de reações de hipersensibilidade, incluindo febre, calafrios, erupção cutânea ou problemas respiratórios ao seu médico [ver AVISOS E PRECAUÇÕES ].
Mascaramento de íleo progressivo e distensão gástrica
Informe os pacientes após cirurgia abdominal ou aqueles com náuseas e vômitos induzidos por quimioterapia que ZOFRAN 4mg pode mascarar sinais e sintomas de obstrução intestinal. Instrua os pacientes a relatar imediatamente quaisquer sinais ou sintomas consistentes com uma possível obstrução intestinal ao seu médico [ver AVISOS E PRECAUÇÕES ].
Interações medicamentosas
- Instruir o paciente a relatar o uso de todos os medicamentos, especialmente apomorfina, ao seu médico. O uso concomitante de apomorfina e ZOFRAN pode causar uma queda significativa na pressão arterial e perda de consciência.
- Avisar os pacientes sobre a possibilidade de síndrome serotoninérgica com o uso concomitante de ZOFRAN 8mg e outro agente serotoninérgico, como medicamentos para tratar depressão e enxaquecas. Aconselhe os pacientes a procurar atendimento médico imediato se ocorrerem os seguintes sintomas: alterações no estado mental, instabilidade autonômica, sintomas neuromusculares com ou sem sintomas gastrointestinais [ver AVISOS E PRECAUÇÕES ].
Administração de comprimidos de desintegração oral de ZOFRAN 4mg ODT
Instrua os pacientes a não remover os comprimidos de desintegração oral de ZOFRAN 4mg ODT do blister até pouco antes da administração.
- Não tente empurrar os comprimidos de desintegração oral de ZOFRAN 8mg ODT através do suporte de alumínio.
- Com as mãos secas, retire a película de 1 blister e retire cuidadosamente o comprimido.
- Coloque imediatamente o comprimido de desintegração oral de ZOFRAN ODT na parte superior da língua, onde se dissolverá em segundos, depois engula com saliva.
- A administração com líquido não é necessária.
- Adesivos ilustrados destacáveis são afixados na caixa do produto que pode ser fornecida com a receita para garantir o uso e manuseio adequados do produto.
