Zovirax 200mg, 400mg, 800mg Acyclovir Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Zovirax 800mg e como é usado?
Zovirax é um medicamento de prescrição usado para tratar os sintomas de herpes labial (Herpes labial) e Herpes Genital. Zovirax 800mg pode ser usado sozinho ou com outros medicamentos.
Zovirax 400mg pertence a uma classe de medicamentos chamados Antivirais, Tópicos.
Não se sabe se Zovirax 200mg é seguro e eficaz em crianças com menos de 12 anos de idade.
Quais são os possíveis efeitos colaterais do Zovirax 800mg?
Zovirax 200mg pode causar efeitos colaterais graves, incluindo:
- hematomas ou sangramentos fáceis,
- manchas roxas ou vermelhas sob a pele,
- pouca ou nenhuma micção,
- micção dolorosa ou difícil,
- inchaço nos pés ou tornozelos,
- sentindo-se cansado e
- falta de ar
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Zovirax incluem:
- náusea,
- vômito,
- diarréia,
- mal-estar geral,
- dor de cabeça, e
- dor na boca ao usar um comprimido bucal de aciclovir
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Zovirax. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
DESCRIÇÃO
RESUMO DE INFORMAÇÕES DO PRODUTO
Substância droga
Nome própio: aciclovir
Nome químico: 9-[(2-hidroxietoxi)metil]guanina
Outro nome: acicloguanosina
Fórmula molecular: C8H11N503
Massa molecular: 225.2 Fórmula estrutural:
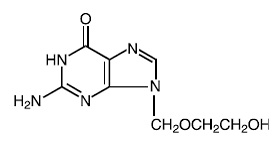
Propriedades físico-químicas: O aciclovir é um pó branco e cristalino com solubilidade máxima em água de 1,3 mg/mL a 25°C.
INDICAÇÕES
Indicações e uso clínico
ZOVIRAX® (aciclovir) é indicado para as seguintes condições:
- O tratamento de episódios iniciais de herpes genital.
- A supressão de recorrências incomumente frequentes de herpes genital (6 ou mais episódios por ano).
- O tratamento agudo de herpes zoster (zona) e varicela (varicela).
Os resultados dos estudos clínicos sugerem que alguns pacientes com herpes genital recorrente podem obter benefícios clínicos da administração oral de ZOVIRAX® se tomado ao primeiro sinal de um episódio iminente. Aqueles com maior probabilidade de se beneficiarem são os pacientes que apresentam recorrências graves e prolongadas; essa terapia intermitente pode ser mais apropriada do que a terapia supressiva quando essas recorrências são infrequentes.
O tratamento precoce do herpes zoster agudo (zona) em indivíduos imunocompetentes com ZOVIRAX® oral resultou na diminuição da disseminação viral; diminuição do tempo de cicatrização; menor divulgação; e alívio da dor aguda.
O tratamento da varicela (varicela) em pacientes imunocompetentes com ZOVIRAX® oral reduziu o número total de lesões, acelerou a progressão das lesões para os estágios crostoso e cicatrizado e diminuiu o número de lesões hipopigmentadas residuais. Além disso, ZOVIRAX® diminuiu a febre e os sintomas constitucionais associados à varicela.
uso profilático de aciclovir na varicela não foi estabelecido.
Geriatria (≥ 65 anos de idade): O uso na população geriátrica pode estar associado a diferenças na segurança devido a alterações na função renal relacionadas à idade e uma breve discussão pode ser encontrada nas seções apropriadas (consulte AVISOS E PRECAUÇÕES ).
Pediatria ( Não há dados disponíveis.
DOSAGEM E ADMINISTRAÇÃO
Considerações de dosagem
- A dosagem de ZOVIRAX® (aciclovir) deve ser reduzida em pacientes com insuficiência renal.
- A terapia deve ser iniciada o mais rápido possível após o diagnóstico de varicela ou herpes zoster, ou ao primeiro sinal ou sintomas de um surto de herpes genital.
- A dose recomendada e a duração do uso dependem da indicação.
Dose Recomendada e Ajuste de Dosagem
Tratamento da Infecção Inicial de Herpes Genital: 200 mg (um comprimido de 200 mg ou uma colher de chá de suspensão [5 mL]) a cada 4 horas, 5 vezes ao dia para um total de 1 g por dia durante 10 dias. A terapia deve ser iniciada o mais cedo possível após o início dos sinais e sintomas.
Terapia supressiva para herpes genital recorrente
A dose inicial recomendada é de 200 mg (um comprimido de 200 mg ou uma colher de chá de suspensão [5 mL]) três vezes ao dia. Isso pode ser aumentado se ocorrer ruptura até uma dose de um comprimido de 200 mg ou uma colher de chá [5 mL] de suspensão, cinco vezes ao dia. Se necessário, uma dose de 400 mg (dois comprimidos de 200 mg ou duas colheres de chá de suspensão [10 mL]) administrada duas vezes ao dia pode ser considerada. Recomenda-se a reavaliação periódica da necessidade de terapia.
administração de ZOVIRAX® para terapia intermitente é de 200 mg (um comprimido de 200 mg ou uma colher de chá [5 mL] de suspensão) a cada 4 horas, 5 vezes ao dia, por 5 dias. A terapia deve ser iniciada ao primeiro sinal ou sintoma (pródromo) de recorrência.
Tratamento do Herpes Zoster
800 mg de ZOVIRAX® oral, a cada 4 horas, 5 vezes ao dia por 7 a 10 dias. O tratamento deve ser iniciado em até 72 horas após o início das lesões. Em ensaios clínicos, o maior benefício ocorreu quando o tratamento foi iniciado dentro de 48 horas do início das lesões.
Tratamento da catapora
20 mg/kg (não exceder 800 mg) por via oral, 4 vezes ao dia por 5 dias. A terapia deve ser iniciada dentro de 24 horas após o aparecimento da erupção cutânea.
Pacientes com insuficiência renal aguda ou crônica
Recomenda-se cautela ao administrar aciclovir a pacientes com função renal comprometida. A hidratação adequada deve ser mantida.
Estudos farmacocinéticos abrangentes foram concluídos após infusões intravenosas de aciclovir em pacientes com insuficiência renal.
Com base nesses estudos, os ajustes de dosagem são recomendados na Tabela 5 para indicações de herpes genital e herpes zoster.
Hemodiálise
Para pacientes que necessitam de hemodiálise, a meia-vida plasmática média do aciclovir durante a hemodiálise é de aproximadamente 5 horas. Isso resulta em uma diminuição de 60% nas concentrações plasmáticas após um período de diálise de seis horas. Portanto, o esquema posológico do paciente deve ser ajustado para que uma dose adicional seja administrada após cada diálise.
Diálise Peritoneal
Nenhuma dose de suplemento parece ser necessária após o ajuste do intervalo de dosagem.
Dose Perdida
Se uma dose de ZOVIRAX® for esquecida, o paciente deve ser aconselhado a tomá-la assim que se lembrar, e então continuar com a próxima dose no intervalo de tempo adequado.
COMO FORNECIDO
Armazenamento e estabilidade
Os comprimidos de ZOVIRAX® devem ser armazenados em temperatura ambiente controlada (15 a 25°C) em local seco e protegido da luz.
ZOVIRAX® Suspension deve ser armazenado em temperatura ambiente controlada (15 a 25°C).
Formas de dosagem, composição e embalagem
Suspensão: Cada colher de chá (5 mL) de ZOVIRAX® Suspension contém 200 mg de aciclovir e os ingredientes não medicinais aroma de banana, celulose, glicerina, metilparabeno, propilparabeno, sorbitol, vanilina e água.
Cada comprimido de ZOVIRAX® 200 contém 200 mg de aciclovir e os ingredientes não medicinais celulose, indigotina, lactose, estearato de magnésio, povidona e amidoglicolato de sódio.
ZOVIRAX® Suspension está disponível em frascos de 125 mL* e 475 mL. Cada colher de chá (5 mL) de suspensão esbranquiçada com sabor de banana contém 200 mg de aciclovir.
*frasco de 125 mL não disponível no Canadá
ZOVIRAX® 200 comprimidos estão disponíveis em frascos de 100 comprimidos. Cada comprimido comprimido azul, em forma de escudo, com bordas biseladas, contém 200 mg de aciclovir e está impresso com “ZOVIRAX” em um lado e um triângulo no verso.
GlaxoSmithKline Inc., 7333 Mississauga Road, Mississauga, Ontário, L5N 6L4 1-800-387-7374. Revisado: 10 de novembro de 2014
EFEITOS COLATERAIS
Visão geral das reações adversas a medicamentos
As reações adversas mais frequentes associadas ao uso de ZOVIRAX® (aciclovir) são cefaleia e náusea.
Efeitos colaterais neurológicos também foram relatados em casos raros. Pacientes idosos e pacientes com histórico de insuficiência renal apresentam risco aumentado de desenvolver esses efeitos. Nos casos notificados, estas reações foram geralmente reversíveis com a descontinuação do tratamento (ver AVISOS E PRECAUÇÕES e REAÇÕES ADVERSAS , Reações Adversas a Medicamentos Pós-Comercialização ).
Reações Adversas a Medicamentos de Ensaios Clínicos
Como os ensaios clínicos são conduzidos em condições muito específicas, as taxas de reações adversas observadas nos ensaios clínicos podem não refletir as taxas observadas na prática e não devem ser comparadas às taxas nos ensaios clínicos de outro medicamento. As informações sobre reações adversas a medicamentos de ensaios clínicos são úteis para identificar eventos adversos relacionados a medicamentos e para aproximar as taxas.
Tratamento do Herpes Simplex
Administração de curto prazo (5-10 dias): As reações adversas mais frequentes relatadas durante os ensaios clínicos de tratamento do herpes genital com ZOVIRAX® oral em 298 pacientes estão listadas na Tabela 1.
Supressão do Herpes Simplex
Administração a longo prazo: Os eventos adversos mais frequentes relatados em um ensaio clínico para a prevenção de recorrências com administração contínua de 400 mg (duas cápsulas de 200 mg) 2 vezes ao dia estão listados na Tabela 2.
Evidências até agora de ensaios clínicos sugerem que é improvável que a gravidade e a frequência dos eventos adversos exijam a descontinuação da terapia.
Herpes Zoster
As reações adversas mais frequentes relatadas durante três ensaios clínicos de tratamento de herpes zoster (zona) com 800 mg de ZOVIRAX® oral 5 vezes ao dia por 7 ou 10 dias ou placebo estão listadas na Tabela 3.
Catapora
Os eventos adversos mais frequentes relatados durante três ensaios clínicos de tratamento da varicela com ZOVIRAX® oral ou placebo estão listados na Tabela 4.
Reações Adversas a Medicamentos em Ensaios Clínicos Menos Comuns (
Outras reações adversas relatadas em menos de 1% dos pacientes que receberam ZOVIRAX® em qualquer ensaio clínico incluíram: dor abdominal, anorexia, constipação, tontura, edema, fadiga, flatulência, adenopatia inguinal, insônia, dor nas pernas, gosto de medicação, erupção cutânea, dor garganta, movimentos espasmódicos das mãos e urticária.
Achados de química clínica e hematológica anormais
Não foram observadas alterações clinicamente significativas nos valores laboratoriais em ensaios clínicos para o tratamento de varicela e zoster, e para o tratamento e supressão de herpes genital com ZOVIRAX®.
Reações Adversas a Medicamentos Pós-Comercialização
Os seguintes eventos foram relatados voluntariamente durante o uso pós-comercialização de ZOVIRAX® na prática clínica. Esses eventos foram escolhidos para inclusão devido à sua gravidade, frequência de notificação, potencial conexão causal com ZOVIRAX® ou uma combinação desses fatores. Os eventos adversos pós-comercialização são relatados espontaneamente por uma população de tamanho desconhecido, portanto, não podem ser feitas estimativas de frequência.
Em geral: Febre, cefaleia, dor e edema periférico.
Nervoso: Tonturas, parestesia, agitação, confusão, tremor, ataxia, disartria, alucinações, sintomas psicóticos, convulsões, sonolência, encefalopatia e coma foram relatados. Esses eventos são geralmente reversíveis e geralmente relatados em pacientes com insuficiência renal ou com outros fatores predisponentes (ver AVISOS E PRECAUÇÕES ). Esses sintomas podem ser acentuados, particularmente em adultos mais velhos.
Digestivo: Diarréia, desconforto gastrointestinal e náuseas.
Hematológicas e Linfáticas: Anemia, leucopenia, linfadenopatia e trombocitopenia.
Hipersensibilidade e Pele: Alopecia, eritema multiforme, síndrome de Stevens-Johnson, necrólise epidérmica tóxica, erupções cutâneas incluindo fotossensibilidade, prurido, urticária, dispneia, angioedema e anafilaxia.
Trato Hepatobiliar e Pâncreas: Relatos de hiperbilirrubinemia reversível e enzimas hepáticas elevadas. Hepatite e icterícia.
Musculoesquelético: Mialgia.
Sentidos Especiais: Anormalidades visuais.
Urogenital: Creatinina sanguínea elevada e nitrogênio ureico no sangue (BUN). Insuficiência renal aguda, dor renal e hematúria foram relatadas. A dor renal pode estar associada à insuficiência renal (ver AVISOS E PRECAUÇÕES ).
INTERAÇÕES MEDICAMENTOSAS
Interações Medicamentosas
Não foram identificadas interações clinicamente significativas.
O aciclovir é eliminado principalmente inalterado na urina por meio da secreção tubular renal ativa. Quaisquer drogas administradas concomitantemente que compitam com este mecanismo podem aumentar as concentrações plasmáticas de aciclovir. A probenecida e a cimetidina aumentam a área sob a curva (AUC) do aciclovir por esse mecanismo e reduzem a depuração renal do aciclovir. Da mesma forma, aumentos nas AUCs plasmáticas do aciclovir e do metabólito inativo do micofenolato mofetil, um agente imunossupressor usado em pacientes transplantados, foram demonstrados quando os medicamentos são coadministrados. No entanto, nenhum ajuste de dose é necessário devido ao amplo índice terapêutico do aciclovir.
Interações medicamento-alimento
Não há interação conhecida com alimentos (ver Ação e Farmacologia Clínica , Farmacocinética ).
Interações Medicamentos-Ervas
As interações com produtos à base de plantas não foram estabelecidas.
Interações de testes de laboratório de drogas
Não foram estabelecidas interações com testes laboratoriais.
AVISOS
As cápsulas, comprimidos e suspensão de ZOVIRAX (aciclovir) destinam-se apenas à ingestão oral. Insuficiência renal, em alguns casos resultando em morte, foi observada com terapia com aciclovir (ver REAÇÕES ADVERSAS: Observadas durante a prática clínica e SUPERDOSAGEM ). Púrpura trombocitopênica trombótica/síndrome hemolítico-urêmica (TTP/SHU), que resultou em morte, ocorreu em pacientes imunocomprometidos recebendo terapia com aciclovir.
PRECAUÇÕES
Recomenda-se o ajuste da dose ao administrar ZOVIRAX (aciclovir) a pacientes com insuficiência renal (ver DOSAGEM E ADMINISTRAÇÃO ). Deve-se ter cuidado ao administrar ZOVIRAX (aciclovir) a pacientes recebendo agentes potencialmente nefrotóxicos, pois isso pode aumentar o risco de disfunção renal e/ou o risco de sintomas reversíveis do sistema nervoso central, como aqueles que foram relatados em pacientes tratados com aciclovir intravenoso. . A hidratação adequada deve ser mantida.
Herpes Zoster: Não existem dados sobre o tratamento iniciado mais de 72 horas após o início da erupção cutânea zoster. Os pacientes devem ser aconselhados a iniciar o tratamento o mais rápido possível após o diagnóstico de herpes zoster.
Infecções por Herpes Genital: Os pacientes devem ser informados de que ZOVIRAX (aciclovir) não é uma cura para o herpes genital. Não há dados avaliando se ZOVIRAX (aciclovir) prevenirá a transmissão da infecção para outras pessoas. Como o herpes genital é uma doença sexualmente transmissível, os pacientes devem evitar o contato com lesões ou relações sexuais quando lesões e/ou sintomas estiverem presentes para evitar a infecção dos parceiros. O herpes genital também pode ser transmitido na ausência de sintomas através da disseminação viral assintomática. Se o tratamento médico de uma recorrência de herpes genital for indicado, os pacientes devem ser aconselhados a iniciar a terapia ao primeiro sinal ou sintoma de um episódio.
Catapora: varicela em crianças saudáveis é geralmente uma doença autolimitada de gravidade leve a moderada. Adolescentes e adultos tendem a ter doença mais grave. O tratamento foi iniciado dentro de 24 horas após a erupção cutânea típica da varicela nos estudos controlados, e não há informações sobre os efeitos do tratamento iniciado mais tarde no curso da doença.
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Os dados apresentados abaixo incluem referências ao pico das concentrações plasmáticas de aciclovir no estado de equilíbrio observadas em humanos tratados com 800 mg administrados por via oral 5 vezes ao dia (dosagem apropriada para o tratamento de herpes zoster) ou 200 mg administrados por via oral 5 vezes ao dia (dosagem apropriada para o tratamento de herpes genital). As concentrações plasmáticas da droga em estudos com animais são expressas como múltiplos da exposição humana ao aciclovir nos esquemas de dosagem mais altos e mais baixos (ver FARMACOLOGIA CLÍNICA: Farmacocinética ).
aciclovir foi testado em bioensaios ao longo da vida em ratos e camundongos em doses únicas diárias de até 450 mg/kg administradas por gavagem. Não houve diferença estatisticamente significativa na incidência de tumores entre os animais tratados e controles, nem o aciclovir encurtou a latência dos tumores. As concentrações plasmáticas máximas foram 3 a 6 vezes os níveis humanos no bioensaio do rato e 1 a 2 vezes os níveis humanos no bioensaio do rato.
O aciclovir foi testado em 16 ensaios de toxicidade genética in vitro e in vivo. O aciclovir foi positivo em 5 dos ensaios.
aciclovir não prejudicou a fertilidade ou a reprodução em camundongos (450 mg/kg/dia, po) ou em ratos (25 mg/kg/dia, sc). No estudo com camundongos, os níveis plasmáticos foram de 9 a 18 vezes os níveis humanos, enquanto no estudo com ratos foram de 8 a 15 vezes os níveis humanos. Em doses mais altas (50 mg/kg/dia, sc) em ratos e coelhos (11 a 22 e 16 a 31 vezes os níveis humanos, respectivamente), a eficácia de implantação, mas não o tamanho da ninhada, foi diminuída. Em um estudo peri e pós-natal em ratos com 50 mg/kg/dia, sc, houve uma diminuição estatisticamente significativa no número médio de corpos lúteos do grupo, locais totais de implantação e fetos vivos.
Não foram observadas anormalidades testiculares em cães que receberam 50 mg/kg/dia, IV por 1 mês (21 a 41 vezes os níveis humanos) ou em cães que receberam 60 mg/kg/dia por via oral por 1 ano (6 a 12 vezes os níveis humanos). Atrofia testicular e aspermatogênese foram observadas em ratos e cães em doses mais altas.
Gravidez
Efeitos teratogênicos: Gravidez Categoria B. O acilovir administrado durante a organogênese não foi teratogênico no camundongo (450 mg/kg/dia, po), coelho (50 mg/kg/dia, sc e IV) ou rato (50 mg/kg/dia, sc). Essas exposições resultaram em níveis plasmáticos de 9 e 18, 16 e 106 e 11 e 22 vezes, respectivamente, os níveis humanos.
Não existem estudos adequados e bem controlados em mulheres grávidas. Um registro epidemiológico prospectivo do uso de aciclovir durante a gravidez foi estabelecido em 1984 e concluído em abril de 1999. Houve 749 gestações seguidas em mulheres expostas ao aciclovir sistêmico durante o primeiro trimestre de gravidez, resultando em 756 desfechos. A taxa de ocorrência de defeitos congênitos se aproxima daquela encontrada na população geral. No entanto, o pequeno tamanho do registro é insuficiente para avaliar o risco de defeitos menos comuns ou para permitir conclusões confiáveis ou definitivas sobre a segurança do aciclovir em mulheres grávidas e seus fetos em desenvolvimento. O aciclovir deve ser usado durante a gravidez apenas se o benefício potencial justificar o risco potencial para o feto.
Mães que amamentam
As concentrações de aciclovir foram documentadas no leite materno em 2 mulheres após administração oral de ZOVIRAX (aciclovir) e variaram de 0,6 a 4,1 vezes os níveis plasmáticos correspondentes. Essas concentrações potencialmente exporiam o lactente a uma dose de aciclovir de até 0,3 mg/kg/dia. ZOVIRAX (aciclovir) deve ser administrado a lactantes com cautela e somente quando indicado.
Uso Pediátrico
A segurança e a eficácia das formulações orais de aciclovir em pacientes pediátricos com menos de 2 anos de idade não foram estabelecidas.
Uso Geriátrico
Dos 376 indivíduos que receberam ZOVIRAX (aciclovir) em um estudo clínico de tratamento de herpes zoster em indivíduos imunocompetentes com 50 anos de idade, 244 tinham 65 anos ou mais, enquanto 111 tinham 75 anos ou mais. Não foram relatadas diferenças gerais na eficácia do tempo até a cessação da formação de novas lesões ou do tempo até a cicatrização entre indivíduos geriátricos e indivíduos adultos mais jovens. A duração da dor após a cicatrização foi maior em pacientes com 65 anos ou mais. Náuseas, vômitos e tontura foram relatados com mais frequência em idosos. Pacientes idosos são mais propensos a ter função renal reduzida e requerem redução de dose. Pacientes idosos também são mais propensos a ter eventos adversos renais ou do SNC. Com relação aos eventos adversos do SNC observados durante a prática clínica, sonolência, alucinações, confusão e coma foram relatados com mais frequência em pacientes idosos (ver FARMACOLOGIA CLÍNICA, REAÇÕES ADVERSAS: Observadas durante a prática clínica, e DOSAGEM E ADMINISTRAÇÃO ).
SOBREDOSAGEM
Para o gerenciamento de uma suspeita de overdose de drogas, entre em contato com o Centro Regional de Controle de Intoxicações.
Carvão ativado pode ser administrado para auxiliar na remoção do fármaco não absorvido. Recomendam-se medidas gerais de suporte.
O aciclovir é apenas parcialmente absorvido no trato gastrointestinal. Os pacientes ingeriram até 20 g de aciclovir em uma única ocasião, sem efeitos adversos inesperados. Em estudos clínicos, a concentração plasmática mais alta observada em um único paciente nessas doses foi de 10,0 μg/mL. Superdosagens acidentais e repetidas de aciclovir oral durante vários dias foram associadas a efeitos gastrointestinais (como náuseas e vômitos) e neurológicos (dor de cabeça e confusão).
As doses intravenosas administradas a humanos foram tão altas quanto 1.200 mg/m² (28 mg/kg) 3 vezes ao dia por até 2 semanas. As concentrações plasmáticas máximas atingiram 80 μg/mL. A superdosagem de aciclovir intravenoso resultou em elevações da creatinina sérica, nitrogênio ureico no sangue e subsequente insuficiência renal. Efeitos neurológicos incluindo confusão, alucinações, agitação, convulsões e coma foram descritos em associação com superdosagem intravenosa.
Os pacientes devem ser observados atentamente quanto a sinais de toxicidade. A hemodiálise aumenta significativamente a remoção do aciclovir do sangue e pode, portanto, ser considerada uma opção de tratamento em caso de sobredosagem sintomática. A precipitação de aciclovir nos túbulos renais pode ocorrer se a solubilidade (2,5 mg/mL) no líquido intratubular for excedida. Em caso de insuficiência renal e anúria, o paciente pode se beneficiar da hemodiálise até que a função renal seja restaurada (ver DOSAGEM E ADMINISTRAÇÃO ).
CONTRA-INDICAÇÕES
ZOVIRAX® (aciclovir) é contraindicado para pacientes que desenvolvem hipersensibilidade ou que são hipersensíveis ao aciclovir, valaciclovir ou a qualquer outro componente das formulações de ZOVIRAX®. Para uma listagem completa, consulte Formas de dosagem , Composição e Embalagem seção da monografia do produto .
FARMACOLOGIA CLÍNICA
Ação e Farmacologia Clínica
Mecanismo de ação
ZOVIRAX® (aciclovir), um análogo sintético de nucleosídeo de purina acíclica, é um substrato com alto grau de especificidade para a timidina quinase especificada para herpes simples e varicela-zoster. O aciclovir é um substrato pobre para a timidina quinase específica da célula hospedeira. A timidina quinase especificada por herpes simples e varicela-zoster transforma o aciclovir em seu monofosfato, que é então transformado por várias enzimas celulares em difosfato de aciclovir e trifosfato de aciclovir. O trifosfato de aciclovir é um inibidor e um substrato para a DNA polimerase específica do herpesvírus. Embora a α-DNA polimerase celular em células infectadas também possa ser inibida pelo aciclovir trifosfato, isso ocorre apenas em concentrações de aciclovir trifosfato que são mais altas do que aquelas que inibem a DNA polimerase especificada pelo herpesvírus. O aciclovir é convertido seletivamente em sua forma ativa em células infectadas com herpesvírus e, portanto, é preferencialmente absorvido por essas células. O aciclovir demonstrou um potencial tóxico muito menor in vitro para células normais não infectadas porque: 1) menos é absorvido; 2) less é convertido para a forma ativa; e 3) a α-DNA polimerase celular apresenta menor sensibilidade à ação da forma ativa do fármaco. Uma combinação da especificidade da timidina quinase, inibição da DNA polimerase e terminação prematura da síntese de DNA resulta na inibição da replicação do vírus do herpes. Nenhum efeito sobre o vírus latente não replicante foi demonstrado. A inibição do vírus reduz o período de excreção viral, limita o grau de disseminação e o nível de patologia e, assim, facilita a cura. Durante a supressão não há evidência de que o aciclovir impeça a migração neural do vírus. Aborta episódios de herpes recorrente devido à inibição da replicação viral após a reativação.
Farmacocinética
farmacocinética do aciclovir após administração oral foi avaliada em 6 estudos clínicos envolvendo 110 pacientes adultos.
Absorção
Em um estudo de 35 pacientes imunocomprometidos com infecção por herpes simples ou varicela-zoster que receberam ZOVIRAX® Capsules em doses de 200 a 1.000 mg a cada 4 horas, 6 vezes ao dia por 5 dias, a biodisponibilidade foi estimada em 15 a 20%. Neste estudo, os níveis plasmáticos em estado de equilíbrio foram atingidos no segundo dia de administração. As concentrações médias de pico e vale no estado de equilíbrio após a última dose de 200 mg foram 0,49 μg/mL (0,47 a 0,54 μg/mL) e 0,31 μg/mL (0,18 a 0,41 μg/mL), respectivamente e após a última dose de 800 mg foram 2,8 μg/mL (2,3 a 3,1 μg/mL) e 1,8 μg/mL (1,3 a 2,5 μg/mL). Em outro estudo, 20 pacientes imunocompetentes com infecções recorrentes de herpes simples genital que receberam ZOVIRAX® Cápsulas na dose de 800 mg a cada 6 horas, 4 vezes ao dia por 5 dias, as concentrações médias de pico e vale no estado de equilíbrio foram de 1,4 μg/mL (0,66 a 1,8 μg/mL) e 0,55 μg/mL (0,14 a 1,1 μg/mL).
Em um estudo cruzado de doses múltiplas em que 23 voluntários receberam ZOVIRAX® como uma cápsula de 200 mg, um comprimido de 400 mg e um comprimido de 800 mg 6 vezes ao dia, a absorção diminuiu com o aumento da dose e as biodisponibilidades estimadas do aciclovir foram de 20, 15 e 10%. , respectivamente. Acredita-se que a diminuição da biodisponibilidade seja uma função da dose e não da forma de dosagem. Foi demonstrado que o aciclovir não é proporcional à dose na faixa de dosagem de 200 a 800 mg. Neste estudo, as concentrações de pico e vale no estado de equilíbrio de aciclovir foram 0,83 e 0,46 μg/mL, 1,21 e 0,63 μg/mL e 1,61 e 0,83 μg/mL para os regimes de dosagem de 200, 400 e 800 mg, respectivamente.
Em outro estudo em 6 voluntários, a influência dos alimentos na absorção do aciclovir não foi aparente.
Um estudo de biodisponibilidade de dose oral única em 23 voluntários normais mostrou que ZOVIRAX® Cápsulas 200 mg são bioequivalentes a 200 mg de aciclovir em solução aquosa. Em um estudo separado em 20 voluntários, foi demonstrado que ZOVIRAX® Suspension é bioequivalente a ZOVIRAX® Capsules. Em outro estudo de biodisponibilidade/bioequivalência de dose única em 24 voluntários, um comprimido de ZOVIRAX® 800 mg demonstrou ser bioequivalente a quatro cápsulas de ZOVIRAX® 200 mg.
Distribuição
A ligação às proteínas plasmáticas é relativamente baixa (9 a 33%) e não se prevêem interações medicamentosas envolvendo deslocamento do sítio de ligação.
Eliminação
Após administração oral, a meia-vida plasmática média do aciclovir em voluntários e pacientes com função renal normal variou de 2,5 a 3,3 horas. A excreção renal média do fármaco inalterado representa 14,4% (8,6 a 19,8%) da dose administrada por via oral. O único metabólito urinário (identificado por cromatografia líquida de alta eficiência) é a 9-[(carboximetoxi)metil]guanina.
Populações e condições especiais
Pediatria
Em geral, a farmacocinética do aciclovir em crianças é semelhante à dos adultos. A meia-vida média após doses orais de 300 e 600 mg/m², em crianças de 7 meses a 7 anos, foi de 2,6 horas (intervalo de 1,59 a 3,74 horas).
O aciclovir administrado por via oral em crianças com menos de 2 anos de idade ainda não foi totalmente estudado.
Geriatria
Nos idosos, a depuração total do corpo diminui com o aumento da idade, associada à diminuição da depuração da creatinina, embora haja pouca alteração na meia-vida plasmática terminal. A redução da dose pode ser necessária em pacientes geriátricos com função renal reduzida (ver DOSAGEM E ADMINISTRAÇÃO ).
Insuficiência renal
A meia-vida e a depuração corporal total do aciclovir dependem da função renal.
Um ajuste de dose é recomendado para pacientes com função renal reduzida (ver DOSAGEM E ADMINISTRAÇÃO ).
Testes clínicos
Herpes Genital Inicial
Estudos duplo-cegos, controlados por placebo, demonstraram que ZOVIRAX® administrado por via oral reduziu significativamente a duração da infecção aguda e a duração da cicatrização da lesão. A duração da dor e a formação de novas lesões foram diminuídas em alguns grupos de pacientes.
Herpes Genital Recorrente
Em um estudo de pacientes que receberam ZOVIRAX® 400 mg duas vezes ao dia por 3 anos, 45, 52 e 63% dos pacientes permaneceram livres de recorrências no primeiro, segundo e terceiro anos, respectivamente. Análises seriadas das taxas de recorrência de 3 meses para os pacientes mostraram que 71 a 87% estavam livres de recorrência em cada trimestre.
Infecções por Herpes Zoster
Em um estudo duplo-cego, controlado por placebo, de pacientes imunocompetentes com infecção cutânea localizada por zoster, ZOVIRAX® (800 mg 5 vezes ao dia por 10 dias) encurtou os tempos de cicatrização da lesão, cicatrização e cessação completa da dor, e reduziu a duração da infecção viral. descamação e a duração da formação de novas lesões.
Em um estudo similar, duplo-cego, controlado por placebo, ZOVIRAX® (800 mg 5 vezes ao dia por 7 dias) encurtou os tempos para completar a formação de crostas, cicatrização e cessação da dor e reduziu a duração da formação de novas lesões.
O tratamento foi iniciado dentro de 72 horas do início do exantema e foi mais eficaz se iniciado nas primeiras 48 horas. Adultos com mais de 50 anos de idade apresentaram maior benefício.
Catapora
Três estudos randomizados, duplo-cegos e controlados por placebo foram conduzidos em 993 pacientes pediátricos com idades entre 2 e 18 anos com varicela. Todos os pacientes foram tratados dentro de 24 horas após o início do exantema. Em dois ensaios, ZOVIRAX® foi administrado a 20 mg/kg quatro vezes ao dia (até 3.200 mg por dia) por 5 dias. No terceiro ensaio, doses de 10, 15 ou 20 mg/kg foram administradas quatro vezes ao dia por 5 a 7 dias. O tratamento com ZOVIRAX® reduziu o tempo de cicatrização para 50%, reduziu o número máximo de lesões, reduziu o número médio de vesículas, diminuiu o número médio de lesões residuais no dia 28 e diminuiu a proporção de pacientes com febre, anorexia e letargia no dia 2. O tratamento com ZOVIRAX® não afetou as respostas imunes humorais ou celulares específicas do vírus da varicela zoster em 1 mês ou 1 ano após o tratamento.
Farmacologia Detalhada
Ver Ação e Farmacologia Clínica.
Virologia
relação quantitativa entre a suscetibilidade in vitro do vírus herpes simplex (HSV) e vírus varicela-zoster (VZV) ao aciclovir e a resposta clínica à terapia não foi estabelecida no homem, e os testes de sensibilidade do vírus não foram padronizados. Os resultados dos testes de sensibilidade, expressos como a concentração de droga necessária para inibir em 50% o crescimento do vírus em cultura de células (ID50), variam muito dependendo do ensaio específico usado, do tipo de célula empregado e do laboratório que realiza o teste. A ID50 do aciclovir contra isolados de HSV-1 pode variar de 0,02 μg/mL (redução de placa em células Vero) a 5,9-13,5 μg/mL (redução de placa em células de rim de macaco verde [GMK]). O ID50 contra HSV-2 varia de 0,01 a 9,9 μg/mL (redução de placa em células Vero e GMK, respectivamente).
Usando um método de captação de corante em células Vero, que fornece valores de ID50 aproximadamente 5 a 10 vezes maiores do que os ensaios de redução de placa, 1.417 isolados de HSV (553 HSV-1 e 864 HSV-2) de aproximadamente 500 pacientes foram examinados ao longo de 5- período de ano. Esses ensaios descobriram que 90% dos isolados de HSV-1 eram sensíveis a ≤ 0,9 μg/mL de aciclovir e 50% de todos os isolados eram sensíveis a ≤ 0,2 μg/mL de aciclovir. Para isolados de HSV-2, 90% foram sensíveis a ≤ 2,2 μg/mL e 50% de todos os isolados foram sensíveis a ≤ 0,7 μg/mL de aciclovir. Isolados com sensibilidade significativamente diminuída foram encontrados em 44 pacientes. Ressalta-se que nem os pacientes nem os isolados foram selecionados aleatoriamente e, portanto, não representam a população geral. A maioria dos isolados clínicos de HSV menos sensíveis têm sido relativamente deficientes na timidina quinase viral (TK). Também foram relatadas cepas com alterações na TK viral ou na DNA polimerase viral.
ID50 contra o VZV varia de 0,17-1,53 μg/mL (redução de rendimento, fibroblastos de prepúcio humano) a 1,85-3,98 μg/mL (redução de focos, fibroblastos de embrião humano [HEF]). A reprodução do genoma do EBV é suprimida em 50% em células Raji superinfectadas ou células linfoblastóides P3HR-1 por 1,5 μg/mL de aciclovir. O citomegalovírus (CMV) é relativamente resistente ao aciclovir com valores de ID50 variando de 2,3-17,6 μg/mL (redução de placa, células HEF) a 1,82-56,8 μg/mL (hibridização de DNA, células HEF). O estado latente do genoma de qualquer um dos herpesvírus humanos não é conhecido por ser sensível ao aciclovir.
Resistência
exposição prolongada do HSV a concentrações subinibitórias (0,1 μg/mL) de aciclovir em cultura de células resultou no surgimento de uma variedade de cepas resistentes ao aciclovir. Acredita-se que o surgimento de cepas resistentes ocorra por “seleção” de vírus de ocorrência natural com suscetibilidade relativamente baixa ao aciclovir. Tais cepas foram relatadas em isolados pré-terapia de vários estudos clínicos.
Dois mecanismos de resistência envolvendo a timidina quinase viral (necessária para a ativação do aciclovir) foram descritos. Estes são: (a) seleção de mutantes com deficiência de timidina-quinase que induzem pouca ou nenhuma atividade enzimática após a infecção, e (b) seleção de mutantes possuindo uma timidina-quinase de especificidade de substrato alterada que é capaz de fosforilar o nucleosídeo natural timidina, mas não aciclovir. A maioria dos vírus menos suscetíveis que surgem in vitro são do tipo de deficiência de timidina-quinase, que têm infecciosidade e patogenicidade reduzidas e menor probabilidade de induzir latência em animais.
No entanto, uma infecção por HSV resistente ao aciclovir em um receptor de transplante de medula óssea imunossuprimido em terapia prolongada com aciclovir foi devido a um isolado clínico que tinha uma timidina quinase normal, mas uma DNA polimerase alterada. Este terceiro mecanismo de resistência envolvendo a DNA polimerase do vírus herpes simplex é devido à seleção de mutantes que codificam uma enzima alterada, que é resistente à inativação pelo trifosfato de aciclovir.
O VZV parece manifestar resistência ao aciclovir através de mecanismos semelhantes aos observados no HSV.
No entanto, a investigação clínica limitada não revelou nenhuma evidência de uma mudança significativa na suscetibilidade in vitro do VZV com a terapia com aciclovir, embora mutantes resistentes desse vírus possam ser isolados in vitro de maneira análoga ao HSV. A análise de um pequeno número de isolados clínicos de pacientes que receberam aciclovir oral ou placebo para herpes zoster agudo sugere que o surgimento in vivo de VZV resistente pode ocorrer com pouca frequência. O tratamento prolongado com aciclovir de pacientes altamente imunocomprometidos com síndrome da imunodeficiência adquirida e VZV grave pode levar ao aparecimento de vírus resistentes.
resistência cruzada a outros antivirais ocorre in vitro em mutantes resistentes ao aciclovir. Os mutantes do HSV que são resistentes ao aciclovir devido à ausência de timidina quinase viral são resistentes a outros agentes que são fosforilados pela timidina quinase do herpesvírus, como bromovinildesoxiuridina, ganciclovir e os nucleosídeos 2'-fluoropirimidina, como 2'-fluoro -5-iodoarabinosil-citosina (FIAC).
resposta clínica ao tratamento com aciclovir geralmente tem sido boa para pacientes com imunidade normal dos quais o HSV com suscetibilidade reduzida ao aciclovir foi recuperado, antes, durante ou após a terapia. No entanto, certos grupos de pacientes, como os gravemente imunocomprometidos (especialmente os receptores de transplante de medula óssea) e aqueles submetidos a regimes supressivos crônicos, foram identificados como mais frequentemente associados ao surgimento de cepas de herpes simples resistentes, que podem ou não acompanhar uma resposta ruim à droga. A possibilidade do aparecimento de vírus menos sensíveis deve ser reconhecida no tratamento desses pacientes, e o monitoramento da suscetibilidade de isolados clínicos desses pacientes deve ser incentivado.
Em resumo, a relação quantitativa entre a suscetibilidade in vitro do HSV e VZV ao aciclovir e a resposta clínica à terapia não foi claramente estabelecida no homem. São necessários métodos padronizados de teste de sensibilidade do vírus para permitir correlações mais precisas entre a sensibilidade do vírus in vitro e a resposta clínica à terapia com aciclovir.
Toxicologia
Estudos de Toxicidade Aguda
Ratos e Ratos Adultos : A toxicidade aguda do aciclovir oral foi determinada conforme mostrado na Tabela 6.
Ratos Neonatais, Imaturos e Adultos
Grupos de 10 ratos machos e 10 fêmeas Charles River CD (Sprague-Dawley) receberam grandes doses únicas (5 níveis de dose diferentes) de uma solução (pH 11,0) de aciclovir por injeção subcutânea quando tinham 3, 10, 28 e 71 dias de idade. Eles foram observados por 14 dias após o tratamento e os valores de LD50 foram calculados pelo método de Litchfield e Wilcoxon (ver Tabela 7 abaixo). Este estudo foi feito para determinar se a idade de exposição afeta a toxicidade aguda do aciclovir; não houve evidência de que ratos jovens fossem mais sensíveis do que ratos mais velhos aos efeitos tóxicos agudos do aciclovir.
Não houve relação aparente entre o tempo de sobrevida após o tratamento e a idade em que o tratamento foi administrado. Os sinais clínicos para os ratos tratados aos 3 e 10 dias de idade incluíram bolhas cutâneas vermelhas e roxas, áreas azuis, crostas, cicatrizes, pele necrótica e descamada, feridas abertas, tremores corporais e alopecia. Diminuição da atividade, lacrimejo, pálpebras fechadas, material vermelho-acastanhado ou marrom ao redor dos olhos, nariz e boca, ataxia, prostração, tremores corporais, manchas de urina ao redor do abdômen ou área genital, áreas com crostas ou necróticas e alopecia foram observadas em ratos tratados em 28 e 71 dias de idade.
Estudo de toxicidade oral subcrônica
Ratos
Quatro grupos consistindo cada um de 28 camundongos Charles River CD-1 (ICR) machos e 28 fêmeas foram dosados oralmente por tubo estomacal por 33 dias com suspensões de aciclovir. Os níveis de dose diária foram 0, 50, 150 e 450 mg/kg. As medições de hematologia e química clínica foram feitas em 8 camundongos machos e 8 fêmeas adicionais por grupo (dosados da mesma maneira) após a primeira e quarta semanas de dosagem e durante a 3ª semana pós-dose.
As concentrações de droga no plasma foram medidas em amostras agrupadas de 4 camundongos machos e 4 camundongos fêmeas adicionais por grupo nos dias de dose 1, 15 e 30.
Com base em experimentos preliminares com ratos e camundongos, a alta dose de 450 mg/kg foi selecionada para produzir os maiores níveis plasmáticos de droga atingíveis, de maneira prática, por dosagem oral em uma espécie de roedor. As concentrações plasmáticas médias do fármaco variaram de aproximadamente 3,4 (na dose baixa) a 11,0 (na dose alta) μg/mL de plasma uma hora após a administração oral.
Não ocorreram alterações nas medidas de saúde, taxa de crescimento, hematologia e química clínica que pudessem ser definitivamente atribuídas à dosagem com aciclovir. Exames macroscópicos e histopatológicos de 16 ratos machos e 16 ratos fêmeas dos grupos de alta dose e controle no final do período de dose não revelaram nada notável.
Estudos de toxicidade crônica
Estudo de toxicidade oral ao longo da vida em ratos que receberam aciclovir por intubação gástrica
Ratos Charles River CD (Sprague-Dawley) receberam suspensões de aciclovir por gavagem. Havia 50 ratos machos e 50 fêmeas em cada um dos seguintes níveis de dose: 0, 50, 150 e 450 mg/kg. Após 30 e 52 semanas de tratamento, 10 ratos machos e 10 fêmeas de cada grupo foram necropsiados. Os ratos restantes foram doseados todos os dias até que a mortalidade natural diminuísse o tamanho do grupo para aproximadamente 20% do número de animais desse sexo presentes nos grupos de teste quando o estudo foi iniciado. Todos os ratos restantes foram mortos e necropsiados quando o ponto de corte de 20% foi atingido. Isto foi durante a semana 110 para os ratos machos e a semana 122 para os ratos fêmeas. Tecidos de ratos controle e aqueles do grupo de alta dose foram avaliados por microscopia de luz. Tecidos de ratos nos grupos de baixa e média dose com massas, nódulos ou lesões incomuns também foram examinados por microscopia de luz. Tecidos fixos de ratos encontrados mortos durante as primeiras 52 semanas do estudo também foram avaliados por microscopia de luz.
Não foram observados sinais de toxicose. As amostras de plasma foram coletadas 1,5 horas após a dosagem nos dias 7, 90, 209, 369, 771 (apenas homens) e 852 (apenas mulheres). Os níveis plasmáticos médios encontrados em homens com altas doses (450 mg/kg/dia) nos tempos indicados acima foram os seguintes: 1,54, 1,63, 1,39, 1,60 e 1,70 μg/mL (6,84, 7,26, 6,17, 7,10 e 7,56 μM) . Os níveis plasmáticos médios correspondentes para as fêmeas de alta dose para os períodos de tempo correspondentes foram 1,76, 2,38, 2,12, 1,71 e 1,81 μg/mL (7,82, 10,58, 9,44, 7,62 e 8,03 μM). Os níveis plasmáticos em homens e mulheres em todos os níveis de dose após um ano de tratamento foram geralmente comparáveis aos níveis plasmáticos obtidos em amostragens anteriores. Os valores dos exames laboratoriais, incluindo hematologia, química clínica e oftalmoscopia, estavam todos dentro da faixa normal. Não houve lesões macroscópicas ou microscópicas induzidas por drogas e não houve evidência de que o aciclovir tenha afetado a sobrevida.
Estudo de carcinogenicidade oral ao longo da vida em ratos
Não houve sinais de toxicose em ratos Charles River CD (Sprague-Dawley) (100 ratos/sexo/grupo de dose) que receberam aciclovir por gavagem oral a 50, 150 e 450 mg/kg em um estudo de carcinogenicidade oral ao longo da vida. Os níveis plasmáticos médios obtidos em machos de alta dose 1,5 horas após a dosagem em vários momentos de amostragem durante o estudo foram os seguintes: 1,54, 1,63, 1,39, 1,60 e 1,70 μg/mL (6,84, 7,26, 6,17, 7,10 e 7,56 μM) em dias 7, 90, 209, 369 e 771, respectivamente. Os valores médios correspondentes para as fêmeas de alta dose foram 1,76, 2,38, 2,12, 1,71 e 1,81 μg/mL (7,82, 10,58, 9,44, 7,62 e 8,03 μM) nos dias 7, 90, 209, 369 e 852, respectivamente.
Os valores dos exames laboratoriais clínicos, incluindo hematologia, química clínica, urinálise, peso corporal, consumo alimentar e oftalmoscopia, estavam todos dentro da normalidade. Não houve lesões macroscópicas ou microscópicas induzidas por drogas e não houve evidência de que o aciclovir tenha afetado a sobrevida, os padrões temporais de incidência do tumor ou a contagem de tumores para neoplasias benignas ou malignas.
A maioria dos relativamente poucos ratos encontrados mortos ou moribundos durante as primeiras 52 semanas deste estudo sofreu acidentes de dosagem como evidenciado por achados post-mortem de perfuração esofágica causando derrame pleural, pneumonia ou mediastinite.
Estudo de carcinogenicidade oral ao longo da vida em camundongos
Não houve sinais de toxicose em camundongos Charles River CD-1 (ICR) (115 camundongos/sexo/grupo de dose) que receberam aciclovir por gavagem oral a 50, 150 e 450 mg/kg/dia em um estudo de carcinogenicidade oral vitalício. Os níveis plasmáticos médios obtidos em machos de alta dose 1,5 horas após a dosagem em vários momentos de amostragem durante o estudo foram os seguintes: 2,83, 3,17 e 1,82 μg/mL (12,59, 14,10 e 8,10 μM) nos dias 90, 365 e 541, respectivamente. Os valores médios correspondentes para as fêmeas de alta dose foram 9,81, 5,85 e 4,0 μg/mL (43,60, 26,0 e 17,79 μM).
Os valores dos exames laboratoriais clínicos, incluindo hematologia, peso corporal e consumo alimentar, estavam todos dentro da normalidade. Não houve lesões macroscópicas ou microscópicas induzidas por drogas. Camundongos fêmeas que receberam 150 e 450 mg/kg de aciclovir sobreviveram significativamente mais do que camundongos fêmeas controle; a sobrevivência dos machos tratados foi comparável à sobrevivência dos machos de controlo. Os padrões de incidência de tumores e contagens de tumores para neoplasias benignas ou malignas não foram afetados pelo tratamento com aciclovir.
Estudo de toxicidade oral crônica de 12 meses em cães
Cães de raça pura Beagle receberam 0, 15, 45 ou 150 mg/kg/dia de aciclovir todos os dias durante as primeiras duas semanas de um estudo de um ano. Havia 9 cães machos e 9 fêmeas em cada grupo de teste. Os cães receberam cápsulas de gelatina que continham a dose apropriada. Eles foram tratados três vezes, portanto, as dosagens administradas em cada um dos três períodos de dose igualmente espaçados foram 0, 5, 15 e 50 mg/kg. Os níveis de dose de 45 e 150 mg/kg induziram diarreia, vômitos, diminuição do consumo de alimentos e perda de peso em cães machos e fêmeas durante as primeiras duas semanas do estudo. Por esta razão, durante a terceira semana do estudo foi tomada a decisão de diminuir os níveis de dosagem média e alta para 30 e 60 mg/kg/dia (10 e 20 mg/kg tid). A dose baixa de 15 mg/kg/dia (5 mg/kg tid) permaneceu inalterada. Os cães que receberam 60 mg/kg/dia ocasionalmente vomitaram e ocasionalmente tiveram diarréia, mas se saíram bem durante o teste, e os valores de ganho de peso corporal e consumo de alimentos foram comparáveis aos valores de controle.
Durante a toxicose induzida pelas doses maiores de aciclovir, os níveis plasmáticos do medicamento provavelmente foram muito altos (como indicado pelos valores médios iniciais de 24,0 μg/mL (106,6 μM) para homens com altas doses e 17,4 μg/mL (77,2 μM) para fêmeas de alta dose quando determinado 1 hora após a terceira dose no dia 1 do estudo). Quando medidos no dia 15, os níveis plasmáticos de aciclovir em cães com altas doses (150 mg/kg/dia) ainda eram muito altos, mas diminuíram mais tarde quando as dosagens foram reduzidas. Os valores dos níveis plasmáticos após 12 meses de tratamento foram geralmente comparáveis aos valores registrados após 1, 3 e 6 meses de tratamento. Assim, não houve indicação de aumento do metabolismo do aciclovir como resultado do tratamento crônico.
Durante a 13ª semana, alguns cães machos e fêmeas nos níveis de dosagem média e alta apresentaram os seguintes sinais: sensibilidade nas patas dianteiras, erosão das patas e quebra e afrouxamento das unhas. A regeneração das unhas perdidas começou algumas semanas depois. As unhas regeneradas por 6 meses (quando 3 machos e 3 fêmeas de cada grupo foram mortos para um sacrifício provisório) e até o final do estudo eram geralmente de boa qualidade. Nunca houve quaisquer sinais de efeito nas patas ou unhas dos cães no grupo de dose baixa (15 mg/kg/dia).
Aceita-se que a lesão do epitélio corial que produz a queratina da unha pode resultar na interrupção da produção de queratina e na produção de queratina anormal. A toxicose transitória induzida pelas grandes doses (45 e 150 mg/kg/dia) de aciclovir administrada durante as duas primeiras semanas do estudo pode ter afetado o epitélio corial. Se houvesse um efeito transitório no epitélio corial (possivelmente relacionado a efeitos diretos ou secundários à doença induzida por drogas durante as primeiras duas semanas do estudo), a perda posterior da unha poderia ser uma sequela. Não foram observados efeitos discerníveis sobre outros tecidos produtores de queratina ou contendo queratina. Deve-se enfatizar que as alterações nas unhas parecem estar relacionadas à toxicose transitória induzida pelos níveis de dose de 50 e 150 mg/kg/dia testados durante as duas primeiras semanas do estudo e não às doses de 30 e 60 mg/kg /dia níveis de dose testados posteriormente.
Não houve alterações importantes induzidas por drogas nos valores de exames bioquímicos séricos, urinálise e exames eletrocardiográficos realizados em intervalos apropriados durante este estudo. Os valores de albumina sérica e proteína total foram ligeiramente diminuídos em cães tratados com 30 e 60 mg/kg/dia por 6 e 12 meses. No entanto, todos os valores desses parâmetros permaneceram dentro dos limites aceitos como normais.
Com exceção de alterações residuais na queratina antiga nas pontas das unhas, não houve sinais de efeitos relacionados ao tratamento em nenhum dos tecidos examinados por microscopia de luz. Tampouco houve alterações significativas nos valores dos órgãos pesados na necropsia. Assim, níveis de dose de até 60 mg/kg/dia foram bem tolerados por um ano. O nível de dose “sem efeito de dose” de aciclovir foi de 15 mg/kg/dia (5 mg/kg tid); no entanto, os únicos efeitos adversos com 30 ou 60 mg/kg/dia foram alterações nas unhas e almofadas plantares (30 e 60 mg/kg/dia) e sinais gastrointestinais leves (60 mg/kg/dia).
Estudos de reprodução
Teratologia – Ratos
Aciclovir foi administrado a ratas prenhas ARS Sprague-Dawley por injeção subcutânea durante o período de organogênese (dia 6 ao dia 15 de gestação) em níveis de dose de 0,0, 6,0, 12,5 e 25,0 mg/kg de peso corporal duas vezes ao dia.
Os critérios avaliados para efeito composto incluíram pesos corporais maternos, ganhos de peso, aparência e comportamento, taxas de sobrevivência, alterações oculares, taxas de gravidez e dados de reprodução. A viabilidade e o desenvolvimento da prole também foram avaliados.
Além das medições acima, os animais designados foram sacrificados 1 hora após a primeira dose no dia 15 para coletar amostras de sangue materno, líquido amniótico e fetos para medições da concentração do fármaco. Os valores médios dessas amostras estão listados na Tabela 8.
Os valores obtidos para o plasma representariam cerca de 30% dos níveis plasmáticos iniciais conforme julgado pela meia-vida plasmática em roedores.
Não foram observados efeitos atribuíveis à administração de aciclovir nas comparações dos valores de peso corporal materno, aparência e comportamento, taxas de sobrevivência, taxas de gravidez ou eficiências de implantação. Além disso, não foram observadas diferenças relacionadas ao composto nas avaliações de tamanho fetal, sexo e desenvolvimento.
Embora as incidências de reabsorção e viabilidade fetal estivessem dentro da faixa de variabilidade normal em todos os grupos, foram observadas incidências ligeiramente maiores de reabsorções nos animais de alta dose sacrificados nos dias 15 e 19 de gestação; no entanto, tendências claras relacionadas à dose não ocorreram.
Portanto, o aciclovir não foi considerado teratogênico ou embriotóxico quando administrado a ratos em níveis de até 50,0 mg/kg de peso corporal por dia durante a organogênese.
Teratologia – Coelhos
Um estudo de teratologia foi feito em coelhos brancos da Nova Zelândia usando essencialmente o mesmo desenho experimental que no rato, exceto que a dosagem foi do dia 6 ao dia 18 de gestação. Além disso, a coleta de fetos, líquido amniótico e amostras de sangue materno ocorreu no dia 18 e não no dia 15.
Não foram observados sinais de toxicidade materna em nenhuma dose, mas houve uma eficiência de implantação menor estatisticamente significativa (p
Concentrações de aciclovir foram detectadas em amostras de plasma e líquido amniótico, bem como em homogenatos de tecidos fetais. Todas as amostras foram colhidas uma hora após a primeira dose no dia 18 de gestação. As concentrações do fármaco no líquido amniótico foram substancialmente mais elevadas do que as do plasma (ver Tabela 9).
Reprodução – Fertilidade
O aciclovir mostrou não prejudicar a fertilidade ou a reprodução em grupos de 15 camundongos machos e 30 fêmeas em um estudo de fertilidade de duas gerações. Os camundongos neste estudo receberam aciclovir por intubação gástrica em níveis de dosagem de 50, 150 e 450 mg/kg/dia. Os machos foram dosados por 64 dias consecutivos antes do acasalamento e as fêmeas por 21 dias antes do acasalamento.
Em um estudo de fertilidade em ratos em que grupos de 20 ratos machos e 20 ratos fêmeas receberam 0, 12,5, 25,0 e 50,0 mg/kg/dia por injeção subcutânea, o aciclovir mostrou não ter efeito sobre o acasalamento ou fertilidade. Os machos foram dosados por 60 dias antes do acasalamento e até que seu cronograma de acasalamento estivesse completo. Ratas fêmeas foram dosadas por 14 dias antes do acasalamento e até o dia 7 de prenhez. Na dose de 50 mg/kg/dia sc houve um aumento estatisticamente significativo na perda pós-implantação, mas sem diminuição concomitante no tamanho da ninhada.
Em 25 coelhas tratadas por via subcutânea com 50 mg/kg/dia de aciclovir nos dias 6 a 18 de gestação, houve uma diminuição estatisticamente significativa na eficiência de implantação, mas nenhuma diminuição concomitante no tamanho da ninhada. Houve também um aumento relacionado à dose no número de fetos com costelas supranumerárias em todos os grupos tratados com drogas. Este aumento não foi relacionado com a dose quando a incidência de costelas supranumerárias por ninhada foi examinada.
Em 15 coelhas tratadas intravenosamente com 50 mg/kg/dia de aciclovir nos dias 6 a 18 de gestação, não houve efeito na eficiência da implantação ou no tamanho da ninhada.
Em um estudo peri e pós-natal em ratos (20 ratas por grupo), o aciclovir foi administrado por via subcutânea em 0, 12,5, 25 e 50 mg/kg/dia de 17 dias de gestação a 21 dias pós-parto. A 50 mg/kg/dia sc houve uma diminuição estatisticamente significativa no número médio de corpos lúteos do grupo, locais totais de implantação e fetos vivos na geração F1. Embora não estatisticamente significativo, houve também uma diminuição relacionada à dose no número médio de fetos vivos e locais de implantação do grupo em 12,5 mg/kg/dia e 25 mg/kg/dia sc
Em um estudo de descoberta de faixa de dose com 5 coelhas, a administração intravenosa de aciclovir na dose de 100 mg/kg/dia do 6º ao 8º dia de gestação, uma dose conhecida por causar nefropatia obstrutiva, causou um aumento significativo nas reabsorções fetais e uma diminuição correspondente no tamanho da ninhada. Em uma dose intravenosa máxima tolerada de 50 mg/kg/dia em coelhos, não houve efeitos reprodutivos relacionados ao medicamento.
Em um estudo de toxicidade subcrônica em que grupos de 20 ratos machos e 20 ratos fêmeas receberam doses intraperitoneais de aciclovir a 0, 20, 80 ou 320 mg/kg/dia por um mês e acompanhados por um período pós-dose de um mês, houve atrofia. Alguma evidência histológica de recuperação da produção de esperma foi evidente 30 dias após a dose, mas este foi um tempo insuficiente para demonstrar a reversibilidade total.
Grupos de 25 ratos machos e 25 fêmeas receberam doses intraperitoneais de aciclovir a 0, 5, 20 ou 80 mg/kg/dia por 6 meses. Dez ratos machos e 10 fêmeas em cada grupo continuaram sem a dosagem por 13 semanas. A atrofia testicular foi limitada a ratos com altas doses de 80 mg/kg/dia por 6 meses. Dados de peso de órgãos e microscopia de luz definiram a reversibilidade total da atrofia testicular ao final do período de recuperação pós-dose.
Em um estudo de 31 dias em cães (16 machos e 16 fêmeas por grupo) onde o aciclovir foi administrado por via intravenosa em níveis de 50, 100 e 200 mg/kg/dia, os testículos eram normais em cães com 50 mg/kg. Doses de 100 ou 200 mg/kg/dia causaram a morte de alguns cães devido a efeitos citostáticos (medula óssea e epitélio gastrointestinal) e testículos aspérmicos ou testículos com túbulos aspérmicos dispersos. Não se pode descartar que a alteração testicular possa ter sido primária, no entanto, alterações semelhantes podem ser observadas secundárias ao estresse severo em cães moribundos.
Estudos de Toxicidade do Desenvolvimento
Ratos Neonatais - Estudo Subcrônico
Aciclovir dissolvido em solução salina estéril a 0,4% foi administrado por injeção subcutânea em ratos neonatos Charles River CD (Sprague-Dawley) por 19 dias consecutivos, começando no 3º dia pós-parto. Os níveis de dose testados foram 0, 5, 20 e 80 mg/kg de peso corporal. Havia 12 ninhadas (cada uma composta por 5 neonatos machos e 5 fêmeas amamentando a mãe natural) em cada nível de dose. As barragens não foram tratadas. Os recém-nascidos foram removidos de cada grupo para necropsia e avaliação microscópica de uma ampla variedade de tecidos, incluindo olhos e várias seções do cérebro, após terem sido tratados por 5, 12 ou 19 dias e após um período de 3 semanas após a administração da droga. quando tinham 45 dias de idade). Testes hematológicos (hemoglobina, hemácias, hemácias, leucócitos e contagem diferencial de células) e de química clínica (BUN) foram realizados após 16 dias de tratamento e repetidos 18 dias após a administração da última (19ª) dose.
sangue foi coletado de alguns neonatos 30 minutos após o tratamento no dia 1, no dia 9 e no final do período de dose para a determinação das concentrações de aciclovir no plasma. A maior concentração de aciclovir no plasma foi de 99,1 μg/mL (440,5 μM) encontrada no plasma agrupado coletado de 6 recém-nascidos do sexo feminino de alta dose (80 mg/kg) 30 minutos após a primeira dose ter sido administrada. O tratamento com aciclovir não aumentou a mortalidade no período neonatal.
Os ratos do grupo de baixa dose ganharam tanto peso corporal quanto os respectivos ratos de controle. Reduções significativas (p
Exames oftalmológicos e microscopia de luz não revelaram efeitos adversos no desenvolvimento ocular. Deve-se enfatizar que não houve evidência morfológica ou funcional de efeitos adversos no cérebro em desenvolvimento ou outras porções do sistema nervoso central. Assim, o aciclovir é distintamente diferente da citosina arabinosídeo que foi relatado para produzir displasia cerebelar e retiniana proeminente em ratos neonatos.
Mutagenicidade e outros estudos de curto prazo
O aciclovir foi testado quanto ao potencial mutagênico em vários sistemas in vitro e in vivo: 10 de novembro de 2014 Página 27 de 38
Microbiano
O aciclovir foi testado quanto à atividade mutagênica no ensaio de placa de Ames Salmonella; em uma modificação de pré-incubação do ensaio de Ames; no ensaio de reparo de DNA polA+/polA- de Rosenkrantz E. coli; e no eucarioto S. cerevisiae, D-4. Todos os estudos foram realizados tanto na presença como na ausência de ativação metabólica exógena de mamíferos. O aciclovir não deu respostas positivas em nenhum desses sistemas.
Os estudos anteriores de Salmonella foram estendidos a concentrações extremamente altas para atingir a toxicidade. Não foram observados efeitos positivos na presença ou ausência de ativação metabólica exógena de mamíferos, em concentrações de aciclovir de até 300 mg/placa ou 80 mg/mL.
Sistemas Mamíferos
aciclovir foi testado quanto à atividade mutagênica em células de linfoma de camundongo L5178Y cultivadas, heterozigotas no locus da timidina quinase (TK), medindo a taxa de mutação direta para deficiência de TK (TK+/- → TK-/-; estudos adicionais foram realizados no HGPRT locus e no marcador de resistência Ouabaína nessas mesmas células. Todos os estudos foram realizados na presença e na ausência de ativação metabólica exógena de mamíferos. O composto de teste foi mutagênico no locus TK em altas concentrações (400 -2.400 μg/mL) (Em comparação, o limite superior dos níveis plasmáticos de pico de aciclovir após a dosagem oral de 200 mg q4h é de 0,9 μg/mL). Foi negativo no locus HGPRT e no marcador de resistência Ouabaína. Resultados idênticos foram obtidos com e sem ativação metabólica.
Resultados inconclusivos sem resposta aparente relacionada à dose foram obtidos quando a mutagenicidade do aciclovir foi estudada em cada um dos 3 loci (APRT, HGPRT e resistência a Ouabaína) em células de ovário de hamster chinês (CHO), tanto na presença quanto na ausência de ativação metabólica exógena.
O aciclovir, a uma concentração de 50 μg/mL (222 μM) para uma exposição de 72 horas, demonstrou causar um aumento estatisticamente significativo na incidência de focos morfologicamente transformados resultantes do tratamento de células BALB/C-3T3 in vitro em ausência de ativação metabólica exógena. Mostrou-se que os focos transformados morfologicamente crescem como tumores após transplante em camundongos desmamados, singênicos e imunossuprimidos. Os tecidos tumorais foram diagnosticados como sendo sarcomas indiferenciados ou linfossarcomas.
aciclovir, em concentrações entre 8 e 64 μg/mL por 18 horas de exposição, não induziu nenhum foco morfologicamente transformado entre as células C3H/10T ½ tratadas in vitro na ausência de ativação metabólica exógena.
O aciclovir, nas concentrações de 62,5 e 125 μg/mL para uma exposição de 48 horas, não induziu aberrações cromossômicas em linfócitos humanos cultivados na ausência de ativação metabólica exógena. Em concentrações mais altas, 250 e 500 μg/mL por 48 horas de exposição, o aciclovir causou um aumento significativo na incidência de quebra cromossômica. Houve também uma diminuição significativa relacionada com a dose no índice mitótico com a exposição ao aciclovir.
aciclovir, nas doses de 25 e 50 mg/kg/dia ip por 5 dias consecutivos, não produziu efeito letal dominante em camundongos BKA machos (CPLP). Além disso, não houve evidência de um efeito letal dominante em camundongos machos e fêmeas Charles River CD-1 (ICR) tratados oralmente em níveis de dose de 50, 150 e 450 mg/kg/dia, conforme resumido para o Estudo de Reprodução/Fertilidade de Duas Gerações .
O aciclovir, em doses intraperitoneais únicas de 25, 50 e 100 mg/kg, não induziu aberrações cromossômicas nas células da medula óssea de hamsters chineses quando examinados 24 horas após a dosagem. Em doses nefrotóxicas mais altas (500 e 1.000 mg/kg), foi observado um efeito blastogênico. (Uma dose intraperitoneal de 500 mg/kg produz níveis plasmáticos máximos médios em hamsters chineses de 611 μg/mL (2,72 mM), que é 680 vezes maior que o limite superior dos níveis plasmáticos máximos humanos durante a dosagem oral de 200 mg q4h).
aciclovir, em doses intravenosas únicas de 25, 50 e 100 mg/kg, não induziu aberrações cromossômicas nas células da medula óssea de ratos machos e fêmeas quando examinados 6, 24 e 48 horas após o tratamento.
Assim, todos esses estudos mostraram que o aciclovir não causa mutações em um único gene, mas é capaz de quebrar cromossomos.
Estudos de imunotoxicologia
O aciclovir foi submetido a vários testes imunológicos in vitro e in vivo.
Em dois testes in vivo, citotoxicidade mediada por linfócitos e quimiotaxia de neutrófilos, o aciclovir não mostrou efeitos inibitórios em concentrações tão altas quanto 135 μg/mL (600 μM). O composto inibiu a formação de rosetas em aproximadamente 50% a 0,9 μg/mL (4 μM).
Em quatro testes in vivo em camundongos que mediram a imunidade mediada por células (citotoxicidade celular dependente do complemento, citotoxicidade celular independente do complemento, hipersensibilidade retardada e reação enxerto versus hospedeiro), o aciclovir não mostrou efeitos inibitórios em doses únicas de até 200 mg/kg administradas no dia 2 após estimulação antigênica.
Quatro doses diárias de 100 mg/kg/dia não tiveram efeito significativo nas placas de hemolisina de Jerne ou no anticorpo circulante no dia 7 após a estimulação antigênica. Quando as placas de hemolisina de Jerne e os títulos de anticorpos foram examinados quatro dias após o desafio antigênico e um dia após a última dose da droga, 100 mg/kg mostraram apenas um leve efeito supressor. No entanto, 200 mg/kg produziram alguma perda de peso (-2,2 g), uma redução moderada no número de placas de hemolisina de Jerne (PFC/baço foram reduzidos para 33% do controle, PFC/107 WBC para 46,5% do controle). No entanto, houve apenas uma pequena redução no título de hemaglutinina circulante (de 8,3 para 6,5) e no título de hemolisina circulante (de 9,5 para 8,3) na dose de 200 mg/kg.
Em experimentos em camundongos projetados para testar se o aciclovir potencializaria o efeito imunossupressor da azatioprina na formação de anticorpos, descobriu-se que os efeitos das duas drogas não eram mais do que aditivos. Apenas a dose de 200 mg/kg de aciclovir mostrou um aumento da supressão da resposta de anticorpos quando administrado em combinação com azatioprina em doses acima de 25 mg/kg.
Foram realizados estudos para avaliar a influência do aciclovir in vitro na função dos linfócitos humanos. Os efeitos inibitórios na blastogênese foram observados apenas em ensaios que examinaram as concentrações máximas de mitógenos potentes, fitohemaglutinina (PHA) e concanavalina A (Con A), e apenas em concentrações de droga acima de 50 μg/mL (222 μM) e foram muito menores com monilia e antígenos do toxóide tetânico, onde a resposta blastogênica é caracteristicamente menos vigorosa. Houve muito pouco efeito na citotoxicidade ou na produção de LIF, exceto em concentrações de 200 μg/mL (890 μM), onde já foi demonstrado um efeito citotóxico direto. Essas concentrações inibitórias são muito superiores aos níveis previstos de doses selecionadas para aplicação clínica e mais de 1.000 vezes maiores do que a concentração necessária para inibir a multiplicação do herpesvírus in vitro.
efeito do aciclovir em células humanas foi medido. Uma concentração de 11,2 - 22,5 μg/mL (50-100 μM) inibe a divisão de fibroblastos em extensão variável, dependendo do desenho experimental e da confluência da monocamada. A magnitude deste efeito foi menor do que a causada por adenina arabinosídeo ou interferon leucocitário humano quando esses três agentes antivirais foram comparados em concentrações clinicamente relevantes. O aciclovir também inibiu a incorporação de timidina por células mononucleares do sangue periférico estimuladas por PHA ou três diferentes antígenos de herpesvírus. Uma curva linear dose-resposta foi observada com essas células, e sua proliferação foi 50% inibida por 22,5 μg/mL (100 μM) de aciclovir. A inibição foi exercida na proliferação de células T sem efeito aparente na liberação de linfocinas ou na função dos monócitos.
Também deve ser mencionado que não houve evidência de efeitos adversos no sistema imunológico nos testes detalhados em animais subcrônicos e crônicos abordados anteriormente neste resumo, exceto em doses excessivamente altas (50 a 100 mg/kg bid) em cães onde hipoplasia linfóide acentuada ocorreu.
REFERÊNCIAS
1. Balfour HH, Jr., Kelly JM, Suarez CS, Heussner RC, Englund JA, Crane DD et al. Tratamento da varicela com aciclovir em crianças saudáveis. J Pediatr 1990; 116(4):633-639.
2. Balfour HH, Jr., Rotbart HA, Feldman S, Dunkle LM, Feder HM, Jr., Prober CG et al. Tratamento da varicela com aciclovir em adolescentes saudáveis. O Grupo Colaborativo de Estudo da Varicela do Aciclovir. J Pediatr 1992; 120(4 Pt 1):627-633.
3. Barry DW, Blum MR. Drogas antivirais: aciclovir, em Recent Advances in Clinical Pharmacology. Turner P, Shand DG (eds) Churchill Livingstone, Edimburgo 1983.
4. Barry DW, Nusinoff-Lehrman S. Resistência viral na prática clínica: resumo de cinco anos de experiência com aciclovir. Pharmacological and Clinical Approaches to Herpesviruses and Virus Chemotherapy, Aiso, Japão, 10-13 de setembro de 1984.
5. Barry DW, Nusinoff-Lehrman S, Ellis MN, Biron KK, Furman PA. Resistência viral, experiência clínica. Scand J Infect Dis Supl 1985; 47:155-164.
6. Barry DW, Nusinoff-Lehrman S. Resistência viral na prática clínica: resumo de cinco anos de experiência com aciclovir. Proceedings of the International Symposium on Pharmacological and Clinical Approaches to Herpes Viruses and Virus Chemotherapy, Elsever, Amsterdam 1985;269-270.
7. Biron KK, Elion GB. Efeito do aciclovir combinado com outros agentes anti-herpéticos no vírus varicela zoster in vitro. Am J Med 1982; 73(1A): 54-57.
8. Boelaert J, Schurgers M, Daneels R, Van Landuyt HW, Weatherley BC. Farmacocinética de doses múltiplas de aciclovir intravenoso em pacientes em diálise peritoneal ambulatorial contínua. J Antimicrob Chemother 1987; 20(1):69-76.
9. Bryson YJ, Dillon M, Lovett M, Acuna G, Taylor S, Cherry JD et al. Tratamento dos primeiros episódios de infecção pelo vírus do herpes simples genital com aciclovir oral. Um estudo randomizado duplo-cego controlado em indivíduos normais. N Engl J Med 1983; 308(16):916-921.
10. Burns WH, Saral R, Santos GW, Laskin OL, Lietman PS, McLaren C et al. Isolamento e caracterização do vírus Herpes simplex resistente após terapia com aciclovir. Lancet 1982; 1(8269):421-423.
11. Christophers J, Sutton RN. Caracterização de isolados clínicos de vírus herpes simplex sensíveis e resistentes ao aciclovir de um paciente imunocomprometido. J Antimicrob Chemother 1987; 20(3):389-398.
12. Cole NL, Balfour HH, Jr. O vírus Varicella-Zoster não se torna mais resistente ao aciclovir durante a terapia. J Infect Dis 1986; 153(3):605-608.
13. Collins P, Bauer DJ. A atividade in vitro contra o vírus do herpes de 9-(2-hidroxietoximetil)guanina (acicloguanosina), um novo agente antiviral. J Antimicrob Chemother 1979; 5(4):431-436.
14. Collins P, Oliver NM. Monitoramento da sensibilidade de isolados de vírus herpes simples de pacientes recebendo aciclovir. J Antimicrob Chemother 1986; 18 Suplemento B:103-112.
15. Collins P. Sensibilidade viral após a introdução do aciclovir. Am J Med 1988; 85(2A): 129-134.
16. Collins P, Larder BA, Oliver NM, Kemp S, Smith IW, Darby G. Caracterização de um mutante de DNA polimerase do vírus herpes simplex de um paciente gravemente imunocomprometido recebendo aciclovir. J Gen Virol 1989; 70 (Pt 2): 375-382.
17. Crumpacker CS, Schnipper LE, Zaia JA, Levin MJ. Inibição do crescimento por acicloguanosina de herpesvírus isolados de infecções humanas. Agentes Antimicrobianos Chemother 1979; 15(5):642-645.
18. Crumpacker CS, Schnipper LE, Marlowe SI, Kowalsky PN, Hershey BJ, Levin MJ. Resistência às drogas antivirais do vírus do herpes simples isolado de um paciente tratado com aciclovir. N Engl J Med 1982; 306(6):343-346.
19. Darby G, Inglis MM, Larder BA. Mecanismos de resistência aos inibidores análogos de nucleosídeos do vírus herpes simplex. 6th Int Congr Virol 1984; (Resumo #W34-5).
20. De Clercq E, Descamps J, Verhelst G, Walker RT, Jones AS, Torrence PF et al. Eficácia comparativa de drogas anti-herpes contra diferentes cepas do vírus herpes simplex. J Infect Dis 1980; 141(5):563-574.
21. De Clercq E. Eficácia comparativa de drogas anti-herpes em diferentes linhagens celulares. Agentes Antimicrobianos Chemother 1982; 21(4):661-663.
22. Dekker C, Ellis MN, McLaren C, Hunter G, Rogers J, Barry DW. Resistência a vírus na prática clínica. J Antimicrob Chemother 1983; 12 Supl B:137-152.
23. Douglas JM, Davis LG, Remington ML, Paulsen CA, Perrin EB, Goodman P et al. Um estudo duplo-cego, controlado por placebo, sobre o efeito do aciclovir oral administrado cronicamente na produção de esperma em homens com herpes genital frequentemente recorrente. J Infect Dis 1988 Março; 157:588-93.
24. Douglas JM, Critchlow C, Benedetti J, Mertz GJ, Connor JD, Hintz MA et al. Um estudo duplo-cego de aciclovir oral para supressão de recorrências de infecção pelo vírus herpes simplex genital. N Engl J Med 1984; 310(24):1551-1556.
25. Dunkle LM, Arvin AM, Whitley RJ, Rotbart HA, Feder HM, Jr., Feldman S et al. Um estudo controlado de aciclovir para varicela em crianças normais. N Engl J Med 1991; 325(22):1539-1544.
26. Ellis MN, Keller PM, Martin JL, Strauss SE, Nusinoff-Lehrman S et al. Caracterização de um isolado clínico de HSV-2 contendo um mutante resistente ao ACV que produz uma timidina quinase com especificidade de substrato alterada. Nona Int Herpesvirus Workshop, Seattle, Washington, 24-29 de agosto de 1984.
27. Ellis MN, Keller PM, Fyfe JA, Martin JL, Rooney JF, Straus SE et al. Isolado clínico do vírus herpes simplex tipo 2 que induz uma timidina quinase com especificidade de substrato alterada. Agentes Antimicrobianos Chemother 1987; 31(7):1117-1125.
28. Englund JA, Zimmerman ME, Swierkosz EM, Goodman JL, Scholl DR, Balfour HH, Jr. Herpes simplex virus resistente ao aciclovir. Um estudo em um centro de atenção terciária. Ann Intern Med 1990; 112(6):416-422.
29. Erlich KS, Jacobson MA, Koehler JE, Follansbee SE, Drennan DP, Gooze L et al. Terapia com foscarnet para infecções graves por vírus herpes simplex tipo 2 resistentes a aciclovir em pacientes com a síndrome da imunodeficiência adquirida (AIDS). Um ensaio não controlado. Ann Intern Med 1989; 110(9):710-713.
30. Erlich KS, Mills J, Chatis P, Mertz GJ, Busch DF, Follansbee SE et al. Infecções pelo vírus do herpes simples resistente ao aciclovir em pacientes com síndrome da imunodeficiência adquirida. N Engl J Med 1989; 320(5):293-296.
31. Field HJ, Darby G, Wildy P. Isolamento e caracterização de mutantes resistentes a aciclovir do vírus herpes simplex. J Gen Virol 1980; 49(1):115-124.
32. Campo HJ. O problema da resistência induzida por drogas em vírus, em Problemas de Terapia Antiviral. Stuart-Harris CH, Oxford J (Eds) Academic Press, Londres 1983.
33. Fyfe K. Padrões de recorrência de herpes genital após cessação de mais de 5 anos de supressão crônica de aciclovir. VIII Int Conf AIDS/III Std Wrld Cong 1992; (B240).
34. Huff JC, Bean B, Balfour HH, Jr., Laskin OL, Connor JD, Corey L et al. Terapia do herpes zoster com aciclovir oral. Am J Med 1988; 85(2A): 84-89.
35. Jacobson MA, Berger TG, Fikrig S, Becherer P, Moohr JW, Stanat SC et al. Infecção pelo vírus varicela zoster resistente ao aciclovir após terapia oral crônica com aciclovir em pacientes com síndrome da imunodeficiência adquirida (AIDS). Ann Intern Med 1990; 112(3):187-191.
36. Kaplowitz LG, Baker D, Gelb L, Blythe J, Hale R, Frost P et al. Tratamento contínuo prolongado com aciclovir de adultos normais com infecção recorrente pelo vírus do herpes simples genital. O Grupo de Estudo do Aciclovir. JAMA 1991; 265(6):747-751.
37. Krasny HC, Liao SH, de Miranda P, Laskin OL, Whelton A, Lietman PS. Influência da hemodiálise na farmacocinética do aciclovir em pacientes com insuficiência renal crônica. Am J Med 1982; 73(1A):202-204.
38. Kurtz T. Segurança e eficácia do tratamento supressivo de longo prazo com ciclovir de herpes genital recorrente: resultados do ano 5. 30th Intersci Conf Antimicrob Agents Chemother 1990;270.
39. Laskin OL, Longstreth JA, Whelton A, Krasny HC, Keeney RE, Rocco L et al. Efeito da insuficiência renal na farmacocinética do aciclovir. Am J Med 1982; 73(1A):197-201.
40. Lau RJ, Emery MG, Galinsky RE. Acúmulo inesperado de aciclovir no leite materno com estimativa da exposição infantil. Obstet Gynecol 1987; 69(3 Pt 2):468-471.
41. Lehrman SN, Douglas JM, Corey L, Barry DW. Herpes genital recorrente e terapia supressiva com aciclovir oral. Relação entre o resultado clínico e a sensibilidade ao fármaco in vitro. Ann Intern Med 1986; 104(6):786-790.
42. Marlowe S, Douglas J, Corey L, Schnipper L, Crumpacker C. Sensibilidade de isolados genitais de HSV após aciclovir oral. 24th Interscience Conf Antimicrob Ag Chemother, Washington, DC, 8-10 de outubro de 1984.
43. Mattison HR, Reichman RC, Benedetti J, Bolgiano D, Davis LG, Bailey-Farchione A et al. Estudo duplo-cego, controlado por placebo, comparando a terapia supressiva de longo prazo com a terapia oral de aciclovir de curto prazo para o manejo do herpes genital recorrente. Am J Med 1988; 85(2A): 20-25.
44. McLaren C, Sibrack CD, Barry DW. Espectro de sensibilidade do aciclovir de isolados clínicos do vírus herpes simplex. Am J Med 1982; 73(1A):376-379.
45. McLaren C, Ellis MN, Hunter GA. Um ensaio colorimétrico para a medição da sensibilidade dos vírus herpes simplex a agentes antivirais. Res antiviral 1983; 3(4):223-234.
46. McLaren C, Corey L, Dekket C, Barry DW. Sensibilidade in vitro ao aciclovir em vírus do herpes simples genital de pacientes tratados com aciclovir. J Infect Dis 1983; 148(5):868-875.
47. Mertz GJ, Critchlow CW, Benedetti J, Reichman RC, Dolin R, Connor J et al. Ensaio duplo-cego controlado por placebo de aciclovir oral no primeiro episódio de infecção pelo vírus herpes simplex genital. JAMA 1984; 252(9):1147-1151.
48. Mertz GJ, Jones CC, Mills J, Fife KH, Lemon SM, Stapleton JT et al. Supressão por aciclovir a longo prazo da infecção pelo vírus do herpes simples genital recorrente. Um estudo multicêntrico duplo-cego. JAMA 1988; 260(2):201-206.
49. Mertz GJ, Eron L, Kaufman R, Goldberg L, Raab B, Conant M et al. Tratamento prolongado com aciclovir oral contínuo versus intermitente em adultos normais com infecção recorrente pelo vírus herpes simplex genital. Am J Med 1988; 85(2A): 14-19.
50. Meyer LJ, de Miranda P, Sheth N, Spruance S. Aciclovir no leite materno humano. Am J Obstet Gynecol 1988; 158(3 Pt 1):586-588.
51. Mindel A, Weller IV, Faherty A, Sutherland S, Hindley D, Fiddian AP et al. Aciclovir oral profilático no herpes genital recorrente. Lancet 1984; 2(8394):57-59.
52. Morton P, Thomson AN. Aciclovir oral no tratamento do herpes zoster na clínica geral. NZ Med J 1989; 102(863):93-95.
53. Naib ZM, Nahmias AJ, Josey WE, Zaki SA. Relação da cito-histopatologia da infecção pelo herpesvírus genital com a anaplasia cervical. Câncer Res 1973; 33(6):1452-1463.
54. Nilsen AE, Aasen T, Halsos AM, Kinge BR, Tjotta EA, Wikstrom K et al. Eficácia do aciclovir oral no tratamento do herpes genital inicial e recorrente. Lancet 1982; 2(8298):571-573.
55. Nusinoff-Lehrman S, Hunter G, Rogers J, Corey L, Davis G. A sensibilidade ao aciclovir in vitro do herpesvírus eliminado por pacientes que recebem terapia oral supressiva. 24th Interscience Conf Antimicrob Ag Chemother, Washington, DC, 8-10 de outubro de 1984; (Resumo #1015).
56. O'Brien JJ, Campoli-Richards DM. Aciclovir. Uma revisão atualizada de sua atividade antiviral, propriedades farmacocinéticas e eficácia terapêutica. Drogas 1989; 37(3):233-309.
57. Pahwa S, Biron K, Lim W, Swenson P, Kaplan MH, Sadick N et al. Infecção contínua por varicela-zoster associada à resistência ao aciclovir em uma criança com AIDS. JAMA 1988; 260(19):2879-2882.
58. Parker AC, Craig JI, Collins P, Oliver N, Smith I. Infecção pelo vírus herpes simplex resistente ao aciclovir devido à alteração da DNA polimerase. Lancet 1987; 2(8573):1461.
59. Parris DS, Harrington JE. Variantes do vírus herpes simplex restritas a altas concentrações de aciclovir existem em isolados clínicos. Agentes Antimicrobianos Chemother 1982; 22(1):71-77.
60. Preblud SR, Arbeter AM, Proctor EA, Starr SE, Plotkin SA. Suscetibilidade de cepas vacinais do vírus varicela-zoster a compostos antivirais. Agentes Antimicrobianos Chemother 1984; 25(4):417-421.
61. Reichman RC, Badger GJ, Mertz GJ, Corey L, Richman DD, Connor JD et al. Tratamento de infecções recorrentes por herpes simples genital com aciclovir oral. Um ensaio controlado. JAMA 1984; 251(16):2103-2107.
62. Shah GM, Winer RL, Krasny HC. Farmacocinética do aciclovir em paciente em diálise peritoneal ambulatorial contínua. Am J Kidney Dis 1986; 7(6):507-510.
63. Sibrack CD, Gutman LT, Wilfert CM, McLaren C, St Clair MH, Keller PM et al. Patogenicidade do vírus herpes simplex tipo 1 resistente ao aciclovir de uma criança imunodeficiente. J Infect Dis 1982; 146(5):673-682.
64. Straus SE, Seidlin M, Takiff H, Jacobs D, Bowen D, Smith HA. Aciclovir oral para suprimir infecções recorrentes pelo vírus herpes simplex em pacientes imunodeficientes. Ann Intern Med 1984; 100(4):522-524.
65. Straus SE, Takiff HE, Seidlin M, Bachrach S, Lininger L, DiGiovanna JJ et al. Supressão de herpes genital frequentemente recorrente. Um estudo duplo-cego controlado por placebo de aciclovir oral. N Engl J Med 1984; 310(24):1545-1550.
66. Straus SE, Croen KD, Sawyer MH, Freifeld AG, Felser JM, Dale JK et al. Supressão por aciclovir do herpes genital recorrente. Eficácia e necessidade decrescente durante anos sucessivos de tratamento. JAMA 1988; 260(15):2227-2230.
67. Vinckier F, Boogaerts M, De Clerck D, De Clercq E. Infecção herpética crônica em paciente imunocomprometido: relato de caso. J Oral Maxillofac Surg 1987; 45(8):723-728.
68. Wade JC, Newton B, McLaren C, Flournoy N, Keeney RE, Meyers JD. Aciclovir intravenoso para tratar a infecção pelo vírus herpes simplex mucocutâneo após transplante de medula: um estudo duplo-cego. Ann Intern Med 1982; 96(3):265-269.
69. Wade JC, McLaren C, Meyers JD. Frequência e significado do vírus do herpes simples resistente ao aciclovir isolado de pacientes com transplante de medula que receberam vários cursos de tratamento com aciclovir. J Infect Dis 1983; 148(6):1077-1082.
INFORMAÇÃO DO PACIENTE
As pacientes são instruídas a consultar seu médico se apresentarem reações adversas graves ou problemáticas, engravidarem ou pretenderem engravidar, pretenderem amamentar enquanto estiverem tomando ZOVIRAX (aciclovir) administrado por via oral ou tiverem outras dúvidas.
Os doentes devem ser aconselhados a manter uma hidratação adequada.
