Tratamento para Cabelo: Avodart 0.5mg Dutasteride Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Avodart 0,5mg e como é usado?
Avodart 0,5 mg é um medicamento de prescrição usado para tratar os sintomas de um aumento da próstata (hiperplasia prostática benigna). Avodart pode ser usado sozinho ou com outros medicamentos.
Avodart 0,5mg pertence a uma classe de medicamentos chamados inibidores da 5-alfa-redutase.
Não se sabe se Avodart 0,5mg é seguro e eficaz em crianças.
Quais são os efeitos colaterais do Avodart?
Os efeitos colaterais do Avodart 0,5mg incluem:
- urticária,
- dificuldade para respirar,
- inchaço no rosto ou na garganta,
- febre,
- dor de garganta,
- Olhos queimando,
- dor na pele e
- erupção cutânea vermelha ou roxa com bolhas e descamação
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns de Avodart 0,5mg incluem:
- diminuição da libido (desejo sexual),
- diminuição da quantidade de sêmen liberado durante o sexo,
- impotência (dificuldade em obter ou manter uma ereção), e
- sensibilidade ou aumento da mama
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Avodart. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
DESCRIÇÃO
AVODART 0,5mg é um composto sintético de 4 azasteróides que é um inibidor seletivo das isoformas tipo 1 e tipo 2 da esteróide 5 alfa-redutase, uma enzima intracelular que converte a testosterona em DHT.
A dutasterida é quimicamente designada como (5α,17β)-N-{2,5 bis(trifluorometil)fenil}-3-oxo-4-azaandrost-1-eno-17-carboxamida. A fórmula empírica da dutasterida é C27H30F6N2O2, representando um peso molecular de 528,5 com a seguinte fórmula estrutural:
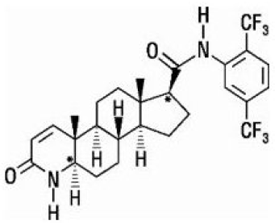
A dutasterida é um pó branco a amarelo pálido com ponto de fusão de 242° a 250°C. É solúvel em etanol (44 mg/mL), metanol (64 mg/mL) e polietilenoglicol 400 (3 mg/mL), mas é insolúvel em água.
Cada cápsula de gelatina mole de AVODART 0,5 mg, administrada por via oral, contém 0,5 mg de dutasterida dissolvido em uma mistura de mono-diglicerídeos de ácido caprílico/cáprico e hidroxitolueno butilado. Os excipientes inativos no invólucro da cápsula são óxido férrico (amarelo), gelatina (de fontes bovinas certificadas sem BSE), glicerina e dióxido de titânio. As cápsulas de gelatina mole são impressas com tinta vermelha comestível.
INDICAÇÕES
Monoterapia
As cápsulas de gelatina mole de AVODART (dutasterida) são indicadas para o tratamento da hiperplasia prostática benigna (HPB) sintomática em homens com próstata aumentada para:
- melhorar os sintomas,
- reduzir o risco de retenção urinária aguda (AUR), e
- reduzir o risco da necessidade de cirurgia relacionada à HBP.
Combinação com Antagonista Alfa-adrenérgico
AVODART em combinação com o antagonista alfa-adrenérgico, tansulosina, é indicado para o tratamento da HBP sintomática em homens com próstata aumentada.
Limitações de uso
AVODART 0,5mg não é aprovado para a prevenção do câncer de próstata.
DOSAGEM E ADMINISTRAÇÃO
As cápsulas devem ser engolidas inteiras e não mastigadas ou abertas, pois o contato com o conteúdo da cápsula pode resultar em irritação da mucosa orofaríngea. AVODART pode ser administrado com ou sem alimentos.
Monoterapia
A dose recomendada de AVODART é de 1 cápsula (0,5 mg) tomada uma vez ao dia.
Combinação com Antagonista Alfa-adrenérgico
A dose recomendada de AVODART 0,5 mg é 1 cápsula (0,5 mg) tomada uma vez ao dia e tansulosina 0,4 mg tomada uma vez ao dia.
COMO FORNECIDO
Formas de dosagem e pontos fortes
Cápsulas de gelatina de 0,5 mg, opacas, amarelas opacas, impressas com “GX CE2” em tinta vermelha em um dos lados.
Armazenamento e manuseio
AVODART cápsulas de gelatina mole 0,5 mg são oblongas, opacas, amarelas opacas, cápsulas de gelatina impressas com “GX CE2” com tinta vermelha comestível em um lado, embaladas em frascos de 30 ( NDC 0173-0712-15) e 90 ( NDC 0173-0712-04) com fechos à prova de crianças.
Armazenar a 25°C (77°F); excursões permitidas de 15° a 30°C (59° a 86°F) [ver Temperatura ambiente controlada USP ].
dutasterida é absorvida pela pele. As cápsulas de AVODART 0,5 mg não devem ser manuseadas por mulheres grávidas ou que possam engravidar devido ao potencial de absorção da dutasterida e ao risco potencial subsequente para o desenvolvimento do feto masculino [ver AVISOS E PRECAUÇÕES ].
Fabricado para: GlaxoSmithKline Research Triangle Park. Revisado: janeiro de 2020
EFEITOS COLATERAIS
Experiência de Ensaios Clínicos
Como os ensaios clínicos são conduzidos sob condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser comparadas diretamente com as taxas no ensaio clínico de outro medicamento e podem não refletir as taxas observadas na prática.
De ensaios clínicos com AVODART 0,5 mg em monoterapia ou em combinação com tansulosina:
- As reações adversas mais comuns relatadas em indivíduos que receberam AVODART 0,5 mg foram impotência, diminuição da libido, distúrbios mamários (incluindo aumento e sensibilidade mamária) e distúrbios da ejaculação. As reações adversas mais comuns relatadas em indivíduos recebendo terapia combinada (AVODART 0,5 mg mais tansulosina) foram impotência, diminuição da libido, distúrbios mamários (incluindo aumento e sensibilidade mamária), distúrbios da ejaculação e tontura. Distúrbios da ejaculação ocorreram significativamente mais em indivíduos que receberam terapia combinada (11%) em comparação com aqueles que receberam AVODART (2%) ou tansulosina (4%) como monoterapia.
- A retirada do estudo devido a reações adversas ocorreu em 4% dos indivíduos que receberam AVODART 0,5 mg e 3% dos indivíduos que receberam placebo em estudos controlados por placebo com AVODART. A reação adversa mais comum que levou à retirada do estudo foi impotência (1%).
- No ensaio clínico que avaliou a terapia combinada, a retirada do estudo devido a reações adversas ocorreu em 6% dos indivíduos recebendo terapia combinada (AVODART mais tansulosina) e 4% dos indivíduos recebendo AVODART 0,5mg ou tansulosina como monoterapia. A reação adversa mais comum em todos os braços de tratamento que levou à retirada do estudo foi disfunção erétil (1% a 1,5%).
Monoterapia
Mais de 4.300 indivíduos do sexo masculino com HBP foram aleatoriamente designados para receber placebo ou doses diárias de 0,5 mg de AVODART em 3 ensaios de tratamento de Fase 3 idênticos de 2 anos, controlados por placebo, duplo-cegos, cada um seguido por um estudo aberto de 2 anos extensão. Durante o período de tratamento duplo-cego, 2.167 indivíduos do sexo masculino foram expostos a AVODART 0,5mg, incluindo 1.772 expostos por 1 ano e 1.510 expostos por 2 anos. Ao incluir as extensões abertas, 1.009 indivíduos do sexo masculino foram expostos a AVODART 0,5mg por 3 anos e 812 foram expostos por 4 anos. A população estava na faixa etária de 47 a 94 anos (idade média: 66 anos) e mais de 90% eram brancos. A Tabela 1 resume as reações adversas clínicas relatadas em pelo menos 1% dos indivíduos que receberam AVODART e com maior incidência do que os indivíduos que receberam placebo.
Tratamento a longo prazo (até 4 anos)
Câncer de próstata de alto grau
estudo REDUCE foi um estudo randomizado, duplo-cego, controlado por placebo que envolveu 8.231 homens com idade entre 50 e 75 anos com PSA sérico de 2,5 ng/mL a 10 ng/mL e biópsia de próstata negativa nos 6 meses anteriores. Os indivíduos foram randomizados para receber placebo (n = 4.126) ou doses diárias de 0,5 mg de AVODART (n = 4.105) por até 4 anos. A média de idade foi de 63 anos e 91% eram brancos. Os indivíduos foram submetidos a biópsias de próstata programadas exigidas pelo protocolo aos 2 e 4 anos de tratamento ou tiveram “biópsias por causa” em horários não programados, se clinicamente indicado. Houve uma maior incidência de câncer de próstata com pontuação de Gleason 8-10 em homens que receberam AVODART (1,0%) em comparação com homens que receberam placebo (0,5%) [ver INDICAÇÕES E USO , AVISOS E PRECAUÇÕES ]. Em um ensaio clínico controlado por placebo de 7 anos com outro inibidor da 5 alfa-redutase (finasterida 5 mg, PROSCAR), foram observados resultados semelhantes para câncer de próstata com pontuação de Gleason 8-10 (finasterida 1,8% versus placebo 1,1%).
Nenhum benefício clínico foi demonstrado em pacientes com câncer de próstata tratados com AVODART.
Distúrbios Reprodutivos e Mamários
Nos 3 ensaios principais de HBP controlados por placebo com AVODART 0,5 mg, a cada 4 anos de duração, não houve evidência de aumento das reações adversas sexuais (impotência, diminuição da libido e distúrbios da ejaculação) ou distúrbios da mama com duração aumentada do tratamento. Entre esses 3 estudos, houve 1 caso de câncer de mama no grupo dutasterida e 1 caso no grupo placebo. Nenhum caso de câncer de mama foi relatado em nenhum grupo de tratamento no estudo CombAT de 4 anos ou no estudo REDUCE de 4 anos.
A relação entre o uso prolongado de dutasterida e neoplasia de mama masculina é atualmente desconhecida.
Combinação com terapia alfa-bloqueadora (CombAT)
Mais de 4.800 indivíduos do sexo masculino com HBP foram aleatoriamente designados para receber 0,5 mg de AVODART 0,5 mg, 0,4 mg de tansulosina ou terapia combinada (0,5 mg de AVODART mais 0,4 mg de tansulosina) administrado uma vez ao dia em um estudo duplo-cego de 4 anos. No geral, 1.623 indivíduos receberam monoterapia com AVODART; 1.611 indivíduos receberam monoterapia com tansulosina; e 1.610 indivíduos receberam terapia combinada. A população tinha idade entre 49 e 88 anos (média de idade: 66 anos) e 88% eram brancos. A Tabela 2 resume as reações adversas relatadas em pelo menos 1% dos indivíduos no grupo de combinação e em uma incidência mais alta do que os indivíduos recebendo monoterapia com AVODART 0,5 mg ou tansulosina.
Insuficiência Cardíaca
No CombAT, após 4 anos de tratamento, a incidência de insuficiência cardíaca a termo composta no grupo de terapia combinada (12/1.610; 0,7%) foi maior do que em qualquer grupo de monoterapia: AVODART 0,5mg, 2/1.623 (0,1%) e tamsulosina, 9/1.611 (0,6%). A insuficiência cardíaca composta também foi examinada em um estudo separado, controlado por placebo, de 4 anos, avaliando o AVODART em homens com risco de desenvolver câncer de próstata. A incidência de insuficiência cardíaca em indivíduos que tomaram AVODART 0,5 mg foi de 0,6% (26/4.105) em comparação com 0,4% (15/4.126) em indivíduos que receberam placebo. A maioria dos indivíduos com insuficiência cardíaca em ambos os estudos tinha comorbidades associadas a um risco aumentado de insuficiência cardíaca. Portanto, o significado clínico dos desequilíbrios numéricos na insuficiência cardíaca é desconhecido. Nenhuma relação causal entre AVODART sozinho ou em combinação com tansulosina e insuficiência cardíaca foi estabelecida. Nenhum desequilíbrio foi observado na incidência geral de eventos adversos cardiovasculares em nenhum dos estudos.
Experiência pós-marketing
As seguintes reações adversas foram identificadas durante o uso pós-aprovação de AVODART. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento. Essas reações foram escolhidas para inclusão devido a uma combinação de sua gravidade, frequência de notificação ou potencial conexão causal com AVODART.
Distúrbios do sistema imunológico
Reações de hipersensibilidade, incluindo erupção cutânea, prurido, urticária, edema localizado, reações cutâneas graves e angioedema.
Neoplasias
Câncer de mama masculino.
Distúrbios psiquiátricos
Humor deprimido.
Distúrbios do sistema reprodutor e da mama
Dor testicular e inchaço testicular.
INTERAÇÕES MEDICAMENTOSAS
Inibidores do Citocromo P450 3A
dutasterida é extensivamente metabolizada em humanos pelas isoenzimas do citocromo P450 (CYP)3A4 e CYP3A5. O efeito de inibidores potentes do CYP3A4 na dutasterida não foi estudado. Devido ao potencial de interações medicamentosas, tenha cuidado ao prescrever AVODART a pacientes que tomam inibidores da enzima CYP3A4 potentes e crônicos (por exemplo, ritonavir) [ver FARMACOLOGIA CLÍNICA ].
Antagonistas alfa-adrenérgicos
A administração de AVODART em combinação com tansulosina ou terazosina não tem efeito sobre a farmacocinética em estado de equilíbrio de nenhum dos antagonistas alfa-adrenérgicos. O efeito da administração de tansulosina ou terazosina nos parâmetros farmacocinéticos da dutasterida não foi avaliado.
Antagonistas dos canais de cálcio
A coadministração de verapamil ou diltiazem diminui a depuração da dutasterida e leva ao aumento da exposição à dutasterida. A alteração na exposição à dutasterida não é considerada clinicamente significativa. Nenhum ajuste de dose é recomendado [ver FARMACOLOGIA CLÍNICA ].
Colestiramina
administração de uma dose única de 5 mg de AVODART 0,5 mg seguida 1 hora depois por 12 g de colestiramina não afeta a biodisponibilidade relativa da dutasterida [ver FARMACOLOGIA CLÍNICA ].
Digoxina
AVODART 0,5 mg não altera a farmacocinética de estado de equilíbrio da digoxina quando administrado concomitantemente na dose de 0,5 mg/dia por 3 semanas [ver FARMACOLOGIA CLÍNICA ].
Varfarina
A administração concomitante de AVODART 0,5 mg/dia por 3 semanas com varfarina não altera a farmacocinética no estado de equilíbrio dos isômeros S ou R-varfarina nem altera o efeito da varfarina no tempo de protrombina [ver FARMACOLOGIA CLÍNICA ].
AVISOS
Incluído como parte do PRECAUÇÕES seção.
PRECAUÇÕES
Efeitos sobre o antígeno específico da próstata (PSA) e o uso do PSA na detecção do câncer de próstata
Em ensaios clínicos, AVODART 0,5 mg reduziu a concentração sérica de PSA em aproximadamente 50% dentro de 3 a 6 meses de tratamento. Essa diminuição foi previsível em toda a faixa de valores de PSA em indivíduos com HBP sintomática, embora possa variar em indivíduos. AVODART 0,5mg também pode causar diminuição do PSA sérico na presença de câncer de próstata. Para interpretar PSAs seriados em homens tomando AVODART 0,5mg, uma nova linha de base de PSA deve ser estabelecida pelo menos 3 meses após o início do tratamento e o PSA monitorado periodicamente a partir de então. Qualquer aumento confirmado do valor de PSA mais baixo durante o tratamento com AVODART pode sinalizar a presença de câncer de próstata e deve ser avaliado, mesmo que os níveis de PSA ainda estejam dentro da faixa normal para homens que não estejam tomando um inibidor da 5 alfa-redutase. A não conformidade com AVODART também pode afetar os resultados do teste de PSA.
Para interpretar um valor de PSA isolado em um homem tratado com AVODART 0,5mg por 3 meses ou mais, o valor de PSA deve ser dobrado para comparação com valores normais em homens não tratados. A proporção de PSA livre total (percentagem de PSA livre) permanece constante, mesmo sob a influência de AVODART. Se os médicos optarem por usar a porcentagem de PSA livre como auxiliar na detecção de câncer de próstata em homens recebendo AVODART, nenhum ajuste em seu valor parece ser necessário.
A coadministração de dutasterida e tansulosina resultou em alterações semelhantes no PSA sérico como monoterapia com dutasterida.
Aumento do risco de câncer de próstata de alto grau
Em homens de 50 a 75 anos com biópsia prévia negativa para câncer de próstata e PSA basal entre 2,5 ng/mL e 10,0 ng/mL tomando AVODART no estudo de 4 anos Redução por Dutasterida de Eventos de Câncer de Próstata (REDUCE), houve uma incidência aumentada de câncer de próstata com pontuação de Gleason 810 em comparação com homens tomando placebo (AVODART 1,0% versus placebo 0,5%) [ver INDICAÇÕES E USO , REAÇÕES ADVERSAS ]. Em um ensaio clínico controlado por placebo de 7 anos com outro inibidor da 5 alfa-redutase (finasterida 5 mg, PROSCAR), foram observados resultados semelhantes para câncer de próstata com pontuação de Gleason 8-10 (finasterida 1,8% versus placebo 1,1%).
Inibidores de 5 alfa-redutase podem aumentar o risco de desenvolvimento de câncer de próstata de alto grau. Não foi estabelecido se o efeito dos inibidores da 5 alfa-redutase na redução do volume da próstata ou fatores relacionados ao estudo impactaram os resultados desses estudos.
Avaliação para outras doenças urológicas
Antes de iniciar o tratamento com AVODART 0,5mg, deve-se considerar outras condições urológicas que possam causar sintomas semelhantes. Além disso, HBP e câncer de próstata podem coexistir.
Exposição transdérmica de AVODART 0,5mg em mulheres grávidas – risco para fetos masculinos
As cápsulas de AVODART não devem ser manuseadas por mulheres grávidas ou que possam estar grávidas. A dutasterida pode ser absorvida através da pele e pode resultar em exposição fetal não intencional e risco potencial para o feto do sexo masculino. Se uma mulher grávida entrar em contato com cápsulas de dutasterida com vazamento, a área de contato deve ser lavada imediatamente com água e sabão [ver Uso em populações específicas ]. A dutasterida pode ser absorvida pela pele com base em estudos em animais [ver Toxicologia não clínica ].
Doação de sangue
Homens em tratamento com AVODART não devem doar sangue até que tenham passado pelo menos 6 meses após a última dose. O objetivo deste período diferido é evitar a administração de dutasterida a uma receptora de transfusão feminina grávida.
Efeito nas características do sêmen
Os efeitos da dutasterida 0,5 mg/dia nas características do sêmen foram avaliados em homens saudáveis ao longo de 52 semanas de tratamento e 24 semanas de acompanhamento pós-tratamento. Às 52 semanas, em comparação com placebo, o tratamento com dutasterida resultou em redução média na contagem total de espermatozóides, volume de sêmen e motilidade espermática; os efeitos na contagem total de espermatozóides não foram reversíveis após 24 semanas de acompanhamento. A concentração de esperma e a morfologia do esperma não foram afetadas e os valores médios para todos os parâmetros do sêmen permaneceram dentro da faixa normal em todos os momentos. O significado clínico do efeito da dutasterida nas características do sêmen para a fertilidade de um paciente individual não é conhecido [ver Uso em populações específicas ].
Informações de Aconselhamento do Paciente
Aconselhe o paciente a ler o rótulo do paciente aprovado pela FDA ( INFORMAÇÃO DO PACIENTE ).
Monitoramento de PSA
Informe os pacientes que AVODART reduz os níveis séricos de PSA em aproximadamente 50% dentro de 3 a 6 meses de terapia, embora possa variar para cada indivíduo. Para pacientes submetidos à triagem de PSA, aumentos nos níveis de PSA durante o tratamento com AVODART podem sinalizar a presença de câncer de próstata e devem ser avaliados por um profissional de saúde [ver AVISOS E PRECAUÇÕES ].
Aumento do risco de câncer de próstata de alto grau
Informar os pacientes que houve um aumento no câncer de próstata de alto grau em homens tratados com inibidores da 5 alfa-redutase (indicados para o tratamento da HBP), incluindo AVODART 0,5mg, em comparação com aqueles tratados com placebo em estudos que analisaram o uso desses medicamentos para reduzir o risco de câncer de próstata [ver INDICAÇÕES E USO , AVISOS E PRECAUÇÕES , REAÇÕES ADVERSAS ].
Exposição transdérmica de AVODART em mulheres grávidas ou potencialmente grávidas – risco para o feto masculino
Informe os pacientes de que AVODART 0,5 mg cápsulas não deve ser manuseado por mulheres grávidas ou que possam estar grávidas devido ao potencial de absorção da dutasterida e ao risco potencial subsequente para o desenvolvimento do feto masculino. A dutasterida pode ser absorvida pela pele e pode resultar em exposição fetal não intencional. Se uma mulher grávida ou potencialmente grávida entrar em contato com cápsulas de AVODART 0,5 mg com vazamento, a área de contato deve ser lavada imediatamente com água e sabão [ver AVISOS E PRECAUÇÕES , Uso em populações específicas ].
Efeitos nos parâmetros do sêmen
Aconselhe os homens que AVODART 0,5 mg pode afetar as características do esperma, mas o efeito sobre a fertilidade é desconhecido [ver AVISOS E PRECAUÇÕES , Uso em populações específicas ].
Doação de sangue
Informar os homens tratados com AVODART 0,5mg que eles não devem doar sangue até pelo menos 6 meses após a última dose para evitar que mulheres grávidas recebam dutasterida por meio de transfusão de sangue [ver AVISOS E PRECAUÇÕES ]. Os níveis séricos de dutasterida são detectáveis por 4 a 6 meses após o término do tratamento [ver FARMACOLOGIA CLÍNICA ].
AVODART é uma marca registrada de propriedade ou licenciada para o grupo de empresas GSK.
As outras marcas listadas são marcas registradas de propriedade ou licenciadas para seus respectivos proprietários e não são de propriedade ou licenciadas para o grupo de empresas GSK. Os fabricantes dessas marcas não são afiliados e não endossam o grupo de empresas GSK ou seus produtos.
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Carcinogênese
Um estudo de carcinogenicidade de 2 anos foi realizado em camundongos B6C3F1 em doses de 3, 35, 250 e 500 mg/kg/dia para machos e 3, 35 e 250 mg/kg/dia para fêmeas; uma incidência aumentada de adenomas hepatocelulares benignos foi observada em 250 mg/kg/dia (290 vezes a MRHD de uma dose diária de 0,5 mg) apenas em camundongos fêmeas. Dois dos 3 principais metabólitos humanos foram detectados em camundongos. A exposição a esses metabólitos em camundongos é menor do que em humanos ou não é conhecida.
Em um estudo de carcinogenicidade de 2 anos em ratos Han Wistar, nas doses de 1,5, 7,5 e 53 mg/kg/dia em machos e 0,8, 6,3 e 15 mg/kg/dia em fêmeas, houve um aumento nas células de Leydig adenomas nos testículos a 135 vezes a MRHD (53 mg/kg/dia e superior). Uma incidência aumentada de hiperplasia das células de Leydig estava presente em 52 vezes a MRHD (doses de ratos machos de 7,5 mg/kg/dia e maiores). Uma correlação positiva entre alterações proliferativas nas células de Leydig e um aumento nos níveis circulantes de hormônio luteinizante foi demonstrada com inibidores da 5 alfa-redutase e é consistente com um efeito no eixo hipotálamo-hipófise-testicular após a inibição da 5-alfa-redutase. Em doses tumorigênicas, os níveis de hormônio luteinizante em ratos foram aumentados em 167%. Neste estudo, os principais metabólitos humanos foram testados quanto à carcinogenicidade em aproximadamente 1 a 3 vezes a exposição clínica esperada.
Mutagênese
dutasterida foi testada para genotoxicidade em um ensaio de mutagênese bacteriana (teste de Ames), um ensaio de aberração cromossômica em células de ovário de hamster chinês e um ensaio de micronúcleo em ratos. Os resultados não indicaram qualquer potencial genotóxico do fármaco original. Dois metabólitos humanos principais também foram negativos no teste de Ames ou em um teste de Ames abreviado.
Prejuízo da Fertilidade
tratamento de ratos machos sexualmente maduros com dutasterida em 0,1 vezes a MRHD (doses animais de 0,05 mg/kg/dia ou mais por até 31 semanas) com base na concentração sérica média resultou em diminuições dependentes da dose e do tempo na fertilidade em todas as doses ; redução da contagem de espermatozóides da cauda epididimal (absoluta), mas não da concentração de espermatozóides (em 50 e 500 mg/kg/dia); pesos reduzidos do epidídimo, próstata e vesículas seminais; e alterações microscópicas (vacuulação citoplasmática do epitélio tubular nos epidídimos e/ou diminuição do conteúdo citoplasmático do epitélio, consistente com diminuição da atividade secretora na próstata e vesículas seminais) nos órgãos reprodutores em todas as doses na ausência de toxicidade paterna. Os efeitos da fertilidade foram revertidos na Semana de Recuperação 6 em todas as doses, e as contagens de esperma foram normais no final de um período de recuperação de 14 semanas. As alterações microscópicas não estavam mais presentes na Semana de Recuperação 14 em 0,1 vezes a MRHD e foram parcialmente recuperadas nos demais grupos de tratamento. Baixos níveis de dutasterida (0,6 a 17 ng/mL) foram detectados no soro de ratas não tratadas acasaladas com machos tratados (10 a 500 mg/kg/dia por 29 a 30 semanas) que são 16 a 110 vezes o MRHD com base em concentração sérica média. Não ocorreu feminização na descendência masculina de ratas não tratadas acasaladas com ratos machos tratados, embora tenham sido observados níveis sanguíneos detectáveis de dutasterida nas ratas.
Em um estudo de fertilidade em ratas com dosagem de 4 semanas antes do acasalamento até o início da gestação, a administração oral de dutasterida em doses de 0,05, 2,5, 12,5 e 30 mg/kg/dia resultou na redução do tamanho da ninhada devido ao aumento das reabsorções e na feminização de fetos do sexo masculino (diminuição da distância anogenital) em 2 a 10 vezes a MRHD (doses animais de 2,5 mg/kg/dia ou mais) com base na concentração sérica média, na presença de toxicidade materna (diminuição do ganho de peso corporal). Os pesos corporais fetais também foram reduzidos em aproximadamente 0,02 vezes a MRHD (dose de rato de 0,05 mg/kg/dia ou superior) com base na concentração sérica média, sem nível de efeito nenhum, na ausência de toxicidade materna.
Uso em populações específicas
Gravidez
Resumo do risco
AVODART 0,5mg é contraindicado para uso na gravidez porque pode causar danos ao feto masculino [ver CONTRA-INDICAÇÕES ]. AVODART não é indicado para uso em mulheres.
AVODART 0,5mg é um inibidor da 5 alfa-redutase que previne a conversão da testosterona em diidrotestosterona (DHT), um hormônio necessário para o desenvolvimento normal da genitália masculina. Anormalidades na genitália de fetos masculinos são uma consequência fisiológica esperada da inibição dessa conversão. Esses resultados são semelhantes às observações em bebês do sexo masculino com deficiência genética de 5 alfa-redutase.
Na população geral dos EUA, o risco de fundo estimado de defeitos congênitos graves e aborto espontâneo em gestações clinicamente reconhecidas é de 2% a 4% e 15% a 20%, respectivamente.
Em estudos de reprodução em animais, a dutasterida inibiu o desenvolvimento normal da genitália externa na prole masculina quando administrada a ratos ou coelhos durante a organogênese em dose inferior à dose humana máxima recomendada (MRHD) de 0,5 mg por dia, na ausência de toxicidade materna. Em 15 vezes a MRHD, gravidez prolongada, diminuição do peso dos órgãos reprodutivos e puberdade tardia na prole masculina foram observadas em ratos, com níveis sem efeito inferiores à MRHD de 0,5 mg por dia. Pesos placentários aumentados em coelhos também foram observados, com níveis sem efeito inferiores ao MRHD de 0,5 mg por dia (ver Dados ).
Embora a dutasterida seja secretada no sêmen humano, a concentração do fármaco na parceira humana é aproximadamente 100 vezes menor do que as concentrações que produzem anormalidades na genitália masculina em estudos com animais (ver Dados ). Em macacos administrados durante a organogênese em concentrações sanguíneas comparáveis ou superiores aos níveis estimados de exposição de uma parceira humana, a genitália externa da prole masculina não foi afetada adversamente. Nenhuma feminização ocorreu na prole masculina de ratas não tratadas acasaladas com ratos machos tratados, embora níveis sanguíneos detectáveis de dutasterida tenham sido observados nas ratas [ver Toxicologia não clínica ].
Dados
Dados humanos
A concentração de sêmen mais alta medida de dutasterida em homens tratados foi de 14 ng/mL. Embora a dutasterida seja detectada no sêmen, assumindo a exposição de uma mulher de 50 kg a 5 mL de sêmen e 100% de absorção, a concentração sanguínea esperada de dutasterida no sêmen seria de cerca de 0,0175 ng/mL. Esta concentração é aproximadamente 100 vezes menor do que as concentrações sanguíneas que produzem anormalidades da genitália masculina em estudos com animais. A dutasterida é altamente ligada às proteínas no sêmen humano (superior a 96%), o que pode reduzir a quantidade de dutasterida disponível para absorção vaginal.
Dados de animais
Em um estudo de desenvolvimento embriofetal em ratos, a administração oral de dutasterida em 10 vezes menos do que a MRHD de 0,5 mg por dia (com base nos níveis sanguíneos médios em homens) resultou na feminização da genitália masculina no feto (diminuição da distância anogenital em 0,05 mg /kg/dia, com ausência de um nível sem efeito) na ausência de toxicidade materna. Além disso, o desenvolvimento do mamilo, hipospádia e glândulas prepuciais distendidas ocorreram em fetos de mães tratadas com doses de 2,5 mg/kg/dia ou mais (aproximadamente 15 vezes a MRHD). Peso corporal fetal reduzido e ossificação retardada associada na presença de toxicidade materna (ganho de peso corporal diminuído) foram observados em exposição materna aproximadamente 15 vezes a MRHD (dose de 2,5 mg/kg/dia ou superior). Um aumento de filhotes natimortos foi observado em mães tratadas com 30 mg/kg/dia (aproximadamente 111 vezes a MRHD), com um nível sem efeito de 12,5 mg/kg/dia.
Em um estudo de desenvolvimento embriofetal de coelho, doses 28 vezes a MRHD (doses de 30 mg/kg/dia ou mais), com base nos níveis sanguíneos médios em homens, foram administradas oralmente nos Dias de Gestação 7 a 29 (durante a organogênese e o final da gestação). período de desenvolvimento da genitália externa). A avaliação histológica da papila genital dos fetos revelou evidências de feminização do feto masculino, bem como ossos do crânio fundidos e aumento do peso da placenta em todas as doses na ausência de toxicidade materna. Um segundo estudo de desenvolvimento embriofetal em coelhos administrado durante toda a gravidez (organogênese e período posterior de desenvolvimento da genitália externa [Dias de gestação 6 a 29]) a 0,3 vezes a MRHD (doses de 0,05 mg/kg/dia ou mais, sem nível de efeito), também produziu evidências de feminização da genitália em fetos masculinos e aumento do peso da placenta em todas as doses na ausência de toxicidade materna.
Em um estudo de desenvolvimento embriofetal, macacas rhesus grávidas foram expostas por via intravenosa durante a organogênese (Dias de gestação 20 a 100) a um nível sanguíneo de dutasterida comparável ou acima da exposição estimada à dutasterida de uma parceira humana. A dutasterida foi administrada nos dias de gestação 20 a 100 (durante a organogênese) em doses de 400, 780, 1.325 ou 2.010 ng/dia (12 macacos/grupo). Não foi observada feminização da genitália externa masculina de descendentes de macacos. A redução do peso das adrenais fetais, a redução do peso da próstata fetal e o aumento do peso dos ovários e testículos fetais foram observados na dose mais alta testada. Com base na concentração de sêmen mais alta medida de dutasterida em homens tratados (14 ng/mL), essas doses no macaco representam até 16 vezes a exposição máxima potencial de uma fêmea humana de 50 kg a 5 mL de sêmen diariamente de uma dutasterida- macho tratado, assumindo 100% de absorção. Os níveis de dose (numa base de ng/kg) administrados a macacos neste estudo são 32 a 186 vezes a dose nominal (ng/kg) à qual uma fêmea seria potencialmente exposta através do sêmen. Não se sabe se coelhos ou macacos rhesus produzem algum dos principais metabólitos humanos.
Em um estudo de desenvolvimento oral pré e pós-natal em ratos, observou-se feminização da genitália masculina. A distância anogenital diminuída foi observada em 0,05 vezes a MRHD e superior (0,05 mg/kg/dia e superior), com ausência de um nível sem efeito, com base nos níveis sanguíneos médios em homens como uma estimativa da AUC. Hipospádia e desenvolvimento do mamilo foram observados em 2,5 mg/kg/dia ou mais (14 vezes a MRHD ou mais, com um nível sem efeito de 0,05 mg/kg/dia). Doses de 2,5 mg/kg/dia e maiores também resultaram em gestação prolongada nas fêmeas parentais, aumento no tempo de separação balano-prepucial na prole masculina, diminuição no tempo de permeabilidade vaginal para prole feminina e diminuição na próstata e peso das vesículas seminais na prole masculina. Aumento de natimortos e diminuição da viabilidade neonatal na prole foram observados em 30 mg/kg/dia (102 vezes o MRHD na presença de toxicidade materna [diminuição do peso corporal]).
Lactação
Resumo do risco
AVODART não é indicado para uso em mulheres. Não há informações disponíveis sobre a presença de dutasterida no leite humano, os efeitos na criança amamentada ou os efeitos na produção de leite.
Fêmeas e Machos com Potencial Reprodutivo
Infertilidade
Machos
Os efeitos da dutasterida 0,5 mg/dia nas características do sêmen foram avaliados em voluntários normais com idades entre 18 e 52 anos (n = 27 dutasterida, n = 23 placebo) ao longo de 52 semanas de tratamento e 24 semanas de acompanhamento pós-tratamento. Às 52 semanas, as reduções percentuais médias da linha de base na contagem total de espermatozóides, volume de sêmen e motilidade dos espermatozóides foram de 23%, 26% e 18%, respectivamente, no grupo dutasterida quando ajustadas para alterações da linha de base no grupo placebo. A concentração espermática e a morfologia espermática não foram afetadas. Após 24 semanas de acompanhamento, a alteração percentual média na contagem total de espermatozóides no grupo dutasterida permaneceu 23% menor do que a linha de base. Enquanto os valores médios para todos os parâmetros de sêmen em todos os pontos de tempo permaneceram dentro dos intervalos normais e não atenderam aos critérios predefinidos para uma alteração clinicamente significativa (30%), 2 indivíduos no grupo da dutasterida tiveram diminuições na contagem de esperma de mais de 90% em relação à linha de base em 52 semanas, com recuperação parcial no seguimento de 24 semanas. O significado clínico do efeito da dutasterida nas características do sêmen para a fertilidade de um paciente individual não é conhecido [ver AVISOS E PRECAUÇÕES ].
Uso Pediátrico
AVODART 0,5mg não é indicado para uso em pacientes pediátricos. A segurança e eficácia em pacientes pediátricos não foram estabelecidas.
Uso Geriátrico
Dos 2.167 indivíduos do sexo masculino tratados com AVODART 0,5 mg em 3 ensaios clínicos, 60% tinham 65 anos ou mais e 15% tinham 75 anos ou mais. Não foram observadas diferenças globais na segurança ou eficácia entre estes indivíduos e indivíduos mais jovens. Outras experiências clínicas relatadas não identificaram diferenças nas respostas entre idosos e pacientes mais jovens, mas a maior sensibilidade de alguns indivíduos mais velhos não pode ser descartada [ver FARMACOLOGIA CLÍNICA ].
Insuficiência renal
Não é necessário ajuste de dose para AVODART 0,5mg em pacientes com insuficiência renal [ver FARMACOLOGIA CLÍNICA ].
Insuficiência hepática
efeito da insuficiência hepática na farmacocinética da dutasterida não foi estudado. Como a dutasterida é extensivamente metabolizada, a exposição pode ser maior em pacientes com insuficiência hepática. No entanto, em um ensaio clínico em que 60 indivíduos receberam 5 mg (10 vezes a dose terapêutica) diariamente por 24 semanas, nenhum evento adverso adicional foi observado em comparação com aqueles observados na dose terapêutica de 0,5 mg [ver FARMACOLOGIA CLÍNICA ].
SOBREDOSAGEM
Em ensaios voluntários, doses únicas de dutasterida de até 40 mg (80 vezes a dose terapêutica) por 7 dias foram administradas sem preocupações significativas de segurança. Em um ensaio clínico, doses diárias de 5 mg (10 vezes a dose terapêutica) foram administradas a 60 indivíduos por 6 meses sem efeitos adversos adicionais aos observados em doses terapêuticas de 0,5 mg.
Não há antídoto específico para a dutasterida. Portanto, em casos de suspeita de superdosagem, o tratamento sintomático e de suporte deve ser administrado conforme apropriado, levando em consideração a longa meia-vida da dutasterida.
CONTRA-INDICAÇÕES
AVODART 0,5mg é contraindicado para uso em:

- Gravidez. O uso de dutasterida é contraindicado em mulheres grávidas. Em estudos de reprodução animal e toxicidade de desenvolvimento, a dutasterida inibiu o desenvolvimento da genitália externa de fetos masculinos. Portanto, AVODART 0,5mg pode causar dano fetal quando administrado a uma mulher grávida [ver AVISOS E PRECAUÇÕES , Uso em populações específicas ].
- Pacientes com hipersensibilidade clinicamente significativa previamente demonstrada (por exemplo, reações cutâneas graves, angioedema) ao AVODART ou a outros inibidores da 5 alfa-redutase REAÇÕES ADVERSAS ].
FARMACOLOGIA CLÍNICA
Mecanismo de ação
A dutasterida inibe a conversão da testosterona em DHT. DHT é o principal andrógeno responsável pelo desenvolvimento inicial e subsequente aumento da próstata. A testosterona é convertida em DHT pela enzima 5 alfa-redutase, que existe como 2 isoformas, tipo 1 e tipo 2. A isoenzima tipo 2 é primariamente ativa nos tecidos reprodutivos, enquanto a isoenzima tipo 1 também é responsável pela conversão da testosterona nos pele e fígado.
dutasterida é um inibidor competitivo e específico das isoenzimas 5 alfa-redutase tipo 1 e tipo 2, com as quais forma um complexo enzimático estável. A dissociação deste complexo foi avaliada em condições in vitro e in vivo e é extremamente lenta. A dutasterida não se liga ao receptor androgênico humano.
Farmacodinâmica
Efeito sobre 5 alfa-diidrotestosterona e testosterona
O efeito máximo de doses diárias de dutasterida na redução de DHT é dose-dependente e é observado em 1 a 2 semanas. Após 1 e 2 semanas de administração diária de 0,5 mg de dutasterida, as concentrações séricas medianas de DHT foram reduzidas em 85% e 90%, respectivamente. Em pacientes com HPB tratados com dutasterida 0,5 mg/dia por 4 anos, a diminuição mediana da DHT sérica foi de 94% em 1 ano, 93% em 2 anos e 95% em 3 e 4 anos. O aumento médio da testosterona sérica foi de 19% em 1 e 2 anos, 26% em 3 anos e 22% em 4 anos, mas os níveis médios e medianos permaneceram dentro da faixa fisiológica.
Em pacientes com HBP tratados com 5 mg/dia de dutasterida ou placebo por até 12 semanas antes da ressecção transuretral da próstata, as concentrações médias de DHT no tecido prostático foram significativamente menores no grupo dutasterida em comparação com placebo (784 e 5.793 pg/g , respectivamente, P
Homens adultos com deficiência de 5 alfa-redutase herdada geneticamente também têm níveis reduzidos de DHT. Esses machos deficientes em 5 alfa-redutase têm uma pequena próstata ao longo da vida e não desenvolvem HBP. Exceto pelos defeitos urogenitais associados presentes ao nascimento, nenhuma outra anormalidade clínica relacionada à deficiência de 5 alfa-redutase foi observada nesses indivíduos.
Efeitos sobre outros hormônios
Em voluntários saudáveis, 52 semanas de tratamento com dutasterida 0,5 mg/dia (n = 26) não resultou em alteração clinicamente significativa em comparação com placebo (n = 23) na globulina de ligação aos hormônios sexuais, estradiol, hormônio luteinizante, hormônio folículo-estimulante, tiroxina (T4 livre) e desidroepiandrosterona. Aumentos médios estatisticamente significativos ajustados na linha de base em comparação com placebo foram observados para testosterona total em 8 semanas (97,1 ng/dL, P
Outros efeitos
painel lipídico plasmático e a densidade mineral óssea foram avaliados após 52 semanas de dutasterida 0,5 mg uma vez ao dia em voluntários saudáveis. Não houve alteração na densidade mineral óssea medida por absorciometria de raios-x de dupla energia em comparação com placebo ou linha de base. Além disso, o perfil lipídico plasmático (isto é, colesterol total, lipoproteínas de baixa densidade, lipoproteínas de alta densidade, triglicerídeos) não foi afetado pela dutasterida. Não foram observadas alterações clinicamente significativas nas respostas do hormônio adrenal à estimulação do hormônio adrenocorticotrófico (ACTH) em uma população de subconjunto (n = 13) do estudo voluntário saudável de 1 ano.
Farmacocinética
Absorção
Após a administração de uma dose única de 0,5 mg de uma cápsula de gelatina mole, o tempo para atingir o pico das concentrações séricas (Tmax) da dutasterida ocorre dentro de 2 a 3 horas. A biodisponibilidade absoluta em 5 indivíduos saudáveis é de aproximadamente 60% (intervalo: 40% a 94%). Quando o medicamento é administrado com alimentos, as concentrações séricas máximas foram reduzidas em 10% a 15%. Esta redução não tem significado clínico.
Distribuição
Os dados farmacocinéticos após doses orais únicas e repetidas mostram que a dutasterida tem um grande volume de distribuição (300 a 500 L). A dutasterida liga-se fortemente à albumina plasmática (99,0%) e à glicoproteína ácida alfa-1 (96,6%).
Em um estudo de indivíduos saudáveis (n = 26) recebendo dutasterida 0,5 mg/dia por 12 meses, as concentrações de dutasterida no sêmen foram em média de 3,4 ng/mL (intervalo: 0,4 a 14 ng/mL) em 12 meses e, semelhante ao soro, atingiram -estado concentrações em 6 meses. Em média, aos 12 meses, 11,5% das concentrações séricas de dutasterida foram divididas em sêmen.
Metabolismo e eliminação
dutasterida é extensivamente metabolizada em humanos. Estudos in vitro mostraram que a dutasterida é metabolizada pelas isoenzimas CYP3A4 e CYP3A5. Ambas as isoenzimas produziram os metabólitos 4'-hidroxidutasterida, 6-hidroxidutasterida e 6,4'-diidroxidutasterida. Além disso, o metabólito 15-hidroxidutasterida foi formado pelo CYP3A4. A dutasterida não é metabolizada in vitro pelas isoenzimas humanas do citocromo P450 CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 e CYP2E1. No soro humano após dosagem até o estado de equilíbrio, dutasterida inalterada, 3 metabólitos principais (4'-hidroxidutasterida, 1,2-di-hidrodutasterida e 6-hidroxidutasterida) e 2 metabólitos menores (6,4'-di-hidroxidutasterida e 15 -hidroxidutasterida), conforme avaliado pela resposta espectrométrica de massa, foram detectados. A estereoquímica absoluta das adições de hidroxila nas posições 6 e 15 não é conhecida. In vitro, os metabólitos 4'-hidroxidutasterida e 1,2-dihidrodutasterida são muito menos potentes do que a dutasterida contra ambas as isoformas da 5 alfa-redutase humana. A atividade da 6β-hidroxidutasterida é comparável à da dutasterida.
dutasterida e seus metabólitos foram excretados principalmente nas fezes. Como porcentagem da dose, havia aproximadamente 5% de dutasterida inalterada (~1% a ~15%) e 40% como metabólitos relacionados à dutasterida (~2% a ~90%). Apenas vestígios de dutasterida inalterada foram encontrados na urina (
A meia-vida de eliminação terminal da dutasterida é de aproximadamente 5 semanas no estado de equilíbrio. A concentração média de dutasterida sérica no estado de equilíbrio foi de 40 ng/mL após 0,5 mg/dia por 1 ano. Após a administração diária, as concentrações séricas de dutasterida atingem 65% da concentração no estado de equilíbrio após 1 mês e aproximadamente 90% após 3 meses. Devido à longa meia-vida da dutasterida, as concentrações séricas permanecem detectáveis (superiores a 0,1 ng/mL) por até 4 a 6 meses após a descontinuação do tratamento.
Populações Específicas
Pacientes pediátricos
A farmacocinética da dutasterida não foi investigada em indivíduos com menos de 18 anos.
Pacientes Geriátricos
Não é necessário ajuste de dose em idosos. A farmacocinética e a farmacodinâmica da dutasterida foram avaliadas em 36 indivíduos saudáveis do sexo masculino com idades entre 24 e 87 anos após a administração de uma dose única de 5 mg de dutasterida. Neste estudo de dose única, a meia-vida da dutasterida aumentou com a idade (aproximadamente 170 horas em homens de 20 a 49 anos, aproximadamente 260 horas em homens de 50 a 69 anos e aproximadamente 300 horas em homens com mais de 70 anos). Dos 2.167 homens tratados com dutasterida nos 3 ensaios principais, 60% tinham 65 anos ou mais e 15% tinham 75 anos ou mais. Nenhuma diferença geral na segurança ou eficácia foi observada entre esses pacientes e pacientes mais jovens.
Pacientes Masculinos e Femininos
AVODART é contraindicado na gravidez e não é indicado para uso em mulheres [ver CONTRA-INDICAÇÕES , AVISOS E PRECAUÇÕES ]. A farmacocinética da dutasterida em mulheres não foi estudada.
Grupos raciais e étnicos
O efeito da raça na farmacocinética da dutasterida não foi estudado.
Pacientes com Insuficiência Renal
efeito da insuficiência renal na farmacocinética da dutasterida não foi estudado. No entanto, menos de 0,1% de uma dose de 0,5 mg de dutasterida no estado de equilíbrio é recuperada na urina humana, portanto, nenhum ajuste de dose é esperado para pacientes com insuficiência renal.
Pacientes com Insuficiência Hepática
O efeito da insuficiência hepática na farmacocinética da dutasterida não foi estudado. Como a dutasterida é extensivamente metabolizada, a exposição pode ser maior em pacientes com insuficiência hepática.
Estudos de interação medicamentosa
Inibidores do Citocromo P450
Não foram realizados ensaios clínicos de interação medicamentosa para avaliar o impacto dos inibidores da enzima CYP3A na farmacocinética da dutasterida. No entanto, com base em dados in vitro, as concentrações sanguíneas de dutasterida podem aumentar na presença de inibidores do CYP3A4/5, como ritonavir, cetoconazol, verapamil, diltiazem, cimetidina, troleandomicina e ciprofloxacina.
dutasterida não inibe o metabolismo in vitro de substratos modelo para as principais isoenzimas do citocromo P450 humano (CYP1A2, CYP2C9, CYP2C19, CYP2D6 e CYP3A4) em uma concentração de 1.000 ng/mL, 25 vezes maior do que as concentrações séricas em estado de equilíbrio em humanos .
Antagonistas alfa-adrenérgicos
Em um estudo cruzado de sequência única em voluntários saudáveis, a administração de tansulosina ou terazosina em combinação com AVODART não teve efeito sobre a farmacocinética em estado de equilíbrio de nenhum dos antagonistas alfa-adrenérgicos. Embora o efeito da administração de tansulosina ou terazosina nos parâmetros farmacocinéticos da dutasterida não tenha sido avaliado, a alteração percentual nas concentrações de DHT foi semelhante para AVODART 0,5 mg isolado em comparação com o tratamento combinado.
Antagonistas dos canais de cálcio
Em uma análise de farmacocinética populacional, observou-se uma diminuição na depuração da dutasterida quando coadministrada com os inibidores da CYP3A4 verapamil (-37%, n = 6) e diltiazem (-44%, n = 5). Em contraste, nenhuma diminuição na depuração foi observada quando amlodipina, outro antagonista do canal de cálcio que não é um inibidor do CYP3A4, foi coadministrado com dutasterida (+7%, n = 4).
A diminuição da depuração e o subsequente aumento da exposição à dutasterida na presença de verapamil e diltiazem não são considerados clinicamente significativos. Nenhum ajuste de dose é recomendado.
Colestiramina
A administração de uma dose única de 5 mg de AVODART 0,5 mg seguida 1 hora depois de 12 g de colestiramina não afetou a biodisponibilidade relativa da dutasterida em 12 voluntários normais.
Digoxina
Em um estudo com 20 voluntários saudáveis, AVODART 0,5 mg não alterou a farmacocinética em estado de equilíbrio da digoxina quando administrado concomitantemente na dose de 0,5 mg/dia por 3 semanas.
Varfarina
Em um estudo com 23 voluntários saudáveis, 3 semanas de tratamento com AVODART 0,5 mg/dia não alteraram a farmacocinética em estado de equilíbrio dos isômeros S- ou R-varfarina ou alteraram o efeito da varfarina no tempo de protrombina quando administrado com varfarina.
Outra terapia concomitante
Embora não tenham sido realizados ensaios de interação específicos com outros compostos, aproximadamente 90% dos indivíduos nos 3 ensaios de segurança e eficácia randomizados, duplo-cegos e controlados por placebo que receberam AVODART estavam tomando outros medicamentos concomitantemente. Nenhuma interação adversa clinicamente significativa pode ser atribuída à combinação de AVODART e terapia concomitante quando AVODART foi coadministrado com anti-hiperlipidêmicos, inibidores da enzima conversora de angiotensina (ECA), agentes bloqueadores beta-adrenérgicos, bloqueadores dos canais de cálcio, corticosteroides, diuréticos, antiesteroides -medicamentos inflamatórios (AINEs), inibidores da fosfodiesterase tipo V e antibióticos quinolonas.
Toxicologia e/ou Farmacologia Animal
Estudos de toxicologia do sistema nervoso central
Em ratos e cães, a administração oral repetida de dutasterida resultou em alguns animais apresentando sinais de toxicidade não específica, reversível, mediada centralmente sem alterações histopatológicas associadas em exposições 425 e 315 vezes a exposição clínica esperada (do medicamento original), respectivamente. .
Absorção Dérmica de Coelho
Em um estudo de farmacocinética dérmica em coelhos, a absorção dérmica de dutasterida em CAPMUL (oleato de glicerila) em coelhos resultou em concentrações séricas de 2,7 a 40,5 mcg/h/mL para doses de 1 a 20 mg/mL, respectivamente, ou 56% a 100% da dutasterida aplicada seja absorvida em condições ocluídas e prolongadas. As cápsulas de gelatina mole de AVODART administradas por via oral contêm 0,5 mg de dutasterida dissolvida em uma mistura de mono-diglicerídeos de ácido caprílico/cáprico e hidroxitolueno butilado. A dutasterida em água foi minimamente absorvida em coelhos (2.000 mg/kg).
Estudos clínicos
Monoterapia
AVODART 0,5 mg/dia (n = 2.167) ou placebo (n = 2.158) foi avaliado em indivíduos do sexo masculino com HBP em três estudos multicêntricos de 2 anos, controlados por placebo, duplo-cegos, cada um com extensões abertas de 2 anos ( n = 2.340). Mais de 90% da população do estudo era branca. Os indivíduos tinham pelo menos 50 anos de idade com PSA sérico ≥1,5 ng/mL e
Efeito nas pontuações de sintomas
Os sintomas foram quantificados usando o AUA-SI, um questionário que avalia os sintomas urinários (esvaziamento incompleto, frequência, intermitência, urgência, jato fraco, esforço e noctúria) por classificação em uma escala de 0 a 5 para uma pontuação total possível de 35, com maiores pontuações numéricas de sintomas totais representando maior gravidade dos sintomas. A pontuação inicial do AUA-SI nos 3 ensaios foi de aproximadamente 17 unidades em ambos os grupos de tratamento.
Os indivíduos que receberam dutasterida alcançaram melhora estatisticamente significativa nos sintomas em relação ao placebo no mês 3 em 1 estudo e no mês 12 nos outros 2 estudos principais. No mês 12, a diminuição média da linha de base nos escores totais de sintomas AUA-SI nos 3 estudos agrupados foi de -3,3 unidades para dutasterida e -2,0 unidades para placebo, com uma diferença média entre os 2 grupos de tratamento de -1,3 (intervalo: -1,1 para -1,5 unidades em cada um dos 3 ensaios, P
Esses estudos foram projetados prospectivamente para avaliar os efeitos nos sintomas com base no tamanho da próstata no início do estudo. Em homens com volumes de próstata ≥40 cc, a diminuição média foi de -3,8 unidades para dutasterida e -1,6 unidades para placebo, com uma diferença média entre os 2 grupos de tratamento de -2,2 no mês 24. Em homens com volumes de próstata
Figura 1: Mudança na pontuação AUA-SI da linha de base (ensaios randomizados, duplo-cegos, controlados por placebo agrupados)
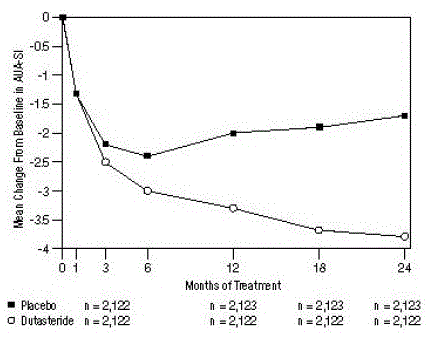
uma pontuação AUA-SI varia de 0 a 35.
Efeito na retenção urinária aguda e na necessidade de cirurgia relacionada à HBP
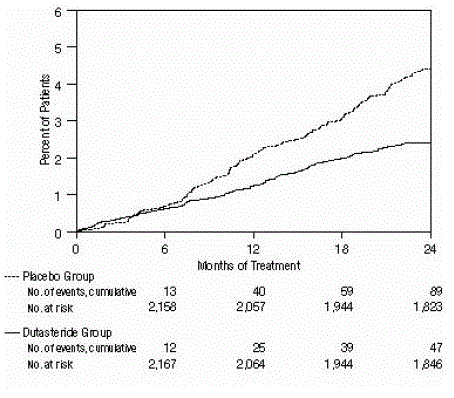
eficácia também foi avaliada após 2 anos de tratamento pela incidência de AUR exigindo cateterismo e intervenção cirúrgica urológica relacionada à HBP. Comparado com placebo, AVODART foi associado a uma incidência estatisticamente significativamente menor de AUR (1,8% para AVODART versus 4,2% para placebo, P
Figura 2: Porcentagem de indivíduos que desenvolvem retenção urinária aguda em um período de 24 meses (ensaios randomizados, duplo-cegos e controlados por placebo agrupados)
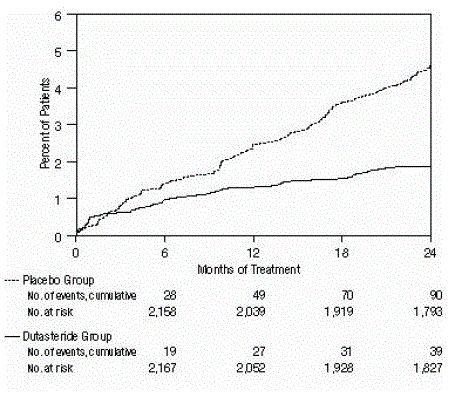
Figura 3: Porcentagem de indivíduos submetidos a cirurgia para hiperplasia prostática benigna durante um período de 24 meses (ensaios randomizados, duplo-cegos e controlados por placebo agrupados)
Efeito no volume da próstata
Um volume de próstata de pelo menos 30 cc medido por ultra-som transretal foi necessário para a entrada no estudo. O volume médio da próstata na entrada do estudo foi de aproximadamente 54 cc.
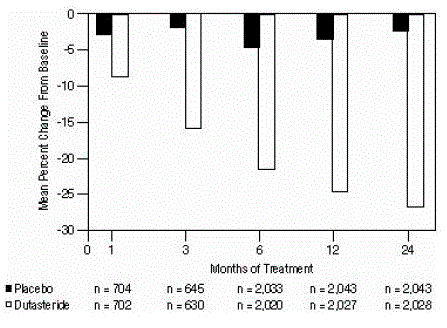
Diferenças estatisticamente significativas (AVODART 0,5 mg versus placebo) foram observadas na primeira medição do volume da próstata pós-tratamento em cada estudo (Mês 1, Mês 3 ou Mês 6) e continuaram até o Mês 24. No Mês 12, a alteração percentual média em o volume da próstata nos 3 estudos agrupados foi de -24,7% para dutasterida e -3,4% para placebo; a diferença média (dutasterida menos placebo) foi de -21,3% (intervalo: -21,0% a -21,6% em cada um dos 3 ensaios, P
Figura 4: Alteração percentual do volume da próstata desde a linha de base (ensaios randomizados, duplo-cegos, controlados por placebo agrupados)
Efeito na taxa máxima de fluxo de urina
Um pico de fluxo urinário médio (Qmax) de ≤ 15 mL/s foi necessário para a entrada no estudo. Qmax foi de aproximadamente 10 mL/s na linha de base nos 3 ensaios principais.
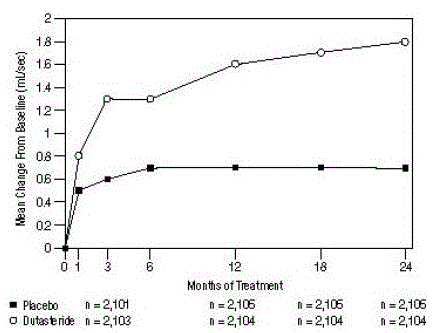
As diferenças entre os 2 grupos foram estatisticamente significativas desde a linha de base no Mês 3 em todos os 3 estudos e foram mantidas até o Mês 12. No Mês 12, o aumento médio no Qmax nos 3 estudos agrupados foi de 1,6 mL/s para AVODART 0,5 mg e 0,7 mL /seg para placebo; a diferença média (dutasterida menos placebo) foi de 0,8 mL/s (intervalo: 0,7 a 1,0 mL/s em cada um dos 3 ensaios, P
Figura 5: Alteração do Qmax desde a linha de base (ensaios aleatórios, duplo-cegos e controlados por placebo agrupados)
Resumo de Ensaios Clínicos
Dados de 3 estudos de eficácia grandes e bem controlados demonstram que o tratamento com AVODART (0,5 mg uma vez ao dia) reduz o risco de intervenção cirúrgica relacionada ao AUR e HBP em relação ao placebo, melhora os sintomas relacionados à HBP, diminui o volume da próstata e aumenta o máximo taxas de fluxo urinário. Esses dados sugerem que AVODART 0,5mg interrompe o processo de doença da HBP em homens com próstata aumentada.
Combinação com terapia alfa-bloqueadora (CombAT)
eficácia da terapia combinada (AVODART 0,5 mg/dia mais tansulosina 0,4 mg/dia, n = 1.610) foi comparada com AVODART 0,5 mg isoladamente (n = 1.623) ou tansulosina sozinha (n = 1.611) em um estudo multicêntrico de 4 anos, randomizado , ensaio duplo-cego. Os critérios de entrada no estudo foram semelhantes aos estudos duplo-cegos de eficácia da monoterapia controlados por placebo descritos na Seção 14.1. Oitenta e oito por cento (88%) da população do estudo inscrito era branca. Aproximadamente 52% dos indivíduos tiveram exposição prévia a tratamento com inibidor da 5 alfa-redutase ou antagonista alfa-adrenérgico. Dos 4.844 indivíduos aleatoriamente designados para receber tratamento, 69% dos indivíduos no grupo de combinação, 67% no grupo que recebeu AVODART 0,5mg e 61% no grupo de tansulosina completaram 4 anos de tratamento duplo-cego.
Efeito na pontuação dos sintomas
Os sintomas foram quantificados usando as primeiras 7 questões do International Prostate Symptom Score (IPSS) (idêntico ao AUA-SI). A pontuação inicial foi de aproximadamente 16,4 unidades para cada grupo de tratamento. A terapia de combinação foi estatisticamente superior a cada um dos tratamentos de monoterapia na diminuição da pontuação de sintomas no mês 24, o ponto de tempo primário para este desfecho. No mês 24, as alterações médias da linha de base (± SD) nos escores de sintomas totais do IPSS foram -6,2 (± 7,14) para combinação, -4,9 (± 6,81) para AVODART e -4,3 (± 7,01) para tansulosina, com uma diferença média entre a combinação e AVODART 0,5 mg de -1,3 unidades (P
Figura 6: Mudança na pontuação dos sintomas da próstata internacional desde a linha de base ao longo de um período de 48 meses (ensaio randomizado, duplo-cego, grupo paralelo [ensaio CombAT])
![International Prostate Symptom Score Change from Baseline over a 48Month Period (Randomized, Double-blind, Parallel-Group Trial [CombAT Trial]) - Illustration](/pics/1d4858abd0b69848c0ed84983f4ffbee.jpg)
Efeito na retenção urinária aguda ou na necessidade de cirurgia relacionada à HBP
Após 4 anos de tratamento, a terapia combinada com AVODART 0,5mg e tansulosina não trouxe benefícios em relação à monoterapia com AVODART na redução da incidência de AUR ou cirurgia relacionada à HPB.
Efeito na taxa máxima de fluxo de urina
Qmax inicial foi de aproximadamente 10,7 mL/seg para cada grupo de tratamento. A terapia de combinação foi estatisticamente superior a cada um dos tratamentos de monoterapia no aumento de Qmax no mês 24, o ponto de tempo primário para este desfecho. No mês 24, os aumentos médios da linha de base (±SD) em Qmax foram 2,4 (±5,26) mL/s para combinação, 1,9 (±5,10) mL/s para AVODART 0,5mg e 0,9 (±4,57) mL/s para tansulosina, com uma diferença média entre a combinação e AVODART de 0,5 mL/s (P = 0,003; [IC 95%: 0,17, 0,84]), e entre a combinação e tansulosina de 1,5 mL/s (P
A melhora adicional no Qmax da terapia combinada em relação à monoterapia com AVODART 0,5 mg não foi mais estatisticamente significativa no mês 48.
Figura 7: Alteração do Qmax da linha de base ao longo de um período de 24 meses (ensaio aleatório, duplo-cego, grupo paralelo [ensaio CombAT])
![Qmax Change from Baseline over a 24-Month Period (Randomized, Double-blind, Parallel-Group Trial [CombAT Trial]) - Illustration](/pics/48d39a4a221330dda7285960578ebc0a.jpg)
Efeito no volume da próstata
volume médio da próstata na entrada do estudo foi de aproximadamente 55 cc. No mês 24, o ponto de tempo primário para este desfecho, as alterações percentuais médias da linha de base (±SD) no volume da próstata foram -26,9% (±22,57) para terapia combinada, -28,0% (±24,88) para AVODART 0,5mg e 0% (±31,14) para tansulosina, com uma diferença média entre a combinação e AVODART 0,5mg de 1,1% (P = NS; [IC 95%: -0,6, 2,8]), e entre a combinação e tansulosina de -26,9% (P
INFORMAÇÃO DO PACIENTE
AVODART (av o dart) (dutasterida) cápsulas
AVODART 0,5mg é para uso apenas por homens.
Leia estas informações do paciente antes de começar a tomar AVODART 0,5 mg e sempre que receber uma recarga. Pode haver novas informações. Esta informação não substitui a conversa com seu médico sobre sua condição médica ou seu tratamento.
que é Avodart 0,5mg?
AVODART 0,5mg é um medicamento de prescrição que contém dutasterida. AVODART 0,5 mg é usado para tratar os sintomas da hiperplasia prostática benigna (HPB) em homens com próstata aumentada para:
- melhorar os sintomas,
- reduzir o risco de retenção urinária aguda (bloqueio completo do fluxo de urina),
- reduzir o risco da necessidade de cirurgia relacionada à HBP.
Quem NÃO deve tomar AVODART?
Não tome AVODART se você for:
- grávida ou pode engravidar. AVODART 0,5 mg pode prejudicar o feto. As mulheres grávidas não devem tocar nas cápsulas de AVODART. Se uma mulher grávida de um bebê do sexo masculino receber AVODART 0,5 mg suficiente em seu corpo ao engolir ou tocar em AVODART, o bebê do sexo masculino pode nascer com órgãos sexuais que não são normais. Se uma mulher grávida ou com potencial para engravidar entrar em contacto com cápsulas de AVODART 0,5 mg com fuga, a área de contacto deve ser lavada imediatamente com água e sabão.
- uma criança ou um adolescente.
- alérgico à dutasterida ou a qualquer um dos ingredientes de AVODART. Consulte o final deste folheto para obter uma lista completa dos ingredientes de AVODART.
- alérgico a outros inibidores da 5 alfa-redutase, por exemplo, PROSCAR (finasterida) ® comprimidos.
O que devo dizer ao meu médico antes de tomar AVODART 0,5 mg?
Antes de tomar AVODART 0,5 mg, informe o seu médico se:
- tem problemas de fígado
Informe o seu médico sobre todos os medicamentos que você toma, incluindo medicamentos prescritos e não prescritos, vitaminas e suplementos de ervas. AVODART e outros medicamentos podem afetar um ao outro, causando efeitos colaterais. AVODART 0,5 mg pode afetar a forma como outros medicamentos funcionam, e outros medicamentos podem afetar a forma como AVODART 0,5 mg funciona.
Conheça os medicamentos que você toma. Mantenha uma lista deles para mostrar ao seu médico e farmacêutico quando receber um novo medicamento.
Como devo tomar AVODART?
- Tome 1 cápsula de AVODART uma vez ao dia.
- Engula as cápsulas de AVODART 0,5mg inteiras. Não esmague, mastigue ou abra as cápsulas de AVODART 0,5mg porque o conteúdo da cápsula pode irritar seus lábios, boca ou garganta.
- Você pode tomar AVODART 0,5 mg com ou sem alimentos.
- Se você perder uma dose, você pode tomá-la mais tarde naquele dia. Não compense a dose esquecida tomando 2 doses no dia seguinte.
O que devo evitar ao tomar AVODART 0,5mg?
- Não deve doar sangue enquanto estiver a tomar AVODART ou durante 6 meses após ter parado AVODART. Isso é importante para evitar que mulheres grávidas recebam AVODART por meio de transfusões de sangue.
Quais são os possíveis efeitos colaterais do AVODART?
AVODART pode causar efeitos colaterais graves, incluindo:
- Reações alérgicas raras e graves, incluindo:
- inchaço do rosto, língua ou garganta
- reações cutâneas graves, como descamação da pele
Obtenha ajuda médica imediatamente se tiver essas reações alérgicas graves.
- Maior chance de uma forma mais grave de câncer de próstata.
Os efeitos colaterais mais comuns de AVODART incluem:
- dificuldade em obter ou manter uma ereção (impotência)*
- uma diminuição do desejo sexual (libido)*
- problemas de ejaculação*
- seios aumentados ou doloridos. Se você notar nódulos mamários ou secreção no mamilo, converse com seu médico.
*Alguns desses eventos podem continuar após você parar de tomar AVODART.
Humor deprimido foi relatado em pacientes recebendo AVODART.
AVODART 0,5mg demonstrou reduzir a contagem de espermatozóides, o volume de sêmen e o movimento dos espermatozóides. No entanto, o efeito de AVODART 0,5 mg na fertilidade masculina não é conhecido.
Teste de Antígeno Específico da Próstata (PSA): seu médico pode avaliá-lo para outros problemas de próstata, incluindo câncer de próstata antes de começar e enquanto estiver tomando AVODART. Um exame de sangue chamado PSA (antígeno específico da próstata) às vezes é usado para ver se você pode ter câncer de próstata. AVODART irá reduzir a quantidade de PSA medida no seu sangue. Seu médico está ciente desse efeito e ainda pode usar o PSA para ver se você pode ter câncer de próstata. Aumentos nos níveis de PSA durante o tratamento com AVODART (mesmo que os níveis de PSA estejam na faixa normal) devem ser avaliados pelo seu médico.
Informe o seu médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os efeitos colaterais possíveis com AVODART. Para mais informações, pergunte ao seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA pelo telefone 1-800-FDA-1088.
Como devo armazenar AVODART 0,5mg?
- Armazene as cápsulas de AVODART 0,5mg em temperatura ambiente (59°F a 86°F ou 15°C a 30°C).
- As cápsulas de AVODART 0,5mg podem ficar deformadas e/ou descoloridas se mantidas em altas temperaturas.
- Não use AVODART 0,5 mg se suas cápsulas estiverem deformadas, descoloridas ou vazando.
- Jogue fora com segurança os medicamentos que não são mais necessários.
Mantenha AVODART 0,5mg e todos os medicamentos fora do alcance das crianças.
Às vezes, os medicamentos são prescritos para outros fins que não os listados em um folheto do paciente. Não use AVODART 0,5mg para uma condição para a qual não foi prescrito. Não dê AVODART a outras pessoas, mesmo que tenham os mesmos sintomas que você. Pode prejudicá-los.
Este folheto informativo do paciente resume as informações mais importantes sobre AVODART. Se você quiser mais informações, converse com seu médico. Você pode pedir ao seu farmacêutico ou profissional de saúde informações sobre AVODART 0,5 mg que são escritas para profissionais de saúde.
Para obter mais informações, acesse www.AVODART.com ou ligue para 1-888-825-5249.
Quais são os ingredientes de AVODART 0,5mg?
Ingrediente ativo: dutasterida.
Ingredientes inativos : hidroxitolueno butilado, óxido férrico (amarelo), gelatina (de fontes bovinas certificadas sem BSE), glicerina, mono-diglicerídeos de ácido caprílico/cáprico, dióxido de titânio e tinta vermelha comestível.
Como o AVODART funciona?
O crescimento da próstata é causado por um hormônio no sangue chamado diidrotestosterona (DHT). AVODART reduz a produção de DHT no corpo, levando ao encolhimento da próstata aumentada na maioria dos homens. Embora alguns homens tenham menos problemas e sintomas após 3 meses de tratamento com AVODART, geralmente é necessário um período de tratamento de pelo menos 6 meses para verificar se AVODART 0,5 mg funcionará para você.
Esta informação do paciente foi aprovada pela Food and Drug Administration dos EUA.
