Colirios para ojos: Lumigan 3ml Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Lumigan e como é usado?
Lumigan 3ml é um medicamento de prescrição usado para tratar os sintomas da Pressão Intraocular Elevada causada por certos tipos de Glaucoma e Hipotricose dos Cílios. Lumigan pode ser usado sozinho ou com outros medicamentos.
Lumigan pertence a uma classe de medicamentos chamados Antiglaucoma, Agonistas de Prostaglandina.
Não se sabe se Lumigan é seguro e eficaz em crianças.
Quais são os possíveis efeitos colaterais do Lumigan?
Lumigan pode causar efeitos colaterais graves, incluindo:
- inchaço dos olhos,
- vermelhidão dos olhos,
- desconforto grave no olho,
- crostas ou drenagem do olho,
- alterações na visão e
- pálpebras vermelhas, inchadas ou com coceira
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Lumigan incluem:
- vermelhidão dos olhos
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Lumigan. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
DESCRIÇÃO
LUMIGAN® (solução oftálmica de bimatoprost) 0,03% é um análogo sintético da prostamida com atividade hipotensora ocular. Seu nome químico é (Z)-7-[(1R,2R,3R,5S)-3,5-Dihidroxi-2[(1E,3S)-3-hidroxi-5-fenil-1-pentenil]ciclopentil]- 5-N-etilheptenamida, e seu peso molecular é 415,58. Sua fórmula molecular é C25H37NO4. Sua estrutura química é:
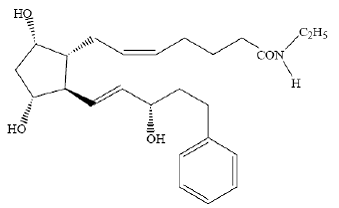
Bimatoprost é um pó, que é muito solúvel em álcool etílico e álcool metílico e ligeiramente solúvel em água. LUMIGAN® 0,03% é uma solução oftálmica límpida, isotônica, incolor e estéril com uma osmolalidade de aproximadamente 290 mOsmol/kg.
LUMIGAN® 0,03% contém Ativo: bimatoprost 0,3 mg/mL; Inativos: cloreto de benzalcónio 0,05 mg/mL; Cloreto de Sódio; fosfato de sódio, dibásico; Ácido Cítrico; e água purificada. Hidróxido de sódio e/ou ácido clorídrico podem ser adicionados para ajustar o pH. O pH durante sua vida útil varia de 6,8-7,8.
INDICAÇÕES
LUMIGAN® (solução oftálmica de bimatoprosta) 0,01% é indicado para a redução da pressão intraocular elevada em pacientes com glaucoma de ângulo aberto ou hipertensão ocular.
DOSAGEM E ADMINISTRAÇÃO
A dosagem recomendada é de uma gota no(s) olho(s) afetado(s) uma vez ao dia à noite. LUMIGAN® (solução oftálmica de bimatoprosta) 0,01% não deve ser administrado mais de uma vez ao dia, pois foi demonstrado que a administração mais frequente de análogos de prostaglandinas pode diminuir o efeito de redução da pressão intraocular.
A redução da pressão intraocular inicia-se aproximadamente 4 horas após a primeira administração com efeito máximo atingido em aproximadamente 8 a 12 horas.
LUMIGAN® 0,01% pode ser usado concomitantemente com outros medicamentos oftálmicos tópicos para reduzir a pressão intraocular. Se mais de um medicamento oftálmico tópico estiver sendo usado, os medicamentos devem ser administrados com pelo menos cinco (5) minutos de intervalo.
COMO FORNECIDO
Formas de dosagem e pontos fortes
Solução oftálmica contendo bimatoprost 0,1 mg/mL.
Armazenamento e entrega
LUMIGAN® (solução oftálmica de bimatoprost) 0,01% é fornecido estéril em frascos dispensadores oftálmicos de polietileno de baixa densidade branco opaco e pontas com tampas de poliestireno turquesa nos seguintes tamanhos:
2,5 mL preencha um recipiente de 5 mL - NDC 0023-3205-03 5 mL encha um recipiente de 10 mL - NDC 0023-3205-05 7,5 mL encha um recipiente de 10 mL - NDC 0023-3205-08
Armazenar: Armazenar de 2°C a 25°C (36°F a 77°F).
Após aberto, o LUMIGAN® 0,01% pode ser usado até a data de validade indicada no frasco.
Distribuído por: Allergan USA, Inc. Madison, NJ 07940. Revisado: março de 2022
EFEITOS COLATERAIS
As seguintes reações adversas são descritas em outras partes da bula:
- Pigmentação incluindo pigmentação blefaral e hiperpigmentação da íris [ver AVISOS E PRECAUÇÕES ]
- Mudanças nos cílios [ver AVISOS E PRECAUÇÕES ]
- Inflamação intraocular [ver AVISOS E PRECAUÇÕES ]
- Edema macular [ver AVISOS E PRECAUÇÕES ]
- Hipersensibilidade [ver CONTRA-INDICAÇÕES ]
Experiência de Ensaios Clínicos
Como os ensaios clínicos são conduzidos em condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparadas às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
Em um estudo clínico de 12 meses com soluções oftálmicas de bimatoprost 0,01%, a reação adversa mais comum foi hiperemia conjuntival (31%). Aproximadamente 1,6% dos pacientes descontinuaram a terapia devido à hiperemia conjuntival. Outras reações adversas a medicamentos (notificadas em 1 a 4% dos pacientes) com LUMIGAN® 0,01% neste estudo incluiu edema conjuntival, hemorragia conjuntival, irritação ocular, dor ocular, prurido ocular, eritema da pálpebra, prurido palpebral, crescimento de cílios, hipertricose, irritação no local da instilação, ceratite puntiforme, hiperpigmentação da pele, visão turva e acuidade visual reduzido.
Experiência pós-marketing
As seguintes reações adversas foram identificadas durante o uso pós-aprovação de LUMIGAN® 0,01%. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento. Estas reações, que foram escolhidas para inclusão devido à sua gravidade, frequência de notificação, possível nexo causal com LUMIGAN® , ou uma combinação desses fatores incluem: sintomas de asma, tontura, olho seco, dispnéia, secreção ocular, edema ocular, sensação de corpo estranho, dor de cabeça, hipersensibilidade incluindo sinais e sintomas de alergia ocular e dermatite alérgica, hipertensão, lacrimejamento aumentado, alterações periorbitais e palpebrais, incluindo aprofundamento do sulco palpebral e fotofobia.
INTERAÇÕES MEDICAMENTOSAS
Nenhuma informação fornecida
AVISOS
Incluído como parte do "PRECAUÇÕES" Seção
PRECAUÇÕES
Pigmentação
Foi relatado que a solução oftálmica de bimatoprosta causa alterações nos tecidos pigmentados. As alterações mais frequentemente relatadas foram aumento da pigmentação da íris, tecido periorbitário (pálpebra) e cílios. Espera-se que a pigmentação aumente enquanto o bimatoprost for administrado. A alteração da pigmentação deve-se ao aumento do conteúdo de melanina nos melanócitos e não ao aumento do número de melanócitos. Após a descontinuação do bimatoprost, a pigmentação da íris provavelmente será permanente, enquanto a pigmentação do tecido periorbitário e as alterações dos cílios foram relatadas como reversíveis em alguns pacientes. Os pacientes que recebem tratamento devem ser informados da possibilidade de aumento da pigmentação. Os efeitos a longo prazo do aumento da pigmentação não são conhecidos.
mudança de cor da íris pode não ser perceptível por vários meses a anos. Normalmente, a pigmentação marrom ao redor da pupila se espalha concentricamente em direção à periferia da íris e toda a íris ou partes da íris se tornam mais acastanhadas. Nem os nevos nem as sardas da íris parecem ser afetados pelo tratamento. Embora o tratamento com LUMIGAN® (solução oftálmica de bimatoprost) 0,01% possa ser continuado em pacientes que desenvolvem pigmentação visivelmente aumentada da íris, esses pacientes devem ser examinados regularmente.
Mudanças nos cílios
LUMIGAN® 0,01% pode alterar gradualmente as pestanas e pêlos vellus no olho tratado. Essas mudanças incluem maior comprimento, espessura e número de cílios. As alterações das pestanas são geralmente reversíveis com a descontinuação do tratamento.
Inflamação intraocular
Análogos da prostaglandina, incluindo bimatoprost, foram relatados como causadores de inflamação intraocular. Além disso, como esses produtos podem exacerbar a inflamação, deve-se ter cautela em pacientes com inflamação intraocular ativa (por exemplo, uveíte).
Edema macular
Edema macular, incluindo edema macular cistóide, foi relatado durante o tratamento com solução oftálmica de bimatoprost. LUMIGAN® 0,01% deve ser usado com cautela em pacientes afácicos, em pacientes pseudofácicos com cápsula posterior do cristalino rasgada ou em pacientes com fatores de risco conhecidos para edema macular.
Ceratite Bacteriana
Houve relatos de ceratite bacteriana associada ao uso de recipientes de doses múltiplas de produtos oftálmicos tópicos. Esses recipientes foram contaminados inadvertidamente por pacientes que, na maioria dos casos, apresentavam uma doença corneana concomitante ou uma ruptura da superfície epitelial ocular.
Uso de lentes de contato
LUMIGAN® 0,01% contém cloreto de benzalcônio, que pode ser absorvido e causar descoloração das lentes de contato gelatinosas. As lentes de contato devem ser removidas antes da instilação de LUMIGAN® 0,01% e podem ser reinseridas 15 minutos após sua administração.
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Carcinogênese
O bimatoprost não foi carcinogênico em camundongos ou ratos quando administrado por gavagem oral por 104 semanas em doses de até 2 mg/kg/dia e 1 mg/kg/dia, respectivamente (192 e 291 vezes a exposição sistêmica humana estimada ao bimatoprost 0,03% administrado bilateralmente uma vez ao dia, respectivamente, com base nos níveis de AUC no sangue)
Mutagênese
O bimatoprost não foi mutagênico ou clastogênico no teste de Ames, no teste de linfoma de camundongo ou nos testes de micronúcleo de camundongo in vivo.
Prejuízo da Fertilidade
O bimatoprost não prejudicou a fertilidade em ratos machos ou fêmeas até doses de 0,6 mg/kg/dia (pelo menos 103 vezes a exposição humana recomendada ao bimatoprost 0,03% administrado bilateralmente uma vez ao dia com base nos níveis de AUC no sangue).
Uso em populações específicas
Gravidez
Resumo do risco
Não existem estudos adequados e bem controlados de administração de LUMIGAN® (solução oftálmica de bimatoprosta) 0,01% em mulheres grávidas. Não há aumento no risco de defeitos congênitos maiores ou abortos espontâneos com base na experiência pós-comercialização do bimatoprost.
Em estudos de desenvolvimento embriofetal, a administração de bimatoprost a camundongos e ratas grávidas durante a organogênese resultou em aborto e parto prematuro em doses orais de pelo menos 33 vezes (camundongos) ou 94 vezes (ratos) a exposição humana ao bimatoprost 0,03% administrado bilateralmente uma vez ao dia ( com base na área de sangue sob os níveis da curva [AUC]). Esses efeitos adversos não foram observados em 2,6 vezes (camundongos) e 47 vezes (ratos) a exposição humana ao bimatoprost 0,03% administrado bilateralmente uma vez ao dia (com base nos níveis de AUC no sangue).
Em estudos de desenvolvimento pré/pós-natal, a administração de bimatoprost a ratas grávidas desde a organogênese até o final da lactação resultou em redução da duração da gestação e do peso corporal fetal, e aumento da mortalidade fetal e de filhotes em doses orais de pelo menos 41 vezes a exposição sistêmica humana ao bimatoprost 0,03 % administrado bilateralmente uma vez ao dia (com base nos níveis de AUC no sangue). Não foram observados efeitos adversos na prole de ratos em exposições estimadas em 14 vezes a exposição humana ao bimatoprost 0,03% administrado bilateralmente uma vez ao dia (com base nos níveis de AUC no sangue).
Como os estudos reprodutivos em animais nem sempre são preditivos da resposta humana, LUMIGAN® 0,01% deve ser administrado durante a gravidez somente se o benefício potencial justificar o risco potencial para o feto.
Dados
Dados de animais
Em um estudo de desenvolvimento embriofetal em ratos, o aborto foi observado em ratas grávidas que receberam bimatoprost oralmente durante a organogênese a 0,6 mg/kg/dia (94 vezes a exposição sistêmica humana a bimatoprost 0,03% administrado bilateralmente uma vez ao dia, com base na AUC). O Nível de Efeito Adverso Não Observado (NOAEL) para aborto foi de 0,3 mg/kg/dia (estimado em 47 vezes a exposição sistêmica humana ao bimatoprost 0,03% administrado bilateralmente uma vez ao dia, com base na AUC). Não foram observadas anormalidades em fetos de ratos em doses de até 0,6 mg/kg/dia.
Em um estudo de desenvolvimento embriofetal em camundongos, aborto e parto prematuro foram observados em camundongos prenhes administrados com bimatoprost oralmente durante a organogênese em doses maiores ou iguais a 0,3 mg/kg/dia (33 vezes a exposição sistêmica humana a bimatoprost 0,03% administrado bilateralmente uma vez ao dia, com base na AUC). O NOAEL para aborto e parto prematuro foi de 0,1 mg/kg/dia (2,6 vezes a exposição sistêmica humana ao bimatoprost 0,03% administrado bilateralmente uma vez ao dia, com base na AUC). Não foram observadas anormalidades em fetos de camundongos em doses de até 0,6 mg/kg/dia (72 vezes a exposição sistêmica humana ao bimatoprost 0,03% administrado bilateralmente uma vez ao dia, com base na AUC).
Em um estudo de desenvolvimento pré/pós-natal, o tratamento de ratas prenhas com bimatoprost por via oral do 7º dia de gestação ao 20º dia de lactação resultou em redução da duração da gestação, aumento das reabsorções tardias, mortes fetais e mortalidade pós-natal dos filhotes e redução do peso corporal dos filhotes em doses maiores que ou igual a 0,3 mg/kg/dia. Esses efeitos foram observados em exposições de pelo menos 41 vezes a exposição sistêmica humana ao bimatoprost 0,03% administrado bilateralmente uma vez ao dia, com base na AUC. O NOAEL para o desenvolvimento pós-natal e desempenho de acasalamento da prole foi de 0,1 mg/kg/dia (estimado em 14 vezes a exposição sistêmica humana ao bimatoprost 0,03% administrado bilateralmente uma vez ao dia, com base na AUC).
Lactação
Resumo do risco
Não se sabe se o tratamento ocular tópico com LUMIGAN® 0,01% pode resultar em absorção sistêmica suficiente para produzir quantidades detectáveis no leite humano. Em estudos com animais, o bimatoprost mostrou estar presente no leite materno de ratas lactantes em uma dose intravenosa (ou seja, 1 mg/kg) 970 vezes a RHOD (em uma base mg/rn 2), no entanto, não há dados disponíveis em animais em doses clinicamente relevantes.
Os benefícios da amamentação para o desenvolvimento e para a saúde devem ser considerados juntamente com a necessidade clínica da mãe de LUMIGAN® 0,01% e quaisquer potenciais efeitos adversos na criança amamentada de LUMIGAN® 0,01%.
Uso Pediátrico
O uso em pacientes pediátricos com idade inferior a 16 anos não é recomendado devido a potenciais preocupações de segurança relacionadas ao aumento da pigmentação após o uso crônico de longo prazo.
Uso Geriátrico
Não foram observadas diferenças clínicas gerais na segurança ou eficácia entre idosos e outros pacientes adultos.
SOBREDOSAGEM
Não há informações disponíveis sobre superdosagem em humanos. Se ocorrer superdosagem com LUMIGAN® (solução oftálmica de bimatoprost) 0,01%, o tratamento deve ser sintomático.
Em estudos orais (por gavagem) em camundongos e ratos, doses de até 100 mg/kg/dia não produziram qualquer toxicidade. Esta dose expressa em mg/m2 é pelo menos 210 vezes maior do que a dose acidental de um frasco de LUMIGAN® 0,01% para uma criança de 10 kg.
CONTRA-INDICAÇÕES
LUMIGAN® 0,01% é contraindicado em pacientes com hipersensibilidade ao bimatoprost ou a qualquer um dos ingredientes [ver REAÇÕES ADVERSAS ].
FARMACOLOGIA CLÍNICA
Mecanismo de ação
Bimatoprost, um análogo da prostaglandina, é um análogo estrutural sintético da prostaglandina com atividade hipotensora ocular. Ele imita seletivamente os efeitos de substâncias naturais, prostamidas. Acredita-se que o bimatoprost reduza a pressão intraocular (PIO) em humanos, aumentando o fluxo de saída do humor aquoso através da malha trabecular e das vias uveoscleral. A PIO elevada apresenta um importante fator de risco para perda de campo glaucomatosa. Quanto maior o nível de PIO, maior a probabilidade de dano ao nervo óptico e perda de campo visual.
Farmacocinética
Absorção
Após administração de uma gota de solução oftálmica de bimatoprosta 0,03% uma vez ao dia em ambos os olhos de 15 indivíduos saudáveis por duas semanas, as concentrações sanguíneas atingiram o pico em 10 minutos após a administração e ficaram abaixo do limite inferior de detecção (0,025 ng/mL) na maioria dos indivíduos dentro de 1,5 horas após a dosagem. Os valores médios de Cmax e AUC0-24h foram semelhantes nos dias 7 e 14 em aproximadamente 0,08 ng/mL e 0,09 ng•hr/mL, respectivamente, indicando que o estado de equilíbrio foi alcançado durante a primeira semana de dosagem ocular. Não houve acúmulo sistêmico significativo de drogas ao longo do tempo.
Distribuição
O bimatoprost é moderadamente distribuído nos tecidos corporais com um volume de distribuição no estado de equilíbrio de 0,67 L/kg. No sangue humano, o bimatoprost reside principalmente no plasma. Aproximadamente 12% do bimatoprost permanece não ligado no plasma humano.
Eliminação
Metabolismo
Bimatoprost é a principal espécie circulante no sangue, uma vez que atinge a circulação sistêmica após a dosagem ocular. Bimatoprost então sofre oxidação, N-deetilação e glucuronidação para formar uma variedade diversificada de metabólitos.
Excreção
Após uma dose intravenosa de bimatoprost radiomarcado (3,12 mcg/kg) em seis indivíduos saudáveis, a concentração sanguínea máxima do fármaco inalterado foi de 12,2 ng/mL e diminuiu rapidamente com uma meia-vida de eliminação de aproximadamente 45 minutos. A depuração sanguínea total do bimatoprost foi de 1,5 L/h/kg. Até 67% da dose administrada foi excretada na urina enquanto 25% da dose foi recuperada nas fezes.
Estudos clínicos
Em um estudo clínico de 12 meses de pacientes com glaucoma de ângulo aberto ou hipertensão ocular com uma PIO basal média de 23,5 mmHg, o efeito de redução da PIO de LUMIGAN® 0,01% uma vez ao dia (à noite) foi de até 7,5 mmHg.
INFORMAÇÃO DO PACIENTE
Potencial para Pigmentação
Aconselhe os pacientes sobre o potencial de aumento da pigmentação marrom da íris, que pode ser permanente. Informar também os pacientes sobre a possibilidade de escurecimento da pele palpebral, que pode ser reversível após a descontinuação de LUMIGAN® (solução oftálmica de bimatoprost) 0,01%.
Potencial para mudanças nos cílios
Informe os pacientes sobre a possibilidade de alterações nos cílios e pelos velus no olho tratado durante o tratamento com LUMIGAN® 0,01%. Essas alterações podem resultar em uma disparidade entre os olhos em comprimento, espessura, pigmentação, número de cílios ou pêlos velos e/ou direção do crescimento dos cílios. As alterações das pestanas são geralmente reversíveis com a descontinuação do tratamento.
Manuseio do Recipiente
Instrua os pacientes a evitar que a ponta do recipiente dispensador entre em contato com os olhos, estruturas circundantes, dedos ou qualquer outra superfície, a fim de evitar a contaminação da solução por bactérias comuns conhecidas por causar infecções oculares. Danos graves aos olhos e subsequente perda de visão podem resultar do uso de soluções contaminadas.
Quando procurar aconselhamento médico
Aconselhe os pacientes que, se desenvolverem uma condição ocular intercorrente (por exemplo, trauma ou infecção), fizerem cirurgia ocular ou desenvolverem quaisquer reações oculares, particularmente conjuntivite e reações palpebrais, devem procurar imediatamente o conselho de seu médico sobre o uso continuado de LUMIGAN® 0,01% .
Uso de lentes de contato
Informe os pacientes de que LUMIGAN® 0,01% contém cloreto de benzalcônio, que pode ser absorvido por lentes de contato gelatinosas. As lentes de contato devem ser removidas antes da instilação de LUMIGAN® 0,01% e podem ser reinseridas 15 minutos após sua administração.
Uso com outros medicamentos oftálmicos
Aconselhe os pacientes que, se mais de um medicamento oftálmico tópico estiver sendo usado, os medicamentos devem ser administrados pelo menos cinco (5) minutos entre as aplicações.
