Xalatan 2.5ml Latanoprost Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
XALATAN® (latanoprost) Solução Oftálmica
DESCRIÇÃO
A latanoprosta é um análogo da prostaglandina F2α. Seu nome químico é isopropil-(Z)-7[(1R,2R,3R,5S)3,5dihidroxi-2-[(3R)-3-hidroxi-5-fenilpentil]ciclopentil]-5-heptenoato. Sua fórmula molecular é C26H40O5 e sua estrutura química é:
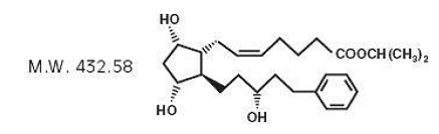
latanoprost é um óleo incolor a levemente amarelo que é muito solúvel em acetonitrila e livremente solúvel em acetona, etanol, acetato de etila, isopropanol, metanol e octanol. É praticamente insolúvel em água.
XALATAN (solução oftálmica de latanoprost) 0,005% é fornecido como uma solução aquosa tamponada, isotônica e estéril de latanoprost com um pH de aproximadamente 6,7 e uma osmolalidade de aproximadamente 267 mOsmol/kg. Cada mL de XALATAN contém 50 mcg de latanoprost. Cloreto de benzalcônio, 0,02% é adicionado como conservante. Os ingredientes inativos são: cloreto de sódio, dihidrogenofosfato de sódio monohidratado, hidrogenofosfato dissódico anidro e água para injeção. Uma gota contém aproximadamente 1,5 mcg de latanoprost.
INDICAÇÕES
XALATAN 2,5ml é indicado para a redução da pressão intraocular elevada em pacientes com glaucoma de ângulo aberto ou hipertensão ocular.
DOSAGEM E ADMINISTRAÇÃO
dosagem recomendada é de uma gota no(s) olho(s) afetado(s) uma vez ao dia à noite. Se uma dose for esquecida, o tratamento deve continuar com a próxima dose normalmente.
A dosagem de XALATAN não deve exceder uma vez ao dia; o uso combinado de duas ou mais prostaglandinas, ou análogos de prostaglandinas, incluindo XALATAN 2,5ml não é recomendado. Foi demonstrado que a administração desses medicamentos com prostaglandinas mais de uma vez ao dia pode diminuir o efeito de redução da pressão intraocular (PIO) ou causar elevações paradoxais da pressão intraocular.
A redução da PIO começa aproximadamente 3 a 4 horas após a administração e o efeito máximo é alcançado após 8 a 12 horas.
XALATAN pode ser usado concomitantemente com outros medicamentos oftálmicos tópicos para diminuir a PIO. Se mais de um medicamento oftálmico tópico estiver sendo usado, os medicamentos devem ser administrados com pelo menos cinco (5) minutos de intervalo. As lentes de contato devem ser removidas antes da administração de XALATAN 2,5ml, e podem ser reinseridas 15 minutos após a administração
COMO FORNECIDO
Formas de dosagem e pontos fortes
Solução oftálmica estéril contendo 50 mcg/mL de latanoprost.
Armazenamento e manuseio
XALATAN é uma solução límpida, isotônica, tamponada e incolor preservada de latanoprost 0,005% (50 mcg/mL). É fornecido como uma solução de 2,5 mL em um frasco de polietileno de baixa densidade transparente de 5 mL com um conta-gotas de polietileno transparente, uma tampa de rosca de polietileno de alta densidade turquesa e uma sobretampa de polietileno de baixa densidade transparente inviolável.
2,5 mL de enchimento, 0,005% (50 mcg/mL): Embalagem com 1 frasco: NDC 0013-8303-04 2,5 mL de enchimento, 0,005% (50 mcg/mL): Embalagem múltipla de 3 frascos: NDC 0013-8303-01
Armazenar
Proteja da luz. Armazene a(s) garrafa(s) fechada(s) sob refrigeração de 2° a 8°C (36° a 46°F). Durante o envio para o paciente, o frasco pode ser mantido a temperaturas de até 40°C (104°F) por um período não superior a 8 dias. Uma vez que um frasco é aberto para uso, ele pode ser armazenado em temperatura ambiente até 25°C (77°F) por 6 semanas.
Distribuído por: Pharmacia & Upjohn Co., Division of Pfizer Inc., NY, NY 10017. Pfizer Manufacturing Belgium NV Puurs, Bélgica. Revisado: n/a
EFEITOS COLATERAIS
As seguintes reações adversas foram relatadas na experiência pós-comercialização e são discutidas com mais detalhes em outras seções do rótulo:
- Alterações na pigmentação da íris [ver AVISOS E PRECAUÇÕES ]
- Escurecimento da pele das pálpebras [ver AVISOS E PRECAUÇÕES ]
- Alterações dos cílios (aumento do comprimento, espessura, pigmentação e número de cílios) [ver AVISOS E PRECAUÇÕES ]
- Inflamação intraocular (irite/uveíte) [ver AVISOS E PRECAUÇÕES ]
- Edema macular, incluindo edema macular cistóide [ver AVISOS E PRECAUÇÕES ]
Experiência de Ensaios Clínicos
Como os ensaios clínicos são conduzidos em condições muito variadas, as taxas de reações adversas observadas nos estudos clínicos de um medicamento não podem ser comparadas diretamente com as taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática clínica.
XALATAN 2,5ml foi estudado em três ensaios clínicos multicêntricos, randomizados e controlados. Os pacientes receberam 50 mcg/mL de XALATAN uma vez ao dia ou 5 mg/mL de comparador ativo (timolol) duas vezes ao dia. A população de pacientes estudada tinha idade média de 65±10 anos. Sete por cento dos pacientes desistiram antes do desfecho de 6 meses.
Menos de 1% dos pacientes tratados com XALATAN 2,5ml necessitaram de descontinuação da terapia devido à intolerância à hiperemia conjuntival.
O evento/sinais e sintomas oculares de blefarite foram identificados como “comumente observados” através da análise de dados de ensaios clínicos.
Experiência pós-marketing
As seguintes reações foram identificadas durante o uso pós-comercialização de XALATAN na prática clínica. Por serem relatados voluntariamente por uma população de tamanho desconhecido, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento. As reações, que foram escolhidas para inclusão devido à sua gravidade, frequência de notificação, possível conexão causal com XALATAN 2,5ml, ou uma combinação desses fatores, incluem:
Distúrbios do sistema nervoso: Tontura; dor de cabeça; Necrólise epidérmica tóxica
Distúrbios oculares: Alterações dos cílios e pelos velos da pálpebra (aumento do comprimento, espessura, pigmentação e número de cílios); ceratite; edema e erosões da córnea; inflamação intraocular (irite/uveíte); edema macular, incluindo edema macular cistóide; triquíase; alterações periorbitais e palpebrais resultando em aprofundamento do sulco palpebral; cisto de íris; escurecimento da pele das pálpebras; reação cutânea localizada nas pálpebras; conjuntivite; pseudopenfigóide da conjuntiva ocular
Distúrbios respiratórios, torácicos e mediastinais: Asma e exacerbação da asma; dispnéia
Distúrbios da Pele e Tecidos Subcutâneos: prurido
Infecções e Infestações: Ceratite por herpes
Distúrbios cardíacos: Angina; palpitações; angina instável
Distúrbios Gerais e Condições do Local de Administração: Dor no peito
INTERAÇÕES MEDICAMENTOSAS
Estudos in vitro mostraram que a precipitação ocorre quando colírios contendo timerosal são misturados com XALATAN. Se tais medicamentos forem usados, eles devem ser administrados com pelo menos cinco (5) minutos de intervalo.
uso combinado de duas ou mais prostaglandinas, ou análogos de prostaglandinas, incluindo XALATAN 2,5ml, não é recomendado. Foi demonstrado que a administração desses medicamentos com prostaglandinas mais de uma vez ao dia pode diminuir o efeito de redução da PIO ou causar elevações paradoxais da PIO.
AVISOS
Incluído como parte do PRECAUÇÕES seção.
PRECAUÇÕES
Pigmentação
Foi relatado que XALATAN causa alterações nos tecidos pigmentados. As alterações mais frequentemente relatadas foram aumento da pigmentação da íris, tecido periorbitário (pálpebra) e cílios. Espera-se que a pigmentação aumente enquanto o latanoprost for administrado.
alteração da pigmentação deve-se ao aumento do conteúdo de melanina nos melanócitos e não ao aumento do número de melanócitos. Após a descontinuação de latanoprost, a pigmentação da íris provavelmente será permanente, enquanto a pigmentação do tecido periorbitário e as alterações dos cílios foram relatadas como reversíveis em alguns pacientes. Os pacientes que recebem tratamento devem ser informados da possibilidade de aumento da pigmentação. Além de 5 anos, os efeitos do aumento da pigmentação não são conhecidos [ver Estudos clínicos ].
A mudança de cor da íris pode não ser perceptível por vários meses a anos. Normalmente, a pigmentação marrom ao redor da pupila se espalha concentricamente em direção à periferia da íris e toda a íris ou partes da íris se tornam mais acastanhadas. Nem os nevos nem as sardas da íris parecem ser afetados pelo tratamento. Embora o tratamento com XALATAN 2,5 ml possa ser continuado em pacientes que desenvolvem pigmentação visivelmente aumentada da íris, esses pacientes devem ser examinados regularmente [ver INFORMAÇÃO DO PACIENTE ].
Mudanças nos cílios
XALATAN 2,5ml pode alterar gradualmente as pestanas e pêlos vellus no olho tratado; essas mudanças incluem aumento do comprimento, espessura, pigmentação, número de cílios ou cabelos e crescimento mal direcionado dos cílios. As alterações dos cílios geralmente são reversíveis com a descontinuação do tratamento [ver INFORMAÇÃO DO PACIENTE ].
Inflamação intraocular
XALATAN 2,5ml deve ser usado com cautela em pacientes com histórico de inflamação intraocular (irite/uveíte) e geralmente não deve ser usado em pacientes com inflamação intraocular ativa porque a inflamação pode ser exacerbada.
Edema macular
Edema macular, incluindo edema macular cistóide, foi relatado durante o tratamento com XALATAN. XALATAN 2,5 ml deve ser usado com cautela em pacientes afácicos, em pacientes pseudofácicos com cápsula posterior do cristalino rasgada ou em pacientes com fatores de risco conhecidos para edema macular.
Ceratite Herpética
Reativação de ceratite por Herpes Simplex foi relatada durante o tratamento com XALATAN. XALATAN 2,5ml deve ser usado com cautela em pacientes com histórico de ceratite herpética. XALATAN 2,5ml deve ser evitado em casos de ceratite ativa por herpes simples porque a inflamação pode ser exacerbada.
Ceratite Bacteriana
Houve relatos de ceratite bacteriana associada ao uso de recipientes de doses múltiplas de produtos oftálmicos tópicos. Esses recipientes foram contaminados inadvertidamente por pacientes que, na maioria dos casos, apresentavam uma doença corneana concomitante ou uma ruptura da superfície epitelial ocular [ver INFORMAÇÃO DO PACIENTE ].
Usar com lentes de contato
As lentes de contato devem ser removidas antes da administração de XALATAN e podem ser reinseridas 15 minutos após a administração.
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
latanoprost não foi carcinogênico em camundongos ou ratos quando administrado por gavagem oral em doses de até 170 mcg/kg/dia (aproximadamente 2.800 vezes a dose humana máxima recomendada) por até 20 e 24 meses, respectivamente.
O latanoprost não foi mutagênico em bactérias, em linfoma de camundongo ou em testes de micronúcleo de camundongo. Aberrações cromossômicas foram observadas in vitro com linfócitos humanos. Estudos adicionais in vitro e in vivo sobre a síntese de DNA não programada em ratos foram negativos.
A latanoprosta não demonstrou qualquer efeito sobre a fertilidade masculina ou feminina em estudos com animais.
Uso em populações específicas
Gravidez
Efeitos teratogênicos
Gravidez Categoria C.
Estudos de reprodução foram realizados em ratos e coelhos. Em coelhos, uma incidência de 4 de 16 mães não teve fetos viáveis em uma dose que foi aproximadamente 80 vezes a dose humana máxima, e a dose não embriocida mais alta em coelhos foi aproximadamente 15 vezes a dose humana máxima.
Não existem estudos adequados e bem controlados em mulheres grávidas. XALATAN 2,5ml deve ser usado durante a gravidez somente se o benefício potencial justificar o risco potencial para o feto.
Mães que amamentam
Não se sabe se este medicamento ou seus metabólitos são excretados no leite humano. Como muitos medicamentos são excretados no leite humano, deve-se ter cautela quando XALATAN 2,5 ml é administrado a lactantes.
Uso Pediátrico
A segurança e eficácia em pacientes pediátricos não foram estabelecidas.
Uso Geriátrico
Nenhuma diferença geral na segurança ou eficácia foi observada entre pacientes idosos e mais jovens.
SOBREDOSAGEM
A infusão intravenosa de até 3 mcg/kg em voluntários saudáveis produziu concentrações plasmáticas médias 200 vezes maiores do que durante o tratamento clínico e não foram observadas reações adversas. Doses intravenosas de 5,5 a 10 mcg/kg causaram dor abdominal, tontura, fadiga, ondas de calor, náusea e sudorese. Se ocorrer superdosagem com XALATAN, o tratamento deve ser sintomático.
CONTRA-INDICAÇÕES
Hipersensibilidade conhecida ao latanoprost, cloreto de benzalcônio ou qualquer outro componente deste produto.
FARMACOLOGIA CLÍNICA
Mecanismo de ação
latanoprost é um agonista seletivo do receptor FP prostanóide que se acredita reduzir a pressão intraocular (PIO) aumentando o fluxo de saída do humor aquoso. Estudos em animais e no homem sugerem que o principal mecanismo de ação é o aumento do fluxo uveoscleral. A PIO elevada representa um importante fator de risco para perda de campo glaucomatosa. Quanto maior o nível de PIO, maior a probabilidade de dano ao nervo óptico e perda de campo visual.
Farmacodinâmica
A redução da PIO no homem começa cerca de 3-4 horas após a administração e o efeito máximo é alcançado após 8-12 horas. A redução da PIO está presente por pelo menos 24 horas.
Farmacocinética
Absorção
O latanoprost é absorvido através da córnea, onde o pró-fármaco de éster isopropílico é hidrolisado para a forma ácida para se tornar biologicamente ativo.
Distribuição
volume de distribuição em humanos é de 0,16 ± 0,02 L/kg. O ácido do latanoprost pode ser medido no humor aquoso durante as primeiras 4 horas e no plasma apenas durante a primeira hora após a administração local. Estudos no homem indicam que o pico de concentração no humor aquoso é atingido cerca de duas horas após a administração tópica.
Metabolismo
O latanoprost, um pró-fármaco de éster isopropílico, é hidrolisado por esterases na córnea ao ácido biologicamente ativo. O ácido ativo do latanoprost que atinge a circulação sistêmica é metabolizado principalmente pelo fígado nos metabólitos 1,2-dinor e 1,2,3,4-tetranor via β-oxidação de ácidos graxos.
Excreção
eliminação do ácido de latanoprost do plasma humano é rápida (t½ = 17 min) após administração intravenosa e tópica. A depuração sistêmica é de aproximadamente 7 mL/min/kg. Após a β-oxidação hepática, os metabólitos são eliminados principalmente pelos rins. Aproximadamente 88% e 98% da dose administrada são recuperadas na urina após administração tópica e intravenosa, respectivamente.
Estudos clínicos
PIO de linha de base elevada
Pacientes com PIO basal média de 24 - 25 mmHg que foram tratados por 6 meses em estudos multicêntricos, randomizados e controlados demonstraram reduções de 6 - 8 mmHg na PIO. Esta redução da PIO com XALATAN 0,005% administrado uma vez ao dia foi equivalente ao efeito do timolol 0,5% administrado duas vezes ao dia.
Progressão do aumento da pigmentação da íris
Um estudo de segurança prospectivo aberto de 3 anos com uma fase de extensão de 2 anos foi conduzido para avaliar a progressão do aumento da pigmentação da íris com o uso contínuo de XALATAN uma vez ao dia como terapia adjuvante em 519 pacientes com glaucoma de ângulo aberto. A análise foi baseada na população de casos observados dos 380 pacientes que continuaram na fase de extensão.
Os resultados mostraram que o início do aumento perceptível da pigmentação da íris ocorreu no primeiro ano de tratamento para a maioria dos pacientes que desenvolveram aumento perceptível da pigmentação da íris. Os pacientes continuaram a mostrar sinais de aumento da pigmentação da íris ao longo dos cinco anos do estudo. A observação do aumento da pigmentação da íris não afetou a incidência, natureza ou gravidade dos eventos adversos (exceto aumento da pigmentação da íris) registrados no estudo. A redução da PIO foi semelhante, independentemente do desenvolvimento de aumento da pigmentação da íris durante o estudo.
INFORMAÇÃO DO PACIENTE
Potencial para Pigmentação
Aconselhe os pacientes sobre o potencial de aumento da pigmentação marrom da íris, que pode ser permanente. Informe os pacientes sobre a possibilidade de escurecimento da pele das pálpebras, que pode ser reversível após a descontinuação de XALATAN [ver AVISOS E PRECAUÇÕES ].
Potencial para mudanças nos cílios
Informe os pacientes sobre a possibilidade de alterações nos cílios e pelos velus no olho tratado durante o tratamento com XALATAN. Essas alterações podem resultar em uma disparidade entre os olhos em comprimento, espessura, pigmentação, número de cílios ou pêlos velos e/ou direção do crescimento dos cílios. As alterações das pestanas são geralmente reversíveis com a descontinuação do tratamento.
Manuseio do Recipiente
Instrua os pacientes a evitar que a ponta do recipiente de dispensação entre em contato com os olhos ou estruturas vizinhas, pois isso pode causar a contaminação da ponta por bactérias comuns conhecidas por causar infecções oculares. Danos graves aos olhos e subsequente perda de visão podem resultar do uso de soluções contaminadas [ver AVISOS E PRECAUÇÕES ].
Quando procurar aconselhamento médico
Aconselhar os pacientes que, se desenvolverem uma condição ocular intercorrente (por exemplo, trauma ou infecção) ou fizerem cirurgia ocular, ou desenvolverem quaisquer reações oculares, particularmente conjuntivite e reações palpebrais, devem procurar imediatamente o conselho de seu médico sobre o uso continuado da dose múltipla recipiente.
Usar com lentes de contato
Avise os pacientes que XALATAN 2,5ml contém cloreto de benzalcônio, que pode ser absorvido pelas lentes de contato. As lentes de contato devem ser removidas antes da administração da solução. As lentes podem ser reinseridas 15 minutos após a administração de XALATAN.
Uso com outros medicamentos oftálmicos
Se mais de um medicamento oftálmico tópico estiver sendo usado, os medicamentos devem ser administrados com pelo menos cinco (5) minutos de intervalo.
