Micardis 20mg, 40mg, 80mg Telmisartan Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Micardis 40mg e como é usado?
Micardis é um medicamento de prescrição utilizado para tratar os sintomas da pressão arterial elevada (hipertensão) e para reduzir o risco de doenças cardiovasculares, como acidente vascular cerebral e ataque cardíaco. Micardis 20mg pode ser usado sozinho ou com outros medicamentos.
Micardis 80mg pertence a uma classe de medicamentos chamados BRAs.
Não se sabe se Micardis é seguro e eficaz em crianças com menos de 18 anos de idade.
Quais são os possíveis efeitos colaterais do Micardis?
Micardis 80mg pode causar efeitos colaterais graves, incluindo:
- tontura,
- inchaço,
- ganho de peso rápido,
- náusea,
- fraqueza,
- sensação de formigamento,
- dor no peito,
- batimentos cardíacos irregulares e
- perda de movimento
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns de Micardis incluem:
- nariz entupido,
- Sinusite,
- dores nas costas e
- diarréia
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Micardis. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
AVISO
TOXICIDADE FETAL
- Quando a gravidez for detectada, descontinue MICARDIS 40mg assim que possível [ver AVISOS E PRECAUÇÕES e Uso em populações específicas ].
- Drogas que agem diretamente no sistema renina-angiotensina podem causar lesão e morte do feto em desenvolvimento [ver AVISOS E PRECAUÇÕES e Uso em populações específicas ].
DESCRIÇÃO
MICARDIS 40mg é um antagonista não peptídico do receptor da angiotensina II (tipo AT1).
Telmisartan é quimicamente descrito como 4'-[(1,4'-dimetil-2'-propil [2,6'-bi-1H-benzimidazol]-1'-il)metil ácido ]-[1,1'-bifenil]-2-carboxílico. Sua fórmula empírica é C33H30N4O2, seu peso molecular é 514,63, e sua fórmula estrutural é:
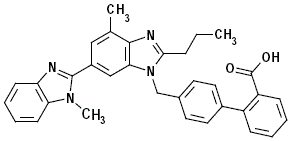
Telmisartan é um sólido branco a levemente amarelado. É praticamente insolúvel em água e na faixa de pH de 3 a 9, pouco solúvel em ácido forte (exceto insolúvel em ácido clorídrico) e solúvel em base forte.
MICARDIS 20 mg está disponível em comprimidos para administração oral, contendo 20 mg, 40 mg ou 80 mg de telmisartan. Os comprimidos contêm os seguintes ingredientes inativos: hidróxido de sódio, meglumina, povidona, sorbitol e estearato de magnésio. Os comprimidos MICARDIS são higroscópicos e requerem proteção contra umidade.
INDICAÇÕES
MICARDIS HCT (telmisartan e hidroclorotiazida) é indicado para o tratamento da hipertensão, para baixar a pressão arterial. A redução da pressão arterial reduz o risco de eventos cardiovasculares fatais e não fatais, principalmente derrames e infartos do miocárdio. Esses benefícios foram observados em ensaios controlados de medicamentos anti-hipertensivos de uma ampla variedade de classes farmacológicas, incluindo as classes às quais esse medicamento pertence principalmente. Não há estudos controlados que demonstrem redução de risco com MICARDIS HCT.
controle da hipertensão arterial deve fazer parte do gerenciamento abrangente do risco cardiovascular, incluindo, conforme apropriado, controle lipídico, controle do diabetes, terapia antitrombótica, cessação do tabagismo, exercícios e ingestão limitada de sódio. Muitos pacientes precisarão de mais de um medicamento para atingir as metas de pressão arterial. Para obter conselhos específicos sobre metas e gerenciamento, consulte as diretrizes publicadas, como as do Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC) do National High Blood Pressure Education Program.
Numerosos medicamentos anti-hipertensivos, de várias classes farmacológicas e com diferentes mecanismos de ação, têm demonstrado em ensaios clínicos randomizados reduzir a morbimortalidade cardiovascular, podendo-se concluir que é a redução da pressão arterial, e não alguma outra propriedade farmacológica do medicamento. os medicamentos, que é o grande responsável por esses benefícios. O maior e mais consistente benefício de resultado cardiovascular tem sido a redução do risco de acidente vascular cerebral, mas reduções no infarto do miocárdio e na mortalidade cardiovascular também foram observadas regularmente.
pressão sistólica ou diastólica elevada causa aumento do risco cardiovascular, e o aumento do risco absoluto por mmHg é maior em pressões sanguíneas mais altas, de modo que mesmo reduções modestas da hipertensão grave podem proporcionar benefícios substanciais. A redução do risco relativo da redução da pressão arterial é semelhante em populações com risco absoluto variável, portanto, o benefício absoluto é maior em pacientes que estão em maior risco independentemente de sua hipertensão (por exemplo, pacientes com diabetes ou hiperlipidemia), e esses pacientes seriam esperados beneficiar de um tratamento mais agressivo para uma meta de pressão arterial mais baixa.
Alguns medicamentos anti-hipertensivos têm efeitos menores na pressão arterial (como monoterapia) em pacientes negros, e muitos medicamentos anti-hipertensivos têm indicações e efeitos adicionais aprovados (por exemplo, na angina, insuficiência cardíaca ou doença renal diabética). Essas considerações podem orientar a seleção da terapia [ver Estudos clínicos ].
MICARDIS 40mg HCT não é indicado para terapia inicial para o tratamento da hipertensão [ver DOSAGEM E ADMINISTRAÇÃO ].
MICARDIS HCT pode ser usado sozinho ou em combinação com outros agentes anti-hipertensivos.
DOSAGEM E ADMINISTRAÇÃO
Informações de dosagem
Iniciar um paciente cuja pressão arterial não esteja adequadamente controlada com telmisartana monoterapia 80 mg em MICARDIS 40 mg HCT, 80 mg/12,5 mg uma vez ao dia. A dose pode ser titulada até 160 mg/25 mg após 2 a 4 semanas, se necessário.
Iniciar um paciente cuja pressão arterial não esteja adequadamente controlada com 25 mg de hidroclorotiazida uma vez ao dia, ou esteja controlada, mas que apresente hipocalemia com este regime com MICARDIS HCT 80 mg/12,5 mg uma vez ao dia. A dose pode ser titulada até 160 mg/25 mg após 2 a 4 semanas, se necessário.
Os pacientes titulados para os componentes individuais (telmisartana e hidroclorotiazida) podem receber a dose correspondente de MICARDIS 20 mg HCT.
MICARDIS 20mg HCT pode ser administrado com outros medicamentos anti-hipertensivos.
Ajuste de Dose Para Insuficiência Hepática
Iniciar pacientes com distúrbios obstrutivos biliares ou insuficiência hepática sob supervisão médica rigorosa usando a combinação de 40 mg/12,5 mg. Os comprimidos de MICARDIS 40mg HCT não são recomendados para pacientes com insuficiência hepática grave [ver Uso em populações específicas e FARMACOLOGIA CLÍNICA ].
Instruções importantes de administração
Os comprimidos de MICARDIS HCT não devem ser removidos dos blisters até imediatamente antes da administração.
COMO FORNECIDO
Formas de dosagem e pontos fortes
- 40 mg/12,5 mg, comprimidos vermelhos e brancos marcados com o logotipo da Boehringer Ingelheim e H4
- 80 mg/12,5 mg, comprimidos vermelhos e brancos marcados com o logotipo da Boehringer Ingelheim e H8
- 80 mg/25 mg, comprimidos amarelos e brancos marcados com o logótipo Boehringer Ingelheim e H9
Armazenamento e manuseio
MICARDIS 20mg HCT está disponível em três dosagens como comprimidos biconvexos, oblongos, não revestidos, contendo telmisartana e hidroclorotiazida:
- Comprimido de 40 mg/12,5 mg: vermelho e branco (pode conter pontos vermelhos) marcados com o símbolo da empresa Boehringer Ingelheim e H4; embalados individualmente em blisters em embalagens de 30 comprimidos em 3 x 10 cartões ( NDC 0597-0043-37)
- Comprimido de 80 mg/12,5 mg: vermelho e branco (pode conter manchas vermelhas) marcados com o símbolo da empresa Boehringer Ingelheim e H8; embalados individualmente em blisters em embalagens de 30 comprimidos em 3 x 10 cartões ( NDC 0597-0044-37)
- Comprimido de 80 mg/25 mg: amarelo e branco (pode conter pontos amarelos) marcados com o símbolo da empresa Boehringer Ingelheim e H9; embalados individualmente em blisters em embalagens de 30 comprimidos em 3 x 10 cartões ( NDC 0597-0042-37)
Armazenar
Armazenar a 25°C (77°F); excursões permitidas para 15°C-30°C (59°F-86°F) [consulte Temperatura ambiente controlada pela USP]. Os comprimidos não devem ser removidos dos blisters até imediatamente antes da administração.
Distribuído por: Boehringer Ingelheim Pharmaceuticals, Inc. Ridgefield, CT 06877 EUA. Revisado: outubro de 2018
EFEITOS COLATERAIS
As seguintes reações adversas são discutidas em outra parte da bula:
- Hipotensão [ver AVISOS E PRECAUÇÕES ]
- Insuficiência Renal [ver AVISOS E PRECAUÇÕES ]
- Distúrbios eletrolíticos e metabólicos [ver AVISOS E PRECAUÇÕES ]
Experiência de Ensaios Clínicos
Como os estudos clínicos são conduzidos em condições muito variadas, as taxas de reações adversas observadas nos estudos clínicos de um medicamento não podem ser comparadas diretamente com as taxas nos estudos clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
MICARDIS HCT foi avaliado quanto à segurança em mais de 1.700 pacientes, incluindo 716 tratados para hipertensão por mais de 6 meses e 420 por mais de 1 ano. As reações adversas foram limitadas àquelas que foram previamente relatadas com telmisartana e/ou hidroclorotiazida.
As reações adversas que ocorrem com incidência ≥2% em pacientes tratados com telmisartana/hidroclorotiazida e em uma taxa maior do que em pacientes tratados com placebo são apresentadas na Tabela 1 [ver Estudos clínicos ].
Outras reações adversas observadas com telmisartana/hidroclorotiazida foram: dor (incluindo nas costas e abdominal), dispepsia, eritema, vômito, bronquite e faringite.
As reações adversas ocorreram aproximadamente nas mesmas taxas em homens e mulheres, pacientes mais velhos e mais jovens, e pacientes negros e não negros.
Telmisartana
Outros eventos adversos que foram relatados com telmisartana estão listados abaixo:
Sistema nervoso autónomo: impotência, aumento da sudorese, rubor
Corpo como um todo: alergia, febre, dor nas pernas, dor no peito
Cardiovascular: palpitação, angina pectoris, ECG anormal, hipertensão, edema periférico
Sistema nervoso central: insônia, sonolência, enxaqueca, parestesia, contrações musculares involuntárias, hipoestesia
Gastrointestinal: flatulência, constipação, gastrite, boca seca, hemorróidas, refluxo gastroesofágico, dor de dente
Hepato-biliar: elevações das enzimas hepáticas ou bilirrubina sérica
Metabólico: gota, hipercolesterolemia, diabetes mellitus
Musculoesquelético: artrite, artralgia, cãibras nas pernas, mialgia
Psiquiátrico: ansiedade, depressão, nervosismo
Mecanismo de resistência: infecção, abscesso, otite média
Respiratório: asma, rinite, dispneia, epistaxe
Pele: dermatite, eczema, prurido
Urinário: frequência de micção, cistite
Vascular: distúrbio cerebrovascular
Sentidos Especiais: visão anormal, conjuntivite, zumbido, dor de ouvido
Hidroclorotiazida
Outros eventos adversos que foram relatados com hidroclorotiazida estão listados abaixo:
Corpo como um todo: fraqueza
Digestivo: pancreatite, icterícia (icterícia colestática intra-hepática), sialoadenite, cólicas, irritação gástrica
Hematologico: anemia aplástica, agranulocitose, leucopenia, anemia hemolítica, trombocitopenia
Hipersensibilidade: púrpura, fotossensibilidade, urticária, angeíte necrosante (vasculite e vasculite cutânea), febre, dificuldade respiratória incluindo pneumonite e edema pulmonar, reações anafiláticas
Metabólico: hiperglicemia, glicosúria
Musculoesquelético: espasmo muscular
Sistema Nervoso/Psiquiátrico: inquietação
Renal: nefrite intersticial
Pele: eritema multiforme incluindo síndrome de Stevens-Johnson, dermatite esfoliativa incluindo necrólise epidérmica tóxica
Sentidos Especiais: visão turva transitória, xantopsia
Achados do Laboratório Clínico
Creatinina, Nitrogênio de Uréia no Sangue (BUN)
Aumentos na ureia (≥11,2 mg/dL) e creatinina sérica (≥0,5 mg/dL) foram observados em 2,8% e 1,4%, respectivamente, de pacientes com hipertensão essencial tratados com MICARDIS 80 mg HCT comprimidos em estudos controlados. Nenhum paciente descontinuou o tratamento com MICARDIS 80mg HCT comprimidos devido a um aumento no BUN ou creatinina [ver AVISOS E PRECAUÇÕES ].
Experiência pós-marketing
As seguintes reações adversas foram identificadas durante o uso pós-aprovação de MICARDIS HCT. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento.
Distúrbios do Sangue e do Sistema Linfático: eosinofilia
Distúrbios cardíacos: fibrilação atrial, insuficiência cardíaca congestiva, infarto do miocárdio, taquicardia, bradicardia
Distúrbios do ouvido e labirinto: vertigem
Distúrbios Gerais e Condições do Local de Administração: astenia, edema
Hepato-biliar: Função hepática anormal/distúrbio do fígado
Distúrbios do sistema imunológico: reação anafilática
Infecções e Infestações: infecção do trato urinário
Investigações: CPK aumentado
Distúrbios do Metabolismo e Nutrição: hipoglicemia (em pacientes diabéticos)
Distúrbios musculoesqueléticos e do tecido conjuntivo: dor no tendão (incluindo tendinite, tenossinovite), rabdomiólise
Distúrbios do sistema nervoso: síncope, dor de cabeça
Distúrbios Renais e Urinários: insuficiência renal, insuficiência renal incluindo insuficiência renal aguda
Distúrbios do sistema reprodutor e da mama: disfunção erétil
Distúrbios respiratórios, torácicos e mediastinais: tossir
Distúrbios da Pele e Tecidos Subcutâneos: erupção medicamentosa (erupção cutânea tóxica principalmente relatada como toxicodermia, erupção cutânea e urticária), angioedema (com resultado fatal)
Distúrbio Vascular: hipotensão ortostática
INTERAÇÕES MEDICAMENTOSAS
Agentes que aumentam o potássio sérico
A coadministração de telmisartana com outros medicamentos que elevam os níveis séricos de potássio pode resultar em hipercalemia. Monitorar o potássio sérico nesses pacientes.
Lítio
Aumentos nas concentrações séricas de lítio e toxicidade do lítio foram relatados com o uso concomitante de diuréticos tiazídicos ou antagonistas dos receptores da angiotensina II, incluindo telmisartana. Monitore os níveis de lítio em pacientes recebendo MICARDIS 80mg HCT e lítio.
Agentes anti-inflamatórios não esteroides, incluindo inibidores seletivos de ciclooxigenas E-2
Telmisartana
Anti-inflamatórios não esteroides, incluindo inibidores seletivos da ciclooxigenase-2 (inibidores da COX-2): em pacientes idosos, com depleção de volume (incluindo aqueles em terapia diurética) ou com função renal comprometida, a coadministração de AINEs, incluindo inibidores seletivos de COX-2, com BRAs, incluindo telmisartana, podem resultar em deterioração da função renal, incluindo possível insuficiência renal aguda. Estes efeitos são geralmente reversíveis. O efeito anti-hipertensivo dos BRAs pode ser atenuado pelos AINEs. Portanto, monitore a função renal e a pressão arterial periodicamente em pacientes recebendo MICARDIS 40mg HCT e AINEs.
Hidroclorotiazida
administração de um agente anti-inflamatório não esteroidal, incluindo um inibidor seletivo de COX2, pode reduzir os efeitos diuréticos, natriuréticos e anti-hipertensivos dos diuréticos. Portanto, quando MICARDIS HCT e agentes anti-inflamatórios não esteroides, incluindo inibidores seletivos de COX2, são usados concomitantemente, observe atentamente para determinar se o efeito desejado do diurético é obtido.
Duplo bloqueio do sistema renina-angiotensina-aldosterona e alterações na função renal
bloqueio duplo do sistema renina-angiotensina-aldosterona (RAS) com bloqueadores da angiotensina, inibidores da ECA ou alisquireno está associado a riscos aumentados de hipotensão, hipercalemia e insuficiência renal. O estudo ONTARGET envolveu 25.620 pacientes ≥55 anos com doença aterosclerótica ou diabetes com lesão de órgão-alvo, randomizando-os para apenas telmisartana (BRA), ramipril (inibidor da ECA) ou a combinação, e os acompanhou por uma média de 56 meses . Os pacientes que receberam a combinação de BRA e inibidor da ECA não obtiveram nenhum benefício adicional (sem redução adicional do risco de morte cardiovascular, infarto do miocárdio, acidente vascular cerebral ou hospitalização por insuficiência cardíaca) em comparação com a monoterapia com BRA ou a monoterapia com inibidor da ECA, mas experimentaram um aumento incidência de disfunção renal (por exemplo, insuficiência renal aguda) em comparação com grupos de monoterapia.
Em geral, evite o uso combinado de inibidores do RAS. Monitore de perto a pressão arterial, a função renal e os eletrólitos em pacientes em uso de MICARDIS 40mg HCT e outros agentes que afetam o EAR.
Não coadministre alisquireno com MICARDIS HCT em pacientes com diabetes. Evite o uso concomitante de alisquireno com MICARDIS HCT em pacientes com insuficiência renal (TFG
Digoxina
Quando o telmisartan foi coadministrado com digoxina, foram observados aumentos medianos na concentração plasmática máxima de digoxina (49%) e na concentração mínima (20%). Monitorar os níveis de digoxina em pacientes tomando MICARDIS 40mg HCT concomitantemente e digoxina.
Drogas antidiabéticas (agentes orais e insulina)
Pode ser necessário ajuste de dose de medicamentos antidiabéticos quando coadministrados com hidroclorotiazida.
Resinas Colestiramina e Colestipol
absorção de hidroclorotiazida é prejudicada na presença de resinas de troca aniônica. Escalonar a dosagem de hidroclorotiazida e da resina de modo que a hidroclorotiazida seja administrada pelo menos 4 horas antes ou 4 a 6 horas após a administração da resina.
AVISOS
Incluído como parte do "PRECAUÇÕES" Seção
PRECAUÇÕES
Toxicidade Fetal
Telmisartana
O uso de drogas que atuam no sistema renina-angiotensina durante o segundo e terceiro trimestres de gestação reduz a função renal fetal e aumenta a morbidade e morte fetal e neonatal. O oligoidrâmnio resultante pode estar associado a hipoplasia pulmonar fetal e deformações esqueléticas. Os potenciais efeitos adversos neonatais incluem hipoplasia do crânio, anúria, hipotensão, insuficiência renal e morte. Quando a gravidez for detectada, descontinue MICARDIS HCT assim que possível.
Hidroclorotiazida
As tiazidas atravessam a barreira placentária e aparecem no sangue do cordão umbilical. As reações adversas incluem icterícia fetal ou neonatal e trombocitopenia [ver Uso em populações específicas ].
Hipotensão em pacientes com depleção de volume ou sal
Em pacientes com um sistema renina-angiotensina ativado, como pacientes com depleção de volume ou sal (por exemplo, aqueles que estão sendo tratados com altas doses de diuréticos), pode ocorrer hipotensão sintomática após o início do tratamento com MICARDIS HCT. Corrija a depleção de volume ou sal antes da administração de MICARDIS 80mg HCT.
Função Renal Prejudicada
Alterações na função renal, incluindo insuficiência renal aguda, podem ser causadas por drogas que inibem o sistema reninangiotensina e por diuréticos. Pacientes cuja função renal pode depender em parte da atividade do sistema renina-angiotensina (p. , ou insuficiência renal aguda em MICARDIS HCT. Monitore a função renal periodicamente nesses pacientes. Considere suspender ou descontinuar a terapia em pacientes que desenvolverem uma diminuição clinicamente significativa da função renal com MICARDIS HCT.
Distúrbios Eletrólitos e Metabólicos
Medicamentos, incluindo telmisartana, que inibem o sistema renina-angiotensina podem causar hipercalemia, particularmente em pacientes com insuficiência renal, diabetes ou uso combinado com outros bloqueadores dos receptores da angiotensina ou inibidores da ECA e o uso concomitante de outros medicamentos que aumentam os níveis séricos de potássio [ver INTERAÇÕES MEDICAMENTOSAS ].
A hidroclorotiazida pode causar hipocalemia e hiponatremia. As tiazidas demonstraram aumentar a excreção urinária de magnésio; isso pode resultar em hipomagnesemia. A hipomagnesemia pode resultar em hipocalemia que pode ser difícil de tratar apesar da reposição de potássio. Monitore os eletrólitos séricos periodicamente.
Em estudos controlados usando o tratamento combinado de telmisartana/hidroclorotiazida, nenhum paciente administrado 40 mg/12,5 mg, 80 mg/12,5 mg ou 80 mg/25 mg apresentou diminuição do potássio ≥1,4 mEq/L, e nenhum paciente apresentou hipercalemia.
hidroclorotiazida diminui a excreção urinária de cálcio e pode causar elevações do cálcio sérico.
A hidroclorotiazida pode alterar a tolerância à glicose e aumentar os níveis séricos de colesterol e triglicerídeos.
Hiperuricemia pode ocorrer ou gota franca pode ser precipitada em certos pacientes recebendo terapia com tiazida. Como o telmisartan diminui o ácido úrico, o telmisartan em combinação com a hidroclorotiazida atenua a hiperuricemia induzida por diuréticos.
Reação de hipersensibilidade
Hidroclorotiazida
As reações de hipersensibilidade à hidroclorotiazida podem ocorrer em pacientes com ou sem histórico de alergia ou asma brônquica, mas são mais prováveis em pacientes com esse histórico [ver CONTRA-INDICAÇÕES ].
Miopia aguda e glaucoma secundário de ângulo fechado
hidroclorotiazida, uma sulfonamida, pode causar uma reação idiossincrática, resultando em miopia transitória aguda e glaucoma agudo de ângulo fechado. Os sintomas incluem início agudo de diminuição da acuidade visual ou dor ocular e geralmente ocorrem dentro de horas a semanas após o início da droga. O glaucoma agudo de ângulo fechado não tratado pode levar à perda permanente da visão. O tratamento primário é descontinuar a hidroclorotiazida o mais rápido possível. Tratamentos médicos ou cirúrgicos imediatos podem precisar ser considerados se a pressão intraocular permanecer descontrolada. Os fatores de risco para o desenvolvimento de glaucoma agudo de ângulo fechado podem incluir história de alergia à sulfonamida ou à penicilina.
Lúpus Eritematoso Sistêmico
Diuréticos tiazídicos podem causar exacerbação ou ativação do lúpus eritematoso sistêmico.
Pacientes pós-simpatectomia
Os efeitos anti-hipertensivos da hidroclorotiazida podem ser aumentados no paciente pós-simpatectomia.
Informações de Aconselhamento do Paciente
Aconselhe o paciente a ler o rótulo do paciente aprovado pela FDA ( INFORMAÇÃO DO PACIENTE ).
Gravidez
Aconselhar as pacientes do sexo feminino em idade fértil sobre as consequências da exposição a MICARDIS 40mg HCT durante a gravidez. Discuta as opções de tratamento com as mulheres que planejam engravidar. Diga às pacientes para relatar a gravidez a seus médicos o mais rápido possível [ver AVISOS E PRECAUÇÕES e Uso em populações específicas ].
Lactação
Aconselhe as mulheres que amamentam a não amamentar durante o tratamento com MICARDIS HCT [ver Uso em populações específicas ].
Hipotensão sintomática e síncope
Aconselhe os pacientes que tonturas podem ocorrer, especialmente durante os primeiros dias de terapia, e informe-os ao seu médico. Informar os pacientes que a ingestão inadequada de líquidos, transpiração excessiva, diarreia ou vômitos podem levar a uma queda excessiva da pressão arterial, com as mesmas consequências de tontura e possível síncope. Aconselhe os pacientes a entrar em contato com seu médico se ocorrer síncope [ver AVISOS E PRECAUÇÕES ].
Suplementos de potássio
Aconselhar os pacientes a não usar suplementos de potássio ou substitutos do sal que contenham potássio sem consultar o médico prescritor [ver AVISOS E PRECAUÇÕES e INTERAÇÕES MEDICAMENTOSAS ].
Miopia aguda e glaucoma secundário de ângulo fechado
Aconselhe os pacientes a descontinuar MICARDIS 80mg HCT e procurar atendimento médico imediato se apresentarem sintomas de Miopia Aguda ou Glaucoma Secundário de Fechamento Angular [ver AVISOS E PRECAUÇÕES ].
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Telmisartana e Hidroclorotiazida
Não foram realizados estudos de carcinogenicidade, mutagenicidade ou fertilidade com a combinação de telmisartana e hidroclorotiazida.
Telmisartana
Não houve evidência de carcinogenicidade quando o telmisartan foi administrado na dieta de camundongos e ratos por até 2 anos. As doses mais altas administradas a camundongos (1000 mg/kg/dia) e ratos (100 mg/kg/dia) são, na base de mg/m2, cerca de 59 e 13 vezes, respectivamente, a dose humana máxima recomendada (MRHD) de telmisartana. Essas mesmas doses demonstraram fornecer exposições sistêmicas médias ao telmisartana > 100 vezes e > 25 vezes, respectivamente, a exposição sistêmica em humanos recebendo a MRHD de telmisartana (80 mg/dia).
Os ensaios de genotoxicidade não revelaram quaisquer efeitos relacionados com o telmisartan, quer ao nível do gene quer do cromossoma. Esses ensaios incluíram testes de mutagenicidade bacteriana com Salmonella e E. coli (Ames), um teste de mutação genética com células V79 de hamster chinês, um teste citogenético com linfócitos humanos e um teste de micronúcleo em camundongo.
Nenhum efeito relacionado à droga no desempenho reprodutivo de ratos machos e fêmeas foi observado com 100 mg/kg/dia (a dose mais alta administrada), cerca de 13 vezes, em uma base de mg/m2, a MRHD de telmisartana. Esta dose no rato resultou numa exposição sistémica média (AUC de telmisartan determinada no dia 6 de gravidez) pelo menos 50 vezes a exposição sistémica média em humanos na MRHD (80 mg/dia).
Hidroclorotiazida
Estudos de alimentação de dois anos em camundongos e ratos conduzidos sob os auspícios do Programa Nacional de Toxicologia (NTP) não revelaram evidência de potencial carcinogênico da hidroclorotiazida em camundongos fêmeas (em doses de até aproximadamente 600 mg/kg/dia) ou em machos e ratos fêmeas (em doses até aproximadamente 100 mg/kg/dia). O NTP, no entanto, encontrou evidências ambíguas de hepatocarcinogenicidade em camundongos machos.
A hidroclorotiazida não foi genotóxica in vitro no ensaio de mutagenicidade de Ames das cepas de Salmonella typhimurium TA 98, TA 100, TA 1535, TA 1537 e TA 1538 e no teste de ovário de hamster chinês (CHO) para aberrações cromossômicas, ou in vivo em ensaios usando cromossomos de células germinais de camundongos, cromossomos de medula óssea de hamster chinês e o gene recessivo de traço letal ligado ao sexo de Drosophila. Os resultados positivos do teste foram obtidos no ensaio in vitro CHO Sister Chromatid Exchange (clastogenicidade), no ensaio de célula de linfoma de camundongo (mutagenicidade) e no ensaio de não disjunção de Aspergillus nidulans.
hidroclorotiazida não teve efeitos adversos na fertilidade de camundongos e ratos de ambos os sexos em estudos em que essas espécies foram expostas, por meio de sua dieta, a doses de até 100 e 4 mg/kg, respectivamente, antes do acasalamento e durante a gestação.
Uso em populações específicas
Gravidez
Resumo do risco
MICARDIS HCT pode causar danos ao feto quando administrado a mulheres grávidas. O uso de drogas que atuam no sistema renina-angiotensina durante o segundo e terceiro trimestres da gravidez reduz a função renal fetal e aumenta a morbidade e morte fetal e neonatal (ver Considerações Clínicas ). A maioria dos estudos epidemiológicos examinando anormalidades fetais após exposição ao uso de anti-hipertensivos no primeiro trimestre não distinguiu drogas que afetam o sistema renina-angiotensina de outros agentes anti-hipertensivos. Estudos em ratos e coelhos com telmisartana mostraram toxicidade fetal apenas em doses maternas tóxicas (ver Dados ). Quando a gravidez for detectada, descontinue MICARDIS HCT assim que possível.
risco de fundo estimado de defeitos congênitos graves e aborto espontâneo para a população indicada é desconhecido. Todas as gestações têm um risco histórico de defeitos congênitos, perda ou outros resultados adversos. Na população geral dos EUA, o risco de fundo estimado de defeitos congênitos graves e aborto espontâneo em gestações clinicamente reconhecidas é de 2% a 4% e 15% a 20%, respectivamente.
Considerações Clínicas
Risco materno e/ou embrio/fetal associado à doença
A hipertensão na gravidez aumenta o risco materno de pré-eclâmpsia, diabetes gestacional, parto prematuro e complicações no parto (por exemplo, necessidade de cesariana e hemorragia pós-parto). A hipertensão aumenta o risco fetal de restrição de crescimento intrauterino e morte intrauterina. Mulheres grávidas com hipertensão devem ser cuidadosamente monitoradas e tratadas adequadamente.
Reações adversas fetais/neonatais
Telmisartana
uso de drogas que atuam no SRA no segundo e terceiro trimestres de gravidez pode resultar em: oligoidrâmnio, redução da função renal fetal levando a anúria e insuficiência renal, hipoplasia pulmonar fetal, deformações esqueléticas, incluindo hipoplasia do crânio, hipotensão e morte . No caso incomum de não haver alternativa adequada à terapia com medicamentos que afetem o sistema renina-angiotensina para um paciente em particular, informar a mãe sobre o risco potencial para o feto.
Em pacientes em uso de MICARDIS HCT durante a gravidez, realize exames ultrassonográficos seriados para avaliar o ambiente intra-amniótico. O teste fetal pode ser apropriado, com base na semana de gestação. Se for observado oligoidrâmnio, descontinuar MICARDIS HCT, a menos que seja considerado vital para a mãe. Pacientes e médicos devem estar cientes, entretanto, de que o oligoidrâmnio pode não aparecer até que o feto tenha sofrido lesão irreversível.
Observe atentamente os bebês com histórico de exposição in utero ao MICARDIS 20mg HCT para hipotensão, oligúria e hipercalemia. Se ocorrer oligúria ou hipotensão, apoiar a pressão arterial e a perfusão renal. Transfusões de troca ou diálise podem ser necessárias como meio de reverter a hipotensão e substituir a função renal [ver Uso em populações específicas ].
Hidroclorotiazida
As tiazidas atravessam a placenta e o uso de tiazidas durante a gravidez está associado ao risco de icterícia fetal ou neonatal, trombocitopenia e possíveis outras reações adversas que ocorreram em adultos.
Dados
Dados de animais
MICARDIS 40mg HCT
Um estudo de toxicidade de desenvolvimento foi realizado em ratos com doses de telmisartana/hidroclorotiazida de 3,2/1,0, 15/4,7, 50/15,6 e 0/15,6 mg/kg/dia. Embora as duas combinações de doses mais altas pareçam ser mais tóxicas (diminuição significativa no ganho de peso corporal) para as mães do que qualquer uma das drogas isoladamente, não parece haver um aumento na toxicidade para os embriões em desenvolvimento.
Telmisartana
Não foram observados efeitos teratogênicos quando o telmisartana foi administrado a ratas prenhas em doses orais de até 50 mg/kg/dia e a coelhas prenhas em doses orais de até 45 mg/kg/dia. Em coelhos, a letalidade embrionária associada à toxicidade materna (ganho de peso corporal reduzido e consumo de alimentos) foi observada em 45 mg/kg/dia (aproximadamente 12 vezes a dose humana máxima recomendada [MRHD] de 80 mg em uma base de mg/m2). Em ratos, doses de telmisartana de 15 mg/kg/dia (aproximadamente 1,9 vezes o MRHD em uma base de mg/m2) tóxicas para a mãe (ganho de peso corporal reduzido e consumo de alimentos reduzidos), administradas durante o final da gestação e lactação, produziram efeitos adversos em recém-nascidos, incluindo viabilidade reduzida, baixo peso ao nascer, atraso na maturação e diminuição do ganho de peso. As doses de efeito não observadas para toxicidade no desenvolvimento em ratos e coelhos, 5 e 15 mg/kg/dia, respectivamente, são aproximadamente 0,64 e 3,7 vezes, respectivamente, com base em mg/m2, a MRHD de telmisartana (80 mg/dia ).
Hidroclorotiazida
Estudos nos quais a hidroclorotiazida foi administrada a camundongos e ratas grávidas durante seus respectivos períodos de organogênese importante em doses de até 3.000 e 1.000 mg/kg/dia, respectivamente (cerca de 600 e 400 vezes a MRHD), não forneceram evidências de danos ao feto .
As tiazidas podem atravessar a placenta e as concentrações alcançadas na veia umbilical aproximam-se das do plasma materno. A hidroclorotiazida, como outros diuréticos, pode causar hipoperfusão placentária. Acumula-se no líquido amniótico, com concentrações relatadas até 19 vezes maiores que no plasma da veia umbilical. O uso de tiazidas durante a gravidez está associado ao risco de icterícia fetal ou neonatal ou trombocitopenia. Como não previnem ou alteram o curso da EPH (Edema, Proteinúria, Hipertensão) gestose (pré-eclâmpsia), esses medicamentos não devem ser usados para tratar a hipertensão em mulheres grávidas. O uso de hidroclorotiazida para outras indicações (por exemplo, doença cardíaca) na gravidez deve ser evitado.
Lactação
Resumo do risco
Não há informações sobre a presença de MICARDIS 20mg HCT ou telmisartana no leite humano, os efeitos no lactente ou os efeitos na produção de leite. Estudos publicados limitados relatam que a hidroclorotiazida está presente no leite humano. No entanto, não há informações suficientes para determinar os efeitos da hidroclorotiazida no lactente ou os efeitos da hidroclorotiazida na produção de leite. Telmisartan está presente no leite de ratas lactantes. (Vejo Dados ). Devido ao potencial de reações adversas graves no lactente, incluindo hipotensão, hipercalemia e insuficiência renal, aconselhe a lactante a não amamentar durante o tratamento com MICARDIS HCT.
Dados
Telmisartana estava presente no leite de ratas lactantes em concentrações 1,5 a 2 vezes as encontradas no plasma de 4 a 8 horas após a administração.
Uso Pediátrico
A segurança e a eficácia de MICARDIS HCT em pacientes pediátricos não foram estabelecidas.
Recém-nascidos com histórico de exposição in utero ao MICARDIS HCT
Se ocorrer oligúria ou hipotensão, apoiar a pressão arterial e a perfusão renal. Transfusões de troca ou diálise podem ser necessárias como meio de reverter a hipotensão e/ou substituir a função renal desordenada.
Uso Geriátrico
Nos ensaios clínicos controlados (n=1017), aproximadamente 20% dos doentes tratados com telmisartan/hidroclorotiazida tinham 65 anos ou mais e 5% tinham 75 anos ou mais. Não foram observadas diferenças globais na eficácia e segurança de telmisartan/hidroclorotiazida nestes doentes em comparação com doentes mais jovens. Outras experiências clínicas relatadas não identificaram diferenças nas respostas entre idosos e pacientes mais jovens, mas não se pode descartar uma maior sensibilidade de alguns indivíduos mais velhos. Em geral, a seleção da dose para um paciente idoso deve ser cautelosa, geralmente começando na extremidade inferior da faixa de dosagem, refletindo a maior frequência de diminuição da função hepática, renal ou cardíaca e de doenças concomitantes ou outras terapias medicamentosas.
Uso em pacientes com insuficiência hepática
Pacientes com distúrbios obstrutivos biliares ou insuficiência hepática devem iniciar o tratamento sob supervisão médica rigorosa usando a combinação de 40 mg/12,5 mg.
Telmisartana
Como a maior parte de telmisartana é eliminada por excreção biliar, espera-se que pacientes com distúrbios obstrutivos biliares ou insuficiência hepática tenham depuração reduzida e níveis sanguíneos mais elevados.
Hidroclorotiazida
Alterações menores do equilíbrio hidroeletrolítico podem precipitar coma hepático em pacientes com função hepática comprometida ou doença hepática progressiva.
Uso em pacientes com insuficiência renal
A segurança e a eficácia de MICARDIS 40mg HCT em pacientes com insuficiência renal grave (ClCr ≤30 mL/min) não foram estabelecidas. Em pacientes com insuficiência renal grave, os comprimidos de MICARDIS 80 mg HCT não são recomendados. Não é necessário ajuste de dose em pacientes com insuficiência renal leve (CrCl 60 a 90 mL/min) ou moderada (CrCl 30 a 60 mL/min).
SOBREDOSAGEM
Telmisartana
Dados limitados estão disponíveis em relação à superdosagem de telmisartana em humanos. As manifestações mais prováveis de superdosagem com telmisartana são hipotensão, tontura e taquicardia; bradicardia pode ocorrer por estimulação parassimpática (vagal). Se ocorrer hipotensão sintomática, deve ser instituído tratamento de suporte. Telmisartan não é removido por hemodiálise.
Hidroclorotiazida
Os sinais e sintomas mais comuns observados em pacientes com superdosagem de hidroclorotiazida são aqueles causados por depleção eletrolítica (hipocalemia, hipocloremia, hiponatremia) e desidratação resultante de diurese excessiva. Se digitálicos também foram administrados, a hipocalemia pode acentuar as arritmias cardíacas. O grau de remoção da hidroclorotiazida por hemodiálise não foi estabelecido. A LD oral da hidroclorotiazida é superior a 10 g/kg em camundongos e ratos.
CONTRA-INDICAÇÕES
MICARDIS HCT é contraindicado:
- Em pacientes hipersensíveis a qualquer componente deste produto [ver AVISOS E PRECAUÇÕES ].
- Em pacientes com anúria.
- Para coadministração com alisquireno em pacientes com diabetes [ver INTERAÇÕES MEDICAMENTOSAS ].
FARMACOLOGIA CLÍNICA
Mecanismo de ação
MICARDIS 40mg HCT
MICARDIS 20mg HCT é uma combinação de dois medicamentos com propriedades anti-hipertensivas: um diurético tiazídico, a hidroclorotiazida, e um bloqueador do receptor da angiotensina II (BRA), o telmisartan.
Telmisartana
A angiotensina II é formada a partir da angiotensina I em uma reação catalisada pela enzima conversora de angiotensina (ECA, cininase II). A angiotensina II é o principal agente pressor do sistema renina-angiotensina, com efeitos que incluem vasoconstrição, estimulação da síntese e liberação de aldosterona, estimulação cardíaca e reabsorção renal de sódio. A telmisartana bloqueia os efeitos vasoconstritores e secretores de aldosterona da angiotensina II bloqueando seletivamente a ligação da angiotensina II ao receptor AT1 em muitos tecidos, como o músculo liso vascular e a glândula adrenal. Sua ação é, portanto, independente das vias de síntese da angiotensina II.
Há também um receptor AT2 encontrado em muitos tecidos, mas não se sabe que AT2 esteja associado à homeostase cardiovascular. Telmisartan tem afinidade muito maior (> 3.000 vezes) para o receptor AT1 do que para o receptor AT2.
Telmisartan não inibe a ECA (cininase II) nem se liga ou bloqueia outros receptores hormonais ou canais iônicos conhecidos por serem importantes na regulação cardiovascular.
O bloqueio do receptor da angiotensina II inibe o feedback regulatório negativo da angiotensina II sobre a secreção de renina, mas o resultante aumento da atividade da renina plasmática e dos níveis circulantes de angiotensina II não superam o efeito do telmisartan na pressão arterial.
Hidroclorotiazida
hidroclorotiazida é um diurético tiazídico. As tiazidas afetam os mecanismos tubulares renais de reabsorção de eletrólitos, aumentando diretamente a excreção de sal de sódio e cloreto em quantidades aproximadamente equivalentes. Indiretamente, a ação diurética da hidroclorotiazida reduz o volume plasmático, com consequente aumento da atividade da renina plasmática, aumento da secreção de aldosterona, aumento da perda urinária de potássio e diminuição do potássio sérico. A ligação renina-aldosterona é mediada pela angiotensina II, de modo que a coadministração de um BRA tende a reverter a perda de potássio associada a esses diuréticos. O mecanismo do efeito anti-hipertensivo das tiazidas não é totalmente compreendido.
Farmacodinâmica
Telmisartana
Em voluntários normais, uma dose de 80 mg de telmisartana inibiu a resposta pressora a uma infusão intravenosa de angiotensina II em aproximadamente 90% nas concentrações plasmáticas máximas, com aproximadamente 40% de inibição persistindo por 24 horas.
concentração plasmática de angiotensina II e a atividade da renina plasmática aumentaram de forma dose-dependente após administração única de telmisartana a indivíduos saudáveis e administração repetida a pacientes hipertensos. A administração diária de até 80 mg de telmisartana a indivíduos saudáveis não influenciou as concentrações plasmáticas de aldosterona. Em estudos de dose múltipla com pacientes hipertensos, não houve alterações clinicamente significativas nos eletrólitos (potássio ou sódio séricos) ou na função metabólica (incluindo níveis séricos de colesterol, triglicerídeos, HDL, LDL, glicose ou ácido úrico).
Os efeitos anti-hipertensivos de telmisartana foram estudados em seis ensaios clínicos controlados com placebo, incluindo um total de 1.773 pacientes com hipertensão leve a moderada (pressão arterial diastólica de 95 a 114 mmHg), 1.031 dos quais foram tratados com telmisartana. Após a administração de telmisartana uma vez ao dia, a magnitude da redução da pressão arterial da linha de base após a subtração do placebo foi de aproximadamente (PAS/PAD) 6-8/6 mmHg para 20 mg, 9-13/6-8 mmHg para 40 mg e 12 -13/7-8 mmHg para 80 mg. Doses maiores (até 160 mg) não parecem causar uma diminuição adicional da pressão arterial.
O início da atividade anti-hipertensiva ocorre em 3 horas, com redução máxima em aproximadamente 4 semanas. Nas doses de 20, 40 e 80 mg, o efeito anti-hipertensivo da administração de telmisartana uma vez ao dia foi mantido por todo o intervalo de dose de 24 horas.
Em 30 pacientes hipertensos com função renal normal tratados por 8 semanas com telmisartana 80 mg ou telmisartana 80 mg em combinação com hidroclorotiazida 12,5 mg, não houve alterações clinicamente significativas da linha de base no fluxo sanguíneo renal, taxa de filtração glomerular, fração de filtração, resistência renovascular, ou depuração de creatinina.
Hidroclorotiazida
Após a administração oral de hidroclorotiazida, a diurese começa em 2 horas, atinge o pico em cerca de 4 horas e dura aproximadamente 6 a 12 horas.
Interações medicamentosas
Hidroclorotiazida
Álcool, barbitúricos ou narcóticos
Pode ocorrer potencialização da hipotensão ortostática.
Relaxantes do músculo esquelético
Possível aumento da capacidade de resposta a relaxantes musculares, como derivados de curare.
Corticosteróides, ACTH
Depleção eletrolítica intensificada, particularmente hipocalemia.
Aminas pressoras (por exemplo, norepinefrina)
Possível resposta diminuída às aminas pressoras, mas não suficiente para impedir seu uso.
Farmacocinética
Telmisartana
Absorção:
Após administração oral, as concentrações máximas (Cmax) de telmisartana são atingidas em 0,5 a 1 hora após a administração. Os alimentos reduzem ligeiramente a biodisponibilidade do telmisartan, com uma redução na área sob a curva de concentração plasmática-tempo (AUC) de aproximadamente 6% com 40 mg e aproximadamente 20% após uma dose de 160 mg. MICARDIS 20mg HCT pode ser administrado com ou sem alimentos. A biodisponibilidade absoluta do telmisartan é dose-dependente. Em 40 e 160 mg a biodisponibilidade foi de 42% e 58%, respectivamente. A farmacocinética do telmisartan com MICARDIS 20 mg administrado por via oral não é linear no intervalo de dose de 20 a 160 mg, com aumentos mais do que proporcionais das concentrações plasmáticas (Cmax e AUC) com o aumento das doses. O telmisartan mostra uma cinética de decaimento biexponencial com uma meia-vida de eliminação terminal de aproximadamente 24 horas. As concentrações plasmáticas mínimas de telmisartana com dose única diária são aproximadamente 10% a 25% das concentrações plasmáticas máximas. Telmisartan tem um índice de acumulação no plasma de 1,5 a 2,0 após administração repetida de uma vez ao dia.
Distribuição:
O telmisartan liga-se fortemente às proteínas plasmáticas (>99,5%), principalmente à albumina e à α1-glicoproteína ácida. A ligação às proteínas plasmáticas é constante ao longo do intervalo de concentração alcançado com as doses recomendadas. O volume de distribuição do telmisartan é de aproximadamente 500 litros, indicando ligação tecidual adicional.
Metabolismo:
A telmisartana é metabolizada por conjugação para formar um acil glicuronídeo farmacologicamente inativo; o glicuronídeo do composto original é o único metabólito que foi identificado no plasma e na urina humanos. Após uma dose única, o glicuronídeo representa aproximadamente 11% da radioatividade medida no plasma. As isoenzimas do citocromo P450 não estão envolvidas no metabolismo do telmisartan.
Eliminação:
Após a administração intravenosa ou oral de telmisartan marcado com 14C, a maior parte da dose administrada (>97%) foi eliminada inalterada nas fezes por excreção biliar; apenas quantidades diminutas foram encontradas na urina (0,91% e 0,49% da radioatividade total, respectivamente).
A depuração plasmática total de telmisartana é >800 mL/min. A meia-vida terminal e a depuração total parecem ser independentes da dose.
Hidroclorotiazida
A hidroclorotiazida não é metabolizada, mas é rapidamente eliminada pelo rim. Quando os níveis plasmáticos foram acompanhados por pelo menos 24 horas, observou-se que a meia-vida plasmática variou entre 5,6 e 14,8 horas. Pelo menos 61% da dose oral é eliminada inalterada em 24 horas.
A hidroclorotiazida atravessa a barreira placentária, mas não a barreira hematoencefálica e é excretada no leite materno.
Populações Específicas
Telmisartana
Insuficiência renal
A telmisartana não é removida do sangue por hemofiltração [ver AVISOS E PRECAUÇÕES , e Uso em populações específicas ].
Insuficiência Hepática
Em pacientes com insuficiência hepática, as concentrações plasmáticas de telmisartana estão aumentadas e a biodisponibilidade absoluta se aproxima de 100% [ver Uso em populações específicas ].
Gênero
As concentrações plasmáticas de telmisartan são geralmente 2 a 3 vezes mais elevadas nas mulheres do que nos homens. Em ensaios clínicos, no entanto, não foram encontrados aumentos significativos na resposta da pressão arterial ou na incidência de hipotensão ortostática em mulheres. Não é necessário ajuste de dose.
Pacientes Geriátricos
A farmacocinética do telmisartan não difere entre os idosos e aqueles com menos de 65 anos de idade.
Estudos de interação medicamentosa
Telmisartana
Ramipril
coadministração de telmisartana 80 mg uma vez ao dia e ramipril 10 mg uma vez ao dia em indivíduos saudáveis aumenta a Cmax e a AUC do ramipril no estado de equilíbrio em 2,3 e 2,1 vezes, respectivamente, e a Cmax e AUC do ramiprilato em 2,4 e 1,5 vezes, respectivamente . Em contraste, a Cmax e a AUC do telmisartan diminuem em 31% e 16%, respectivamente. Ao co-administrar telmisartana e ramipril, a resposta pode ser maior devido aos possíveis efeitos farmacodinâmicos aditivos dos medicamentos combinados e também devido ao aumento da exposição ao ramipril e ao ramiprilato na presença de telmisartana.
Outras drogas
coadministração de telmisartana não resultou em interação clinicamente significativa com acetaminofeno, amlodipino, gliburida, sinvastatina, hidroclorotiazida, varfarina ou ibuprofeno. O telmisartan não é metabolizado pelo sistema do citocromo P450 e não teve efeitos in vitro nas enzimas do citocromo P450, exceto por alguma inibição do CYP2C19. Não se espera que o telmisartan interaja com medicamentos que inibem as enzimas do citocromo P450; também não se espera que interaja com drogas metabolizadas pelas enzimas do citocromo P450, exceto pela possível inibição do metabolismo de drogas metabolizadas pelo CYP2C19.
Estudos clínicos
Telmisartana e Hidroclorotiazida
Em ensaios clínicos controlados com mais de 2.500 pacientes hipertensos, 1.017 pacientes foram expostos a telmisartana (20 mg a 160 mg) e hidroclorotiazida concomitante (6,25 mg a 25 mg). Esses estudos incluíram um estudo fatorial (Estudo 1) com combinações de telmisartana (20 mg, 40 mg, 80 mg, 160 mg ou placebo) e hidroclorotiazida (6,25 mg, 12,5 mg, 25 mg e placebo). O ensaio fatorial randomizou 818 pacientes, incluindo 493 (60%) homens; 596 (73%) não negros e 222 (27%) negros; e 143 (18%) ≥65 anos (idade mediana foi de 53 anos). A pressão arterial média em decúbito dorsal na linha de base para a população total foi de 154/101 mmHg.
combinação de telmisartana e hidroclorotiazida resultou em reduções aditivas ajustadas ao placebo nas pressões sanguíneas sistólica e diastólica no vale de 16-21/9-11 mmHg para doses entre 40 mg/12,5 mg e 80 mg/25 mg, em comparação com 9-13 /7-8 mmHg para monoterapia com telmisartana 40 mg a 80 mg e 4/4 mmHg para monoterapia com hidroclorotiazida 12,5 mg. O efeito anti-hipertensivo foi independente da idade ou sexo. Não houve praticamente nenhuma alteração na frequência cardíaca em pacientes tratados com a combinação de telmisartana e hidroclorotiazida no estudo controlado por placebo.
Quatro outros estudos de pacientes hipertensos com pelo menos seis meses de duração permitiram a adição de hidroclorotiazida para pacientes que não foram adequadamente controlados com a dose randomizada de telmisartana em monoterapia ou que não obtiveram resposta adequada da pressão arterial após completar a titulação de telmisartana. Em estudos com controle ativo, a adição de 12,5 mg de hidroclorotiazida a doses tituladas de telmisartana em pacientes que não obtiveram ou mantiveram resposta adequada com a monoterapia com telmisartana reduziu ainda mais a pressão arterial sistólica e diastólica.
INFORMAÇÃO DO PACIENTE
MICARDIS® HCT (my-CAR-dis HCT) (telmis artan e hidroclorotiazida) Comprimidos
Leia esta Informação do Paciente antes de começar a tomar os comprimidos de MICARDIS HCT e sempre que receber um reabastecimento. Pode haver novas informações. Esta informação não substitui a conversa com o seu médico sobre a sua condição médica ou o seu tratamento.
Qual é a informação mais importante que devo saber sobre os comprimidos de MICARDIS 20mg HCT?
MICARDIS HCT pode causar danos ou morte ao feto. Fale com o seu médico sobre outras formas de baixar a pressão arterial se planeia engravidar. Se engravidar enquanto estiver a tomar MICARDIS 20 mg HCT, informe o seu médico imediatamente.
O que é MICARDIS HCT?
MICARDIS 40mg HCT é um medicamento de prescrição utilizado para tratar a pressão arterial elevada (hipertensão).
MICARDIS 40mg HCT contém:
- telmisartan, um bloqueador do receptor de angiotensina (BRA)
- hidroclorotiazida, uma pílula de água ou diurético
seu médico pode receitar-lhe outros medicamentos para tomar juntamente com MICARDIS 80 mg HCT para tratar a sua tensão arterial elevada.
Não se sabe se MICARDIS 40mg HCT é seguro e eficaz em crianças.
Não tome MICARDIS 20 mg HCT comprimidos se:
- tem baixa ou nenhuma produção de urina
- tem alergia (hipersensibilidade) aos ingredientes ativos (telmisartan ou hidroclorotiazida) ou a qualquer outro componente listado no final deste folheto
O que devo dizer ao meu médico antes de usar MICARDIS 40mg HCT comprimidos?
Antes de tomar MICARDIS 20 mg HCT comprimidos, informe o seu médico se:
- está grávida ou planeja engravidar. Ver “Qual é a informação mais importante que devo saber sobre os comprimidos MICARDIS 20mg HCT?”
- está amamentando ou planeja amamentar. MICARDIS 80mg HCT pode passar para o leite materno e pode prejudicar o seu bebé. Você e seu médico devem decidir se você vai tomar MICARDIS HCT ou amamentar. Você não deve fazer ambos. Fale com o seu médico sobre a melhor forma de alimentar o seu bebé se tomar os comprimidos de MICARDIS HCT.
- foi informado de que tem níveis anormais de sal corporal (eletrólitos) no sangue
- tem problemas de fígado
- tem asma ou história de asma
- tem lúpus
- tem diabetes
- tem problemas renais
- tem outras condições médicas
Informe o seu médico sobre todos os medicamentos que toma, incluindo medicamentos prescritos e não prescritos, vitaminas e suplementos de ervas. Além disso, informe o seu médico se você beber álcool.
MICARDIS 20mg HCT pode afetar a forma como outros medicamentos atuam, e outros medicamentos podem afetar a forma como MICARDIS 20mg HCT atua. Informe especialmente o seu médico se estiver a tomar:
- alisquireno
- digoxina (Lanoxin®)
- lítio (Lithobid®, carbonato de lítio, citrato de lítio)
- outros medicamentos utilizados para tratar a sua pressão arterial elevada ou um problema cardíaco
- pílulas de água (diurético)
- aspirina ou outros anti-inflamatórios não esteroides (AINEs)
- suplementos de potássio ou um substituto do sal contendo potássio
- medicamento usado para tratar diabetes, incluindo insulina
- medicamentos narcóticos para dor
- pílulas para dormir
- medicamento esteróide ou hormônio adrenocorticotrófico (ACTH)
- barbitúricos
- certos medicamentos para baixar o colesterol (resinas que são usadas para reduzir o colesterol, por exemplo, resinas de colestiramina e colestipol)
Pergunte ao seu médico se não tiver certeza se está tomando um dos medicamentos listados acima.
Conheça os medicamentos que você toma. Mantenha uma lista deles e mostre-a ao seu médico ou farmacêutico quando receber um novo medicamento.
Como devo tomar os comprimidos de MICARDIS HCT?
- Tome os comprimidos de MICARDIS 40mg HCT exatamente como o seu médico lhe disser.
- seu médico dir-lhe-á a quantidade de MICARDIS HCT que deve tomar e quando o deve tomar.
- Não altere a sua dose a menos que o seu médico lhe diga para o fazer.
- Tome MICARDIS HCT uma vez por dia.
- Tome os comprimidos de MICARDIS 20mg HCT com ou sem alimentos.
- Se você tomar muito MICARDIS HCT, ligue para o seu médico ou dirija-se imediatamente ao pronto-socorro do hospital mais próximo.
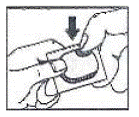
- Leia o “Como abrir a bolha” no final deste folheto antes de usar MICARDIS 20mg HCT. Fale com o seu médico se não compreender as instruções.
Quais são os possíveis efeitos colaterais dos comprimidos de MICARDIS 80mg HCT?
Os comprimidos de MICARDIS 20mg HCT podem causar efeitos colaterais graves, incluindo:
- Lesão ou morte do feto. Ver “Qual é a informação mais importante que devo saber sobre os comprimidos MICARDIS HCT?”
- Pressão arterial baixa (íon hipotensor) é mais provável de acontecer se você também:
- tomar pílulas de água (diuréticos)
- estão em uma dieta pobre em sal
- obter tratamentos de diálise
- tem problemas cardíacos
- ficar doente com vômitos ou diarréia
- não beba líquidos suficientes
- suar muito
- Problemas renais , que pode piorar se já tiver doença renal. Você pode ter alterações nos resultados do seu teste renal e pode precisar de uma dose mais baixa de MICARDIS 40 mg HCT comprimidos. Ligue para o seu médico se você tiver:
- inchaço nos pés, tornozelos ou mãos
- ganho de peso inexplicável
- Problemas de fígado, que pode piorar em pessoas que já têm problemas de fígado e tomam MICARDIS 40mg HCT.
- Problemas oculares. Um dos medicamentos de MICARDIS HCT pode causar problemas oculares que podem levar à perda de visão. Os sintomas de problemas oculares podem ocorrer dentro de horas a semanas após o início do MICARDIS
HCT. Informe o seu médico imediatamente se tiver:
- diminuição da visão
- dor nos olhos
- Reações alérgicas . Informe o seu médico imediatamente se tiver algum destes sintomas:
- inchaço da face, língua, garganta
- dificuldade para respirar
- Piora do lúpus. Informe o seu médico se o seu lúpus piorar ou se tornar ativo enquanto estiver a tomar MICARDIS 20 mg HCT.
- Alteração no nível de sais corporais (eletrólitos) no sangue e problemas de fluidos. O seu médico pode fazer testes para verificar o seu sangue. Ligue para o seu médico imediatamente se você tiver:
- boca seca
- sede
- cansaço
- sonolência
- inquietação
- confusão
- convulsões
- batimentos cardíacos rápidos
- fraqueza
- dores musculares ou cãibras
- produção de urina muito baixa
- náusea ou vômito
Se você se sentir fraco ou tonto, deite-se e chame seu médico imediatamente.
Ligue para o seu médico imediatamente se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns dos comprimidos de MICARDIS 80mg HCT incluem:
- infecções do trato respiratório superior, incluindo dor sinusal/congestão e dor de garganta
- tontura
- sentindo cansado
- sintomas como os da gripe
- dor nas costas
- diarréia
- náusea
Estes não são todos os efeitos colaterais possíveis com os comprimidos de MICARDIS 20mg HCT. Informe o seu médico se tiver algum efeito secundário que o incomode ou que não desapareça. Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
Como devo armazenar os comprimidos de MICARDIS 80mg HCT?
- Armazene os comprimidos de MICARDIS HCT à temperatura ambiente 68°F a 77°F (20°C a 25°C).
- Não remova os comprimidos de MICARDIS 40mg HCT das bolhas até pouco antes de tomá-los.
Mantenha os comprimidos de MICARDIS 80mg HCT e todos os medicamentos fora do alcance das crianças.
Informações gerais sobre os comprimidos de MICARDIS 40mg HCT:
Os medicamentos às vezes são prescritos para outros fins que não os listados em um folheto de informações ao paciente. Não use os comprimidos de MICARDIS HCT para uma condição para a qual não foi prescrito. Não dê MICARDIS 20mg HCT comprimidos a outras pessoas, mesmo que tenham a mesma condição que você. Pode prejudicá-los.
Este folheto informativo do paciente resume as informações mais importantes sobre os comprimidos de MICARDIS HCT. Se você quiser mais informações, converse com seu médico. Você pode pedir ao seu farmacêutico ou médico informações sobre os comprimidos MICARDIS 20mg HCT que são escritos para profissionais de saúde.
Para obter informações de prescrição atuais, digitalize o código abaixo ou ligue para a Boehringer Ingelheim Pharmaceuticals, Inc. em 1-800-542-6257 ou (TTY) 1-800-459-9906.
Quais são os ingredientes dos comprimidos MICARDIS 20mg HCT?
Princípios ativos: telmisartan e hidroclorotiazida
Ingredientes inativos: hidróxido de sódio, meglumina, povidona, sorbitol, estearato de magnésio, lactose monohidratada, celulose microcristalina, amido de milho e glicolato de amido sódico
Os comprimidos de 40 mg/12,5 mg e 80 mg/12,5 mg também contêm: óxido férrico vermelho.
Os comprimidos de 80 mg/25 mg também contêm: óxido férrico amarelo.
O que é pressão alta (hipertensão)?
pressão arterial é a força nos vasos sanguíneos quando o coração bate e quando o coração descansa. Você tem pressão alta quando a força é demais. Os medicamentos que baixam a pressão arterial diminuem a probabilidade de ter um acidente vascular cerebral ou ataque cardíaco.
A pressão alta faz com que o coração trabalhe mais para bombear o sangue pelo corpo e causa danos aos vasos sanguíneos. Os comprimidos de MICARDIS 80mg HCT podem ajudar a relaxar os vasos sanguíneos para que a pressão arterial seja mais baixa.
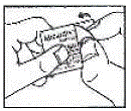
Como abrir a bolha:
Esta informação do paciente foi aprovada pela Food and Drug Administration dos EUA.
