Rhinocort 100mcg Budesonide Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Rhinocort Aqua e como é usado?
O spray nasal Rhinocort Aqua (budesonida) é um esteróide usado para tratar sintomas nasais, como congestão, espirros e coriza causados por alergias sazonais ou durante todo o ano. O spray nasal Rhinocort Aqua também é usado para evitar que os pólipos nasais retornem após a remoção cirúrgica.
Quais são os efeitos colaterais do Rhinocort 100mcg Aqua?
Os efeitos colaterais comuns do spray nasal Rhinocort Aqua incluem:
- secura ou irritação do nariz/garganta,
- dor de garganta,
- tosse,
- espirrando,
- hemorragias nasais,
- gosto/cheiro desagradável,
- feridas ou manchas brancas dentro ou ao redor do nariz, ou
- dor, inchaço, queimação, coceira ou irritação ao redor do nariz.
Informe o seu médico se tiver efeitos secundários raros mas graves do spray nasal Rhinocort Aqua, incluindo:
- perda de paladar ou olfato, ou
- dor ou feridas no nariz.
DESCRIÇÃO
Budesonida, o ingrediente ativo do spray nasal RHINOCORT AQUA (budesonida), é um corticosteroide sintético anti-inflamatório.
É designado quimicamente como (RS)-11-beta, 16-alfa, 17, 21-tetra-hidroxipregna-l,4-dieno-3,20-diona cíclico 16,17-acetal com butiraldeído.
Budesonida é fornecida como a mistura de dois epímeros (22R e 22S).
A fórmula empírica da budesonida é C25H34O6 e seu peso molecular é 430,5.
Sua fórmula estrutural é:
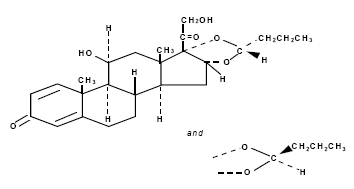
A budesonida é um pó branco a esbranquiçado, inodoro, praticamente insolúvel em água e em heptano, pouco solúvel em etanol e livremente solúvel em clorofórmio.
Seu coeficiente de partição entre octanol e água em pH 5 é 1,6 x 103.
spray nasal RHINOCORT AQUA (budesonida) é uma formulação de spray de bomba manual, sem perfume, de dose calibrada, contendo uma suspensão micronizada de budesonida em meio aquoso. Celulose microcristalina e carboximetilcelulose sódica, dextrose anidra, polissorbato 80, edetato dissódico, sorbato de potássio e água purificada estão contidos neste meio; ácido clorídrico é adicionado para ajustar o pH para um alvo de 4,5.
RHINOCORT 100mcg AQUA Nasal Spray fornece 32 mcg de budesonida por spray.
Cada frasco de spray nasal RHINOCORT 100mcg AQUA (budesonida) 32 mcg contém 120 sprays dosados após a aplicação inicial.
Antes do uso inicial, o recipiente deve ser agitado suavemente e a bomba deve ser escorvada acionando oito vezes. Se usado diariamente, a bomba não precisa ser reabastecida. Se não for usado por dois dias consecutivos, recarregue com um spray ou até que um spray fino apareça. Se não for usado por mais de 14 dias, enxágue o aplicador e volte a aplicar dois sprays ou até que apareça um spray fino.
INDICAÇÕES
Tratamento da rinite alérgica sazonal ou perene
O spray nasal RHINOCORT AQUA (budesonida) é indicado para o tratamento de sintomas nasais de rinite alérgica sazonal ou perene em adultos e crianças com seis anos de idade ou mais.
DOSAGEM E ADMINISTRAÇÃO
A dose inicial recomendada para adultos e crianças com 6 anos de idade ou mais é de 64 mcg por dia administrado como um spray por narina de RHINOCORT AQUA (budesonida) spray nasal 32 mcg uma vez ao dia. Alguns pacientes que não atingem o controle dos sintomas na dosagem inicial recomendada podem se beneficiar de um aumento da dosagem. A dose máxima recomendada para adultos (com idade igual ou superior a 12 anos) é de 256 mcg por dia administrada em quatro pulverizações por narina uma vez ao dia de RHINOCORT AQUA (budesonida) spray nasal 32 mcg e a dose máxima recomendada para pacientes pediátricos (6 a
É sempre desejável titular um paciente individual para a dosagem mínima eficaz para reduzir a possibilidade de efeitos colaterais. Uma melhora nos sintomas nasais pode ser observada em pacientes dentro de 10 horas após o primeiro uso de RHINOCORT 100mcg AQUA (budesonida) spray nasal, no entanto, a melhora clínica geralmente leva de 1 a 2 dias com benefício máximo em aproximadamente 2 semanas. Quando o benefício máximo for alcançado e os sintomas forem controlados, a redução da dose pode ser eficaz na manutenção do controle dos sintomas da rinite alérgica em pacientes que foram inicialmente controlados com doses mais altas.
Antes do uso inicial, o recipiente deve ser agitado suavemente e a bomba deve ser escorvada acionando oito vezes. Se usado diariamente, a bomba não precisa ser reabastecida. Se não for usado por dois dias consecutivos, recarregue com um spray ou até que um spray fino apareça. Se não for usado por mais de 14 dias, enxágue o aplicador e volte a aplicar dois sprays ou até que apareça um spray fino. Agite o recipiente suavemente antes de cada uso.
Ilustrado Instruções de uso do paciente acompanham cada embalagem de RHINOCORT AQUA (budesonida) Spray Nasal 32 mcg.
COMO FORNECIDO
Formas de dosagem e pontos fortes
RHINOCORT AQUA (budesonida) Spray Nasal é uma suspensão em spray nasal. Cada spray fornece 32 mcg de budesonida. Cada frasco de spray nasal RHINOCORT 100mcg AQUA (budesonida) 32 mcg contém 120 sprays dosados após a aplicação inicial.
RHINOCORT 100mcg AQUA (budesonida) spray nasal 32 mcg está disponível em um frasco de vidro âmbar com um spray de bomba dosimetrado e uma tampa de proteção verde. RHINOCORT 100mcg AQUA (budesonida) spray nasal 32 mcg ( NDC 0186-1070-08) fornece 120 pulverizações dosadas após a aplicação inicial; peso líquido de enchimento 8,6 g. O frasco de spray nasal RHINOCORT 100mcg AQUA (budesonida) de 32 mcg foi preenchido com excesso para acomodar a atividade de primer. O frasco deve ser descartado após 120 pulverizações após a aplicação inicial, uma vez que a quantidade de budesonida administrada por pulverização subsequente pode ser substancialmente menor do que a dose rotulada. Cada spray fornece 32 mcg de budesonida ao paciente.
O spray nasal RHINOCORT 100mcg AQUA (budesonida) deve ser armazenado em temperatura ambiente controlada, 20 a 25°C (68 a 77°F) com a válvula para cima. Não congele. Proteja da luz. Agite suavemente antes de usar. Não pulverize nos olhos.
Distribuído por: AstraZeneca LP, Wilmington, DE 19850. Revisado: 12/2010
EFEITOS COLATERAIS
uso de corticosteroides sistêmicos e intranasais pode resultar no seguinte:
- Epistaxe, infecção por Candida albicans, perfuração do septo nasal e cicatrização prejudicada de feridas [ver AVISOS E PRECAUÇÕES ].
- Hipersensibilidade incluindo anafilaxia [ver AVISOS E PRECAUÇÕES ].
- Imunossupressão [ver AVISOS E PRECAUÇÕES ].
- Hipercorticismo e supressão adrenal [ver AVISOS E PRECAUÇÕES ].
- Efeito de crescimento [ver AVISOS E PRECAUÇÕES e Uso em populações específicas ].
- Glaucoma e Catarata [ver AVISOS E PRECAUÇÕES ].
Experiência de Ensaios Clínicos
Como os ensaios clínicos são conduzidos em condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparadas às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
incidência de reações adversas comuns na Tabela 1 é baseada em dois ensaios clínicos controlados nos EUA e cinco fora dos EUA em 1.526 pacientes com rinite sazonal ou perene em adultos e crianças ≥ 6 anos tratados com spray nasal RHINOCORT AQUA (budesonida) em doses até 400 mcg uma vez ao dia por 3-6 semanas. Esta população incluiu 745 mulheres e 781 homens com idade média de 31 anos (variação de 6-85 anos, 349 eram 6
Um perfil de reações adversas semelhante foi observado no subgrupo de pacientes pediátricos de 6 a 12 anos de idade. Esses pacientes estão incluídos na Tabela 1.
Dois a três por cento (2-3%) dos pacientes em ensaios clínicos descontinuaram devido a reações adversas. Efeitos colaterais sistêmicos de corticosteroides não foram relatados durante estudos clínicos controlados com RHINOCORT AQUA (budesonida) spray nasal.
Se as doses recomendadas forem excedidas, ou se os indivíduos forem particularmente sensíveis, podem ocorrer sintomas de hipercorticismo, ou seja, síndrome de Gushing e supressão adrenal.
Experiência pós-comercialização
As seguintes reações adversas foram relatadas durante o uso pós-aprovação do spray nasal RHINOCORT AQUA (budesonida). Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento.
Distúrbios do sistema imunológico: reações de hipersensibilidade imediatas e tardias (incluindo reação anafilática, urticária, erupção cutânea, dermatite, angioedema e prurido), [ver AVISOS E PRECAUÇÕES e CONTRA-INDICAÇÕES ]
Distúrbios oculares: glaucoma, aumento da pressão intraocular, catarata [ver AVISOS E PRECAUÇÕES ]
Distúrbios respiratórios, torácicos e mediastinais: perfuração do septo nasal, anosmia, distúrbios da faringe (irritação da garganta, dor na garganta, garganta inchada, garganta inflamada e coceira na garganta) e sibilos
Distúrbios cardíacos: palpitações
Distúrbios musculoesqueléticos e do tecido conjuntivo: supressão do crescimento [ver AVISOS E PRECAUÇÕES e Uso em populações específicas ]
INTERAÇÕES MEDICAMENTOSAS
Inibidores do Citocromo P450 3A4
principal via de metabolismo dos corticosteroides, incluindo a budesonida, é através da isoenzima 3A4 (CYP3A4) do citocromo P450 (CYP). Após a administração oral de cetoconazol, um forte inibidor do CYP3A4, a concentração plasmática média da budesonida administrada por via oral aumentou. A administração concomitante de CYP3A4 pode inibir o metabolismo e aumentar a exposição sistêmica à budesonida. Deve-se ter cautela ao considerar a coadministração de RHINOCORT AQUA (budesonida) spray nasal com cetoconazol de longa duração e outros inibidores fortes conhecidos do CYP3A4 (por exemplo, ritonavir, atazanavir claritromicina, indinavir itraconazol, nefazodona nelfinavir-saquinavir, telitromicina) [ver AVISOS E PRECAUÇÕES e FARMACOLOGIA CLÍNICA ].
AVISOS
Incluído como parte do PRECAUÇÕES seção.
PRECAUÇÕES
Efeitos nasais locais
Epistaxe
Em estudos clínicos de 3 a 52 semanas de duração, a epistaxe foi observada mais frequentemente em pacientes tratados com RHINOCORT 100mcg AQUA (budesonida) spray nasal do que aqueles que receberam placebo [ver REAÇÕES ADVERSAS ].
Infecção por Candida
Em estudos clínicos com budesonida administrada por via intranasal, ocorreu o desenvolvimento de infecções localizadas do nariz e faringe com Candida albicans. Quando tal infecção se desenvolve, pode ser necessário tratamento com terapia local ou sistêmica apropriada e descontinuação do tratamento com spray nasal RHINOCORT AQUA (budesonida). Pacientes usando spray nasal RHINOCORT AQUA (budesonida) por vários meses ou mais devem ser examinados periodicamente quanto a evidências de infecção por Candida ou outros sinais de efeitos adversos na mucosa nasal.
Perfuração do Septo Nasal
Casos de perfuração do septo nasal foram relatados após a aplicação intranasal de corticosteroides, incluindo budesonida [ver REAÇÕES ADVERSAS ].
Cicatrização de Feridas Prejudicadas
Devido ao efeito inibitório dos corticosteroides na cicatrização de feridas, pacientes que sofreram úlceras do septo nasal, cirurgia nasal ou trauma nasal não devem usar corticosteroides nasais até que a cicatrização tenha ocorrido.
Reações de hipersensibilidade incluindo anafilaxia
Reações de hipersensibilidade, incluindo reação anafilática, urticária, erupção cutânea, dermatite, angioedema e prurido podem ocorrer. CONTRA-INDICAÇÕES e REAÇÕES ADVERSAS, Experiência pós-comercialização ].
Imunossupressão
Pacientes que tomam medicamentos que suprimem o sistema imunológico são mais suscetíveis a infecções do que indivíduos saudáveis. A catapora e o sarampo, por exemplo, podem ter um curso mais grave ou mesmo fatal em crianças ou adultos suscetíveis usando corticosteróides. Em tais crianças ou adultos que não tiveram essas doenças ou foram devidamente imunizados, deve-se tomar cuidado especial para evitar a exposição. Não se sabe como a dose, a via e a duração da administração de corticosteroides afetam o risco de desenvolver uma infecção disseminada. A contribuição da doença subjacente e/ou tratamento prévio com corticosteroides para o risco também não é conhecida. Se exposto à catapora, a terapia com imunoglobulina contra varicela zoster (VZIG) ou imunoglobulina intravenosa combinada (WIG), conforme apropriado, pode ser indicada. Se exposto ao sarampo, a profilaxia com imunoglobulina intramuscular (IG) combinada pode ser indicada. (Ver as respectivas bulas para informações completas sobre prescrição de VZIG e IG ). Se a varicela se desenvolver, o tratamento com agentes antivirais pode ser considerado.
O curso clínico da infecção por varicela ou sarampo em pacientes em uso de corticosteroides intranasais ou inalatórios não foi estudado. Embora não existam dados com corticosteroides intranasais, um estudo clínico examinou a resposta imune à vacina contra varicela em pacientes com asma de 12 meses a 8 anos de idade que foram tratados com suspensão inalatória de budesonida.
Um estudo clínico aberto e não randomizado examinou a resposta imune à vacina contra varicela em 243 pacientes com asma de 12 meses a 8 anos de idade que foram tratados com suspensão para inalação de budesonida 0,25 mg a 1 mg por dia (n = 151) ou terapia para asma sem corticosteroides (n=92) (isto é, beta-agonistas, antagonistas do receptor de leucotrienos ou cromonas). A porcentagem de pacientes que desenvolveram um título de anticorpos soroprotetores ≥ 5,0 (valor gpELISA) em resposta à vacinação foi semelhante em pacientes tratados com suspensão para inalação de budesonida (85%) em comparação com pacientes tratados com terapia de asma sem corticosteroides (90%). Nenhum paciente tratado com suspensão para inalação de budesonida desenvolveu catapora como resultado da vacinação.
Os corticosteróides devem ser usados com cautela, se for o caso, em pacientes com infecção ativa ou quiescente por tuberculose, infecções fúngicas, bacterianas, sistêmicas virais ou parasitárias não tratadas; ou herpes simples ocular.
Efeitos do eixo hipotalâmico-hipofisário-adrenal
Hipercorticismo e Supressão Adrenal: Quando os esteroides intranasais são usados em doses superiores às recomendadas ou em indivíduos suscetíveis nas dosagens recomendadas, podem aparecer efeitos sistêmicos dos corticosteroides, como hipercorticismo e supressão adrenal. Se tais alterações ocorrerem, a dosagem de RHINOCORT 100mcg AQUA (budesonida) spray nasal deve ser descontinuada lentamente, de acordo com os procedimentos aceitos para descontinuar a terapia com corticosteroides orais.
substituição de um corticosteroide sistêmico por um corticosteroide tópico pode ser acompanhada de sinais de insuficiência adrenal e, além disso, alguns pacientes podem apresentar sintomas de abstinência de corticosteroides, por exemplo, dores articulares e/ou musculares, fadiga, fraqueza, náuseas, vômitos, hipotensão, cansaço e depressão. Pacientes previamente tratados por períodos prolongados com corticosteroides sistêmicos devem ser desmamados lentamente quando transferidos para corticosteroides tópicos e cuidadosamente monitorados quanto à insuficiência adrenal aguda em resposta ao estresse. Nos pacientes com asma ou outras condições clínicas que requerem tratamento prolongado com corticosteroides sistêmicos, uma diminuição muito rápida dos corticosteroides sistêmicos pode causar uma exacerbação grave dos sintomas.
Interações com Inibidores Fortes do Citocromo P450 3A4
Deve-se ter cautela ao considerar a coadministração de RHINOCORT AQUA Spray Nasal com cetoconazol e outros inibidores fortes do CYP3A4 conhecidos (por exemplo, ritonavir, atazanavir, claritromicina, indinavir, itraconazol, nefazodona, nelfinavir, saquinavir, telitromicina) porque os efeitos adversos relacionados ao aumento pode ocorrer exposição sistêmica à budesonida [ver INTERAÇÕES MEDICAMENTOSAS, FARMACOLOGIA CLÍNICA ].
Efeito no crescimento
Corticosteróides intranasais, incluindo budesonida, podem causar redução na velocidade de crescimento quando administrados a pacientes pediátricos. Monitore o crescimento rotineiramente de pacientes pediátricos recebendo tratamento de longo prazo com spray nasal RHINOCORT 100mcg AQUA (budesonida). Para minimizar os efeitos sistêmicos dos corticosteroides intranasais, incluindo o spray nasal RHINOCORT AQUA (budesonida), titule a dose de cada paciente para a menor que efetivamente controle seus sintomas [ver Uso em populações específicas, uso pediátrico ].
Glaucoma e Catarata
Glaucoma, aumento da pressão intraocular e catarata foram relatados após a aplicação intranasal de corticosteroides, incluindo budesonida. Portanto, o monitoramento cuidadoso é necessário em pacientes com alteração na visão ou com histórico de aumento da pressão intraocular, glaucoma e/ou catarata [ver REAÇÕES ADVERSAS ].
Informações de Aconselhamento do Paciente
[Ver Rotulagem de Paciente Aprovada pela FDA ]
Pacientes em tratamento com spray nasal RHINOCORT 100mcg AQUA (budesonida) devem receber as seguintes informações e instruções. Esta informação destina-se a auxiliar o paciente no uso seguro e eficaz do medicamento. Não é uma divulgação de todos os possíveis efeitos adversos ou pretendidos. Para o uso adequado do spray nasal RHINOCORT 100mcg AQUA (budesonida) e para obter a melhora máxima, o paciente deve ler e seguir a Rotulagem do Paciente Aprovada pela FDA que acompanha.
Efeitos nasais locais
Os pacientes devem ser informados de que epistaxe e infecções localizadas por Candida albicans ocorreram no nariz e na faringe em alguns pacientes. Se a candidíase se desenvolver, ela deve ser tratada com terapia local ou sistêmica apropriada e descontinuar o tratamento com RHINOCORT 100mcg AQUA (budesonida) spray nasal. Além disso, os corticosteróides nasais estão associados à perfuração do septo nasal e cicatrização prejudicada de feridas. Pacientes que sofreram úlceras nasais recentes, cirurgias nasais ou traumas nasais não devem usar RHINOCORT AQUA (budesonida) spray nasal até que a cicatrização tenha ocorrido. AVISOS E PRECAUÇÕES ].
Hipersensibilidade incluindo anafilaxia
Os pacientes devem ser informados de que reações de hipersensibilidade incluindo reação anafilática, urticária, erupção cutânea, dermatite, angioedema e prurido foram relatadas com o uso de RHINOCORT AQUA (budesonida) spray nasal. Descontinuar
RHINOCORT AQUA (budesonida) spray nasal se tais reações ocorrerem [ver CONTRA-INDICAÇÕES, AVISOS E PRECAUÇÕES e REAÇÕES ADVERSAS ].
Imunossupressão
Pacientes em uso de doses imunossupressoras de corticosteroides devem ser alertados para evitar exposição à varicela ou sarampo e, se expostos, consultar seu médico imediatamente. Os pacientes devem ser informados sobre o potencial agravamento da tuberculose existente, infecção fúngica, bacteriana, viral ou parasitária, ou herpes simples ocular [ver AVISOS E PRECAUÇÕES ].
Velocidade de crescimento reduzida
Os pacientes devem ser alertados de que corticosteroides intranasais, incluindo budesonida, podem causar redução na velocidade de crescimento quando administrados a pacientes pediátricos. Os médicos devem acompanhar de perto o crescimento de crianças e adolescentes em uso de corticosteroides por qualquer via [ver AVISOS E PRECAUÇÕES ].
Glaucoma e Catarata
Os pacientes devem ser informados de que o uso prolongado de corticosteroides intranasais, incluindo budesonida, pode aumentar o risco de alguns problemas oculares (catarata e glaucoma). Os pacientes devem informar seu médico se uma alteração na visão for observada durante o uso de spray nasal RHINOCORT AQUA (budesonida) [ver AVISOS E PRECAUÇÕES ].
Usar diariamente
Os pacientes devem usar spray nasal RHINOCORT 100mcg AQUA (budesonida) em intervalos regulares, pois sua eficácia depende do uso regular. Os pacientes podem notar uma melhora nos sintomas nasais dentro de 10 horas após o primeiro uso do spray nasal RHINOCORT AQUA (budesonida). O benefício máximo pode não ser alcançado até aproximadamente 2 semanas após o início do tratamento [ver DOSAGEM E ADMINISTRAÇÃO ].
Os pacientes devem tomar a medicação conforme indicado e não devem exceder a dosagem prescrita. O paciente deve entrar em contato com o médico se os sintomas não melhorarem após duas semanas ou se a condição piorar. Pacientes que experimentam episódios recorrentes de epistaxe (sangramento nasal) ou desconforto no septo nasal enquanto tomam este medicamento devem entrar em contato com seu médico. Para o uso adequado do spray nasal RHINOCORT AQUA (budesonida) e para obter o máximo de melhora, o paciente deve ler e seguir cuidadosamente as informações que acompanham o paciente. Não use RHINOCORT 100mcg AQUA (budesonida) spray nasal após o número de sprays rotulados (não inclui primer) ou após a data de validade mostrada na embalagem ou rótulo do frasco.
Como usar o spray nasal RHINOCORT 100mcg AQUA (budesonida)
Os pacientes devem ser cuidadosamente instruídos sobre o uso deste medicamento para garantir a administração da dose ideal [ver INFORMAÇÃO DO PACIENTE ].
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Em um estudo oral de 104 semanas em ratos Sprague-Dawley, um aumento estatisticamente significativo na incidência de gliomas foi observado em ratos machos recebendo uma dose oral de budesonida 50 mcg/kg/dia (aproximadamente duas vezes a dose intranasal diária máxima recomendada em adultos e crianças na base de mcg/m2). Nenhuma tumorigenicidade foi observada em ratos machos em doses orais de até 25 mcg/kg (aproximadamente igual à dose intranasal diária máxima recomendada em adultos e crianças em uma base de mcg/m2, e em ratos fêmeas em doses orais de até 50 mcg/kg aproximadamente duas vezes a dose intranasal diária máxima recomendada em adultos e crianças com base em mcg/m2). Em dois estudos adicionais de dois anos em ratos machos Fischer e Sprague-Dawley, a budesonida não causou gliomas na dose oral de 50 mcg/kg (aproximadamente duas vezes a dose intranasal diária máxima recomendada em adultos e crianças com base em mcg/m2). No entanto, em ratos machos Sprague-Dawley, a budesonida causou um aumento estatisticamente significativo na incidência de tumores hepatocelulares em uma dose oral de 50 mcg/kg (aproximadamente duas vezes a dose intranasal diária máxima recomendada em adultos e crianças na base de mcg/m2 ). Os corticosteroides de referência concomitantes (prednisolona e acetonido de triancinolona) nesses dois estudos mostraram achados semelhantes.
Não houve evidência de efeito carcinogênico quando a budesonida foi administrada por via oral por 91 semanas a camundongos em doses de até 200 mcg/kg/dia (aproximadamente 3 vezes a dose intranasal diária máxima recomendada em adultos e crianças na base de mcg/m2) .
A budesonida não foi mutagênica ou clastogênica em seis sistemas de teste diferentes: teste de Ames Salmonella/microssoma placa, teste de micronúcleo de camundongo, teste de linfoma de camundongo, teste de aberração cromossômica em linfócitos humanos, teste letal recessivo ligado ao sexo em Drosophila melanogaster e análise de reparo de DNA em rato cultura de hepatócitos.
Em ratos, a budesonida não teve efeito sobre a fertilidade em doses subcutâneas de até 80 mcg/kg (aproximadamente 3 vezes a dose intranasal diária máxima recomendada em adultos com base em mcg/m2).
Com uma dose subcutânea de 20 mcg/kg/dia (menos do que a dose intranasal diária máxima recomendada em adultos com base em mcg/m2), diminui o ganho de peso corporal materno, a viabilidade pré-natal e a viabilidade dos filhotes ao nascimento e durante a lactação foram observados. Não foram observados tais efeitos com 5 mcg/kg (menos do que a dose intranasal diária máxima recomendada em adultos com base em mcg/m2).
Uso em populações específicas
Gravidez
Efeitos teratogênicos: Gravidez Categoria B. O impacto da budesonida nos resultados da gravidez humana foi avaliado por meio de avaliações de registros de nascimento relacionados ao uso materno de budesonida inalada (ou seja, PULMICORT TURBUHALER) e budesonida administrada por via intranasal (ou seja, RHINOCORT 100mcg AQUA (budesonida) spray nasal). Os resultados de estudos epidemiológicos de coorte prospectiva de base populacional revisando dados de três registros suecos cobrindo aproximadamente 99% das gestações de 1995-2001 (ou seja, Registro Médico Sueco de Nascimento; Registro de Malformações Congênitas; Registro de Cardiologia Infantil) não indicam risco aumentado para malformações congênitas decorrentes do uso de budesonida inalatória ou intranasal durante o início da gravidez.
Malformações congênitas foram estudadas em 2.014 bebês nascidos de mães que relataram o uso de budesonida inalatória para asma no início da gravidez (geralmente 10-12 semanas após o último período menstrual), o período em que ocorre a maioria das malformações de órgãos principais.1 A taxa de malformações congênitas gerais foi semelhante em comparação com a taxa da população geral (3,8% vs. 3,5%, respectivamente). O número de bebês nascidos com fissuras orofaciais e defeitos cardíacos foi semelhante ao número esperado na população geral (4 crianças vs. 3,3 e 18 crianças vs. 17-18, respectivamente). Em um estudo de acompanhamento que elevou o número total de bebês para 2.534, a taxa de malformações congênitas gerais entre bebês cujas mães foram expostas à budesonida inalatória durante o início da gravidez não foi diferente da taxa de todos os recém-nascidos durante o mesmo período (3,6% ).2 Um terceiro estudo do Registro Médico Sueco de Nascimento de 2.968 gestações expostas à budesonida inalatória, a maioria das quais foram exposições no primeiro trimestre, relatou idade gestacional, peso ao nascer, comprimento ao nascer, natimortos e nascimentos múltiplos semelhantes para bebês expostos em comparação com bebês não expostos.3
Malformações congênitas foram estudadas em 2.113 bebês nascidos de mães que relataram o uso de budesonida intranasal no início da gravidez. A taxa de malformações congênitas gerais foi semelhante em comparação com a taxa da população geral (4,5% vs. 3,5%, respectivamente). O odds ratio ajustado (OR) foi de 1,06 (IC 95% 0,86-1,31). O número de bebês nascidos com fissuras orofaciais foi semelhante ao esperado na população geral (3 crianças vs. 3, respectivamente). O número de bebês nascidos com defeitos cardíacos excedeu o esperado na população geral (28 crianças vs. 17,8, respectivamente). A exposição sistêmica da budesonida intranasal é 6 vezes menor do que a da budesonida inalada e uma associação de defeitos cardíacos não foi observada com exposições mais altas de budesonida.
Apesar das descobertas em animais, parece que a possibilidade de dano fetal é remota se a droga for usada durante a gravidez. No entanto, como os estudos em humanos não podem descartar a possibilidade de danos, o spray nasal RHINOCORT AQUA (budesonida) deve ser usado durante a gravidez somente se for claramente necessário.
A budesonida produziu perda fetal, diminuição do peso dos filhotes e anormalidades esqueléticas em uma dose subcutânea em coelhos que foi aproximadamente 2 vezes a dose intranasal diária máxima recomendada em adultos na base de mcg/m2 e em uma dose subcutânea em ratos que foi aproximadamente 16 vezes a dose dose intranasal diária máxima recomendada em adultos na base de mcg/m2. Não foram observados efeitos teratogênicos ou embriocidas em ratos quando a budesonida foi administrada por inalação em doses até aproximadamente 8 vezes a dose intranasal diária máxima recomendada em adultos na base de mcg/m2.
experiência com corticosteróides orais desde a sua introdução em doses farmacológicas, em oposição às doses fisiológicas, sugere que os roedores são mais propensos aos efeitos teratogênicos dos corticosteróides do que os humanos.
Efeitos não teratogênicos: O hipoadrenalismo pode ocorrer em bebês nascidos de mães que receberam corticosteroides durante a gravidez. Esses bebês devem ser cuidadosamente observados.
Mães que amamentam
A budesonida é secretada no leite humano. Dados com budesonida administrado por inalador de pó seco indicam que a dose oral diária total de budesonida disponível no leite materno para o bebê é de aproximadamente 0,3% a 1% da dose inalada pela mãe [ver FARMACOLOGIA CLÍNICA, Farmacocinética, Populações Especiais, Enfermagem ]. Não foram realizados estudos em mulheres lactantes especificamente com RHINOCORT 100mcg AQUA Spray Nasal; no entanto, espera-se que a dose de budesonida disponível para o lactente no leite materno, como porcentagem da dose materna, seja semelhante. O spray nasal RHINOCORT AQUA (budesonida) deve ser usado em lactantes somente se clinicamente apropriado. Os prescritores devem pesar os benefícios conhecidos da amamentação para a mãe e o bebê em relação aos riscos potenciais de exposição mínima à budesonida no bebê. As considerações de dosagem incluem prescrição ou titulação para a menor dose clinicamente eficaz e uso de spray nasal RHINOCORT 100mcg AQUA (budesonida) imediatamente após a amamentação para maximizar o intervalo de tempo entre a dosagem e a amamentação para minimizar a exposição infantil.
Uso Pediátrico
A segurança e eficácia em pacientes pediátricos com menos de 6 anos de idade não foram estabelecidas.
Estudos clínicos controlados mostraram que os corticosteroides intranasais podem causar redução na velocidade de crescimento em pacientes pediátricos. Este efeito foi observado na ausência de evidência laboratorial de supressão do eixo hipotálamo-hipófise-adrenal (HPA), sugerindo que a velocidade de crescimento é um indicador mais sensível de exposição sistêmica a corticosteróides em pacientes pediátricos do que alguns testes comumente usados da função do eixo HPA . Os efeitos a longo prazo dessa redução na velocidade de crescimento associada aos corticosteroides intranasais, incluindo o impacto na altura final do adulto, são desconhecidos. O potencial de "recuperação" do crescimento após a descontinuação do tratamento com corticosteróides intranasais não foi adequadamente estudado.
crescimento de pacientes pediátricos recebendo corticosteroides intranasais, incluindo RHINOCORT 100mcg AQUA (budesonida) spray nasal, deve ser monitorado rotineiramente (por exemplo, por meio de estadiometria). Os potenciais efeitos de crescimento do tratamento prolongado devem ser ponderados em relação aos benefícios clínicos obtidos e os riscos e benefícios associados às terapias alternativas. Para minimizar os efeitos sistêmicos dos corticosteroides intranasais, incluindo RHINOCORT AQUA (budesonida) spray nasal, cada paciente deve ser titulado para a dose mais baixa que efetivamente controle seus sintomas.
Um estudo de crescimento clínico controlado por placebo de um ano foi realizado em 229 pacientes pediátricos (4 a 8 anos de idade) para avaliar o efeito do spray nasal RHINOCORT AQUA (budesonida) (dose única diária de 64 mcg, a dose inicial recomendada para crianças de 6 anos ou mais) na velocidade de crescimento. De uma população de 141 pacientes recebendo RHINOCORT 100mcg AQUA (budesonida) spray nasal e 67 recebendo placebo, a estimativa pontual para a velocidade de crescimento com RHINOCORT AQUA (budesonida) spray nasal foi 0,25 cm/ano menor do que a observada com placebo (intervalo de confiança de 95% variando de 0,59 cm/ano inferior ao placebo a 0,08 cm/ano superior ao placebo).
Em um estudo com crianças asmáticas de 5 a 12 anos de idade, aquelas tratadas com budesonida administrada por meio de um inalador de pó seco 200 mcg duas vezes ao dia (n = 311) tiveram uma redução de 1,1 centímetro (0,433 polegada) no crescimento em comparação com aquelas que receberam placebo ( n=418) ao final de um ano; a diferença entre estes dois grupos de tratamento não aumentou mais ao longo de três anos de tratamento adicional. Ao final de quatro anos, as crianças tratadas com inalador de pó seco de budesonida e as crianças tratadas com placebo apresentaram velocidades de crescimento semelhantes. As conclusões extraídas deste estudo podem ser confundidas pelo uso desigual de corticosteróides nos grupos de tratamento e inclusão de dados de pacientes que atingiram a puberdade durante o curso do estudo.
Os efeitos sistêmicos dos corticosteróides inalatórios estão relacionados à exposição sistêmica a tais drogas. Estudos farmacocinéticos demonstraram que em adultos e crianças, a exposição sistêmica à budesonida nas doses mais altas recomendadas do spray nasal RHINOCORT AQUA (budesonida) não deve ser maior do que a exposição nas doses mais baixas recomendadas por meio de um inalador de pó seco. Portanto, espera-se que os efeitos sistêmicos (eixo HPA e crescimento) da budesonida administrada pelo spray nasal RHINOCORT AQUA (budesonida) não sejam maiores do que o relatado para a budesonida inalada quando administrada através do inalador de pó seco.
O potencial de RHINOCORT 100mcg AQUA (budesonida) spray nasal para causar supressão do crescimento em pacientes suscetíveis ou quando administrado em doses acima de 64 mcg diariamente não pode ser descartado. A faixa de dosagem recomendada em pacientes de 6 a 11 anos de idade é de 64 a 128 mcg por dia [ver DOSAGEM E ADMINISTRAÇÃO ].
Uso Geriátrico
Dos 2.461 pacientes em estudos clínicos de RHINOCORT 100mcg AQUA (budesonida) spray nasal, 5% tinham 60 anos de idade ou mais. Não foram observadas diferenças globais na segurança ou eficácia entre estes indivíduos e indivíduos mais jovens, exceto para uma frequência de notificação de reações adversas de epistaxe que aumentou com a idade. Além disso, outras experiências clínicas relatadas não identificaram outras diferenças nas respostas entre pacientes idosos e mais jovens, mas a maior sensibilidade de alguns indivíduos mais velhos não pode ser descartada.
Insuficiência hepática
Estudos farmacocinéticos formais usando RHINOCORT 100mcg AQUA (budesonida) spray nasal não foram conduzidos em pacientes com insuficiência hepática. No entanto, como a budesonida é predominantemente eliminada pelo metabolismo hepático, o comprometimento da função hepática pode levar ao acúmulo de budesonida no plasma. Portanto, pacientes com doença hepática devem ser monitorados de perto.
SOBREDOSAGEM
superdosagem aguda com esta forma de dosagem é improvável, pois um frasco de spray de 120 mcg de RHINOCORT 100mcg AQUA (budesonida) spray nasal 32 mcg contém apenas aproximadamente 5,4 mg de budesonida. A superdosagem crônica pode resultar em sinais/sintomas de hipercorticismo [ver AVISOS E PRECAUÇÕES ].
CONTRA-INDICAÇÕES
O spray nasal RHINOCORT AQUA (budesonida) é contraindicado em pacientes com hipersensibilidade a qualquer um de seus ingredientes [ver AVISOS E PRECAUÇÕES ].
FARMACOLOGIA CLÍNICA
Mecanismo de ação
budesonida é um corticosteróide anti-inflamatório que apresenta atividade glicocorticóide potente e atividade mineralocorticóide fraca. Em modelos in vitro e animais padrão, a budesonida tem aproximadamente uma afinidade 200 vezes maior para o receptor de glicocorticóides e uma potência anti-inflamatória tópica 1000 vezes maior do que o cortisol (ensaio de edema de orelha com óleo de cróton de rato). Como medida da atividade sistêmica, a budesonida é 40 vezes mais potente que o cortisol quando administrada por via subcutânea e 25 vezes mais potente quando administrada por via oral no ensaio de involução do timo de rato. O significado clínico disso é desconhecido.
A atividade do RHINOCORT 100mcg AQUA Spray Nasal é devido ao medicamento original, budesonida. Em estudos de afinidade do receptor de glicocorticóides, a forma 22R foi duas vezes mais ativa que o epímero 22S. Estudos in vitro indicaram que as duas formas de budesonida não se interconvertem.
mecanismo preciso das ações dos corticosteróides na inflamação na rinite alérgica sazonal e perene não é bem conhecido. A inflamação é um componente importante na patogênese da rinite alérgica sazonal e perene. Os corticosteróides têm uma ampla gama de atividades inibitórias contra vários tipos de células (por exemplo, mastócitos, eosinófilos, neutrófilos, macrófagos e linfócitos) e mediadores (por exemplo, histamina, eicosanóides, leucotrienos e citocinas) envolvidos em reações alérgicas e não mediadas por alergia. inflamação. Essas ações anti-inflamatórias dos corticosteróides podem contribuir para sua eficácia na rinite alérgica sazonal e perene.
Farmacodinâmica
Um estudo clínico de 3 semanas em rinite sazonal, comparando RHINOCORT 100mcg Inalador Nasal, budesonida ingerida por via oral e placebo em 98 pacientes com rinite alérgica devido ao pólen de bétula, demonstrou que o efeito terapêutico do RHINOCORT Nasal Inhaler pode ser atribuído aos efeitos tópicos de budesonida.

Efeitos do eixo HPA
Os efeitos do spray nasal RHINOCORT 100mcg AQUA (budesonida) na função adrenal foram avaliados em vários ensaios clínicos. Em um ensaio clínico de quatro semanas, 61 pacientes adultos que receberam 256 mcg diários de RHINOCORT AQUA (budesonida) spray nasal não demonstraram diferenças significativas em relação aos pacientes que receberam placebo nos níveis de cortisol plasmático medidos antes e 60 minutos após 0,25 mg de cosintropina intramuscular. Não houve diferenças consistentes nas medidas de cortisol urinário de 24 horas em pacientes que receberam até 400 mcg diariamente. Resultados semelhantes foram observados em um estudo com 150 crianças e adolescentes de 6 a 17 anos com rinite perene que foram tratados com 256 mcg diariamente por até 12 meses.
Após o tratamento com a dose diária máxima recomendada de RHINOCORT AQUA (budesonida) spray nasal (256 mcg) por sete dias, houve uma pequena, mas estatisticamente significativa diminuição na área sob a curva de cortisol plasmático-tempo em 24 horas (AUC0-24h ) em voluntários adultos saudáveis.
Uma supressão relacionada à dose da excreção de cortisol urinário de 24 horas foi observada após a administração de doses de spray nasal de RHINOCORT AQUA (budesonida) variando de 100-800 mcg diariamente por até quatro dias em 78 voluntários adultos saudáveis. A relevância clínica destes resultados é desconhecida.
Farmacocinética
Absorção
Após a administração intranasal de uma dose única de RHINOCORT AQUA (budesonida) spray nasal (128 mcg), o pico médio de concentração plasmática de aproximadamente 0,3 nmol/L ocorre cerca de 0,5 horas após a dose. Em comparação com uma dose intravenosa, aproximadamente 34% da dose intranasal administrada atinge a circulação sistêmica, sendo a maior parte absorvida pela mucosa nasal. Embora a budesonida seja bem absorvida pelo trato GI, a biodisponibilidade oral da budesonida é baixa (~10%), principalmente devido ao extenso metabolismo de primeira passagem no fígado.
Distribuição
volume de distribuição da budesonida foi de aproximadamente 2-3 L/kg. Ligava-se 85-90% às proteínas plasmáticas. O volume de distribuição do epímero 22R é quase o dobro do epímero 22S. A ligação às proteínas foi constante em uma faixa de concentração (1-100 nmol/L) alcançada com e excedendo as doses recomendadas de RHINOCORT 100mcg AQUA Spray Nasal. A budesonida mostrou pouca ou nenhuma ligação à globulina de ligação aos corticosteróides. A budesonida equilibrou-se rapidamente com os glóbulos vermelhos de forma independente da concentração com uma relação sangue/plasma de cerca de 0,8.
Metabolismo
Estudos in vitro com homogeneizados de fígado humano mostraram que a budesonida é rápida e extensivamente metabolizada. Dois metabólitos principais formados via biotransformação catalisada pela isoenzima 3A4 (CYP3A4) do citocromo P450 (CYP) foram isolados e identificados como 16α-hidroxiprednisolona e 6p-hidroxibudesonida. A actividade corticosteróide de cada um destes dois metabolitos é inferior a 1% da do composto original. Nenhuma diferença qualitativa entre os padrões metabólicos in vitro e in vivo foi detectada. Inativação metabólica insignificante foi observada em preparações de soro e pulmão humano.
Excreção/Eliminação
forma 22R de budesonida foi preferencialmente eliminada pelo fígado com depuração sistêmica de 1,4 L/min vs. 1,0 L/min para a forma 22S. A meia-vida terminal, de 2 a 3 horas, foi a mesma para ambos os epímeros e independente da dose. A budesonida foi excretada na urina e nas fezes na forma de metabólitos. Aproximadamente 2/3 de uma dose intranasal radiomarcada foi recuperada na urina e o restante nas fezes. Nenhuma budesonida inalterada foi detectada na urina.
Populações Específicas
Geriátrico
A farmacocinética do spray nasal RHINOCORT 100mcg AQUA (budesonida) em pacientes geriátricos não foi especificamente estudada.
Pediátrico
Após a administração de RHINOCORT 100mcg AQUA (budesonida) spray nasal, o tempo para atingir o pico de concentração do medicamento e a meia-vida plasmática foram semelhantes em crianças e adultos. As crianças apresentaram concentrações plasmáticas aproximadamente o dobro das observadas em adultos devido principalmente a diferenças de peso entre crianças e adultos.
Gênero
Não foi realizado nenhum estudo farmacocinético específico para avaliar o efeito do sexo na farmacocinética da budesonida. No entanto, após a administração de 400 mcg de RHINOCORT 100 mcg AQUA (budesonida) spray nasal a 7 voluntários do sexo masculino e 8 do sexo feminino em um estudo farmacocinético, não foram encontradas grandes diferenças de gênero nos parâmetros farmacocinéticos.
Corrida
Nenhum estudo específico foi realizado para avaliar o efeito da raça na farmacocinética da budesonida.
Mães que amamentam
disposição da budesonida quando administrada por inalação oral a partir de um inalador de pó seco em doses de 200 ou 400 mcg duas vezes ao dia por pelo menos 3 meses foi estudada em oito mulheres lactantes com asma de 1 a 6 meses após o parto. A exposição sistêmica à budesonida nessas mulheres parece ser comparável à de mulheres não lactantes com asma de outros estudos. O leite materno obtido mais de oito horas após a dose revelou que a concentração máxima de budesonida para as doses de 400 e 800 mcg foi de 0,39 e 0,78 nmol/L, respectivamente, e ocorreu dentro de 45 minutos após a dosagem. A dose oral diária estimada de budesonida do leite materno para o lactente foi de aproximadamente 0,007 e 0,014 mcg/kg/dia para os dois regimes de dose usados neste estudo, o que representa aproximadamente 0,3% a 1% da dose inalada pela mãe. Os níveis de budesonida em amostras de plasma obtidas de cinco bebês cerca de 90 minutos após a amamentação (e cerca de 140 minutos após a administração do medicamento à mãe) estavam abaixo dos níveis quantificáveis ( Uso em populações específicas, mães que amamentam ].
Insuficiência renal ou hepática
A farmacocinética da budesonida não foi investigada em pacientes com insuficiência renal. A redução da função hepática pode afetar a eliminação dos corticosteroides. A farmacocinética da budesonida foi afetada pelo comprometimento da função hepática, evidenciado por uma disponibilidade sistêmica dobrada após a ingestão oral. A relevância deste achado para a budesonida administrada por via intranasal não foi estabelecida.
Interações Medicamentosas
Inibidores das enzimas do citocromo P450
Cetoconazol: O cetoconazol, um forte inibidor da isoenzima 3A4 do citocromo P450 (CYP) (CYP3A4), a principal enzima metabólica dos corticosteroides, aumentou os níveis plasmáticos de budesonida ingerida por via oral [ver AVISOS E PRECAUÇÕES e INTERAÇÕES MEDICAMENTOSAS ].
Cimetidina: Nas doses recomendadas, a cimetidina, um inibidor inespecífico das enzimas CYP, teve um efeito leve, mas clinicamente insignificante, na farmacocinética da budesonida oral.
Toxicologia e/ou Farmacologia Animal
budesonida foi teratogênica e embriocida em coelhos e ratos. A budesonida produziu perda fetal, diminuição do peso dos filhotes e anormalidades esqueléticas em uma dose subcutânea de 25 mcg/kg em coelhos (aproximadamente 2 vezes a dose intranasal diária máxima recomendada em adultos com base em mcg/m2) e em uma dose subcutânea de 500 mcg /kg em ratos (aproximadamente 16 vezes a dose intranasal diária máxima recomendada em adultos com base em mcg/m2). Não foram observados efeitos teratogênicos ou embriocidas em ratos quando a budesonida foi administrada por inalação de doses de até 250 mcg/kg (aproximadamente 8 vezes a dose intranasal diária máxima recomendada em adultos com base em mcg/m2).
Estudos clínicos
A eficácia terapêutica do spray nasal RHINOCORT AQUA (budesonida) foi avaliada em ensaios clínicos controlados por placebo de rinite alérgica sazonal e perene com duração de 3-6 semanas.
número de doentes tratados com budesonida nestes estudos foi de 90 homens e 51 mulheres com idades compreendidas entre os 6-12 anos e 691 homens e 694 mulheres com 12 anos ou mais. Os pacientes eram predominantemente caucasianos.
Em geral, os resultados desses ensaios clínicos mostraram que o spray nasal RHINOCORT AQUA (budesonida) administrado uma vez ao dia proporciona redução estatisticamente significativa na gravidade dos sintomas nasais de rinite alérgica sazonal e perene, incluindo coriza, espirros e congestão nasal.
Uma melhora nos sintomas nasais pode ser observada em pacientes dentro de 10 horas após o primeiro uso de RHINOCORT 100mcg AQUA (budesonida) spray nasal. Este tempo de início é apoiado por um estudo de unidade de exposição ambiental em pacientes com rinite alérgica sazonal que demonstrou que RHINOCORT 100mcg AQUA (budesonida) spray nasal levou a uma melhora estatisticamente significativa nos sintomas nasais em comparação com placebo em 10 horas. Suporte adicional vem de um estudo clínico de pacientes com rinite alérgica perene que demonstrou uma melhora estatisticamente significativa nos sintomas nasais tanto para o spray nasal RHINOCORT AQUA (budesonida) quanto para o comparador ativo (furoato de mometasona) em comparação ao placebo em 8 horas. O início também foi avaliado neste estudo com o pico da taxa de fluxo inspiratório nasal e esse desfecho não demonstrou eficácia para nenhum dos tratamentos ativos. Embora melhorias estatisticamente significativas nos sintomas nasais em comparação com o placebo tenham sido observadas dentro de 8-10 horas nesses estudos, cerca de metade a dois terços da melhora clínica final com RHINOCORT 100mcg AQUA (budesonida) spray nasal ocorre durante os primeiros 1-2 dias, e o benefício máximo pode não ser alcançado até aproximadamente 2 semanas após o início do tratamento.
REFERÊNCIAS
Kallen B, Rydhstroem H, Aberg A. Malformações congênitas após o uso de budesonida inalatória no início da gravidez. Obstet Gynecol 1999; 93:392-395.
2 Ericson A, Kallen B. Uso de drogas durante a gravidez: método único de registro sueco que pode ser melhorado. Agência Sueca de Produtos Médicos 1999; 1:8-11.
3 Norjavaara E, Gerhardsson de Verdier M. Resultados normais da gravidez em um estudo de base populacional incluindo 2.968 mulheres grávidas expostas à budesonida. J Allergy Clin Immunol 2003;! 11:736-742.
INFORMAÇÃO DO PACIENTE
RHINOCORT 100mcg AQUA (budesonida) ® (RINE-o-cort AH-kwa) (budesonida) Spray nasal
Para uso apenas no nariz
Leia as informações do paciente que acompanham o spray nasal RHINOCORT 100mcg AQUA (budesonida) antes de começar a usá-lo e sempre que receber uma recarga. Pode haver novas informações. Esta informação não substitui a conversa com seu médico sobre sua condição médica ou tratamento. Se você tiver dúvidas sobre o spray nasal RHINOCORT AQUA (budesonida), pergunte ao seu médico ou farmacêutico.
O que é o spray nasal RHINOCORT 100mcg AQUA (budesonida)?
O spray nasal RHINOCORT AQUA (budesonida) é um medicamento de prescrição usado para tratar sintomas de alergia sazonais e durante todo o ano em adultos e crianças com 6 anos de idade ou mais.
spray nasal RHINOCORT AQUA contém budesonida, que é um corticosteroide sintético. Os corticosteróides intranasais são hormônios naturais encontrados no corpo que reduzem o inchaço do revestimento do nariz. Quando você pulveriza o spray nasal RHINOCORT 100mcg AQUA (budesonida) no nariz, ele ajuda a reduzir os sintomas nasais da rinite alérgica (inflamação do revestimento do nariz), como nariz entupido, coriza, coceira e espirros.
A segurança e eficácia do spray nasal RHINOCORT 100mcg AQUA (budesonida) não foi demonstrada em crianças com menos de 6 anos de idade.
Quem não deve usar o spray nasal RHINOCORT AQUA (budesonida)?
Não use spray nasal RHINOCORT 100mcg AQUA (budesonida):
- se tem alergia à budesonida ou a qualquer um dos ingredientes de RHINOCORT AQUA Spray Nasal. Consulte o final deste folheto para obter uma lista completa dos ingredientes do spray nasal RHINOCORT AQUA (budesonida).
que devo dizer ao meu médico antes de usar o spray nasal RHINOCORT 100mcg AQUA (budesonida)?
Antes de usar RHINOCORT AQUA (budesonida) spray nasal, informe o seu médico ou farmacêutico se:
- recentemente esteve perto de alguém com catapora ou sarampo
- tem problemas de fígado
- tem alguma infecção não tratada
- já teve uma infecção chamada tuberculose
- tem uma infecção ocular
- teve recentemente uma cirurgia ou uma lesão no nariz
- tem outras condições médicas
- estão grávidas ou planejam engravidar. Não se sabe se o spray nasal RHINOCORT 100mcg AQUA (budesonida) prejudicará o feto. Fale com o seu médico se estiver grávida ou planeia engravidar.
- está amamentando ou planeja amamentar. O spray nasal RHINOCORT 100mcg AQUA (budesonida) pode passar para o leite materno. Converse com seu médico sobre a melhor maneira de alimentar seu bebê se você tomar RHINOCORT AQUA (budesonida) spray nasal.
Informe o seu médico sobre todos os medicamentos que toma, incluindo medicamentos prescritos e não prescritos, vitaminas e suplementos de ervas.
O spray nasal RHINOCORT AQUA (budesonida) pode afetar a forma como outros medicamentos funcionam, e outros medicamentos podem afetar o funcionamento do spray nasal RHINOCORT 100mcg AQUA (budesonida).
Conheça os medicamentos que você toma. Mantenha uma lista de seus medicamentos com você para mostrar ao seu médico e farmacêutico quando receber um novo medicamento.
Como devo usar o spray nasal RHINOCORT 100mcg AQUA (budesonida)?
- O spray nasal RHINOCORT 100mcg AQUA (budesonida) deve ser usado apenas no nariz. Não pulverize nos olhos ou na boca.
- Use o spray nasal RHINOCORT AQUA (budesonida) exatamente como seu médico lhe disser para usá-lo.
- É muito importante que você use o spray nasal RHINOCORT AQUA (budesonida) regularmente. Não pare de usar RHINOCORT AQUA (budesonida) spray nasal ou altere sua dose sem falar com seu médico, mesmo se estiver se sentindo melhor.
- Fale com o seu médico se os seus sintomas não melhorarem após tomar RHINOCORT AQUA (budesonida) spray nasal durante 2 semanas ou se os seus sintomas piorarem.
- Um adulto deve ajudar uma criança a usar este medicamento.
- Consulte as Instruções de Uso do Paciente no final deste folheto para obter informações completas sobre como usar o spray nasal RHINOCORT AQUA (budesonida).
Quais são os possíveis efeitos colaterais do spray nasal RHINOCORT AQUA (budesonida)?
O spray nasal RHINOCORT 100mcg AQUA (budesonida) pode causar efeitos colaterais graves, incluindo:
- orifício na cartilagem dentro do nariz (perfuração do septo nasal). Informe o seu médico se você ouvir um som de assobio no nariz ao respirar.
- cicatrização lenta da ferida. Você não deve usar RHINOCORT 100mcg AQUA (budesonida) spray nasal até que o nariz esteja curado se tiver uma ferida no nariz, se tiver feito uma cirurgia no nariz ou se o nariz estiver ferido.
- infecção fúngica no nariz.
- Reações alérgicas. Informe o seu médico ou procure ajuda médica imediatamente se tiver:
- erupção cutânea, vermelhidão ou inchaço
- coceira intensa
- inchaço da face, boca e língua
- problemas do sistema imunológico que podem aumentar o risco de infecções. É mais provável que você tenha infecções se tomar medicamentos que enfraquecem a capacidade do seu corpo de combater infecções. Evite o contato com pessoas que tenham doenças contagiosas, como catapora ou sarampo, enquanto estiver usando o spray nasal RHINOCORT AQUA (budesonida). Os sintomas da infecção podem incluir febre, dor, dores, calafrios, sensação de cansaço, náuseas e vômitos.
- insuficiência supra-renal, A insuficiência adrenal é uma condição na qual as glândulas adrenais não produzem hormônios esteróides suficientes. Os sintomas de insuficiência supra-renal podem incluir cansaço, fraqueza, náuseas, vómitos e pressão arterial baixa.
- crescimento lento ou retardado em crianças. crescimento de uma criança deve ser verificado regularmente durante o uso de spray nasal RHINOCORT 100mcg AQUA (budesonida).
- problemas oculares, como glaucoma e catarata. Informe o seu médico se tiver uma alteração na visão ou histórico de aumento da pressão intraocular, glaucoma e/ou catarata.
Ligue para o seu médico ou procure ajuda médica imediatamente se tiver sintomas de algum dos efeitos colaterais graves listados acima.
Os efeitos colaterais mais comuns do spray nasal RHINOCORT 100mcg AQUA (budesonida) incluem:
- sangramento do nariz
- dor de garganta
- dificuldades respiratórias, como chiado no peito ou aperto no peito
- tosse
- irritação do seu nariz
Informe o seu médico se tiver algum efeito colateral que o incomode ou não desapareça.
Estes não são todos os possíveis efeitos colaterais do spray nasal RHINOCORT 100mcg AQUA (budesonida). Para mais informações, pergunte ao seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088 ou www.fda.gov/medwatch.
Você pode relatar efeitos colaterais à AstraZeneca pelo telefone 1-800-236-9933.
O que devo saber sobre rinite alérgica?
"Rinite" significa inflamação do revestimento do nariz. Às vezes é chamado de "febre do feno". A rinite alérgica pode ser causada por alergias ao pólen, pêlos de animais, ácaros da poeira doméstica e esporos de mofo. Se você tem rinite alérgica, seu nariz fica entupido, escorrendo e coçando. Você também pode espirrar muito. Você pode ter olhos vermelhos, com coceira e lacrimejantes; coceira na garganta; ou orelhas bloqueadas e com coceira.
O spray nasal RHINOCORT AQUA (budesonida) ajuda a aliviar os sintomas nasais.
Se você também tiver olhos lacrimejantes e com coceira, informe o seu médico. Ele ou ela pode prescrever medicamentos adicionais para tratar esses sintomas.
Como devo armazenar o spray nasal RHINOCORT AQUA (budesonida)?
- Armazene o spray nasal RHINOCORT AQUA (budesonida) entre 20°C e 25°C (68°F a 77°F).
- Não congele o spray nasal RHINOCORT AQUA (budesonida).
- Proteja o spray nasal RHINOCORT 100mcg AQUA (budesonida) da luz.
- Não use RHINOCORT 100mcg AQUA (budesonida) spray nasal após o número de sprays rotulados (não inclui primer) ou após a data de validade mostrada na embalagem ou rótulo do frasco.
- Mantenha a tampa protetora verde do spray nasal RHINOCORT AQUA (budesonida) quando não estiver em uso. (Por favor, veja Antes de usar no verso ).
- Mantenha o spray nasal RHINOCORT 100mcg AQUA (budesonida) e todos os medicamentos fora do alcance das crianças.
Informações gerais sobre o uso seguro e eficaz do spray nasal RHINOCORT AQUA (budesonida):
Não use spray nasal RHINOCORT 100mcg AQUA (budesonida) para uma condição para a qual não foi prescrito. Não dê RHINOCORT AQUA (budesonida) spray nasal a outras pessoas, mesmo que tenham os mesmos sintomas que você. Pode prejudicá-los.
Este folheto informativo do paciente resume as informações mais importantes sobre o spray nasal RHINOCORT 100mcg AQUA (budesonida). Se você quiser mais informações, converse com seu médico. Você pode pedir ao seu farmacêutico ou profissional de saúde informações sobre o spray nasal RHINOCORT 100mcg AQUA (budesonida) que foi escrito para profissionais de saúde.
Para obter mais informações, acesse www.astrazeneca-us.com ou ligue para a AstraZeneca no número 1-800-236-9933.
Quais são os ingredientes do spray nasal RHINOCORT AQUA (budesonida)?
Ingrediente ativo: budesonida
Ingredientes inativos: Celulose microcristalina e carboximetilcelulose sódica, dextrose anidra, polissorbato 80, edetato dissódico, sorbato de potássio e água purificada e ácido clorídrico.
Instruções de uso do paciente
Para uso apenas no nariz. Não pulverize nos olhos ou na boca.
Leia atentamente as Instruções de Uso do Paciente antes de começar a usar o spray nasal RHINOCORT 100mcg AQUA (budesonida). Se você tiver alguma dúvida, pergunte ao seu médico
Figura A 
Como preparar seu spray nasal RHINOCORT AQUA (budesonida)
Antes de usar o spray nasal RHINOCORT AQUA (budesonida), o frasco deve ser preparado. Para preparar o spray nasal RHINOCORT 100mcg AQUA (budesonida):
1. Puxe para remover a tampa protetora verde da unidade de pulverização nasal.
2. Agite o frasco suavemente por alguns segundos antes de cada uso.
3. Segure o frasco com firmeza, conforme mostrado na Figura B, com o dedo indicador e médio em cada lado da ponta de pulverização e o polegar embaixo do frasco.
Figura B 
4. Ative a bomba pressionando rápida e firmemente o colar branco enquanto segura a base do frasco com o polegar.
5. Antes de usar o spray nasal RHINOCORT AQUA (budesonida) pela primeira vez, agite o frasco suavemente. A bomba deve ser escorvada pressionando o colar branco 8 vezes. A bomba está agora pronta a ser utilizada. Se usado diariamente, a bomba não precisa ser reabastecida. Se não for usado por 2 dias seguidos, recarregue com 1 spray ou até que um spray fino apareça. Se não for usado por mais de 14 dias, lave a ponta de pulverização da bomba usando as etapas de limpeza listadas no final deste folheto. Após a limpeza, recarregue com 2 sprays ou até que apareça um spray fino.
Cada frasco de RHINOCORT AQUA (budesonida) spray nasal contém medicamento suficiente para você pulverizar o medicamento do frasco 120 vezes após o frasco ser preparado.
Você não deve usar o frasco de spray nasal RHINOCORT 100mcg AQUA (budesonida) após 120 pulverizações. Pulverizações adicionais após 120 podem não conter a quantidade certa de medicamento. Deve manter-se a par do número de pulverizações que utiliza de cada frasco de RHINOCORT 100mcg AQUA Spray Nasal e deitar fora qualquer medicamento restante que possa ter ficado no frasco. Recarregue sua receita mensalmente.
Como usar seu spray nasal RHINOCORT 100mcg AQUA (budesonida)
Siga estas instruções para o uso diário do spray nasal RHINOCORT AQUA (budesonida):
Figura C 
4. Insira a ponta de pulverização em sua narina (a ponta não deve chegar muito em seu nariz). Feche a outra narina com um dedo e incline a cabeça ligeiramente para a frente para que o spray aponte para a parte de trás do nariz (consulte Figura D ).
Figura D 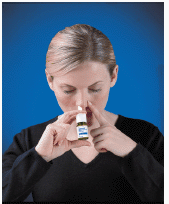
5. Para cada pulverização, ative a bomba pressionando rápida e firmemente o colar branco enquanto segura a base do frasco com o polegar. Respire suavemente para dentro pela narina.
6. Depois de pulverizar na narina, incline a cabeça para trás por alguns segundos (consulte Figura E ).
Figura E 
7. Se for necessária uma segunda pulverização na mesma narina, repita os passos 3 a 6.
8. Repita os passos 3 a 7 para a outra narina.
9. Evite assoar o nariz por 15 minutos após usar o spray nasal RHINOCORT 100mcg AQUA (budesonida).
10. Limpe a ponta de pulverização com um pano limpo (consulte Figura F ) e recoloque a tampa protetora verde. Armazene a garrafa na posição vertical.
Figura F 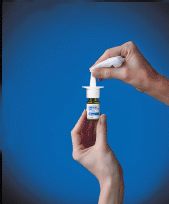
Como limpar seu spray nasal RHINOCORT 100mcg AQUA (budesonida)
Figura G 
Lave a tampa protetora verde e a ponta de pulverização regularmente. Para fazer isso:
Para obter informações adicionais sobre o RHINOCORT 100mcg AQUA (budesonida) ® Spray Nasal, ligue para o Centro de Informações da AstraZeneca, de segunda a sexta-feira, das 8h às 18h ET, exceto feriados em 1-800-236-9933.
