Zanaflex 2mg, 4mg Tizanidine Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Zanaflex 2mg e como é usado?
Zanaflex 2mg é um medicamento de prescrição usado para tratar os sintomas de rigidez muscular (espasticidade) associada a condições como paralisia cerebral ou outros distúrbios neurológicos. Zanaflex 2mg pode ser usado sozinho ou com outros medicamentos.
Zanaflex 2mg pertence a uma classe de medicamentos chamada Central Alpha-2-Adrenérgico Agonist.
Não se sabe se Zanaflex é seguro e eficaz em crianças.
Quais são os possíveis efeitos colaterais do Zanaflex?
Zanaflex 2mg pode causar efeitos colaterais graves, incluindo:
- pressão sanguínea baixa,
- testes de função hepática anormais,
- sonolência,
- alucinações,
- sonolência excessiva,
- batimentos cardíacos lentos,
- boca seca,
- cansaço, e
- fraqueza
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Zanaflex incluem:
- boca seca,
- cansaço,
- fraqueza,
- fadiga,
- cansaço,
- tontura,
- infecção do trato urinário,
- constipação,
- testes de função hepática anormais,
- vômito,
- Distúrbio da fala,
- olho preguiçoso (ambliopia),
- frequência urinária,
- sintomas da gripe,
- movimentos musculares descontrolados,
- nervosismo,
- dor de garganta, e
- nariz a pingar
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Zanaflex. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
DESCRIÇÃO
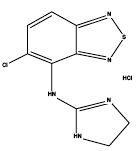
Zanaflex® (cloridrato de tizanidina) é um agonista alfa2-adrenérgico central. O cloridrato de tizanidina é um pó cristalino fino branco a esbranquiçado, inodoro ou com odor característico fraco. A tizanidina é ligeiramente solúvel em água e metanol; solubilidade em água diminui à medida que o pH aumenta. Seu nome químico é monocloridrato de 5-cloro-4-(2-imidazolin-2-ilamino)-2,1,3-benzotiadiazol. A fórmula molecular da tizanidina é C9H8ClN5S-HCl, seu peso molecular é 290,2 e sua fórmula estrutural é:
Zanaflex 4mg Capsules® é fornecido em cápsulas de 2, 4 e 6 mg para administração oral. Zanaflex Capsules® contém o ingrediente ativo, cloridrato de tizanidina (2,29 mg equivalente a 2 mg de base de tizanidina, 4,58 mg equivalente a 4 mg de base de tizanidina e 6,87 mg equivalente a 6 mg de base de tizanidina), e os ingredientes inativos, hipromelose, dióxido de silício, esferas de açúcar, dióxido de titânio, gelatina e corantes.
Os comprimidos Zanaflex® são fornecidos em comprimidos de 4 mg para administração oral. Zanaflex® comprimidos contém o ingrediente ativo, cloridrato de tizanidina (4,58 mg equivalente a 4 mg de base de tizanidina), e os ingredientes inativos, dióxido de silício coloidal, ácido esteárico, celulose microcristalina e lactose anidra.
INDICAÇÕES
Zanaflex é indicado para o tratamento da espasticidade. Devido à curta duração do efeito terapêutico, o tratamento com Zanaflex deve ser reservado para as atividades diárias e momentos em que o alívio da espasticidade é mais importante [ver DOSAGEM E ADMINISTRAÇÃO ].
DOSAGEM E ADMINISTRAÇÃO
Informações de dosagem
Zanaflex 2mg Cápsulas® ou Zanaflex® comprimidos podem ser prescritos com ou sem alimentos. Uma vez selecionada a formulação e tomada a decisão de tomar com ou sem alimentos, este regime não deve ser alterado.
Os alimentos têm efeitos complexos na farmacocinética da tizanidina, que diferem com as diferentes formulações. Zanaflex Cápsulas e Zanaflex comprimidos são bioequivalentes entre si em condições de jejum (mais de 3 horas após uma refeição), mas não em condições de alimentação (dentro de 30 minutos de uma refeição). Essas diferenças farmacocinéticas podem resultar em diferenças clinicamente significativas ao alternar a administração de comprimidos e cápsulas e ao alternar a administração entre o estado alimentado ou em jejum. Essas alterações podem resultar em aumento de eventos adversos ou início de atividade retardado ou mais rápido, dependendo da natureza da mudança. Por esta razão, o prescritor deve estar completamente familiarizado com as mudanças na cinética associadas a essas diferentes condições [ver FARMACOLOGIA CLÍNICA ].
dose inicial recomendada é de 2 mg. Como o efeito de Zanaflex atinge o pico em aproximadamente 1 a 2 horas após a dose e se dissipa entre 3 a 6 horas após a dose, o tratamento pode ser repetido em intervalos de 6 a 8 horas, conforme necessário, até um máximo de três doses em 24 horas.
A dosagem pode ser aumentada gradualmente de 2 mg a 4 mg em cada dose, com 1 a 4 dias entre os aumentos da dose, até que uma redução satisfatória do tônus muscular seja alcançada. A dose diária total não deve exceder 36 mg. Doses únicas superiores a 16 mg não foram estudadas.
Dosagem em Pacientes com Insuficiência Renal
Zanaflex deve ser usado com cautela em pacientes com insuficiência renal (clearance de creatinina AVISOS E PRECAUÇÕES ].
Dosagem em Pacientes com Insuficiência Hepática
Zanaflex 4mg deve ser usado com cautela em pacientes com qualquer insuficiência hepática. Nesses pacientes, durante a titulação, as doses individuais devem ser reduzidas. Se forem necessárias doses mais elevadas, devem ser aumentadas as doses individuais em vez da frequência de administração. Recomenda-se o monitoramento dos níveis de aminotransferase na linha de base e 1 mês após atingir a dose máxima, ou se houver suspeita de lesão hepática [ver Uso em populações específicas ].
Descontinuação do medicamento
Se a terapia precisar ser descontinuada, particularmente em pacientes que estão recebendo altas doses (20 mg a 36 mg diariamente) por longos períodos (9 semanas ou mais) ou que podem estar em tratamento concomitante com narcóticos, a dose deve ser diminuída lentamente. 2 mg a 4 mg por dia) para minimizar o risco de síndrome de abstinência e hipertensão de rebote, taquicardia e hipertonia [ver Abuso e Dependência de Drogas ].
COMO FORNECIDO
Formas de dosagem e pontos fortes
Cápsulas
mg: Corpo opaco azul claro com tampa opaca azul claro com “2 MG” impresso na tampa 4 mg: Corpo opaco branco com tampa opaca azul com “4 MG” impresso na tampa 6 mg: Corpo opaco azul com uma tampa faixa branca e tampa azul opaca com “6 MG” impresso na tampa
Comprimidos
Comprimidos brancos de 4 mg, não revestidos, com ranhura quadrissectada de um lado e gravado com “A594” no outro lado.
Armazenamento e manuseio
Zanaflex Cápsulas®
Zanaflex Capsules® (cloridrato de tizanidina) cápsulas estão disponíveis em três dosagens como cápsulas de gelatina dura de duas peças contendo cloridrato de tizanidina 2,29 mg, 4,58 mg e 6,87 mg, equivalente a 2 mg, 4 mg e 6 mg de base de tizanidina.
As cápsulas de 2 mg têm um corpo azul claro opaco com uma tampa azul claro opaca com “2 MG” impresso na tampa: frascos de 150 cápsulas ( NDC 70515-602-15)
As cápsulas de 4 mg têm um corpo branco opaco com uma tampa azul opaca com “4 MG” impresso na tampa: frascos de 150 cápsulas ( NDC 70515-604-15)
As cápsulas de 6 mg têm um corpo azul opaco com uma faixa branca e tampa azul opaca com “6 MG” impresso nas cápsulas: frascos de 150 cápsulas ( NDC 70515-606-15)
Armazenar a 25°C (77°F); excursões permitidas de 15°C a 30°C (59°F a 86°F) [ver Temperatura ambiente controlada USP ]. Dispensar em recipientes com fecho resistente a crianças.
Zanaflex® Comprimidos
Os comprimidos Zanaflex® (cloridrato de tizanidina) estão disponíveis em comprimidos brancos de 4 mg, não revestidos, contendo 4,58 mg de cloridrato de tizanidina, equivalente a 4 mg de base de tizanidina. Os comprimidos têm um sulco quadrisseccionado de um lado e estão gravados com “A594” no outro lado. Os comprimidos são fornecidos da seguinte forma: frascos de 150 comprimidos (NDC 70515-594-15).
Armazenar a 25°C (77°F); excursões permitidas de 15°C a 30°C (59°F a 86°F) [ver Temperatura ambiente controlada USP ].
Dispensar em recipientes com fecho resistente a crianças.
Fabricado para: Covis Pharma Zug, 6300 Suíça. Revisado: dezembro de 2020
EFEITOS COLATERAIS
As seguintes reações adversas são descritas em outras seções das informações de prescrição:
- Hipotensão [ver AVISOS E PRECAUÇÕES ]
- Lesão hepática [ver AVISOS E PRECAUÇÕES ]
- Sedação [ver AVISOS E PRECAUÇÕES ]
- Alucinose/Sintomas Psicóticos [ver AVISOS E PRECAUÇÕES ]
- Reações de hipersensibilidade [ver AVISOS E PRECAUÇÕES ]
Experiência de Ensaios Clínicos
Como os estudos clínicos são conduzidos em condições muito variadas, as taxas de reações adversas observadas nos estudos clínicos de um medicamento não podem ser comparadas diretamente com as taxas nos estudos clínicos de outro medicamento e podem não refletir as taxas observadas na prática clínica.
Três estudos clínicos duplo-cegos, randomizados e controlados por placebo foram conduzidos para avaliar o efeito da tizanidina no controle da espasticidade. Dois estudos foram realizados em pacientes com esclerose múltipla e um em pacientes com lesão medular. Cada estudo teve um período de tratamento ativo de 13 semanas que incluiu uma fase de titulação de 3 semanas até a dose máxima tolerada até 36 mg/dia em três doses divididas, uma fase de platô de 9 semanas onde a dose de tizanidina foi mantida constante e uma Redução da dose de 1 semana. Ao todo, 264 pacientes receberam tizanidina e 261 pacientes receberam placebo. Nos três estudos, as idades dos pacientes variaram de 15 a 69 anos e 51,4% eram mulheres. A dose mediana durante a fase de platô variou de 20-28 mg/dia.
As reações adversas mais frequentes relatadas em estudos clínicos controlados por placebo de dose múltipla envolvendo 264 pacientes com espasticidade foram boca seca, sonolência/sedação, astenia (fraqueza, fadiga e/ou cansaço) e tontura. Três quartos dos pacientes classificaram os eventos como leves a moderados e um quarto dos pacientes classificaram os eventos como graves. Estes eventos pareciam estar relacionados com a dose.
A Tabela 1 lista os sinais e sintomas que foram relatados em mais de 2% dos pacientes em três estudos de dose múltipla, controlados por placebo que receberam Zanaflex, onde a frequência no grupo Zanaflex foi maior do que no grupo placebo. Para fins de comparação, também é fornecida a frequência correspondente do evento (por 100 pacientes) entre os pacientes tratados com placebo.
No estudo de dose única, controlado por placebo, envolvendo 142 pacientes com espasticidade devido à esclerose múltipla (Estudo 1) [ver Estudos clínicos ], os pacientes foram questionados especificamente se haviam experimentado alguma das quatro reações adversas mais comuns: boca seca, sonolência (sonolência), astenia (fraqueza, fadiga e/ou cansaço) e tontura. Além disso, foram observadas hipotensão e bradicardia. A ocorrência dessas reações está resumida na Tabela 2. Outros eventos foram, em geral, relatados a uma taxa de 2% ou menos.
Experiência pós-marketing
As seguintes reações adversas foram identificadas durante o uso pós-aprovação de Zanaflex. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento.
Certos eventos, como sonolência, boca seca, hipotensão, diminuição da pressão arterial, bradicardia, tontura, fraqueza ou astenia, espasmos musculares, alucinações, fadiga, anormalidades nos testes de função hepática e hepatotoxicidade, foram observados em ensaios clínicos e pós-comercialização e são discutidos nas seções anteriores deste documento.
As seguintes reações adversas foram identificadas como ocorrendo na experiência pós-comercialização de Zanaflex. Com base nas informações fornecidas sobre essas reações, uma relação causal com Zanaflex não pode ser totalmente excluída. Os eventos estão listados em ordem decrescente de significância clínica; gravidade no cenário pós-comercialização não é relatada.
- Síndrome de Stevens Johnson
- Reação anafilática
- Dermatite Esfoliativa
- Taquicardia ventricular
- Hepatite
- Convulsão
- Depressão
- Artralgia
- Parestesia
- Irritação na pele
- Tremor
INTERAÇÕES MEDICAMENTOSAS
Fluvoxamina
uso concomitante de fluvoxamina e Zanaflex 4mg é contraindicado. Alterações na farmacocinética da tizanidina quando administrada com fluvoxamina resultaram em diminuição significativa da pressão arterial, aumento da sonolência e aumento do comprometimento psicomotor. CONTRA-INDICAÇÕES e FARMACOLOGIA CLÍNICA ].
Ciprofloxacina
O uso concomitante de ciprofloxacina e Zanaflex é contraindicado. Alterações na farmacocinética da tizanidina quando administrada com ciprofloxacina resultaram em diminuição significativa da pressão arterial, aumento da sonolência e aumento do comprometimento psicomotor. CONTRA-INDICAÇÕES e FARMACOLOGIA CLÍNICA ].
Inibidores de CYP1A2, exceto fluvoxamina e ciprofloxacina
Devido a potenciais interações medicamentosas, o uso concomitante de Zanaflex com outros inibidores do CYP1A2, como zileuton, fluoroquinolonas que não sejam inibidores fortes do CYP1A2 (que são contraindicados), antiarrítmicos (amiodarona, mexiletina, propafenona e verapamil), cimetidina, famotidina, contraceptivos orais, aciclovir e ticlopidina) devem ser evitados. Se seu uso for clinicamente necessário, a terapia deve ser iniciada com dose de 2 mg e aumentada em etapas de 2-4 mg diariamente com base na resposta do paciente à terapia. Se ocorrerem reações adversas como hipotensão, bradicardia ou sonolência excessiva, reduza ou interrompa a terapia com Zanaflex [ver AVISOS E PRECAUÇÕES e FARMACOLOGIA CLÍNICA ].
Contraceptivos orais
uso concomitante de Zanaflex 2mg com contraceptivos orais não é recomendado. No entanto, se o uso concomitante for clinicamente necessário, inicie Zanaflex 4mg com uma dose única de 2mg e aumente em etapas de 2-4 mg diariamente com base na resposta do paciente à terapia. Se ocorrerem reações adversas como hipotensão, bradicardia ou sonolência excessiva, reduza ou interrompa a terapia com Zanaflex [ver FARMACOLOGIA CLÍNICA ].
Álcool
O álcool aumenta a quantidade total de droga na corrente sanguínea após uma dose de Zanaflex. Isso foi associado a um aumento nas reações adversas do Zanaflex. Os efeitos depressores do SNC de Zanaflex e álcool são aditivos [ver FARMACOLOGIA CLÍNICA ].
Outros depressores do SNC
Os efeitos sedativos de Zanaflex com depressores do SNC (por exemplo, benzodiazepínicos, opióides, antidepressivos tricíclicos) podem ser aditivos. Monitorar os pacientes que tomam Zanaflex 2mg com outro depressor do SNC quanto a sintomas de sedação excessiva [ver FARMACOLOGIA CLÍNICA ].
Agonistas α2-adrenérgicos
Como os efeitos hipotensores podem ser cumulativos, não é recomendado que Zanaflex 4mg seja usado com outros agonistas α2-adrenérgicos [ver AVISOS E PRECAUÇÕES ].
Abuso e Dependência de Drogas
Abuso
O potencial de abuso não foi avaliado em estudos em humanos. Os ratos foram capazes de distinguir a tizanidina da solução salina em um paradigma de discriminação padrão, após o treinamento, mas não conseguiram generalizar os efeitos da morfina, cocaína, diazepam ou fenobarbital para tizanidina.
Dependência
tizanidina está intimamente relacionada com a clonidina, que muitas vezes é abusada em combinação com narcóticos e é conhecida por causar sintomas de rebote após a retirada abrupta. Foram relatados três casos de sintomas rebote na retirada súbita de tizanidina. Os relatos de casos sugerem que esses pacientes também faziam uso indevido de narcóticos. Os sintomas de abstinência incluíram hipertensão, taquicardia, hipertonia, tremor e ansiedade. Os sintomas de abstinência são mais prováveis de ocorrer nos casos em que são utilizadas altas doses, especialmente por períodos prolongados, ou com o uso concomitante de narcóticos. Se a terapia precisar ser descontinuada, a dose deve ser diminuída lentamente para minimizar o risco de sintomas de abstinência. DOSAGEM E ADMINISTRAÇÃO ].
Macacos demonstraram autoadministrar tizanidina de maneira dose-dependente, e a interrupção abrupta da tizanidina produziu sinais transitórios de abstinência em doses > 35 vezes a dose humana máxima recomendada com base em mg/m². Esses sinais transitórios de retirada (aumento da locomoção, espasmos do corpo e comportamento aversivo em relação ao observador) não foram revertidos pela administração de naloxona.
AVISOS
Incluído como parte do PRECAUÇÕES seção.
PRECAUÇÕES
Hipotensão
A tizanidina é um agonista α2-adrenérgico que pode produzir hipotensão. Síncope foi relatada na configuração pós-comercialização. A chance de hipotensão significativa pode ser minimizada pela titulação da dose e pela atenção aos sinais e sintomas de hipotensão antes do avanço da dose. Além disso, os pacientes que se deslocam da posição supina para a posição vertical fixa podem apresentar risco aumentado de hipotensão e efeitos ortostáticos.
Monitore a hipotensão quando Zanaflex for usado em pacientes recebendo terapia anti-hipertensiva concomitante. Não é recomendado que Zanaflex 2mg seja usado com outros agonistas α2-adrenérgicos. Hipotensão clinicamente significativa (diminuição da pressão sistólica e diastólica) foi relatada com a administração concomitante de fluvoxamina ou ciprofloxacina e doses únicas de 4 mg de Zanaflex. Portanto, o uso concomitante de Zanaflex com fluvoxamina ou com ciprofloxacina, inibidores potentes do CYP1A2, é contraindicado [ver CONTRA-INDICAÇÕES e INTERAÇÕES MEDICAMENTOSAS ].
Risco de lesão hepática
Zanaflex pode causar lesão hepática hepatocelular. Zanaflex 4mg deve ser usado com cautela em pacientes com qualquer insuficiência hepática. Recomenda-se o monitoramento dos níveis de aminotransferase na linha de base e 1 mês após atingir a dose máxima, ou se houver suspeita de lesão hepática [ver DOSAGEM E ADMINISTRAÇÃO e Uso em populações específicas ].
Sedação
Zanaflex pode causar sedação, o que pode interferir nas atividades diárias. Nos estudos de dose múltipla, a prevalência de pacientes com sedação atingiu o pico após a primeira semana de titulação e depois permaneceu estável durante a fase de manutenção do estudo. Os efeitos depressores do SNC de Zanaflex com álcool e outros depressores do SNC (por exemplo, benzodiazepínicos, opióides, antidepressivos tricíclicos) podem ser aditivos. Monitorar os pacientes que tomam Zanaflex 4mg com outro depressor do SNC quanto a sintomas de sedação excessiva [ver INTERAÇÕES MEDICAMENTOSAS ].

Alucinose/Sintomas Psicóticos
uso de Zanaflex 4mg tem sido associado a alucinações. Alucinações ou delírios visuais formados foram relatados em 5 de 170 pacientes (3%) em dois estudos clínicos controlados norte-americanos. A maioria dos pacientes estava ciente de que os eventos eram irreais. Um paciente desenvolveu psicose em associação com as alucinações. Um paciente entre esses 5 continuou a ter problemas por pelo menos 2 semanas após a descontinuação da tizanidina. Considere descontinuar Zanaflex em pacientes que desenvolvem alucinações.
Interação com Inibidores de CYP1A2
Devido a potenciais interações medicamentosas, Zanaflex 4mg é contraindicado em pacientes em uso de inibidores potentes do CYP1A2, como fluvoxamina ou ciprofloxacina. Reações adversas como hipotensão, bradicardia ou sonolência excessiva podem ocorrer quando Zanaflex é tomado com outros inibidores do CYP1A2, como zileuton, fluoroquinolonas diferentes do ciprofloxacino (que é contraindicado), antiarrítmicos (amiodarona, mexiletina, propafenona), cimetidina, famotidina, anticoncepcionais, aciclovir e ticlopidina). O uso concomitante deve ser evitado a menos que a necessidade da terapia com Zanaflex 2mg seja clinicamente evidente. Nesse caso, use com cautela [consulte INTERAÇÕES MEDICAMENTOSAS e FARMACOLOGIA CLÍNICA ].
Reações de hipersensibilidade
Zanaflex pode causar anafilaxia. Sinais e sintomas, incluindo comprometimento respiratório, urticária e angioedema da garganta e da língua foram relatados. Os pacientes devem ser informados sobre os sinais e sintomas de reações alérgicas graves e instruídos a descontinuar o Zanaflex e procurar atendimento médico imediato caso esses sinais e sintomas ocorram. CONTRA-INDICAÇÕES ].
Aumento do risco de reações adversas em pacientes com insuficiência renal
Zanaflex deve ser usado com cautela em pacientes com insuficiência renal (clearance de creatinina DOSAGEM E ADMINISTRAÇÃO e Uso em populações específicas ].
Reações Adversas de Retirada
As reações adversas de retirada incluem hipertensão rebote, taquicardia e hipertonia. Para minimizar o risco dessas reações, particularmente em pacientes que receberam altas doses (20 a 28 mg por dia) por longos períodos de tempo (9 semanas ou mais) ou que podem estar em tratamento concomitante com narcóticos, a dose deve ser diminuída lentamente (2 a 4 mg por dia) [ver DOSAGEM E ADMINISTRAÇÃO ].
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Carcinogênese
tizanidina foi administrada a camundongos por 78 semanas em doses orais de até 16 mg/kg/dia, que é 2 vezes a dose humana máxima recomendada (MRHD) de 36 mg/dia com base na área de superfície corporal (mg/m²). A tizanidina foi administrada a ratos por 104 semanas em doses orais de até 9 mg/kg/dia, que é 2,5 vezes a MRHD na base de mg/m². Não houve aumento de tumores em nenhuma das espécies.
Mutagênese
A tizanidina foi negativa no ensaio in vitro (mutação reversa bacteriana [Ames], mutação genética de mamífero e teste de aberração cromossômica em células de mamífero) e in vivo (micronúcleo da medula óssea e citogenética).
Prejuízo da Fertilidade
A administração oral de tizanidina a ratos antes e durante o acasalamento e continuando durante o início da gravidez em fêmeas resultou na redução da fertilidade em ratos machos e fêmeas em doses de 30 e 10 mg/kg/dia, respectivamente. Nenhum efeito sobre a fertilidade foi observado com doses de 10 (masculino) e 3 (feminino) mg/kg/dia, que são aproximadamente 3 vezes e semelhantes à MRHD, respectivamente, na base de mg/m².
Uso em populações específicas
Gravidez
Resumo do risco
Não existem dados adequados sobre o risco de desenvolvimento associado ao uso de Zanaflex 2mg em mulheres grávidas. Em estudos com animais, a administração de tizanidina durante a gravidez resultou em toxicidade no desenvolvimento (mortalidade embriofetal e pós-natal e déficits de crescimento) em doses menores do que as usadas clinicamente, que não foram associadas a toxicidade materna (ver Dados de animais ).
Na população geral dos EUA, o risco de fundo estimado de defeitos congênitos graves e aborto espontâneo em gestações clinicamente reconhecidas é de 2% - 4% e 15% - 20%, respectivamente. O risco de fundo de defeitos congênitos graves e aborto para a população indicada é desconhecido.
Dados
Dados de animais
administração oral de tizanidina (0,3 a 100 mg/kg/dia) a ratas grávidas durante o período de organogênese resultou em mortalidade embriofetal e pós-natal da prole e reduções no peso corporal em doses de 30 mg/kg/dia e acima. A toxicidade materna foi observada na dose mais alta testada. A dose sem efeito para toxicidade no desenvolvimento embriofetal em ratos (3 mg/kg/dia) é semelhante à dose humana máxima recomendada (MRHD) de 36 mg/dia com base na área de superfície corporal (mg/m²).
administração oral de tizanidina (1 a 100 mg/kg/dia) a coelhas grávidas durante o período de organogênese resultou em mortalidade embriofetal e pós-natal da prole em todas as doses. A toxicidade materna foi observada na dose mais alta testada. A administração oral de tizanidina (10 e 30 mg/kg/dia) durante o período perinatal da gravidez (2-6 dias antes do parto) resultou em aumento da mortalidade pós-natal da prole em ambas as doses. Não foi identificada uma dose sem efeito para toxicidade no desenvolvimento embriofetal em coelhos. A dose mais baixa testada (1 mg/kg/dia) é inferior à MRHD na base de mg/m².
Em um estudo de desenvolvimento pré e pós-natal em ratos, a administração oral de tizanidina (3 a 30 mg/kg/dia) resultou em aumento da mortalidade pós-natal da prole. Uma dose sem efeito para toxicidade de desenvolvimento pré e pós-natal não foi identificada. A dose mais baixa testada (3 mg/kg/dia) é semelhante à MRHD na base de mg/m², respectivamente.
Lactação
Resumo do risco
Não existem dados sobre a presença de tizanidina no leite humano, os efeitos no lactente ou os efeitos na produção de leite humano. Estudos em animais relataram a presença de tizanidina no leite de animais lactantes.
Os benefícios do aleitamento materno para o desenvolvimento e para a saúde devem ser considerados juntamente com a necessidade clínica da mãe de Zanaflex 4mg e quaisquer potenciais efeitos adversos no lactente de Zanaflex ou da condição materna subjacente.
Fêmeas e Machos com Potencial Reprodutivo
Não existem estudos adequados e bem controlados em humanos sobre o efeito de Zanaflex 4mg no potencial reprodutivo feminino ou masculino. A administração oral de tizanidina a ratos machos e fêmeas resultou em efeitos adversos na fertilidade [ver Toxicologia não clínica ].
Uso Pediátrico
A segurança e eficácia em pacientes pediátricos não foram estabelecidas.
Uso Geriátrico
Zanaflex 2mg é conhecido por ser substancialmente excretado pelos rins, e o risco de reações adversas a este medicamento pode ser maior em pacientes com função renal comprometida. Como os pacientes idosos são mais propensos a ter função renal diminuída, deve-se ter cuidado na seleção da dose e pode ser útil monitorar a função renal.
Os estudos clínicos de Zanaflex 2mg não incluíram um número suficiente de indivíduos com 65 anos ou mais para determinar se eles respondem de forma diferente dos indivíduos mais jovens. A comparação de estudos cruzados de dados farmacocinéticos após a administração de dose única de 6 mg de Zanaflex 2 mg mostrou que indivíduos mais jovens eliminaram o medicamento quatro vezes mais rápido do que indivíduos idosos. Em pacientes idosos com insuficiência renal (depuração de creatinina
Função Renal Prejudicada
Zanaflex é conhecido por ser substancialmente excretado pelos rins, e o risco de reações adversas a este medicamento pode ser maior em pacientes com função renal comprometida. Em pacientes com insuficiência renal (clearance de creatinina DOSAGEM E ADMINISTRAÇÃO , AVISOS E PRECAUÇÕES e FARMACOLOGIA CLÍNICA ].
Função hepática prejudicada
A influência da insuficiência hepática na farmacocinética da tizanidina não foi avaliada. Como a tizanidina é extensamente metabolizada no fígado, espera-se que a insuficiência hepática tenha efeitos significativos na farmacocinética da tizanidina [ver DOSAGEM E ADMINISTRAÇÃO , AVISOS E PRECAUÇÕES , e FARMACOLOGIA CLÍNICA ].
SOBREDOSAGEM
Uma revisão do banco de dados de vigilância de segurança revelou casos de overdose intencional e acidental de Zanaflex. Alguns dos casos resultaram em fatalidade e muitas das overdoses intencionais foram com vários medicamentos, incluindo depressores do SNC. As manifestações clínicas da superdosagem de tizanidina foram consistentes com sua farmacologia conhecida. Na maioria dos casos foi observada uma diminuição do sensório incluindo letargia, sonolência, confusão e coma. A função cardíaca deprimida também é observada, incluindo mais frequentemente bradicardia e hipotensão. A depressão respiratória é outra característica comum da overdose de tizanidina.
Caso ocorra sobredosagem, devem ser tomadas medidas básicas para assegurar a adequação de uma via aérea e a monitorização dos sistemas cardiovascular e respiratório. A tizanidina é uma droga lipossolúvel, que é apenas ligeiramente solúvel em água e metanol. Portanto, não é provável que a diálise seja um método eficiente de remover o fármaco do corpo. Em geral, os sintomas desaparecem dentro de um a três dias após a descontinuação da tizanidina e administração de terapia apropriada. Devido ao mecanismo de ação semelhante, os sintomas e a gestão da sobredosagem de tizanidina são semelhantes aos da sobredosagem de clonidina. Para obter as informações mais recentes sobre o gerenciamento de overdose, entre em contato com um centro de controle de intoxicações.
CONTRA-INDICAÇÕES
Zanaflex é contraindicado em pacientes em uso de inibidores potentes do CYP1A2, como fluvoxamina ou ciprofloxacina. INTERAÇÕES MEDICAMENTOSAS ].
FARMACOLOGIA CLÍNICA
Mecanismo de ação
tizanidina é um agonista central do receptor alfa-2-adrenérgico e, presumivelmente, reduz a espasticidade ao aumentar a inibição pré-sináptica dos neurônios motores. Os efeitos da tizanidina são maiores nas vias polissinápticas. Acredita-se que o efeito geral dessas ações reduz a facilitação dos neurônios motores espinhais.
Farmacocinética
Absorção e Distribuição
Após administração oral, a tizanidina é essencialmente completamente absorvida. A biodisponibilidade oral absoluta da tizanidina é de aproximadamente 40% (CV = 24%), devido ao extenso metabolismo hepático de primeira passagem. A tizanidina é amplamente distribuída por todo o corpo com um volume médio de distribuição no estado de equilíbrio de 2,4 L/kg (CV = 21%) após administração intravenosa em voluntários adultos saudáveis. A tizanidina liga-se aproximadamente 30% às proteínas plasmáticas.
Diferenças entre as cápsulas de 4mg Zanaflex® e os comprimidos Zanaflex®
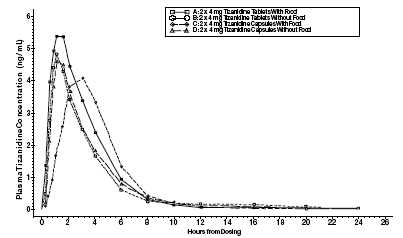
Zanaflex 2mg Capsules® e Zanaflex® comprimidos são bioequivalentes entre si em condições de jejum, mas não em condições de alimentação. Uma dose única de dois comprimidos de 4 mg ou duas cápsulas de 4 mg foi administrada sob condições de alimentação e jejum em um estudo aberto, randomizado, cruzado de quatro períodos em 96 voluntários humanos, dos quais 81 eram elegíveis para a análise estatística. Após a administração oral do comprimido ou da cápsula (em jejum), as concentrações plasmáticas máximas de tizanidina ocorreram 1,0 horas após a administração com meia-vida de aproximadamente 2 horas. Quando dois comprimidos de 4 mg foram administrados com alimentos, a concentração plasmática máxima média aumentou em aproximadamente 30% e o tempo médio para atingir o pico da concentração plasmática aumentou em 25 minutos, para 1 hora e 25 minutos. Em contraste, quando duas cápsulas de 4 mg foram administradas com alimentos, a concentração plasmática máxima média foi diminuída em 20%, o tempo médio para atingir o pico de concentração plasmática aumentou 2 a 3 horas. Consequentemente, a Cmax média para a cápsula quando administrada com alimentos é aproximadamente 66% da Cmax para o comprimido quando administrado com alimentos. Os alimentos também aumentaram a extensão da absorção tanto para os comprimidos quanto para as cápsulas. O aumento com o comprimido (~30%) foi significativamente maior do que com a cápsula (~10%). Consequentemente, quando cada um foi administrado com alimentos, a quantidade absorvida da cápsula foi de cerca de 80% da quantidade absorvida do comprimido. A administração do conteúdo da cápsula polvilhada em compota de maçã não foi bioequivalente à administração de uma cápsula intacta em condições de jejum. A administração do conteúdo da cápsula em compota de maçã resultou em um aumento de 15%-20% na Cmax e AUC da tizanidina e uma diminuição de 15 minutos no tempo médio de atraso e no tempo até a concentração máxima em comparação com a administração de uma cápsula intacta em jejum.
Figura 1: Concentração média de tizanidina versus perfis de tempo para comprimidos e cápsulas Zanaflex (2 x 4 mg) sob condições de jejum e alimentação
Metabolismo e Excreção
A tizanidina tem farmacocinética linear sobre as doses estudadas no desenvolvimento clínico (1-20 mg). A tizanidina tem uma meia-vida de aproximadamente 2,5 horas (CV=33%). Aproximadamente 95% de uma dose administrada é metabolizada. A isoenzima primária do citocromo P450 envolvida no metabolismo da tizanidina é a CYP1A2. Os metabólitos da tizanidina não são ativos; suas meias-vidas variam de 20 a 40 horas.
Após administração oral única e múltipla de 14C-tizanidina, uma média de 60% e 20% da radioatividade total foi recuperada na urina e nas fezes, respectivamente.
Populações Específicas
Efeitos da idade
Nenhum estudo farmacocinético específico foi realizado para investigar os efeitos da idade. A comparação de estudos cruzados de dados farmacocinéticos após a administração de dose única de 6 mg de Zanaflex 2 mg mostrou que indivíduos mais jovens eliminaram o medicamento quatro vezes mais rápido do que indivíduos idosos. Zanaflex 4mg não foi avaliado em crianças [ver Uso em populações específicas ].
Insuficiência hepática
A influência da insuficiência hepática na farmacocinética da tizanidina não foi avaliada. Como a tizanidina é extensamente metabolizada no fígado, espera-se que a insuficiência hepática tenha efeitos significativos na farmacocinética da tizanidina. Zanaflex não é recomendado nesta população de pacientes [ver Uso em populações específicas ].
Insuficiência renal
A depuração da tizanidina é reduzida em mais de 50% em pacientes idosos com insuficiência renal (depuração de creatinina AVISOS E PRECAUÇÕES e Uso em populações específicas ].
Efeitos de gênero
Nenhum estudo farmacocinético específico foi realizado para investigar os efeitos de gênero. A análise retrospectiva dos dados farmacocinéticos, no entanto, após a administração de dose única e múltipla de 4 mg de Zanaflex 2 mg, mostrou que o sexo não teve efeito sobre a farmacocinética da tizanidina.
Efeitos de corrida
As diferenças farmacocinéticas devido à raça não foram estudadas.
Interações medicamentosas
Inibidores de CYP1A2
A interação entre Zanaflex e fluvoxamina ou ciprofloxacina é provavelmente devido à inibição do CYP1A2 pela fluvoxamina ou ciprofloxacina. O efeito da fluvoxamina na farmacocinética de uma dose única de 4 mg de Zanaflex foi estudado em 10 indivíduos saudáveis. A Cmax, AUC e meia-vida da tizanidina aumentaram 12 vezes, 33 vezes e 3 vezes, respectivamente. O efeito da ciprofloxacina na farmacocinética de uma dose única de 4 mg de Zanaflex 4 mg foi estudado em 10 indivíduos saudáveis. A Cmax e a AUC da tizanidina aumentaram 7 vezes e 10 vezes, respectivamente [ver CONTRA-INDICAÇÕES ].
Embora não haja estudos clínicos avaliando os efeitos de outros inibidores do CYP1A2 sobre a tizanidina, outros inibidores do CYP1A2, como zileuton, outras fluoroquinolonas, antiarrítmicos (amiodarona, mexiletina, propafenona e verapamil), cimetidina, famotidina, contraceptivos orais, aciclovir e ticlopidina, também pode levar a aumentos substanciais nas concentrações sanguíneas de tizanidina [ver AVISOS E PRECAUÇÕES ].
Estudos in vitro de isoenzimas do citocromo P450 usando microssomas hepáticos humanos indicam que nem a tizanidina nem os principais metabólitos podem afetar o metabolismo de outras drogas metabolizadas pelas isoenzimas do citocromo P450.
Contraceptivos orais
Nenhum estudo farmacocinético específico foi realizado para investigar a interação entre contraceptivos orais e Zanaflex. A análise retrospectiva dos dados farmacocinéticos da população após a administração de doses únicas e múltiplas de 4 mg de Zanaflex, no entanto, mostrou que as mulheres que tomavam contraceptivos orais concomitantemente tinham uma depuração de tizanidina 50% menor em comparação com as mulheres que não tomavam contraceptivos orais [ver AVISOS E PRECAUÇÕES ].
Paracetamol
A tizanidina atrasou o Tmax do paracetamol em 16 minutos. O paracetamol não afetou a farmacocinética da tizanidina.
Álcool
O álcool aumentou a AUC da tizanidina em aproximadamente 20%, ao mesmo tempo em que aumentou sua Cmax em aproximadamente 15%. Isso foi associado a um aumento nos efeitos colaterais da tizanidina. Os efeitos depressores do SNC da tizanidina e do álcool são aditivos.
Estudos clínicos
capacidade da tizanidina em reduzir o tônus muscular aumentado associado à espasticidade foi demonstrada em dois estudos adequados e bem controlados em pacientes com esclerose múltipla ou lesão medular (Estudos 1 e 2).
Estudo de dose única em pacientes com esclerose múltipla com espasticidade
No Estudo 1, pacientes com esclerose múltipla foram randomizados para receber doses orais únicas de medicamento ou placebo. Pacientes e avaliadores estavam cegos para a atribuição do tratamento e esforços foram feitos para reduzir a probabilidade de que os avaliadores ficassem cientes indiretamente da atribuição do tratamento (por exemplo, eles não forneceram atendimento direto aos pacientes e foram proibidos de fazer perguntas sobre os efeitos colaterais). Ao todo, 140 pacientes receberam placebo, 8 mg ou 16 mg de Zanaflex.
resposta foi avaliada por exame físico; o tônus muscular foi avaliado em uma escala de 5 pontos (escore de Ashworth), com uma pontuação de 0 usada para descrever o tônus muscular normal. Uma pontuação de 1 indicava uma leve contração espástica, enquanto uma pontuação de 2 indicava uma resistência muscular mais acentuada. Uma pontuação de 3 foi usada para descrever um aumento considerável no tônus, dificultando o movimento passivo. Um músculo imobilizado por espasticidade recebeu uma pontuação de 4. As contagens de espasmo também foram coletadas.
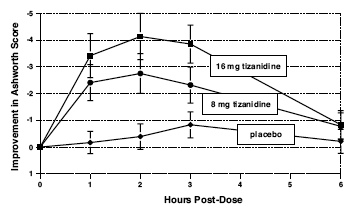
As avaliações foram feitas em 1, 2, 3 e 6 horas após o tratamento. Uma redução estatisticamente significativa da pontuação de Ashworth para Zanaflex 2mg em comparação com placebo foi detectada em 1, 2 e 3 horas após o tratamento. A Figura 2 abaixo mostra uma comparação da mudança média no tônus muscular da linha de base, medida pela escala de Ashworth. A maior redução no tônus muscular foi de 1 a 2 horas após o tratamento. Por 6 horas após o tratamento, o tônus muscular nos grupos de 8 e 16 mg de Zanaflex 2mg era indistinguível do tônus muscular em pacientes tratados com placebo. Dentro de um determinado paciente, a melhora no tônus muscular foi correlacionada com a concentração plasmática. As concentrações plasmáticas foram variáveis de paciente para paciente em uma determinada dose. Embora 16 mg tenha produzido um efeito maior, eventos adversos, incluindo hipotensão, foram mais comuns e mais graves do que no grupo de 8 mg. Não houve diferenças no número de espasmos ocorridos em cada grupo.
Figura 2: Estudo de Dose Única - Mudança Média no Tônus Muscular desde a Linha de Base medida pela Escala Ashworth ± 95% de Intervalo de Confiança (Uma pontuação Ashworth negativa significa uma melhora no Tônus Muscular desde a Linha de Base)
Estudo de sete semanas em pacientes com lesão medular com espasticidade
Em um estudo de 7 semanas (Estudo 2), 118 pacientes com espasticidade secundária a lesão medular foram randomizados para placebo ou Zanaflex. Passos semelhantes aos do primeiro estudo foram empregados para garantir a integridade do cegamento.
Os pacientes foram titulados ao longo de 3 semanas até uma dose máxima tolerada ou 36 mg por dia administrados em três doses desiguais (por exemplo, 10 mg administrados de manhã e à tarde e 16 mg administrados à noite). Os pacientes foram então mantidos em sua dose máxima tolerada por 4 semanas adicionais (ou seja, fase de manutenção). Ao longo da fase de manutenção, o tônus muscular foi avaliado na escala de Ashworth dentro de um período de 2,5 horas após a dose da manhã ou da tarde. O número de espasmos diurnos foi registrado diariamente pelos pacientes.
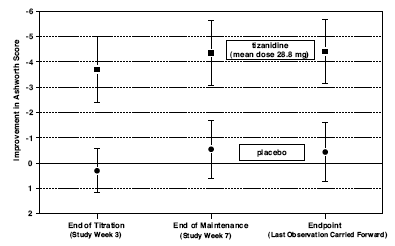
No ponto final (o tempo de avaliação do resultado especificado pelo protocolo), houve uma redução estatisticamente significativa no tônus muscular e na frequência de espasmos no grupo tratado com Zanaflex em comparação ao placebo. A redução no tônus muscular não foi associada a uma redução na força muscular (um resultado desejável), mas também não levou a nenhuma vantagem consistente dos pacientes tratados com Zanaflex nas medidas das atividades da vida diária. A Figura 3 abaixo mostra uma comparação da mudança média no tônus muscular da linha de base, medida pela escala de Ashworth.
Figura 3: Estudo de Sete Semanas - Mudança Média no Tônus Muscular 0,5 - 2,5 Horas Após a Dosagem, Medido pela Escala de Ashworth ± 95% de Intervalo de Confiança (Uma pontuação Ashworth negativa significa uma melhora no tônus muscular desde a linha de base)
INFORMAÇÃO DO PACIENTE
Interações Medicamentosas Graves
Aconselhe os pacientes que não devem tomar Zanaflex se estiverem tomando fluvoxamina ou ciprofloxacina devido ao risco aumentado de reações adversas graves, incluindo redução grave da pressão arterial e sedação. Instruir os pacientes a informarem seus médicos ou farmacêuticos quando iniciarem ou deixarem de tomar qualquer medicamento devido aos riscos associados à interação entre Zanaflex e outros medicamentos.
Dosagem Zanaflex
Diga aos pacientes para tomar Zanaflex 2mg exatamente como prescrito (de forma consistente com ou sem alimentos) e não alternar entre comprimidos e cápsulas. Informe aos pacientes que eles não devem tomar mais Zanaflex 2mg do que o prescrito devido ao risco de eventos adversos em doses únicas superiores a 8 mg ou doses diárias totais superiores a 36 mg. Informe aos pacientes que eles não devem descontinuar repentinamente Zanaflex 4mg, pois podem ocorrer hipertensão de rebote e taquicardia.
Efeitos do Zanaflex
Avise os pacientes que eles podem apresentar hipotensão e tome cuidado ao mudar da posição deitada ou sentada para a posição de pé. Informe aos pacientes que Zanaflex pode deixá-los sedados ou sonolentos e que devem ter cuidado ao realizar atividades que exijam atenção, como dirigir veículos ou operar máquinas. Informe aos pacientes que a sedação pode ser aditiva quando Zanaflex 4mg é tomado em conjunto com medicamentos (baclofeno, benzodiazepínicos) ou substâncias (por exemplo, álcool) que atuam como depressores do SNC. Lembre aos pacientes que, se eles dependem de sua espasticidade para manter a postura e o equilíbrio na locomoção, ou sempre que a espasticidade é utilizada para obter uma função aumentada, Zanaflex diminui a espasticidade e deve-se ter cuidado.
