Benicar 10mg, 20mg, 40mg Olmesartan Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Benicar 40mg e como é usado?
Benicar é um medicamento de prescrição utilizado para tratar os sintomas da pressão arterial elevada (hipertensão). Benicar 10mg pode ser usado sozinho ou com outros medicamentos.
Benicar é um bloqueador do receptor de angiotensina II ou BRA.
Não se sabe se Benicar é seguro e eficaz em crianças menores de 6 anos.
Quais são os possíveis efeitos colaterais do Benicar 40mg?
Benicar pode causar efeitos colaterais graves, incluindo:
- tontura
- pouca ou nenhuma micção
- inchaço nas mãos ou pés
- náusea
- fraqueza
- sensação de formigamento
- dor no peito
- batimentos cardíacos rápidos ou irregulares
- perda de movimento
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns de Benicar incluem:
- tontura
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Benicar. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
AVISO
TOXICIDADE FETAL
- Quando a gravidez for detectada, interrompa Benicar 40mg o mais rápido possível [ver ADVERTÊNCIAS E PRECAUÇÕES]
- Drogas que agem diretamente no sistema renina-angiotens podem causar lesões e morte ao feto em desenvolvimento [ver ADVERTÊNCIAS E PRECAUÇÕES]
DESCRIÇÃO
A olmesartana medoxomila, uma pró-droga, é hidrolisada a olmesartana durante a absorção pelo trato gastrointestinal. Olmesartan é um antagonista seletivo do receptor da angiotensina II do subtipo AT1.
Olmesartana medoxomila é descrita quimicamente como 2,3-dihidroxi-2-butenil 4-(1 hidroxi-1-metiletil)-2-propil-1-[p-(o-1H-tetrazol-5-ilfenil)benzil]imidazol- 5 carboxilato, 2,3-carbonato cíclico.
Sua fórmula empírica é C29H30N6O6 e sua fórmula estrutural é:
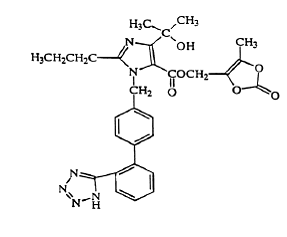
Olmesartan medoxomilo é um pó ou pó cristalino branco a branco amarelado claro com um peso molecular de 558,59. É praticamente insolúvel em água e pouco solúvel em metanol. Benicar 20 mg está disponível para uso oral na forma de comprimidos revestidos por película contendo 5 mg, 20 mg ou 40 mg de olmesartana medoxomila e os seguintes ingredientes inativos: hidroxipropilcelulose, hipromelose, lactose monohidratada, hidroxipropilcelulose de baixa substituição, estearato de magnésio, celulose microcristalina , talco, dióxido de titânio e (5 mg apenas) óxido de ferro amarelo.
INDICAÇÕES
Benicar 40mg é indicado para o tratamento da hipertensão em adultos e crianças de seis anos de idade ou mais, para baixar a pressão arterial. A redução da pressão arterial reduz o risco de eventos cardiovasculares fatais e não fatais, principalmente derrames e infartos do miocárdio. Esses benefícios foram observados em ensaios controlados de medicamentos anti-hipertensivos de uma ampla variedade de classes farmacológicas, incluindo a classe à qual esse medicamento pertence principalmente. Não há estudos controlados que demonstrem redução de risco com Benicar.
controle da hipertensão arterial deve fazer parte do gerenciamento abrangente do risco cardiovascular, incluindo, conforme apropriado, controle lipídico, controle do diabetes, terapia antitrombótica, cessação do tabagismo, exercícios e ingestão limitada de sódio. Muitos pacientes precisarão de mais de um medicamento para atingir as metas de pressão arterial. Para obter conselhos específicos sobre metas e gerenciamento, consulte as diretrizes publicadas, como as do Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC) do National High Blood Pressure Education Program.
Numerosos medicamentos anti-hipertensivos, de várias classes farmacológicas e com diferentes mecanismos de ação, têm demonstrado em ensaios clínicos randomizados reduzir a morbimortalidade cardiovascular, podendo-se concluir que é a redução da pressão arterial, e não alguma outra propriedade farmacológica do medicamento. os medicamentos, que é o grande responsável por esses benefícios. O maior e mais consistente benefício de resultado cardiovascular tem sido a redução do risco de acidente vascular cerebral, mas reduções no infarto do miocárdio e na mortalidade cardiovascular também foram observadas regularmente.
pressão sistólica ou diastólica elevada causa aumento do risco cardiovascular, e o aumento do risco absoluto por mmHg é maior em pressões sanguíneas mais altas, de modo que mesmo reduções modestas da hipertensão grave podem proporcionar benefícios substanciais. A redução do risco relativo da redução da pressão arterial é semelhante em populações com risco absoluto variável, portanto, o benefício absoluto é maior em pacientes que estão em maior risco independentemente de sua hipertensão (por exemplo, pacientes com diabetes ou hiperlipidemia), e esses pacientes seriam esperados beneficiar de um tratamento mais agressivo para uma meta de pressão arterial mais baixa.
Alguns medicamentos anti-hipertensivos têm efeitos menores na pressão arterial (como monoterapia) em pacientes negros, e muitos medicamentos anti-hipertensivos têm indicações e efeitos adicionais aprovados (por exemplo, na angina, insuficiência cardíaca ou doença renal diabética). Essas considerações podem orientar a seleção da terapia.
Pode ser usado sozinho ou em combinação com outros agentes anti-hipertensivos.
DOSAGEM E ADMINISTRAÇÃO
Hipertensão adulta
dosagem deve ser individualizada. A dose inicial habitualmente recomendada de Benicar 20mg é de 20mg uma vez ao dia quando usado como monoterapia em pacientes que não estão contraídos por volume. Para pacientes que necessitam de redução adicional da pressão arterial após 2 semanas de terapia, a dose de Benicar pode ser aumentada para 40 mg. Doses acima de 40 mg não parecem ter maior efeito. A dosagem duas vezes ao dia não oferece vantagem sobre a mesma dose total administrada uma vez ao dia.
Para pacientes com possível depleção do volume intravascular (p. AVISOS E PRECAUÇÕES ].
Hipertensão Pediátrica (6 anos de idade ou mais)
dosagem deve ser individualizada. Para crianças que podem engolir comprimidos, a dose inicial usualmente recomendada de Benicar é de 10 mg uma vez ao dia para pacientes que pesam 20 a
O uso de Benicar 10mg em crianças AVISOS E PRECAUÇÕES e Uso em populações específicas ].
Para crianças que não conseguem engolir comprimidos, a mesma dose pode ser administrada usando uma suspensão extemporânea conforme descrito abaixo [ver FARMACOLOGIA CLÍNICA ]. Siga as instruções de preparação da suspensão abaixo para administrar Benicar como suspensão.
Preparação da suspensão (para 200 mL de uma suspensão de 2 mg/mL)
Adicione 50 mL de Água Purificada a um frasco âmbar de polietileno tereftalato (PET) contendo vinte comprimidos de Benicar 20 mg e deixe em repouso por no mínimo 5 minutos. Agite o recipiente por pelo menos 1 minuto e deixe a suspensão repousar por pelo menos 1 minuto. Repita 1 minuto de agitação e 1 minuto em pé por mais quatro vezes. Adicione 100 mL de ORA-Sweet® e 50 mL de ORA-Plus®* à suspensão e agite bem por pelo menos 1 minuto. A suspensão deve ser refrigerada a 2-8°C (36-46°F) e pode ser armazenada por até 4 semanas. Agite bem a suspensão antes de cada uso e retorne imediatamente à geladeira.
COMO FORNECIDO
Formas de dosagem e pontos fortes
- Comprimidos de 5 mg, redondos, amarelos, revestidos por película, sem ranhuras, gravados com Sankyo de um lado e C12 do outro lado
- 20 mg comprimidos brancos, redondos, revestidos por película, sem ranhuras, gravados com Sankyo numa das faces e C14 na outra face
- 40 mg comprimidos brancos, ovais, revestidos por película, sem ranhuras, gravados com Sankyo numa das faces e C15 na outra face
Armazenamento e manuseio
Benicar é fornecido na forma de comprimidos amarelos, redondos, revestidos por película, sem ranhura, contendo 5 mg de olmesartana medoxomila, como comprimidos brancos, redondos, revestidos por película, sem ranhura, contendo 20 mg de olmesartana medoxomila, e como comprimidos brancos, ovais. , comprimidos revestidos por película, sem ranhuras, contendo 40 mg de olmesartan medoxomilo. Os comprimidos são gravados com Sankyo de um lado e C12, C14 ou C15 do outro lado dos comprimidos de 5, 20 e 40 mg, respectivamente.
Os comprimidos são fornecidos da seguinte forma:
Armazenar
Armazenar a 20-25°C (68-77°F) [consulte Temperatura ambiente controlada pela USP].
Fabricado para Daiichi Sankyo, Inc., Basking Ridge, NJ 07920. Revisado: outubro de 2019
EFEITOS COLATERAIS
Experiência de Ensaios Clínicos
Como os estudos clínicos são conduzidos em condições muito variadas, as taxas de reações adversas observadas nos estudos clínicos de um medicamento não podem ser comparadas diretamente com as taxas nos estudos clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
Hipertensão adulta
Benicar foi avaliado quanto à segurança em mais de 3.825 pacientes/indivíduos, incluindo mais de 3.275 pacientes tratados para hipertensão em estudos controlados. Esta experiência incluiu cerca de 900 pacientes tratados por pelo menos 6 meses e mais de 525 por pelo menos 1 ano. Os eventos geralmente foram leves, transitórios e não tiveram relação com a dose de Benicar.
A análise dos grupos de sexo, idade e raça não demonstrou diferenças entre Benicar 40mg e pacientes tratados com placebo. A taxa de retiradas devido a reações adversas em todos os ensaios de pacientes hipertensos foi de 2,4% (ou seja, 79/3278) dos pacientes tratados com Benicar 40mg e 2,7% (ou seja, 32/1179) dos pacientes de controle. Em estudos controlados com placebo, a única reação adversa que ocorreu em mais de 1% dos pacientes tratados com Benicar 20mg e com maior incidência em relação ao placebo foi tontura (3% vs. 1%).
Edema facial foi relatado em cinco pacientes que receberam Benicar. Angioedema foi relatado com antagonistas da angiotensina II.
Hipertensão Pediátrica
Não foram identificadas diferenças relevantes entre o perfil de experiências adversas para pacientes pediátricos de 1 a 16 anos e o relatado anteriormente para pacientes adultos.
Experiência pós-marketing
As seguintes reações adversas foram relatadas na experiência pós-comercialização. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento.
Corpo como um todo: Astenia, angioedema, reações anafiláticas
Gastrointestinal: Vômitos, enteropatia tipo espru [ver AVISOS E PRECAUÇÕES ]
Distúrbios metabólicos e nutricionais: Hipercalemia
Musculoesquelético: Rabdomiólise
Sistema Urogenital: Insuficiência renal aguda, aumento dos níveis de creatinina no sangue
Pele e anexos: Alopecia, prurido, urticária
Dados de um estudo controlado e de um estudo epidemiológico sugeriram que altas doses de olmesartana podem aumentar o risco cardiovascular (CV) em pacientes diabéticos, mas os dados gerais não são conclusivos. O estudo randomizado, controlado por placebo e duplo-cego ROADMAP (Randomized Olmesartan And Diabetes MicroAlbuminuria Prevention trial, n=4447) examinou o uso de olmesartan, 40 mg por dia, versus placebo em pacientes com diabetes mellitus tipo 2, normoalbuminúria e em menos um fator de risco adicional para doença CV. O estudo atingiu seu desfecho primário, atraso no início da microalbuminúria, mas a olmesartana não teve efeito benéfico no declínio da taxa de filtração glomerular (TFG). Houve um achado de aumento da mortalidade CV (morte cardíaca súbita julgada, infarto do miocárdio fatal, acidente vascular cerebral fatal, morte por revascularização) no grupo olmesartana em comparação com o grupo placebo (15 olmesartana versus 3 placebo, HR 4,9, intervalo de confiança de 95% [CI ], 1,4, 17), mas o risco de infarto do miocárdio não fatal foi menor com olmesartana (HR 0,64, IC 95% 0,35, 1,18).
estudo epidemiológico incluiu pacientes com 65 anos ou mais com exposição global > 300.000 pacientes-ano. No subgrupo de pacientes diabéticos que receberam altas doses de olmesartana (40 mg/d) por > 6 meses, parecia haver um risco aumentado de morte (HR 2,0, IC 95% 1,1, 3,8) em comparação com pacientes semelhantes tomando outros bloqueadores dos receptores da angiotensina. Em contraste, o uso de altas doses de olmesartana em pacientes não diabéticos pareceu estar associado a uma diminuição do risco de morte (HR 0,46, IC 95% 0,24, 0,86) em comparação com pacientes semelhantes tomando outros bloqueadores dos receptores da angiotensina. Não foram observadas diferenças entre os grupos que receberam doses mais baixas de olmesartana em comparação com outros bloqueadores da angiotensina ou aqueles que receberam terapia por
No geral, esses dados levantam a preocupação de um possível aumento do risco CV associado ao uso de altas doses de olmesartana em pacientes diabéticos. Há, no entanto, preocupações com a credibilidade do achado de risco CV aumentado, notadamente a observação no grande estudo epidemiológico para um benefício de sobrevida em não diabéticos de magnitude semelhante ao achado adverso em diabéticos.
INTERAÇÕES MEDICAMENTOSAS
Agentes que aumentam o potássio sérico
O uso concomitante de olmesartana com outros agentes que bloqueiam o sistema renina-angiotensina, diuréticos poupadores de potássio (p. levar ao aumento do potássio sérico. Se a co-medicação for considerada necessária, é aconselhável a monitorização do potássio sérico.
Agentes anti-inflamatórios não esteroides, incluindo inibidores seletivos de ciclooxigenase-2 (inibidores de COX-2)
Em pacientes idosos, com depleção de volume (incluindo aqueles em terapia diurética) ou com função renal comprometida, a coadministração de AINEs, incluindo inibidores seletivos da COX-2, com antagonistas dos receptores da angiotensina II, incluindo olmesartana medoxomila, pode resultar em deterioração da função renal, incluindo possível insuficiência renal aguda. Estes efeitos são geralmente reversíveis. Monitorar a função renal periodicamente em pacientes recebendo terapia com olmesartana medoxomila e AINEs.
O efeito anti-hipertensivo dos antagonistas do receptor da angiotensina II, incluindo olmesartana medoxomila, pode ser atenuado por AINEs, incluindo inibidores seletivos da COX-2.
Duplo bloqueio do sistema renina-angiotensina (RAS)
bloqueio duplo do SRA com bloqueadores dos receptores da angiotensina, inibidores da ECA ou alisquireno está associado a riscos aumentados de hipotensão, hipercalemia e alterações na função renal (incluindo insuficiência renal aguda) em comparação com a monoterapia. A maioria dos pacientes que recebem a combinação de dois inibidores do RAS não obtém nenhum benefício adicional em comparação com a monoterapia. Em geral, evite o uso combinado de inibidores do RAS. Monitore de perto a pressão arterial, a função renal e os eletrólitos em pacientes em uso de Benicar e outros agentes que afetam o SRA.
Não coadministre alisquireno com Benicar em pacientes com diabetes [ver CONTRA-INDICAÇÕES ]. Evitar o uso de alisquireno com Benicar 40mg em pacientes com insuficiência renal (TFG
Lítio
Aumentos nas concentrações séricas de lítio e toxicidade do lítio foram relatados durante a administração concomitante de lítio com antagonistas dos receptores da angiotensina II, incluindo BENICAR. Monitorar os níveis séricos de lítio durante o uso concomitante.
Cloridrato de Colesevelam
administração concomitante do agente sequestrante de ácidos biliares cloridrato de colesevelam reduz a exposição sistêmica e a concentração plasmática máxima de olmesartana. A administração de olmesartana pelo menos 4 horas antes do cloridrato de colessevelam diminuiu o efeito da interação medicamentosa. Considere administrar olmesartana pelo menos 4 horas antes da dose de cloridrato de colesevelam [ver FARMACOLOGIA CLÍNICA ].
AVISOS
Incluído como parte do "PRECAUÇÕES" Seção
PRECAUÇÕES
Toxicidade Fetal
Benicar 10mg pode causar dano fetal quando administrado a uma mulher grávida. O uso de medicamentos que atuam no sistema renina-angiotensina (SRA) durante o segundo e terceiro trimestres de gestação reduz a função renal fetal e aumenta a morbidade e morte fetal e neonatal. O oligoidrâmnio resultante pode estar associado a hipoplasia pulmonar fetal e deformações esqueléticas. Os potenciais efeitos adversos neonatais incluem hipoplasia do crânio, anúria, hipotensão, insuficiência renal e morte. Quando a gravidez for detectada, interrompa o Benicar assim que possível [ver Uso em populações específicas ].
Morbidade em bebês
uso de Benicar em crianças Uso em populações específicas ].
Hipotensão em pacientes com depleção de volume ou sal
Em pacientes com um sistema renina-angiotensina-aldosterona ativado, como pacientes com depleção de volume e/ou sal (por exemplo, aqueles que estão sendo tratados com altas doses de diuréticos), hipotensão sintomática pode ser antecipada após o início do tratamento com Benicar. Inicie o tratamento sob rigorosa supervisão médica e considere iniciar com uma dose mais baixa. Se ocorrer hipotensão, coloque o paciente em decúbito dorsal e, se necessário, administre uma infusão intravenosa de solução salina normal [ver DOSAGEM E ADMINISTRAÇÃO ]. Uma resposta hipotensiva transitória não é uma contraindicação para tratamento adicional, que geralmente pode ser continuado sem dificuldade uma vez que a pressão arterial esteja estabilizada.
Função Renal Prejudicada
Como consequência da inibição do sistema renina-angiotensina-aldosterona, podem ser antecipadas alterações na função renal em indivíduos susceptíveis tratados com Benicar. Em pacientes cuja função renal pode depender da atividade do sistema renina-angiotensinaldosterona (p. e raramente com insuficiência renal aguda e/ou morte. Resultados semelhantes podem ser esperados em pacientes tratados com Benicar [ver DOSAGEM E ADMINISTRAÇÃO , INTERAÇÕES MEDICAMENTOSAS , Uso em populações específicas e FARMACOLOGIA CLÍNICA ].
Em estudos de inibidores da ECA em pacientes com estenose unilateral ou bilateral da artéria renal, foram relatados aumentos na creatinina sérica ou nitrogênio ureico no sangue (BUN). Não houve uso prolongado de Benicar em pacientes com estenose unilateral ou bilateral da artéria renal, mas resultados semelhantes podem ser esperados.
Enteropatia tipo Sprue
Diarreia crônica grave com perda de peso substancial foi relatada em pacientes que tomaram olmesartana meses a anos após o início do medicamento. Biópsias intestinais de pacientes frequentemente demonstraram atrofia das vilosidades. Se um paciente desenvolver esses sintomas durante o tratamento com olmesartana, exclua outras etiologias. Considerar terapia anti-hipertensiva alternativa nos casos em que nenhuma outra etiologia for identificada.
Hipercalemia
O potássio sérico deve ser monitorado em pacientes recebendo Benicar. Drogas que inibem o sistema renina angiotensina podem causar hipercalemia. Os fatores de risco para o desenvolvimento de hipercalemia incluem insuficiência renal, diabetes mellitus e o uso concomitante de diuréticos poupadores de potássio, suplementos de potássio e/ou substitutos do sal contendo potássio [ver INTERAÇÕES MEDICAMENTOSAS ].
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Olmesartan medoxomilo não foi carcinogénico quando administrado por via dietética a ratos até 2 anos. A dose mais elevada testada (2000 mg/kg/dia) foi, numa base de mg/m2, cerca de 480 vezes a dose humana máxima recomendada (MRHD) de 40 mg/dia. Dois estudos de carcinogenicidade realizados em camundongos, um estudo de gavagem de 6 meses no camundongo knockout p53 e um estudo de administração dietética de 6 meses no camundongo transgênico Hras2, em doses de até 1000 mg/kg/dia (cerca de 120 vezes o MRHD) , não revelou evidência de efeito carcinogênico do olmesartana medoxomila.
Tanto o olmesartan medoxomilo como o olmesartan apresentaram resultados negativos no ensaio in vitro de transformação de células embrionárias de hamster sírio e não mostraram evidência de toxicidade genética no teste de Ames (mutagenicidade bacteriana). No entanto, ambos mostraram induzir aberrações cromossômicas em células cultivadas in vitro (pulmão de hamster chinês) e testaram positivo para mutações da timidina quinase no ensaio de linfoma de camundongo in vitro. O olmesartan medoxomilo apresentou resultados negativos in vivo para mutações no intestino e rim de MutaMouse e para clastogenicidade na medula óssea do rato (teste do micronúcleo) em doses orais até 2000 mg/kg (olmesartan não testado).
A fertilidade de ratos não foi afetada pela administração de olmesartana medoxomila em níveis de dose tão altos quanto 1.000 mg/kg/dia (240 vezes a MRHD) em um estudo em que a dosagem foi iniciada 2 (fêmeas) ou 9 (machos) semanas antes do acasalamento.
Uso em populações específicas
Gravidez
Resumo do risco
Benicar 10mg pode causar dano fetal quando administrado a uma mulher grávida. O uso de drogas que atuam no sistema renina-angiotensina durante o segundo e terceiro trimestres de gestação reduz a função renal fetal e aumenta a morbidade e morte fetal e neonatal. A maioria dos estudos epidemiológicos examinando anormalidades fetais após exposição ao uso de anti-hipertensivos no primeiro trimestre não distinguiu drogas que afetam o sistema renina-angiotensina de outros agentes anti-hipertensivos. Em estudos de reprodução em animais, o tratamento com Benicar durante a organogénese resultou num aumento da toxicidade embriofetal em ratos com doses inferiores às doses maternas tóxicas.
Quando a gravidez for detectada, interrompa Benicar o mais rápido possível. Considerar terapia anti-hipertensiva alternativa durante a gravidez.
risco de fundo estimado de defeitos congênitos graves e aborto espontâneo para a população indicada é desconhecido. Todas as gestações têm um risco histórico de defeitos congênitos, perda ou outros resultados adversos. Na população geral dos EUA, o risco de fundo estimado de defeitos congênitos graves e aborto espontâneo em gestações clinicamente reconhecidas é de 2%–4% e 15%–20%, respectivamente.
Considerações Clínicas
Risco Materno e/ou Embrio/Fetal Associado à Doença
A hipertensão na gravidez aumenta o risco materno de pré-eclâmpsia, diabetes gestacional, parto prematuro e complicações no parto (por exemplo, necessidade de cesariana e hemorragia pós-parto). A hipertensão aumenta o risco fetal de restrição de crescimento intrauterino e morte intrauterina. Mulheres grávidas com hipertensão devem ser cuidadosamente monitoradas e tratadas adequadamente.
Reações Adversas Fetais/Neonatais
Oligoidrâmnio em mulheres grávidas que usam drogas que afetam o sistema renina-angiotensina no segundo e terceiro trimestres de gravidez pode resultar no seguinte: redução da função renal fetal levando a anúria e insuficiência renal, hipoplasia pulmonar fetal, deformações esqueléticas, incluindo hipoplasia do crânio, hipotensão e morte. Em pacientes em uso de Benicar 20mg durante a gravidez, realizar exames ultrassonográficos seriados para avaliar o ambiente intra-amniótico. O teste fetal pode ser apropriado, com base na semana de gestação. Pacientes e médicos devem estar cientes, entretanto, de que o oligoidrâmnio pode não aparecer até que o feto tenha sofrido lesão irreversível.
Observar de perto bebês com história de exposição in utero a Benicar 40mg para hipotensão, oligúria e hipercalemia. Em recém-nascidos com história de exposição in utero a Benicar, se ocorrer oligúria ou hipotensão, utilizar medidas para manter a pressão arterial e a perfusão renal adequadas. Transfusões de troca ou diálise podem ser necessárias como meio de reverter a hipotensão e apoiar a função renal.
Dados
Dados de animais
Não foram observados efeitos teratogénicos quando o olmesartan medoxomilo foi administrado a ratas grávidas em doses orais até 1000 mg/kg/dia (240 vezes a dose humana máxima recomendada (MRHD) numa base de mg/m2) ou coelhas grávidas em doses orais até 1 mg/kg/dia (metade da MRHD na base de mg/m2; doses mais altas não puderam ser avaliadas quanto aos efeitos no desenvolvimento fetal, pois eram letais para as fêmeas). Em ratos, foram observadas diminuições significativas no peso ao nascimento e ganho de peso dos filhotes com doses ≥1,6 mg/kg/dia, e atrasos nos marcos de desenvolvimento (retardo na separação das aurículas, erupção dos incisivos inferiores, aparecimento de pelos abdominais, descida dos testículos, e separação das pálpebras) e aumentos dose-dependentes na incidência de dilatação da pelve renal foram observados em doses ≥ 8 mg/kg/dia. A dose de efeito não observada para toxicidade no desenvolvimento em ratos é de 0,3 mg/kg/dia, cerca de um décimo da MRHD de 40 mg/dia.
Lactação
Resumo do risco
Não há informações sobre a presença de olmesartana no leite humano, os efeitos no lactente ou os efeitos na produção de leite. A olmesartana é secretada em baixa concentração no leite de ratas lactantes (ver Dados ). Devido ao potencial de efeitos adversos no lactente, deve-se decidir entre descontinuar a amamentação ou descontinuar o medicamento, levando em consideração a importância do medicamento para a mãe.
Dados
A presença de olmesartana no leite foi observada após uma administração oral única de 5 mg/kg [14C] de olmesartana medoxomila em ratas lactantes.
Uso Pediátrico
Os efeitos anti-hipertensivos de Benicar foram avaliados em um estudo clínico randomizado, duplo-cego em pacientes pediátricos de 1 a 16 anos de idade [ver Estudos clínicos ]. A farmacocinética de Benicar foi avaliada em pacientes pediátricos de 1 a 16 anos de idade [ver FARMACOLOGIA CLÍNICA ]. Benicar 10mg foi geralmente bem tolerado em pacientes pediátricos, e o perfil de reações adversas foi semelhante ao descrito para adultos.
Benicar 20mg não demonstrou ser eficaz para hipertensão em crianças
O uso de Benicar em crianças AVISOS E PRECAUÇÕES ]. O sistema renina-angiotensina-aldosterona (SRAA) desempenha um papel crítico no desenvolvimento renal. O bloqueio do SRAA mostrou levar ao desenvolvimento anormal do rim em camundongos muito jovens. A administração de drogas que atuam diretamente no sistema reninangiotensina aldosterona (SRAA) pode alterar o desenvolvimento renal normal.
Uso Geriátrico
Do número total de pacientes hipertensos que receberam Benicar em estudos clínicos, mais de 20% tinham 65 anos de idade ou mais, enquanto mais de 5% tinham 75 anos de idade ou mais. Não foram observadas diferenças globais na eficácia ou segurança entre pacientes idosos e pacientes mais jovens. Outras experiências clínicas relatadas não identificaram diferenças nas respostas entre idosos e pacientes mais jovens, mas a maior sensibilidade de alguns indivíduos mais velhos não pode ser descartada [ver FARMACOLOGIA CLÍNICA ].
Insuficiência hepática
Aumentos na AUC0-∞ e Cmax foram observados em pacientes com insuficiência hepática moderada em comparação com aqueles em controles pareados, com um aumento na AUC de cerca de 60%. Nenhum ajuste de dose inicial é recomendado para pacientes com disfunção hepática moderada a acentuada [ver FARMACOLOGIA CLÍNICA ].
Insuficiência renal
Pacientes com insuficiência renal apresentam concentrações séricas elevadas de olmesartana em comparação com indivíduos com função renal normal. Após administração repetida, a AUC foi aproximadamente triplicada em pacientes com insuficiência renal grave (clearance de creatinina DOSAGEM E ADMINISTRAÇÃO , AVISOS E PRECAUÇÕES e FARMACOLOGIA CLÍNICA ].
Pacientes negros
O efeito anti-hipertensivo de Benicar 10mg foi menor em pacientes negros (geralmente uma população com baixa renina), como foi observado com inibidores da ECA, betabloqueadores e outros bloqueadores dos receptores da angiotensina.
SOBREDOSAGEM
Dados limitados estão disponíveis relacionados à superdosagem em humanos. As manifestações mais prováveis de superdosagem seriam hipotensão e taquicardia; bradicardia pode ser encontrada se ocorrer estimulação parassimpática (vagal). Se ocorrer hipotensão sintomática, iniciar tratamento de suporte. A dialisabilidade do olmesartan é desconhecida.
CONTRA-INDICAÇÕES
Não coadministre alisquireno com Benicar 20mg em pacientes com diabetes [ver INTERAÇÕES MEDICAMENTOSAS ].
FARMACOLOGIA CLÍNICA
Mecanismo de ação
angiotensina II é formada a partir da angiotensina I em uma reação catalisada pela enzima conversora de angiotensina (ECA, cininase II). A angiotensina II é o principal agente pressor do sistema renina-angiotensina, com efeitos que incluem vasoconstrição, estimulação da síntese e liberação de aldosterona, estimulação cardíaca e reabsorção renal de sódio. A olmesartana bloqueia os efeitos vasoconstritores da angiotensina II bloqueando seletivamente a ligação da angiotensina II ao receptor AT1 no músculo liso vascular. Sua ação é, portanto, independente das vias de síntese da angiotensina II.
Um receptor AT2 também é encontrado em muitos tecidos, mas não se sabe que este receptor esteja associado à homeostase cardiovascular. Olmesartan tem uma afinidade mais de 12.500 vezes maior para o receptor AT1 do que para o receptor AT2.
bloqueio do sistema renina-angiotensina com inibidores da ECA, que inibem a biossíntese da angiotensina II a partir da angiotensina I, é um mecanismo de muitos medicamentos usados no tratamento da hipertensão. Os inibidores da ECA também inibem a degradação da bradicinina, reação também catalisada pela ECA. Como a olmesartana medoxomila não inibe a ECA (cininase II), ela não afeta a resposta à bradicinina. Ainda não se sabe se essa diferença tem relevância clínica.
O bloqueio do receptor da angiotensina II inibe o feedback regulatório negativo da angiotensina II sobre a secreção de renina, mas o aumento da atividade da renina plasmática resultante e os níveis circulantes de angiotensina II não superam o efeito do olmesartana na pressão arterial.
Farmacodinâmica
Doses de Benicar de 2,5 mg a 40 mg inibem os efeitos pressores da infusão de angiotensina I. A duração do efeito inibitório foi relacionada à dose, com doses de Benicar > 40 mg dando > 90% de inibição em 24 horas.
As concentrações plasmáticas de angiotensina I e angiotensina II e a atividade da renina plasmática (PRA) aumentam após administração única e repetida de Benicar 10mg a indivíduos saudáveis e pacientes hipertensos. A administração repetida de até 80 mg de Benicar teve influência mínima nos níveis de aldosterona e nenhum efeito no potássio sérico.
Farmacocinética
Absorção
A olmesartana medoxomila é rápida e completamente bioativada por hidrólise do éster em olmesartana durante a absorção pelo trato gastrointestinal.
Os comprimidos de Benicar e a formulação de suspensão preparada a partir de comprimidos de Benicar são bioequivalentes [ver DOSAGEM E ADMINISTRAÇÃO ].
A biodisponibilidade absoluta do olmesartan é de aproximadamente 26%. Após administração oral, a concentração plasmática máxima (Cmax) de olmesartana é atingida após 1 a 2 horas. Os alimentos não afetam a biodisponibilidade do olmesartan. Benicar pode ser administrado com ou sem alimentos.
Distribuição
volume de distribuição do olmesartan é de aproximadamente 17 L. O olmesartan liga-se fortemente às proteínas plasmáticas (99%) e não penetra nos glóbulos vermelhos. A ligação às proteínas é constante em concentrações plasmáticas de olmesartana bem acima da faixa alcançada com as doses recomendadas.
Em ratos, o olmesartan cruzou mal a barreira hematoencefálica, se é que atravessou. Olmesartan atravessou a barreira placentária em ratos e foi distribuído para o feto. Olmesartan foi distribuído ao leite em níveis baixos em ratos.
Metabolismo e Excreção
Após a conversão rápida e completa de olmesartana medoxomila em olmesartana durante a absorção, praticamente não há mais metabolismo de olmesartana. A depuração plasmática total de olmesartana é de 1,3 L/h, com uma depuração renal de 0,6 L/h. Aproximadamente 35% a 50% da dose absorvida é recuperada na urina, enquanto o restante é eliminado nas fezes pela bile.
olmesartana parece ser eliminada de maneira bifásica com meia-vida de eliminação terminal de aproximadamente 13 horas. A olmesartana apresenta farmacocinética linear após doses orais únicas de até 320 mg e doses orais múltiplas de até 80 mg. Os níveis de estado estacionário de olmesartana são alcançados em 3 a 5 dias e não ocorre acúmulo no plasma com a administração de uma vez ao dia.
Populações Específicas
Pacientes Geriátricos
A farmacocinética do olmesartan foi estudada em idosos (≥65 anos). No geral, as concentrações plasmáticas máximas de olmesartana foram semelhantes em adultos jovens e idosos. A acumulação modesta de olmesartan foi observada em idosos com doses repetidas; AUCss, τ foi 33% maior em pacientes idosos, correspondendo a uma redução de aproximadamente 30% na CLR [ver DOSAGEM E ADMINISTRAÇÃO e Uso em populações específicas ].
Pacientes pediátricos
A farmacocinética da olmesartana foi estudada em pacientes pediátricos hipertensos com idades entre 1 e 16 anos. A depuração de olmesartana em pacientes pediátricos foi semelhante à de pacientes adultos quando ajustada pelo peso corporal [ver Uso em populações específicas ].
farmacocinética da olmesartana não foi investigada em pacientes pediátricos com menos de 1 ano de idade [ver AVISOS E PRECAUÇÕES e Uso em populações específicas ].
Pacientes Masculinos e Femininos
Foram observadas pequenas diferenças na farmacocinética do olmesartan nas mulheres em comparação com os homens. A AUC e Cmax foram 10-15% mais elevadas nas mulheres do que nos homens.
Pacientes com Insuficiência Hepática
Aumentos na AUC0-∞ e Cmax foram observados em pacientes com insuficiência hepática moderada em comparação com aqueles em controles pareados, com um aumento na AUC de cerca de 60% [ver DOSAGEM E ADMINISTRAÇÃO e Uso em populações específicas ].
Pacientes com Insuficiência Renal
Em pacientes com insuficiência renal, as concentrações séricas de olmesartana foram elevadas em comparação com indivíduos com função renal normal. Após administração repetida, a AUC foi aproximadamente triplicada em pacientes com insuficiência renal grave (clearance de creatinina DOSAGEM E ADMINISTRAÇÃO , AVISOS E PRECAUÇÕES e Uso em populações específicas ].
Estudos de interação medicamentosa
Agente sequestrante de ácidos biliares Colesevelam
administração concomitante de 40 mg de olmesartana medoxomila e 3.750 mg de cloridrato de colessevelam em indivíduos saudáveis resultou em redução de 28% na Cmax e redução de 39% na AUC de olmesartana. Efeitos menores, redução de 4% e 15% na Cmax e AUC, respectivamente, foram observados quando olmesartana medoxomila foi administrada 4 horas antes do cloridrato de colessevelam [ver INTERAÇÕES MEDICAMENTOSAS ].
Outros estudos
Não foram relatadas interações medicamentosas significativas em estudos nos quais olmesartana medoxomila foi coadministrada com digoxina ou varfarina em voluntários saudáveis.
A biodisponibilidade do olmesartan não foi significativamente alterada pela coadministração de antiácidos [Al(OH)3/Mg(OH)2].
Olmesartan medoxomilo não é metabolizado pelo sistema do citocromo P450 e não tem efeitos nas enzimas P450; assim, não são esperadas interações com drogas que inibem, induzem ou são metabolizadas por essas enzimas.
Estudos clínicos
Hipertensão adulta
Os efeitos anti-hipertensivos de Benicar 10 mg foram demonstrados em sete estudos controlados com placebo em doses variando de 2,5 mg a 80 mg por 6 a 12 semanas, cada um mostrando reduções estatisticamente significativas no pico e no vale da pressão arterial. Um total de 2.693 pacientes (2.145 Benicar; 548 placebo) com hipertensão essencial foram estudados. Benicar 40mg uma vez ao dia reduziu a pressão arterial diastólica e sistólica. A resposta foi relacionada à dose, conforme mostrado no gráfico a seguir. Uma dose de Benicar de 20 mg diários produz uma redução mínima da pressão arterial (PA) sentada em relação ao placebo de cerca de 10/6 mmHg e uma dose de 40 mg diários produz uma redução mínima da pressão arterial sentada em relação ao placebo de cerca de 12/7 mmHg. Doses de Benicar 10mg superiores a 40mg tiveram pouco efeito adicional. O início do efeito anti-hipertensivo ocorreu em 1 semana e foi amplamente manifesto após 2 semanas.
Benicar 40mg Dose Response Redução da Pressão Arterial Ajustada por Placebo (mmHg) 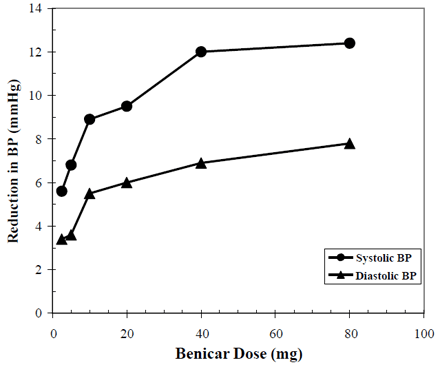
Os dados acima são de sete estudos controlados por placebo (2.145 pacientes com Benicar, 548 pacientes com placebo). O efeito de redução da pressão arterial foi mantido durante todo o período de 24 horas com Benicar uma vez ao dia, com razões de pico para resposta sistólica e diastólica entre 60 e 80%.
O efeito redutor da pressão arterial de Benicar 40mg, com e sem hidroclorotiazida, foi mantido em pacientes tratados por até 1 ano. Não houve evidência de taquifilaxia durante o tratamento prolongado com Benicar ou efeito rebote após a retirada abrupta de olmesartana medoxomila após 1 ano de tratamento.
O efeito anti-hipertensivo de Benicar foi semelhante em homens e mulheres e em pacientes com idade superior e inferior a 65 anos. O efeito foi menor em pacientes negros (geralmente uma população com baixo teor de renina), como foi observado com inibidores da ECA, betabloqueadores e outros bloqueadores dos receptores da angiotensina. Benicar teve um efeito adicional de redução da pressão arterial quando adicionado à hidroclorotiazida.
Não há estudos com Benicar demonstrando redução do risco cardiovascular em pacientes com hipertensão, mas pelo menos um medicamento farmacologicamente similar demonstrou tais benefícios.
Hipertensão Pediátrica
Os efeitos anti-hipertensivos de Benicar 40mg na população pediátrica foram avaliados em um estudo randomizado, duplo-cego, envolvendo 302 pacientes hipertensos com idades entre 6 e 16 anos. A população do estudo consistiu em uma coorte totalmente negra de 112 pacientes e uma coorte racial mista de 190 pacientes, incluindo 38 pacientes negros. A etiologia da hipertensão foi predominantemente hipertensão essencial (87% da coorte negra e 67% da coorte mista). Os pacientes que pesavam 20 a
No mesmo estudo, 59 pacientes de 1 a 5 anos que pesavam ≥5 kg receberam 0,3 mg/kg de Benicar 10 mg uma vez ao dia por três semanas em uma fase aberta e depois foram randomizados para receber Benicar ou placebo em um estudo duplo-cego. Estágio. Ao final da segunda semana de retirada, a pressão arterial sistólica/diastólica média no vale foi 3/3 mmHg menor no grupo randomizado para Benicar; essa diferença na pressão arterial não foi estatisticamente significativa (IC 95% -2 a 7/-1 a 7).
INFORMAÇÃO DO PACIENTE
Gravidez
Aconselhar as pacientes do sexo feminino em idade fértil sobre as consequências da exposição a Benicar 20mg durante a gravidez. Discuta as opções de tratamento com as mulheres que planejam engravidar. Diga às pacientes para relatar a gravidez a seus médicos o mais rápido possível [ver AVISOS E PRECAUÇÕES e Uso em populações específicas ].
Lactação
Aconselhe as mulheres que amamentam a não amamentar durante o tratamento com BENICAR [ver Uso em populações específicas ].
Hipercalemia
Aconselhe os pacientes a não usar suplementos de potássio ou substitutos do sal que contenham potássio sem consultar seu médico [ver INTERAÇÕES MEDICAMENTOSAS ].
