Pulmicort 100mcg, 200mcg Budesonide Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Pulmicort 100mcg Turbohaler e como é usado?
Pulmicort 100mcg Turbohaler é um medicamento de prescrição usado para tratar os sintomas da asma. Pulmicort 100mcg Turbohaler pode ser usado sozinho ou com outros medicamentos.
Pulmicort Turbohaler pertence a uma classe de medicamentos chamados Corticosteróides, Inalantes.
Não se sabe se Pulmicort Turbohaler é seguro e eficaz em crianças com menos de 1 ano de idade.
Quais são os possíveis efeitos colaterais do Pulmicort 200mcg Turbohaler?
Pulmicort 100mcg Turbohaler pode causar efeitos colaterais graves, incluindo:
- urticária,
- dificuldade para respirar,
- inchaço do rosto, lábios, língua ou garganta,
- cansaço incomum,
- problemas de visão,
- hematomas ou sangramentos fáceis,
- rosto inchado,
- crescimento incomum do cabelo,
- mudanca de humor,
- depressão,
- mudanças de humor,
- agitação,
- fraqueza ou dor muscular,
- afinamento da pele,
- cicatrização lenta e
- aumento da sede ou micção
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Pulmicort 100mcg Turbohaler incluem:
- garganta seca, irritada ou dolorida,
- rouquidão,
- mudanças de voz,
- gosto ruim na boca,
- nariz escorrendo ou entupido, e
- hemorragias nasais
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Pulmicort Turbohaler. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
Apenas para inalação oral.
DESCRIÇÃO
Budesonida, o componente ativo de PULMICORT TURBUHALER (budesonida) 200 mcg, é um corticosteroide designado quimicamente como (RS)-11β, 16α, 17,21-Tetrahidroxipregna-1,4-dieno-3,20-diona cíclico 16,17- acetal com butiraldeído. A budesonida é fornecida como uma mistura de dois epímeros (22R e 22S). A fórmula empírica da budesonida é C25H34O6 e seu peso molecular é 430,5. Sua fórmula estrutural é:
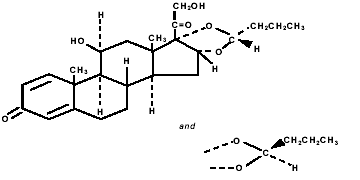
A budesonida é um pó branco a esbranquiçado, insípido e inodoro, praticamente insolúvel em água e heptano, pouco solúvel em etanol e livremente solúvel em clorofórmio. Seu coeficiente de partição entre octanol e água em pH 7,4 é 1,6 x 103.
PULMICORT 100mcg TURBUHALER (budesonida) é um inalador de pó seco multidose acionado por inalação que contém apenas budesonida micronizada. Cada acionamento de PULMICORT 100mcg TURBUHALER fornece 200 mcg de budesonida por dose medida, que libera aproximadamente 160 mcg de budesonida do bocal (com base em testes in vitro a 60 L/min por 2 segundos).
Testes in vitro mostraram que a administração da dose de PULMICORT 100mcg TURBUHALER (budesonida) é substancialmente dependente do fluxo de ar através do dispositivo. Fatores do paciente, como taxas de fluxo inspiratório, também afetarão a dose administrada aos pulmões de pacientes em uso real (consulte Instruções de uso do paciente ). Em pacientes adultos com asma (VEF1 médio 2,9 L [0,8 - 5,1 L]), o pico de fluxo inspiratório (PIF) médio através de PULMICORT TURBUHALER (budesonida) foi de 78 (40-111) L/min. Resultados semelhantes (PIF médio 82 [43-125] L/min) foram obtidos em crianças asmáticas (6 a 15 anos, VEF1 médio 2,1 L [0,9 - 5,4 L]). Os pacientes devem ser cuidadosamente instruídos sobre o uso deste medicamento para garantir a distribuição ideal da dose.
INDICAÇÕES
PULMICORT TURBUHALER (budesonida) é indicado para o tratamento de manutenção da asma como terapia profilática em pacientes adultos e pediátricos com seis anos de idade ou mais. Também é indicado para pacientes que necessitam de corticoterapia oral para asma. Muitos desses pacientes podem reduzir ou eliminar a necessidade de corticosteroides orais ao longo do tempo.
PULMICORT 100mcg TURBUHALER (budesonida) NÃO é indicado para o alívio do broncoespasmo agudo.
DOSAGEM E ADMINISTRAÇÃO
PULMICORT 200mcg TURBUHALER (budesonida) deve ser administrado por via oral inalatória em pacientes asmáticos com idade igual ou superior a 6 anos. Pacientes individuais experimentarão um início variável e grau de alívio dos sintomas. Geralmente, PULMICORT TURBUHALER (budesonida) tem um início de ação relativamente rápido para um corticosteroide inalado. A melhora no controle da asma após a administração inalatória de PULMICORT 200mcg TURBUHALER (budesonida) pode ocorrer dentro de 24 horas após o início do tratamento, embora o benefício máximo possa não ser alcançado por 1 a 2 semanas ou mais. A segurança e eficácia de PULMICORT TURBUHALER (budesonida) quando administrado em excesso das doses recomendadas não foram estabelecidas.
A dose inicial recomendada e a dose mais alta recomendada de PULMICORT TURBUHALER (budesonida), com base na terapia anterior da asma, estão listadas na tabela a seguir.
*Em pacientes com asma leve a moderada que estão bem controlados com corticosteroides inalatórios, a dosagem de PULMICORT 100 mcg TURBUHALER (budesonida) 200 mcg ou 400 mcg uma vez ao dia pode ser considerada. PULMICORT 200mcg TURBUHALER (budesonida) pode ser administrado uma vez ao dia pela manhã ou à noite.
Se o tratamento uma vez ao dia com PULMICORT 200mcg TURBUHALER (budesonida) não fornecer controle adequado dos sintomas da asma, a dose diária total deve ser aumentada e/ou administrada em dose dividida.
Pacientes mantidos em corticosteróides orais crônicos
Inicialmente, PULMICORT TURBUHALER (budesonida) deve ser usado concomitantemente com a dose usual de manutenção de corticosteroide sistêmico do paciente. Após aproximadamente uma semana, inicia-se a retirada gradual do corticosteroide sistêmico, reduzindo a dose diária ou diária alternada. A próxima redução é feita após um intervalo de uma ou duas semanas, dependendo da resposta do paciente. Geralmente, esses decréscimos não devem exceder 2,5 mg de prednisona ou seu equivalente. Uma taxa lenta de retirada é fortemente recomendada. Durante a redução de corticosteroides orais, os pacientes devem ser cuidadosamente monitorados quanto à instabilidade da asma, incluindo medidas objetivas da função das vias aéreas e à insuficiência adrenal (ver AVISOS ). Durante a retirada, alguns pacientes podem apresentar sintomas de retirada sistêmica de corticosteróides, por exemplo, dores articulares e/ou musculares, cansaço e depressão, apesar da manutenção ou mesmo melhora da função pulmonar. Esses pacientes devem ser encorajados a continuar com PULMICORT TURBUHALER (budesonida), mas devem ser monitorados quanto a sinais objetivos de insuficiência adrenal. Se ocorrer evidência de insuficiência adrenal, as doses sistêmicas de corticosteroides devem ser aumentadas temporariamente e, posteriormente, a retirada deve continuar mais lentamente. Durante períodos de estresse ou crise de asma grave, os pacientes transferidos podem necessitar de tratamento suplementar com corticosteróides sistêmicos.
NOTA: Em todos os pacientes, é desejável titular a dose efetiva mais baixa assim que a estabilidade da asma for alcançada.
Instruções de uso
Instruções ilustradas do paciente para Uso acompanham cada embalagem de PULMICORT 200mcg TURBUHALER (budesonida).
Os pacientes devem ser instruídos a preparar PULMICORT TURBUHALER (budesonida) antes de seu uso inicial e instruídos a inalar profunda e vigorosamente cada vez que a unidade for usada. Enxaguar a boca após a inalação também é recomendado.
COMO FORNECIDO
O PULMICORT TURBUHALER (budesonida) consiste em uma série de detalhes plásticos montados, sendo as partes principais o mecanismo de dosagem, a unidade de armazenamento da substância do medicamento e o bocal. O inalador é protegido por uma tampa tubular externa branca aparafusada no inalador. O corpo do inalador é branco e a alça giratória é marrom. O texto a seguir está impresso na alça em letras em relevo, “Pulmicort™ 200 mcg”. O inalador TURBUHALER não pode ser reabastecido e deve ser descartado quando estiver vazio.
PULMICORT TURBUHALER (budesonida) está disponível como 200 mcg/dose, 200 doses (NDC 0186-0915-42) e tem um peso de preenchimento alvo de 104 mg.
Quando houver 20 doses restantes em PULMICORT 200mcg TURBUHALER (budesonida), uma marca vermelha aparecerá na janela do indicador. Se a unidade for usada além do ponto em que a marca vermelha aparece na parte inferior da janela, a quantidade correta de medicamento pode não ser obtida. A unidade deve ser descartada.
Armazene com a tampa apertada em local seco em temperatura ambiente controlada de 20-25°C (68-77°F) [consulte USP]. Manter fora do alcance das crianças.
Todas as marcas registradas são propriedade do grupo de empresas AstraZeneca. ©AstraZeneca 2001, 2006. Fabricado para: AstraZeneca LP, Wilmington, DE 19850 Por: AstraZeneca AB, Sodertalje, Suécia 33020-00. Rev. 10/06. Data de revisão da FDA: 20/08/2007
EFEITOS COLATERAIS
As seguintes reações adversas foram relatadas em pacientes tratados com PULMICORT 100mcg TURBUHALER (budesonida).
incidência de eventos adversos comuns é baseada em ensaios clínicos duplo-cegos controlados por placebo nos EUA, nos quais 1.116 pacientes adultos e pediátricos com idades entre 6 e 70 anos (472 mulheres e 644 homens) foram tratados com PULMICORT TURBUHALER (budesonida) (200 a 800 mcg duas vezes ao dia por 12 a 20 semanas) ou placebo.
A tabela a seguir mostra a incidência de eventos adversos em pacientes que receberam previamente broncodilatadores e/ou corticosteroides inalatórios em estudos clínicos controlados nos EUA. Essa população incluiu 232 pacientes pediátricos do sexo masculino e 62 do sexo feminino (6 a 17 anos) e 332 pacientes adultos do sexo masculino e 331 do sexo feminino (18 anos ou mais).
Eventos Adversos com Incidência ≥ 3% relatados por Pacientes em PULMICORT 100mcg TURBUHALER (budesonida)
tabela acima inclui todos os eventos (sejam considerados relacionados ao medicamento ou não relacionados ao medicamento pelos investigadores) que ocorreram a uma taxa ≥3% em qualquer grupo de PULMICORT TURBUHALER (budesonida) e foram mais comuns do que no grupo placebo. Ao considerar esses dados, o aumento da duração média da exposição para pacientes com PULMICORT 200mcg TURBUHALER (budesonida) deve ser levado em consideração.
Os seguintes outros eventos adversos ocorreram nesses ensaios clínicos usando PULMICORT 100mcg TURBUHALER (budesonida) com incidência de 1 a 3% e foram mais comuns com PULMICORT 200mcg TURBUHALER (budesonida) do que com placebo.
Corpo como um todo: dor de pescoço
Cardiovascular: síncope
Digestivo: dor abdominal, boca seca, vômitos
Metabólico e Nutricional: ganho de peso
Musculoesquelético: fratura, mialgia
Nervoso: hipertonia, enxaqueca
Plaquetas, Sangramento e Coagulação: equimose
Psiquiátrico: insônia
Mecanismos de Resistência: infecção
Sentidos Especiais: perversão do gosto
Em um estudo de 20 semanas em asmáticos adultos que anteriormente necessitaram de corticosteroides orais, os efeitos de PULMICORT TURBUHALER (budesonida) 400 mcg duas vezes ao dia (N=53) e 800 mcg duas vezes ao dia (N=53) foram comparados com placebo (N=53). ) sobre a frequência de eventos adversos relatados. Os eventos adversos, considerados pelos pesquisadores ou não relacionados ao medicamento, relatados em mais de cinco pacientes no grupo PULMICORT 200mcg TURBUHALER (budesonida) e que ocorreram com mais frequência com PULMICORT TURBUHALER (budesonida) do que com placebo são mostrados abaixo ( % PULMICORT TURBUHALER (budesonida) e % placebo). Ao considerar esses dados, deve-se levar em consideração o aumento da duração média da exposição para pacientes com PULMICORT 200mcg TURBUHALER (budesonida) (78 dias para PULMICORT TURBUHALER (budesonida) versus 41 dias para placebo).
Pacientes que recebem PULMICORT TURBUHALER (budesonida) uma vez ao dia
perfil de eventos adversos da administração uma vez ao dia de PULMICORT 100mcg TURBUHALER (budesonida) 200 mcg e 400 mcg, e placebo, foi avaliado em 309 pacientes adultos asmáticos em um estudo de 18 semanas. A população do estudo incluiu tanto pacientes previamente tratados com corticosteróides inalatórios, quanto pacientes que não receberam terapia com corticosteróides previamente. Não houve diferença clinicamente relevante no padrão de eventos adversos após a administração de PULMICORT 200mcg TURBUHALER (budesonida) uma vez ao dia em comparação com a administração de duas vezes ao dia.
Estudos Pediátricos: Em um estudo controlado por placebo de 12 semanas em 404 pacientes pediátricos de 6 a 18 anos de idade mantidos previamente com corticosteroides inalatórios, a frequência de eventos adversos para cada categoria de idade (6 a 12 anos, 13 a 18 anos) foi comparável para PULMICORT TURBUHALER (budesonida) (em 100, 200 e 400 mcg duas vezes ao dia) e placebo. Não houve diferenças clinicamente relevantes no padrão ou gravidade dos eventos adversos em crianças em comparação com aqueles relatados em adultos.
Relatórios de eventos adversos de outras fontes: Os eventos adversos raros relatados na literatura publicada ou na experiência de marketing mundial com qualquer formulação de budesonida inalada incluem: reações de hipersensibilidade imediatas e tardias, incluindo erupção cutânea, dermatite de contato, urticária, angioedema e broncoespasmo; sintomas de hipocorticismo e hipercorticismo; glaucoma, catarata; sintomas psiquiátricos, incluindo depressão, reações agressivas, irritabilidade, ansiedade e psicose.
INTERAÇÕES MEDICAMENTOSAS
Em estudos clínicos, a administração concomitante de budesonida e outros medicamentos comumente usados no tratamento da asma não resultou em aumento da frequência de eventos adversos. A principal via de metabolismo da budesonida, assim como de outros corticosteroides, é através da isoenzima 3A4 (CYP3A4) do citocromo P450 (CYP). Após a administração oral de cetoconazol, um potente inibidor do CYP3A4, a concentração plasmática média da budesonida administrada por via oral aumentou. A administração concomitante de outros inibidores conhecidos do CYP3A4 (por exemplo, itraconazol, claritromicina, eritromicina, etc.) pode inibir o metabolismo e aumentar a exposição sistêmica à budesonida. Deve-se ter cuidado quando a budesonida é coadministrada com cetoconazol de longa duração e outros inibidores de CYP3A4 conhecidos.
AVISOS
É necessário cuidado especial para pacientes que são transferidos de corticosteroides sistemicamente ativos para PULMICORT 200mcg TURBUHALER (budesonida) porque ocorreram mortes devido à insuficiência adrenal em pacientes asmáticos durante e após a transferência de corticosteroides sistêmicos para corticosteroides inalatórios menos disponíveis sistemicamente. Após a retirada dos corticosteroides sistêmicos, alguns meses são necessários para a recuperação da função hipotálamo-hipófise-adrenal (HPA).
Os pacientes que foram previamente mantidos com 20 mg ou mais por dia de prednisona (ou seu equivalente) podem ser mais suscetíveis, particularmente quando seus corticosteroides sistêmicos foram quase completamente retirados. Durante este período de supressão do HPA, os pacientes podem apresentar sinais e sintomas de insuficiência adrenal quando expostos a trauma, cirurgia ou infecção (particularmente gastroenterite) ou outras condições associadas à perda grave de eletrólitos. Embora PULMICORT TURBUHALER (budesonida) possa fornecer controle dos sintomas de asma durante esses episódios, nas doses recomendadas ele fornece quantidades fisiológicas de glicocorticóide sistemicamente inferiores ao normal e NÃO fornece a atividade mineralocorticóide necessária para lidar com essas emergências.
Durante períodos de estresse ou crise de asma grave, os pacientes que foram retirados de corticosteroides sistêmicos devem ser instruídos a retomar os corticosteroides orais (em grandes doses) imediatamente e a entrar em contato com seus médicos para mais instruções. Esses pacientes também devem ser instruídos a portar um cartão de identificação médica indicando que podem precisar de corticosteroides sistêmicos suplementares durante períodos de estresse ou crise de asma grave.
Pacientes que necessitam de corticosteroides orais devem ser desmamados lentamente do uso de corticosteroides sistêmicos após a transferência para PULMICORT 100mcg TURBUHALER (budesonida). A função pulmonar (VEF1 ou AM PEF), uso de beta-agonistas e sintomas de asma devem ser cuidadosamente monitorados durante a retirada de corticosteroides orais. Além de monitorar os sinais e sintomas da asma, os pacientes devem ser observados quanto a sinais e sintomas de insuficiência adrenal, como fadiga, lassidão, fraqueza, náuseas e vômitos e hipotensão.
transferência de pacientes da terapia com corticosteroides sistêmicos para PULMICORT 200mcg TURBUHALER (budesonida) pode desmascarar condições alérgicas previamente suprimidas pela terapia com corticosteroides sistêmicos, por exemplo, rinite, conjuntivite, artrite, condições eosinofílicas e eczema (consulte DOSAGEM E ADMINISTRAÇÃO ).
Pacientes que tomam medicamentos que suprimem o sistema imunológico são mais suscetíveis à infecção do que indivíduos saudáveis. A catapora e o sarampo, por exemplo, podem ter um curso mais grave ou mesmo fatal em pacientes pediátricos suscetíveis ou adultos em doses imunossupressoras de corticosteroides. Em pacientes pediátricos ou adultos que não tiveram essas doenças, deve-se tomar cuidado especial para evitar a exposição. Não se sabe como a dose, a via e a duração da administração de corticosteroides afetam o risco de desenvolver uma infecção disseminada. A contribuição da doença subjacente e/ou tratamento prévio com corticosteroides para o risco também não é conhecida. Se exposto, a terapia com imunoglobulina contra varicela zoster (VZIG) ou imunoglobulina intravenosa combinada (IVIG), conforme apropriado, pode ser indicada. Se exposto ao sarampo, a profilaxia com imunoglobulina intramuscular (IG) combinada pode ser indicada. (Consulte as respectivas bulas para obter informações completas sobre a prescrição de VZIG e IG.) Se a catapora se desenvolver, o tratamento com agentes antivirais pode ser considerado.
PULMICORT 200mcg TURBUHALER (budesonida) não é um broncodilatador e não é indicado para alívio rápido de broncoespasmo ou outros episódios agudos de asma.
Tal como acontece com outros medicamentos para asma inalados, pode ocorrer broncoespasmo, com aumento imediato da sibilância, após a administração. Se ocorrer broncoespasmo após a administração de PULMICORT TURBUHALER (budesonida), ele deve ser tratado imediatamente com um broncodilatador inalatório de ação rápida. O tratamento com PULMICORT TURBUHALER (budesonida) deve ser descontinuado e uma terapia alternativa instituída.
Os pacientes devem ser instruídos a contatar seu médico imediatamente quando ocorrerem episódios de asma que não respondem às suas doses usuais de broncodilatadores durante o tratamento com PULMICORT TURBUHALER (budesonida). Durante esses episódios, os pacientes podem necessitar de terapia com corticosteroides orais.
PRECAUÇÕES
Em geral
Durante a retirada de corticosteroides orais, alguns pacientes podem apresentar sintomas de retirada de corticosteroides sistemicamente ativos, por exemplo, dores articulares e/ou musculares, cansaço e depressão, apesar da manutenção ou mesmo melhora da função respiratória (ver DOSAGEM E ADMINISTRAÇÃO ).
Em pacientes responsivos, PULMICORT TURBUHALER (budesonida) pode permitir o controle dos sintomas da asma com menor supressão da função do eixo HPA do que doses orais terapeuticamente equivalentes de prednisona. Como a budesonida é absorvida na circulação e pode ser sistemicamente ativa, os efeitos benéficos de PULMICORT 100mcg TURBUHALER (budesonida) na minimização da disfunção do HPA podem ser esperados apenas quando as dosagens recomendadas não são excedidas e os pacientes individuais são titulados para a dose eficaz mais baixa. Como existe sensibilidade individual aos efeitos sobre a produção de cortisol, os médicos devem considerar essa informação ao prescrever PULMICORT 100mcg TURBUHALER (budesonida).
Devido à possibilidade de absorção sistêmica de corticosteróides inalatórios, os pacientes tratados com PULMICORT 200mcg TURBUHALER (budesonida) devem ser observados cuidadosamente quanto a qualquer evidência de efeitos sistêmicos de corticosteróides. Cuidado especial deve ser tomado ao observar pacientes no pós-operatório ou durante períodos de estresse para evidência de resposta adrenal inadequada.
É possível que efeitos sistêmicos dos corticosteróides, como hipercorticismo, redução da densidade mineral óssea e supressão adrenal, possam aparecer em um pequeno número de pacientes, particularmente em doses mais altas. Se tais alterações ocorrerem, PULMICORT 100mcg TURBUHALER (budesonida) deve ser reduzido lentamente, de acordo com os procedimentos aceitos para o tratamento dos sintomas da asma e para redução gradual dos esteróides sistêmicos.
Corticosteróides inalados por via oral, incluindo budesonida, podem causar redução na velocidade de crescimento quando administrados a pacientes pediátricos. A redução da velocidade de crescimento pode ocorrer em decorrência do controle inadequado da asma ou do uso de corticosteróides para o tratamento. Os efeitos potenciais do tratamento prolongado na velocidade de crescimento devem ser ponderados em relação aos benefícios clínicos obtidos e os riscos associados às terapias alternativas. Para minimizar os efeitos sistêmicos dos corticosteróides inalados por via oral, incluindo PULMICORT 200mcg TURBUHALER (budesonida), cada paciente deve ser titulado para sua menor dose eficaz (ver PRECAUÇÕES, Uso Pediátrico ).
Embora os pacientes em ensaios clínicos tenham recebido PULMICORT TURBUHALER (budesonida) de forma contínua por períodos de 1 a 2 anos, os efeitos locais e sistêmicos a longo prazo de PULMICORT 200mcg TURBUHALER (budesonida) em seres humanos não são completamente conhecidos. Em particular, os efeitos resultantes do uso crônico de PULMICORT TURBUHALER (budesonida) em processos de desenvolvimento ou imunológicos na boca, faringe, traqueia e pulmão são desconhecidos.
Em ensaios clínicos com PULMICORT TURBUHALER (budesonida), infecções localizadas por Candida albicans ocorreram na boca e faringe em alguns pacientes. Essas infecções podem exigir tratamento com terapia antifúngica apropriada e/ou interrupção do tratamento com PULMICORT TURBUHALER (budesonida).
Os corticosteroides inalatórios devem ser usados com cautela, se for o caso, em pacientes com infecção ativa ou quiescente por tuberculose do trato respiratório, infecções sistêmicas fúngicas, bacterianas, virais ou parasitárias não tratadas ou herpes simples ocular.
Raros casos de glaucoma, aumento da pressão intraocular e catarata foram relatados após a administração inalatória de corticosteroides.
Informações para Pacientes
Pacientes em tratamento com PULMICORT TURBUHALER (budesonida) devem receber as seguintes informações e instruções. Esta informação destina-se a auxiliar o paciente no uso seguro e eficaz do medicamento. Não é uma divulgação de todos os possíveis efeitos adversos ou pretendidos. Para o uso adequado de PULMICORT 200mcg TURBUHALER (budesonida) e para obter a melhora máxima, o paciente deve ler e seguir as instruções Instruções do paciente para uso com cuidado.
- Os pacientes devem usar PULMICORT 200mcg TURBUHALER (budesonida) em intervalos regulares, conforme indicado, pois sua eficácia depende do uso regular. O paciente não deve alterar a dosagem prescrita a menos que seja aconselhado pelo médico.
- Os pacientes devem ser informados de que PULMICORT 100mcg TURBUHALER (budesonida) não é um broncodilatador e não se destina a tratar episódios agudos ou de asma com risco de vida.
- Os pacientes devem ser informados de que a eficácia de PULMICORT 100mcg TURBUHALER (budesonida) depende do uso adequado do dispositivo e da técnica de administração por inalação:
- 1. O PULMICORT TURBUHALER (budesonida) deve estar na posição vertical (bocal na parte superior) durante o carregamento para fornecer a dose correta.
- 2. PULMICORT 100mcg TURBUHALER (budesonida) deve ser preparado quando a unidade for usada pela primeira vez. Para escorvar a unidade, ela deve ser mantida na posição vertical e a alça marrom girada totalmente para a direita e, em seguida, girada totalmente para a esquerda até ouvir um clique. Repetir.
- 3. Para carregar a primeira dose, a alça deve ser girada totalmente para a direita e totalmente para a esquerda até ouvir um clique.
- 4. Após a primeira dose, não é necessário preparar a unidade. No entanto, ele deve ser carregado na posição vertical imediatamente antes do uso, conforme descrito acima.
- 5. Os pacientes devem ser aconselhados a não agitar o inalador.
- Os pacientes devem colocar o bocal entre os lábios e inspirar com força e profundidade. O pó é então entregue aos pulmões.
- Os pacientes não devem expirar através do PULMICORT TURBUHALER (budesonida) .
- Devido ao pequeno volume de pó, o paciente pode não provar ou sentir a presença de qualquer medicamento entrando nos pulmões ao inalar do inalador TURBUHALER. Essa falta de sensação não indica que o paciente não esteja recebendo benefícios de PULMICORT TURBUHALER (budesonida) .
- Os pacientes devem ser avisados de que enxaguar a boca com água sem engolir após cada administração pode diminuir o risco de desenvolvimento de candidíase oral.
- Os pacientes devem ser instruídos de que receberão uma nova unidade de PULMICORT TURBUHALER (budesonida) cada vez que reabastecerem sua prescrição. Os pacientes devem ser aconselhados a descartar todo o dispositivo após o número rotulado de inalações ter sido usado. Quando houver 20 doses restantes em PULMICORT TURBUHALER (budesonida), uma marca vermelha aparecerá na janela do indicador.
- PULMICORT TURBUHALER (budesonida) não deve ser usado com espaçador.
- O bocal não deve ser mordido ou mastigado.
- tampa deve ser recolocada com segurança após cada abertura.
- Os pacientes devem manter PULMICORT TURBUHALER (budesonida) sempre limpo e seco.
- Os pacientes devem ser informados de que a melhora no controle da asma após a inalação de PULMICORT TURBUHALER (budesonida) pode ocorrer dentro de 24 horas após o início do tratamento, embora o benefício máximo possa não ser alcançado por 1 a 2 semanas ou mais. Se os sintomas não melhorarem nesse período, ou se a condição piorar, o paciente deve ser instruído a não aumentar a dosagem, mas a entrar em contato com o médico.
- Os pacientes cujos corticosteróides sistêmicos foram reduzidos ou retirados devem ser instruídos a carregar um cartão de advertência indicando que podem precisar de corticosteróides sistêmicos suplementares durante períodos de estresse ou um ataque de asma que não responde aos broncodilatadores.
- Os pacientes devem ser aconselhados a não interromper o uso de PULMICORT TURBUHALER (budesonida) abruptamente.
- Os pacientes devem ser alertados para evitar a exposição à catapora ou sarampo e, se forem expostos, consultar seus médicos sem demora.
- O uso prolongado de corticosteróides inalados, incluindo budesonida, pode aumentar o risco de alguns problemas oculares (catarata ou glaucoma). Exames oftalmológicos regulares devem ser considerados.
- As mulheres que consideram o uso de PULMICORT TURBUHALER (budesonida) devem consultar seu médico se estiverem grávidas ou pretenderem engravidar, ou se estiverem amamentando um bebê.
- Os pacientes que consideram o uso de PULMICORT TURBUHALER (budesonida) devem consultar seu médico se forem alérgicos à budesonida ou a qualquer outro corticosteróide inalado por via oral.
- Os pacientes devem informar seu médico sobre outros medicamentos que estejam tomando, pois PULMICORT 100mcg TURBUHALER (budesonida) pode não ser adequado em algumas circunstâncias e o médico pode desejar usar um medicamento diferente.
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Estudos de longo prazo foram conduzidos em ratos e camundongos usando administração oral para avaliar o potencial carcinogênico da budesonida.
Em um estudo oral de 104 semanas em ratos Sprague-Dawley, um aumento estatisticamente significativo na incidência de gliomas foi observado em ratos machos recebendo uma dose oral de 50 mcg/kg/dia (menos do que a dose diária máxima recomendada por inalação em adultos e crianças numa base de mcg/m2). Nenhuma tumorigenicidade foi observada em ratos machos e fêmeas em doses orais respectivas de até 25 e 50 mcg/kg (menos do que a dose inalatória diária máxima recomendada em adultos e crianças com base em mcg/m2). Em dois estudos adicionais de dois anos em ratos machos Fischer e Sprague-Dawley, a budesonida não causou gliomas em uma dose oral de 50 mcg/kg (menos do que a dose diária máxima recomendada por inalação em adultos e crianças com base em mcg/m2). No entanto, nos ratos machos Sprague-Dawley, a budesonida causou um aumento estatisticamente significativo na incidência de tumores hepatocelulares em uma dose oral de 50 mcg/kg (menos do que a dose inalatória diária máxima recomendada em adultos e crianças na base de mcg/m2 ). Os corticosteroides de referência concomitantes (prednisona e acetonido de triancinolona) nesses dois estudos mostraram achados semelhantes.
Não houve evidência de efeito carcinogênico quando a budesonida foi administrada por via oral por 91 semanas a camundongos em doses de até 200 mcg/kg/dia (menos do que a dose diária máxima recomendada para inalação em adultos e crianças na base de mcg/m2).
A budesonida não foi mutagênica ou clastogênica em seis sistemas de teste diferentes: teste de Ames Salmonella/microssoma placa, teste de micronúcleo de camundongo, teste de linfoma de camundongo, teste de aberração cromossômica em linfócitos humanos, teste letal recessivo ligado ao sexo em Drosophila melanogaster e análise de reparo de DNA em rato cultura de hepatócitos.
Em ratos, a budesonida não teve efeito sobre a fertilidade em doses subcutâneas de até 80 mcg/kg (menos do que a dose máxima recomendada para inalação humana diária com base em mcg/m2).
20 mcg/kg/dia (menos do que a dose inalatória humana diária máxima recomendada em uma base de mcg/m2), foram observadas diminuições no ganho de peso corporal materno, viabilidade pré-natal e viabilidade dos filhotes ao nascimento e durante a lactação. Nenhum desses efeitos foi observado com 5 mcg/kg (menos do que a dose máxima recomendada para inalação humana diária em adultos com base em mcg/m2).
Gravidez: Efeitos Teratogênicos
Gravidez Categoria B: Assim como com outros glicocorticóides, a budesonida produziu perda fetal, diminuição do peso dos filhotes e anormalidades esqueléticas em doses subcutâneas de 25 mcg/kg/dia em coelhos (menos do que a dose máxima diária recomendada para inalação humana em uma base de mcg/m2) e 500 mcg/kg/dia em ratos (aproximadamente 3 vezes a dose máxima recomendada para inalação humana diária com base em mcg/m2).
Não foram observados efeitos teratogênicos ou embriocidas em ratos quando a budesonida foi administrada por inalação em doses de até 250 mcg/kg/dia (equivalente à dose máxima recomendada por inalação humana diária com base em mcg/m2).
A experiência com corticosteróides orais desde a sua introdução em doses farmacológicas em oposição às fisiológicas sugere que os roedores são mais propensos aos efeitos teratogênicos dos corticosteróides do que os humanos.
Estudos em mulheres grávidas, no entanto, não demonstraram que PULMICORT TURBUHALER (budesonida) aumenta o risco de anormalidades quando administrado durante a gravidez. Os resultados de um grande estudo epidemiológico de coorte prospectivo de base populacional revisando dados de três registros suecos cobrindo aproximadamente 99% das gestações de 1995-1997 (ou seja, Registro Médico Sueco de Nascimento; Registro de Malformações Congênitas; Registro de Cardiologia Infantil) não indicam risco aumentado para malformações congênitas decorrentes do uso de budesonida inalatória durante o início da gravidez. As malformações congênitas foram estudadas em 2.014 bebês nascidos de mães que relataram o uso de budesonida inalatória para asma no início da gravidez (geralmente 10-12 semanas após a última menstruação), período em que ocorre a maioria das malformações de órgãos importantes. A taxa de malformações congênitas registradas foi semelhante em comparação com a taxa da população geral (3,8% vs. 3,5%, respectivamente). Além disso, após a exposição à budesonida inalatória, o número de bebês nascidos com fissuras orofaciais foi semelhante ao número esperado na população normal (4 crianças vs. 3,3, respectivamente).
Esses mesmos dados foram utilizados em um segundo estudo, totalizando 2.534 lactentes cujas mães foram expostas à budesonida inalatória. Neste estudo, a taxa de malformações congênitas entre os bebês cujas mães foram expostas à budesonida inalatória no início da gravidez não foi diferente da taxa de todos os recém-nascidos durante o mesmo período (3,6%).
Apesar das descobertas em animais, parece que a possibilidade de dano fetal é remota se a droga for usada durante a gravidez. No entanto, como os estudos em humanos não podem descartar a possibilidade de danos, PULMICORT TURBUHALER (budesonida) deve ser usado durante a gravidez somente se claramente necessário.

Efeitos não teratogênicos
O hipoadrenalismo pode ocorrer em bebês nascidos de mães que receberam corticosteroides durante a gravidez. Esses bebês devem ser cuidadosamente observados.
Mães que amamentam
Os corticosteróides são secretados no leite humano. Devido ao potencial de reações adversas em lactentes de qualquer corticosteróide, deve-se decidir entre descontinuar a amamentação ou descontinuar o medicamento, levando em consideração a importância do medicamento para a mãe. Faltam dados reais para budesonida.
Uso Pediátrico
A segurança e eficácia de PULMICORT 100mcg TURBUHALER (budesonida) em pacientes pediátricos com menos de 6 anos de idade não foram estabelecidas.
Em pacientes pediátricos com asma, a frequência de eventos adversos observados com PULMICORT 100mcg TURBUHALER (budesonida) foi semelhante entre a faixa etária de 6 a 12 anos (N=172) em comparação com a faixa etária de 13 a 17 anos (N=124) .
Estudos clínicos controlados mostraram que os corticosteróides inalados por via oral podem causar uma redução na velocidade de crescimento em pacientes pediátricos. Esse efeito foi observado na ausência de evidência laboratorial de supressão do eixo hipotálamo-hipófise-adrenal (HPA), sugerindo que a velocidade de crescimento é um indicador mais sensível de exposição sistêmica a corticosteróides em pacientes pediátricos do que alguns testes comumente usados da função do eixo HPA. Os efeitos a longo prazo dessa redução na velocidade de crescimento associada aos corticosteróides inalados por via oral, incluindo o impacto na altura final do adulto, são desconhecidos. O potencial de “recuperação” do crescimento após a descontinuação do tratamento com corticosteroides inalados por via oral não foi adequadamente estudado.
Em um estudo com crianças asmáticas de 5 a 12 anos de idade, aquelas tratadas com PULMICORT 200mcg TURBUHALER (budesonida) 200 mcg duas vezes ao dia (n=311) tiveram uma redução de 1,1 centímetro no crescimento em comparação com aquelas que receberam placebo (n=418) em o final de um ano; a diferença entre estes dois grupos de tratamento não aumentou mais ao longo de três anos de tratamento adicional. Ao final de quatro anos, as crianças tratadas com PULMICORT TURBUHALER (budesonida) e as crianças tratadas com placebo apresentaram velocidades de crescimento semelhantes. As conclusões extraídas deste estudo podem ser confundidas pelo uso desigual de corticosteróides nos grupos de tratamento e inclusão de dados de pacientes que atingiram a puberdade durante o curso do estudo.
crescimento de pacientes pediátricos recebendo corticosteroides inalatórios por via oral, incluindo PULMICORT TURBUHALER (budesonida), deve ser monitorado rotineiramente (por exemplo, por meio de estadiometria). Os potenciais efeitos de crescimento do tratamento prolongado devem ser ponderados em relação aos benefícios clínicos obtidos e os riscos e benefícios associados às terapias alternativas. Para minimizar os efeitos sistêmicos dos corticosteroides inalatórios, incluindo PULMICORT 100mcg TURBUHALER (budesonida), cada paciente deve ser titulado para sua menor dose eficaz.
Uso Geriátrico
Cem pacientes com 65 anos ou mais foram incluídos nos ensaios clínicos controlados nos EUA e fora dos EUA de PULMICORT 100mcg TURBUHALER (budesonida) . Não houve diferenças na segurança e eficácia do medicamento em comparação com os observados em pacientes mais jovens.
Em geral, a seleção da dose para um paciente idoso deve ser cautelosa, geralmente começando no limite inferior da faixa de dosagem, refletindo a maior frequência de diminuição da função hepática, renal ou cardíaca e de doença concomitante ou outra terapia medicamentosa.
SOBREDOSAGEM
O potencial para efeitos tóxicos agudos após superdosagem de PULMICORT 100mcg TURBUHALER (budesonida) é baixo. Se usado em doses excessivas por períodos prolongados, podem ocorrer efeitos sistêmicos de corticosteroides, como hipercorticismo (ver PRECAUÇÕES ). PULMICORT TURBUHALER com o dobro da dose mais alta recomendada (3200 mcg diários) administrado por 6 semanas causou uma redução significativa (27%) na resposta do cortisol plasmático a uma infusão de 6 horas de ACTH em comparação com placebo (+1%). O efeito correspondente de 10 mg de prednisona diariamente foi uma redução de 35% na resposta do cortisol plasmático ao ACTH.
dose letal mínima por inalação em camundongos foi de 100 mg/kg (aproximadamente 320 vezes a dose inalatória diária máxima recomendada em adultos e aproximadamente 380 vezes a dose inalatória diária máxima recomendada em crianças com base em mcg/m2). Não houve mortes após a administração de uma dose inalatória de 68 mg/kg em ratos (aproximadamente 430 vezes a dose inalatória diária máxima recomendada em adultos e aproximadamente 510 vezes a dose inalatória diária máxima recomendada em crianças com base em mcg/m2). A dose oral letal mínima foi de 200 mg/kg em camundongos (aproximadamente 630 vezes a dose máxima diária recomendada para inalação em adultos e aproximadamente 750 vezes a dose máxima diária recomendada para inalação em crianças na base de mcg/m2) e inferior a 100 mg/kg em ratos (aproximadamente 630 vezes a dose inalatória diária máxima recomendada em adultos e aproximadamente 750 vezes a dose inalatória diária máxima recomendada em crianças com base em mcg/m2).
experiência pós-comercialização mostrou que os pacientes com overdose aguda de budesonida inalada geralmente permaneceram assintomáticos. O uso de doses excessivas (até 6.400 mcg diários) por períodos prolongados mostrou efeitos sistêmicos dos corticosteróides, como hipercorticismo.
CONTRA-INDICAÇÕES
PULMICORT TURBUHALER (budesonida) é contraindicado no tratamento primário do estado de mal asmático ou outros episódios agudos de asma onde são necessárias medidas intensivas.
A hipersensibilidade à budesonida contra-indica o uso de PULMICORT TURBUHALER (budesonida) .
FARMACOLOGIA CLÍNICA
Mecanismo de ação
budesonida é um corticosteróide anti-inflamatório que apresenta atividade glicocorticóide potente e atividade mineralocorticóide fraca. Em modelos in vitro e animais padrão, a budesonida tem aproximadamente uma afinidade 200 vezes maior para o receptor de glicocorticóides e uma potência anti-inflamatória tópica 1000 vezes maior do que o cortisol (ensaio de edema de orelha com óleo de cróton de rato). Como medida da atividade sistêmica, a budesonida é 40 vezes mais potente que o cortisol quando administrada por via subcutânea e 25 vezes mais potente quando administrada por via oral no ensaio de involução do timo de rato.
A atividade de PULMICORT 100mcg TURBUHALER deve-se ao fármaco original, budesonida. Em estudos de afinidade do receptor de glicocorticóides, a forma 22R foi duas vezes mais ativa que o epímero 22S. Estudos in vitro indicaram que as duas formas de budesonida não se interconvertem.
mecanismo preciso das ações dos corticosteróides na inflamação na asma não é conhecido. A inflamação é um componente importante na patogênese da asma. Os corticosteroides demonstraram ter uma ampla gama de atividades inibitórias contra vários tipos de células (por exemplo, mastócitos, eosinófilos, neutrófilos, macrófagos e linfócitos) e mediadores (por exemplo, histamina, eicosanóides, leucotrienos e citocinas) envolvidos em reações alérgicas e não -inflamação mediada por alergia. Essas ações anti-inflamatórias dos corticosteróides podem contribuir para sua eficácia na asma.
Estudos em pacientes asmáticos mostraram uma relação favorável entre a atividade anti-inflamatória tópica e os efeitos sistêmicos dos corticosteróides em uma ampla gama de doses de PULMICORT 200mcg TURBUHALER (budesonida) . Isso é explicado por uma combinação de um efeito anti-inflamatório local relativamente alto, extensa degradação hepática de primeira passagem da droga absorvida oralmente (85-95%) e a baixa potência dos metabólitos formados (veja abaixo).
Farmacocinética
Absorção:
Após a administração oral de budesonida, a concentração plasmática máxima foi alcançada em cerca de 1 a 2 horas e a disponibilidade sistêmica absoluta foi de 6-13%. Em contraste, a maior parte da budesonida entregue aos pulmões é absorvida sistemicamente. Em indivíduos saudáveis, 34% da dose medida foi depositada nos pulmões (conforme avaliado pelo método de concentração plasmática) com uma disponibilidade sistêmica absoluta de 39% da dose medida. A farmacocinética da budesonida não difere significativamente em voluntários saudáveis e pacientes asmáticos. As concentrações plasmáticas máximas de budesonida ocorreram dentro de 30 minutos após a inalação de PULMICORT 200mcg TURBUHALER.Em pacientes asmáticos, a budesonida mostrou um aumento linear na AUC e Cmax com o aumento da dose após uma dose única e doses repetidas de PULMICORT 200mcg TURBUHALER (budesonida).
Distribuição:
volume de distribuição da budesonida foi de aproximadamente 3 L/kg. Ligava-se 85-90% às proteínas plasmáticas. A ligação às proteínas foi constante ao longo da faixa de concentração (1-100 nmol/L) alcançada com e excedendo as doses recomendadas de PULMICORT TURBUHALER. A budesonida mostrou pouca ou nenhuma ligação à globulina de ligação aos corticosteróides. A budesonida equilibrou-se rapidamente com os glóbulos vermelhos de forma independente da concentração com uma relação sangue/plasma de cerca de 0,8.Metabolismo:
Estudos in vitro com homogeneizados de fígado humano mostraram que a budesonida é rápida e extensivamente metabolizada. Dois metabólitos principais formados via biotransformação catalisada pela isoenzima 3A4 (CYP3A4) do citocromo P450 (CYP) foram isolados e identificados como 16α-hidroxiprednisolona e 6β-hidroxibudesonida. A actividade corticosteróide de cada um destes dois metabolitos é inferior a 1% da do composto original. Não foram detectadas diferenças qualitativas entre os padrões metabólicos in vitro e in vivo. Inativação metabólica insignificante foi observada em preparações de soro e pulmão humano.Excreção/Eliminação:
forma 22R de budesonida foi preferencialmente eliminada pelo fígado com depuração sistêmica de 1,4 L/min vs. 1,0 L/min para a forma 22S. A meia-vida terminal, de 2 a 3 horas, foi a mesma para ambos os epímeros e independente da dose. A budesonida foi excretada na urina e nas fezes na forma de metabólitos. Aproximadamente 60% de uma dose intravenosa radiomarcada foi recuperada na urina. Nenhuma budesonida inalterada foi detectada na urina.Populações Especiais:
Não foram identificadas diferenças farmacocinéticas devido à raça, sexo ou idade avançada.Pediátrico:
Após administração intravenosa em pacientes pediátricos de 10 a 14 anos, a meia-vida plasmática foi menor do que em adultos (1,5 horas vs. 2,0 horas em adultos). Na mesma população após a inalação de budesonida através de um inalador pressurizado dosimetrado, a disponibilidade sistêmica absoluta foi semelhante à dos adultos.Insuficiência Hepática:
redução da função hepática pode afetar a eliminação dos corticosteroides. A farmacocinética da budesonida foi afetada pelo comprometimento da função hepática, evidenciado por uma disponibilidade sistêmica dobrada após a ingestão oral. A farmacocinética intravenosa da budesonida foi, no entanto, semelhante em pacientes cirróticos e em indivíduos saudáveis.Interações Medicamentosas:
O cetoconazol, um potente inibidor da isoenzima 3A4 do citocromo P450 (CYP) (CYP3A4), a principal enzima metabólica dos corticosteroides, aumentou os níveis plasmáticos de budesonida ingerida por via oral. Nas doses recomendadas, a cimetidina teve um efeito leve, mas clinicamente insignificante, na farmacocinética da budesonida oral.Farmacodinâmica
Para confirmar que a absorção sistêmica não é um fator significativo na eficácia clínica da budesonida inalatória, um estudo clínico em pacientes com asma foi realizado comparando 400 mcg de budesonida administrado por um inalador dosimetrado pressurizado com espaçador de tubo a 1400 mcg de budesonida oral e placebo. O estudo demonstrou a eficácia da budesonida inalada, mas não da budesonida ingerida por via oral, apesar de níveis sistêmicos comparáveis. Assim, o efeito terapêutico das doses convencionais de budesonida inalada por via oral é amplamente explicado por sua ação direta no trato respiratório.
Geralmente, PULMICORT TURBUHALER (budesonida) tem um início de ação relativamente rápido para um corticosteroide inalado. A melhora no controle da asma após a inalação de PULMICORT TURBUHALER (budesonida) pode ocorrer dentro de 24 horas após o início do tratamento, embora o benefício máximo possa não ser alcançado por 1 a 2 semanas ou mais.
PULMICORT TURBUHALER (budesonida) demonstrou diminuir a reatividade das vias aéreas em vários modelos de desafio, incluindo histamina, metacolina, metabissulfito de sódio e monofosfato de adenosina em pacientes com vias aéreas hiperreativas. A relevância clínica desses modelos não é certa.
O pré-tratamento com PULMICORT 200 mcg TURBUHALER (budesonida) 1600 mcg diariamente (800 mcg duas vezes ao dia) por 2 semanas reduziu a redução aguda (reação de fase inicial) e tardia (reação de fase tardia) no VEF1 após a provocação com alérgeno inalado.
Os efeitos de PULMICORT 200mcg TURBUHALER (budesonida) no eixo hipotálamo-hipófise-adrenal (HPA) foram estudados em 905 adultos e 404 pacientes pediátricos com asma. Para a maioria dos pacientes, a capacidade de aumentar a produção de cortisol em resposta ao estresse, avaliada pelo teste de estimulação com cosintropina (ACTH), permaneceu intacta com o tratamento com PULMICORT TURBUHALER (budesonida) nas doses recomendadas. Para pacientes adultos tratados com 100, 200, 400 ou 800 mcg duas vezes ao dia por 12 semanas, 4%, 2%, 6% e 13%, respectivamente, tiveram uma resposta anormal de cortisol estimulado (pico de cortisol
administração de budesonida via PULMICORT 200mcg TURBUHALER (budesonida) em doses de até 800 mcg/dia (dose média diária 445 mcg/dia) ou via inalador pressurizado dosimetrado em doses de até 1200 mcg/dia (dose média diária 620 mcg /dia) para 216 pacientes pediátricos (3 a 11 anos) por 2 a 6 anos não teve efeito significativo no crescimento estatural em comparação com a terapia sem corticosteróides em 62 pacientes controles pareados. No entanto, o efeito a longo prazo de PULMICORT TURBUHALER (budesonida) no crescimento não é totalmente conhecido.
Trilhas clínicas
A eficácia terapêutica de PULMICORT 100mcg TURBUHALER (budesonida) foi avaliada em ensaios clínicos controlados envolvendo mais de 1.300 pacientes (6 anos ou mais) com asma de duração variável da doença (20 anos) e gravidade.
Ensaios clínicos duplo-cegos, paralelos e controlados por placebo com duração de 12 semanas ou mais mostraram que, em comparação com placebo, PULMICORT TURBUHALER (budesonida) melhorou significativamente a função pulmonar (medida pelo PEF e VEF1), diminuiu significativamente os sintomas matinais e noturnos da asma e reduziu significativamente a necessidade de uso de β2-agonista inalado conforme necessário em doses de 400 mcg a 1600 mcg por dia (200 mcg a 800 mcg duas vezes ao dia) em adultos e 400 mcg a 800 mcg por dia (200 mcg a 400 mcg duas vezes ao dia) em pacientes pediátricos com 6 anos de idade ou mais.
A função pulmonar melhorada (PFE matinal) foi observada dentro de 24 horas após o início do tratamento em pacientes adultos e pediátricos com 6 anos de idade ou mais, embora o benefício máximo não tenha sido alcançado por 1 a 2 semanas ou mais após o início do tratamento. A função pulmonar melhorada foi mantida durante as 12 semanas da porção duplo-cega dos ensaios.
Pacientes que não recebem terapia com corticosteroides
Em um ensaio clínico de 12 semanas em 273 pacientes com asma leve a moderada (média basal de VEF1 2,27 L) que não foram bem controlados apenas com broncodilatadores, PULMICORT 200 mcg TURBUHALER (budesonida) foi avaliado em doses de 200 mcg duas vezes ao dia e 400 mcg duas vezes diariamente versus placebo. Os resultados do VEF1 deste estudo são mostrados na figura abaixo. A função pulmonar melhorou significativamente em ambas as doses de PULMICORT 100mcg TURBUHALER (budesonida) em comparação com placebo.
Um teste de 12 semanas em pacientes que não estão em terapia com corticosteroides antes da entrada no estudo
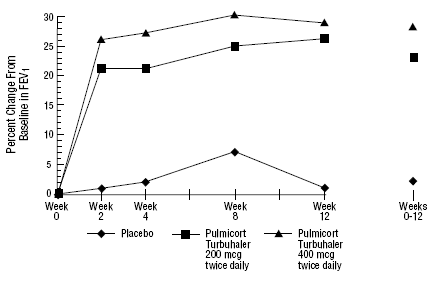
Em um estudo controlado de 12 meses em 75 pacientes que não receberam corticosteroides anteriormente, PULMICORT TURBUHALER (budesonida) a 200 mcg duas vezes ao dia resultou em melhora da função pulmonar (medida pelo PFE) e redução da hiperreatividade brônquica em comparação com placebo.
Pacientes previamente mantidos em corticosteróides inalatórios
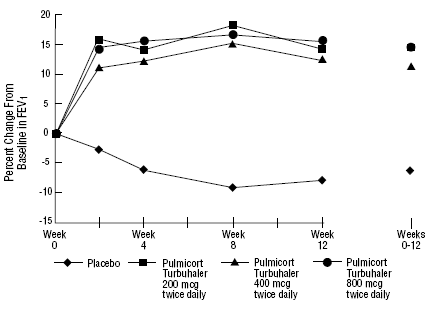
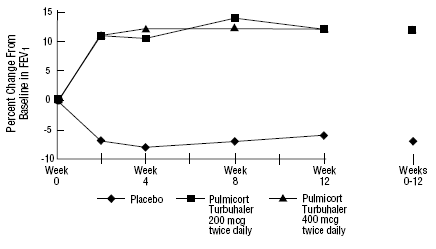
segurança e eficácia de PULMICORT 200mcg TURBUHALER (budesonida) também foi avaliada em pacientes adultos e pediátricos (6 a 18 anos) previamente mantidos com corticosteroides inalatórios (adultos: N=473, VEF1 basal médio 2,04 L, doses iniciais de dipropionato de beclometasona 126 -1008 mcg/dia; pediatria: N=404, VEF1 basal médio 2,09 L, doses basais de dipropionato de beclometasona 126-672 mcg/dia ou acetonido de triancinolona 300-1800 mcg/dia). Os resultados do VEF1 desses dois estudos, ambos com 12 semanas de duração, são apresentados nas figuras a seguir. A função pulmonar melhorou significativamente com todas as doses de PULMICORT TURBUHALER (budesonida) em comparação com placebo em ambos os estudos.
Pacientes adultos previamente mantidos com corticosteróides inalatórios
Pacientes pediátricos de 6 a 18 anos previamente mantidos em corticosteróides inalatórios
Pacientes que recebem PULMICORT TURBUHALER (budesonida) uma vez ao dia
eficácia e segurança da administração uma vez ao dia de PULMICORT 100mcg TURBUHALER (budesonida) 200 mcg e 400 mcg e placebo também foram avaliadas em 309 pacientes adultos asmáticos (VEF1 basal médio 2,7 L) em um estudo de 18 semanas. Em comparação com o placebo, os pacientes que receberam Pulmicort 200 ou 400 mcg uma vez ao dia apresentaram estabilidade da asma significativamente melhor avaliada pelo PEF e VEF1 durante um período inicial de tratamento de 6 semanas, que foi mantido com uma dose diária de 200 mcg nas 12 semanas subsequentes. Embora a população do estudo tenha incluído pacientes previamente tratados com corticosteróides inalatórios, bem como pacientes que não receberam terapia com corticosteróides anteriormente, os resultados mostraram que a administração de uma vez ao dia foi mais claramente eficaz para aqueles pacientes previamente mantidos com corticosteróides inalados por via oral (ver DOSAGEM E ADMINISTRAÇÃO ).
Pacientes previamente mantidos em corticosteróides orais
Em um ensaio clínico em 159 pacientes asmáticos graves que necessitavam de terapia crônica com prednisona oral (dose média basal de prednisona 19,3 mg/dia), PULMICORT TURBUHALER (budesonida) em doses de 400 mcg duas vezes ao dia e 800 mcg duas vezes ao dia foi comparado com placebo durante um período de 20 semanas período. Aproximadamente dois terços (68% com 400 mcg duas vezes ao dia e 64% com 800 mcg duas vezes ao dia) dos pacientes tratados com PULMICORT TURBUHALER (budesonida) foram capazes de alcançar a interrupção sustentada (pelo menos 2 semanas) do corticosteroide oral (comparado com 8% dos pacientes tratados com placebo) e melhor controle da asma. A dose média de corticosteroide oral foi reduzida em 83% com 400 mcg duas vezes ao dia e 79% com 800 mcg duas vezes ao dia para pacientes tratados com PULMICORT TURBUHALER (budesonida) versus 27% para placebo. Além disso, 58 dos 64 pacientes (91%) que eliminaram completamente os corticosteroides orais durante a fase duplo-cega do estudo permaneceram sem corticosteroides orais por mais 12 meses enquanto recebiam PULMICORT 200mcg TURBUHALER (budesonida).
INFORMAÇÃO DO PACIENTE
Instruções de uso do paciente
Por favor, leia atentamente este folheto antes de começar a tomar o medicamento. Fornece um resumo das informações sobre o seu medicamento. Seguir estas instruções ajuda a garantir que você está inalando o medicamento corretamente.
PARA MAIS INFORMAÇÕES PERGUNTE AO SEU MÉDICO OU FARMACÊUTICO.
O QUE VOCÊ DEVE SABER SOBRE PULMICORT TURBUHALER (budesonida)
Seu médico receitou PULMICORT TURBUHALER 200 mcg. Ele contém um medicamento chamado budesonida, que é um corticosteróide sintético. Os corticosteróides são substâncias naturais encontradas no corpo que ajudam a combater a inflamação. Eles são usados para tratar a asma porque reduzem o inchaço e a irritação nas paredes das pequenas passagens de ar nos pulmões e aliviam os problemas respiratórios. Quando inalados regularmente, os corticosteróides também ajudam a prevenir ataques de asma.
PULMICORT TURBUHALER (budesonida) trata a inflamação – a “parte silenciosa” da asma que você não pode ouvir, ver ou sentir. Quando a inflamação não é tratada, seus sintomas e ataques de asma podem aumentar. PULMICORT 200mcg TURBUHALER (budesonida) trabalha para prevenir e reduzir os sintomas e ataques de asma.
PONTOS IMPORTANTES PARA LEMBRAR SOBRE PULMICORT TURBUHALER (budesonida)
CERTIFIQUE-SE de que este medicamento é adequado para si (ver “ANTES DE UTILIZAR O SEU PULMICORT TURBUHALER (budesonida)”).
É importante que você inale cada dose conforme recomendado pelo seu médico.
Use o Turbohaler conforme indicado pelo seu médico. NÃO PARE O TRATAMENTO OU REDUZA A SUA DOSE MESMO QUE SE SINTA MELHOR, a menos que seja instruído a fazê-lo pelo seu médico.
NÃO FAÇA inale mais doses ou use o Turbohaler com mais frequência do que o indicado pelo seu médico.
Este medicamento é NÃO destina-se a proporcionar alívio rápido de suas dificuldades respiratórias durante um ataque de asma. Deve ser tomado em intervalos regulares, conforme recomendado pelo seu médico, e não como uma medida de emergência.
Seu médico pode prescrever medicamentos adicionais (como broncodilatadores) para alívio de emergência se uma crise aguda
Se você também usar outro medicamento por inalação, consulte seu médico para obter instruções sobre quando usá-lo em relação ao uso de seu PULMICORT 100mcg TURBUHALER (budesonida).
ANTES DE USAR SEU PULMICORT TURBUHALER (budesonida)
INFORME AO SEU MÉDICO ANTES DE COMEÇAR A TOMAR ESTE MEDICAMENTO SE VOCÊ:
- está grávida (ou pretende engravidar),
- está amamentando um bebê,
- são alérgicos à budesonida ou a qualquer outro corticosteróide inalado por via oral,
- tem alguma infecção,
- tem ou teve tuberculose,
- tem osteoporose,
- recentemente esteve perto de alguém com catapora ou sarampo,
- estão planejando fazer uma cirurgia,
- estiver a tomar um medicamento corticosteróide oral como a prednisona. Você pode ter que seguir instruções específicas para evitar riscos à saúde associados à interrupção do uso desses tipos de medicamentos.
Em algumas circunstâncias, este medicamento pode não ser adequado e o seu médico pode querer prescrever um medicamento diferente. Certifique-se de que seu médico saiba quais outros medicamentos você está tomando, incluindo medicamentos prescritos e não prescritos, bem como quaisquer vitaminas ou suplementos dietéticos e fitoterápicos.
QUAIS SÃO OS POSSÍVEIS EFEITOS COLATERAIS DO PULMICORT TURBUHALER (budesonida) ?
Como com todos os corticosteróides inalados, você deve estar ciente dos seguintes efeitos colaterais:
- Pieira aumentada logo após tomar PULMICORT 100mcg TURBUHALER (budesonida) . Tenha sempre consigo um medicamento broncodilatador de curta duração para tratar a sibilância súbita. Os medicamentos broncodilatadores de ação curta ajudam a relaxar os músculos ao redor das vias aéreas em seus pulmões. Chiado acontece quando os músculos ao redor das vias aéreas se contraem. Isso dificulta a respiração. Em casos graves, o chiado pode parar a respiração e causar a morte se não for tratado imediatamente.
- Efeitos no sistema imunológico e maior chance de infecções.
- Problemas oculares, incluindo glaucoma e catarata. Exames oftalmológicos devem ser considerados durante o uso de PULMICORT TURBUHALER (budesonida).
- O crescimento de uma criança deve ser verificado regularmente enquanto estiver tomando PULMICOR TURBUHALER devido ao potencial de crescimento lento.
Com base em ensaios clínicos, os efeitos colaterais mais comuns relatados por pacientes que usam PULMICORT 100mcg TURBUHALER (budesonida) são:
- infecção respiratória
- dor de cabeça
- sintomas da gripe
- dor de garganta
- sinusite
Estes não são todos os possíveis efeitos colaterais de PULMICORT TURBUHALER (budesonida). Para mais informações, pergunte ao seu médico, profissional de saúde ou farmacêutico.
UTILIZAÇÃO DO SEU PULMICORT TURBUHALER (budesonida)
- Siga as instruções indicadas na seção “COMO USAR SEU PULMICORT 200mcg TURBUHALER”. Se tiver algum problema, informe o seu médico ou farmacêutico.
- É importante que você inale cada dose conforme indicado pelo seu médico. O rótulo da farmácia geralmente informa qual dose tomar e com que frequência. Se isso não acontecer, ou se você não tiver certeza, pergunte ao seu médico ou farmacêutico.
DOSAGEM
- Use conforme indicado pelo seu médico.
- Isso é MUITO IMPORTANTE que você siga as instruções do seu médico sobre quantas inalações tomar e com que frequência usar seu PULMICORT TURBUHALER (budesonida).
- NÃO FAÇA inale mais doses ou use seu PULMICORT TURBUHALER (budesonida) com mais frequência do que seu médico aconselha.
- Pode levar de 1 a 2 semanas ou mais antes de você sentir a melhora máxima, então É MUITO IMPORTANTE USAR PULMICORT 100mcg TURBUHALER (budesonida) REGULARMENTE. NÃO PARE O TRATAMENTO OU REDUZA SUA DOSE MESMO QUE ESTEJA SE SENTINDO MELHOR, a menos que seja instruído a fazê-lo pelo seu médico.
- Se você perder uma dose, apenas tome a próxima dose programada regularmente quando for devido. NÃO DOBRAR a dose.
COMO USAR SEU PULMICORT TURBUHALER (budesonida)
Leia atentamente as instruções completas e use apenas conforme indicado.
INSTRUÇÕES DE PREPARAÇÃO:
Antes de usar um novo PULMICORT 200mcg TURBUHALER (budesonida) pela primeira vez, você deve prepará-lo. Para fazer isso, gire a tampa e levante. Segure o PULMICORT TURBUHALER (budesonida) na vertical (com o bocal para cima), depois gire a alça marrom totalmente para a direita e novamente para a esquerda. Repetir. Agora você está pronto para tomar sua primeira dose (veja as instruções para “TOMAR UMA DOSE”). Você não precisa prepará-lo em nenhum outro momento depois disso, mesmo que o deixe de lado por um período prolongado de tempo.
TOMAR UMA DOSE:
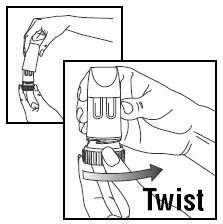
CARREGANDO UMA DOSE
- Gire a tampa e levante.
- Para fornecer a dose correta, PULMICORT TURBUHALER (budesonida) deve ser mantido na posição vertical (bocal para cima) sempre que uma dose de medicamento estiver sendo carregada.
- Gire a alça marrom totalmente para a direita o máximo possível. Torça-o novamente totalmente para a esquerda.
- Você ouvirá um clique.
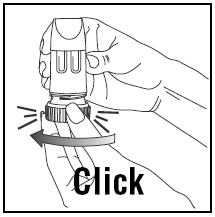
INALANDO A DOSE
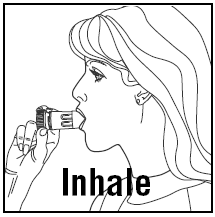
- Ao inspirar, PULMICORT 200mcg TURBUHALER (budesonida) deve ser mantido na posição vertical (bocal para cima) ou horizontal.
- Vire a cabeça para longe do inalador e expire. Não agite o inalador após carregá-lo.
- Coloque o bocal entre os lábios e inspire profundamente e com força. Você pode não provar ou sentir a medicação.
- Não mastigue ou morda o bocal.
- Retire o inalador da boca e expire. Não sopre ou expire no bocal.
- Se for necessária mais de uma dose, basta repetir os passos acima.
- Quando terminar, coloque a tampa de volta no inalador e gire para fechar. Enxaguar a boca com água. Não engula.
- Mantenha seu PULMICORT TURBUHALER (budesonida) sempre limpo e seco.
- Não use PULMICORT TURBUHALER (budesonida) se estiver danificado ou se o bocal se soltar.
ARMAZENANDO SEU PULMICORT TURBUHALER (budesonida)
- Após cada uso, coloque a tampa branca de volta e gire-a firmemente no lugar.
- Mantenha PULMICORT TURBUHALER (budesonida) em local seco com temperatura ambiente controlada, 68-77°F (20-25°C).
- Mantenha seu PULMICORT TURBUHALER (budesonida) em um local seguro, fora do alcance das crianças pequenas.
- NÃO FAÇA utilizar após a data indicada no corpo do Turbohaler.
COMO SABER QUANDO SEU PULMICORT TURBUHALER (budesonida) ESTÁ VAZIO
A etiqueta na caixa ou na tampa informa quantas doses existem em seu PULMICORT TURBUHALER. Seu PULMICORT TURBUHALER (budesonida) possui uma janela indicadora de dose conveniente logo abaixo do bocal.
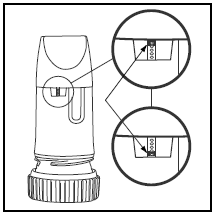
- Quando uma marca vermelha aparece na parte superior da janela, restam 20 doses de medicamento. Agora é a hora de adquirir o seu próximo PULMICORT 100mcg TURBUHALER (budesonida).
- Quando a marca vermelha atingir a parte inferior da janela, seu inalador deve ser descartado, pois pode não fornecer mais a quantidade correta de medicamento. (Você ainda pode ouvir um som se agitá-lo - este som não é o medicamento. Este som é produzido pelo agente de secagem dentro do Turbohaler.)
- Lembre-se, você receberá um novo inalador cada vez que reabastecer sua receita.
- Não o mergulhe na água para saber se está vazio. Basta verificar a janela do indicador de dose.
MAIS INFORMAÇÕES SOBRE PULMICORT TURBUHALER (budesonida)
- PULMICORT 200mcg TURBUHALER (budesonida) fornece seu medicamento como um pó muito fino. Por causa disso, você não pode gosto, cheiro ou sensação qualquer medicamento que entre nos pulmões ao inalar de PULMICORT TURBUHALER (budesonida) Isso não significa que você não esteja recebendo seu medicamento.
- PULMICORT 100mcg TURBUHALER (budesonida) não deve ser usado com espaçador.
- PULMICORT 100mcg TURBUHALER contém apenas budesonida e não contém ingredientes inativos.
- PULMICORT TURBUHALER (budesonida) foi especialmente projetado para fornecer apenas uma dose de cada vez, não importa quantas vezes você clique no botão marrom. Se você acidentalmente soprar no inalador após carregar uma dose, basta seguir as instruções para carregar uma nova dose.
Este folheto não contém a informação completa sobre o seu medicamento. Se você tiver alguma dúvida ou não tiver certeza sobre algo, pergunte ao seu médico ou farmacêutico.
Você pode querer ler este folheto novamente. Por favor, NÃO O JOGUE FORA até que você tenha terminado seu medicamento.
LEMBRE-SE: Este medicamento foi prescrito para você pelo seu médico. NÃO dê este medicamento a mais ninguém.
USE ESTE PRODUTO CONFORME INDICADO, A MENOS QUE INDICADO DE OUTRA FORMA PELO SEU MÉDICO.
Se você tiver mais dúvidas sobre o uso de PULMICORT 100mcg TURBUHALER (budesonida), ligue para: 1-800-236-9933.
