Symbicort 160/4.5mcg Budesonide Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Symbicort 4,5mcg e como é usado?
Symbicort 4,5mcg é um medicamento de prescrição usado para tratar os sintomas de asma e doença pulmonar obstrutiva crônica. Symbicort pode ser usado sozinho ou com outros medicamentos.
Symbicort pertence a uma classe de medicamentos chamados Combos Inalantes Respiratórios.
Não se sabe se Symbicort 4,5mcg é seguro e eficaz em crianças menores de 6 anos de idade.
Quais são os possíveis efeitos colaterais do Symbicort 4,5mcg?
Symbicort pode causar efeitos colaterais graves, incluindo:
- agravamento dos problemas respiratórios,
- feridas ou manchas brancas na boca ou garganta,
- dor ao engolir,
- tremores,
- nervosismo,
- dor no peito,
- batimentos cardíacos rápidos ou acelerados,
- tosse com muco,
- sentindo falta de ar,
- chiado,
- asfixia,
- outros problemas respiratórios,
- visão embaçada,
- visão de túnel,
- dor nos olhos ou vermelhidão,
- vendo halos ao redor das luzes,
- febre,
- arrepios,
- dores no corpo,
- cansaço incomum,
- aumento da sede,
- aumento da micção,
- boca seca,
- odor de hálito frutado,
- cãibras nas pernas,
- constipação,
- batimentos cardíacos irregulares,
- vibrando em seu peito,
- dormência ou formigamento,
- fraqueza muscular,
- sentimento flácido,
- cansaço,
- fraqueza,
- tontura,
- náusea, e
- vômito
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Symbicort incluem:
- dor ou irritação na garganta,
- manchas brancas na boca ou garganta,
- desconforto estomacal,
- vômito,
- dor nas costas,
- dor de cabeça,
- sintomas de gripe e
- sintomas de resfriado (nariz entupido ou escorrendo, espirros, dor sinusal ou dor de garganta)
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Symbicort. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
DESCRIÇÃO
SYMBICORT 80/4.5 e SYMBICORT 160/4.5 contêm budesonida micronizada e fumarato de formoterol dihidratado micronizado apenas para inalação oral.
Cada recipiente de SYMBICORT 80/4.5 e SYMBICORT 160/4.5 é formulado como um inalador pressurizado de dose medida com propulsão hidrofluoroalcano (HFA 227; 1,1,1,2,3,3,3-heptafluoropropano) contendo 60 ou 120 atuações [ver Formas de dosagem e pontos fortes e COMO FORNECIDO / Armazenamento e manuseio ]. Após a escorva, cada acionamento mede 91/5,1 mcg ou 181/5,1 mcg da válvula e fornece 80/4,5 mcg ou 160/4,5 mcg (budesonida micronizada/formoterol fumarato di-hidratado micronizado) do atuador. A quantidade real de droga entregue ao pulmão pode depender de fatores do paciente, como a coordenação entre a atuação do dispositivo e a inspiração através do sistema de entrega. SYMBICORT 160mg também contém povidona K25 USP como agente de suspensão e polietilenoglicol 1000 NF como lubrificante.
SYMBICORT 160mg deve ser preparado antes de usar pela primeira vez, liberando dois sprays de teste no ar longe do rosto, agitando bem por 5 segundos antes de cada spray. Nos casos em que o inalador não foi usado por mais de 7 dias ou quando caiu, prepare o inalador novamente agitando bem por 5 segundos antes de cada pulverização e liberando dois sprays de teste no ar longe do rosto.
Um componente ativo de SYMBICORT 4,5mcg é a budesonida, um corticosteroide designado quimicamente como (RS)11β, 16α, 17,21-Tetrahidroxipregna-1,4-dieno-3,20-diona cíclico 16,17-acetal com butiraldeído. A budesonida é fornecida como uma mistura de dois epímeros (22R e 22S). A fórmula empírica da budesonida é C25H34O6 e seu peso molecular é 430,5. Sua fórmula estrutural é:
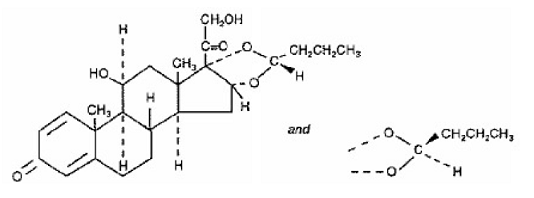
budesonida é um pó branco a esbranquiçado, insípido e inodoro, praticamente insolúvel em água e em heptano, pouco solúvel em etanol e livremente solúvel em clorofórmio. Seu coeficiente de partição entre octanol e água em pH 7,4 é 1,6 x 103.
O outro componente ativo de SYMBICORT 160mg é o fumarato de formoterol dihidratado, um beta2-agonista seletivo designado quimicamente como (R*,R*)-(±)-N-[2-hidroxi-5-[1-hidroxi-2-[[ 2-(4-metoxifenil)-1metiletil]amino]etil]fenil]formamida, (E)-2-butendioato (2:1), di-hidrato. A fórmula empírica do formoterol é C42H56N4O14 e seu peso molecular é 840,9. Sua fórmula estrutural é:
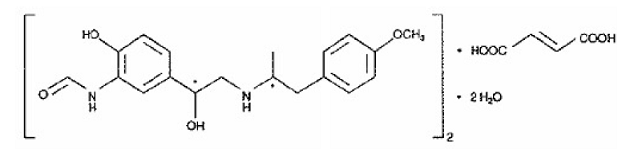
O fumarato de formoterol dihidratado é um pó ligeiramente solúvel em água. Seu coeficiente de partição octanol-água em pH 7,4 é 2,6. O pKa do dihidrato de fumarato de formoterol a 25°C é 7,9 para o grupo fenólico e 9,2 para o grupo amino.
INDICAÇÕES
Tratamento da asma
SYMBICORT 4,5mcg é indicado para o tratamento da asma em pacientes com 6 anos de idade ou mais.
SYMBICORT deve ser usado para pacientes não controlados adequadamente com um medicamento de controle de asma de longo prazo, como um corticosteroide inalatório (ICS) ou cuja doença justifique o início do tratamento com um corticosteroide inalatório e um agonista beta2-adrenérgico de longa ação (LABA).
Limitações importantes de uso
- SYMBICORT NÃO é indicado para o alívio do broncoespasmo agudo.
Tratamento de manutenção da doença pulmonar obstrutiva crônica
SYMBICORT 160/4.5 é indicado para o tratamento de manutenção da obstrução do fluxo aéreo em pacientes com doença pulmonar obstrutiva crônica (DPOC), incluindo bronquite crônica e/ou enfisema. SYMBICORT 160/4.5 também é indicado para reduzir as exacerbações da DPOC. SYMBICORT 160/4.5 é a única dosagem indicada para o tratamento da DPOC.
Limitações importantes de uso
- SYMBICORT 4,5mcg NÃO é indicado para o alívio do broncoespasmo agudo.
DOSAGEM E ADMINISTRAÇÃO
Informações de administração
SYMBICORT 160mg deve ser administrado em 2 inalações duas vezes ao dia (manhã e noite, com intervalo de aproximadamente 12 horas), todos os dias apenas por via oral inalatória. Após a inalação, o paciente deve enxaguar a boca com água sem engolir.
Prepare SYMBICORT 4,5mcg antes de usar pela primeira vez, liberando dois sprays de teste no ar longe do rosto, agitando bem por 5 segundos antes de cada spray. Nos casos em que o inalador não foi usado por mais de 7 dias ou quando caiu, prepare o inalador novamente agitando bem antes de cada pulverização e liberando duas pulverizações de teste no ar longe do rosto.
A administração mais frequente ou um número maior de inalações (mais de 2 inalações duas vezes ao dia) da dosagem prescrita de SYMBICORT não é recomendada, pois alguns pacientes têm maior probabilidade de apresentar efeitos adversos com doses mais altas de formoterol. Pacientes em uso de SYMBICORT não devem usar LABA adicional por qualquer motivo [ver AVISOS E PRECAUÇÕES ].
Asma
Se surgirem sintomas de asma no período entre as doses, um beta2-agonista inalado de curta ação deve ser administrado para alívio imediato.
Pacientes adultos e adolescentes com 12 anos de idade ou mais
Para pacientes com 12 anos de idade ou mais, a dosagem é de 2 inalações de SYMBICORT 80/4,5 ou SYMBICORT 160/4,5 duas vezes ao dia.
As dosagens iniciais recomendadas de SYMBICORT para pacientes com 12 anos de idade ou mais são baseadas na gravidade da asma do paciente ou no nível de controle dos sintomas da asma e no risco de exacerbações com os corticosteroides inalatórios atuais.
A dosagem máxima recomendada em pacientes adultos e adolescentes com 12 anos ou mais é SYMBICORT 160/4,5, duas inalações duas vezes ao dia.
A melhora no controle da asma após a administração inalatória de SYMBICORT pode ocorrer dentro de 15 minutos após o início do tratamento, embora o benefício máximo possa não ser alcançado por 2 semanas ou mais após o início do tratamento. Os pacientes individuais experimentarão um tempo variável para o início e grau de alívio dos sintomas.
Para pacientes que não respondem adequadamente à dose inicial após 1-2 semanas de terapia com SYMBICORT 80/4.5, a substituição por SYMBICORT 160/4.5 pode fornecer controle adicional da asma.
Se um regime de dosagem previamente eficaz de SYMBICORT 4,5mcg não fornecer o controle adequado da asma, o regime terapêutico deve ser reavaliado e opções terapêuticas adicionais (por exemplo, substituir a dosagem mais baixa de SYMBICORT 4,5mcg por uma dosagem mais alta, adicionando corticosteroides ou iniciar corticosteroides orais) deve ser considerado.
Pacientes pediátricos de 6 a menos de 12 anos
Para pacientes de 6 a menos de 12 anos de idade, a dosagem é de 2 inalações de SYMBICORT 80/4.5 duas vezes ao dia.
Doença de obstrução pulmonar crônica
Para pacientes com DPOC a dose recomendada é SYMBICORT 160/4.5, duas inalações duas vezes ao dia.
Se ocorrer falta de ar no período entre as doses, um beta2-agonista inalado de curta ação deve ser tomado para alívio imediato.
COMO FORNECIDO
Formas de dosagem e pontos fortes
SYMBICORT está disponível como um inalador dosimetrado contendo uma combinação de budesonida (80 ou 160 mcg) e formoterol (4,5 mcg) como aerossol para inalação nas duas dosagens seguintes: 80/4,5 e 160/4,5. Cada dosagem contém 60 ou 120 atuações por/canister. Cada dosagem de SYMBICORT 160mg é fornecida com um atuador de plástico vermelho com tampa cinza.
Armazenamento e manuseio
SYMBICORT está disponível em duas dosagens e é fornecido nos seguintes tamanhos de embalagem:
Formas de dosagem e pontos fortes
Cada força é fornecida como um recipiente de alumínio pressurizado com um dispositivo de contagem anexado, um corpo de atuador de plástico vermelho com um bocal branco e tampa de poeira cinza anexada. Cada recipiente de 120 inalações tem um peso líquido de enchimento de 10,2 gramas e cada recipiente de 60 inalações tem um peso líquido de enchimento de 6,9 gramas (SYMBICORT 80/4,5) ou 6 gramas (SYMBICORT 160/4,5). Cada recipiente é embalado em uma bolsa de papel alumínio com sachê dessecante e colocado em uma caixa de papelão. Cada embalagem contém um recipiente e um folheto informativo do paciente.
O recipiente SYMBICORT 4,5mcg só deve ser usado com o atuador SYMBICORT 4,5mcg, e o atuador SYMBICORT não deve ser usado com nenhum outro medicamento para inalação.
quantidade correta de medicamento em cada inalação não pode ser assegurada após o número rotulado de inalações do recipiente ter sido usado, mesmo que o inalador não pareça completamente vazio e possa continuar a funcionar. O inalador deve ser descartado quando o número rotulado de inalações tiver sido usado ou dentro de 3 meses após a remoção da bolsa de alumínio. Nunca mergulhe o recipiente em água para determinar a quantidade restante no recipiente (“teste de flutuação”).
Armazenar em temperatura ambiente controlada de 20°C a 25°C (68°F a 77°F) [ver USP]. Guarde o inalador com o bocal para baixo.
Para melhores resultados, o recipiente deve estar à temperatura ambiente antes do uso. Agite bem por 5 segundos antes de usar.
Manter fora do alcance das crianças. Evite borrifar nos olhos.
CONTEÚDO SOBRE PRESSÃO.
Não perfure ou incinere. Não armazene perto de calor ou chama aberta. A exposição a temperaturas acima de 120°F pode causar explosão. Nunca jogue o recipiente no fogo ou incinerador.
Fabricado para: AstraZeneca Pharmaceuticals LP, Wilmington, DE 19850 Por: AstraZeneca Dunkerque Production, Dunkerque, França. Revisado: dezembro de 2017
EFEITOS COLATERAIS
O uso de LABA pode resultar no seguinte:
- Eventos graves relacionados à asma – hospitalizações, intubações, morte [ver AVISOS E PRECAUÇÕES ].
- Efeitos cardiovasculares e no sistema nervoso central [ver AVISOS E PRECAUÇÕES ].
O uso de corticosteroides sistêmicos e inalatórios pode resultar no seguinte:
- Infecção por Candida albicans [ver AVISOS E PRECAUÇÕES ]
- Pneumonia ou infecções do trato respiratório inferior em pacientes com DPOC [ver AVISOS E PRECAUÇÕES ]
- Imunossupressão [ver AVISOS E PRECAUÇÕES ]
- Hipercorticismo e supressão adrenal [ver AVISOS E PRECAUÇÕES ]
- Efeitos de crescimento em pacientes pediátricos [ver AVISOS E PRECAUÇÕES ]
- Glaucoma e catarata [ver AVISOS E PRECAUÇÕES ]
Como os ensaios clínicos são conduzidos em condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparadas às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
Experiência de Ensaios Clínicos em Asma
Pacientes adultos e adolescentes com 12 anos de idade ou mais
Os dados gerais de segurança em adultos e adolescentes são baseados em 10 ensaios clínicos controlados por ativos e placebo nos quais 3.393 pacientes com 12 anos ou mais (2.052 mulheres e 1.341 homens) com asma de gravidade variável foram tratados com SYMBICORT 80/4.5 ou 160 /4,5 tomado 2 inalações uma ou duas vezes ao dia por 12 a 52 semanas. Nesses estudos, os pacientes em uso de SYMBICORT tinham idade média de 38 anos e eram predominantemente caucasianos (82%).
incidência de eventos adversos comuns na Tabela 2 abaixo é baseada em dados agrupados de três estudos clínicos de 12 semanas, duplo-cegos, controlados por placebo, nos quais 401 pacientes adultos e adolescentes (148 homens e 253 mulheres) com 12 anos ou mais foram tratado com 2 inalações de SYMBICORT 80/4.5 ou SYMBICORT 160/4.5 duas vezes ao dia. O grupo SYMBICORT foi composto principalmente por pacientes caucasianos (84%) com idade média de 38 anos e uma porcentagem média de VEF1 previsto no início do estudo de 76 e 68 para os grupos de tratamento de 80/4,5 mcg e 160/4,5 mcg, respectivamente. Os braços de controle para comparação incluíram 2 inalações de inalador de dose calibrada de budesonida HFA (MDI) 80 ou 160 mcg, inalador de pó seco de formoterol (DPI) 4,5 mcg ou placebo (MDI e DPI) duas vezes ao dia. A Tabela 2 inclui todos os eventos adversos que ocorreram com incidência >3% em qualquer grupo SYMBICORT e mais comumente do que no grupo placebo com dosagem duas vezes ao dia. Ao considerar esses dados, o aumento da duração média da exposição do paciente para pacientes com SYMBICORT deve ser levado em consideração, pois as incidências não são ajustadas para um desequilíbrio na duração do tratamento.
Segurança a longo prazo - Ensaios clínicos de asma em pacientes com 12 anos ou mais
Estudos de segurança de longo prazo em pacientes adolescentes e adultos com 12 anos de idade ou mais, tratados por até 1 ano com doses de até 1280/36 mcg/dia (640/18 mcg duas vezes ao dia), não revelaram alterações clinicamente importantes na incidência nem novos tipos de eventos adversos surgindo após longos períodos de tratamento. Da mesma forma, nenhum padrão significativo ou inesperado de anormalidades foi observado por até 1 ano em medidas de segurança, incluindo química, hematologia, ECG, monitor Holter e avaliações do eixo HPA.
Pacientes pediátricos de 6 a menos de 12 anos de idade
Os dados de segurança para doentes pediátricos com idades compreendidas entre os 6 e os 12 anos baseiam-se em 1 ensaio com 12 semanas de duração do tratamento. Os pacientes (79 mulheres e 105 homens) recebendo corticosteroide inalado no início do estudo foram randomizados para SYMBICORT 80/4.5 (n=92) ou budesonida pMDI 80 mcg (n=92), 2 inalações duas vezes ao dia. O perfil de segurança geral desses pacientes foi semelhante ao observado em pacientes com 12 anos de idade ou mais que receberam SYMBICORT 80/4.5 duas vezes ao dia em estudos de desenho semelhante. As reações adversas comuns que ocorreram em pacientes tratados com SYMBICORT 80/4.5 com uma frequência ≥3% e mais frequentemente do que pacientes tratados apenas com budesonida pMDI 80 mcg incluíram infecção do trato respiratório superior, faringite, cefaleia e rinite.
Experiência de Ensaios Clínicos em Doença Pulmonar Obstrutiva Crônica
Os dados de segurança descritos abaixo refletem a exposição ao SYMBICORT 160/4.5 em 1.783 pacientes. SYMBICORT 160/4.5 foi estudado em dois estudos de função pulmonar controlados por placebo (6 e 12 meses de duração) e dois estudos de exacerbação controlados por ativos (6 e 12 meses de duração) em pacientes com DPOC.
incidência de eventos adversos comuns na Tabela 3 abaixo é baseada em dados agrupados de dois estudos clínicos duplo-cegos de função pulmonar controlados por placebo (6 e 12 meses de duração) nos quais 771 pacientes adultos com DPOC (496 homens e 275 mulheres) 40 anos de idade e mais velhos foram tratados com SYMBICORT 160/4.5, duas inalações duas vezes ao dia. Destes pacientes, 651 foram tratados por 6 meses e 366 foram tratados por 12 meses. O grupo SYMBICORT era composto principalmente por pacientes caucasianos (93%) com idade média de 63 anos e uma porcentagem média de VEF1 previsto no início do estudo de 33%. Os braços de controle para comparação incluíram 2 inalações de budesonida HFA (MDI) 160 mcg, formoterol (DPI) 4,5 mcg ou placebo (MDI e DPI) duas vezes ao dia. A Tabela 3 inclui todos os eventos adversos que ocorreram com incidência ≥3% no grupo SYMBICORT e mais comumente do que no grupo placebo. Ao considerar esses dados, o aumento da duração média da exposição do paciente ao SYMBICORT 4,5mcg deve ser levado em consideração, pois as incidências não são ajustadas para um desequilíbrio na duração do tratamento.
Infecções pulmonares que não pneumonia (principalmente bronquite) ocorreram em uma porcentagem maior de indivíduos tratados com SYMBICORT 160/4,5 em comparação com placebo (7,9% vs. 5,1%, respectivamente). Não houve padrões clinicamente importantes ou inesperados de anormalidades observados por até 1 ano em avaliações de química, hematologia, ECG, ECG (Holter), eixo HPA, densidade mineral óssea e oftalmologia.
Os achados de segurança dos dois estudos duplo-cegos de exacerbações com controle ativo (6 e 12 meses de duração) nos quais 1.012 pacientes adultos com DPOC (616 homens e 396 mulheres) com 40 anos de idade ou mais foram tratados com SYMBICORT 160/4.5, duas inalações duas vezes ao dia foram consistentes com os estudos de função pulmonar.
Experiência pós-marketing
As seguintes reações adversas foram identificadas durante o uso pós-aprovação de SYMBICORT. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento. Algumas dessas reações adversas também podem ter sido observadas em estudos clínicos com SYMBICORT.
Distúrbios cardíacos: angina pectoris, taquicardia, taquiarritmias atriais e ventriculares, fibrilação atrial, extra-sístoles, palpitações
Distúrbios endócrinos: hipercorticismo, redução da velocidade de crescimento em pacientes pediátricos
Distúrbios oculares: catarata, glaucoma, aumento da pressão intraocular
Problemas gastrointestinais: candidíase orofaríngea, náusea
Distúrbios do sistema imunológico: reações de hipersensibilidade imediatas e tardias, como reação anafilática, angioedema, broncoespasmo, urticária, exantema, dermatite, prurido
Distúrbios metabólicos e nutricionais: hiperglicemia, hipocalemia
Distúrbios musculoesqueléticos, do tecido conjuntivo e dos ossos: cãibras musculares
Distúrbios do sistema nervoso: tremor, tontura
Distúrbios psiquiátricos: distúrbios de comportamento, distúrbios do sono, nervosismo, agitação, depressão, inquietação
Distúrbios respiratórios, torácicos e mediastinais: disfonia, tosse, irritação na garganta
Distúrbios da pele e tecidos subcutâneos: hematomas na pele
Distúrbios vasculares: hipotensão, hipertensão
INTERAÇÕES MEDICAMENTOSAS
Em estudos clínicos, a administração concomitante de SYMBICORT e outros medicamentos, como beta2agonistas de curta ação, corticosteroides intranasais e anti-histamínicos/descongestionantes, não resultou em aumento da frequência de reações adversas. Não foram realizados estudos formais de interação medicamentosa com SYMBICORT.
Inibidores do Citocromo P4503A4
principal via de metabolismo dos corticosteroides, incluindo budesonida, um componente de SYMBICORT, é através da isoenzima 3A4 do citocromo P450 (CYP) (CYP3A4). Após a administração oral de cetoconazol, um forte inibidor do CYP3A4, a concentração plasmática média da budesonida administrada por via oral aumentou. A administração concomitante de CYP3A4 pode inibir o metabolismo e aumentar a exposição sistêmica à budesonida. Deve-se ter cautela ao considerar a coadministração de SYMBICORT 4,5mcg com cetoconazol de longa duração e outros inibidores potentes de CYP3A4 conhecidos (por exemplo, ritonavir, atazanavir, claritromicina, indinavir, itraconazol, nefazodona, nelfinavir, saquinavir, telitromicina) [ver AVISOS E PRECAUÇÕES ].
Inibidores da Monoamino Oxidase e Antidepressivos Tricíclicos
SYMBICORT deve ser administrado com cautela a pacientes em tratamento com inibidores da monoaminoxidase ou antidepressivos tricíclicos, ou dentro de 2 semanas após a descontinuação de tais agentes, porque a ação do formoterol, um componente de SYMBICORT 160mg, no sistema vascular pode ser potencializada por esses agentes. . Em ensaios clínicos com SYMBICORT, um número limitado de pacientes com DPOC e asma recebeu antidepressivos tricíclicos e, portanto, nenhuma conclusão clinicamente significativa sobre eventos adversos pode ser feita.
Agentes bloqueadores de receptores beta-adrenérgicos
Os betabloqueadores (incluindo colírios) podem não apenas bloquear o efeito pulmonar dos beta-agonistas, como o formoterol, um componente de SYMBICORT, mas também podem produzir broncoespasmo grave em pacientes com asma. Portanto, os pacientes com asma normalmente não devem ser tratados com betabloqueadores. No entanto, sob certas circunstâncias, pode não haver alternativas aceitáveis ao uso de agentes bloqueadores beta-adrenérgicos em pacientes com asma. Nesse cenário, betabloqueadores cardiosseletivos podem ser considerados, embora devam ser administrados com cautela.
Diuréticos
As alterações no ECG e/ou hipocalemia que podem resultar da administração de diuréticos não poupadores de potássio (como diuréticos de alça ou tiazídicos) podem ser agudamente agravadas por beta-agonistas, especialmente quando a dose recomendada de beta-agonista é excedida. Embora o significado clínico desses efeitos não seja conhecido, recomenda-se cautela na coadministração de SYMBICORT com diuréticos não poupadores de potássio.
AVISOS
Incluído como parte do PRECAUÇÕES seção.
PRECAUÇÕES
Eventos Graves Relacionados à Asma - Hospitalizações, Intubações e Morte
O uso de LABA como monoterapia (sem CI) para asma está associado a um risco aumentado de morte relacionada à asma [ver Salmeterol Multicenter Asthma Research Trial (SMART)]. Os dados disponíveis de ensaios clínicos controlados também sugerem que o uso de LABA como monoterapia aumenta o risco de hospitalização relacionada à asma em pacientes pediátricos e adolescentes. Esses achados são considerados um efeito de classe do LABA. Quando os LABA são usados em combinação de dose fixa com CI, os dados de grandes ensaios clínicos não mostram um aumento significativo no risco de eventos graves relacionados à asma (hospitalizações, intubações, morte) em comparação com CI sozinho (consulte Eventos Graves Relacionados à Asma com ICS/LABA).
Eventos sérios relacionados à asma com ICS/LABA
Quatro grandes ensaios clínicos de segurança clínica de 26 semanas, randomizados, cegos e controlados por ativos foram conduzidos para avaliar o risco de eventos graves relacionados à asma quando LABA foi usado em combinação de dose fixa com CI em comparação com CI sozinho em pacientes com asma. Três estudos incluíram pacientes adultos e adolescentes com idade ≥12 anos: um estudo comparou budesonida/formoterol (SYMBICORT) com budesonida [ver Estudos clínicos ]; um ensaio comparou o pó para inalação de propionato de fluticasona/salmeterol ao pó para inalação de propionato de fluticasona; e um estudo comparou furoato de mometasona/formoterol com furoato de mometasona. O quarto estudo incluiu pacientes pediátricos de 4 a 11 anos de idade e comparou propionato de fluticasona/pó para inalação de salmeterol ao pó para inalação de propionato de fluticasona. O desfecho primário de segurança para todos os quatro estudos foi eventos graves relacionados à asma (hospitalizações, intubações e morte). Um comitê de adjudicação cego determinou se os eventos estavam relacionados à asma.
Os três ensaios para adultos e adolescentes foram projetados para descartar uma margem de risco de 2,0, e o ensaio pediátrico foi projetado para descartar um risco de 2,7. Cada ensaio individual atingiu seu objetivo pré-especificado e demonstrou não inferioridade de ICS/LABA em relação ao ICS sozinho. Uma meta-análise dos três estudos em adultos e adolescentes não mostrou um aumento significativo no risco de um evento grave relacionado à asma com a combinação de dose fixa de CI/LABA em comparação com CI sozinho (Tabela 1). Esses estudos não foram projetados para descartar todos os riscos de eventos graves relacionados à asma com ICS/LABA em comparação com ICS.
estudo de segurança pediátrica incluiu 6.208 pacientes pediátricos de 4 a 11 anos de idade que receberam ICS/LABA (propionato de fluticasona/pó para inalação de salmeterol) ou ICS (pó para inalação de propionato de fluticasona). Neste estudo, 27/3107 (0,9%) pacientes randomizados para ICS/LABA e 21/3101 (0,7%) pacientes randomizados para ICS apresentaram um evento grave relacionado à asma. Não houve mortes ou intubações relacionadas à asma. O ICS/LABA não mostrou um risco significativamente aumentado de um evento grave relacionado à asma em comparação com o ICS com base na margem de risco pré-especificada (2,7), com uma taxa de risco estimada de tempo até o primeiro evento de 1,29 (IC 95%: 0,73 , 2.27).
Ensaio Multicêntrico de Pesquisa em Asma Salmeterol (SMART)
Um estudo americano de 28 semanas, controlado por placebo, que comparou a segurança do salmeterol com placebo, cada um adicionado à terapia usual da asma, mostrou um aumento nas mortes relacionadas à asma em pacientes que receberam salmeterol (13/13.176 em pacientes tratados com salmeterol vs. 3 /13.179 em pacientes tratados com placebo; risco relativo: 4,37 [IC 95% 1,25, 15,34]). O uso de ICS em segundo plano não era necessário no SMART. O aumento do risco de morte relacionada à asma é considerado um efeito de classe da monoterapia com LABA.
Estudos de monoterapia com formoterol
Estudos clínicos com formoterol usado como monoterapia sugeriram uma maior incidência de exacerbação grave da asma em pacientes que receberam formoterol do que naqueles que receberam placebo. Os tamanhos desses estudos não foram adequados para quantificar com precisão a diferença nas exacerbações graves da asma entre os grupos de tratamento.
Deterioração da doença e episódios agudos
SYMBICORT 4,5mcg não deve ser iniciado em pacientes durante episódios de asma ou DPOC de rápida deterioração ou potencialmente fatais. SYMBICORT não foi estudado em pacientes com piora aguda da asma ou DPOC. O início de SYMBICORT 4,5mcg neste cenário não é apropriado.
O uso crescente de beta2-agonistas de curta duração inalados é um marcador de deterioração da asma. Nessa situação, o paciente necessita de reavaliação imediata com reavaliação do esquema de tratamento, dando atenção especial à possível necessidade de substituir a dosagem atual de SYMBICORT por uma dosagem mais alta, adicionar corticosteróide inalatório adicional ou iniciar corticosteróide sistêmico. Os pacientes não devem usar mais de 2 inalações duas vezes ao dia (manhã e noite) de SYMBICORT.
SYMBICORT 160mg não deve ser usado para alívio de sintomas agudos, ou seja, como terapia de resgate para o tratamento de episódios agudos de broncoespasmo. Um beta2-agonista inalado de ação curta, não SYMBICORT, deve ser usado para aliviar os sintomas agudos, como falta de ar.
Ao iniciar o tratamento com SYMBICORT 4,5mcg, os pacientes que estejam tomando beta2-agonistas de curta ação orais ou inalatórios regularmente (por exemplo, 4 vezes ao dia) devem ser instruídos a descontinuar o uso regular desses medicamentos.
Uso excessivo de SYMBICORT 4,5mcg e uso com outros beta2-agonistas de ação prolongada
Assim como outros medicamentos inalatórios contendo agentes beta2-adrenérgicos, SYMBICORT 4,5mcg não deve ser usado com mais frequência do que o recomendado, em doses mais altas do que o recomendado, ou em conjunto com outros medicamentos contendo LABA, pois pode resultar em superdosagem. Efeitos cardiovasculares clinicamente significativos e fatalidades foram relatados em associação com o uso excessivo de drogas simpaticomiméticas inalatórias. Pacientes em uso de SYMBICORT não devem usar LABA adicional (por exemplo, salmeterol, fumarato de formoterol, tartarato de arformoterol) por qualquer motivo, incluindo prevenção de broncoespasmo induzido por exercício (BIE) ou tratamento de asma ou DPOC.
Efeitos locais
Em estudos clínicos, o desenvolvimento de infecções localizadas da boca e faringe com Candida albicans ocorreu em pacientes tratados com SYMBICORT. Quando tal infecção se desenvolve, ela deve ser tratada com terapia local ou sistêmica apropriada (ou seja, antifúngico oral) enquanto o tratamento com SYMBICORT 160mg continua, mas às vezes a terapia com SYMBICORT 4,5mcg pode precisar ser interrompida. Aconselhe o paciente a enxaguar a boca com água sem engolir após a inalação para ajudar a reduzir o risco de candidíase orofaríngea.
Pneumonia e outras infecções do trato respiratório inferior
Os médicos devem permanecer vigilantes quanto ao possível desenvolvimento de pneumonia em pacientes com DPOC, pois as características clínicas da pneumonia e das exacerbações frequentemente se sobrepõem. Infecções do trato respiratório inferior, incluindo pneumonia, foram relatadas após a administração inalatória de corticosteróides.
Em um estudo de função pulmonar de 6 meses de 1.704 pacientes com DPOC, houve uma maior incidência de infecções pulmonares além de pneumonia (por exemplo, bronquite, infecções virais do trato respiratório inferior, etc.) em pacientes que receberam SYMBICORT 160/4.5 (7,6%) do que naqueles que receberam SYMBICORT 80/4,5 (3,2%), formoterol 4,5 mcg (4,6%) ou placebo (3,3%). Pneumonia não ocorreu com maior incidência no grupo SYMBICORT 160/4.5 (1,1%) em comparação com placebo (1,3%). Em um estudo de função pulmonar de 12 meses de 1.964 pacientes com DPOC, também houve uma maior incidência de infecções pulmonares além de pneumonia em pacientes que receberam SYMBICORT 160/4,5 (8,1%) do que naqueles que receberam SYMBICORT 80/4,5 (6,9%). formoterol 4,5 mcg (7,1%) ou placebo (6,2%). Semelhante ao estudo de 6 meses, a pneumonia não ocorreu com maior incidência no grupo SYMBICORT 160/4.5 (4,0%) em comparação com placebo (5,0%).
Imunossupressão
Pacientes que tomam medicamentos que suprimem o sistema imunológico são mais suscetíveis à infecção do que indivíduos saudáveis. A catapora e o sarampo, por exemplo, podem ter um curso mais grave ou mesmo fatal em crianças ou adultos suscetíveis usando corticosteróides. Em tais crianças ou adultos que não tiveram essas doenças ou foram devidamente imunizados, deve-se tomar cuidado especial para evitar a exposição. Não se sabe como a dose, a via e a duração da administração de corticosteroides afetam o risco de desenvolver uma infecção disseminada. A contribuição da doença subjacente e/ou tratamento prévio com corticosteroides para o risco também não é conhecida. Se exposto, a terapia com imunoglobulina contra varicela zoster (VZIG) ou imunoglobulina intravenosa combinada (IVIG), conforme apropriado, pode ser indicada. Se exposto ao sarampo, a profilaxia com imunoglobulina intramuscular (IG) agrupada pode ser indicada (consulte as respectivas bulas para obter informações completas sobre a prescrição de VZIG e IG). Se a varicela se desenvolver, o tratamento com agentes antivirais pode ser considerado. A resposta imune à vacina contra varicela foi avaliada em pacientes pediátricos com asma de 12 meses a 8 anos com suspensão inalatória de budesonida.
Um estudo clínico aberto e não randomizado examinou a resposta imune à vacina contra varicela em 243 pacientes com asma de 12 meses a 8 anos de idade que foram tratados com suspensão inalatória de budesonida 0,25 mg a 1 mg diariamente (n = 151) ou terapia de asma sem corticosteroides (n =92) (isto é, beta2-agonistas, antagonistas do receptor de leucotrienos, cromonas). A porcentagem de pacientes que desenvolveram um título de anticorpos soroprotetores >5,0 (valor gpELISA) em resposta à vacinação foi semelhante em pacientes tratados com suspensão inalatória de budesonida (85%), em comparação com pacientes tratados com terapia de asma sem corticosteroides (90%). Nenhum paciente tratado com suspensão para inalação de budesonida desenvolveu catapora como resultado da vacinação.
Os corticosteroides inalatórios devem ser usados com cautela, se for o caso, em pacientes com infecções por tuberculose ativa ou quiescente do trato respiratório; infecções sistêmicas fúngicas, bacterianas, virais ou parasitárias não tratadas; ou herpes simples ocular.
Transferência de pacientes da terapia com corticosteroides sistêmicos
É necessário cuidado especial para pacientes que foram transferidos de corticosteróides sistemicamente ativos para corticosteróides inalados, porque ocorreram mortes por insuficiência adrenal em pacientes com asma durante e após a transferência de corticosteróides sistêmicos para corticosteróides inalatórios menos disponíveis sistemicamente. Após a retirada dos corticosteroides sistêmicos, alguns meses são necessários para a recuperação da função hipotálamo-hipófise-adrenal (HPA).
Os pacientes que foram previamente mantidos com 20 mg ou mais por dia de prednisona (ou seu equivalente) podem ser mais suscetíveis, particularmente quando seus corticosteroides sistêmicos foram quase completamente retirados. Durante este período de supressão do HPA, os pacientes podem apresentar sinais e sintomas de insuficiência adrenal quando expostos a trauma, cirurgia ou infecção (particularmente gastroenterite) ou outras condições associadas à perda grave de eletrólitos. Embora SYMBICORT possa fornecer controle dos sintomas de asma durante esses episódios, nas doses recomendadas, ele fornece quantidades fisiológicas de glicocorticóides sistemicamente inferiores ao normal e NÃO fornece a atividade mineralocorticóide necessária para lidar com essas emergências.
Durante períodos de estresse, um ataque de asma grave ou uma exacerbação grave de DPOC, os pacientes que foram retirados de corticosteroides sistêmicos devem ser instruídos a retomar os corticosteroides orais (em grandes doses) imediatamente e a entrar em contato com seus médicos para mais instruções. Esses pacientes também devem ser instruídos a portar um cartão de advertência indicando que podem precisar de corticosteroides sistêmicos suplementares durante períodos de estresse, crise de asma grave ou exacerbação grave de DPOC.
Os pacientes que necessitam de corticosteroides orais devem ser desmamados lentamente do uso de corticosteroides sistêmicos após a transferência para SYMBICORT. A redução da prednisona pode ser conseguida reduzindo a dose diária de prednisona em 2,5 mg semanalmente durante a terapia com SYMBICORT. A função pulmonar (volume expiratório forçado médio em 1 segundo [VEF1] ou pico de fluxo expiratório matinal [PFE]), uso de beta-agonistas e sintomas de asma ou DPOC devem ser cuidadosamente monitorados durante a retirada de corticosteroides orais. Além disso, os pacientes devem ser observados quanto a sinais e sintomas de insuficiência adrenal, como fadiga, lassidão, fraqueza, náuseas e vômitos e hipotensão.
transferência de pacientes da terapia com corticosteroides sistêmicos para corticosteroides inalatórios ou SYMBICORT pode desmascarar condições previamente suprimidas pela terapia com corticosteroides sistêmicos (por exemplo, rinite, conjuntivite, eczema, artrite, condições eosinofílicas). Alguns pacientes podem apresentar sintomas de retirada de corticosteroides sistemicamente ativos (por exemplo, dores articulares e/ou musculares, cansaço, depressão) apesar da manutenção ou mesmo da melhora da função respiratória.
Hipercorticismo e supressão adrenal
A budesonida, um componente do SYMBICORT, muitas vezes ajudará a controlar os sintomas da asma e da DPOC com menos supressão da função HPA do que doses orais terapeuticamente equivalentes de prednisona. Uma vez que a budesonida é absorvida na circulação e pode ser sistemicamente ativa em doses mais altas, os efeitos benéficos de SYMBICORT na minimização da disfunção do HPA podem ser esperados apenas quando as dosagens recomendadas não são excedidas e os pacientes individuais são titulados para a dose eficaz mais baixa.
Devido à possibilidade de absorção sistêmica de corticosteróides inalatórios, os pacientes tratados com SYMBICORT 160mg devem ser observados cuidadosamente quanto a qualquer evidência de efeitos sistêmicos de corticosteróides. Cuidado especial deve ser tomado ao observar pacientes no pós-operatório ou durante períodos de estresse para evidência de resposta adrenal inadequada.
É possível que os efeitos sistêmicos dos corticosteroides, como hipercorticismo e supressão adrenal (incluindo crise adrenal), possam aparecer em um pequeno número de pacientes, particularmente quando a budesonida é administrada em doses superiores às recomendadas por períodos prolongados. Se tais efeitos ocorrerem, a dosagem de SYMBICORT deve ser reduzida lentamente, de acordo com os procedimentos aceitos para redução de corticosteroides sistêmicos e para controle dos sintomas da asma.
Interações medicamentosas com inibidores fortes do citocromo P450 3A4
Deve-se ter cautela ao considerar a coadministração de SYMBICORT 4,5 mcg com cetoconazol e outros inibidores fortes de CYP3A4 conhecidos (por exemplo, ritonavir, atazanavir, claritromicina, indinavir, itraconazol, nefazodona, nelfinavir, saquinavir, telitromicina) porque os efeitos adversos relacionados ao aumento da exposição sistêmica à budesonida pode ocorrer [ver INTERAÇÕES MEDICAMENTOSAS e FARMACOLOGIA CLÍNICA ].
Broncoespasmo Paradoxal e Sintomas das Vias Aéreas Superiores
Assim como outros medicamentos inalatórios, SYMBICORT 160mg pode produzir broncoespasmo paradoxal, que pode ser fatal. Se ocorrer broncoespasmo paradoxal após a administração de SYMBICORT 160 mg, ele deve ser tratado imediatamente com broncodilatador inalatório de ação curta, SYMBICORT deve ser descontinuado imediatamente e uma terapia alternativa deve ser instituída.
Reações de hipersensibilidade imediata
Reações de hipersensibilidade imediata podem ocorrer após a administração de SYMBICORT 160mg, conforme demonstrado por casos de urticária, angioedema, erupção cutânea e broncoespasmo.
Efeitos cardiovasculares e no sistema nervoso central
A estimulação beta-adrenérgica excessiva tem sido associada a convulsões, angina, hipertensão ou hipotensão, taquicardia com frequências de até 200 batimentos/min, arritmias, nervosismo, cefaleia, tremor, palpitação, náusea, tontura, fadiga, mal-estar e insônia [ver SUPERDOSAGEM ]. Portanto, SYMBICORT 160mg, como todos os produtos contendo aminas simpaticomiméticas, deve ser usado com cautela em pacientes com distúrbios cardiovasculares, especialmente insuficiência coronariana, arritmias cardíacas e hipertensão.
Formoterol, um componente de SYMBICORT, pode produzir um efeito cardiovascular clinicamente significativo em alguns pacientes, conforme medido pela frequência cardíaca, pressão arterial e/ou sintomas. Embora tais efeitos sejam incomuns após a administração de formoterol nas doses recomendadas, se ocorrerem, o medicamento pode precisar ser descontinuado. Além disso, foi relatado que os beta-agonistas produzem alterações no ECG, como achatamento da onda T, prolongamento do intervalo QTc e depressão do segmento ST. O significado clínico destes resultados é desconhecido. Fatalidades foram relatadas em associação com o uso excessivo de drogas simpaticomiméticas inalatórias.
Redução da densidade mineral óssea
Foram observadas diminuições na densidade mineral óssea (DMO) com a administração a longo prazo de produtos contendo corticosteróides inalados. O significado clínico de pequenas alterações na DMO em relação às consequências a longo prazo, como fratura, é desconhecido. Pacientes com fatores de risco importantes para diminuição do conteúdo mineral ósseo, como imobilização prolongada, história familiar de osteoporose, estado pós-menopausa, tabagismo, idade avançada, má nutrição ou uso crônico de medicamentos que podem reduzir a massa óssea (por exemplo, anticonvulsivantes, corticosteroides orais ) devem ser monitorados e tratados com padrões de cuidados estabelecidos. Como os pacientes com DPOC geralmente apresentam múltiplos fatores de risco para redução da DMO, a avaliação da DMO é recomendada antes de iniciar SYMBICORT 160 mg e periodicamente a partir daí. Se forem observadas reduções significativas na DMO e SYMBICORT ainda for considerado clinicamente importante para a terapia da DPOC desse paciente, o uso de medicamentos para tratar ou prevenir a osteoporose deve ser fortemente considerado.
Os efeitos do tratamento com SYMBICORT 160/4.5, SYMBICORT 80/4.5, formoterol 4,5 mcg ou placebo na DMO foram avaliados em um subgrupo de 326 pacientes (mulheres e homens de 41 a 88 anos) com DPOC na função pulmonar de 12 meses estudar. As avaliações de DMO das regiões do quadril e da coluna lombar foram realizadas no início e 52 semanas usando varreduras de absorciometria de raios-x de dupla energia (DEXA). As alterações médias na DMO desde a linha de base até o final do tratamento foram pequenas (as alterações médias variaram de -0,01 a 0,01 g/cm²). Os resultados da ANCOVA para a coluna total e BMD total do quadril com base no final do ponto de tempo de tratamento mostraram que todas as proporções geométricas LS médias para as comparações do grupo de tratamento pareado foram próximas de 1, indicando que, em geral, a BMD para o quadril total e as regiões da coluna total para as 12 -mês foram estáveis ao longo de todo o período de tratamento.
Efeito no crescimento
Os corticosteróides inalados por via oral podem causar uma redução na velocidade de crescimento quando administrados a pacientes pediátricos. Monitore o crescimento de pacientes pediátricos recebendo SYMBICORT rotineiramente (por exemplo, por meio de estadiometria). Para minimizar os efeitos sistêmicos dos corticosteróides inalados por via oral, incluindo SYMBICORT, titule a dose de cada paciente para a dosagem mais baixa que efetivamente controle seus sintomas [ver DOSAGEM E ADMINISTRAÇÃO e Uso em populações específicas ].
Glaucoma e Catarata
Glaucoma, aumento da pressão intraocular e catarata foram relatados em pacientes com asma e DPOC após administração prolongada de corticosteroides inalatórios, incluindo budesonida, um componente de SYMBICORT. Portanto, o monitoramento cuidadoso é necessário em pacientes com alteração na visão ou com histórico de pressão intraocular aumentada, glaucoma e/ou catarata.
Os efeitos do tratamento com SYMBICORT 160/4.5, SYMBICORT 80/4.5, formoterol 4,5 mcg ou placebo no desenvolvimento de catarata ou glaucoma foram avaliados em um subgrupo de 461 pacientes com DPOC no estudo de função pulmonar de 12 meses. Os exames oftalmológicos foram realizados no início, 24 semanas e 52 semanas. Houve 26 indivíduos (6%) com um aumento na pontuação subcapsular posterior da linha de base para o valor máximo (> 0,7) durante o período de tratamento randomizado. Alterações nos escores subcapsulares posteriores de >0,7 desde a linha de base até o máximo do tratamento ocorreram em 11 pacientes (9,0%) no grupo SYMBICORT 160/4,5, 4 pacientes (3,8%) no grupo SYMBICORT 80/4,5, 5 pacientes (4,2%) no o grupo formoterol e 6 pacientes (5,2%) no grupo placebo.
Condições eosinofílicas e síndrome de Churg-Strauss
Em casos raros, pacientes em uso de corticosteroides inalatórios podem apresentar condições eosinofílicas sistêmicas. Alguns desses pacientes apresentam características clínicas de vasculite consistentes com a síndrome de Churg-Strauss, uma condição que é frequentemente tratada com corticoterapia sistêmica. Esses eventos geralmente, mas nem sempre, têm sido associados à redução e/ou retirada da terapia com corticosteroides orais após a introdução de corticosteroides inalatórios. Os médicos devem estar atentos à eosinofilia, erupção cutânea vasculítica, agravamento dos sintomas pulmonares, complicações cardíacas e/ou neuropatia presentes em seus pacientes. Não foi estabelecida uma relação causal entre a budesonida e essas condições subjacentes.
Condições coexistentes
SYMBICORT 4,5mcg, como todos os medicamentos contendo aminas simpaticomiméticas, deve ser usado com cautela em pacientes com distúrbios convulsivos ou tireotoxicose e naqueles que respondem de forma incomum a aminas simpaticomiméticas. Doses do agonista beta2-adrenérgico relacionado albuterol, quando administradas por via intravenosa, foram relatadas para agravar diabetes mellitus e cetoacidose preexistentes.
Hipocalemia e hiperglicemia
Medicamentos agonistas beta-adrenérgicos podem produzir hipocalemia significativa em alguns pacientes, possivelmente por meio de derivação intracelular, que tem o potencial de produzir efeitos cardiovasculares adversos. FARMACOLOGIA CLÍNICA ]. A diminuição do potássio sérico geralmente é transitória, não necessitando de suplementação. Alterações clinicamente significativas na glicemia e/ou potássio sérico foram observadas com pouca frequência durante os estudos clínicos com SYMBICORT nas doses recomendadas.
Informações de Aconselhamento do Paciente
Aconselhe o paciente a ler o rótulo do paciente aprovado pela FDA ( INFORMAÇÕES DO PACIENTE e Instruções de Uso ).
Eventos Graves Relacionados à Asma
Informar os pacientes com asma que o LABA quando usado sozinho aumenta o risco de hospitalização por asma ou morte relacionada à asma. Os dados disponíveis mostram que quando ICS e LABA são usados juntos, como com SYMBICORT, não há um aumento significativo no risco desses eventos.
Não para sintomas agudos
Informe os pacientes que SYMBICORT 160mg não se destina a aliviar os sintomas agudos de asma ou DPOC e doses extras não devem ser usadas para esse fim. Aconselhe os pacientes a tratar os sintomas agudos com um beta2-agonista inalado de curta ação, como o albuterol. Fornecer esses medicamentos aos pacientes e instruir o paciente sobre como deve ser usado.
Instrua os pacientes a procurar atendimento médico imediatamente se apresentarem algum dos seguintes:
- Diminuição da eficácia dos beta2-agonistas de ação curta inalados
- Necessidade de mais inalações do que o habitual de beta2-agonistas inalados de ação curta
- Diminuição significativa da função pulmonar, conforme descrito pelo médico
Diga aos pacientes que eles não devem interromper o tratamento com SYMBICORT sem orientação do médico/profissional, pois os sintomas podem reaparecer após a descontinuação.
Não use beta2-agonistas adicionais de ação prolongada
Instruir os pacientes a não usar outro LABA para asma e DPOC.
Efeitos locais
Informar os pacientes que infecções localizadas por Candida albicans ocorreram na boca e faringe em alguns pacientes. Se a candidíase orofaríngea se desenvolver, ela deve ser tratada com terapia antifúngica local ou sistêmica apropriada (ou seja, oral) enquanto continua a terapia com SYMBICORT 4,5mcg, mas às vezes a terapia com SYMBICORT pode precisar ser temporariamente interrompida sob supervisão médica rigorosa. Enxaguar a boca com água sem engolir após a inalação é aconselhado para reduzir o risco de aftas.
Pneumonia
Pacientes com DPOC têm maior risco de pneumonia; instrua-os a entrar em contato com seu médico se desenvolverem sintomas de pneumonia.
Imunossupressão
Avise os pacientes que estão em doses imunossupressoras de corticosteróides para evitar a exposição à varicela ou sarampo e, se expostos, consultar seu médico imediatamente. Informar os pacientes sobre o potencial agravamento da tuberculose existente, infecções fúngicas, bacterianas, virais ou parasitárias, ou herpes simples ocular.
Hipercorticismo e supressão adrenal
Avise os pacientes que SYMBICORT pode causar efeitos sistêmicos de corticosteróides de hipercorticismo e supressão adrenal. Além disso, informar aos pacientes que ocorreram mortes por insuficiência adrenal durante e após a transferência de corticosteroides sistêmicos. Os pacientes devem diminuir lentamente os corticosteroides sistêmicos se forem transferidos para SYMBICORT.
Redução da densidade mineral óssea
Aconselhe os pacientes com risco aumentado de diminuição da densidade mineral óssea que o uso de corticosteróides pode representar um risco adicional.
Velocidade de crescimento reduzida
Informe os pacientes que corticosteroides inalados por via oral, um componente de SYMBICORT, podem causar redução na velocidade de crescimento quando administrados a pacientes pediátricos. Os médicos devem acompanhar de perto o crescimento de crianças e adolescentes em uso de corticosteroides por qualquer via.
Efeitos oculares
O uso prolongado de corticosteróides inalados pode aumentar o risco de alguns problemas oculares (catarata ou glaucoma); considere exames oftalmológicos regulares.
Riscos Associados à Terapia Beta-Agonista
Informe os pacientes sobre os efeitos adversos associados aos beta2agonistas, como palpitações, dor no peito, ritmo cardíaco acelerado, tremor ou nervosismo.
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Budesonida
Estudos de longo prazo foram conduzidos em ratos e camundongos usando administração oral para avaliar o potencial carcinogênico da budesonida.
Em um estudo de 2 anos em ratos Sprague-Dawley, a budesonida causou um aumento estatisticamente significativo na incidência de gliomas em ratos machos em uma dose oral de 50 mcg/kg (aproximadamente equivalente ao MRHDID em adultos e crianças em um mcg/m² base). Nenhuma tumorigenicidade foi observada em ratos machos e fêmeas em doses orais respectivas de até 25 e 50 mcg/kg (aproximadamente equivalente ao MRHDID em adultos e crianças em uma base de mcg/m²). Em dois estudos adicionais de 2 anos em ratos machos Fischer e Sprague-Dawley, a budesonida não causou gliomas em uma dose oral de 50 mcg/kg (aproximadamente equivalente ao MRHDID em adultos e crianças com base em mcg/m²). No entanto, nos ratos machos Sprague-Dawley, a budesonida causou um aumento estatisticamente significativo na incidência de tumores hepatocelulares na dose oral de 50 mcg/kg (aproximadamente equivalente ao MRHDID em adultos e crianças na base de mcg/m²). Os corticosteroides de referência concomitantes (prednisolona e acetonido de triancinolona) nesses dois estudos mostraram achados semelhantes.
Em um estudo de 91 semanas em camundongos, a budesonida não causou carcinogenicidade relacionada ao tratamento em doses orais de até 200 mcg/kg (aproximadamente 2 vezes o MRHDID em adultos e crianças com base em mcg/m²).
A budesonida não foi mutagênica ou clastogênica em seis sistemas de teste diferentes: teste de Ames Salmonella/microssoma placa, teste de micronúcleo de camundongo, teste de linfoma de camundongo, teste de aberração cromossômica em linfócitos humanos, teste letal recessivo ligado ao sexo em Drosophila melanogaster e análise de reparo de DNA em rato cultura de hepatócitos.
A fertilidade e o desempenho reprodutivo não foram afetados em ratos em doses subcutâneas de até 80 mcg/kg (aproximadamente igual ao MRHDID em uma base de mcg/m²). No entanto, causou uma diminuição na viabilidade e viabilidade pré-natal nos filhotes ao nascimento e durante a lactação, juntamente com uma diminuição no ganho de peso corporal materno, em doses subcutâneas de 20 mcg/kg e acima (menos que o MRHDID em uma base de mcg/m² ). Nenhum desses efeitos foi observado em 5 mcg/kg (menos que o MRHDID em uma base de mcg/m²).
Formoterol
Estudos de longo prazo foram conduzidos em camundongos usando administração oral e ratos usando administração por inalação para avaliar o potencial carcinogênico do fumarato de formoterol.
Em um estudo de carcinogenicidade de 24 meses em camundongos CD-1, formoterol em doses orais de 100 mcg/kg e acima (aproximadamente 30 e 15 vezes o MRHDID em adultos e crianças, respectivamente, em uma base de mcg/m²) causou uma dose- aumento relacionado na incidência de leiomiomas uterinos.
Em um estudo de carcinogenicidade de 24 meses em ratos Sprague-Dawley, observou-se um aumento na incidência de leiomioma mesovariano e leiomiossarcoma uterino na dose inalatória de 130 mcg/kg (aproximadamente 70 e 35 vezes a MRHDID em adultos e crianças, respectivamente, em um base mcg/m²). Nenhum tumor foi observado em 22 mcg/kg (aproximadamente 12 e 6 vezes o MRHDID em adultos e crianças, respectivamente, em uma base de mcg/m²).
Outras drogas beta-agonistas também demonstraram aumentos em leiomiomas do trato genital em roedores fêmeas. A relevância desses achados para uso humano é desconhecida.
O formoterol não foi mutagênico ou clastogênico no teste de placa de Ames Salmonella/microssoma, teste de linfoma de camundongo, teste de aberração cromossômica em linfócitos humanos e teste de micronúcleo em rato.
Uma redução na fertilidade e/ou desempenho reprodutivo foi identificada em ratos machos tratados com formoterol em uma dose oral de 15.000 mcg/kg (aproximadamente 2.200 vezes o MRHDID com base na AUC). Nenhum efeito desse tipo foi observado com 3.000 mcg/kg (aproximadamente 1.600 vezes o MRHDID em uma base de mcg/m²). Em um estudo separado com ratos machos tratados com uma dose oral de 15.000 mcg/kg (aproximadamente 8.000 vezes o MRHDID em uma base de mcg/m²), houve achados de atrofia tubular testicular e restos espermáticos nos testículos e oligospermia nos epidídimos. Nenhum efeito sobre a fertilidade foi detectado em ratas com doses de até 15.000 mcg/kg (aproximadamente 1.100 vezes o MRHDID com base na AUC).
Uso em populações específicas
Gravidez
Resumo do risco
Não existem estudos adequados e bem controlados de SYMBICORT 160mg ou de um de seus componentes individuais, fumarato de formoterol, em mulheres grávidas; no entanto, estão disponíveis estudos para o outro componente budesonida. Em estudos de reprodução em animais, SYMBICORT 4,5mcg, administrado por via inalatória, foi teratogênico, embriocida e reduziu o peso fetal em ratos em doses inferiores à dose máxima diária recomendada para inalação humana (MRHDID) com base em mcg/m². A budesonida isolada, administrada por via subcutânea, foi teratogênica, embriocida e reduziu o peso fetal em ratos e coelhos em valores inferiores ao MRHDID, mas esses efeitos não foram observados em ratos que receberam doses inaladas de até 4 vezes o MRHDID. Estudos em mulheres grávidas não demonstraram que a budesonida inalada isoladamente aumenta o risco de anormalidades quando administrada durante a gravidez. A experiência com corticosteróides orais sugere que os roedores são mais propensos a efeitos teratogênicos da exposição aos corticosteróides do que os humanos. O fumarato de formoterol sozinho, administrado por via oral, foi teratogênico em ratos e coelhos em 1.600 e 65.000 vezes o MRHDID, respectivamente. O fumarato de formoterol também foi embriocida, aumentou a perda de filhotes ao nascimento e durante a lactação e diminuiu o peso dos filhotes em ratos em 110 vezes o MRHDID. Esses efeitos adversos geralmente ocorreram em grandes múltiplos do MRHDID quando o fumarato de formoterol foi administrado por via oral para atingir altas exposições sistêmicas. Não foram observados efeitos teratogênicos, embriocidas ou de desenvolvimento em ratos que receberam doses de inalação até 375 vezes o MRHDID.
risco de fundo estimado de grandes defeitos congênitos e aborto das populações indicadas é desconhecido. Na população geral dos EUA, o risco de fundo estimado de defeitos congênitos graves e aborto espontâneo em gestações clinicamente reconhecidas é de 2% a 4% e 15% a 20%, respectivamente.
Considerações Clínicas
Risco materno e/ou embrionário/fetal associado à doença
Em mulheres com asma mal ou moderadamente controlada, há um risco aumentado de vários desfechos adversos perinatais, como pré-eclâmpsia na mãe e prematuridade, baixo peso ao nascer e pequeno para a idade gestacional no recém-nascido. As mulheres grávidas com asma devem ser monitoradas de perto e a medicação ajustada conforme necessário para manter o controle ideal da asma.
Mão de obra ou entrega
Não há estudos humanos bem controlados que investigaram os efeitos de SYMBICORT 4,5mcg durante o trabalho de parto e parto. Devido ao potencial de interferência do beta-agonista na contratilidade uterina, o uso de SYMBICORT 4,5mcg durante o trabalho de parto deve ser restrito às pacientes em que os benefícios superam claramente o risco.
Dados
Dados humanos
Estudos em mulheres grávidas não demonstraram que a budesonida inalada aumenta o risco de anormalidades quando administrada durante a gravidez. Os resultados de um grande estudo epidemiológico de coorte prospectivo de base populacional revisando dados de três registros suecos cobrindo aproximadamente 99% das gestações de 1995-1997 (ou seja, Registro Médico Sueco de Nascimento; Registro de Malformações Congênitas; Registro de Cardiologia Infantil) não indicam risco aumentado para malformações congênitas decorrentes do uso de budesonida inalatória durante o início da gravidez. As malformações congênitas foram estudadas em 2014 bebês nascidos de mães que relataram o uso de budesonida inalatória para asma no início da gravidez (geralmente 10-12 semanas após a última menstruação), período em que ocorrem a maioria das malformações de órgãos importantes. A taxa de malformações congênitas registradas foi semelhante à taxa da população geral (3,8% vs. 3,5%, respectivamente). Além disso, após a exposição à budesonida inalatória, o número de bebês nascidos com fissuras orofaciais foi semelhante ao número esperado na população normal (4 crianças vs. 3,3, respectivamente).
Esses mesmos dados foram utilizados em um segundo estudo, totalizando 2.534 crianças cujas mães foram expostas à budesonida inalatória. Neste estudo, a taxa de malformações congênitas entre os bebês cujas mães foram expostas à budesonida inalatória no início da gravidez não foi diferente da taxa de todos os recém-nascidos durante o mesmo período (3,6%).
Dados de animais
SIMBICORT
Em um estudo de desenvolvimento embriofetal em ratas prenhas, administrado durante o período de organogênese dos dias de gestação 6-16, SYMBICORT 160mg produziu hérnia umbilical em fetos em doses menores que o MRHDID (em uma base de mcg/m² em doses inalatórias maternas de 12/ 0,66 mcg/kg/dia e acima). Os pesos fetais foram reduzidos em aproximadamente 5 e 3 vezes o MRHDID, respectivamente (com base na AUC em uma dose materna inalatória de 80/4,4 mcg/kg (budesonida/formoterol)). Não foram detectados efeitos teratogénicos ou embriocidas com doses inferiores à MRHDID (com base em mcg/m² numa dose materna inalada de 2,5/0,14 mcg/kg/dia).
Budesonida
Em um estudo de fertilidade e reprodução, ratos machos foram administrados por via subcutânea por 9 semanas e fêmeas por 2 semanas antes do pareamento e durante todo o período de acasalamento. As fêmeas foram dosadas até o desmame de seus filhotes. A budesonida causou uma diminuição na viabilidade e viabilidade pré-natal nos filhotes ao nascimento e durante a lactação, juntamente com uma diminuição no ganho de peso corporal materno, em doses menores do que o MRHDID (em uma base de mcg/m² em doses subcutâneas maternas de 20 mcg/ kg/dia e acima). Não foram observados tais efeitos com uma dose inferior à MRHDID (em uma base de mcg/m² em uma dose subcutânea materna de 5 mcg/kg/dia).
Em um estudo de desenvolvimento embriofetal em coelhas grávidas, administrado durante o período de organogênese dos dias 6 a 18 de gestação, a budesonida produziu perda fetal, diminuição do peso fetal e anormalidades esqueléticas em doses menores do que o MRHDID (em uma base de mcg/m² em uma subcutânea materna de 25 mcg/kg/dia). Em um estudo de desenvolvimento embriofetal em ratas prenhas administrada durante o período de organogênese dos dias 6 a 15 de gestação, a budesonida produziu efeitos adversos fetais semelhantes em doses aproximadamente 8 vezes a MRHDID (em uma base de mcg/m² em uma dose subcutânea materna de 500 mcg/kg/dia). Em outro estudo de desenvolvimento embriofetal em ratas grávidas, não foram observados efeitos teratogênicos ou embriocidas em doses até 4 vezes a MRHDID (numa base de mcg/m² em doses de inalação materna de até 250 mcg/kg/dia).
Em um estudo de desenvolvimento peri e pós-natal, em ratos que receberam doses do dia 15 da gestação ao dia 21 pós-parto, budesonida não teve efeito no parto, mas teve efeito no crescimento e desenvolvimento da prole. A sobrevivência da prole foi reduzida e a prole sobrevivente diminuiu o peso corporal médio ao nascimento e durante a lactação em doses menores do que o MRHDID e superiores (em uma base de mcg/m² em doses subcutâneas maternas de 20 mcg/kg/dia e superiores). Esses achados ocorreram na presença de toxicidade materna.
Formoterol
Em um estudo de fertilidade e reprodução, ratos machos foram administrados por via oral por 9 semanas e fêmeas por 2 semanas antes do pareamento e durante todo o período de acasalamento. As fêmeas foram dosadas até o 19º dia de gestação ou até o desmame de seus filhotes. Os machos receberam doses até 25 semanas. Hérnia umbilical foi observada em fetos de ratos em doses orais 1600 vezes e maiores do que o MRHDID (em uma base de mcg/m² em doses orais maternas de 3000 mcg/kg/dia e superiores). Braquignatia foi observada em fetos de ratos em uma dose 8.000 vezes a MRHDID (em uma base de mcg/m² em uma dose oral materna de 15.000 mcg/kg/dia). A gravidez foi prolongada com uma dose 8.000 vezes a MRHDID (numa base de mcg/m² com uma dose oral materna de 15.000 mcg/kg/dia). Mortes fetais e de filhotes ocorreram em doses aproximadamente 1.600 vezes o MRHDID e superiores (em uma base de mcg/m² em doses orais de 3.000 mcg/kg/dia e superiores) durante a gestação.
Em um estudo de desenvolvimento embriofetal em ratas prenhas administrada durante o período de organogênese dos dias de gestação 6-15, não foram observados efeitos teratogênicos, embriocidas ou de desenvolvimento em doses até 375 vezes o MRHDID (numa base de mcg/m² com inalação materna doses até 690 mcg/kg/dia).
Em um estudo de desenvolvimento embriofetal em coelhas grávidas, administrado durante o período de organogênese dos dias de gestação 6-18, cistos subcapsulares no fígado foram observados nos fetos em uma dose 65.000 vezes a MRHDID (numa base de mcg/m² com uma dose oral de 60.000 mcg/kg/dia). Não foram observados efeitos teratogênicos em doses de até 3.800 vezes a MRHDID (numa base de mcg/m² em doses orais maternas de até 3.500 mcg/kg/dia).
Em um estudo de desenvolvimento pré e pós-natal, ratas grávidas receberam formoterol em doses orais de 0, 210, 840 e 3400 mcg/kg/dia do 6º dia de gestação até o período de lactação. A sobrevida dos filhotes foi diminuída desde o nascimento até o 26º dia pós-parto em doses 110 vezes o MRHDID e superiores (em uma base de mcg/m² em doses orais maternas de 210 mcg/kg/dia e superiores), embora não houvesse evidência de dose-resposta relação. Não houve efeitos relacionados ao tratamento no desenvolvimento físico, funcional e comportamental de filhotes de ratos.
Lactação
Resumo do risco
Não existem dados disponíveis sobre os efeitos de SYMBICORT 4,5mcg, budesonida ou fumarato de formoterol na criança amamentada ou na produção de leite. A budesonida, como outros corticosteroides inalatórios, está presente no leite humano [ver Dados ]. Não existem dados disponíveis sobre a presença de fumarato de formoterol no leite humano. O fumarato de formoterol está presente no leite de rato [ver Dados ]. Os benefícios do aleitamento materno para o desenvolvimento e para a saúde devem ser considerados juntamente com a necessidade clínica da mãe de SYMBICORT 4,5 mcg e quaisquer potenciais efeitos adversos no lactente de SYMBICORT 160 mg ou da condição materna subjacente.
Dados
Dados em humanos com budesonida administrado por inalador de pó seco indicam que a dose oral diária total de budesonida disponível no leite materno para o bebê é de aproximadamente 0,3% a 1% da dose inalada pela mãe [ver FARMACOLOGIA CLÍNICA ]. Para SYMBICORT 4,5mcg, espera-se que a dose de budesonida disponível para o lactente no leite materno, como porcentagem da dose materna, seja semelhante.
No estudo de fertilidade e reprodução em ratos, os níveis plasmáticos de formoterol foram medidos em filhotes no dia 15 pós-natal [ver Uso em populações específicas ]. Estimou-se que a concentração plasmática máxima que os filhotes receberam do animal materno, na dose mais alta de 15 mg/kg, após a amamentação foi de 4,4% (0,24 nmol/L para uma ninhada versus 5,5 nmol/L para a mãe) .
Uso Pediátrico
A segurança e a eficácia de SYMBICORT em pacientes com asma com 12 anos de idade ou mais foram estabelecidas em estudos de até 12 meses. Nos dois estudos principais de 12 semanas, duplo-cegos e controlados por placebo nos EUA, 25 pacientes de 12 a 17 anos de idade foram tratados com SYMBICORT duas vezes ao dia [ver Estudos clínicos ]. Os resultados de eficácia nesta faixa etária foram semelhantes aos observados em pacientes com 18 anos ou mais. Não houve diferenças óbvias no tipo ou frequência de eventos adversos relatados nesta faixa etária em comparação com pacientes com 18 anos de idade ou mais.
A segurança e eficácia de SYMBICORT 80/4.5 em pacientes com asma de 6 a menos de 12 anos de idade foram estabelecidas em estudos de até 12 semanas de duração [ver Estudos clínicos ]. O perfil de segurança nesses pacientes foi consistente com o observado em pacientes com 12 anos de idade ou mais que também receberam SYMBICORT [ver REAÇÕES ADVERSAS ].
A segurança e eficácia de SYMBICORT 160mg em pacientes com asma com menos de 6 anos de idade não foram estabelecidas.
Estudos clínicos controlados mostraram que corticosteroides inalados por via oral, incluindo budesonida, um componente de SYMBICORT, podem causar redução na velocidade de crescimento em pacientes pediátricos. Este efeito foi observado na ausência de evidência laboratorial de supressão do eixo HPA, sugerindo que a velocidade de crescimento é um indicador mais sensível de exposição sistêmica a corticosteróides em pacientes pediátricos do que alguns testes comumente usados de função do eixo HPA. O efeito a longo prazo dessa redução na velocidade de crescimento associada aos corticosteróides inalados por via oral, incluindo o impacto na altura final, é desconhecido. O potencial de “recuperação” do crescimento após a descontinuação do tratamento com corticosteroides inalados por via oral não foi adequadamente estudado.
Em um estudo com crianças asmáticas de 5 a 12 anos de idade, aquelas tratadas com budesonida DPI 200 mcg duas vezes ao dia (n=311) tiveram uma redução de 1,1 centímetro no crescimento em comparação com aquelas que receberam placebo (n=418) ao final de um ano ; a diferença entre estes dois grupos de tratamento não aumentou mais ao longo de três anos de tratamento adicional. Ao final de 4 anos, as crianças tratadas com budesonida DPI e as crianças tratadas com placebo apresentaram velocidades de crescimento semelhantes. As conclusões extraídas deste estudo podem ser confundidas pelo uso desigual de corticosteróides nos grupos de tratamento e inclusão de dados de pacientes que atingiram a puberdade durante o curso do estudo.
crescimento de pacientes pediátricos recebendo corticosteroides inalados por via oral, incluindo SYMBICORT, deve ser monitorado. Se uma criança ou adolescente em uso de qualquer corticosteroide parece ter supressão do crescimento, deve ser considerada a possibilidade de que ele/ela seja particularmente sensível a esse efeito. Os potenciais efeitos de crescimento do tratamento prolongado devem ser ponderados em relação aos benefícios clínicos obtidos. Para minimizar os efeitos sistêmicos dos corticosteroides inalados por via oral, incluindo SYMBICORT, cada paciente deve ser titulado para a dosagem mais baixa que efetivamente controle sua asma [ver DOSAGEM E ADMINISTRAÇÃO ].
Uso Geriátrico
Do número total de pacientes com asma tratados com SYMBICORT 160 mg duas vezes ao dia em dois estudos de 12 semanas e um estudo pós-comercialização de 26 semanas, 791 tinham 65 anos ou mais, dos quais 141 tinham 75 anos ou mais.
Nos estudos de DPOC de 6 a 12 meses de duração, 810 pacientes tratados com SYMBICORT 160/4.5, duas inalações duas vezes ao dia tinham 65 anos ou mais e desses, 177 pacientes tinham 75 anos de idade ou mais. Não foram observadas diferenças gerais na segurança ou eficácia entre esses pacientes e pacientes mais jovens, e outras experiências clínicas relatadas não identificaram diferenças nas respostas entre pacientes idosos e pacientes mais jovens.
Assim como com outros produtos contendo beta2-agonistas, deve-se ter cuidado especial ao usar SYMBICORT em pacientes geriátricos com doença cardiovascular concomitante que pode ser adversamente afetada por beta2-agonistas.
Com base nos dados disponíveis para SYMBICORT ou seus componentes ativos, nenhum ajuste de dose de SYMBICORT 4,5mcg em pacientes geriátricos é garantido.
Insuficiência hepática
Estudos farmacocinéticos formais com SYMBICORT não foram conduzidos em pacientes com insuficiência hepática. No entanto, uma vez que tanto a budesonida como o fumarato de formoterol são eliminados predominantemente pelo metabolismo hepático, o comprometimento da função hepática pode levar ao acúmulo de budesonida e fumarato de formoterol no plasma. Portanto, pacientes com doença hepática devem ser monitorados de perto.
Insuficiência renal
Estudos farmacocinéticos formais com SYMBICORT não foram conduzidos em pacientes com insuficiência renal.
SOBREDOSAGEM
SIMBICORT
SYMBICORT contém budesonida e formoterol; portanto, os riscos associados à superdosagem para os componentes individuais descritos abaixo se aplicam a SYMBICORT. Em estudos farmacocinéticos, doses únicas de 960/54 mcg (12 aplicações de SYMBICORT 80/4.5) e 1280/36 mcg (8 aplicações de 160/4.5) foram administradas a pacientes com DPOC. Um total de 1920/54 mcg (12 aplicações de SYMBICORT 160/4.5) foi administrado como uma dose única tanto para indivíduos saudáveis quanto para pacientes com asma. Em um estudo de segurança de longo prazo com controle ativo em pacientes com asma adolescentes e adultos com 12 anos de idade ou mais, SYMBICORT 160/4.5 foi administrado por até 12 meses em doses até duas vezes a dose diária mais alta recomendada. Não foram observadas reações adversas clinicamente significativas em nenhum desses estudos.
Budesonida
O potencial para efeitos tóxicos agudos após sobredosagem de budesonida é baixo. Se usado em doses excessivas por períodos prolongados, podem ocorrer efeitos sistêmicos dos corticosteróides, como hipercorticismo. AVISOS E PRECAUÇÕES ]. A budesonida em cinco vezes a dose mais alta recomendada (3.200 mcg diariamente) administrada a humanos por 6 semanas causou uma redução significativa (27%) na resposta do cortisol plasmático a uma infusão de 6 horas de ACTH em comparação com placebo (+1%). O efeito correspondente de 10 mg de prednisona diariamente foi uma redução de 35% na resposta do cortisol plasmático ao ACTH.
Formoterol
Uma overdose de formoterol provavelmente levaria a um exagero dos efeitos típicos dos beta2agonistas: convulsões, angina, hipertensão, hipotensão, taquicardia, taquiarritmias atriais e ventriculares, nervosismo, dor de cabeça, tremor, palpitações, cãibras musculares, náusea, tontura, distúrbios do sono , acidose metabólica, hiperglicemia, hipocalemia. Tal como acontece com todos os medicamentos simpaticomiméticos, a parada cardíaca e até a morte podem estar associadas ao abuso de formoterol. Nenhuma reação adversa clinicamente significativa foi observada quando o formoterol foi administrado a pacientes adultos com broncoconstrição aguda na dose de 90 mcg/dia por 3 horas ou a asmáticos estáveis 3 vezes ao dia na dose total de 54 mcg/dia por 3 dias.
tratamento da superdosagem de formoterol consiste na descontinuação da medicação juntamente com a instituição de terapia sintomática e/ou de suporte apropriada. O uso criterioso de um betabloqueador cardiosseletivo pode ser considerado, tendo em vista que tal medicação pode produzir broncoespasmo. Não há evidências suficientes para determinar se a diálise é benéfica para a superdosagem de formoterol. A monitorização cardíaca é recomendada em casos de sobredosagem.
CONTRA-INDICAÇÕES
O uso de SYMBICORT é contraindicado nas seguintes condições:
- Tratamento primário do estado de mal asmático ou outros episódios agudos de asma ou DPOC onde são necessárias medidas intensivas.
- Hipersensibilidade a qualquer um dos ingredientes de SYMBICORT.
FARMACOLOGIA CLÍNICA
Mecanismo de ação
SIMBICORT
SYMBICORT contém budesonida e formoterol; portanto, os mecanismos de ação descritos abaixo para os componentes individuais se aplicam ao SYMBICORT. Esses medicamentos representam duas classes de medicamentos (um corticosteroide sintético e um agonista seletivo de beta2-adrenoceptor de longa ação) que têm efeitos diferentes nos índices clínicos, fisiológicos e inflamatórios da DPOC e da asma.
Budesonida
A budesonida é um corticosteróide anti-inflamatório que apresenta atividade glicocorticóide potente e atividade mineralocorticóide fraca. Em modelos in vitro e animais padrão, a budesonida tem aproximadamente uma afinidade 200 vezes maior para o receptor de glicocorticóides e uma potência anti-inflamatória tópica 1000 vezes maior do que o cortisol (ensaio de edema de orelha com óleo de cróton de rato). Como medida da atividade sistêmica, a budesonida é 40 vezes mais potente que o cortisol quando administrada por via subcutânea e 25 vezes mais potente quando administrada por via oral no ensaio de involução do timo de rato.
Em estudos de afinidade do receptor de glicocorticóides, a forma 22R da budesonida foi duas vezes mais ativa que o epímero 22S. Estudos in vitro indicaram que as duas formas de budesonida não se interconvertem.
A inflamação é um componente importante na patogênese da DPOC e da asma. Os corticosteróides têm uma ampla gama de atividades inibitórias contra vários tipos de células (por exemplo, mastócitos, eosinófilos, neutrófilos, macrófagos e linfócitos) e mediadores (por exemplo, histamina, eicosanóides, leucotrienos e citocinas) envolvidos em reações alérgicas e não mediadas por alergia. inflamação. Essas ações anti-inflamatórias dos corticosteróides podem contribuir para sua eficácia na DPOC e na asma.
Estudos em pacientes asmáticos mostraram uma relação favorável entre a atividade anti-inflamatória tópica e os efeitos sistêmicos dos corticosteróides em uma ampla gama de doses de budesonida. Isso é explicado por uma combinação de um efeito anti-inflamatório local relativamente alto, extensa degradação hepática de primeira passagem do fármaco absorvido por via oral (85%-95%) e a baixa potência dos metabólitos formados.
Formoterol
O fumarato de formoterol é um agonista beta2-adrenérgico seletivo de longa ação (agonista beta2) com um rápido início de ação. O fumarato de formoterol inalado atua localmente no pulmão como broncodilatador. Estudos in vitro mostraram que o formoterol tem atividade agonista mais de 200 vezes maior nos receptores beta2 do que nos receptores beta1. A seletividade de ligação in vitro para beta2 sobre beta1-adrenoceptores é maior para formoterol do que para albuterol (5 vezes), enquanto o salmeterol tem uma taxa de seletividade beta2 maior (3 vezes) do que formoterol.
Embora os receptores beta2 sejam os receptores adrenérgicos predominantes no músculo liso brônquico e os receptores beta1 sejam os receptores predominantes no coração, também existem receptores beta2 no coração humano compreendendo 10% a 50% do total de receptores beta-adrenérgicos. A função precisa desses receptores não foi estabelecida, mas eles levantam a possibilidade de que mesmo beta2-agonistas altamente seletivos possam ter efeitos cardíacos.
Os efeitos farmacológicos dos fármacos agonistas dos receptores beta2-adrenérgicos, incluindo o formoterol, são, pelo menos em parte, atribuíveis à estimulação da adenilciclase intracelular, a enzima que catalisa a conversão do trifosfato de adenosina (ATP) em monofosfato cíclico-3', 5'-adenosina. AMP cíclico). Níveis aumentados de AMP cíclico causam relaxamento do músculo liso brônquico e inibição da liberação de mediadores de hipersensibilidade imediata das células, especialmente dos mastócitos.
Testes in vitro mostram que o formoterol é um inibidor da liberação de mediadores de mastócitos, como histamina e leucotrienos, do pulmão humano. O formoterol também inibe o extravasamento de albumina plasmática induzida por histamina em cobaias anestesiadas e inibe o influxo de eosinófilos induzido por alérgenos em cães com hiper-responsividade das vias aéreas. A relevância desses achados in vitro e em animais para humanos é desconhecida.
Farmacodinâmica
Asma
Efeitos cardiovasculares
Em um estudo cruzado de dose única envolvendo 201 pacientes com asma persistente, os tratamentos de dose única de 4,5, 9 e 18 mcg de formoterol em combinação com 320 mcg de budesonida administrados via SYMBICORT foram comparados com budesonida 320 mcg isoladamente. Melhorias ordenadas pela dose no VEF1 foram demonstradas quando comparadas com budesonida. ECGs e amostras de sangue para glicose e potássio foram obtidos após a dose. Para SYMBICORT 4,5mcg, pequenos aumentos médios na glicose sérica e diminuições no potássio sérico (+0,44 mmol/L e -0,18 mmol/L na dose mais alta, respectivamente) foram observados com doses crescentes de formoterol, em comparação com budesonida. Em ECGs, SYMBICORT produziu pequenos aumentos médios relacionados à dose na frequência cardíaca (aproximadamente 3 bpm na dose mais alta) e intervalos QTc (3-6 ms) em comparação com budesonida isoladamente. Nenhum sujeito teve um valor de QT ou QTc ≥500 mseg.
Nos Estados Unidos, cinco estudos de 12 semanas controlados por ativo e placebo e um estudo de 6 meses controlado por ativo avaliaram 2.976 pacientes com 6 anos de idade ou mais com asma. Os efeitos farmacodinâmicos sistêmicos do formoterol (frequência cardíaca/pulsação, pressão arterial, intervalo QTc, potássio e glicose) foram semelhantes em pacientes tratados com SYMBICORT, em comparação com pacientes tratados com formoterol pó seco para inalação 4,5 mcg, 2 inalações duas vezes ao dia. Nenhum paciente apresentou valor de QT ou QTc ≥500 mseg durante o tratamento.
Em três estudos controlados por placebo em adolescentes e adultos com asma, com idade igual ou superior a 12 anos, um total de 1232 doentes (553 doentes no grupo SYMBICORT 160 mg) teve monitorização eletrocardiográfica contínua de 24 horas avaliável. No geral, não houve diferenças importantes na ocorrência de ectopia ventricular ou supraventricular e nenhuma evidência de aumento do risco de arritmia clinicamente significativa no grupo SYMBICORT 160mg comparado ao placebo.
Efeitos do Eixo HPA
Em geral, nenhum efeito clinicamente importante no eixo HPA, medido pelo cortisol urinário de 24 horas, foi observado em pacientes adultos ou adolescentes tratados com SYMBICORT em doses de até 640/18 mcg/dia em comparação com budesonida.
Doença de obstrução pulmonar crônica
Efeitos cardiovasculares
Em dois estudos de função pulmonar com DPOC, com duração de 6 meses e 12 meses, incluindo 3.668 pacientes com DPOC, não foram observadas diferenças clinicamente importantes na frequência de pulso, pressão arterial, potássio e glicose entre SYMBICORT, os componentes individuais de SYMBICORT 160mg e placebo [ver Estudos clínicos ].
Os ECGs registrados em várias consultas clínicas durante o tratamento em ambos os estudos não mostraram diferenças clinicamente importantes para frequência cardíaca, intervalo PR, duração do QRS, frequência cardíaca, sinais de isquemia cardíaca ou arritmias entre SYMBICORT 160/4.5 os monoprodutos e placebo, todos administrados como 2 inalações duas vezes por dia. Com base nos ECGs, 6 pacientes tratados com SYMBICORT 160/4.5, 6 pacientes tratados com formoterol 4,5 mcg e 6 pacientes no grupo placebo apresentaram fibrilação ou flutter atrial que não estava presente na linha de base. Não houve casos de taquicardia ventricular não sustentada nos grupos SYMBICORT 160/4.5, formoterol 4.5 mcg ou placebo.
No estudo de 12 meses, 520 pacientes tiveram monitoramento contínuo de ECG de 24 horas (Holter) avaliável antes da primeira dose e após aproximadamente 1 e 4 meses de tratamento. Não foram observadas diferenças clinicamente importantes em arritmias ventriculares ou supraventriculares, batimentos ectópicos ventriculares ou supraventriculares ou frequência cardíaca entre os grupos tratados com SYMBICORT 160/4.5, formoterol ou placebo tomados como 2 inalações duas vezes ao dia. Com base no monitoramento de ECG (Holter), um paciente em SYMBICORT 160/4.5, nenhum paciente em formoterol 4,5 mcg e três pacientes no grupo placebo apresentaram fibrilação ou flutter atrial que não estava presente na linha de base.
Efeitos do eixo HPA
As medições de cortisol urinário de 24 horas foram coletadas em um subconjunto agrupado (n = 616) de pacientes de dois estudos de função pulmonar da DPOC. Os dados indicaram valores médios de cortisol livre urinário de 24 horas aproximadamente 30% mais baixos após administração crônica (> 6 meses) de SYMBICORT em relação ao placebo. SYMBICORT 4,5 mcg pareceu exibir supressão de cortisol comparável à budesonida 160 mcg isoladamente ou à coadministração de budesonida 160 mcg e formoterol 4,5 mcg. Para pacientes tratados com SYMBICORT 160mg ou placebo por até 12 meses, a porcentagem de pacientes que passou de normal para baixo para esta medida foi geralmente comparável.
Outros produtos de budesonida
Para confirmar que a absorção sistêmica não é um fator significativo na eficácia clínica da budesonida inalatória, um estudo clínico em pacientes com asma foi realizado comparando 400 mcg de budesonida administrados por meio de um inalador dosimetrado pressurizado com espaçador de tubo a 1400 mcg de budesonida oral e placebo . O estudo demonstrou a eficácia da budesonida inalada, mas não da budesonida ingerida por via oral, apesar de níveis sistêmicos comparáveis. Assim, o efeito terapêutico das doses convencionais de budesonida inalada por via oral é amplamente explicado por sua ação direta no trato respiratório.
A budesonida inalada demonstrou diminuir a reatividade das vias aéreas a vários modelos de desafio, incluindo histamina, metacolina, metabissulfito de sódio e monofosfato de adenosina em pacientes com vias aéreas hiperreativas. A relevância clínica desses modelos não é certa.
pré-tratamento com budesonida inalada, 1.600 mcg diariamente (800 mcg duas vezes ao dia) por 2 semanas, reduziu a diminuição aguda (reação de fase inicial) e tardia (reação de fase tardia) no VEF1 após a provocação com alérgeno inalado.
Os efeitos sistêmicos dos corticosteróides inalatórios estão relacionados à exposição sistêmica a tais drogas. Estudos farmacocinéticos demonstraram que em adultos e crianças com asma a exposição sistêmica à budesonida é menor com SYMBICORT 160mg em comparação com budesonida inalada administrada na mesma dose administrada por meio de um inalador de pó seco [ver FARMACOLOGIA CLÍNICA ]. Portanto, espera-se que os efeitos sistêmicos (eixo HPA e crescimento) da budesonida fornecida pelo SYMBICORT não sejam maiores do que o relatado para budesonida inalada quando administrado em doses comparáveis através do inalador de pó seco [ver Uso em populações específicas ].
Efeitos do Eixo HPA
Os efeitos da budesonida inalada administrada através de um inalador de pó seco no eixo HPA foram estudados em 905 adultos e 404 pacientes pediátricos com asma. Para a maioria dos pacientes, a capacidade de aumentar a produção de cortisol em resposta ao estresse, avaliada pelo teste de estimulação com cosintropina (ACTH), permaneceu intacta com o tratamento com budesonida nas doses recomendadas. Para pacientes adultos tratados com 100, 200, 400 ou 800 mcg duas vezes ao dia por 12 semanas, 4%, 2%, 6% e 13%, respectivamente, tiveram uma resposta anormal de cortisol estimulado (pico de cortisol
Outros produtos de formoterol
Embora o efeito farmacodinâmico seja através da estimulação dos receptores beta-adrenérgicos, a ativação excessiva desses receptores geralmente leva a tremores e cãibras do músculo esquelético, insônia, taquicardia, diminuição do potássio plasmático e aumento da glicose plasmática. O formoterol inalado, como outros fármacos agonistas beta2-adrenérgicos, pode produzir efeitos cardiovasculares relacionados à dose e efeitos sobre a glicemia e/ou potássio sérico [ver AVISOS E PRECAUÇÕES ]. Para SYMBICORT 160mg, esses efeitos são detalhados na seção Farmacologia Clínica, Farmacodinâmica, SYMBICORT (12.2).
O uso de drogas LABA pode resultar em tolerância aos efeitos broncoprotetores e broncodilatadores.
Não foi observada hiperresponsividade brônquica de rebote após a interrupção da terapia crônica com beta-agonistas de longa duração.
Farmacocinética
SIMBICORT
Absorção
Budesonida
Assuntos saudáveis
budesonida inalada por via oral é rapidamente absorvida nos pulmões e o pico de concentração é tipicamente atingido em 20 minutos. Após a administração oral de budesonida, o pico de concentração plasmática foi alcançado em cerca de 1 a 2 horas e a disponibilidade sistêmica absoluta foi de 6%-13% devido ao extenso metabolismo de primeira passagem. Em contraste, a maior parte da budesonida entregue aos pulmões foi absorvida sistemicamente. Em indivíduos saudáveis, 34% da dose medida foi depositada no pulmão (conforme avaliado pelo método de concentração plasmática e usando um inalador de pó seco contendo budesonida) com uma disponibilidade sistêmica absoluta de 39% da dose medida.
Após a administração de SYMBICORT 160/4.5, duas ou quatro inalações duas vezes ao dia por 5 dias em indivíduos saudáveis, a concentração plasmática de budesonida geralmente aumentou proporcionalmente à dose. O índice de acumulação para o grupo que recebeu 2 inalações duas vezes ao dia foi de 1,32 para budesonida.
Pacientes com asma
Em um estudo de dose única, doses de SYMBICORT superiores às recomendadas (12 inalações de SYMBICORT 160/4.5) foram administradas a pacientes com asma moderada. O pico de concentração plasmática de budesonida de 4,5 nmol/L ocorreu 20 minutos após a dosagem. Este estudo demonstrou que a exposição sistêmica total à budesonida de SYMBICORT 4,5mcg foi aproximadamente 30% menor do que a de budesonida inalada por meio de um inalador de pó seco (DPI) na mesma dose administrada. Após a administração de SYMBICORT, a meia-vida do componente budesonida foi de 4,7 horas.
Em um estudo de dose repetida, a dose mais alta recomendada de SYMBICORT (160/4,5, duas inalações duas vezes ao dia) foi administrada a pacientes com asma moderada e indivíduos saudáveis por 1 semana. O pico de concentração plasmática de budesonida de 1,2 nmol/L ocorreu em 21 minutos em pacientes com asma. A concentração plasmática máxima de budesonida foi 27% menor em pacientes com asma em comparação com indivíduos saudáveis. No entanto, a exposição sistêmica total de budesonida foi comparável à de pacientes com asma.
As concentrações plasmáticas máximas de budesonida administradas por DPI em adultos com asma foram em média de 0,6 e 1,6 nmol/L em doses de 180 mcg e 360 mcg duas vezes ao dia, respectivamente. Em doentes asmáticos, a budesonida mostrou um aumento linear na AUC e Cmax com o aumento da dose após administração única e repetida de budesonida inalada.
Pacientes com DPOC
Em um estudo de dose única, 12 inalações de SYMBICORT 80/4.5 (dose total 960/54 mcg) foram administradas a pacientes com DPOC. O pico médio de concentração plasmática de budesonida de 3,3 nmol/L ocorreu 30 minutos após a dosagem. A exposição sistêmica à budesonida foi comparável entre SYMBICORT pMDI e a coadministração de budesonida por meio de um inalador dosimetrado e formoterol por meio de um inalador de pó seco (budesonida 960 mcg e formoterol 54 mcg). No mesmo estudo, um grupo aberto de pacientes com asma moderada também recebeu a mesma dose mais alta de SYMBICORT. Para budesonida, os pacientes com DPOC exibiram AUC 12% maior e Cmax 10% menor em comparação com pacientes com asma.
No estudo clínico principal da função pulmonar de 6 meses, os dados farmacocinéticos de estado de equilíbrio da budesonida foram obtidos em um subconjunto de pacientes com DPOC com braços de tratamento de SYMBICORT 4,5 mcg pMDI 160/4,5, SYMBICORT 160 mg pMDI 80/4,5, budesonida 160 mcg, budesonida 160 mcg e formoterol 4,5 mcg administrados juntos, todos administrados como 2 inalações duas vezes ao dia. A exposição sistêmica à budesonida (AUC e Cmax) aumentou proporcionalmente com doses de 80 mcg a 160 mcg e foi geralmente semelhante entre os 3 grupos de tratamento que receberam a mesma dose de budesonida (SYMBICORT 4,5mcg pMDI 160/4,5, budesonida 160 mcg, budesonida 160 mcg e formoterol 4,5 mcg administrados em conjunto).
Formoterol
O formoterol inalado é rapidamente absorvido; as concentrações plasmáticas máximas são normalmente atingidas no primeiro momento de amostragem de plasma, dentro de 5-10 minutos após a dosagem. Tal como acontece com muitos medicamentos para inalação oral, é provável que a maior parte do formoterol inalado seja ingerido e depois absorvido pelo trato gastrointestinal.
Assuntos saudáveis
Após a administração de SYMBICORT (160/4,5, duas ou quatro inalações duas vezes ao dia) por 5 dias em indivíduos saudáveis, a concentração plasmática de formoterol geralmente aumentou proporcionalmente à dose. O índice de acumulação para o grupo que recebeu 2 inalações duas vezes ao dia foi de 1,77 para formoterol.
Pacientes com asma
Em um estudo de dose única, doses de SYMBICORT superiores às recomendadas (12 inalações de SYMBICORT 160/4.5) foram administradas a pacientes com asma moderada. A concentração plasmática máxima de formoterol de 136 pmol ocorreu 10 minutos após a administração. Aproximadamente 8% da dose liberada de formoterol foi recuperada na urina como droga inalterada.
Em um estudo de dose repetida, a dose mais alta recomendada de SYMBICORT (160/4,5, duas inalações duas vezes ao dia) foi administrada a pacientes com asma moderada e indivíduos saudáveis por 1 semana. O pico de concentração plasmática de formoterol de 28 pmol/L ocorreu em 10 minutos em pacientes com asma. A concentração plasmática máxima de formoterol foi cerca de 42% menor em pacientes com asma em comparação com indivíduos saudáveis. No entanto, a exposição sistêmica total de formoterol foi comparável à de pacientes com asma.
Pacientes com DPOC
Após a administração de dose única de 12 inalações de SYMBICORT 80/4.5, o pico médio de concentração plasmática de formoterol de 167 pmol/L foi rapidamente alcançado 15 minutos após a administração. A exposição ao formoterol foi ligeiramente maior (~16-18%) do SYMBICORT 160mg pMDI em comparação com a coadministração de budesonida por meio de um inalador dosimetrado e formoterol por meio de um inalador de pó seco (dose total de budesonida 960 mcg e formoterol 54 mcg). No mesmo estudo, um grupo aberto de pacientes com asma moderada recebeu a mesma dose de SYMBICORT. Os pacientes com DPOC exibiram AUC e Cmax 12-15% maiores para formoterol em comparação com pacientes com asma.
No estudo clínico principal da função pulmonar de 6 meses, os dados farmacocinéticos de estado de equilíbrio do formoterol foram obtidos em um subconjunto de pacientes com DPOC com braços de tratamento de SYMBICORT 160mg pMDI 160/4,5, SYMBICORT 160mg pMDI 80/4,5, formoterol 4,5 mcg, budesonida 160 mcg e formoterol 4,5 mcg administrados juntos, todos administrados como 2 inalações duas vezes ao dia. A exposição sistêmica do formoterol, conforme evidenciado pela AUC, foi cerca de 30% e 16% maior do SYMBICORT pMDI em comparação com o braço de tratamento de formoterol isolado e a coadministração de componentes individuais de budesonida e braço de tratamento de formoterol, respectivamente.
Distribuição
Budesonida
volume de distribuição da budesonida foi de aproximadamente 3 L/kg. Foi 85%-90% ligado às proteínas plasmáticas. A ligação às proteínas foi constante ao longo da faixa de concentração (1-100 nmol/L) alcançada com e excedendo as doses inaladas recomendadas. A budesonida mostrou pouca ou nenhuma ligação à globulina de ligação aos corticosteróides. A budesonida equilibrou-se rapidamente com os glóbulos vermelhos de forma independente da concentração com uma proporção de plasma sanguíneo de cerca de 0,8.
Formoterol
Na faixa de concentração de 10-500 nmol/L, a ligação às proteínas plasmáticas para os enantiômeros RR e SS do formoterol foi de 46% e 58%, respectivamente. As concentrações de formoterol usadas para avaliar a ligação às proteínas plasmáticas foram maiores do que aquelas alcançadas no plasma após a inalação de uma dose única de 54 mcg.
Metabolismo
Budesonida
Estudos in vitro com homogeneizados de fígado humano mostraram que a budesonida foi rápida e extensivamente metabolizada. Dois metabólitos principais formados via biotransformação catalisada pela isoenzima 3A4 (CYP3A4) do citocromo P450 (CYP) foram isolados e identificados como 16α-hidroxiprednisolona e 6ß-hidroxibudesonida. A actividade corticosteróide de cada um destes dois metabolitos foi inferior a 1% da do composto original. Não foram detectadas diferenças qualitativas entre os padrões metabólicos in vitro e in vivo. Inativação metabólica insignificante foi observada em preparações de soro e pulmão humano.
Formoterol
O metabolismo primário do formoterol é por glucuronidação direta e por O-desmetilação seguida de conjugação com metabólitos inativos. As vias metabólicas secundárias incluem deformilação e conjugação de sulfato. CYP2D6 e CYP2C foram identificados como sendo os principais responsáveis pela Odemetilação.
Eliminação
Budesonida
budesonida foi excretada na urina e nas fezes na forma de metabólitos. Aproximadamente 60% de uma dose intravenosa radiomarcada foi recuperada na urina.
Nenhuma budesonida inalterada foi detectada na urina. A forma 22R de budesonida foi preferencialmente eliminada pelo fígado com depuração sistêmica de 1,4 L/min vs. 1,0 L/min para a forma 22S. A meia-vida terminal, de 2 a 3 horas, foi a mesma para ambos os epímeros e independente da dose.
Formoterol
A excreção de formoterol foi estudada em quatro indivíduos saudáveis após administração simultânea de formoterol radiomarcado pelas vias oral e IV. Nesse estudo, 62% do formoterol radiomarcado foi excretado na urina enquanto 24% foi eliminado nas fezes.
Populações Especiais
Geriátrico
A farmacocinética de SYMBICORT 4,5mcg em pacientes geriátricos não foi especificamente estudada.
Pediátrico
As concentrações plasmáticas de budesonida foram medidas após a administração de quatro inalações de SYMBICORT 160/4.5 em um estudo de dose única em pacientes pediátricos com asma, de 6 a menos de 12 anos de idade. As concentrações máximas de budesonida de 1,4 nmol/L ocorreram 20 minutos após a dose. Este estudo também demonstrou que a exposição sistêmica total à budesonida de SYMBICORT 4,5mcg foi aproximadamente 30% menor do que a de budesonida inalada por meio de um inalador de pó seco que também foi avaliado na mesma dose administrada. A Cmax normalizada pela dose e AUC0-inf de budesonida após inalação de dose única em crianças de 6 a menos de 12 anos de idade foram numericamente inferiores às observadas em adultos.
Após 2 inalações de SYMBICORT 160/4.5 duas vezes ao dia, a Cmax e AUC0-6 de formoterol no estado de equilíbrio em crianças de 6 a menos de 12 anos de idade foram comparáveis às observadas em adultos.
Gênero/raça
Não foram realizados estudos específicos para examinar os efeitos de gênero e raça na farmacocinética de SYMBICORT. A análise farmacocinética da população dos dados de SYMBICORT 4,5mcg indica que o sexo não afeta a farmacocinética da budesonida e do formoterol. Nenhuma conclusão pode ser tirada sobre o efeito da raça devido ao baixo número de não caucasianos avaliados para PK.
Mães que amamentam
disposição da budesonida quando administrada por inalação de um inalador de pó seco em doses de 200 ou 400 mcg duas vezes ao dia por pelo menos 3 meses foi estudada em oito mulheres lactantes com asma de 1 a 6 meses após o parto. A exposição sistêmica à budesonida nessas mulheres parece ser comparável à de mulheres não lactantes com asma de outros estudos. O leite materno obtido mais de oito horas após a dose revelou que a concentração máxima de budesonida para as doses diárias totais de 400 e 800 mcg foi de 0,39 e 0,78 nmol/L, respectivamente, e ocorreu dentro de 45 minutos após a administração. A dose oral diária estimada de budesonida do leite materno para o lactente é de aproximadamente 0,007 e 0,014 mcg/kg/dia para os dois regimes de dose usados neste estudo, o que representa aproximadamente 0,3% a 1% da dose inalada pela mãe. Os níveis de budesonida em amostras de plasma obtidas de cinco bebês cerca de 90 minutos após a amamentação (e cerca de 140 minutos após a administração do medicamento à mãe) estavam abaixo dos níveis quantificáveis ( Uso em populações específicas ].
Insuficiência renal ou hepática
Não há dados sobre o uso específico de SYMBICORT em pacientes com insuficiência hepática ou renal. A redução da função hepática pode afetar a eliminação dos corticosteroides. A farmacocinética da budesonida foi afetada pelo comprometimento da função hepática, conforme evidenciado por uma disponibilidade sistêmica dobrada após a ingestão oral. A farmacocinética da budesonida intravenosa foi, no entanto, semelhante em pacientes cirróticos e em indivíduos saudáveis. Dados específicos com formoterol não estão disponíveis, mas como o formoterol é eliminado principalmente por meio do metabolismo hepático, pode-se esperar um aumento da exposição em pacientes com insuficiência hepática grave.
Interações Medicamentosas
Um estudo cruzado de dose única foi realizado para comparar a farmacocinética de oito inalações dos seguintes: budesonida, formoterol e budesonida mais formoterol administrados simultaneamente. Os resultados do estudo indicaram que não houve evidência de interação farmacocinética entre os dois componentes de SYMBICORT.
Inibidores das enzimas do citocromo P450
Cetoconazol
O cetoconazol, um forte inibidor da isoenzima 3A4 do citocromo P450 (CYP) (CYP3A4), a principal enzima metabólica dos corticosteroides, aumentou os níveis plasmáticos de budesonida ingerida por via oral.
Cimetidina
Nas doses recomendadas, a cimetidina, um inibidor não específico das enzimas CYP, teve um efeito leve, mas clinicamente insignificante, na farmacocinética da budesonida oral.
Não foram realizados estudos específicos de interação medicamentosa com formoterol.
Toxicologia e/ou Farmacologia Animal
Pré-clínico
Estudos em animais de laboratório (miniporcos, roedores e cães) demonstraram a ocorrência de arritmias cardíacas e morte súbita (com evidência histológica de necrose miocárdica) quando beta-agonistas e metilxantinas são administrados concomitantemente. O significado clínico destes resultados é desconhecido.
Estudos clínicos
Asma
Pacientes com asma com 12 anos de idade ou mais
Em dois estudos clínicos comparando SYMBICORT 4,5mcg com os componentes individuais, as melhorias na maioria dos desfechos de eficácia foram maiores com SYMBICORT do que com o uso de budesonida ou formoterol isoladamente. Além disso, um estudo clínico mostrou resultados semelhantes entre SYMBICORT e o uso concomitante de budesonida e formoterol em doses correspondentes de inaladores separados.
A segurança e eficácia de SYMBICORT 160mg foram demonstradas em dois estudos clínicos randomizados, duplo-cegos, controlados por placebo nos EUA envolvendo 1.076 pacientes com 12 anos de idade ou mais. As dosagens fixas de SYMBICORT de 160/9 mcg e 320/9 mcg duas vezes ao dia (cada dose administrada como 2 inalações das dosagens de 80/4,5 e 160/4,5 mcg, respectivamente) foram comparadas com os monocomponentes (budesonida e formoterol) e placebo para fornecer informações sobre a dosagem apropriada para cobrir uma gama de gravidade da asma.
Estudo 1: Estudo Clínico com SYMBICORT 160/4.5
Este estudo de 12 semanas avaliou 596 pacientes com 12 anos de idade ou mais comparando SYMBICORT 160/4.5, a combinação livre de budesonida 160 mcg mais formoterol 4,5 mcg em inaladores separados, budesonida 160 mcg, formoterol 4,5 mcg e placebo; cada administrado como 2 inalações duas vezes ao dia. O estudo incluiu um período de run-in de 2 semanas com budesonida 80 mcg, 2 inalações duas vezes ao dia. A maioria dos pacientes tinha asma moderada a grave e estava usando doses moderadas a altas de corticosteróides inalatórios antes da entrada no estudo. A randomização foi estratificada por tratamento prévio com corticosteróide inalatório (71,6% em corticosteróide inalado moderado e 28,4% em altas doses). A porcentagem média do VEF1 previsto no início do estudo foi de 68,1% e foi semelhante entre os grupos de tratamento. Os desfechos co-primários de eficácia foram a média de 12 horas de VEF1 pós-dose na semana 2 e a média de VEF1 pré-dose ao longo do estudo. O estudo também exigiu que os pacientes que satisfizessem um critério predefinido de piora da asma fossem retirados. Os critérios pré-definidos de piora da asma foram diminuição clinicamente importante do VEF1 ou PFE, aumento do uso de albuterol de resgate, despertar noturno por asma, intervenção de emergência ou hospitalização por asma ou necessidade de medicação para asma não permitida pelo protocolo. Para o critério de despertar noturno devido à asma, os pacientes foram autorizados a permanecer no estudo a critério do investigador se nenhum dos outros critérios de piora da asma fossem atendidos. A porcentagem de pacientes que desistem devido a ou atendem a critérios predefinidos para piora da asma é mostrada na Tabela 4.
alteração percentual média da linha de base no VEF1 medido imediatamente antes da dosagem (pré-dose) ao longo de 12 semanas é exibida na Figura 1. Os resultados da dose FEV1 na última visita de estudo disponível (final do tratamento, EOT) também são fornecidos. Os pacientes que receberam SYMBICORT 160/4,5 tiveram melhorias médias significativamente maiores desde a linha de base no VEF1 pré-dose no final do tratamento (0,19 L, 9,4%), em comparação com budesonida 160 mcg (0,10 L, 4,9%), formoterol 4,5 mcg (-0,12). L, -4,8%) e placebo (-0,17 L, -6,9%).
Figura 1: Alteração percentual média da linha de base no VEF1 pré-dose ao longo de 12 semanas (Estudo 1)
INFORMAÇÃO DO PACIENTE
SIMBICORT (SIM-bi-kort) (budesonida 80 mcg e fumarato de formoterol di-hidratado 4,5 mcg) Inalação Aerossol
SIMBICORT (SIM-bi-kort) (budesonida 160 mcg e fumarato de formoterol di-hidratado 4,5 mcg) Inalação Aerossol
O que é SYMBICORT?
SYMBICORT combina um medicamento corticosteróide inalado (ICS), budesonida e um medicamento agonista beta2-adrenérgico de ação prolongada (LABA), formoterol.
- Os corticosteróides inalados ajudam a diminuir a inflamação nos pulmões. A inflamação nos pulmões pode levar a problemas respiratórios.
- Os medicamentos LABA são usados em pessoas com doença pulmonar obstrutiva crônica (DPOC) e asma. Os medicamentos LABA ajudam os músculos ao redor das vias aéreas dos pulmões a ficarem relaxados para evitar sintomas como chiado, tosse, aperto no peito e falta de ar. Esses sintomas podem ocorrer quando os músculos ao redor das vias aéreas se contraem. Isso dificulta a respiração. Em casos graves, a respiração ofegante pode parar a respiração e pode levar à morte se não for tratada imediatamente.
SYMBICORT 4,5mcg não é usado para aliviar problemas respiratórios repentinos e não substituirá um inalador de resgate. SYMBICORT é usado para asma e DPOC da seguinte forma:
- Asma: SYMBICORT é usado para controlar os sintomas da asma e prevenir sintomas como sibilos em adultos e crianças com 6 anos ou mais. SYMBICORT 4,5mcg contém formoterol. Os medicamentos LABA, como o formoterol, quando usados isoladamente, aumentam o risco de morte e hospitalizações por problemas de asma. SYMBICORT contém um ICS e um LABA. Quando um ICS e LABA são usados juntos, não há um aumento significativo do risco de hospitalizações e morte por problemas de asma. SYMBICORT 160mg não é para adultos e crianças com asma que estão bem controladas com um medicamento de controle da asma, como uma dose baixa a média de um CI. SYMBICORT 160mg é para adultos e crianças com asma que precisam de um medicamento ICS e LABA. Não se sabe se SYMBICORT é seguro e eficaz em crianças com menos de 6 anos de idade com asma.
- DPOC: DPOC é uma doença pulmonar de longo prazo (crônica) que inclui bronquite crônica, enfisema ou ambos. SYMBICORT 160/4,5 mcg é usado a longo prazo, como 2 inalações 2 vezes ao dia, para melhorar os sintomas da DPOC para melhorar a respiração e reduzir o número de surtos (o agravamento dos sintomas da DPOC por vários dias).
Não use SYMBICORT:
- para tratar sintomas graves repentinos de asma ou DPOC.
- se você é alérgico a qualquer um dos ingredientes de SYMBICORT. Consulte o final deste folheto para obter uma lista de ingredientes de SYMBICORT.
Antes de usar SYMBICORT, informe seu médico sobre todas as suas condições médicas, inclusive se você:
- tem problemas cardíacos.
- tem pressão alta.
- tem convulsões.
- tem problemas de tireóide.
- tem diabetes.
- tem problemas de fígado.
- tem osteoporose.
- tem um problema no sistema imunológico.
- tem problemas oculares, como aumento da pressão no olho, glaucoma ou catarata.
- são alérgicos a algum medicamento.
- tem qualquer tipo de infecção viral, bacteriana, fúngica ou parasitária.
- estão expostos à catapora ou sarampo.
- estão grávidas ou planejam engravidar. Não se sabe se SYMBICORT 4,5mcg pode prejudicar o feto.
- estão amamentando. A budesonida, um dos ingredientes ativos de SYMBICORT, passa para o leite materno. Você e seu médico devem decidir se você vai tomar SYMBICORT 160mg enquanto estiver amamentando.
Informe o seu médico sobre todos os medicamentos que você toma, incluindo medicamentos prescritos e de venda livre, vitaminas e suplementos de ervas. SYMBICORT e alguns outros medicamentos podem interagir entre si. Isso pode causar efeitos colaterais graves. Informe especialmente o seu médico se estiver a tomar medicamentos antifúngicos ou anti-VIH.
Conheça todos os medicamentos que toma. Mantenha uma lista e mostre-a ao seu médico e farmacêutico sempre que receber um novo medicamento.
Como devo usar SYMBICORT?
Consulte as instruções passo a passo para usar SYMBICORT no final deste folheto de informações ao paciente. Não use SYMBICORT 4,5mcg a menos que seu médico tenha lhe ensinado e você entenda tudo. Pergunte ao seu médico ou farmacêutico se tiver alguma dúvida.
- Use SYMBICORT exatamente como prescrito. Não use SYMBICORT 160mg com mais frequência do que o prescrito. SYMBICORT vem em 2 dosagens. Seu médico prescreveu a dosagem que é melhor para você. Observe as diferenças entre SYMBICORT e seus outros medicamentos inalatórios, incluindo as diferenças no uso prescrito e na aparência física.
- As crianças devem usar SYMBICORT com a ajuda de um adulto, conforme as instruções do profissional de saúde da criança.
- SYMBICORT 160 mg deve ser tomado todos os dias em 2 inalações de manhã e 2 inalações à noite com cerca de 12 horas de intervalo.
- Se você perder uma dose de SYMBICORT 160mg, você deve tomar a próxima dose no mesmo horário que normalmente toma.
- Enxaguar a boca com água e cuspir a água após cada dose (2 inalações) de SYMBICORT. Não engula a água. Isso ajudará a diminuir a chance de contrair uma infecção por fungos (aftas) na boca e na garganta.
- Se você tomar muito SYMBICORT, ligue para o seu médico ou dirija-se imediatamente ao pronto-socorro do hospital mais próximo se tiver quaisquer sintomas incomuns, como piora da falta de ar, dor no peito, aumento da frequência cardíaca ou tremores.
- Não pulverize SYMBICORT 4,5mcg nos olhos. Se você acidentalmente receber SYMBICORT 160mg em seus olhos, lave os olhos com água e se a vermelhidão ou irritação persistir, consulte seu médico.
- Não altere ou interrompa nenhum medicamento usado para controlar ou tratar seus problemas respiratórios. O seu médico irá alterar os seus medicamentos conforme necessário.
- Enquanto estiver usando SYMBICORT 2 vezes ao dia, não use outros medicamentos que contenham LABA por qualquer motivo. Pergunte ao seu médico ou farmacêutico se algum dos seus outros medicamentos são medicamentos LABA.
- SYMBICORT 4,5mcg não alivia os sintomas súbitos. Sempre tenha um medicamento inalador de resgate com você para tratar sintomas súbitos. Se você não tiver um inalador de resgate, ligue para seu médico para prescrever um para você.
- Ligue para o seu médico ou procure atendimento médico imediatamente se:
- seus problemas respiratórios pioram com SYMBICORT.
- você precisa usar seu medicamento inalador de resgate com mais frequência do que o habitual.
- seu medicamento inalador de resgate não funciona tão bem para você no alívio dos sintomas.
- os resultados do medidor de fluxo de pico diminuem. Seu médico lhe dirá os números certos para você.
- seus sintomas não melhoram após o uso regular de SYMBICORT 160mg por 1 semana.
Quais são os possíveis efeitos colaterais do SYMBICORT?
SYMBICORT 4,5mcg pode causar efeitos colaterais graves, incluindo:
- O uso excessivo de um medicamento LABA pode causar:
- dor no peito
- aumento da pressão arterial
- um batimento cardíaco rápido e irregular
- dor de cabeça
- tremor
- nervosismo
- Infecção fúngica na boca ou garganta (aftas). Enxágue a boca com água sem engolir depois de usar SYMBICORT 4,5mcg para ajudar a reduzir sua chance de contrair aftas.
- Pneumonia e outras infecções do trato respiratório inferior. Pessoas com DPOC têm uma chance maior de contrair pneumonia e outras infecções pulmonares. Corticosteróides inalados podem aumentar a chance de contrair pneumonia. Ligue para o seu médico se notar algum destes sintomas:
- aumento na produção de muco (escarro)
- mudança na cor do muco
- febre
- arrepios
- aumento da tosse
- aumento dos problemas respiratórios
- Efeitos no sistema imunológico e maior chance de infecções. Informe o seu médico sobre quaisquer sinais de infecção, tais como:
- febre
- dor
- dores no corpo
- arrepios
- sentindo cansado
- náusea
- vômito
- Insuficiência adrenal. A insuficiência adrenal é uma condição na qual as glândulas adrenais não produzem hormônios esteróides suficientes. Isso pode acontecer quando você para de tomar medicamentos corticosteróides orais e inicia o medicamento corticosteróide inalado.
- Pieira aumentada logo após tomar SYMBICORT. Sempre tenha um inalador de resgate com você para tratar chiado súbito.
- Reações alérgicas graves, incluindo erupção cutânea, urticária, inchaço da face, boca e língua e problemas respiratórios. Ligue para o seu médico ou procure atendimento médico de emergência se tiver algum sintoma de uma reação alérgica grave.
- Baixa densidade mineral óssea. Isso pode acontecer em pessoas que têm uma grande chance de baixa densidade mineral óssea (osteoporose). Seu médico deve verificar isso durante o tratamento com SYMBICORT.
- Crescimento retardado em crianças. crescimento de uma criança deve ser verificado regularmente durante o uso de SYMBICORT.
- Problemas oculares, incluindo glaucoma e catarata. Você deve fazer exames oftalmológicos regulares enquanto estiver usando SYMBICORT.
- Inchaço de seus vasos sanguíneos. Isso pode acontecer em pessoas com asma. Informe o seu médico imediatamente se tiver:
- uma sensação de alfinetes e agulhas ou
- sintomas semelhantes aos da gripe dormência dos braços ou pernas
- dor e inchaço dos seios nasais
- irritação na pele
- Diminuição dos níveis de potássio no sangue (hipocalemia).
- Aumento dos níveis de açúcar no sangue (hiperglicemia).
Os efeitos colaterais mais comuns de SYMBICORT incluem:
Pessoas com asma:
- irritação na garganta
- dor de cabeça
- infecção do trato respiratório superior
- dor de garganta
- inflamação das membranas mucosas dos seios
- gripe (sinusite)
- congestão nasal
- dor nas costas
- vômito
- desconforto estomacal
- aftas na boca e na garganta. Enxaguar a boca com água sem engolir após o uso para ajudar a prevenir aftas
Pessoas com DPOC:
- irritação na garganta.
- aftas na boca e na garganta. Enxágue a boca com água sem engolir após o uso para ajudar a prevenir aftas.
- infecção e inflamação das membranas mucosas dos brônquios (bronquite).
- inflamação das membranas mucosas nos seios da face (sinusite).
- infecção do trato respiratório superior.
Informe o seu médico sobre qualquer efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais de SYMBICORT.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
Você também pode relatar efeitos colaterais à AstraZeneca pelo telefone 1-800-236-9933.
Como devo armazenar SYMBICORT?
- Armazene SYMBICORT em temperatura ambiente entre 20°C e 25°C (68°F a 77°F).
- Guarde SYMBICORT com o bocal para baixo.
- O conteúdo do seu recipiente SYMBICORT está sob pressão. Não perfure ou jogue o recipiente no fogo ou incinerador. Não use ou armazene perto de calor ou chama aberta. O armazenamento acima de 120°F pode causar a explosão do recipiente.
- Deite fora SYMBICORT 160mg quando o contador chegar a zero (“0”) ou 3 meses após retirar SYMBICORT da sua bolsa de alumínio, o que ocorrer primeiro.
- Mantenha SYMBICORT 4,5mcg e todos os medicamentos fora do alcance das crianças.
Informações gerais sobre o uso seguro e eficaz de SYMBICORT.
Os medicamentos às vezes são prescritos para outros fins que não os listados em um folheto de informações ao paciente. Não use SYMBICORT 4,5mcg para uma condição para a qual não foi prescrito. Não dê SYMBICORT a outras pessoas, mesmo que tenham os mesmos sintomas que você. Pode prejudicá-los.
Você pode pedir ao seu médico ou farmacêutico informações sobre SYMBICORT 4,5mcg que foi escrito para profissionais de saúde.
Quais são os ingredientes de SYMBICORT 4,5mcg?
Ingredientes ativos: budesonida micronizada e fumarato de formoterol micronizado dihidratado
Ingredientes inativos: hidrofluroalcano (HFA 227), povidona K25 USP e polietilenoglicol 1000 NF
Instruções de uso
SIMBICORT (SIM-bi-kort)(budesonida 80 mcg e fumarato de formoterol dihidratado 4,5 mcg) Inalação Aerossol
SIMBICORT (SIM-bi-kort) (budesonida 160 mcg e fumarato de formoterol di-hidratado 4,5 mcg) Inalação Aerossol
figura 1  Posição vertical
Posição vertical
Como usar SYMBICORT
Siga as instruções abaixo para usar SYMBICORT. Você vai inspirar (inalar) o medicamento. Se você tiver alguma dúvida, pergunte ao seu médico ou farmacêutico.
Preparando seu inalador SYMBICORT para uso
Figura 2 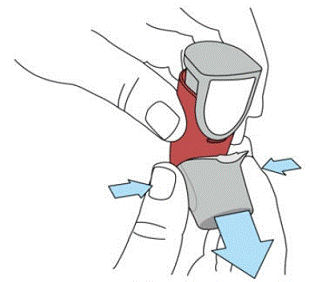
5. Preparando seu inalador SYMBICORT
Antes de usar SYMBICORT pela primeira vez, você precisará prepará-lo. Para preparar SYMBICORT 160mg, segure-o na posição vertical. Consulte a Figura 1. Agite bem o inalador SYMBICORT 4,5mcg por 5 segundos. Segure o inalador SYMBICORT 160mg de costas para você e pressione firme e totalmente a parte superior do balcão do inalador SYMBICORT 160mg para liberar um spray de teste. Em seguida, agite novamente por 5 segundos e libere um segundo spray de teste. Seu inalador SYMBICORT 160mg está preparado e pronto para uso. Depois de preparar o inalador SYMBICORT pela primeira vez, o contador indicará 120 ou 60, dependendo do tamanho que lhe foi fornecido.
Se não utilizar o seu inalador SYMBICORT durante mais de 7 dias ou se o deixar cair, terá de voltar a preparar.
Maneiras de segurar o inalador SYMBICORT 160mg para uso
Figura 3 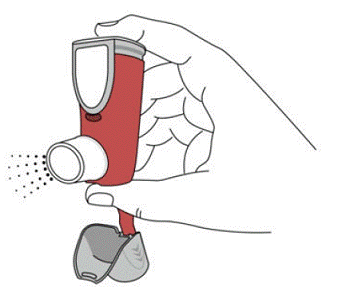
OU
Figura 4 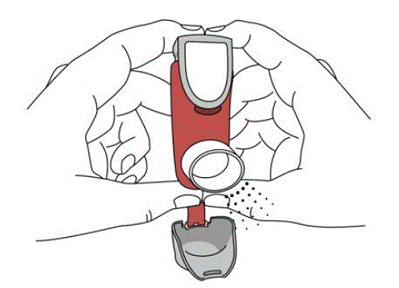
Usando seu inalador SYMBICORT
6. Agite bem o seu inalador SYMBICORT 160mg durante 5 segundos. Remova a tampa do bocal. Verifique o bocal quanto a objetos estranhos.
7. Expire completamente (expire). Segure o inalador SYMBICORT até a boca. Coloque o bocal branco totalmente em sua boca e feche os lábios ao redor dele. Certifique-se de que o inalador SYMBICORT 4,5mcg esteja na vertical e que a abertura do bocal esteja apontando para a parte posterior da garganta (consulte a Figura 5).
Figura 5 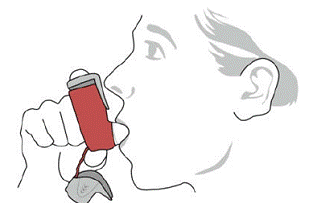
8. Inspire (inspire) profunda e lentamente pela boca. Pressione firme e totalmente a parte superior do balcão do inalador SYMBICORT para liberar o medicamento (veja as Figuras 3 e 4).
9. Continue a inspirar (inspirar) e prender a respiração por cerca de 10 segundos, ou pelo tempo que for confortável. Antes de expirar (expire), solte o dedo da parte superior do balcão. Mantenha o inalador SYMBICORT na vertical e retire-o da boca.
10. Agite novamente o inalador SYMBICORT por 5 segundos e repita as etapas 7 a 9.
Depois de usar o seu inalador SYMBICORT
11. Após o uso, feche a tampa do bocal empurrando até encaixar no lugar.
12. Após terminar de tomar SYMBICORT (2 inalações), lave a boca com água. Cuspa a água. Não o engula.
Lendo o contador
- A seta no contador na parte superior do inalador SYMBICORT aponta para o número de inalações (inalações) restantes no inalador.
CONTADOR 
- O contador fará uma contagem regressiva cada vez que você liberar uma inalação de medicamento (ao preparar seu inalador SYMBICORT ou ao tomar o medicamento).
- Quando a seta no balcão se aproximar de 20, você notará o início de uma área amarela informando que é hora de ligar para o seu médico para reabastecer.
CONTADOR 
- É importante que você preste atenção ao número de inalações (inalações) restantes no seu inalador SYMBICORT 160mg lendo o contador. Deite fora SYMBICORT quando o contador indicar zero (“0”) ou 3 meses após retirar o seu inalador SYMBICORT 160 mg da sua bolsa de alumínio, o que ocorrer primeiro. O seu inalador SYMBICORT pode não parecer vazio e pode continuar a funcionar, mas não receberá a quantidade certa de medicamento se continuar a utilizá-lo. Use um novo inalador SYMBICORT e siga as instruções de preparação (consulte a instrução 5 acima).
Como limpar o seu inalador SYMBICORT
Limpe o bocal branco do seu inalador SYMBICORT 4,5mcg a cada 7 dias. Para limpar o bocal:
- Remova a tampa cinza do bocal
- Limpe o interior e o exterior da abertura branca do bocal com um pano limpo e seco
- Substitua a tampa do bocal
- Não coloque o inalador SYMBICORT na água
- Não tente desmontar o seu SIMBICORT inalador
Estas Informações ao Paciente e Instruções de Uso foram aprovadas pela Food and Drug Administration dos EUA.
