Singulair 10mg, 4mg, 5mg Montelukast Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Singulair e como é usado?
Singulair 5mg é um medicamento de prescrição usado para tratar os sintomas de asma, broncoespasmo induzido por exercício e rinite alérgica ou durante todo o ano (perene). Singulair pode ser usado sozinho ou com outros medicamentos.
- Singulair pertence a uma classe de medicamentos chamados Antagonistas do Receptor de Leucotrienos.
- Não se sabe se Singulair é seguro e eficaz em crianças com menos de 1 ano de idade.
Quais são os possíveis efeitos colaterais do Singulair?
Singulair pode causar efeitos colaterais graves, incluindo:
- mudanças incomuns no humor ou comportamento,
- erupção cutânea,
- contusões,
- formigamento intenso,
- dormência,
- dor,
- fraqueza muscular,
- dor de ouvido,
- inchaço,
- cordialidade,
- febre,
- dor de garganta,
- inchaço no rosto ou na língua,
- queimando em seus olhos, e
- dor na pele, seguida por uma erupção cutânea vermelha ou roxa que se espalha para a parte superior do corpo e causa bolhas e descamação
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Singulair incluem:
- dor de estômago,
- diarréia,
- febre,
- sintomas da gripe,
- sintomas de resfriado (nariz entupido, dor sinusal, tosse, dor de garganta),
- dor de cabeça, e
- enurese ou perda de controle da bexiga em crianças
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Singulair. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
DESCRIÇÃO
O montelucaste de sódio, o ingrediente ativo de SINGULAIR 4 mg, é um antagonista seletivo e ativo do receptor de leucotrienos por via oral que inibe o receptor de cisteína leucotrieno CysLT1.
O montelucaste de sódio é descrito quimicamente como [R-(E)]-1-[[[1-[3-[2-(7-cloro-2-quinolinil)etenil]fenil]-3-[2-(1-hidroxi ácido -1-metiletil)fenil]propil]tio]metil]ciclopropanoacético, sal monossódico.
A fórmula empírica é C35H35ClNNaO3S e seu peso molecular é 608,18. A fórmula estrutural é:
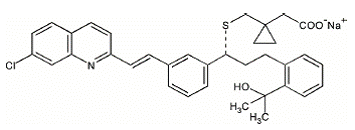
montelucaste de sódio é um pó higroscópico, opticamente ativo, branco a esbranquiçado. O montelucaste de sódio é livremente solúvel em etanol, metanol e água e praticamente insolúvel em acetonitrila.
Cada comprimido revestido por película de 10 mg de SINGULAIR contém 10,4 mg de montelucaste sódico, que é equivalente a 10 mg de montelucaste, e os seguintes ingredientes inativos: celulose microcristalina, lactose monohidratada, croscarmelose sódica, hidroxipropilcelulose e estearato de magnésio. O revestimento de filme consiste em hidroxipropilmetilcelulose, hidroxipropilcelulose, dióxido de titânio, óxido férrico vermelho, óxido férrico amarelo e cera de carnaúba.
Cada comprimido mastigável de 4 mg e 5 mg de SINGULAIR contém 4,2 e 5,2 mg de montelucaste sódico, respectivamente, que são equivalentes a 4 e 5 mg de montelucaste, respectivamente. Ambos os comprimidos mastigáveis contêm os seguintes ingredientes inativos: manitol, celulose microcristalina, hidroxipropilcelulose, óxido férrico vermelho, croscarmelose sódica, aroma de cereja, aspartame e estearato de magnésio.
Cada embalagem de SINGULAIR granulado oral de 4 mg contém 4,2 mg de montelucaste sódico, o que equivale a 4 mg de montelucaste. A formulação granular oral contém os seguintes ingredientes inativos: manitol, hidroxipropilcelulose e estearato de magnésio.
INDICAÇÕES
Asma
SINGULAIR® é indicado para a profilaxia e tratamento crônico da asma em adultos e pacientes pediátricos com idade igual ou superior a 12 meses.
Broncoconstrição Induzida por Exercício (BEI)
SINGULAIR é indicado para a prevenção da broncoconstrição induzida pelo exercício (BIE) em pacientes com 6 anos de idade ou mais.
Rinite alérgica
SINGULAIR 10mg é indicado para o alívio dos sintomas da rinite alérgica sazonal em pacientes com 2 anos de idade ou mais e rinite alérgica perene em pacientes com 6 meses de idade ou mais. Como os benefícios de SINGULAIR 4mg podem não superar o risco de sintomas neuropsiquiátricos em pacientes com rinite alérgica [ver AVISOS E PRECAUÇÕES ], reservam o uso para pacientes que apresentam resposta inadequada ou intolerância a terapias alternativas.
Limitações de uso
SINGULAIR não é indicado para o tratamento de uma crise aguda de asma.
DOSAGEM E ADMINISTRAÇÃO
Asma
Para asma, administrar SINGULAIR por via oral uma vez ao dia à noite, com ou sem alimentos. Não houve ensaios clínicos em pacientes com asma para avaliar a eficácia relativa da administração da manhã versus à noite.
As seguintes doses são recomendadas:
Os pacientes que omitem uma dose devem tomar a próxima dose no horário regular e não devem tomar 2 doses ao mesmo tempo.
Broncoconstrição Induzida por Exercício (BEI)
Para prevenção de BIE, administrar uma dose única de SINGULAIR 10mg por via oral pelo menos 2 horas, antes do exercício. As seguintes doses são recomendadas:
Uma dose adicional de SINGULAIR não deve ser tomada dentro de 24 horas após a dose anterior. Pacientes que já estejam tomando SINGULAIR diariamente para outra indicação (incluindo asma crônica) não devem tomar uma dose adicional para prevenir o BIE. Todos os pacientes devem ter disponível para resgate um β-agonista de curta duração.
A administração diária de SINGULAIR para o tratamento crônico da asma não foi estabelecida para prevenir episódios agudos de BIE.
Rinite alérgica
Para rinite alérgica, administrar SINGULAIR 5mg por via oral uma vez ao dia, independentemente do horário de ingestão do alimento. O tempo de administração em pacientes com rinite alérgica pode ser individualizado para atender às necessidades do paciente.
Recomendam-se as seguintes doses para o tratamento dos sintomas da rinite alérgica sazonal:
Tabela 3: Dosagem Recomendada na Rinite Alérgica Sazonal
Os pacientes que omitem uma dose devem tomar a próxima dose no horário regular e não devem tomar 2 doses ao mesmo tempo.
Asma e Rinite Alérgica
Para pacientes com asma e rinite alérgica, administrar apenas uma dose de SINGULAIR por via oral uma vez ao dia à noite.
Os pacientes que omitem uma dose devem tomar a próxima dose no horário regular e não devem tomar 2 doses ao mesmo tempo.
Instruções para administração de grânulos orais
Os grânulos orais de SINGULAIR 4 mg podem ser administrados diretamente na boca, dissolvidos em 1 colher de chá (5 mL) de fórmula infantil fria ou à temperatura ambiente ou leite materno, ou misturados com uma colher de alimentos macios frios ou à temperatura ambiente; com base em estudos de estabilidade, apenas molho de maçã, cenoura, arroz ou sorvete devem ser usados. O pacote não deve ser aberto até que esteja pronto para uso. Após a abertura da embalagem, a dose completa (com ou sem mistura com fórmula infantil, leite materno ou alimentos) deve ser administrada em 15 minutos. Se misturado com fórmula infantil, leite materno ou alimentos, SINGULAIR 4mg granulado oral não deve ser armazenado para uso futuro. Descarte qualquer porção não utilizada. Os grânulos orais de SINGULAIR não se destinam a ser dissolvidos em nenhum líquido que não seja fórmula infantil ou leite materno para administração. No entanto, líquidos podem ser tomados após a administração. SINGULAIR granulado oral pode ser administrado independentemente do horário das refeições.
COMO FORNECIDO
Formas de dosagem e pontos fortes
Comprimidos
Comprimidos revestidos por película de 10 mg, bege, redondos, quadrados, com o código MSD 117 de um lado e SINGULAIR 4 mg do outro.
Comprimidos mastigáveis
5 mg, rosa, redondo, biconvexo, com código MSD 275 de um lado e SINGULAIR do outro.
Comprimidos mastigáveis
4 mg, rosa, oval, biconvexo, com código MSD 711 de um lado e SINGULAIR do outro.
Grânulos orais
4 mg, grânulos brancos com 500 mg de peso líquido, embalados em embalagem de alumínio resistente a crianças.
Armazenamento e manuseio
SINGULAIR 4 mg grânulos orais : grânulos brancos com 500 mg de peso líquido, embalados em embalagem de alumínio resistente a crianças.
NDC 0006-3841-30 unidade de uso cartonado com 30 pacotes.
SINGULAIR 4 mg comprimidos : comprimidos mastigáveis cor-de-rosa, ovais, biconvexos, com o código MSD 711 de um lado e SINGULAIR 10mg do outro.
NDC 0006-1711-31 unidade de uso Frascos de polietileno de alta densidade (PEAD) de 30 com tampa de polipropileno resistente a crianças, selo de indução em folha de alumínio e dessecante de sílica gel.
SINGULAIR 5 mg comprimidos comprimidos mastigáveis cor-de-rosa, redondos, biconvexos, com o código MSD 275 de um lado e SINGULAIR do outro.
NDC 0006-9275-31 unidade de uso Frascos de polietileno de alta densidade (PEAD) de 30 com tampa de polipropileno resistente a crianças, selo de indução de folha de alumínio e dessecante de sílica gel.
SINGULAIR 10 mg comprimidos : comprimidos revestidos por película de cor bege, redondos, quadrados, com o código MSD 117 numa das faces e SINGULAIR 4 mg na outra.
NDC 0006-9117-31 unidade de uso frascos de polietileno de alta densidade (HDPE) de 30 com tampa de polipropileno resistente a crianças, selo de indução de folha de alumínio e dessecante de sílica gel
NDC 0006-9117-54 unidade de uso Frascos de polietileno de alta densidade (PEAD) de 90 com tampa de polipropileno à prova de crianças, selo de indução de folha de alumínio e dessecante de sílica gel.
Armazenar
Armazenar SINGULAIR grânulos orais de 4 mg, comprimidos para mastigar de 4 mg, comprimidos para mastigar de 5 mg e comprimidos revestidos por película de 10 mg a 20°C a 25°C (68°F a 77°F), com excursões permitidas a 15° C a 30°C (59°F a 86°F) [consulte Temperatura ambiente controlada pela USP]. Proteger da umidade e da luz. Armazenar na embalagem original.
Distribuído por: Merck Sharp & Dohme Corp., uma subsidiária da MERCK & CO., INC., Whitehouse Station, EUA. Revisado: fevereiro de 2021
EFEITOS COLATERAIS
As seguintes reações adversas clinicamente significativas são descritas em outras partes da bula:
- Eventos neuropsiquiátricos [ver AVISOS E PRECAUÇÕES ]
Experiência de Ensaios Clínicos
Como os ensaios clínicos são conduzidos sob condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparadas às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática clínica. Na seguinte descrição da experiência de ensaios clínicos, as reações adversas são listadas independentemente da avaliação da causalidade.
As reações adversas mais comuns (incidência ≥5% e maior que placebo; listadas em ordem decrescente de frequência) em ensaios clínicos controlados foram: infecção do trato respiratório superior, febre, cefaleia, faringite, tosse, dor abdominal, diarreia, otite média, gripe, rinorreia, sinusite, otite.
Adultos e adolescentes de 15 anos ou mais com asma
SINGULAIR 10mg foi avaliado quanto à segurança em aproximadamente 2.950 pacientes adultos e adolescentes com 15 anos de idade ou mais em ensaios clínicos. Em estudos clínicos controlados por placebo, as seguintes reações adversas relatadas com SINGULAIR 4mg ocorreram em mais ou igual a 1% dos pacientes e com incidência maior do que em pacientes tratados com placebo:
A frequência de reações adversas menos comuns foi comparável entre SINGULAIR e placebo.
perfil de segurança de SINGULAIR 10mg, quando administrado em dose única para prevenção de BIE em pacientes adultos e adolescentes com idade igual ou superior a 15 anos, foi consistente com o perfil de segurança previamente descrito para SINGULAIR.
Cumulativamente, 569 pacientes foram tratados com SINGULAIR 10mg por pelo menos 6 meses, 480 por um ano e 49 por dois anos em ensaios clínicos. Com o tratamento prolongado, o perfil de reações adversas não mudou significativamente.
Pacientes pediátricos de 6 a 14 anos de idade com asma
SINGULAIR 10mg foi avaliado quanto à segurança em 476 pacientes pediátricos de 6 a 14 anos de idade. Cumulativamente, 289 pacientes pediátricos foram tratados com SINGULAIR 10mg por pelo menos 6 meses e 241 por um ano ou mais em ensaios clínicos. O perfil de segurança de SINGULAIR no estudo de eficácia pediátrica duplo-cego de 8 semanas foi geralmente semelhante ao perfil de segurança do adulto. Em pacientes pediátricos de 6 a 14 anos de idade recebendo SINGULAIR 5mg, as seguintes reações ocorreram com frequência ≥2% e mais frequentemente do que em pacientes pediátricos que receberam placebo: faringite, gripe, febre, sinusite, náusea, diarreia, dispepsia, otite, infecção viral e laringite. A frequência de reações adversas menos comuns foi comparável entre SINGULAIR 4mg e placebo. Com o tratamento prolongado, o perfil de reações adversas não mudou significativamente.
perfil de segurança de SINGULAIR 4mg, quando administrado em dose única para prevenção de BIE em pacientes pediátricos com 6 anos de idade ou mais, foi consistente com o perfil de segurança previamente descrito para SINGULAIR.
Em estudos que avaliaram a taxa de crescimento, o perfil de segurança nesses pacientes pediátricos foi consistente com o perfil de segurança previamente descrito para SINGULAIR. Em um estudo duplo-cego de 56 semanas avaliando a taxa de crescimento em pacientes pediátricos de 6 a 8 anos de idade recebendo SINGULAIR, as seguintes reações não observadas anteriormente com o uso de SINGULAIR nesta faixa etária ocorreram com uma frequência ≥2% e mais frequentemente do que em pacientes pediátricos que receberam placebo: dor de cabeça, rinite (infecciosa), varicela, gastroenterite, dermatite atópica, bronquite aguda, infecção dentária, infecção cutânea e miopia.
Pacientes pediátricos de 2 a 5 anos de idade com asma
segurança de SINGULAIR foi avaliada em 573 pacientes pediátricos de 2 a 5 anos de idade em estudos de dose única e múltipla. Cumulativamente, 426 pacientes pediátricos de 2 a 5 anos de idade foram tratados com SINGULAIR 10mg por pelo menos 3 meses, 230 por 6 meses ou mais e 63 pacientes por um ano ou mais em estudos clínicos. Em pacientes pediátricos de 2 a 5 anos de idade recebendo SINGULAIR, as seguintes reações ocorreram com frequência ≥2% e mais frequentemente do que em pacientes pediátricos que receberam placebo: febre, tosse, dor abdominal, diarréia, cefaléia, rinorréia, sinusite, otite, gripe, erupção cutânea, dor de ouvido, gastroenterite, eczema, urticária, varicela, pneumonia, dermatite e conjuntivite.
Pacientes pediátricos de 6 a 23 meses de idade com asma
A segurança e a eficácia em pacientes pediátricos com menos de 12 meses de idade com asma não foram estabelecidas.
SINGULAIR 4mg foi avaliado quanto à segurança em 175 pacientes pediátricos de 6 a 23 meses de idade. O perfil de segurança de SINGULAIR em um estudo clínico de 6 semanas, duplo-cego, controlado por placebo foi geralmente semelhante ao perfil de segurança em pacientes adultos e pediátricos de 2 a 14 anos de idade. Em pacientes pediátricos de 6 a 23 meses de idade recebendo SINGULAIR 5mg, as seguintes reações ocorreram com frequência ≥2% e mais frequentemente do que em pacientes pediátricos que receberam placebo: infecção respiratória superior, sibilos; inflamação na orelha; faringite, amigdalite, tosse; e rinite. A frequência de reações adversas menos comuns foi comparável entre SINGULAIR e placebo.
Adultos e adolescentes com 15 anos ou mais com rinite alérgica sazonal
SINGULAIR foi avaliado quanto à segurança em 2.199 pacientes adultos e adolescentes com 15 anos de idade ou mais em ensaios clínicos. SINGULAIR 10mg administrado uma vez ao dia pela manhã ou à noite teve um perfil de segurança semelhante ao do placebo. Em estudos clínicos controlados com placebo, a seguinte reação foi relatada com SINGULAIR 5mg com frequência ≥1% e incidência maior que placebo: infecção respiratória superior, 1,9% dos pacientes recebendo SINGULAIR 4mg vs. 1,5% dos pacientes recebendo placebo. Em um estudo clínico controlado por placebo de 4 semanas, o perfil de segurança foi consistente com o observado em estudos de 2 semanas. A incidência de sonolência foi semelhante à do placebo em todos os estudos.
Pacientes pediátricos de 2 a 14 anos de idade com rinite alérgica sazonal
SINGULAIR 5mg foi avaliado em 280 pacientes pediátricos de 2 a 14 anos de idade em um estudo de segurança de 2 semanas, multicêntrico, duplo-cego, controlado por placebo e de grupos paralelos. SINGULAIR administrado uma vez ao dia à noite teve um perfil de segurança semelhante ao do placebo. Neste estudo, as seguintes reações ocorreram com frequência ≥2% e com incidência maior que a do placebo: cefaleia, otite média, faringite e infecção respiratória superior.
Adultos e adolescentes com 15 anos ou mais com rinite alérgica perene
SINGULAIR foi avaliado quanto à segurança em 3.357 pacientes adultos e adolescentes com 15 anos de idade ou mais com rinite alérgica perene, dos quais 1.632 receberam SINGULAIR em dois estudos clínicos de 6 semanas. SINGULAIR 10mg administrado uma vez ao dia teve um perfil de segurança consistente com o observado em pacientes com rinite alérgica sazonal e semelhante ao do placebo. Nestes dois estudos, as seguintes reações foram relatadas com SINGULAIR com frequência ≥1% e incidência maior que placebo: sinusite, infecção respiratória superior, sinusite, tosse, epistaxe e aumento da ALT. A incidência de sonolência foi semelhante à do placebo.
Pacientes pediátricos de 6 meses a 14 anos de idade com rinite alérgica perene
segurança em pacientes de 2 a 14 anos de idade com rinite alérgica perene é apoiada pela segurança em pacientes de 2 a 14 anos de idade com rinite alérgica sazonal. A segurança em pacientes de 6 a 23 meses de idade é apoiada por dados de estudos farmacocinéticos e de segurança e eficácia em asma nesta população pediátrica e de estudos farmacocinéticos em adultos.
Experiência pós-marketing
As seguintes reações adversas foram identificadas durante o uso pós-aprovação de SINGULAIR. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento.
Distúrbios do sangue e do sistema linfático aumento da tendência de sangramento, trombocitopenia
Distúrbios do sistema imunológico reações de hipersensibilidade incluindo anafilaxia, infiltração eosinofílica hepática
Distúrbios psiquiátricos incluindo, mas não limitado a, agitação, comportamento agressivo ou hostilidade, ansiedade, depressão, desorientação, perturbação da atenção, anormalidades do sonho, disfemia (gagueira), alucinações, insônia, irritabilidade, comprometimento da memória, sintomas obsessivo-compulsivos, inquietação, sonambulismo, pensamento e comportamento suicida (incluindo suicídio), tiques e tremores [ver AVISO EM CAIXA , AVISOS E PRECAUÇÕES ]
Distúrbios do sistema nervoso sonolência, parestesia/hipoestesia, convulsões
Distúrbios cardíacos palpitações
Distúrbios respiratórios, torácicos e mediastinais epistaxe, eosinofilia pulmonar
Problemas gastrointestinais diarreia, dispepsia, náuseas, pancreatite, vómitos
Distúrbios hepatobiliares Casos de hepatite colestática, lesão hepática hepatocelular e lesão hepática de padrão misto foram relatados em pacientes tratados com SINGULAIR. A maioria destes ocorreu em combinação com outros fatores de confusão, como uso de outros medicamentos, ou quando SINGULAIR foi administrado a pacientes com potencial subjacente para doença hepática, como uso de álcool ou outras formas de hepatite.
Distúrbios da pele e tecido subcutâneo angioedema, hematomas, eritema multiforme, eritema nodoso, prurido, síndrome de Stevens-Johnson/necrólise epidérmica tóxica, urticária
Distúrbios musculoesqueléticos e do tecido conjuntivo artralgia, mialgia incluindo cãibras musculares
Distúrbios renais e urinários enurese em crianças
Distúrbios gerais e condições do local de administração edema
Pacientes com asma em terapia com SINGULAIR podem apresentar eosinofilia sistêmica, às vezes apresentando características clínicas de vasculite consistentes com síndrome de Churg-Strauss, uma condição que é frequentemente tratada com terapia com corticosteroides sistêmicos. Essas reações foram algumas vezes associadas à redução da terapia com corticosteroides orais. Os médicos devem estar atentos à eosinofilia, erupção cutânea vasculítica, agravamento dos sintomas pulmonares, complicações cardíacas e/ou neuropatia presentes em seus pacientes [ver AVISOS E PRECAUÇÕES ].
INTERAÇÕES MEDICAMENTOSAS
Não é necessário ajuste de dose quando SINGULAIR 5mg é coadministrado com teofilina, prednisona, prednisolona, contraceptivos orais, fexofenadina, digoxina, varfarina, gemfibrozil, itraconazol, hormônios tireoidianos, hipnóticos sedativos, agentes anti-inflamatórios não esteroides, benzodiazepínicos, descongestionantes, e indutores enzimáticos do citocromo P450 (CYP) [ver FARMACOLOGIA CLÍNICA ].
AVISOS
Incluído como parte do "PRECAUÇÕES" Seção
PRECAUÇÕES
Eventos neuropsiquiátricos
Eventos neuropsiquiátricos (NP) graves foram relatados com o uso de SINGULAIR. Esses relatos pós-comercialização foram altamente variáveis e incluíram, mas não se limitaram a, agitação, comportamento agressivo ou hostilidade, ansiedade, depressão, desorientação, distúrbios da atenção, anormalidades dos sonhos, disfemia (gagueira), alucinações, insônia, irritabilidade, comprometimento da memória, sintomas obsessivo-compulsivos, inquietação, sonambulismo, pensamentos e comportamentos suicidas (incluindo suicídio), tiques e tremores. Eventos de DN foram relatados em pacientes adultos, adolescentes e pediátricos com e sem história prévia de transtorno psiquiátrico. Eventos de DN foram relatados principalmente durante o tratamento com SINGULAIR 10mg, mas alguns foram relatados após a descontinuação de SINGULAIR 5mg. Estudos em animais mostraram que o montelucaste se distribui no cérebro de ratos [ver FARMACOLOGIA CLÍNICA ]; no entanto, os mecanismos subjacentes aos eventos de NP associados ao SINGULAIR não são bem compreendidos. Com base nos dados disponíveis, é difícil identificar fatores de risco ou quantificar o risco de eventos de DN com o uso de SINGULAIR 10mg.
Devido ao risco de eventos de DN, os benefícios de SINGULAIR podem não superar os riscos em alguns pacientes, particularmente quando os sintomas da doença podem ser leves e tratados adequadamente com terapias alternativas. Reserve o uso de SINGULAIR 4mg para pacientes com rinite alérgica que apresentam resposta inadequada ou intolerância a terapias alternativas [ver INDICAÇÕES ]. Em pacientes com asma ou broncoconstrição induzida por exercício, considere os benefícios e riscos antes de prescrever SINGULAIR.
Discuta os benefícios e riscos do uso de SINGULAIR 10mg com pacientes e cuidadores ao prescrever SINGULAIR. Aconselhe os pacientes e/ou cuidadores a ficarem atentos a mudanças de comportamento ou a novos sintomas de DN ao tomar SINGULAIR. Se forem observadas mudanças no comportamento, ou se ocorrerem novos sintomas de DN ou pensamentos e/ou comportamentos suicidas, aconselhe os pacientes a descontinuar SINGULAIR 10mg e entrar em contato com um profissional de saúde imediatamente. Em muitos casos, os sintomas desapareceram após a interrupção da terapia com SINGULAIR; entretanto, em alguns casos, os sintomas persistiram após a descontinuação de SINGULAIR. Portanto, continue a monitorar e fornecer cuidados de suporte até que os sintomas desapareçam. Reavaliar os benefícios e riscos de reiniciar o tratamento com SINGULAIR 10mg se tais eventos ocorrerem.
Asma Aguda
SINGULAIR não é indicado para uso na reversão de broncoespasmo em crises agudas de asma, incluindo estado de mal asmático. Os pacientes devem ser aconselhados a ter a medicação de resgate adequada disponível. A terapia com SINGULAIR 4mg pode ser continuada durante as exacerbações agudas da asma. Pacientes que apresentam exacerbações de asma após o exercício devem ter disponível para resgate um β-agonista inalatório de curta ação.
Uso concomitante de corticosteróides
Embora a dose de corticosteróide inalado possa ser reduzida gradualmente sob supervisão médica, SINGULAIR não deve ser substituído abruptamente por corticosteróides inalados ou orais.
Sensibilidade à aspirina
Pacientes com sensibilidade conhecida à aspirina devem continuar evitando aspirina ou agentes anti-inflamatórios não esteroides enquanto estiverem tomando SINGULAIR. Embora SINGULAIR seja eficaz na melhora da função das vias aéreas em asmáticos com sensibilidade documentada à aspirina, não demonstrou truncar a resposta broncoconstritora à aspirina e a outros anti-inflamatórios não esteroides em pacientes asmáticos sensíveis à aspirina [ver Estudos clínicos ].
Condições eosinofílicas
Pacientes com asma em terapia com SINGULAIR podem apresentar eosinofilia sistêmica, às vezes apresentando características clínicas de vasculite consistentes com síndrome de Churg-Strauss, uma condição que é frequentemente tratada com terapia com corticosteroides sistêmicos. Esses eventos foram algumas vezes associados à redução da terapia com corticosteroides orais. Os médicos devem estar atentos à eosinofilia, erupção cutânea vasculítica, agravamento dos sintomas pulmonares, complicações cardíacas e/ou neuropatia presentes em seus pacientes. Não foi estabelecida uma associação causal entre SINGULAIR 10mg e essas condições subjacentes [ver REAÇÕES ADVERSAS ].
Risco em pacientes com fenilcetonúria
SINGULAIR 4mg contém aspartame, uma fonte de fenilalanina. A fenilalanina pode ser prejudicial para pacientes com fenilcetonúria (PKU). Cada comprimido mastigável de 4 mg e 5 mg contém 0,674 mg e 0,842 mg de fenilalanina, respectivamente. Antes de prescrever SINGULAIR a um paciente com PKU, considere a quantidade diária combinada de fenilalanina de todas as fontes, incluindo SINGULAIR.
Informações de Aconselhamento do Paciente
Para os comprimidos e comprimidos mastigáveis, aconselhe o paciente e/ou cuidador a ler o rótulo do paciente aprovado pela FDA ( Guia de Medicação ).
Para os grânulos orais, aconselhe o paciente e/ou cuidador a ler o rótulo do paciente aprovado pela FDA ( Guia de Medicação e Instruções de Uso ).
- Aconselhe os pacientes sobre o risco potencial de sintomas neuropsiquiátricos graves e alterações comportamentais com o uso de SINGULAIR [ver AVISOS E PRECAUÇÕES ].
- Discuta os benefícios e riscos de SINGULAIR com os pacientes ao prescrever ou continuar o tratamento com SINGULAIR [ver AVISOS E PRECAUÇÕES ].
- Aconselhe os pacientes a monitorarem mudanças no comportamento ou sintomas neuropsiquiátricos em pacientes tomando SINGULAIR [ver AVISOS E PRECAUÇÕES ].
- Instrua os pacientes a descontinuar SINGULAIR e entrar em contato com um profissional de saúde imediatamente se ocorrerem alterações de comportamento ou pensamento que não sejam típicas do paciente, ou se o paciente desenvolver ideação ou comportamento suicida [ver AVISOS E PRECAUÇÕES ].
- Aconselhe os pacientes a tomar SINGULAIR diariamente conforme prescrito, mesmo quando assintomáticos, bem como durante períodos de piora da asma, e a contatar seus médicos se a asma não estiver bem controlada.
- Avise os pacientes que SINGULAIR oral não é para o tratamento de crises agudas de asma. Eles devem ter à disposição medicamentos β-agonistas inalatórios de curta duração apropriados para tratar as exacerbações da asma. Os pacientes que apresentam exacerbações de asma após o exercício devem ser instruídos a ter disponível para resgate um β-agonista inalatório de curta ação. A administração diária de SINGULAIR para o tratamento crônico da asma não foi estabelecida para prevenir episódios agudos de BIE [ver AVISOS E PRECAUÇÕES ].
- Aconselhe os pacientes a procurar atendimento médico se broncodilatadores inalatórios de ação curta forem necessários com mais frequência do que o habitual ou se for necessário mais do que o número máximo de inalações do tratamento broncodilatador de ação curta prescrito por um período de 24 horas.
- Instrua os pacientes a continuar com outros medicamentos antiasmáticos conforme prescrito, a menos que seja instruído por um médico.
- Instruir os pacientes com sensibilidade conhecida à aspirina a continuar evitando aspirina ou agentes anti-inflamatórios não esteroides enquanto estiverem tomando SINGULAIR [ver AVISOS E PRECAUÇÕES ].
- Informar os pacientes fenilcetonúricos que os comprimidos mastigáveis de 4 mg e 5 mg contêm fenilalanina (uma fonte de aspartame) [ver AVISOS E PRECAUÇÕES ].
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Nenhuma evidência de tumorigenicidade foi observada em estudos de carcinogenicidade de 2 anos em ratos Sprague-Dawley ou 92 semanas em camundongos em doses orais de até 200 mg/kg/dia ou 100 mg/kg/dia, respectivamente. A exposição estimada em ratos foi de aproximadamente 120 e 75 vezes a AUC para adultos e crianças, respectivamente, na dose oral diária máxima recomendada. A exposição estimada em camundongos foi de aproximadamente 45 e 25 vezes a AUC para adultos e crianças, respectivamente, na dose oral diária máxima recomendada.
O montelucaste não demonstrou evidência de atividade mutagênica ou clastogênica nos seguintes ensaios: ensaio de mutagênese microbiana, ensaio de mutagênese em células de mamífero V-79, ensaio de eluição alcalina em hepatócitos de rato, ensaio de aberração cromossômica em células de ovário de hamster chinês e no ensaio de aberração cromossômica da medula óssea de camundongo vivo.
Em estudos de fertilidade em ratos fêmeas, o montelucaste produziu reduções nos índices de fertilidade e fecundidade com uma dose oral de 200 mg/kg (a exposição estimada foi de aproximadamente 70 vezes a AUC para adultos na dose oral diária máxima recomendada). Não foram observados efeitos na fertilidade ou fecundidade feminina com uma dose oral de 100 mg/kg (a exposição estimada foi de aproximadamente 20 vezes a AUC para adultos na dose oral diária máxima recomendada). O montelucaste não teve efeitos na fertilidade em ratos machos em doses orais de até 800 mg/kg (a exposição estimada foi de aproximadamente 160 vezes a AUC para adultos na dose oral diária máxima recomendada).
Uso em populações específicas
Gravidez
Resumo do risco
Os dados disponíveis de estudos de coorte prospectivos e retrospectivos publicados ao longo de décadas com o uso de montelucaste em mulheres grávidas não estabeleceram um risco associado ao medicamento de defeitos congênitos maiores [ver Dados ]. Em estudos de reprodução em animais, não foram observados efeitos adversos no desenvolvimento com a administração oral de montelucaste a ratas e coelhas grávidas durante a organogênese em doses aproximadamente 100 e 110 vezes, respectivamente, a dose oral diária humana máxima recomendada (MRHDOD) com base nas AUCs [ver Dados ].
O risco de fundo estimado de defeitos congênitos graves e aborto espontâneo para a população indicada é desconhecido. Todas as gestações têm um risco histórico de defeitos congênitos, perda ou outros resultados adversos. No
Na população geral dos EUA, o risco de fundo estimado de defeitos congênitos graves e aborto espontâneo em gestações clinicamente reconhecidas é de 2-4% e 15-20%, respectivamente.
Considerações Clínicas
Risco materno e/ou embrionário/fetal associado à doença
A asma mal ou moderadamente controlada na gravidez aumenta o risco materno de desfechos adversos perinatais, como pré-eclâmpsia e prematuridade infantil, baixo peso ao nascer e pequeno para a idade gestacional.
Dados
Dados humanos
Dados publicados de estudos de coorte prospectivos e retrospectivos não identificaram uma associação com o uso de SINGULAIR durante a gravidez e defeitos congênitos maiores. Os estudos disponíveis têm limitações metodológicas, incluindo tamanho de amostra pequeno, em alguns casos coleta de dados retrospectiva e grupos de comparação inconsistentes.
Dados de animais
Em estudos de desenvolvimento embriofetal, montelucaste administrado a ratas e coelhas grávidas durante a organogênese (dias de gestação 6 a 17 em ratos e 6 a 18 em coelhos) não causou nenhum efeito adverso no desenvolvimento em doses orais maternas de até 400 e 300 mg/kg /dia em ratos e coelhos, respectivamente (aproximadamente 100 e 110 vezes a AUC em humanos no MRHDOD, respectivamente).
Lactação
Resumo do risco
Um estudo clínico de lactação publicado relata a presença de montelucaste no leite humano. Dados disponíveis sobre os efeitos do medicamento em bebês, seja diretamente [ver Uso Pediátrico ou através do leite materno, não sugerem um risco significativo de reações adversas por exposição a SINGULAIR. Os efeitos da droga na produção de leite são desconhecidos. Os benefícios do aleitamento materno para o desenvolvimento e para a saúde devem ser considerados juntamente com a necessidade clínica da mãe de SINGULAIR 5mg e quaisquer reações adversas potenciais no lactente de SINGULAIR 10mg ou da condição materna subjacente.
Uso Pediátrico
A segurança e a eficácia de SINGULAIR para asma foram estabelecidas em pacientes pediátricos de 6 a 14 anos de idade. O uso de SINGULAIR 4mg para esta indicação é apoiado por evidências de estudos bem controlados. Os dados de segurança e eficácia neste grupo etário são semelhantes aos observados em adultos [ver REAÇÕES ADVERSAS , FARMACOLOGIA CLÍNICA , Populações Específicas , e Estudos clínicos ].
eficácia de SINGULAIR para o tratamento da rinite alérgica sazonal em pacientes pediátricos de 2 a 14 anos de idade e para o tratamento de rinite alérgica perene em pacientes pediátricos de 6 meses a 14 anos de idade foi estabelecida e é apoiada por extrapolação da eficácia demonstrada em pacientes com 15 anos de idade ou mais com rinite alérgica, bem como a suposição de que o curso da doença, a fisiopatologia e o efeito da droga são substancialmente semelhantes entre essas populações.
A segurança de SINGULAIR 4 mg comprimidos para mastigar em pacientes pediátricos de 2 a 5 anos de idade com asma foi demonstrada por dados adequados e bem controlados [ver REAÇÕES ADVERSAS ]. A eficácia de SINGULAIR 5mg nesta faixa etária é extrapolada da eficácia demonstrada em pacientes com 6 anos de idade ou mais com asma e é baseada em dados farmacocinéticos semelhantes, bem como na suposição de que o curso da doença, a fisiopatologia e o efeito do medicamento são substancialmente semelhantes entre essas populações. A eficácia nesta faixa etária é apoiada por avaliações de eficácia exploratórias de um grande estudo de segurança bem controlado realizado em pacientes de 2 a 5 anos de idade.
A segurança de SINGULAIR 4 mg granulado oral em pacientes pediátricos de 12 a 23 meses de idade com asma foi demonstrada em uma análise de 172 pacientes pediátricos, 124 dos quais foram tratados com SINGULAIR, em um placebo de 6 semanas, duplo-cego. -estudo controlado [ver REAÇÕES ADVERSAS ]. A eficácia do SINGULAIR nesta faixa etária é extrapolada a partir da eficácia demonstrada em pacientes com 6 anos de idade ou mais com asma com base em exposição sistêmica média semelhante (AUC), e que o curso da doença, a fisiopatologia e o efeito da droga são substancialmente semelhantes entre essas populações , apoiado por dados de eficácia de um ensaio de segurança em que a eficácia foi uma avaliação exploratória.
A segurança de SINGULAIR 4 mg e 5 mg comprimidos para mastigar em pacientes pediátricos de 2 a 14 anos com rinite alérgica é apoiada por dados de estudos realizados em pacientes pediátricos de 2 a 14 anos com asma. Um estudo de segurança em pacientes pediátricos de 2 a 14 anos de idade com rinite alérgica sazonal demonstrou um perfil de segurança semelhante [ver REAÇÕES ADVERSAS ]. A segurança de SINGULAIR 4 mg granulado oral em pacientes pediátricos a partir dos 6 meses de idade com rinite alérgica perene é apoiada pela extrapolação de dados de segurança obtidos de estudos realizados em pacientes pediátricos de 6 meses a 23 meses de idade com asma e de dados farmacocinéticos comparando exposições sistêmicas em pacientes de 6 meses a 23 meses de idade com exposições sistêmicas em adultos.
A segurança e eficácia em pacientes pediátricos com idade inferior a 12 meses com asma, 6 meses com rinite alérgica perene e 6 anos com broncoconstrição induzida por exercício não foram estabelecidas.
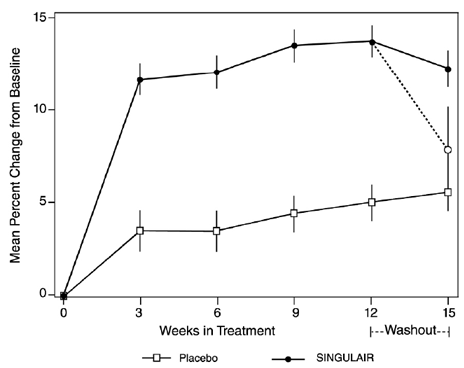
Taxa de crescimento em pacientes pediátricos
Um estudo de grupo paralelo de 56 semanas, multicêntrico, duplo-cego, randomizado, controlado por ativo e placebo foi conduzido para avaliar o efeito de SINGULAIR 4mg na taxa de crescimento em 360 pacientes com asma leve, com idades entre 6 e 8 anos. Os grupos de tratamento incluíram SINGULAIR 5 mg uma vez ao dia, placebo e dipropionato de beclometasona administrado como 168 mcg duas vezes ao dia com um dispositivo espaçador. Para cada sujeito, uma taxa de crescimento foi definida como a inclinação de uma linha de regressão linear ajustada às medidas de altura ao longo de 56 semanas. A comparação primária foi a diferença nas taxas de crescimento entre os grupos SINGULAIR e placebo. As taxas de crescimento, expressas como média dos mínimos quadrados (LS) (IC 95%) em cm/ano, para os grupos de tratamento com SINGULAIR, placebo e beclometasona foram 5,67 (5,46, 5,88), 5,64 (5,42, 5,86) e 4,86 ( 4,64, 5,08), respectivamente. As diferenças nas taxas de crescimento, expressas como média dos mínimos quadrados (LS) (IC 95%) em cm/ano, para os grupos de tratamento SINGULAIR 5mg menos placebo, beclometasona menos placebo e SINGULAIR 5mg menos beclometasona foram de 0,03 (-0,26, 0,31) , -0,78 (-1,06, -0,49); e 0,81 (0,53, 1,09), respectivamente. A taxa de crescimento (expressa como mudança média na altura ao longo do tempo) para cada grupo de tratamento é mostrada na FIGURA 1.
Figura 1: Mudança na Altura (cm) da Visita de Randomização por Semana Agendada (Média do Grupo de Tratamento ± Erro Padrão* da Média)
Uso Geriátrico
Do número total de indivíduos em estudos clínicos de montelucaste, 3,5% tinham 65 anos ou mais e 0,4% tinham 75 anos ou mais. Não foram observadas diferenças gerais na segurança ou eficácia entre esses indivíduos e indivíduos mais jovens, e outras experiências clínicas relatadas não identificaram diferenças nas respostas entre os pacientes idosos e os pacientes mais jovens, mas a maior sensibilidade de alguns indivíduos mais velhos não pode ser descartada. O perfil farmacocinético e a biodisponibilidade oral de uma dose oral única de 10 mg de montelucaste são semelhantes em idosos e adultos jovens. A meia-vida plasmática do montelucaste é ligeiramente maior em idosos. Não é necessário ajuste de dose em idosos.
Insuficiência hepática
Nenhum ajuste de dose é recomendado em pacientes com insuficiência hepática leve a moderada [ver FARMACOLOGIA CLÍNICA ].
Insuficiência renal
Nenhum ajuste de dose é recomendado em pacientes com insuficiência renal [ver FARMACOLOGIA CLÍNICA ].
SOBREDOSAGEM
Nenhuma informação específica está disponível sobre o tratamento de superdosagem com SINGULAIR. Em caso de superdosagem, é razoável empregar as medidas de suporte usuais; por exemplo, remover o material não absorvido do trato gastrointestinal, empregar monitoramento clínico e instituir terapia de suporte, se necessário. Não se sabe se o montelucaste é removido por diálise peritoneal ou hemodiálise.
CONTRA-INDICAÇÕES
SINGULAIR é contraindicado em pacientes com hipersensibilidade a qualquer um de seus componentes.
FARMACOLOGIA CLÍNICA
Mecanismo de ação
Os cisteinil leucotrienos (LTC4, LTD4, LTE4) são produtos do metabolismo do ácido araquidônico e são liberados de várias células, incluindo mastócitos e eosinófilos. Esses eicosanóides se ligam aos receptores de cisteína leucotrieno (CysLT). O receptor CysLT tipo 1 (CysLT1) é encontrado nas vias aéreas humanas (incluindo células do músculo liso das vias aéreas e macrófagos das vias aéreas) e em outras células pró-inflamatórias (incluindo eosinófilos e certas células-tronco mieloides). CysLTs foram correlacionados com a fisiopatologia da asma e rinite alérgica. Na asma, os efeitos mediados por leucotrienos incluem edema das vias aéreas, contração do músculo liso e atividade celular alterada associada ao processo inflamatório. Na rinite alérgica, os CysLTs são liberados da mucosa nasal após a exposição ao alérgeno durante as reações de fase inicial e tardia e estão associados a sintomas de rinite alérgica.
montelucaste é um composto oralmente ativo que se liga com alta afinidade e seletividade ao receptor CysLT1 (de preferência a outros receptores farmacologicamente importantes das vias aéreas, como o receptor prostanóide, colinérgico ou β-adrenérgico). O montelucaste inibe as ações fisiológicas do LTD4 no receptor CysLT1 sem qualquer atividade agonista.
Farmacodinâmica
O montelucaste inibe os receptores de leucotrienos de cisteína das vias aéreas, conforme demonstrado pela capacidade de inibir a broncoconstrição devido ao LTD4 inalado em asmáticos. Doses tão baixas quanto 5 mg causam bloqueio substancial da broncoconstrição induzida por LTD4. Em um estudo cruzado, controlado por placebo (n=12), SINGULAIR 4mg inibiu em 75% e 57% a broncoconstrição de fase precoce e tardia devido à provocação com antígeno em 75% e 57%, respectivamente.
efeito de SINGULAIR 5mg nos eosinófilos no sangue periférico foi examinado em ensaios clínicos. Em pacientes com asma com idade igual ou superior a 2 anos que receberam SINGULAIR 10mg, observou-se uma diminuição na contagem média de eosinófilos no sangue periférico variando de 9% a 15%, em comparação com placebo, durante os períodos de tratamento duplo-cego. Em pacientes com rinite alérgica sazonal com 15 anos ou mais que receberam SINGULAIR 4mg, observou-se um aumento médio de 0,2% na contagem de eosinófilos no sangue periférico, em comparação com um aumento médio de 12,5% em pacientes tratados com placebo, em relação ao tratamento duplo-cego períodos; isso reflete uma diferença média de 12,3% a favor da SINGULAIR. A relação entre essas observações e os benefícios clínicos do montelucaste observados nos ensaios clínicos não é conhecida [ver Estudos clínicos ].
Farmacocinética
Absorção
montelucaste é rapidamente absorvido após administração oral. Após a administração do comprimido revestido por película de 10 mg a adultos em jejum, o pico médio da concentração plasmática de montelucaste (Cmax) é alcançado em 3 a 4 horas (Tmax). A biodisponibilidade oral média é de 64%. A biodisponibilidade oral e a Cmax não são influenciadas por uma refeição padrão pela manhã.
Para o comprimido mastigável de 5 mg, a Cmax média é alcançada em 2 a 2,5 horas após a administração a adultos em jejum. A biodisponibilidade oral média é de 73% em jejum versus 63% quando administrado com uma refeição padrão pela manhã.
Para o comprimido mastigável de 4 mg, a Cmax média é alcançada 2 horas após a administração em pacientes pediátricos de 2 a 5 anos de idade em jejum.
formulação granulada oral de 4 mg é bioequivalente ao comprimido mastigável de 4 mg quando administrado a adultos em jejum. A coadministração da formulação granulada oral com compota de maçã não teve efeito clinicamente significativo na farmacocinética do montelucaste. Uma refeição rica em gordura pela manhã não afetou a AUC do montelucaste granulado oral; no entanto, a refeição diminuiu a Cmax em 35% e prolongou a Tmax de 2,3 ± 1,0 horas para 6,4 ± 2,9 horas.
segurança e eficácia de SINGULAIR em pacientes com asma foram demonstradas em ensaios clínicos nos quais as formulações de comprimidos revestidos por película de 10 mg e comprimidos mastigáveis de 5 mg foram administrados à noite, independentemente do horário de ingestão dos alimentos. A segurança de SINGULAIR 4 mg em pacientes com asma também foi demonstrada em ensaios clínicos nos quais as formulações de comprimidos mastigáveis de 4 mg e grânulos orais de 4 mg foram administrados à noite, independentemente do horário de ingestão dos alimentos. A segurança e a eficácia de SINGULAIR em pacientes com rinite alérgica sazonal foram demonstradas em ensaios clínicos nos quais o comprimido revestido por película de 10 mg foi administrado de manhã ou à noite, independentemente do horário de ingestão dos alimentos.
A farmacocinética comparativa do montelucaste quando administrado como dois comprimidos mastigáveis de 5 mg versus um comprimido revestido por película de 10 mg não foi avaliada.
Distribuição
montelucaste liga-se mais de 99% às proteínas plasmáticas. O volume de distribuição no estado de equilíbrio do montelucaste é em média de 8 a 11 litros. O montelucaste administrado por via oral distribui-se no cérebro de ratos.
Eliminação
A depuração plasmática do montelucaste é em média de 45 mL/min em adultos saudáveis. Após uma dose oral de montelucaste radiomarcado, 86% da radioatividade foi recuperada em coletas fecais de 5 dias e
Em vários estudos, a meia-vida plasmática média do montelucaste variou de 2,7 a 5,5 horas em adultos jovens saudáveis. A farmacocinética do montelucaste é quase linear para doses orais de até 50 mg. Durante a administração de 10 mg de montelucaste uma vez ao dia, há pouca acumulação do fármaco original no plasma (14%).
Metabolismo
montelucaste é extensivamente metabolizado. Em estudos com doses terapêuticas, as concentrações plasmáticas dos metabólitos do montelucaste são indetectáveis no estado de equilíbrio em adultos e pacientes pediátricos.
Estudos in vitro usando microssomas hepáticos humanos indicam que CYP3A4, 2C8 e 2C9 estão envolvidos no metabolismo do montelucaste. Em concentrações clinicamente relevantes, o 2C8 parece desempenhar um papel importante no metabolismo do montelucaste.
Populações Específicas
Pacientes com Insuficiência Hepática
Pacientes com insuficiência hepática leve a moderada e evidência clínica de cirrose apresentaram evidência de metabolismo diminuído de montelucaste, resultando em 41% (IC 90% = 7%, 85%) de AUC média de montelucaste mais alta após uma dose única de 10 mg. A eliminação do montelucaste foi ligeiramente prolongada em comparação com indivíduos saudáveis (meia-vida média, 7,4 horas). Não é necessário ajuste de dose em pacientes com insuficiência hepática leve a moderada. A farmacocinética de SINGULAIR em pacientes com insuficiência hepática mais grave ou com hepatite não foi avaliada.
Pacientes com Insuficiência Renal
Como o montelucaste e seus metabólitos não são excretados na urina, a farmacocinética do montelucaste não foi avaliada em pacientes com insuficiência renal. Nenhum ajuste de dose é recomendado nestes pacientes.
Pacientes Masculinos e Femininos
A farmacocinética do montelucaste é semelhante em homens e mulheres.
Grupos Raciais
As diferenças farmacocinéticas devido à raça não foram estudadas.
Adolescentes e Pacientes Pediátricos
Os estudos farmacocinéticos avaliaram a exposição sistêmica da formulação granular oral de 4 mg em pacientes pediátricos de 6 a 23 meses de idade, os comprimidos mastigáveis de 4 mg em pacientes pediátricos de 2 a 5 anos de idade, os comprimidos mastigáveis de 5 mg em pacientes pediátricos 6 até 14 anos de idade e os comprimidos revestidos por película de 10 mg em adultos jovens e adolescentes ≥15 anos de idade.
perfil de concentração plasmática de montelucaste após a administração do comprimido revestido por película de 10 mg é semelhante em adolescentes ≥15 anos de idade e adultos jovens. O comprimido revestido por película de 10 mg é recomendado para uso em pacientes ≥15 anos de idade.
A exposição sistêmica média do comprimido mastigável de 4 mg em pacientes pediátricos de 2 a 5 anos de idade e dos comprimidos mastigáveis de 5 mg em pacientes pediátricos de 6 a 14 anos de idade é semelhante à exposição sistêmica média do filme de 10 mg. comprimido revestido em adultos. O comprimido mastigável de 5 mg deve ser usado em pacientes pediátricos de 6 a 14 anos de idade e o comprimido mastigável de 4 mg deve ser usado em pacientes pediátricos de 2 a 5 anos de idade.
Em crianças de 6 a 11 meses de idade, a exposição sistêmica ao montelucaste e a variabilidade das concentrações plasmáticas de montelucaste foram maiores do que as observadas em adultos. Com base nas análises da população, a AUC média (4.296 ng•hr/mL [intervalo de 1.200 a 7.153]) foi 60% maior e a Cmax média (667 ng/mL [intervalo de 201 a 1.058]) foi 89% maior do que as observadas em adultos (AUC média 2.689 ng•h/mL [intervalo de 1.521 a 4.595]) e Cmax médio (353 ng/mL [intervalo de 180 a 548]). A exposição sistêmica em crianças de 12 a 23 meses de idade foi menos variável, mas ainda maior do que a observada em adultos. A AUC média (3574 ng•hr/mL [intervalo de 2229 a 5408]) foi 33% maior e a Cmax média (562 ng/mL [intervalo de 296 a 814]) foi 60% maior do que as observadas em adultos. A segurança e a tolerabilidade do montelucaste em um estudo farmacocinético de dose única em 26 crianças de 6 a 23 meses de idade foram semelhantes às de pacientes com dois anos ou mais [ver REAÇÕES ADVERSAS ]. A formulação granular oral de 4 mg deve ser usada para pacientes pediátricos de 12 a 23 meses de idade para o tratamento da asma, ou para pacientes pediátricos de 6 a 23 meses de idade para o tratamento de rinite alérgica perene. Como a formulação granulada oral de 4 mg é bioequivalente ao comprimido mastigável de 4 mg, também pode ser utilizada como formulação alternativa ao comprimido mastigável de 4 mg em pacientes pediátricos de 2 a 5 anos de idade.
Estudos de interação medicamentosa
Teofilina, Prednisona e Prednisolona
SINGULAIR foi administrado com outras terapias usadas rotineiramente na profilaxia e tratamento crônico da asma sem aumento aparente de reações adversas. Em estudos de interação medicamentosa, a dose clínica recomendada de montelucaste não teve efeitos clinicamente importantes na farmacocinética dos seguintes medicamentos: teofilina, prednisona e prednisolona.
Montelucaste na dose de 10 mg uma vez ao dia administrado no estado de equilíbrio farmacocinético, não causou alterações clinicamente significativas na cinética de uma dose intravenosa única de teofilina [predominantemente um substrato do citocromo P450 (CYP) 1A2]. Montelucaste em doses de ≥100 mg por dia administrados no estado de equilíbrio farmacocinético, não causou qualquer alteração clinicamente significativa nos perfis plasmáticos de prednisona ou prednisolona após a administração de prednisona oral ou prednisolona intravenosa.
Anticoncepcionais orais, fexofenadina, digoxina e varfarina
Em estudos de interação medicamentosa, a dose clínica recomendada de montelucaste não teve efeitos clinicamente importantes na farmacocinética dos seguintes medicamentos: contraceptivos orais (noretindrona 1 mg/etinilestradiol 35 mcg), digoxina e varfarina. Montelucaste em doses ≥100 mg por dia administrados até o estado de equilíbrio farmacocinético não alterou significativamente as concentrações plasmáticas de nenhum dos componentes de um contraceptivo oral contendo noretindrona 1 mg/etinilestradiol 35 mcg. Montelucaste na dose de 10 mg uma vez ao dia administrado no estado de equilíbrio farmacocinético não alterou o perfil de concentração plasmática da fexofenadina, não alterou o perfil farmacocinético ou a excreção urinária de digoxina imunorreativa; não alterou o perfil farmacocinético da varfarina (principalmente um substrato de CYP2C9, 3A4 e 1A2) nem influenciou o efeito de uma dose oral única de 30 mg de varfarina no tempo de protrombina ou no International Normalized Ratio (INR).
Hormônios da tireoide, hipnóticos sedativos, agentes anti-inflamatórios não esteroides, benzodiazepínicos e descongestionantes
Embora não tenham sido realizados estudos de interação específicos adicionais, SINGULAIR foi usado concomitantemente com uma ampla gama de medicamentos comumente prescritos em estudos clínicos sem evidência de interações clínicas adversas. Esses medicamentos incluíam hormônios da tireoide, hipnóticos sedativos, agentes anti-inflamatórios não esteroides, benzodiazepínicos e descongestionantes.
Indutores enzimáticos do citocromo P450 (CYP)
O fenobarbital, que induz o metabolismo hepático, diminuiu a área sob a curva de concentração plasmática (AUC) do montelucaste em aproximadamente 40% após uma dose única de 10 mg de montelucaste. Nenhum ajuste de dose para SINGULAIR é recomendado. É razoável empregar monitoramento clínico apropriado quando indutores potentes da enzima CYP, como fenobarbital ou rifampicina, são coadministrados com SINGULAIR.
Efeito do montelucaste nas enzimas do citocromo P450 (CYP)
montelucaste é um potente inibidor do CYP2C8 in vitro. No entanto, dados de um estudo clínico de interação medicamentosa envolvendo montelucaste e rosiglitazona (um substrato de sonda representativo de medicamentos metabolizados principalmente pelo CYP2C8) em 12 indivíduos saudáveis demonstraram que a farmacocinética da rosiglitazona não é alterada quando os medicamentos são coadministrados, indicando que o montelucaste não não inibe o CYP2C8 in vivo. Portanto, não se prevê que o montelucaste altere o metabolismo de medicamentos metabolizados por essa enzima (por exemplo, paclitaxel, rosiglitazona e repaglinida). Com base em outros resultados in vitro em microssomas hepáticos humanos, as concentrações plasmáticas terapêuticas de montelucaste não inibem o CYP 3A4, 2C9, 1A2, 2A6, 2C19 ou 2D6.
Inibidores da Enzima do Citocromo P450 (CYP)
Estudos in vitro demonstraram que o montelucaste é um substrato do CYP 2C8, 2C9 e 3A4. A coadministração de montelucaste com itraconazol, um forte inibidor do CYP 3A4, não resultou em aumento significativo na exposição sistêmica do montelucaste. Dados de um estudo clínico de interação medicamentosa envolvendo montelucaste e gemfibrozil (um inibidor do CYP 2C8 e 2C9) demonstraram que o gemfibrozil, em dose terapêutica, aumentou a exposição sistêmica do montelucaste em 4,4 vezes. A coadministração de itraconazol, gemfibrozil e montelucaste não aumentou ainda mais a exposição sistêmica do montelucaste. Com base na experiência clínica disponível, não é necessário ajuste de dose de montelucaste na coadministração com gemfibrozil [ver SOBREDOSAGEM ].
Estudos clínicos
Asma
Adultos e adolescentes de 15 anos ou mais com asma
Ensaios clínicos em adultos e adolescentes com 15 anos de idade ou mais demonstraram que não há benefício clínico adicional para doses de montelucaste acima de 10 mg uma vez ao dia.
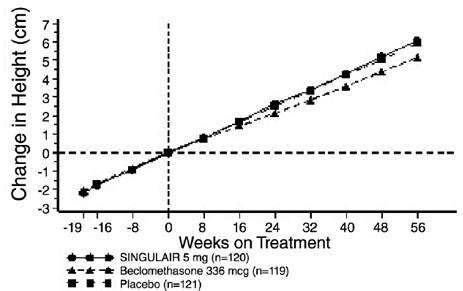
eficácia de SINGULAIR para o tratamento crônico da asma em adultos e adolescentes com 15 anos de idade ou mais foi demonstrada em dois estudos semelhantes, randomizados, de 12 semanas, duplo-cegos, controlados por placebo em 1.576 pacientes ( 795 tratados com SINGULAIR, 530 tratados com placebo e 251 tratados com controle ativo). A idade mediana foi de 33 anos (variação de 15 a 85); 56,8% eram do sexo feminino e 43,2% do sexo masculino. A distribuição étnica/racial nesses estudos foi de 71,6% caucasianos, 17,7% hispânicos, 7,2% de outras origens e 3,5% negros. Os pacientes tinham asma leve ou moderada e não eram fumantes e necessitavam de aproximadamente 5 inalações de β-agonista inalatório por dia, conforme a necessidade. Os pacientes tiveram uma porcentagem média basal do volume expiratório forçado previsto em 1 segundo (VEF1) de 66% (intervalo aproximado, 40 a 90%). Os desfechos co-primários nesses estudos foram VEF1 e sintomas diurnos de asma. Em ambos os estudos após 12 semanas, um subgrupo aleatório de pacientes recebendo SINGULAIR 5mg foi trocado para placebo por mais 3 semanas de tratamento duplo-cego para avaliar possíveis efeitos rebote.
Os resultados do estudo nos EUA sobre o desfecho primário, VEF1 matinal, expressos como alteração percentual média da linha de base média ao longo do período de tratamento de 12 semanas, são mostrados na FIGURA 2. Comparado com placebo, tratamento com um comprimido de SINGULAIR 10 mg diariamente em a noite resultou em um aumento estatisticamente significativo na alteração percentual do VEF1 em relação à linha de base (alteração de 13,0% no grupo tratado com SINGULAIR 4mg versus alteração de 4,2% no grupo placebo, p
Figura 2: Alteração Percentual Média do VEF1 desde a Linha de Base (Teste dos EUA: SINGULAIR 5mg N=406; Placebo N=270) (Modelo ANOVA)
efeito de SINGULAIR 5mg em outros desfechos primários e secundários, representados pelo estudo multinacional, é mostrado na TABELA 6. Os resultados desses desfechos foram semelhantes no estudo norte-americano.
Ambos os estudos avaliaram o efeito de SINGULAIR 4mg em desfechos secundários, incluindo ataque de asma (utilização de recursos de saúde, como visita não programada a um consultório médico, pronto-socorro ou hospital; ou tratamento com administração oral, intravenosa ou corticosteróide intramuscular) e uso de corticosteróide oral para resgate da asma. No estudo multinacional, um número significativamente menor de pacientes (15,6% dos pacientes) com SINGULAIR apresentou crises de asma em comparação com os pacientes que receberam placebo (27,3%, p
Início da ação e manutenção dos efeitos
Em cada estudo controlado por placebo em adultos, o efeito do tratamento de SINGULAIR 4mg, medido por parâmetros diários do cartão diário, incluindo pontuações de sintomas, uso de β-agonista “conforme necessário” e medições de PEFR, foi alcançado após a primeira dose e foi mantido durante todo o intervalo de dosagem (24 horas). Nenhuma mudança significativa no efeito do tratamento foi observada durante a administração contínua uma vez ao dia à noite em estudos de extensão não controlados por placebo por até um ano. A retirada de SINGULAIR 4mg em pacientes asmáticos após 12 semanas de uso contínuo não causou piora rebote da asma.
Pacientes pediátricos de 6 a 14 anos de idade com asma
eficácia de SINGULAIR 5mg em pacientes pediátricos de 6 a 14 anos de idade foi demonstrada em um estudo duplo-cego, controlado por placebo, de 8 semanas em 336 pacientes (201 tratados com SINGULAIR e 135 tratados com placebo) usando um β-agonista inalatório de acordo com a necessidade. Os pacientes tinham uma porcentagem média de VEF1 previsto na linha de base de 72% (intervalo aproximado, 45 a 90%) e uma necessidade média diária de β-agonista inalatório de 3,4 inalações de albuterol. Aproximadamente 36% dos pacientes estavam em uso de corticosteróides inalatórios. A idade mediana foi de 11 anos (variação de 6 a 15); 35,4% eram do sexo feminino e 64,6% do sexo masculino. A distribuição étnica/racial neste estudo foi de 80,1% caucasianos, 12,8% negros, 4,5% hispânicos e 2,7% de outras origens.
Comparado com placebo, o tratamento com um comprimido mastigável de 5 mg de SINGULAIR 4 mg por dia resultou em uma melhora significativa na variação percentual média do VEF1 matinal em relação à linha de base (8,7% no grupo tratado com SINGULAIR 4 mg versus 4,2% de alteração em relação à linha de base no grupo placebo, p
Semelhante aos estudos em adultos, nenhuma mudança significativa no efeito do tratamento foi observada durante a administração contínua uma vez ao dia em um estudo de extensão aberto sem um grupo placebo concomitante por até 6 meses.
Pacientes pediátricos de 2 a 5 anos de idade com asma
A eficácia de SINGULAIR para o tratamento crônico da asma em pacientes pediátricos de 2 a 5 anos de idade foi explorada em um estudo de segurança e tolerabilidade controlado por placebo de 12 semanas em 689 pacientes, 461 dos quais foram tratados com SINGULAIR. A idade mediana foi de 4 anos (variação de 2 a 6); 41,5% eram do sexo feminino e 58,5% do sexo masculino. A distribuição étnica/racial neste estudo foi de 56,5% caucasianos, 20,9% hispânicos, 14,4% de outras origens e 8,3% negros.
Embora o objetivo primário fosse determinar a segurança e a tolerabilidade de SINGULAIR 10mg nessa faixa etária, o estudo incluiu avaliações exploratórias de eficácia, incluindo escores de sintomas de asma diurnos e noturnos, uso de β-agonistas, resgate de corticosteroides orais e avaliação global do médico. Os achados dessas avaliações exploratórias de eficácia, juntamente com a farmacocinética e a extrapolação de dados de eficácia de pacientes idosos, corroboram a conclusão geral de que SINGULAIR é eficaz no tratamento de manutenção da asma em pacientes de 2 a 5 anos de idade.
Efeitos em pacientes em uso concomitante de corticosteróides inalatórios
Ensaios separados em adultos avaliaram a capacidade de SINGULAIR 10mg de aumentar o efeito clínico dos corticosteroides inalatórios e permitir a redução gradual do corticosteroide inalado quando usado concomitantemente.
Um estudo randomizado, controlado por placebo, de grupos paralelos (n = 226) recrutou adultos com asma estável com um VEF1 médio de aproximadamente 84% do previsto que foram previamente mantidos com vários corticosteroides inalatórios (administrados por aerossol dosimetrado ou inaladores de pó seco ). A idade mediana foi de 41,5 anos (variação de 16 a 70); 52,2% eram do sexo feminino e 47,8% do sexo masculino. A distribuição étnica/racial neste estudo foi de 92,0% caucasianos, 3,5% negros, 2,2% hispânicos e 2,2% asiáticos. Os tipos de corticosteroides inalatórios e suas necessidades basais médias incluíram dipropionato de beclometasona (dose média, 1.203 mcg/dia), acetonido de triancinolona (dose média, 2.004 mcg/dia), flunisolida (dose média, 1.971 mcg/dia), propionato de fluticasona (dose média, 1.971 mcg/dia), dose, 1083 mcg/dia), ou budesonida (dose média, 1192 mcg/dia). Alguns desses corticosteróides inalados eram formulações não aprovadas pelos EUA e as doses expressas podem não ser ex-atuador. As necessidades de corticosteróide inalado pré-estudo foram reduzidas em aproximadamente 37% durante um período de introdução de placebo de 5 a 7 semanas, projetado para titular os pacientes em direção à sua menor dose eficaz de corticosteróide inalado. O tratamento com SINGULAIR 4mg resultou em uma redução adicional de 47% na dose média de corticosteroide inalado em comparação com uma redução média de 30% no grupo placebo durante o período de tratamento ativo de 12 semanas (p≤0,05). Não se sabe se os resultados deste estudo podem ser generalizados para pacientes com asma que necessitam de doses mais altas de corticosteroides inalatórios ou corticosteroides sistêmicos.
Em outro estudo randomizado, controlado por placebo, de grupos paralelos (n=642) em uma população semelhante de pacientes adultos previamente mantidos, mas não adequadamente controlados, com corticosteroides inalatórios (beclometasona 336 mcg/dia), a adição de SINGULAIR à beclometasona resultou em melhorias estatisticamente significativas no VEF1 em comparação com os pacientes que continuaram com beclometasona isoladamente ou aqueles pacientes que foram retirados da beclometasona e tratados com montelucaste ou placebo sozinho nas últimas 10 semanas do período de tratamento cego de 16 semanas. Os pacientes que foram randomizados para braços de tratamento contendo beclometasona tiveram um controle da asma estatisticamente significativamente melhor do que aqueles pacientes randomizados para SINGULAIR sozinho ou placebo sozinho, conforme indicado pelo VEF1, sintomas diurnos de asma, PEFR, despertares noturnos devido à asma e β- “conforme necessário” requisitos de agonista.
Em pacientes adultos com asma com sensibilidade documentada à aspirina, quase todos recebendo concomitantemente corticosteroides inalatórios e/ou orais, um estudo randomizado de grupos paralelos de 4 semanas (n=80) demonstrou que SINGULAIR 10mg, comparado com placebo, resultou na melhora significativa dos parâmetros de controle da asma. A magnitude do efeito de SINGULAIR 4mg em pacientes sensíveis à aspirina foi semelhante ao efeito observado na população geral de pacientes asmáticos estudados. O efeito de SINGULAIR na resposta broncoconstritora à aspirina ou a outros anti-inflamatórios não esteroides em pacientes asmáticos sensíveis à aspirina não foi avaliado [ver AVISOS E PRECAUÇÕES ].
Broncoconstrição Induzida por Exercício (BEI)
Broncoconstrição induzida por exercício (adultos, adolescentes e pacientes pediátricos com 6 anos de idade ou mais)
eficácia de SINGULAIR 5mg, 10mg, quando administrado em dose única 2 horas antes do exercício para a prevenção de BIE foi investigada em três estudos cruzados (EUA e Multinacionais), randomizados, duplo-cegos e controlados por placebo que incluíram um total de 160 pacientes adultos e adolescentes com 15 anos ou mais com BEI. O teste de provocação de esforço foi realizado em 2 horas, 8,5 ou 12 horas e 24 horas após a administração de uma dose única do medicamento do estudo (SINGULAIR 10 mg ou placebo). O desfecho primário foi a queda percentual máxima média no VEF1 após o desafio de exercício 2 horas após a dose em todos os três estudos (Estudo A, Estudo B e Estudo C). No Estudo A, uma dose única de SINGULAIR 10 mg demonstrou um benefício protetor estatisticamente significativo contra o BIE quando tomado 2 horas antes do exercício. Alguns pacientes foram protegidos do BIE em 8,5 e 24 horas após a administração; no entanto, alguns pacientes não foram. Os resultados para a queda percentual máxima média em cada ponto de tempo no Estudo A são mostrados na TABELA 7 e são representativos dos resultados dos outros dois estudos.
eficácia de SINGULAIR 5 mg comprimidos mastigáveis, quando administrados em dose única 2 horas antes do exercício para a prevenção de BIE, foi investigada em um estudo cruzado multinacional, randomizado, duplo-cego e controlado por placebo que incluiu um total de 64 pacientes pediátricos pacientes de 6 a 14 anos de idade com BIE. O teste de provocação de esforço foi realizado 2 horas e 24 horas após a administração de uma dose única do medicamento em estudo (SINGULAIR 5 mg ou placebo). O desfecho primário foi a queda percentual máxima média no VEF1 após o desafio de exercício pós-dose de 2 horas. Uma dose única de SINGULAIR 5 mg demonstrou um benefício protetor estatisticamente significativo contra o BEI quando tomado 2 horas antes do exercício (TABELA 8). Resultados semelhantes foram mostrados 24 horas após a dose (um endpoint secundário). Alguns pacientes foram protegidos do BIE 24 horas após a administração; no entanto, alguns pacientes não foram. Nenhum ponto de tempo foi avaliado entre 2 e 24 horas após a dose.
eficácia de SINGULAIR 5mg na prevenção do BIE em pacientes com menos de 6 anos de idade não foi estabelecida.
A administração diária de SINGULAIR 4mg para o tratamento crônico da asma não foi estabelecida para prevenir episódios agudos de BIE.
Em um estudo de 12 semanas, randomizado, duplo-cego, de grupos paralelos de 110 adultos e adolescentes asmáticos com 15 anos de idade ou mais, com VEF1 por cento médio do previsto de 83% e com exacerbação de asma induzida por exercício documentada, o tratamento com SINGULAIR, 10 mg, uma vez ao dia à noite, resultou em uma redução estatisticamente significativa na queda percentual máxima média do VEF1 e no tempo médio de recuperação para dentro de 5% do VEF1 pré-exercício. O desafio de exercício foi realizado no final do intervalo de dosagem (ou seja, 20 a 24 horas após a dose anterior). Este efeito foi mantido durante todo o período de tratamento de 12 semanas, indicando que a tolerância não ocorreu. No entanto, SINGULAIR 4mg não evitou a deterioração clinicamente significativa na queda percentual máxima do VEF1 após o exercício (ou seja, diminuição ≥20% da linha de base pré-exercício) em 52% dos pacientes estudados. Em um estudo cruzado separado em adultos, um efeito semelhante foi observado após duas doses diárias de 10 mg de SINGULAIR.
Em pacientes pediátricos de 6 a 14 anos de idade, usando o comprimido mastigável de 5 mg, um estudo cruzado de 2 dias demonstrou efeitos semelhantes aos observados em adultos quando o desafio de exercício foi realizado no final do intervalo de dosagem (ou seja, 20 a 24 horas após a dose anterior).
Rinite alérgica (sazonal e perene)
Rinite Alérgica Sazonal
A eficácia de SINGULAIR comprimidos para o tratamento da rinite alérgica sazonal foi investigada em 5 estudos de desenho semelhante, randomizados, duplo-cegos, de grupos paralelos, controlados por placebo e ativos (loratadina) conduzidos na América do Norte. Os 5 estudos envolveram um total de 5.029 pacientes, dos quais 1.799 foram tratados com comprimidos de SINGULAIR. Os pacientes tinham 15 a 82 anos de idade com histórico de rinite alérgica sazonal, teste cutâneo positivo para pelo menos um alérgeno sazonal relevante e sintomas ativos de rinite alérgica sazonal no início do estudo.
período de tratamento randomizado foi de 2 semanas em 4 ensaios e 4 semanas em um ensaio. A variável de desfecho primário foi a alteração média da linha de base no escore de sintomas nasais diurnos (a média dos escores individuais de congestão nasal, rinorréia, coceira nasal, espirros), conforme avaliado pelos pacientes em uma escala categórica de 0-3.
Quatro dos cinco estudos mostraram uma redução significativa nos escores de sintomas nasais diurnos com SINGULAIR 10 mg comprimidos em comparação com placebo. Os resultados de um ensaio são mostrados abaixo. A idade mediana neste estudo foi de 35,0 anos (variação de 15 a 81); 65,4% eram do sexo feminino e 34,6% do sexo masculino. A distribuição étnica/racial neste estudo foi de 83,1% caucasianos, 6,4% de outras origens, 5,8% negros e 4,8% hispânicos. As alterações médias da linha de base na pontuação dos sintomas nasais diurnos nos grupos de tratamento que receberam comprimidos de SINGULAIR 4mg, loratadina e placebo são mostradas na TABELA 9. Os três ensaios restantes que demonstraram eficácia mostraram resultados semelhantes. A eficácia foi demonstrada para a rinite alérgica sazonal quando o montelucaste foi administrado de manhã ou à noite.
Rinite Alérgica Perene
eficácia de SINGULAIR 5mg comprimidos para o tratamento da rinite alérgica perene foi investigada em 2 estudos randomizados, duplo-cegos, controlados por placebo, realizados na América do Norte e Europa. Os dois estudos envolveram um total de 3.357 pacientes, dos quais 1.632 receberam comprimidos de SINGULAIR 10 mg. Pacientes de 15 a 82 anos de idade com rinite alérgica perene confirmada pela história e teste cutâneo positivo para pelo menos um alérgeno perene relevante (ácaros, pêlos de animais e/ou esporos de mofo), que apresentavam sintomas ativos no momento do estudo entrada, foram inscritos.
No estudo em que a eficácia foi demonstrada, a idade mediana foi de 35 anos (variação de 15 a 81); 64,1% eram do sexo feminino e 35,9% do sexo masculino. A distribuição étnica/racial neste estudo foi de 83,2% caucasianos, 8,1% negros, 5,4% hispânicos, 2,3% asiáticos e 1,0% de outras origens. Os comprimidos de SINGULAIR 10 mg uma vez ao dia demonstraram reduzir significativamente os sintomas de rinite alérgica perene durante um período de tratamento de 6 semanas (TABELA 10); neste estudo, a variável de desfecho primário foi a alteração média da linha de base no escore de sintomas nasais diurnos (a média dos escores individuais de congestão nasal, rinorreia e espirros).
outro estudo de 6 semanas avaliou SINGULAIR 10 mg (n=626), placebo (n=609) e um controle ativo (cetirizina 10 mg; n=120). A análise primária comparou a alteração média da linha de base no escore de sintomas nasais diurnos para SINGULAIR versus placebo nas primeiras 4 semanas de tratamento; o estudo não foi desenhado para comparação estatística entre SINGULAIR e o controle ativo. A variável de desfecho primário incluiu prurido nasal além de congestão nasal, rinorréia e espirros. A diferença estimada entre SINGULAIR e placebo foi de -0,04 com IC de 95% de (-0,09, 0,01). A diferença estimada entre o controle ativo e placebo foi de -0,10 com um IC de 95% de (-0,19, -0,01).
INFORMAÇÃO DO PACIENTE
SINGULAIR® (SING-u-lair) (montelucaste sódico) comprimidos mastigáveis
Qual é a informação mais importante que devo saber sobre SINGULAIR 4mg?Problemas graves de saúde mental ocorreram em pessoas que tomam SINGULAIR ou mesmo após a interrupção do tratamento.
Isso pode acontecer em pessoas com ou sem histórico de problemas de saúde mental. Pare de tomar SINGULAIR e informe o seu médico imediatamente se você ou seu filho apresentarem quaisquer alterações incomuns de comportamento ou pensamento, incluindo qualquer um destes sintomas:
- agitação, incluindo comportamento agressivo ou hostilidade
- problemas de atenção
- sonhos ruins ou vívidos
- depressão
- desorientação (confusão)
- sentindo ansioso
- irritabilidade
- alucinações (ver ou ouvir coisas que não estão realmente lá)
- problemas de memória
- sintomas obsessivo-compulsivos
- inquietação
- sonambulismo
- engasgando
- pensamentos e ações suicidas (incluindo suicídio)
- tremor
- problemas para dormir
- movimentos musculares descontrolados
O que é SINGULAIR 10mg?
SINGULAIR 4mg é um medicamento de prescrição que bloqueia substâncias no corpo chamadas leucotrienos. Isso pode ajudar a melhorar os sintomas de asma e inflamação do revestimento do nariz (rinite alérgica). SINGULAIR não contém um esteróide. SINGULAIR é usado para:
- alergias ao ar livre que acontecem parte do ano (rinite alérgica sazonal) em adultos e crianças com 2 anos ou mais, e
- alergias internas que ocorrem durante todo o ano (rinite alérgica perene) em adultos e crianças com 6 meses ou mais.
Não faça tome SINGULAIR se você é alérgico a qualquer um de seus componentes. Consulte o final deste Guia de Medicação para obter uma lista completa dos ingredientes de SINGULAIR.
Antes de tomar SINGULAIR 4mg, informe o seu médico sobre todas as suas condições médicas, inclusive se você:
- são alérgicos à aspirina.
- tem fenilcetonúria. Os comprimidos mastigáveis SINGULAIR contêm aspartame, uma fonte de fenilalanina.
- tem ou teve problemas de saúde mental.
- estão grávidas ou planejam engravidar. Fale com o seu médico se estiver grávida ou planeia engravidar, SINGULAIR 4 mg pode não ser adequado para si.
- está amamentando ou planeja amamentar. Não se sabe se SINGULAIR passa para o leite materno. Converse com seu médico sobre a melhor maneira de alimentar seu bebê enquanto estiver tomando SINGULAIR.
Informe o seu médico sobre todos os medicamentos que você toma, incluindo medicamentos prescritos e de venda livre, vitaminas e suplementos de ervas. Alguns medicamentos podem afetar o funcionamento de SINGULAIR, ou SINGULAIR 4mg pode afetar o funcionamento de outros medicamentos.
Como devo tomar SINGULAIR 10mg?
Por alguém quem toma SINGULAIR:
- Leia o detalhado Instruções de uso que vem com grânulos orais SINGULAIR.
- Tome SINGULAIR 4mg exatamente como prescrito pelo seu médico. Seu médico lhe dirá a quantidade de SINGULAIR que você deve tomar e quando tomá-lo.
- Pare de tomar SINGULAIR 5mg e informe o seu médico imediatamente se você ou seu filho apresentarem quaisquer alterações incomuns de comportamento ou pensamento.
- Você pode tomar SINGULAIR 5mg com alimentos ou sem alimentos. Veja a seção "Como posso dar grânulos orais SINGULAIR ao meu filho?" no Instruções de uso para obter informações sobre quais alimentos e líquidos podem ser tomados com SINGULAIR 10mg granulado oral.
- Se você ou seu filho esquecer de tomar uma dose de SINGULAIR, apenas tome a próxima dose no horário regular. Não tome 2 doses ao mesmo tempo.
- Se você tomar muito SINGULAIR, ligue para o seu médico imediatamente.
Para adultos e crianças com 12 meses de idade ou mais com asma:
- Tome SINGULAIR 1 vez por dia, à noite. Continue a tomar SINGULAIR 5mg todos os dias pelo tempo que seu médico prescrever, mesmo que você não tenha sintomas de asma.
- Informe o seu médico imediatamente se os sintomas da asma piorarem ou se você precisar usar o medicamento inalador de resgate com mais frequência para ataques de asma.
- Sempre tenha seu medicamento inalador de resgate com você para ataques de asma.
- Continue a tomar seus outros medicamentos para asma conforme prescrito, a menos que seu médico lhe diga para alterar a forma como você toma esses medicamentos.
Para pessoas com 6 anos de idade ou mais para a prevenção da asma induzida pelo exercício:
- Tome SINGULAIR pelo menos 2 horas antes do exercício.
- Sempre tenha seu medicamento inalador de resgate com você para ataques de asma.
- Se você toma SINGULAIR 10mg todos os dias para asma crônica ou rinite alérgica, não faça tome outra dose para prevenir a asma induzida pelo exercício. Converse com seu médico sobre seu tratamento para asma induzida por exercício.
- Não tome 2 doses de SINGULAIR 5mg dentro de 24 horas (1 dia).
Para qualquer pessoa com 2 anos de idade ou mais com rinite alérgica sazonal, ou para qualquer pessoa com 6 meses de idade ou mais com rinite alérgica perene:
- Tome SINGULAIR 1 vez por dia, aproximadamente à mesma hora todos os dias.
O que devo evitar ao tomar SINGULAIR 10mg?
Se você tem asma e a aspirina piora os sintomas da asma, continue evitando tomar aspirina ou outros medicamentos chamados anti-inflamatórios não esteroides (AINEs) enquanto estiver tomando SINGULAIR.
Quais são os possíveis efeitos colaterais do SINGULAIR?
SINGULAIR pode causar efeitos colaterais graves, incluindo:
- Ver “Qual é a informação mais importante que devo saber sobre SINGULAIR 4mg?”
- Aumento de certos glóbulos brancos (eosinófilos) e possíveis vasos sanguíneos inflamados em todo o corpo (vasculite sistêmica). Raramente, isso pode acontecer em pessoas com asma que tomam SINGULAIR. Isso às vezes acontece em pessoas que também tomam um medicamento esteróide por via oral que está sendo interrompido ou a dose está sendo reduzida.
Informe o seu médico imediatamente se tiver um ou mais destes sintomas:
- uma sensação de alfinetes e agulhas ou dormência nos braços ou pernas
- uma doença semelhante à gripe
- irritação na pele
- inflamação grave (dor e inchaço) dos seios nasais (sinusite)
Os efeitos colaterais mais comuns de SINGULAIR incluem:
- infecção respiratória superior
- febre
- dor de cabeça
- dor de garganta
- tosse
- dor de estômago
- diarréia
- dor de ouvido ou infecção de ouvido
- gripe
- nariz a pingar
- infecção do sinus
Estes não são todos os possíveis efeitos colaterais de SINGULAIR. Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
Como devo armazenar o SINGULAIR?
- Armazene SINGULAIR 10mg em temperatura ambiente entre 20°C e 25°C (68°F a 77°F).
- Mantenha SINGULAIR 4mg na embalagem em que vem.
- Manter SINGULAIR 4mg em local seco e ao abrigo da luz.
- Mantenha SINGULAIR e todos os medicamentos fora do alcance das crianças.
Informações gerais sobre o uso seguro e eficaz de SINGULAIR.
Os medicamentos às vezes são prescritos para outros fins que não os listados em um Guia de Medicamentos. Não use SINGULAIR para uma condição para a qual não foi prescrito. Não dê SINGULAIR a outras pessoas, mesmo que tenham os mesmos sintomas que você. Pode prejudicá-los.
Você pode pedir ao seu farmacêutico ou profissional de saúde informações sobre SINGULAIR 10mg que foi escrito para profissionais de saúde.
Quais são os ingredientes do SINGULAIR?
Ingrediente ativo: montelucaste de sódio
Ingredientes inativos:
- Grânulos orais de 4 mg: manitol, hidroxipropilcelulose e estearato de magnésio.
- Comprimidos mastigáveis de 4 mg e 5 mg: manitol, celulose microcristalina, hidroxipropilcelulose, óxido férrico vermelho, croscarmelose sódica, aroma de cereja, aspartame e estearato de magnésio.
- Pessoas com Fenilcetonúria: SINGULAIR 4 mg comprimidos mastigáveis contêm 0,674 mg de fenilalanina e SINGULAIR 5 mg comprimidos mastigáveis contêm 0,842 mg de fenilalanina.
- comprimido de 10 mg: celulose microcristalina, lactose mono-hidratada, croscarmelose sódica, hidroxipropilcelulose e estearato de magnésio. A película de revestimento contém: hidroxipropilmetilcelulose, hidroxipropilcelulose, dióxido de titânio, óxido férrico vermelho, óxido férrico amarelo e cera de carnaúba.
Instruções de uso
SINGULAIR® (SING-u-lair) (montelucaste sódico) grânulos orais
Estas Instruções de Uso contêm informações sobre como usar SINGULAIR 10mg grânulos orais.
Informação importante:
- Antes de administrar uma dose de SINGULAIR granulado oral, leia estas Instruções de Uso para certificar-se de preparar e administrar o granulado oral corretamente.
- Dê SINGULAIR granulado oral ao seu filho exatamente como instruído pelo seu médico.
- Pare de administrar SINGULAIR 5mg e informe o seu médico imediatamente se o seu filho tiver quaisquer alterações incomuns de comportamento ou pensamento.
- Continue a dar ao seu filho os medicamentos para asma conforme prescrito, a menos que o seu médico lhe diga para alterar a forma como você administra esses medicamentos.
- Você pode administrar SINGULAIR 5mg granulado oral com ou sem alimentos.
Como posso dar SINGULAIR 4mg grânulos orais ao meu filho?
- Não faça abra o pacote até estar pronto para uso.
- Existem diferentes maneiras de administrar grânulos orais de SINGULAIR 4 mg. Você deve escolher o melhor método para seu filho:
- direto na boca
- dissolvido em 1 colher de chá (5 mL) de fórmula infantil fria ou à temperatura ambiente ou leite materno
- misturado com 1 colher de um dos seguintes alimentos moles em temperatura fria ou ambiente: purê de maçã, purê de cenoura, arroz ou sorvete.
- Dê à criança toda a mistura dentro de 15 minutos.
- Não guarde sobras da mistura SINGULAIR (grânulos orais misturados com alimentos, fórmula infantil ou leite materno) para uso posterior. Jogue fora qualquer porção não utilizada.
- Não misture os grânulos orais de SINGULAIR com qualquer bebida líquida que não seja fórmula infantil ou leite materno. Seu filho pode beber outros líquidos depois de engolir a mistura.
Como devo armazenar SINGULAIR 5mg?
- Armazene SINGULAIR 4mg em temperatura ambiente entre 20°C e 25°C (68°F a 77°F).
- Mantenha SINGULAIR na embalagem em que vem.
- Manter SINGULAIR 5mg em local seco e ao abrigo da luz.
- Mantenha SINGULAIR e todos os medicamentos fora do alcance das crianças.
Estas Instruções de Uso foram aprovadas pela Food and Drug Administration dos EUA
