Brand Temovate 15g Clobetasol Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Temovate e como é usado?
Temovate é um medicamento de prescrição usado para tratar os sintomas da psoríase em placas e couro cabeludo e dermatoses responsivas a corticosteróides. Temovate pode ser usado sozinho ou com outros medicamentos.
Temovate pertence a uma classe de medicamentos chamados Corticosteróides Tópicos.
Não se sabe se Temovate é seguro e eficaz em crianças com menos de 12 anos de idade.
Quais são os possíveis efeitos colaterais do Temovate?
Temovate pode causar efeitos colaterais graves, incluindo:
- agravamento da sua condição de pele,
- vermelhidão, calor, inchaço, exsudação ou irritação grave de qualquer pele tratada,
- visão embaçada,
- visão de túnel,
- dor nos olhos,
- vendo halos ao redor das luzes,
- aumento da sede,
- boca seca,
- odor de hálito frutado,
- ganho de peso no rosto e ombros,
- cicatrização lenta de feridas,
- descoloração da pele,
- afinamento da pele,
- aumento dos pelos do corpo,
- cansaço,
- mudanca de humor,
- alterações menstruais e
- mudanças sexuais
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Temovate incluem:
- ardor, comichão, inchaço ou irritação da pele tratada,
- pele seca ou rachada,
- vermelhidão ou crostas em torno de seus folículos capilares,
- Veias de aranha,
- estrias,
- afinamento da pele,
- erupção cutânea ou urticária,
- acne, e
- queda de cabelo temporária
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Temovate. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
DESCRIÇÃO
TEMOVATE® (creme e pomada de propionato de clobetasol) Creme e Pomada, 0,05% contém o composto ativo propionato de clobetasol, um corticosteroide sintético, para uso dermatológico tópico. Clobetasol, um análogo da prednisolona, tem um alto grau de atividade glicocorticóide e um leve grau de atividade mineralocorticóide.
Quimicamente, propionato de clobetasol é (11ß,16ß)-21-cloro-9-fluoro-11-hidroxi-16-metil-17-(1-oxopropoxi)-pregna-1,4-dieno-3,20-diona, e tem a seguinte fórmula estrutural:
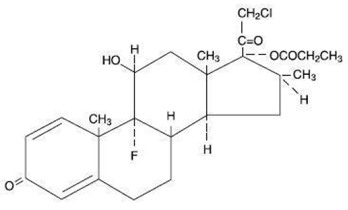
O propionato de clobetasol tem fórmula molecular C25H32CIFO5 e peso molecular de 467. É um pó cristalino branco a creme insolúvel em água.
TEMOVATE® Creme contém propionato de clobetasol 0,5 mg/g em uma base creme de propilenoglicol, monoestearato de glicerila, álcool cetoestearílico, estearato de glicerila, estearato de PEG 100, cera branca, clorocresol, citrato de sódio, ácido cítrico monohidratado e água purificada.
A pomada TEMOVATE® contém propionato de clobetasol 0,5 mg/g em uma base de propilenoglicol, sesquioleato de sorbitano e petrolato branco.
INDICAÇÕES
TEMOVATE® Creme e Pomada são formulações corticosteróides de super alta potência indicadas para o alívio das manifestações inflamatórias e pruriginosas de dermatoses responsivas a corticosteróides. O tratamento além de 2 semanas consecutivas não é recomendado, e a dosagem total não deve exceder 50 g/semana devido ao potencial do medicamento em suprimir o eixo hipotálamo-hipófise-adrenal (HPA). O uso em pacientes pediátricos com menos de 12 anos de idade não é recomendado.
Tal como acontece com outros corticosteroides altamente ativos, a terapia deve ser descontinuada quando o controle for alcançado. Se nenhuma melhora for observada em 2 semanas, pode ser necessária uma reavaliação do diagnóstico.
DOSAGEM E ADMINISTRAÇÃO
Aplique uma camada fina de TEMOVATE® Creme ou Pomada nas áreas afetadas da pele duas vezes ao dia e esfregue suavemente e completamente (consulte INDICAÇÕES E USO ).
TEMOVATE® Creme e Pomada são corticosteróides tópicos de super alta potência; Portanto, o tratamento deve ser limitado a 2 semanas consecutivas e não devem ser utilizadas quantidades superiores a 50 g/semana.
Tal como acontece com outros corticosteroides altamente ativos, a terapia deve ser descontinuada quando o controle for alcançado. Se nenhuma melhora for observada dentro de 2 semanas, a reavaliação do diagnóstico pode ser necessária.
TEMOVATE® Creme e Pomada não deve ser usado com curativos oclusivos.
Uso Geriátrico
Em estudos em que pacientes geriátricos (65 anos de idade ou mais, ver PRECAUÇÕES foram tratados com TEMOVATE® Creme ou Pomada, a segurança não diferiu daquela em pacientes mais jovens; portanto, nenhum ajuste de dose é recomendado.
COMO FORNECIDO
TEMOVATE® (creme de propionato de clobetasol) Creme, 0,05% é fornecido em:
tubos de 30 g ( NDC 10337-163-30), e tubos de 60 g ( NDC 10337-163-60).
TEMOVATE® (pomada de propionato de clobetasol) Pomada, 0,05% é fornecida em:
tubos de 15 g ( NDC 10337-162-15), e tubos de 30 g ( NDC 10337-162-30).
Armazenar entre 15° e 30°C (59° e 86°F). TEMOVATE® Creme não deve ser refrigerado. PharmaDerm
Uma divisão da Fougera Pharmaceuticals Inc., Melville, NY 11747 EUA. Revisado: janeiro de 2012
EFEITOS COLATERAIS
Em ensaios clínicos controlados, as reações adversas mais frequentes relatadas para TEMOVATE® Creme foram sensação de queimação e ardência em 1% dos pacientes tratados. As reações adversas menos frequentes foram coceira, atrofia da pele e rachaduras e fissuras na pele.
Em ensaios clínicos controlados, os eventos adversos mais frequentes relatados para TEMOVATE® Pomada foram sensação de queimação, irritação e coceira em 0,5% dos pacientes tratados. As reações adversas menos frequentes foram picadas, rachaduras, eritema, foliculite, dormência dos dedos, atrofia da pele e telangiectasia.
A síndrome de Cushing foi relatada em lactentes e adultos como resultado do uso prolongado de formulações tópicas de propionato de clobetasol.
As seguintes reações adversas locais adicionais foram relatadas com corticosteroides tópicos e podem ocorrer com mais frequência com o uso de curativos oclusivos e corticosteroides de maior potência. Essas reações estão listadas em ordem de ocorrência aproximadamente decrescente: ressecamento, erupções acneiformes, hipopigmentação, dermatite perioral, dermatite alérgica de contato, infecção secundária, irritação, estrias e miliária.

INTERAÇÕES MEDICAMENTOSAS
Nenhuma informação fornecida.
AVISOS
Nenhuma informação fornecida. Por favor, veja PRECAUÇÕES seção abaixo.
PRECAUÇÕES
Em geral
TEMOVATE® Creme e Pomada não deve ser usado no tratamento de rosácea ou dermatite perioral, e não deve ser usado na face, virilha ou axilas.
A absorção sistêmica de corticosteroides tópicos pode produzir supressão reversível do eixo HPA com potencial para insuficiência de glicocorticosteroides após a retirada do tratamento. Manifestações da síndrome de Cushing, hiperglicemia e glicosúria também podem ser produzidas em alguns pacientes pela absorção sistêmica de corticosteroides tópicos durante a terapia.
Pacientes que aplicam um esteroide tópico em uma grande área de superfície ou em áreas sob oclusão devem ser avaliados periodicamente quanto à evidência de supressão do eixo HPA. Isso pode ser feito usando a estimulação de ACTH, cortisol plasmático AM e testes de cortisol livre urinário. Pacientes recebendo corticosteroides superpotentes não devem ser tratados por mais de 2 semanas de cada vez, e apenas pequenas áreas devem ser tratadas de cada vez devido ao risco aumentado de supressão de HPA.
TEMOVATE® Creme e Pomada produziram supressão do eixo HPA quando usados em doses tão baixas quanto 2 g/dia por 1 semana em pacientes com eczema.
Se for observada supressão do eixo HPA, deve-se tentar retirar o medicamento, reduzir a frequência de aplicação ou substituir um corticosteroide menos potente. A recuperação da função do eixo HPA é geralmente imediata após a descontinuação de corticosteroides tópicos. Raramente, podem ocorrer sinais e sintomas de insuficiência de glicocorticosteroides que requerem corticosteroides sistêmicos suplementares. Para obter informações sobre suplementação sistêmica, consulte as informações de prescrição desses produtos.
Pacientes pediátricos podem ser mais suscetíveis à toxicidade sistêmica de doses equivalentes devido à maior superfície da pele em relação à massa corporal (consulte PRECAUÇÕES : Uso Pediátrico ).
Se ocorrer irritação, TEMOVATE® Creme e Pomada deve ser descontinuado e a terapia apropriada instituída. A dermatite de contato alérgica com corticosteróides geralmente é diagnosticada pela observação de uma falha na cicatrização, em vez de notar uma exacerbação clínica, como acontece com a maioria dos produtos tópicos que não contêm corticosteróides. Tal observação deve ser corroborada com testes de contato diagnósticos apropriados.
Se infecções concomitantes da pele estiverem presentes ou se desenvolverem, um agente antifúngico ou antibacteriano apropriado deve ser usado. Se uma resposta favorável não ocorrer imediatamente, o uso de TEMOVATE® Creme e Pomada deve ser descontinuado até que a infecção tenha sido adequadamente controlada.
Testes laboratoriais
Os seguintes testes podem ser úteis na avaliação de pacientes para supressão do eixo HPA:
Teste de estimulação com ACTH Teste de cortisol plasmático AM Teste de cortisol livre urinário
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Estudos em animais de longo prazo não foram realizados para avaliar o potencial carcinogênico do propionato de clobetasol.
Estudos em ratos após administração subcutânea em níveis de dosagem de até 50 mcg/kg/dia revelaram que as fêmeas exibiram um aumento no número de embriões reabsorvidos e uma diminuição no número de fetos vivos na dose mais alta.
O propionato de clobetasol foi não mutagênico em 3 sistemas de teste diferentes: o teste de Ames, o teste de conversão gênica de Saccharomyces cerevisiae e o teste de flutuação de E. coli B WP2.
Gravidez
Efeitos teratogênicos
Gravidez Categoria C. Os corticosteróides demonstraram ser teratogênicos em animais de laboratório quando administrados sistemicamente em níveis de dosagem relativamente baixos. Alguns corticosteróides demonstraram ser teratogênicos após aplicação dérmica em animais de laboratório.
propionato de clobetasol não foi testado quanto à teratogenicidade quando aplicado topicamente; no entanto, é absorvido por via percutânea e, quando administrado por via subcutânea, foi um teratógeno significativo em coelhos e camundongos. O propionato de clobetasol tem maior potencial teratogênico do que os esteróides menos potentes.
Estudos de teratogenicidade em camundongos usando a via subcutânea resultaram em fetotoxicidade na dose mais alta testada (1 mg/kg) e teratogenicidade em todos os níveis de dose testados até 0,03 mg/kg. Essas doses são aproximadamente 1,4 e 0,04 vezes, respectivamente, a dose tópica humana de TEMOVATE® Creme e Pomada. As anormalidades observadas incluíram fenda palatina e anormalidades esqueléticas.
Em coelhos, o propionato de clobetasol foi teratogênico nas doses de 3 e 10 mcg/kg. Essas doses são aproximadamente 0,02 e 0,05 vezes, respectivamente, a dose tópica humana de TEMOVATE® Creme e Pomada. As anormalidades observadas incluíam fenda palatina, craniosquise e outras anormalidades esqueléticas.
Não existem estudos adequados e bem controlados sobre o potencial teratogênico do propionato de clobetasol em mulheres grávidas. TEMOVATE® Creme e Pomada deve ser usado durante a gravidez somente se o benefício potencial justificar o risco potencial para o feto.
Mães que amamentam
Os corticosteroides administrados sistemicamente aparecem no leite humano e podem suprimir o crescimento, interferir na produção endógena de corticosteroides ou causar outros efeitos adversos. Não se sabe se a administração tópica de corticosteroides pode resultar em absorção sistêmica suficiente para produzir quantidades detectáveis no leite humano. Como muitos medicamentos são excretados no leite humano, deve-se ter cautela quando TEMOVATE® Creme ou Pomada é administrado a uma lactante.
Uso Pediátrico
segurança e eficácia de TEMOVATE® Creme e Pomada em pacientes pediátricos não foram estabelecidas. O uso em pacientes pediátricos com menos de 12 anos de idade não é recomendado. Devido a uma maior proporção da área de superfície da pele para a massa corporal, os pacientes pediátricos correm um risco maior do que os adultos de supressão do eixo HPA e síndrome de Cushing quando são tratados com corticosteróides tópicos. Eles também estão em maior risco de insuficiência adrenal durante ou após a retirada do tratamento. Efeitos adversos, incluindo estrias, foram relatados com o uso inadequado de corticosteroides tópicos em bebês e crianças.
Supressão do eixo HPA, síndrome de Cushing, retardo do crescimento linear, ganho de peso retardado e hipertensão intracraniana foram relatados em crianças recebendo corticosteroides tópicos. As manifestações de supressão adrenal em crianças incluem baixos níveis plasmáticos de cortisol e ausência de resposta à estimulação com ACTH. As manifestações de hipertensão intracraniana incluem fontanelas abauladas, cefaleias e papiledema bilateral.
Uso Geriátrico
Um número limitado de pacientes com idade igual ou superior a 65 anos foi tratado com TEMOVATE® Creme (n = 231) e com TEMOVATE® Pomada (n = 101) em estudos clínicos nos EUA e fora dos EUA. Embora o número de pacientes seja muito pequeno para permitir uma análise separada de eficácia e segurança, as reações adversas relatadas nesta população foram semelhantes às relatadas por pacientes mais jovens. Com base nos dados disponíveis, nenhum ajuste de dose de TEMOVATE® Creme e Pomada em pacientes geriátricos é garantido.
SOBREDOSAGEM
Creme e Pomada TEMOVATE® aplicados topicamente podem ser absorvidos em quantidades suficientes para produzir efeitos sistêmicos (consulte PRECAUÇÕES ).
CONTRA-INDICAÇÕES
TEMOVATE® (creme e pomada de propionato de clobetasol) Creme e Pomada, 0,05% são contraindicados naqueles pacientes com histórico de hipersensibilidade a qualquer um dos componentes das preparações.
FARMACOLOGIA CLÍNICA
Como outros corticosteroides tópicos, o propionato de clobetasol tem propriedades anti-inflamatórias, antipruriginosas e vasoconstritoras. O mecanismo da atividade anti-inflamatória dos esteróides tópicos, em geral, não é claro. No entanto, acredita-se que os corticosteróides atuem pela indução de proteínas inibidoras da fosfolipase A2, chamadas coletivamente de lipocortinas. Postula-se que essas proteínas controlam a biossíntese de potentes mediadores da inflamação, como prostaglandinas e leucotrienos, inibindo a liberação de seu precursor comum, o ácido araquidônico. O ácido araquidônico é liberado dos fosfolipídios da membrana pela fosfolipase A2.
Farmacocinética
extensão da absorção percutânea de corticosteroides tópicos é determinada por muitos fatores, incluindo o veículo e a integridade da barreira epidérmica. O curativo oclusivo com hidrocortisona por até 24 horas não demonstrou aumentar a penetração; entretanto, a oclusão da hidrocortisona por 96 horas aumenta marcadamente a penetração. Os corticosteroides tópicos podem ser absorvidos pela pele normal intacta. Inflamação e/ou outros processos patológicos na pele podem aumentar a absorção percutânea.
Estudos realizados com TEMOVATE® Creme e Pomada indicam que eles estão na faixa de potência super alta em comparação com outros corticosteróides tópicos.
INFORMAÇÃO DO PACIENTE
Pacientes em uso de corticosteroides tópicos devem receber as seguintes informações e instruções:
