Elocon 5g Mometasone Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Elocon 5g e como é usado?
Elocon (furoato de mometasona) Creme, 0,1% é um creme, loção ou pomada tópica de corticosteroide indicado para o alívio das manifestações inflamatórias e pruriginosas de dermatoses responsivas a corticosteroides em pacientes com 2 anos de idade ou mais.
Quais são os efeitos colaterais do Elocon 5g?
Os efeitos colaterais comuns do Elocon incluem:
- erupção cutânea,
- coceira,
- queimando,
- vermelhidão,
- secura,
- afinamento ou amolecimento da sua pele,
- erupção cutânea ou irritação ao redor da boca,
- folículos capilares inchados,
- Veias de aranha,
- dormência ou formigamento,
- alterações na cor da pele tratada,
- bolhas,
- espinhas,
- crostas da pele tratada, ou
- estrias.
DESCRIÇÃO
ELOCON (furoato de mometasona) Creme, 0,1% contém furoato de mometasona para uso tópico. O furoato de mometasona é um corticosteroide sintético com atividade anti-inflamatória.
Quimicamente, o furoato de mometasona é 9α,21-dicloro-11β,17-dihidroxi-16α-metilpregna-1,4-dieno3,20-diona 17-(2-furoato), com a fórmula empírica C27 H30CI2O6, um peso molecular de 521,4 e a seguinte fórmula estrutural:
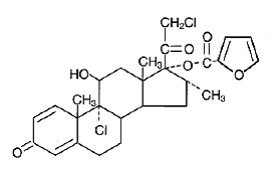
O furoato de mometasona é um pó branco a esbranquiçado praticamente insolúvel em água, ligeiramente solúvel em octanol e moderadamente solúvel em álcool etílico.
Cada grama de ELOCON 5g Creme, 0,1% contém 1 mg de furoato de mometasona em uma base creme branca a esbranquiçada de octenilsuccinato de amido de alumínio (irradiado gama), hexilenoglicol, lecitina de soja hidrogenada, ácido fosfórico, água purificada, dióxido de titânio, branco macio parafina e cera branca.
INDICAÇÕES
ELOCON® Creme é um corticosteroide indicado para o alívio das manifestações inflamatórias e pruriginosas de dermatoses responsivas a corticosteroides em pacientes com idade igual ou superior a 2 anos.
DOSAGEM E ADMINISTRAÇÃO
Aplique uma fina película de ELOCON Creme nas áreas afetadas da pele uma vez ao dia. ELOCON Creme pode ser usado em pacientes pediátricos com 2 anos de idade ou mais. Uma vez que a segurança e eficácia de ELOCON Creme não foram estabelecidas em pacientes pediátricos com menos de 2 anos de idade; uso nesta faixa etária não é recomendado [ver AVISOS E PRECAUÇÕES e Uso em populações específicas ].
terapia deve ser descontinuada quando o controle for alcançado. Se nenhuma melhora for observada dentro de 2 semanas, a reavaliação do diagnóstico pode ser necessária. A segurança e eficácia de ELOCON Creme em pacientes pediátricos por mais de 3 semanas de uso não foram estabelecidas.
ELOCON Creme não deve ser usado com curativos oclusivos, a menos que indicado por um médico. ELOCON 5g Creme não deve ser aplicado na área da fralda se a criança ainda precisar de fraldas ou calças plásticas, pois essas peças podem constituir curativo oclusivo.
ELOCON Creme é apenas para uso tópico. Não é para uso oral, oftálmico ou intravaginal.
Evite o uso no rosto, virilha ou axilas.
COMO FORNECIDO
Formas de dosagem e pontos fortes
Creme, 0,1%. Cada grama de ELOCON Creme contém 1 mg de furoato de mometasona em uma base cremosa branca a esbranquiçada lisa e homogênea.
Armazenamento e manuseio
ELOCON Creme é de cor branca a esbranquiçada e fornecida em 15 gramas (NDC 0085-3149-01) e 50 gramas ( NDC 0085-3149-03) tubos.
Armazenar a 25°C (77°F); excursões permitidas para 15-30°C (59-86°F) [ver Temperatura ambiente controlada USP ]. Evite calor excessivo.
Fabricado para: Merck Sharp & Dohme Corp., uma subsidiária da Merck & Co., Inc., Whitehouse Station, NJ 08889, EUA. Fabricado por: Schering-Plough Labo NV Heist-op-den-Berg, Bélgica. Revisado: abril de 2013
EFEITOS COLATERAIS
Como os ensaios clínicos são conduzidos sob condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparadas às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática clínica.
Em ensaios clínicos controlados envolvendo 319 indivíduos, a incidência de reações adversas associadas ao uso de ELOCON 5g Creme foi de 1,6%. As reações relatadas incluíram queimação, prurido e atrofia da pele. Também foram recebidos relatos de rosácea associada ao uso de ELOCON 5g Creme. Em ensaios clínicos controlados (n=74) envolvendo indivíduos pediátricos de 2 a 12 anos de idade, a incidência de reações adversas associadas ao uso de ELOCON 5g Creme foi de aproximadamente 7%. As reações relatadas incluíram picadas, prurido e furunculose.
As seguintes reações adversas foram relatadas como possivelmente ou provavelmente relacionadas ao tratamento com ELOCON 5g Creme durante estudos clínicos em 4% de 182 pacientes pediátricos de 6 meses a 2 anos de idade: diminuição dos níveis de glicocorticóides, 2; parestesia, 2; foliculite, 1; monilíase, 1; infecção bacteriana, 1; despigmentação da pele, 1. Os seguintes sinais de atrofia da pele também foram observados em 97 indivíduos tratados com ELOCON Creme em um ensaio clínico: brilho, 4; telangiectasia, 1; perda de elasticidade, 4; perda de marcas normais da pele, 4; magreza, 1; e hematomas, 1.
As seguintes reações adversas locais adicionais foram relatadas com corticosteroides tópicos, mas podem ocorrer mais frequentemente com o uso de curativos oclusivos. Essas reações são: irritação, ressecamento, foliculite, hipertricose, erupções acneiformes, hipopigmentação, dermatite perioral, dermatite alérgica de contato, infecção secundária, estrias e miliária.
INTERAÇÕES MEDICAMENTOSAS
Não foram realizados estudos de interação medicamentosa com ELOCON Creme.
AVISOS
Incluído como parte do PRECAUÇÕES seção.
PRECAUÇÕES
Efeitos no sistema endócrino
A absorção sistêmica de corticosteroides tópicos pode produzir supressão reversível do eixo hipotálamo-hipófise-adrenal (HPA) com potencial para insuficiência de glicocorticosteroides. Isso pode ocorrer durante o tratamento ou após a interrupção do tratamento. Manifestações da síndrome de Cushing, hiperglicemia e glicosúria também podem ser produzidas em alguns pacientes pela absorção sistêmica de corticosteroides tópicos durante o tratamento. Os fatores que predispõem um paciente em uso de corticosteroide tópico à supressão do eixo HPA incluem o uso de esteroides de alta potência, grandes áreas de superfície de tratamento, uso prolongado, uso de curativos oclusivos, barreira cutânea alterada, insuficiência hepática e idade jovem.
Devido ao potencial de absorção sistêmica, o uso de corticosteroides tópicos pode exigir que os pacientes sejam avaliados periodicamente quanto à supressão do eixo HPA. Isso pode ser feito usando o teste de estimulação do hormônio adrenocorticotrófico (ACTH).
Em um estudo avaliando os efeitos do creme de furoato de mometasona no eixo HPA, 15 gramas foram aplicados duas vezes ao dia por 7 dias a seis indivíduos adultos com psoríase ou dermatite atópica. Os resultados mostram que a droga causou uma ligeira diminuição da secreção de corticosteróide adrenal.
Se houver supressão do eixo HPA, deve-se tentar retirar gradualmente o medicamento, reduzir a frequência de aplicação ou substituir um corticosteroide menos potente. A recuperação da função do eixo HPA é geralmente imediata após a descontinuação de corticosteroides tópicos. Raramente, podem ocorrer sinais e sintomas de insuficiência de glicocorticosteroides, necessitando de corticosteroides sistêmicos suplementares.
Pacientes pediátricos podem ser mais suscetíveis à toxicidade sistêmica de doses equivalentes devido à maior superfície da pele em relação à massa corporal [ver Uso em populações específicas ].
Dermatite de contato alérgica
Se ocorrer irritação, ELOCON Creme deve ser descontinuado e a terapia apropriada instituída. A dermatite de contato alérgica com corticosteróides geralmente é diagnosticada pela observação de uma falha na cicatrização, em vez de notar uma exacerbação clínica, como acontece com a maioria dos produtos tópicos que não contêm corticosteróides. Tal observação deve ser corroborada com testes de contato diagnósticos apropriados.
Infecções de Pele Concomitantes
Se infecções concomitantes da pele estiverem presentes ou se desenvolverem, um agente antifúngico ou antibacteriano apropriado deve ser usado. Se uma resposta favorável não ocorrer imediatamente, o uso de ELOCON 5g Creme deve ser descontinuado até que a infecção tenha sido adequadamente controlada.

Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Não foram realizados estudos de longa duração em animais para avaliar o potencial carcinogênico de ELOCON 5g Creme. Estudos de carcinogenicidade de longo prazo do furoato de mometasona foram conduzidos por via inalatória em ratos e camundongos. Em um estudo de carcinogenicidade de 2 anos em ratos Sprague Dawley, o furoato de mometasona não demonstrou aumento estatisticamente significativo de tumores em doses de inalação de até 67 mcg/kg (aproximadamente 0,04 vezes a dose tópica clínica máxima estimada de ELOCON 5g Creme em uma base de mcg/m² ). Em um estudo de carcinogenicidade de 19 meses em camundongos Swiss CD-1, o furoato de mometasona não demonstrou aumento estatisticamente significativo na incidência de tumores em doses de inalação de até 160 mcg/kg (aproximadamente 0,05 vezes a dose tópica clínica máxima estimada de ELOCON Creme em um base mcg/m²).
furoato de mometasona aumentou as aberrações cromossômicas em um ensaio in vitro de células de ovário de hamster chinês, mas não aumentou as aberrações cromossômicas em um ensaio in vitro de células de pulmão de hamster chinês. O furoato de mometasona não foi mutagênico no teste de Ames ou no ensaio de linfoma de camundongo, e não foi clastogênico em um ensaio de micronúcleo de camundongo in vivo, um ensaio de aberração cromossômica de medula óssea de rato ou um ensaio de aberração cromossômica de células germinativas de camundongo macho. O furoato de mometasona também não induziu síntese de DNA não programada in vivo em hepatócitos de ratos.
Em estudos reprodutivos em ratos, o comprometimento da fertilidade não foi produzido em ratos machos ou fêmeas por doses subcutâneas de até 15 mcg/kg (aproximadamente 0,01 vezes a dose tópica clínica máxima estimada de ELOCON 5g Creme, na base de mcg/m²).
Uso em populações específicas
Gravidez
Efeitos teratogênicos - Gravidez Categoria C
Não existem estudos adequados e bem controlados em mulheres grávidas. Portanto, ELOCON 5g Creme deve ser usado durante a gravidez somente se o benefício potencial justificar o risco potencial para o feto.
Os corticosteroides demonstraram ser teratogênicos em animais de laboratório quando administrados sistemicamente em níveis de dosagem relativamente baixos. Alguns corticosteroides demonstraram ser teratogênicos após aplicação dérmica em animais de laboratório.
Quando administrado a ratas, coelhas e camundongos prenhes, o furoato de mometasona aumentou as malformações fetais. As doses que produziram malformações também diminuíram o crescimento fetal, medido por pesos fetais mais baixos e/ou ossificação retardada. O furoato de mometasona também causou distocia e complicações relacionadas quando administrado a ratos durante o final da gravidez.
Em camundongos, o furoato de mometasona causou fenda palatina em doses subcutâneas de 60 mcg/kg e acima. A sobrevivência fetal foi reduzida a 180 mcg/kg. Nenhuma toxicidade foi observada a 20 mcg/kg. (As doses de 20, 60 e 180 mcg/kg no camundongo são aproximadamente 0,01, 0,02 e 0,05 vezes a dose tópica clínica máxima estimada do ELOCON Creme com base em mcg/m².)
Em ratos, o furoato de mometasona produziu hérnias umbilicais em doses tópicas de 600 mcg/kg e acima. Uma dose de 300 mcg/kg produziu atrasos na ossificação, mas sem malformações. (Doses de 300 e 600 mcg/kg no rato são aproximadamente 0,2 e 0,4 vezes a dose tópica clínica máxima estimada de ELOCON 5g Creme com base em mcg/m².)
Em coelhos, o furoato de mometasona causou múltiplas malformações (p. base m²). Em um estudo oral, o furoato de mometasona aumentou as reabsorções e causou fenda palatina e/ou malformações da cabeça (hidrocefalia e cabeça abobadada) na dose de 700 mcg/kg. A 2800 mcg/kg a maioria das ninhadas foi abortada ou reabsorvida. Nenhuma toxicidade foi observada a 140 mcg/kg. (As doses de 140, 700 e 2800 mcg/kg no coelho são aproximadamente 0,2, 0,9 e 3,6 vezes a dose tópica clínica máxima estimada do ELOCON 5g Creme com base em mcg/m².)
Quando ratos receberam doses subcutâneas de furoato de mometasona durante a gravidez ou durante os estágios finais da gravidez, 15 mcg/kg causaram trabalho de parto prolongado e difícil e reduziram o número de nascidos vivos, peso ao nascer e sobrevivência precoce dos filhotes. Efeitos semelhantes não foram observados em 7,5 mcg/kg. (Doses de 7,5 e 15 mcg/kg no rato são aproximadamente 0,005 e 0,01 vezes a dose tópica clínica máxima estimada do ELOCON Creme com base em mcg/m².)
Mães que amamentam
Os corticosteroides administrados sistemicamente aparecem no leite humano e podem suprimir o crescimento, interferir na produção endógena de corticosteroides ou causar outros efeitos adversos. Não se sabe se a administração tópica de corticosteroides pode resultar em absorção sistêmica suficiente para produzir quantidades detectáveis no leite humano. Como muitos medicamentos são excretados no leite humano, deve-se ter cautela quando ELOCON 5g Creme for administrado a lactantes.
Uso Pediátrico
ELOCON Creme pode ser usado com cautela em pacientes pediátricos com 2 anos de idade ou mais, embora a segurança e a eficácia do uso do medicamento por mais de 3 semanas não tenham sido estabelecidas. Uma vez que a segurança e eficácia de ELOCON 5g Creme não foram estabelecidas em pacientes pediátricos com menos de 2 anos de idade, seu uso nesta faixa etária não é recomendado.
Num ensaio pediátrico, 24 indivíduos com dermatite atópica, dos quais 19 indivíduos com idades compreendidas entre os 2 e os 12 anos, foram tratados com ELOCON Creme uma vez por dia. A maioria dos indivíduos foi eliminada em 3 semanas. ELOCON 5g Creme causou supressão do eixo HPA em aproximadamente 16% dos pacientes pediátricos com idades entre 6 e 23 meses, que mostraram função adrenal normal pelo teste de Cortrosyn antes do início do tratamento e foram tratados por aproximadamente 3 semanas durante um período de área de superfície corporal média de 41% (intervalo 15%-94%). Os critérios de supressão foram: nível basal de cortisol ≤ 5 mcg/dL, nível 30 minutos pós-estimulação ≤ 18 mcg/dL ou aumento FARMACOLOGIA CLÍNICA ].
Devido a uma maior proporção de área de superfície da pele para massa corporal, os pacientes pediátricos correm um risco maior do que os adultos de supressão do eixo HPA e síndrome de Cushing quando são tratados com corticosteróides tópicos. Eles estão, portanto, também em maior risco de insuficiência adrenal durante e/ou após a interrupção do tratamento. Pacientes pediátricos podem ser mais suscetíveis que adultos à atrofia da pele, incluindo estrias, quando tratados com corticosteroides tópicos. Pacientes pediátricos que aplicam corticosteroides tópicos em mais de 20% da superfície corporal apresentam maior risco de supressão do eixo HPA.
Supressão do eixo HPA, síndrome de Cushing, retardo do crescimento linear, ganho de peso retardado e hipertensão intracraniana foram relatados em pacientes pediátricos recebendo corticosteroides tópicos. As manifestações de supressão adrenal em crianças incluem baixos níveis plasmáticos de cortisol e ausência de resposta à estimulação com ACTH. As manifestações de hipertensão intracraniana incluem fontanelas abauladas, cefaleias e papiledema bilateral.
ELOCON Creme não deve ser utilizado no tratamento da dermatite das fraldas.
Uso Geriátrico
Os estudos clínicos de ELOCON 5g Creme incluíram 190 indivíduos com 65 anos de idade ou mais e 39 indivíduos com 75 anos de idade ou mais. Não foram observadas diferenças globais na segurança ou eficácia entre estes indivíduos e indivíduos mais jovens, e outras experiências clínicas relatadas não identificaram diferenças nas respostas entre pacientes idosos e mais jovens. No entanto, uma maior sensibilidade de alguns indivíduos mais velhos não pode ser descartada.
SOBREDOSAGEM
ELOCON creme aplicado topicamente pode ser absorvido em quantidades suficientes para produzir efeitos sistêmicos [ver AVISOS E PRECAUÇÕES ].
CONTRA-INDICAÇÕES
Nenhum.
FARMACOLOGIA CLÍNICA
Mecanismo de ação
Como outros corticosteroides tópicos, o furoato de mometasona tem propriedades anti-inflamatórias, antipruriginosas e vasoconstritoras. O mecanismo da atividade anti-inflamatória dos esteróides tópicos, em geral, não é claro. No entanto, acredita-se que os corticosteróides atuem pela indução de proteínas inibidoras da fosfolipase A2, chamadas coletivamente de lipocortinas. Postula-se que essas proteínas controlam a biossíntese de potentes mediadores da inflamação, como prostaglandinas e leucotrienos, inibindo a liberação de seu precursor comum ácido araquidônico. O ácido araquidônico é liberado dos fosfolipídios da membrana pela fosfolipase A2.
Farmacodinâmica
Estudos realizados com ELOCON 5g Creme indicam que está na faixa média de potência em comparação com outros corticosteróides tópicos.
Em um estudo avaliando os efeitos do creme de furoato de mometasona no eixo HPA, 15 gramas foram aplicados duas vezes ao dia por 7 dias a seis indivíduos adultos com psoríase ou dermatite atópica. O creme foi aplicado sem oclusão em pelo menos 30% da superfície corporal. Os resultados mostraram que a droga causou uma ligeira diminuição da secreção de corticosteróide adrenal [ver AVISOS E PRECAUÇÕES ].
Noventa e sete indivíduos pediátricos com idades entre 6 e 23 meses com dermatite atópica foram incluídos em um estudo aberto de segurança do eixo HPA. ELOCON Creme foi aplicado uma vez ao dia por aproximadamente 3 semanas em uma área média de superfície corporal de 41% (intervalo de 15%-94%). Em aproximadamente 16% dos indivíduos que apresentaram função adrenal normal pelo teste de Cortrosyn antes do início do tratamento, a supressão adrenal foi observada no final do tratamento com ELOCON 5g Creme. Os critérios de supressão foram: nível basal de cortisol ≤ 5 mcg/dL, nível 30 minutos pós-estimulação ≤ 18 mcg/dL ou aumento Uso em populações específicas ].
Farmacocinética
extensão da absorção percutânea de corticosteroides tópicos é determinada por muitos fatores, incluindo o veículo e a integridade da barreira epidérmica. Estudos em humanos indicam que aproximadamente 0,4% da dose aplicada de ELOCON 5g Creme entra na circulação após 8 horas de contato na pele normal sem oclusão. Inflamação e/ou outros processos patológicos na pele podem aumentar a absorção percutânea.
Estudos clínicos
A segurança e eficácia do ELOCON 5g Creme para o tratamento de dermatoses responsivas a corticosteroides foram avaliadas em dois ensaios clínicos randomizados, duplo-cegos e controlados por veículo, um na psoríase e outro na dermatite atópica. Um total de 366 indivíduos (12-81 anos de idade), dos quais 177 receberam ELOCON Creme e 181 indivíduos receberam creme veículo, foram avaliados nestes ensaios. ELOCON Creme ou o creme veículo foram aplicados uma vez ao dia durante 21 dias.
Os dois ensaios demonstraram que ELOCON 5g Creme é eficaz no tratamento da psoríase e da dermatite atópica.
INFORMAÇÃO DO PACIENTE
Informe os pacientes sobre o seguinte:
- Use ELOCON 5g Creme conforme orientação do médico. Para uso externo apenas.
- Evite contato com os olhos.
- Não use ELOCON Creme no rosto, axilas ou áreas da virilha, a menos que indicado pelo médico.
- Não use ELOCON 5g Creme para qualquer distúrbio diferente daquele para o qual foi prescrito.
- A área da pele tratada não deve ser enfaixada ou coberta ou embrulhada de forma oclusiva, a menos que indicado pelo médico.
- Relate quaisquer sinais de reações adversas locais ao médico.
- Aconselhar os pacientes a não usar ELOCON 5g Creme no tratamento da dermatite das fraldas. Não aplique ELOCON Creme na área da fralda, pois fraldas ou calças plásticas podem constituir curativo oclusivo.
- Interrompa a terapia quando o controle for alcançado. Se nenhuma melhora for observada em 2 semanas, entre em contato com o médico.
- Não use outros produtos contendo corticosteróides com ELOCON Creme sem antes consultar o médico.
