Neoral 25mg, 100mg Cyclosporine Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Neoral 25mg e como é usado?
Neoral 25mg é um medicamento de prescrição usado como profilaxia para prevenir a rejeição de órgãos após o transplante e para tratar os sintomas da artrite reumatóide e da psoríase. Neoral pode ser usado sozinho ou com outros medicamentos.
Neoral pertence a uma classe de medicamentos chamados DMARDs, Imunomoduladores; Imunossupressores; Inibidores da Calcineurina.
Não se sabe se Neoral 25mg é seguro e eficaz em crianças.
Quais são os possíveis efeitos colaterais do Neoral?
Neoral pode causar efeitos colaterais graves, incluindo:
- urticária,
- dificuldade para respirar,
- inchaço do rosto, lábios, língua ou garganta,
- problemas com a fala, pensamento, visão ou movimento muscular,
- apreensão,
- dor de cabeça severa,
- visão embaçada,
- batendo em seu pescoço ou ouvidos,
- pele pálida,
- contusões fáceis,
- sangramento incomum,
- náusea,
- fraqueza,
- sensação de formigamento,
- dor no peito,
- batimentos cardíacos irregulares,
- perda de movimento,
- pouca ou nenhuma micção,
- inchaço nos pés ou tornozelos,
- sentindo-se cansado,
- falta de ar,
- perda de apetite,
- dor de estômago (lado superior direito),
- amarelecimento da pele ou dos olhos,
- febre,
- arrepios,
- sintomas da gripe,
- aftas,
- feridas na pele,
- dor de garganta, e
- tosse
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Neoral incluem:
- tremores ou tremores,
- acne,
- aumento do crescimento de pêlos faciais ou corporais,
- aumento da pressão arterial,
- náusea,
- diarreia, e
- gengivas inchadas ou doloridas
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Neoral. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
AVISO
Somente médicos experientes no manejo de terapia imunossupressora sistêmica para a doença indicada devem prescrever Neoral®. Nas doses utilizadas em transplantes de órgãos sólidos, apenas médicos com experiência em terapia imunossupressora e manejo de receptores de transplantes de órgãos devem prescrever Neoral®. Os pacientes que recebem o medicamento devem ser tratados em instalações equipadas e equipadas com laboratórios adequados e recursos médicos de apoio. O médico responsável pela terapia de manutenção deve ter todas as informações necessárias para o acompanhamento do paciente. Neoral®, um imunossupressor sistêmico, pode aumentar a suscetibilidade à infecção e ao desenvolvimento de neoplasias. Em pacientes com transplante de rim, fígado e coração, Neoral® pode ser administrado com outros agentes imunossupressores. O aumento da suscetibilidade à infecção e o possível desenvolvimento de linfoma e outras neoplasias podem resultar do aumento do grau de imunossupressão em pacientes transplantados.
As cápsulas de gelatina mole Neoral® (cápsulas de ciclosporina, USP) MODIFIED e a solução oral Neoral® (solução oral de ciclosporina, USP) MODIFIED têm maior biodisponibilidade em comparação com as cápsulas de gelatina mole Sandimmune® (cápsulas de ciclosporina, USP) e a solução oral Sandimmune® (ciclosporina oral solução, USP). Neoral® e Sandimmune® não são bioequivalentes e não podem ser usados alternadamente sem supervisão médica. Para uma determinada concentração mínima, a exposição à ciclosporina será maior com Neoral® do que com Sandimmune®. Se um paciente que está recebendo doses excepcionalmente altas de Sandimmune® for convertido para Neoral®, deve-se ter cuidado especial. As concentrações sanguíneas de ciclosporina devem ser monitoradas em pacientes transplantados e com artrite reumatoide em uso de Neoral® para evitar toxicidade devido a altas concentrações. Os ajustes de dose devem ser feitos em pacientes transplantados para minimizar a possível rejeição de órgãos devido a baixas concentrações. A comparação das concentrações sanguíneas na literatura publicada com as concentrações sanguíneas obtidas usando os ensaios atuais deve ser feita com conhecimento detalhado dos métodos de ensaio empregados.
Para pacientes com psoríase (veja também ADVERTÊNCIAS EM CAIXA acima)
Pacientes com psoríase previamente tratados com PUVA e, em menor grau, com metotrexato ou outros agentes imunossupressores, UVB, alcatrão de hulha ou radioterapia, apresentam risco aumentado de desenvolver malignidades de pele ao tomar Neoral®.
A ciclosporina, ingrediente ativo do Neoral®, nas dosagens recomendadas, pode causar hipertensão sistêmica e nefrotoxicidade. O risco aumenta com o aumento da dose e duração da terapia com ciclosporina. A disfunção renal, incluindo lesão renal estrutural, é uma consequência potencial da ciclosporina e, portanto, a função renal deve ser monitorada durante a terapia.
DESCRIÇÃO
Neoral® é uma formulação oral de ciclosporina que forma imediatamente uma microemulsão em meio aquoso.
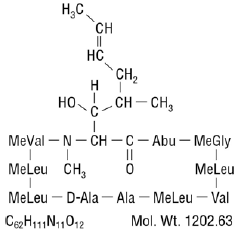
A ciclosporina, o princípio ativo do Neoral®, é um agente imunossupressor polipeptídico cíclico composto por 11 aminoácidos. É produzido como um metabólito pela espécie de fungo Beauveria nivea.
Quimicamente, a ciclosporina é designada como [R-[R*,R*-(E)]]-cíclico-(L-alanil-D-alanil-N-metil-L-leucilN-metil-L-leucil-N-metil -L-valil-3-hidroxi-N,4-dimetil-L-2-amino-6-octenoil-L-α-aminobutiril-N-metilglicil-N-metil-L-leucil-L-valil-N-metil -L-leucil).
As cápsulas de gelatina mole Neoral® (cápsulas de ciclosporina, USP) MODIFICADAS estão disponíveis em dosagens de 25 mg e 100 mg.
Cada cápsula de 25 mg contém:
ciclosporina……………………………… 25 mg de álcool, USP desidratado..............................11,9% v/v (9,5% p/vol.)
Cada cápsula de 100 mg contém:
ciclosporina……………………………...100 mg de álcool, USP desidratado..............................11.9 % v/v (9,5% p/vol.)
Ingredientes inativos: Óleo de milho-mono-di-triglicerídeos, polioxil 40 óleo de rícino hidrogenado NF, DL-αtocoferol USP, gelatina NF, glicerol, óxido de ferro preto, propilenoglicol USP, dióxido de titânio USP, carmim e outros ingredientes.
Neoral® Oral Solution (solução oral de ciclosporina, USP) MODIFIED está disponível em frascos de 50 mL.
Cada ml contém:
ciclosporina………………….................. 100 mg/mL de álcool, USP desidratado........ ...........11,9% v/v (9,5% p/vol.)
Ingredientes inativos: Óleo de milho-mono-di-triglicéridos, polioxil 40 óleo de rícino hidrogenado NF, DL-α tocoferol USP, propilenoglicol USP.
A estrutura química da ciclosporina (também conhecida como ciclosporina A) é:
INDICAÇÕES
Transplante de Rim, Fígado e Coração
Neoral 25mg é indicado para a profilaxia da rejeição de órgãos em transplantes alogênicos de rim, fígado e coração. Neoral 100mg tem sido usado em combinação com azatioprina e corticosteróides.
Artrite reumatoide
Neoral é indicado para o tratamento de pacientes com artrite reumatoide ativa grave em que a doença não respondeu adequadamente ao metotrexato. Neoral pode ser usado em combinação com metotrexato em pacientes com artrite reumatoide que não respondem adequadamente ao metotrexato isolado.
Psoríase
Neoral é indicado para o tratamento de pacientes adultos não imunocomprometidos com psoríase em placas grave (ou seja, extensa e/ou incapacitante), recalcitrante, que não responderam a pelo menos uma terapia sistêmica (por exemplo, PUVA, retinóides ou metotrexato) ou em pacientes para os quais outras terapias sistêmicas são contraindicadas ou não podem ser toleradas.
Embora o rebote raramente ocorra, a maioria dos pacientes apresentará recaída com Neoral 100mg, assim como com outras terapias, após a interrupção do tratamento.
DOSAGEM E ADMINISTRAÇÃO
Cápsulas de Gelatina Mole Neoral 25mg (cápsulas de ciclosporina, USP) MODIFICADA e Solução Oral Neoral (solução oral de ciclosporina, USP) MODIFICAR D
Neoral aumentou a biodisponibilidade em comparação com Sandimmune. Neoral 25mg e Sandimmune não são bioequivalentes e não podem ser usados alternadamente sem supervisão médica.
A dose diária de Neoral 100mg deve ser sempre dividida em duas doses (BID). Recomenda-se que Neoral seja administrado em um esquema consistente em relação à hora do dia e em relação às refeições. Toranja e suco de toranja afetam o metabolismo, aumentando a concentração sanguínea de ciclosporina, portanto, devem ser evitados.
Populações Específicas
Insuficiência Renal em Transplante de Rim, Fígado e Coração
A ciclosporina sofre eliminação renal mínima e sua farmacocinética não parece ser significativamente alterada em pacientes com doença renal em estágio terminal que recebem tratamentos de hemodiálise de rotina. FARMACOLOGIA CLÍNICA ). No entanto, devido ao seu potencial nefrotóxico (ver AVISOS ), recomenda-se monitorização cuidadosa da função renal; a dosagem de ciclosporina deve ser reduzida se indicada (ver AVISOS e PRECAUÇÕES ).
Insuficiência renal na artrite reumatóide e psoríase
Pacientes com função renal comprometida não devem receber ciclosporina (ver CONTRA-INDICAÇÕES , AVISOS e PRECAUÇÕES ).
Insuficiência hepática
A depuração da ciclosporina pode ser significativamente reduzida em pacientes com doença hepática grave (ver FARMACOLOGIA CLÍNICA ). A redução da dose pode ser necessária em pacientes com insuficiência hepática grave para manter as concentrações sanguíneas dentro da faixa alvo recomendada (ver AVISOS e PRECAUÇÕES ).
Pacientes Recém-Transplantados
dose oral inicial de Neoral 25mg pode ser administrada 4 a 12 horas antes do transplante ou no pós-operatório. A dose inicial de Neoral 25mg varia de acordo com o órgão transplantado e os demais agentes imunossupressores incluídos no protocolo imunossupressor. Em pacientes recém-transplantados, a dose oral inicial de Neoral é a mesma que a dose oral inicial de Sandimmune. As doses iniciais sugeridas estão disponíveis a partir dos resultados de uma pesquisa de 1994 sobre o uso de Sandimmune em centros de transplante dos EUA. As doses iniciais médias ± DP foram 9 ± 3 mg/kg/dia para pacientes com transplante renal (75 centros), 8 ± 4 mg/kg/dia para pacientes com transplante de fígado (30 centros) e 7 ± 3 mg/kg/dia para pacientes transplantados cardíacos (24 centros). As doses diárias totais foram divididas em duas doses diárias iguais. A dose de Neoral é subsequentemente ajustada para atingir uma concentração sanguínea de ciclosporina predefinida (ver Monitoramento da Concentração Sanguínea em Pacientes Transplantados abaixo de). Se forem utilizadas concentrações sanguíneas mínimas de ciclosporina, o intervalo alvo é o mesmo para Neoral 100 mg e para Sandimmune. O uso da mesma faixa alvo de concentração mínima para Neoral 100mg que para Sandimmune resulta em maior exposição à ciclosporina quando Neoral é administrado (ver Farmacocinética, Absorção ). A dosagem deve ser titulada com base em avaliações clínicas de rejeição e tolerabilidade. Doses mais baixas de Neoral 100mg podem ser suficientes como terapia de manutenção.
terapia adjuvante com corticosteroides adrenais é recomendada inicialmente. Diferentes esquemas de dosagem de prednisona parecem alcançar resultados semelhantes. Um esquema de dosagem representativo com base no peso do paciente começou com 2,0 mg/kg/dia nos primeiros 4 dias, diminuindo para 1,0 mg/kg/dia em 1 semana, 0,6 mg/kg/dia em 2 semanas, 0,3 mg/kg/dia em 1 mês e 0,15 mg/kg/dia em 2 meses e posteriormente como dose de manutenção. As doses de esteróides podem ser ainda mais reduzidas de forma individualizada, dependendo do estado do paciente e da função do enxerto. Ajustes na dosagem de prednisona devem ser feitos de acordo com a situação clínica.
Conversão de Sandimmune para Neoral 25mg em Pacientes Transplantados
Em pacientes transplantados que são considerados para conversão para Neoral de Sandimmune, Neoral deve ser iniciado com a mesma dose diária que foi usada anteriormente com Sandimmune (conversão de dose 1:1). A dose de Neoral deve ser subsequentemente ajustada para atingir a concentração sanguínea mínima de ciclosporina pré-conversão. O uso da mesma faixa alvo de concentração mínima para Neoral 100mg que para Sandimmune resulta em maior exposição à ciclosporina quando Neoral é administrado (ver Farmacocinética, Absorção ). Pacientes com suspeita de má absorção de Sandimmune requerem diferentes estratégias de dosagem (ver Pacientes de transplante com má absorção de Sandimmune, abaixo de). Em alguns pacientes, o aumento na concentração sanguínea de vale é mais pronunciado e pode ter significância clínica.
Até que a concentração sanguínea mínima atinja o valor de pré-conversão, é fortemente recomendado que a concentração sanguínea mínima de ciclosporina seja monitorada a cada 4 a 7 dias após a conversão para Neoral. Além disso, os parâmetros de segurança clínica, como creatinina sérica e pressão arterial, devem ser monitorados a cada duas semanas durante os primeiros dois meses após a conversão. Se as concentrações sanguíneas mínimas estiverem fora do intervalo desejado e/ou se os parâmetros de segurança clínica piorarem, a dosagem de Neoral 100mg deve ser ajustada adequadamente.
Pacientes transplantados com má absorção de Sandimmune
Os doentes com concentrações sanguíneas mínimas de ciclosporina inferiores às esperadas em relação à dose oral de Sandimmune podem ter uma absorção deficiente ou inconsistente da ciclosporina de Sandimmune. Após a conversão para Neoral, os pacientes tendem a apresentar concentrações mais altas de ciclosporina. Devido ao aumento da biodisponibilidade da ciclosporina após a conversão para Neoral, a concentração sanguínea mínima da ciclosporina pode exceder o intervalo alvo. Deve-se ter cuidado especial ao converter pacientes para Neoral 100mg em doses superiores a 10mg/kg/dia. dose de Neoral deve ser titulada individualmente com base nas concentrações mínimas de ciclosporina, tolerabilidade e resposta clínica. Nesta população, a concentração sanguínea mínima de ciclosporina deve ser medida com mais frequência, pelo menos duas vezes por semana (diariamente, se a dose inicial exceder 10 mg/kg/dia) até que a concentração se estabilize dentro do intervalo desejado.
Artrite reumatoide
A dose inicial de Neoral é de 2,5 mg/kg/dia, tomada duas vezes ao dia como uma dose oral dividida (BID). Salicilatos, AINEs e corticosteroides orais podem ser continuados (ver AVISOS e PRECAUÇÕES , INTERAÇÕES MEDICAMENTOSAS ). O início da ação geralmente ocorre entre 4 e 8 semanas. Se for observado benefício clínico insuficiente e a tolerabilidade for boa (incluindo creatinina sérica inferior a 30% acima da linha de base), a dose pode ser aumentada em 0,5 a 0,75 mg/kg/dia após 8 semanas e novamente após 12 semanas até um máximo de 4 mg /kg/dia. Se nenhum benefício for observado em 16 semanas de terapia, a terapia com Neoral 25mg deve ser descontinuada.
redução da dose em 25% a 50% deve ser feita a qualquer momento para controlar os eventos adversos, por exemplo, elevações da hipertensão na creatinina sérica (30% acima do nível pré-tratamento do paciente) ou anormalidades laboratoriais clinicamente significativas (ver AVISOS e PRECAUÇÕES ).
Se a redução da dose não for eficaz no controle de anormalidades ou se o evento adverso ou anormalidade for grave, Neoral 25mg deve ser descontinuado. A mesma dose inicial e faixa de dosagem deve ser usada se Neoral 25mg for combinado com a dose recomendada de metotrexato. A maioria dos pacientes pode ser tratada com doses de Neoral 25 mg de 3 mg/kg/dia ou menos quando combinadas com doses de metotrexato de até 15 mg/semana (ver FARMACOLOGIA CLÍNICA , Testes clínicos ).
Há dados limitados de tratamento a longo prazo. A recorrência da atividade da doença da artrite reumatóide é geralmente aparente dentro de 4 semanas após a interrupção da ciclosporina.
Psoríase
dose inicial de Neoral 100mg deve ser de 2,5mg/kg/dia. Neoral deve ser tomado duas vezes ao dia, como uma dose oral dividida (1,25 mg/kg BID). Os pacientes devem ser mantidos nessa dose por pelo menos 4 semanas, exceto eventos adversos. Se não ocorrer melhora clínica significativa nos pacientes até esse momento, a dosagem do paciente deve ser aumentada em intervalos de 2 semanas. Com base na resposta do paciente, aumentos de dose de aproximadamente 0,5 mg/kg/dia devem ser feitos até um máximo de 4,0 mg/kg/dia.
A diminuição da dose em 25% a 50% deve ser feita a qualquer momento para controlar eventos adversos, por exemplo, hipertensão, elevações na creatinina sérica (≥ 25% acima do nível pré-tratamento do paciente) ou anormalidades laboratoriais clinicamente significativas. Se a redução da dose não for eficaz no controle de anormalidades, ou se o evento adverso ou anormalidade for grave, Neoral 25mg deve ser descontinuado (ver Monitoramento Especial de Pacientes com Psoríase ).
Os pacientes geralmente apresentam alguma melhora nas manifestações clínicas da psoríase em 2 semanas. O controle satisfatório e a estabilização da doença podem levar de 12 a 16 semanas para serem alcançados. Os resultados de um ensaio clínico de titulação de dose com Neoral 25mg indicam que uma melhora da psoríase em 75% ou mais (com base no PASI) foi alcançada em 51% dos pacientes após 8 semanas e em 79% dos pacientes após 16 semanas. O tratamento deve ser descontinuado se a resposta satisfatória não puder ser alcançada após 6 semanas com 4 mg/kg/dia ou a dose máxima tolerada pelo paciente. Uma vez que o paciente esteja adequadamente controlado e pareça estável, a dose de Neoral 25mg deve ser reduzida e o paciente tratado com a dose mais baixa que mantenha uma resposta adequada (isso não deve necessariamente ser a eliminação total do paciente). Em ensaios clínicos, doses de ciclosporina na extremidade inferior da faixa de dosagem recomendada foram eficazes na manutenção de uma resposta satisfatória em 60% dos pacientes. Doses abaixo de 2,5 mg/kg/dia também podem ser igualmente eficazes.
Ao interromper o tratamento com ciclosporina, a recidiva ocorrerá em aproximadamente 6 semanas (50% dos pacientes) a 16 semanas (75% dos pacientes). Na maioria dos pacientes não ocorre rebote após a interrupção do tratamento com ciclosporina. Foram relatados 13 casos de transformação de psoríase em placas crônica para formas mais graves de psoríase. Houve 9 casos de psoríase pustulosa e 4 casos de psoríase eritrodérmica. A experiência de longo prazo com Neoral em pacientes com psoríase é limitada e o tratamento contínuo por períodos prolongados superiores a um ano não é recomendado. A alternância com outras formas de tratamento deve ser considerada no manejo de longo prazo de pacientes com esta doença ao longo da vida.
Neoral 25mg Solução Oral (solução oral de ciclosporina, USP) MODIFICADA - Recomendações para Administração
Para tornar o Neoral 25mg Solução Oral (solução oral de ciclosporina, USP) MODIFICADO mais palatável, deve ser diluído com suco de laranja ou maçã em temperatura ambiente. Os pacientes devem evitar trocar os diluentes com frequência. O suco de toranja afeta o metabolismo da ciclosporina e deve ser evitado. A combinação da solução Neoral com leite pode ser desagradável. O efeito do leite na biodisponibilidade da ciclosporina quando administrado como Neoral 100mg Solução Oral não foi avaliado.
Retire a quantidade prescrita de Neoral 25mg Solução Oral (solução oral de ciclosporina, USP) MODIFICADA do recipiente usando a seringa dosadora fornecida, após a remoção da tampa protetora, e transfira a solução para um copo de suco de laranja ou maçã. Mexa bem e beba de uma vez. Não deixe a solução oral diluída repousar antes de beber. Use um recipiente de vidro (não de plástico). Enxágue o copo com mais diluente para garantir que a dose total seja consumida. Após o uso, seque a parte externa da seringa de dosagem com uma toalha limpa e recoloque a capa protetora. Não lave a seringa doseadora com água ou outros agentes de limpeza. Se a seringa necessitar de limpeza, deve estar completamente seca antes de voltar a ser utilizada.
Monitoramento da Concentração Sanguínea em Pacientes Transplantados
Centros de transplante descobriram que o monitoramento da concentração sanguínea de ciclosporina é um componente essencial do manejo do paciente. De importância para a análise da concentração sanguínea são o tipo de ensaio usado, o órgão transplantado e outros agentes imunossupressores que estão sendo administrados. Embora nenhuma relação fixa tenha sido estabelecida, o monitoramento da concentração sanguínea pode auxiliar na avaliação clínica de rejeição e toxicidade, ajustes de dose e avaliação da adesão.
Vários ensaios têm sido usados para medir as concentrações sanguíneas de ciclosporina. Estudos mais antigos usando um ensaio não específico frequentemente citavam concentrações que eram aproximadamente o dobro dos ensaios específicos. Portanto, a comparação entre as concentrações na literatura publicada e uma concentração de paciente individual usando os ensaios atuais deve ser feita com conhecimento detalhado dos métodos de ensaio empregados. Os resultados dos ensaios atuais também não são intercambiáveis e seu uso deve ser orientado por sua rotulagem aprovada. Uma discussão dos diferentes métodos de ensaio está contida em Annals of Clinical Biochemistry 1994; 31: 420-446. Embora vários ensaios e matrizes de ensaios estejam disponíveis, há um consenso de que ensaios específicos de compostos originais se correlacionam melhor com eventos clínicos. Destes, HPLC é a referência padrão, mas os anticorpos monoclonais RIAs e o anticorpo monoclonal FPIA oferecem sensibilidade, reprodutibilidade e conveniência. A maioria dos médicos baseia seu monitoramento nas concentrações mínimas de ciclosporina. Applied Pharmacokinetics, Principles of Therapeutic Drug Monitoring (1992) contém uma ampla discussão da farmacocinética da ciclosporina e técnicas de monitoramento de drogas. O monitoramento da concentração sanguínea não substitui o monitoramento da função renal ou biópsias de tecidos.
COMO FORNECIDO
Cápsulas de Gelatina Mole Neoral® (Cápsulas de Ciclosporina, USP) MODIFICADA
25 mg
Oval, cinza-azulado impresso em vermelho, “Neoral” sobre “25 mg”.
Embalagens de 30 blisters de dose unitária ( NDC 0078-0246-15).
100 mg
Oblongo, azul-acinzentado impresso em vermelho, “NEORAL” sobre “100 mg”.
Embalagens de 30 blisters de dose unitária ( NDC 0078-0248-15).
Armazenar e Dispensar
No recipiente de dose unitária original em temperatura ambiente controlada de 68°F a 77°F (20°C a 25°C).
Solução Oral Neoral® (Solução Oral de Ciclosporina, USP) MODIFICADA
Um líquido amarelo claro fornecido em frascos de 50 mL contendo 100 mg/mL ( NDC 0078-0274-22).
Armazenar e Dispensar
No recipiente original em temperatura ambiente controlada de 68°F a 77°F (20° a 25°C). Não guarde na geladeira. Uma vez aberto, o conteúdo deve ser utilizado no prazo de dois meses. Em temperaturas abaixo de 20°C (68°F) a solução pode gelificar; floculação leve ou a formação de um sedimento leve também pode ocorrer. Não há impacto no desempenho ou dosagem do produto usando a seringa fornecida. Deixe aquecer até a temperatura ambiente de 25°C (77°F) para reverter essas mudanças.
Cápsulas de gelatina mole Neoral® (cápsulas de ciclosporina, USP) MODIFICADA
Neoral® Oral Solution (solução oral de ciclosporina, USP) MODIFICADO
Distribuído por: Novartis Pharmaceuticals Corporation, East Hanover, Nova Jersey 07936. Revisado em junho de 2021.
EFEITOS COLATERAIS
Transplante de Rim, Fígado e Coração
As principais reações adversas da terapia com ciclosporina são disfunção renal, tremor, hirsutismo, hipertensão e hiperplasia gengival.
Hipertensão
hipertensão, que geralmente é leve a moderada, pode ocorrer em aproximadamente 50% dos pacientes após transplante renal e na maioria dos pacientes com transplante cardíaco.
Trombose capilar glomerular
Trombose capilar glomerular foi encontrada em pacientes tratados com ciclosporina e pode evoluir para falência do enxerto. As alterações patológicas assemelhavam-se às observadas na síndrome hemolítico-urêmica e incluíam trombose da microvasculatura renal, com trombos plaquetas-fibrina ocluindo capilares glomerulares e arteríolas aferentes, anemia hemolítica microangiopática, trombocitopenia e diminuição da função renal. Achados semelhantes foram observados quando outros imunossupressores foram empregados após o transplante.
Hipomagnesemia
Hipomagnesemia foi relatada em alguns, mas não em todos, pacientes que apresentaram convulsões durante a terapia com ciclosporina. Embora estudos de depleção de magnésio em indivíduos normais sugiram que a hipomagnesemia está associada a distúrbios neurológicos, vários fatores, incluindo hipertensão, metilprednisolona em altas doses, hipocolesterolemia e nefrotoxicidade associada a altas concentrações plasmáticas de ciclosporina parecem estar relacionados às manifestações neurológicas de toxicidade da ciclosporina.
INTERAÇÕES MEDICAMENTOSAS
Efeito de drogas e outros agentes na farmacocinética e/ou segurança da ciclosporina
Todas as drogas individuais citadas abaixo são bem fundamentadas para interagir com a ciclosporina. Além disso, o uso concomitante de AINEs com ciclosporina, particularmente no cenário de desidratação, pode potencializar a disfunção renal. Deve-se ter cautela ao usar outros medicamentos que sabidamente prejudicam a função renal (ver AVISOS , Nefrotoxicidade ).
Medicamentos que podem potencializar a disfunção renal
Durante o uso concomitante de um medicamento que pode apresentar insuficiência renal aditiva ou sinérgica com a ciclosporina, deve ser realizada uma monitorização cuidadosa da função renal (em particular da creatinina sérica). Se ocorrer um comprometimento significativo da função renal, a dosagem do medicamento coadministrado deve ser reduzida ou um tratamento alternativo considerado.
A ciclosporina é extensivamente metabolizada pelas isoenzimas CYP 3A, em particular CYP3A4, e é um substrato da glicoproteína P do transportador de efluxo de múltiplas drogas. Vários agentes são conhecidos por aumentar ou diminuir as concentrações de ciclosporina no plasma ou no sangue total, geralmente por inibição ou indução do transportador de CYP3A4 ou P-glicoproteína ou ambos. Os compostos que diminuem a absorção da ciclosporina, como o orlistat, devem ser evitados. O ajuste adequado da dose de Neoral 100mg para atingir as concentrações desejadas de ciclosporina é essencial quando drogas que alteram significativamente as concentrações de ciclosporina são usadas concomitantemente (ver B Monitoramento de Concentração de Sangue ).
1. Medicamentos que aumentam as concentrações de ciclosporina
Inibidores da Protease do HIV
Os inibidores da protease do HIV (por exemplo, indinavir, nelfinavir, ritonavir e saquinavir) são conhecidos por inibir o citocromo P-450 3A e, portanto, podem aumentar as concentrações de ciclosporina, no entanto, não há estudos formais de interação disponíveis. Deve-se ter cuidado quando esses medicamentos são administrados concomitantemente.
Suco de toranja
Toranja e suco de toranja afetam o metabolismo, aumentando as concentrações sanguíneas de ciclosporina, portanto, devem ser evitados.
2. Medicamentos/suplementos dietéticos que diminuem as concentrações de ciclosporina
Bosentana
coadministração de bosentana (250 a 1.000 mg a cada 12 horas com base na tolerabilidade) e ciclosporina (300 mg a cada 12 horas por 2 dias e, em seguida, dosagem para atingir uma Cmax de 200 a 250 ng/mL) por 7 dias em indivíduos saudáveis resultou em diminuição da a AUC, Cmax e concentração mínima normalizada pela dose de ciclosporina de aproximadamente 50%, 30% e 60%, respectivamente, em comparação com quando a ciclosporina foi administrada sozinha (consulte Efeito da ciclosporina na farmacocinética e/ou segurança de outras drogas ou agentes ). A coadministração de ciclosporina com bosentana deve ser evitada.
Boceprevir
A coadministração de boceprevir (800 mg três vezes ao dia por 7 dias) e ciclosporina (dose única de 100 mg) em indivíduos saudáveis resultou em aumentos na AUC média e Cmax da ciclosporina aproximadamente 2,7 vezes e 2 vezes, respectivamente, em comparação com quando a ciclosporina foi dado sozinho.
Telaprevir
coadministração de telaprevir (750 mg a cada 8 horas por 11 dias) com ciclosporina (10 mg no dia 8) em indivíduos saudáveis resultou em aumentos na AUC média normalizada e Cmax da ciclosporina aproximadamente 4,5 vezes e 1,3 vezes, respectivamente, em comparação com quando a ciclosporina (dose única de 100 mg) foi administrada isoladamente.
Erva de São João
Houve relatos de uma interação medicamentosa séria entre a ciclosporina e o suplemento dietético à base de ervas St. John's Wort. Foi relatado que esta interação produz uma redução acentuada nas concentrações sanguíneas de ciclosporina, resultando em níveis subterapêuticos, rejeição de órgãos transplantados e perda do enxerto.
Rifabutina
A rifabutina é conhecida por aumentar o metabolismo de outras drogas metabolizadas pelo sistema citocromo P-450. A interação entre rifabutina e ciclosporina não foi estudada. Deve-se ter cuidado quando esses dois medicamentos são administrados concomitantemente.
Efeito da ciclosporina na farmacocinética e/ou segurança de outras drogas ou agentes
ciclosporina é um inibidor do CYP3A4 e de múltiplos transportadores de efluxo de fármacos (por exemplo, glicoproteína P) e pode aumentar as concentrações plasmáticas de medicamentos que são substratos do CYP3A4, glicoproteína P ou proteínas transportadoras de ânions orgânicos.
A ciclosporina pode reduzir a depuração de digoxina, colchicina, prednisolona, inibidores da HMG-CoA redutase (estatinas) e alisquireno, bosentana, dabigatrana, repaglinida, AINEs, sirolimus, etoposídeo e outros medicamentos.
Consulte as informações completas de prescrição do outro medicamento para obter mais informações e recomendações específicas. A decisão sobre a coadministração de ciclosporina com outros medicamentos ou agentes deve ser tomada pelo profissional de saúde após avaliação cuidadosa dos benefícios e riscos.
Digoxina
A toxicidade digitálica grave foi observada alguns dias após o início da ciclosporina em vários pacientes em uso de digoxina. Se digoxina for usada concomitantemente com ciclosporina, as concentrações séricas de digoxina devem ser monitoradas.
Colchicina
Existem relatos sobre o potencial da ciclosporina para potencializar os efeitos tóxicos da colchicina, como miopatia e neuropatia, especialmente em pacientes com disfunção renal. A administração concomitante de ciclosporina e colchicina resulta em aumentos significativos nas concentrações plasmáticas de colchicina. Se a colchicina for usada concomitantemente com a ciclosporina, recomenda-se uma redução na dosagem de colchicina.
Inibidores da HMG-CoA redutase (estatinas)
literatura e casos pós-comercialização de miotoxicidade, incluindo dor e fraqueza muscular, miosite e rabdomiólise, foram relatados com a administração concomitante de ciclosporina com lovastatina, sinvastatina, atorvastatina, pravastatina e, raramente, fluvastatina. Quando administrados concomitantemente com ciclosporina, a dosagem dessas estatinas deve ser reduzida de acordo com as recomendações da bula. A terapia com estatina deve ser temporariamente suspensa ou descontinuada em pacientes com sinais e sintomas de miopatia ou aqueles com fatores de risco que predispõem a lesão renal grave, incluindo insuficiência renal, secundária a rabdomiólise.
Repaglinida
ciclosporina pode aumentar as concentrações plasmáticas de repaglinida e, assim, aumentar o risco de hipoglicemia. Em 12 indivíduos saudáveis do sexo masculino que receberam duas doses de 100 mg de ciclosporina cápsula por via oral com 12 horas de intervalo com uma dose única de 0,25 mg de comprimido de repaglinida (metade de um comprimido de 0,5 mg) por via oral 13 horas após a dose inicial de ciclosporina, a Cmax média de repaglinida e AUC aumentaram 1,8 vezes (intervalo: 0,6 a 3,7 vezes) e 2,4 vezes (intervalo de 1,2 a 5,3 vezes), respectivamente. A monitorização cuidadosa do nível de glicose no sangue é aconselhável para um paciente tomando ciclosporina e repaglinida concomitantemente.
Ambrisentano
coadministração de ambrisentana (5 mg por dia) e ciclosporina (100 a 150 mg duas vezes ao dia inicialmente, depois a dosagem para atingir Cmax 150 a 200 ng/mL) por 8 dias em indivíduos saudáveis resultou em aumentos médios na AUC e Cmax de ambrisentana de aproximadamente 2- vezes e 1,5 vezes, respectivamente, em comparação com ambrisentana isoladamente. Ao coadministrar ambrisentana com ciclosporina, a dose de ambrisentana não deve ser titulada para a dose diária máxima recomendada
Antibióticos antraciclinas
Altas doses de ciclosporina (por exemplo, na dose intravenosa inicial de 16 mg/kg/dia) podem aumentar a exposição a antibióticos antraciclinas (por exemplo, doxorrubicina, mitoxantrona, daunorrubicina) em pacientes com câncer.
Alisquireno
ciclosporina altera a farmacocinética do alisquireno, um substrato da glicoproteína P e do CYP3A4. Em 14 indivíduos saudáveis que receberam concomitantemente doses únicas de ciclosporina (200 mg) e dose reduzida de alisquireno (75 mg), a Cmax média de alisquireno foi aumentada em aproximadamente 2,5 vezes (IC 90%: 1,96 a 3,17) e a AUC média por aproximadamente 4,3 vezes (IC 90%: 3,52 a 5,21), em comparação com quando esses indivíduos receberam apenas alisquireno. A administração concomitante de alisquireno com ciclosporina prolongou a meia-vida mediana de eliminação do alisquireno (26 horas versus 43 a 45 horas) e a T (0,5 horas versus 1,5 a 2,0 horas). A AUC média e Cmax da ciclosporina foram comparáveis aos valores relatados na literatura. A coadministração de ciclosporina e alisquireno nesses indivíduos também resultou em um aumento no número e/ou intensidade de eventos adversos, principalmente dor de cabeça, ondas de calor, náuseas, vômitos e sonolência. A coadministração de ciclosporina com alisquireno não é recomendada.
Bosentana
Em indivíduos saudáveis, a coadministração de bosentana e ciclosporina resultou em aumentos médios dependentes do tempo na dose normalizada
concentrações mínimas de bosentana (ou seja, aproximadamente 21 vezes no dia 1 e 2 vezes no dia 8 (estado estacionário)) em comparação com quando bosentana foi administrada isoladamente em dose única no dia 1 (consulte Efeito de drogas e outros agentes na farmacocinética e/ou segurança da ciclosporina ). A coadministração de ciclosporina com bosentana deve ser evitada.
Dabigatrano
O efeito da ciclosporina nas concentrações de dabigatrana não foi formalmente estudado. A administração concomitante de dabigatrana e ciclosporina pode resultar em aumento das concentrações plasmáticas de dabigatrana devido à atividade inibitória da P-gp da ciclosporina. A coadministração de ciclosporina com dabigatrana deve ser evitada.
Diuréticos Poupadores de Potássio
ciclosporina não deve ser usada com diuréticos poupadores de potássio porque pode ocorrer hipercalemia. Também é necessária cautela quando a ciclosporina é coadministrada com medicamentos poupadores de potássio (por exemplo, inibidores da enzima de conversão da angiotensina, antagonistas dos receptores da angiotensina II), medicamentos contendo potássio, bem como em pacientes com dieta rica em potássio. O controle dos níveis de potássio nestas situações é aconselhável.
Interações de anti-inflamatórios não esteroides (AINEs)
O estado clínico e a creatinina sérica devem ser cuidadosamente monitorados quando a ciclosporina é usada com AINEs em pacientes com artrite reumatoide (ver AVISOS ).
Foram relatadas interações farmacodinâmicas entre a ciclosporina e o naproxeno e o sulindaco, em que o uso concomitante está associado a diminuições aditivas da função renal, conforme determinado pelas depurações de PAH de ácido 99mTc-dietilenotriaminopentaacético (DTPA) e (ácido p-aminohipúrico). Embora a administração concomitante de diclofenaco não afete as concentrações sanguíneas de ciclosporina, tem sido associada à duplicação aproximada das concentrações sanguíneas de diclofenaco e relatos ocasionais de diminuição reversível da função renal. Consequentemente, a dose de diclofenaco deve estar no limite inferior da faixa terapêutica.
Interação do Metotrexato
Dados preliminares indicam que quando metotrexato e ciclosporina foram coadministrados a pacientes com artrite reumatoide (N = 20), as concentrações de metotrexato (AUCs) aumentaram aproximadamente 30% e as concentrações (AUCs) de seu metabólito, 7-hidroximetotrexato, foram reduzidas em aproximadamente 80 %. O significado clínico desta interação não é conhecido. As concentrações de ciclosporina não parecem ter sido alteradas (N = 6).
Sirolimus
Elevações na creatinina sérica foram observadas em estudos usando sirolimus em combinação com a dose completa de ciclosporina. Este efeito é muitas vezes reversível com a redução da dose de ciclosporina. A coadministração simultânea de ciclosporina aumenta significativamente os níveis sanguíneos de sirolimus. Para minimizar os aumentos nas concentrações de sirolímus, recomenda-se que o sirolímus seja administrado 4 horas após a administração de ciclosporina.
Nifedipina
Foi relatada hiperplasia gengival frequente quando a nifedipina é administrada concomitantemente com a ciclosporina. O uso concomitante de nifedipina deve ser evitado em pacientes nos quais a hiperplasia gengival se desenvolve como efeito colateral da ciclosporina.
Metilprednisolona
Foram relatadas convulsões quando metilprednisolona em altas doses é administrada concomitantemente com ciclosporina.
Outros medicamentos e agentes imunossupressores
Pacientes com psoríase recebendo outros agentes imunossupressores ou radioterapia (incluindo PUVA e UVB) não devem receber ciclosporina concomitantemente devido à possibilidade de imunossupressão excessiva.
Efeito da ciclosporina na eficácia de vacinas vivas
Durante o tratamento com ciclosporina, a vacinação pode ser menos eficaz. O uso de vacinas vivas deve ser evitado.
Para obter informações adicionais sobre interações medicamentosas com ciclosporina, entre em contato com o Departamento de Assuntos Médicos da Novartis pelo telefone 1-888- NOW-NOVA [1-888-669-6682].
AVISOS
(Veja também AVISO EM CAIXA )
Todos os pacientes
ciclosporina, ingrediente ativo do Neoral 25mg, pode causar nefrotoxicidade e hepatotoxicidade. O risco aumenta com doses crescentes de ciclosporina. A disfunção renal, incluindo lesão renal estrutural, é uma consequência potencial de Neoral 100mg e, portanto, a função renal deve ser monitorada durante o tratamento. Cuidados devem ser tomados no uso de ciclosporina com drogas nefrotóxicas (Vejo PRECAUÇÕES ).
Pacientes recebendo Neoral requerem monitoramento frequente da creatinina sérica (ver Monitoramento Especial debaixo DOSAGEM E ADMINISTRAÇÃO ). Os doentes idosos devem ser monitorizados com especial cuidado, uma vez que também ocorrem diminuições da função renal com a idade. Se os pacientes não forem monitorados adequadamente e as doses não forem ajustadas adequadamente, a terapia com ciclosporina pode estar associada à ocorrência de lesão renal estrutural e disfunção renal persistente.
Um aumento na creatinina sérica e BUN pode ocorrer durante a terapia com Neoral e refletir uma redução na taxa de filtração glomerular. A função renal prejudicada a qualquer momento requer monitoramento cuidadoso e o ajuste frequente da dose pode ser indicado. A frequência e a gravidade das elevações da creatinina sérica aumentam com a dose e a duração da terapia com ciclosporina. Essas elevações provavelmente se tornarão mais pronunciadas sem redução da dose ou descontinuação.
Como Neoral 100mg não é bioequivalente a Sandimmune, a conversão de Neoral para Sandimmune usando uma proporção de 1:1 (mg/kg/dia) pode resultar em menores concentrações sanguíneas de ciclosporina. A conversão de Neoral para Sandimmune deve ser feita com maior monitoramento para evitar o potencial de subdosagem.
Transplante de Rim, Fígado e Coração
Nefrotoxicidade
ciclosporina, ingrediente ativo do Neoral, pode causar nefrotoxicidade e hepatotoxicidade quando usada em altas doses. Não é incomum que os níveis séricos de creatinina e BUN sejam elevados durante a terapia com ciclosporina. Essas elevações em pacientes com transplante renal não indicam necessariamente rejeição, e cada paciente deve ser totalmente avaliado antes de iniciar o ajuste de dose.
Com base na experiência histórica de Sandimmune com solução oral, a nefrotoxicidade associada à ciclosporina foi observada em 25% dos casos de transplante renal, 38% dos casos de transplante cardíaco e 37% dos casos de transplante hepático. A nefrotoxicidade leve foi geralmente observada 2 a 3 meses após o transplante renal e consistiu em uma parada na queda das elevações pré-operatórias de BUN e creatinina na faixa de 35 a 45 mg/dL e 2,0 a 2,5 mg/dL, respectivamente. Estas elevações foram frequentemente responsivas à redução da dosagem de ciclosporina.
nefrotoxicidade mais evidente foi observada logo após o transplante e foi caracterizada por um rápido aumento do BUN e da creatinina. Como esses eventos são semelhantes aos episódios de rejeição renal, deve-se ter cuidado para diferenciá-los. Esta forma de nefrotoxicidade geralmente responde à redução da dosagem de ciclosporina.
Embora não tenham sido encontrados critérios diagnósticos específicos que diferenciem de forma confiável a rejeição do enxerto renal da toxicidade do medicamento, vários parâmetros foram significativamente associados a um ou outro. Deve-se notar, no entanto, que até 20% dos pacientes podem apresentar nefrotoxicidade e rejeição simultâneas.
Uma forma de nefropatia associada à ciclosporina é caracterizada por deterioração em série da função renal e alterações morfológicas nos rins. De 5% a 15% dos receptores de transplante que receberam ciclosporina não apresentarão redução na elevação da creatinina sérica apesar da diminuição ou interrupção da terapia com ciclosporina. As biópsias renais desses pacientes demonstrarão uma ou várias das seguintes alterações: vacuolização tubular, microcalcificações tubulares, congestão capilar peritubular, arteriolopatia e uma forma listrada de fibrose intersticial com atrofia tubular. Embora nenhuma dessas alterações morfológicas seja totalmente específica, um diagnóstico de nefrotoxicidade estrutural associada à ciclosporina requer evidências desses achados.
Ao considerar o desenvolvimento de nefropatia associada à ciclosporina, vale ressaltar que vários autores relataram uma associação entre o aparecimento de fibrose intersticial e doses cumulativas mais altas ou concentrações circulantes de vale persistentemente altas de ciclosporina. Isto é particularmente verdadeiro durante os primeiros 6 meses pós-transplante, quando a dosagem tende a ser mais alta e quando, em receptores de rim, o órgão parece ser mais vulnerável aos efeitos tóxicos da ciclosporina. Entre outros fatores que contribuem para o desenvolvimento de fibrose intersticial nesses pacientes estão o tempo de perfusão prolongado, o tempo de isquemia quente, assim como episódios de toxicidade aguda e rejeição aguda e crônica. A reversibilidade da fibrose intersticial e sua correlação com a função renal ainda não foram determinadas. A reversibilidade da arteriopatia foi relatada após a interrupção da ciclosporina ou redução da dose.
função renal prejudicada a qualquer momento requer monitoramento cuidadoso e o ajuste frequente da dose pode ser indicado.
No caso de rejeição grave e persistente, quando a terapia de resgate com pulsos de esteróides e anticorpos monoclonais não consegue reverter o episódio de rejeição, pode ser preferível mudar para terapia imunossupressora alternativa em vez de aumentar a dose de Neoral para concentrações sanguíneas excessivas.
Devido ao potencial de comprometimento aditivo ou sinérgico da função renal, deve-se ter cautela ao coadministrar Neoral com outros medicamentos que podem prejudicar a função renal (ver PRECAUÇÕES , INTERAÇÕES MEDICAMENTOSAS ).
Microangiopatia Trombótica
Ocasionalmente, os pacientes desenvolveram uma síndrome de trombocitopenia e anemia hemolítica microangiopática que pode resultar em falha do enxerto. A vasculopatia pode ocorrer na ausência de rejeição e é acompanhada por consumo ávido de plaquetas dentro do enxerto, conforme demonstrado por estudos de plaquetas marcadas com índio 111. Nem a patogênese nem o manejo dessa síndrome são claros. Embora a resolução tenha ocorrido após a redução ou descontinuação da ciclosporina e 1) administração de estreptoquinase e heparina ou 2) plasmaférese, isso parece depender da detecção precoce com cintilografia de plaquetas marcadas com índio 111 (ver REAÇÕES ADVERSAS ).
Hipercalemia
Hipercalemia significativa (às vezes associada à acidose metabólica hiperclorêmica) e hiperuricemia foram observadas ocasionalmente em pacientes individuais.
Hepatotoxicidade
Casos de hepatotoxicidade e lesão hepática, incluindo colestase, icterícia, hepatite e insuficiência hepática, foram relatados em pacientes tratados com ciclosporina. A maioria dos relatos incluiu pacientes com comorbidades significativas, condições subjacentes e outros fatores de confusão, incluindo complicações infecciosas e medicações com potencial hepatotóxico. Em alguns casos, principalmente em pacientes transplantados, foram relatados desfechos fatais (ver REAÇÕES ADVERSAS , Experiência pós-comercialização, transplante de rim, fígado e coração ).
Hepatotoxicidade, geralmente manifestada por elevações nas enzimas hepáticas e bilirrubina, foi relatada em pacientes tratados com ciclosporina em ensaios clínicos: 4% no transplante renal, 7% no transplante cardíaco e 4% no transplante hepático. Isso geralmente foi observado durante o primeiro mês de terapia, quando altas doses de ciclosporina foram usadas. As elevações químicas geralmente diminuíam com a redução da dosagem.
Malignidades
Assim como em pacientes que recebem outros imunossupressores, os pacientes que recebem ciclosporina apresentam risco aumentado para o desenvolvimento de linfomas e outras malignidades, particularmente aquelas da pele. Pacientes em uso de ciclosporina devem ser alertados para evitar exposição excessiva à luz ultravioleta. O risco aumentado parece estar relacionado à intensidade e duração da imunossupressão e não ao uso de agentes específicos. Devido ao perigo de supersupressão do sistema imunológico, resultando em aumento do risco de infecção ou malignidade, um regime de tratamento contendo vários imunossupressores deve ser usado com cautela. Algumas malignidades podem ser fatais. Pacientes transplantados recebendo ciclosporina apresentam risco aumentado de infecção grave com desfecho fatal.
Infecções Graves
Pacientes recebendo imunossupressores, incluindo Neoral 100mg, apresentam risco aumentado de desenvolver infecções bacterianas, virais, fúngicas e protozoárias, incluindo infecções oportunistas. Essas infecções podem levar a desfechos graves, inclusive fatais (ver AVISO EM CAIXA , e REAÇÕES ADVERSAS ).
Infecções pelo vírus do polioma
Pacientes recebendo imunossupressores, incluindo Neoral 100mg, apresentam risco aumentado de infecções oportunistas, incluindo infecções pelo vírus do polioma. As infecções pelo vírus do polioma em pacientes transplantados podem ter resultados graves e, às vezes, fatais. Estes incluem casos de leucoencefalopatia multifocal progressiva associada ao vírus JC (LMP) e nefropatia associada ao vírus polioma (PVAN), especialmente devido à infecção pelo vírus BK, que foram observadas em pacientes que receberam ciclosporina. O PVAN está associado a desfechos graves, incluindo deterioração da função renal e perda do enxerto renal (ver REAÇÕES ADVERSAS , Experiência pós-comercialização, transplante de rim, fígado e coração ). O monitoramento do paciente pode ajudar a detectar pacientes em risco de PVAN.
Casos de LMP foram relatados em pacientes tratados com Neoral. A LMP, que às vezes é fatal, comumente se apresenta com hemiparesia, apatia, confusão, deficiências cognitivas e ataxia. Os fatores de risco para LMP incluem tratamento com terapias imunossupressoras e comprometimento da função imunológica. Em pacientes imunossuprimidos, os médicos devem considerar a LMP no diagnóstico diferencial em pacientes que relatam sintomas neurológicos e a consulta com um neurologista deve ser considerada como clinicamente indicada.
Deve-se considerar a redução da imunossupressão total em pacientes transplantados que desenvolvem LMP ou PVAN. No entanto, a redução da imunossupressão pode colocar o enxerto em risco.
Neurotoxicidade
Houve relatos de convulsões em pacientes adultos e pediátricos recebendo ciclosporina, particularmente em combinação com altas doses de metilprednisolona.
encefalopatia, incluindo a Síndrome da Encefalopatia Posterior Reversível (PRES), foi descrita tanto em relatórios pós-comercialização quanto na literatura. As manifestações incluem diminuição da consciência, convulsões, distúrbios visuais (incluindo cegueira), perda da função motora, distúrbios do movimento e distúrbios psiquiátricos. Em muitos casos, as alterações na substância branca foram detectadas usando técnicas de imagem e espécimes patológicos. Fatores predisponentes, como hipertensão, hipomagnesemia, hipocolesterolemia, altas doses de corticosteroides, altas concentrações sanguíneas de ciclosporina e doença do enxerto contra o hospedeiro, foram observados em muitos, mas não em todos os casos relatados. As alterações na maioria dos casos foram reversíveis com a descontinuação da ciclosporina e, em alguns casos, a melhora foi observada após a redução da dose. Parece que os pacientes que recebem transplante de fígado são mais suscetíveis à encefalopatia do que aqueles que recebem transplante de rim. Outra manifestação rara de neurotoxicidade induzida pela ciclosporina, ocorrendo em pacientes transplantados com mais frequência do que em outras indicações, é o edema do disco óptico, incluindo papiledema, com possível comprometimento visual, secundário à hipertensão intracraniana benigna.
Deve-se ter cuidado ao usar ciclosporina com drogas nefrotóxicas (ver PRECAUÇÕES ).
Artrite reumatoide
A nefropatia por ciclosporina foi detectada em biópsias renais de 6 de 60 (10%) pacientes com artrite reumatóide após a duração média do tratamento de 19 meses. Apenas um paciente, desses 6 pacientes, foi tratado com uma dose ≤ 4 mg/kg/dia. A creatinina sérica melhorou em todos, exceto um paciente, após a descontinuação da ciclosporina. O “aumento máximo de creatinina” parece ser um fator preditivo de nefropatia por ciclosporina.

Existe um potencial, como com outros agentes imunossupressores, para um aumento na ocorrência de linfomas malignos com ciclosporina. Não está claro se o risco com a ciclosporina é maior do que em pacientes com artrite reumatóide ou em pacientes com artrite reumatóide em tratamento citotóxico para esta indicação. Cinco casos de linfoma foram detectados: quatro em uma pesquisa com aproximadamente 2.300 pacientes tratados com ciclosporina para artrite reumatóide, e outro caso de linfoma foi relatado em um ensaio clínico. Embora outros tumores (12 cânceres de pele, 24 tumores sólidos de diversos tipos e 1 mieloma múltiplo) também tenham sido relatados nesta pesquisa, as análises epidemiológicas não apoiaram uma relação com a ciclosporina além dos linfomas malignos.
Os pacientes devem ser cuidadosamente avaliados antes e durante o tratamento com Neoral 25mg para o desenvolvimento de malignidades. Além disso, o uso da terapia Neoral 25mg com outros agentes imunossupressores pode induzir uma imunossupressão excessiva que é conhecida por aumentar o risco de malignidade.
Psoríase
(Veja também AVISO EM CAIXA para psoríase )
Como a ciclosporina é um agente imunossupressor potente com vários efeitos colaterais potencialmente graves, os riscos e benefícios do uso de Neoral 100mg devem ser considerados antes do tratamento de pacientes com psoríase. A ciclosporina, o ingrediente ativo de Neoral, pode causar nefrotoxicidade e hipertensão (ver PRECAUÇÕES ) e o risco aumenta com o aumento da dose e duração da terapia. Pacientes com risco aumentado, como aqueles com função renal anormal, hipertensão não controlada ou neoplasias, não devem receber Neoral.
A disfunção renal é uma consequência potencial de Neoral, portanto, a função renal deve ser monitorada durante o tratamento.
Pacientes recebendo Neoral 100mg requerem monitoramento frequente da creatinina sérica (ver Monitoramento Especial debaixo DOSAGEM E ADMINISTRAÇÃO ). Os doentes idosos devem ser monitorizados com especial cuidado, uma vez que também ocorrem diminuições da função renal com a idade. Se os pacientes não forem monitorados adequadamente e as doses não forem ajustadas adequadamente, a terapia com ciclosporina pode causar danos estruturais nos rins e disfunção renal persistente.
Um aumento na creatinina sérica e BUN pode ocorrer durante a terapia com Neoral 25mg e reflete uma redução na taxa de filtração glomerular.
Biópsias renais de 86 pacientes com psoríase tratados por uma duração média de 23 meses com 1,2 a 7,6 mg/kg/dia de ciclosporina mostraram evidência de nefropatia por ciclosporina em 18/86 (21%) dos pacientes. A patologia consistiu em atrofia tubular renal e fibrose intersticial. Na biópsia repetida de 13 desses pacientes mantidos em várias dosagens de ciclosporina por uma média de 2 anos adicionais, o número com nefropatia induzida por ciclosporina subiu para 26/86 (30%). A maioria dos doentes (19/26) estava a tomar uma dose ≥ 5,0 mg/kg/dia (a dose mais elevada recomendada é de 4 mg/kg/dia). Os pacientes também estavam em uso de ciclosporina por mais de 15 meses (18/26) e/ou tiveram um aumento clinicamente significativo na creatinina sérica por mais de 1 mês (21/26). Os níveis de creatinina retornaram ao intervalo normal em 7 de 11 pacientes nos quais a terapia com ciclosporina foi descontinuada.
Existe um risco aumentado para o desenvolvimento de malignidades da pele e linfoproliferativas em pacientes com psoríase tratados com ciclosporina. O risco relativo de malignidades é comparável ao observado em pacientes com psoríase tratados com outros agentes imunossupressores.
Os tumores foram relatados em 32 (2,2%) dos 1.439 pacientes com psoríase tratados com ciclosporina em todo o mundo a partir de ensaios clínicos. Tumores adicionais foram relatados em 7 pacientes na experiência pós-comercialização com ciclosporina. Malignidades de pele foram relatadas em 16 (1,1%) desses pacientes; todos, exceto 2 deles, já haviam recebido terapia com PUVA. O metotrexato foi recebido por 7 pacientes.
UVB e alcatrão de carvão foram usados por 2 e 3 pacientes, respectivamente. Sete pacientes tinham história de câncer de pele prévio ou uma lesão potencialmente predisponente estava presente antes da exposição à ciclosporina. Dos 16 pacientes com câncer de pele, 11 pacientes tinham 18 carcinomas espinocelulares e 7 pacientes tinham 10 carcinomas basocelulares.
Havia duas malignidades linfoproliferativas; um caso de linfoma não Hodgkin que necessitou de quimioterapia e um caso de micose fungóide que regrediu espontaneamente com a descontinuação da ciclosporina. Houve quatro casos de infiltração linfocítica benigna: 3 regrediram espontaneamente com a descontinuação da ciclosporina, enquanto o quarto regrediu apesar da continuação da droga. O restante das neoplasias, 13 casos (0,9%), envolveu vários órgãos.
Os pacientes não devem ser tratados concomitantemente com ciclosporina e PUVA ou UVB, outras radioterapias ou outros agentes imunossupressores, devido à possibilidade de imunossupressão excessiva e ao risco subsequente de malignidades (Vejo CONTRA-INDICAÇÕES ). Os pacientes também devem ser avisados para se protegerem adequadamente quando estiverem ao sol e evitarem exposição excessiva ao sol. Os pacientes devem ser cuidadosamente avaliados antes e durante o tratamento quanto à presença de malignidades, lembrando que as lesões malignas podem estar ocultas por placas psoriáticas. As lesões cutâneas não típicas da psoríase devem ser biopsiadas antes do início do tratamento. Os pacientes devem ser tratados com Neoral somente após a resolução completa das lesões suspeitas e somente se não houver outras opções de tratamento (ver Monitoramento especial para pacientes com psoríase ).
Excipientes Especiais
Álcool (etanol)
O teor alcoólico (ver DESCRIÇÃO de Neoral 100mg deve ser levado em consideração quando administrado a pacientes nos quais a ingestão de álcool deve ser evitada ou minimizada, por exemplo, mulheres grávidas ou lactantes, em pacientes com doença hepática ou epilepsia, em pacientes alcoólatras ou pacientes pediátricos. Para um adulto pesando 70 kg, a dose oral diária máxima forneceria cerca de 1 grama de álcool, que é aproximadamente 6% da quantidade de álcool contida em uma bebida padrão.
PRECAUÇÕES
Em geral
Hipertensão
A ciclosporina é o ingrediente ativo do Neoral. A hipertensão é um efeito colateral comum da terapia com ciclosporina que pode persistir (ver REAÇÕES ADVERSAS e DOSAGEM E ADMINISTRAÇÃO para recomendações de monitoramento). A hipertensão leve ou moderada é encontrada com mais frequência do que a hipertensão grave e a incidência diminui com o tempo. Em receptores de aloenxertos de rim, fígado e coração tratados com ciclosporina, pode ser necessária terapia anti-hipertensiva (ver Monitoramento Especial da Artrite Reumatóide e Pacientes com psoríase ). No entanto, como a ciclosporina pode causar hipercalemia, os diuréticos poupadores de potássio não devem ser usados. Embora os antagonistas do cálcio possam ser agentes eficazes no tratamento da hipertensão associada à ciclosporina, eles podem interferir no metabolismo da ciclosporina. INTERAÇÕES MEDICAMENTOSAS ).
Vacinação
Durante o tratamento com ciclosporina, a vacinação pode ser menos eficaz; e o uso de vacinas vivas atenuadas deve ser evitado.
Monitoramento Especial de Pacientes com Artrite Reumatóide
Antes de iniciar o tratamento, deve ser realizado um exame físico cuidadoso, incluindo medições da pressão arterial (em pelo menos duas ocasiões) e dois níveis de creatinina para estimar a linha de base. A pressão arterial e a creatinina sérica devem ser avaliadas a cada 2 semanas durante os 3 meses iniciais e depois mensalmente se o paciente estiver estável. É aconselhável monitorar a creatinina sérica e a pressão arterial sempre após o aumento da dose de anti-inflamatórios não esteroides (AINEs) e após o início de nova terapia com AINEs durante o tratamento com Neoral 25mg. Se coadministrado com metotrexato, recomenda-se que o hemograma completo e os testes de função hepática sejam monitorados mensalmente (ver PRECAUÇÕES , Geral, Hipertensão ).
Em pacientes que estão recebendo ciclosporina, a dose de Neoral deve ser reduzida em 25% a 50% se ocorrer hipertensão. Se a hipertensão persistir, a dose de Neoral 100mg deve ser reduzida ainda mais ou a pressão arterial deve ser controlada com agentes anti-hipertensivos. Na maioria dos casos, a pressão arterial voltou à linha de base quando a ciclosporina foi descontinuada.
Em estudos controlados por placebo de pacientes com artrite reumatóide, hipertensão sistólica (definida como uma ocorrência de duas leituras de pressão arterial sistólica > 140 mmHg) e hipertensão diastólica (definida como duas leituras de pressão arterial diastólica > 90 mmHg) ocorreram em 33% e 19% dos pacientes tratados com ciclosporina, respectivamente. As taxas de placebo correspondentes foram de 22% e 8%.
Monitoramento especial para pacientes com psoríase
Antes de iniciar o tratamento, deve ser realizado um cuidadoso exame dermatológico e físico, incluindo medidas de pressão arterial (em pelo menos duas ocasiões). Como Neoral é um agente imunossupressor, os pacientes devem ser avaliados quanto à presença de infecção oculta no primeiro exame físico e quanto à presença de tumores inicialmente e durante todo o tratamento com Neoral. As lesões cutâneas não típicas da psoríase devem ser biopsiadas antes de iniciar Neoral. Pacientes com alterações malignas ou pré-malignas da pele devem ser tratados com Neoral 100mg somente após o tratamento adequado de tais lesões e se não houver outra opção de tratamento.
Os laboratórios de linha de base devem incluir creatinina sérica (em duas ocasiões), ureia, hemograma completo, magnésio sérico, potássio, ácido úrico e lipídios.
risco de nefropatia por ciclosporina é reduzido quando a dose inicial é baixa (2,5 mg/kg/dia), a dose máxima não excede 4,0 mg/kg/dia, a creatinina sérica é monitorada regularmente enquanto a ciclosporina é administrada e a dose de Neoral 25mg é diminuído quando o aumento da creatinina é maior ou igual a 25% acima do nível pré-tratamento do paciente. O aumento da creatinina é geralmente reversível com a diminuição oportuna da dose de Neoral ou sua descontinuação.
A creatinina sérica e a ureia devem ser avaliadas a cada 2 semanas durante os 3 meses iniciais de terapia e depois mensalmente se o paciente estiver estável. Se a creatinina sérica for maior ou igual a 25% acima do nível pré-tratamento do paciente, a creatinina sérica deve ser repetida dentro de duas semanas. Se a alteração na creatinina sérica permanecer maior ou igual a 25% acima da linha de base, Neoral 25mg deve ser reduzido em 25% a 50%. Se em a qualquer momento se a creatinina sérica aumentar mais ou igual a 50% acima do nível pré-tratamento, Neoral 25mg deve ser reduzido em 25% a 50%. Neoral deve ser descontinuado se a reversibilidade (dentro de 25% da linha de base) da creatinina sérica não for alcançada após duas modificações de dosagem. É aconselhável monitorar a creatinina sérica após o aumento da dose do anti-inflamatório não esteroidal e após o início de nova terapia anti-inflamatória não esteroidal durante o tratamento com Neoral 25mg.
pressão arterial deve ser avaliada a cada 2 semanas durante os 3 meses iniciais de terapia e, em seguida, mensalmente se o paciente estiver estável, ou com mais frequência quando forem feitos ajustes de dose. Pacientes sem histórico de hipertensão prévia antes do início do tratamento com Neoral devem ter a droga reduzida em 25% a 50% se houver hipertensão sustentada. Se o paciente continuar hipertenso apesar das múltiplas reduções de Neoral 25mg, Neoral deve ser descontinuado. Para pacientes com hipertensão tratada, antes do início da terapia com Neoral 100mg, sua medicação deve ser ajustada para controlar a hipertensão durante o tratamento com Neoral. Neoral 100mg deve ser descontinuado se uma mudança no manejo da hipertensão não for eficaz ou tolerável.
Hemograma, ácido úrico, potássio, lipídios e magnésio também devem ser monitorados a cada 2 semanas durante os primeiros 3 meses de terapia e, em seguida, mensalmente se o paciente estiver estável ou com mais frequência quando forem feitos ajustes de dose. A dosagem de Neoral 25mg deve ser reduzida em 25% a 50% para qualquer anormalidade de interesse clínico.
Em estudos controlados de ciclosporina em pacientes com psoríase, as concentrações sanguíneas de ciclosporina não se correlacionaram bem com a melhora ou com efeitos colaterais, como disfunção renal.
Testes laboratoriais
Em todos os pacientes tratados com ciclosporina, as funções renal e hepática devem ser avaliadas repetidamente pela medição da creatinina sérica, BUN, bilirrubina sérica e enzimas hepáticas. Lipídios séricos, magnésio e potássio também devem ser monitorados.
As concentrações sanguíneas de ciclosporina devem ser monitoradas rotineiramente em pacientes transplantados (ver DOSAGEM E ADMINISTRAÇÃO , Monitoramento da Concentração Sanguínea em Pacientes Transplantados ), e monitorados periodicamente em pacientes com artrite reumatóide.
Carcinogênese, mutagênese e comprometimento da fertilidade
Estudos de carcinogenicidade foram realizados em ratos e camundongos machos e fêmeas. No estudo de 78 semanas em camundongos, foi encontrada evidência de uma tendência estatisticamente significativa para linfomas linfocíticos em fêmeas, e a incidência de carcinomas hepatocelulares em machos de dose média excedeu significativamente o valor de controle. No estudo de 24 meses em ratos, os adenomas de células das ilhotas pancreáticas excederam significativamente a taxa de controle no nível de dose baixa. As doses usadas nos estudos em camundongos e ratos foram de 0,01 a 0,16 vezes a dose de manutenção clínica (6 mg/kg). Os carcinomas hepatocelulares e os adenomas de células das ilhotas pancreáticas não foram relacionados com a dose. Relatórios publicados indicam que o co-tratamento de camundongos sem pêlos com irradiação UV e ciclosporina ou outros agentes imunossupressores encurtam o tempo para a formação do tumor de pele em comparação com a irradiação UV sozinha.
ciclosporina não foi mutagênica em sistemas de teste apropriados. A ciclosporina não foi considerada mutagênica/genotóxica no teste de Ames, no teste V79-HGPRT, no teste de micronúcleo em camundongos e hamsters chineses, nos testes de aberração cromossômica na medula óssea de hamster chinês, no ensaio letal dominante em camundongo e no Teste de reparo de DNA em espermatozoides de camundongos tratados. Um estudo recente analisando a indução de troca de cromátides irmãs (SCE) por ciclosporina usando linfócitos humanos in vitro deu indicação de um efeito positivo (ou seja, indução de SCE), em altas concentrações neste sistema. Em dois estudos publicados, coelhos expostos à ciclosporina in utero (10 mg/kg/dia por via subcutânea) demonstraram redução do número de néfrons, hipertrofia renal, hipertensão sistêmica e insuficiência renal progressiva até 35 semanas de idade. Ratas grávidas que receberam 12 mg/kg/dia de ciclosporina por via intravenosa (duas vezes a dose intravenosa humana recomendada) tiveram fetos com incidência aumentada de defeito do septo ventricular. Esses achados não foram demonstrados em outras espécies e sua relevância para humanos é desconhecida.
Nenhum prejuízo na fertilidade foi demonstrado em estudos em ratos machos e fêmeas.
A papilomatose da pele amplamente distribuída foi observada após o tratamento crônico de cães com ciclosporina em 9 vezes a dose inicial do tratamento da psoríase humana de 2,5 mg/kg, onde as doses são expressas com base na área de superfície corporal. Esta papilomatose apresentou regressão espontânea com a descontinuação da ciclosporina.
Uma incidência aumentada de malignidade é uma complicação reconhecida da imunossupressão em receptores de transplantes de órgãos e pacientes com artrite reumatóide e psoríase. As formas mais comuns de neoplasias são o linfoma não Hodgkin e os carcinomas da pele. O risco de malignidades em receptores de ciclosporina é maior do que na população normal e saudável, mas semelhante ao de pacientes recebendo outras terapias imunossupressoras. A redução ou interrupção da imunossupressão pode fazer com que as lesões regridam.
Em pacientes com psoríase em uso de ciclosporina, foi relatado o desenvolvimento de malignidades, especialmente as da pele (ver AVISOS ). As lesões cutâneas não típicas da psoríase devem ser biopsiadas antes de iniciar o tratamento com ciclosporina. Pacientes com alterações malignas ou pré-malignas da pele devem ser tratados com ciclosporina somente após o tratamento adequado de tais lesões e se não houver outra opção de tratamento.
Gravidez
Estudos em animais mostraram toxicidade reprodutiva em ratos e coelhos. A ciclosporina não evidenciou efeitos mutagênicos ou teratogênicos nos sistemas de teste padrão com aplicação oral (ratos até 17 mg/kg e coelhos até 30 mg/kg por dia por via oral). em estudos de reprodução em ratos. A ciclosporina demonstrou ser embriotóxica e fetotóxica em ratos e coelhos após administração oral em doses maternas tóxicas. A toxicidade fetal foi observada em ratos em 0,8 e coelhos em 5,4 vezes as doses de transplante em humanos de 6,0 mg/kg, onde as correções de dose são baseadas na área de superfície corporal. A ciclosporina foi embriotóxica e fetotóxica, conforme indicado pelo aumento da mortalidade pré e pós-natal e redução do peso fetal juntamente com retardo esquelético relacionado.
Não existem estudos adequados e bem controlados em mulheres grávidas, portanto, Neoral não deve ser usado durante a gravidez, a menos que o benefício potencial para a mãe justifique o risco potencial para o feto.
Em receptoras de transplante grávidas que estão sendo tratadas com imunossupressores, o risco de parto prematuro é aumentado. Os dados a seguir representam os resultados relatados de 116 gestações em mulheres que receberam ciclosporina durante a gravidez, 90% das quais eram pacientes transplantadas e a maioria das quais recebeu ciclosporina durante todo o período gestacional. Os únicos padrões consistentes de anormalidade foram nascimento prematuro (período gestacional de 28 a 36 semanas) e baixo peso ao nascer para a idade gestacional. Ocorreram dezesseis perdas fetais. A maioria das gestações (85 de 100) foi complicada por distúrbios; incluindo pré-eclâmpsia, eclâmpsia, parto prematuro, descolamento prematuro da placenta, oligoidrâmnio, incompatibilidade Rh e disfunção fetoplacentária. O parto prematuro ocorreu em 47%. Sete malformações foram relatadas em 5 lactentes viáveis e em 2 casos de perda fetal. Vinte e oito por cento dos bebês eram pequenos para a idade gestacional. Complicações neonatais ocorreram em 27%. Portanto, os riscos e benefícios do uso de Neoral durante a gravidez devem ser cuidadosamente avaliados.
Está disponível um número limitado de observações em crianças expostas à ciclosporina in utero, até uma idade de aproximadamente 7 anos. A função renal e a pressão arterial nessas crianças eram normais.
Devido à possível interrupção da interação materno-fetal, a relação risco/benefício do uso de Neoral em pacientes com psoríase durante a gravidez deve ser cuidadosamente ponderada, considerando seriamente a descontinuação de Neoral.
O teor alcoólico das formulações de Neoral 100mg também deve ser levado em consideração em mulheres grávidas (ver AVISOS , Excipientes Especiais ).
Mães que amamentam
ciclosporina está presente no leite materno. Devido ao potencial de reações adversas graves a medicamentos em lactentes com Neoral 100mg, deve-se decidir entre descontinuar a amamentação ou descontinuar o medicamento, levando em consideração a importância do medicamento para a mãe. Neoral contém etanol. O etanol estará presente no leite humano em níveis semelhantes aos encontrados no soro materno e, se presente no leite materno, será absorvido oralmente pelo lactente (ver AVISOS ).
Uso Pediátrico
Embora não tenham sido concluídos estudos adequados e bem controlados em crianças, receptores de transplantes a partir de um ano de idade receberam Neoral sem efeitos adversos incomuns. A segurança e eficácia do tratamento com Neoral em crianças com artrite reumatóide juvenil ou psoríase com idade inferior a 18 anos não foram estabelecidas.
Uso Geriátrico
Em ensaios clínicos de artrite reumatóide com ciclosporina, 17,5% dos pacientes tinham 65 anos ou mais. Esses pacientes eram mais propensos a desenvolver hipertensão sistólica em terapia e mais propensos a apresentar aumentos de creatinina sérica ≥ 50% acima da linha de base após 3 a 4 meses de terapia.
Os estudos clínicos de Neoral 100mg em pacientes transplantados e com psoríase não incluíram um número suficiente de indivíduos com 65 anos ou mais para determinar se eles respondem de forma diferente dos indivíduos mais jovens. Outras experiências clínicas relatadas não identificaram diferenças na resposta entre os pacientes idosos e os mais jovens. Em geral, a seleção da dose para um paciente idoso deve ser cautelosa, geralmente começando no limite inferior da faixa de dosagem, refletindo a maior frequência de diminuição da função hepática, renal ou cardíaca e de doença concomitante ou outra terapia medicamentosa.
SOBREDOSAGEM
Existe uma experiência mínima com superdosagem de ciclosporina. Emese forçada e lavagem gástrica podem ser úteis até 2 horas após a administração de Neoral. Pode ocorrer hepatotoxicidade e nefrotoxicidade transitórias, que devem desaparecer após a retirada do medicamento. Doses orais de ciclosporina de até 10 g (cerca de 150 mg/kg) foram toleradas com consequências clínicas relativamente menores, como vômitos, sonolência, cefaleia, taquicardia e, em alguns pacientes, comprometimento reversível da função renal moderadamente grave. No entanto, sintomas graves de intoxicação foram relatados após superdosagem parenteral acidental com ciclosporina em recém-nascidos prematuros. Medidas gerais de suporte e tratamento sintomático devem ser seguidos em todos os casos de superdosagem. A ciclosporina não é dialisável em grande medida, nem é bem depurada por hemoperfusão com carvão. A dosagem oral na qual se estima que metade dos animais experimentais morra é 31 vezes, 39 vezes e > 54 vezes a dose de manutenção humana para pacientes transplantados (6mg/kg; correções baseadas na área de superfície corporal) em camundongos, ratos e coelhos .
CONTRA-INDICAÇÕES
Em geral
Neoral 100mg é contraindicado em pacientes com hipersensibilidade à ciclosporina ou a qualquer um dos ingredientes da formulação.
Artrite reumatoide
Pacientes com artrite reumatoide com função renal anormal, hipertensão não controlada ou neoplasias não devem receber Neoral.
Psoríase
Pacientes com psoríase tratados com Neoral 100mg não devem receber terapia concomitante com PUVA ou UVB, metotrexato ou outros agentes imunossupressores, alcatrão de carvão ou radioterapia. Pacientes com psoríase com função renal anormal, hipertensão não controlada ou neoplasias não devem receber Neoral.
FARMACOLOGIA CLÍNICA
ciclosporina é um potente agente imunossupressor que em animais prolonga a sobrevida de transplantes alogênicos envolvendo pele, rim, fígado, coração, pâncreas, medula óssea, intestino delgado e pulmão. A ciclosporina demonstrou suprimir alguma imunidade humoral e, em maior extensão, reações imunes mediadas por células, como rejeição de aloenxerto, hipersensibilidade tardia, encefalomielite alérgica experimental, artrite adjuvante de Freund e doença do enxerto versus hospedeiro em muitas espécies animais para uma variedade de órgãos .
A eficácia da ciclosporina resulta da inibição específica e reversível de linfócitos imunocompetentes nas fases G0 e G1 do ciclo celular. Os linfócitos T são preferencialmente inibidos. A célula T auxiliar é o alvo principal, embora a célula Tsupressora também possa ser suprimida. A ciclosporina também inibe a produção e liberação de linfocinas, incluindo interleucina-2.
Não foram detectados efeitos na função fagocítica (alterações nas secreções enzimáticas, migração quimiotática de granulócitos, migração de macrófagos, depuração de carbono in vivo) em animais. A ciclosporina não causa supressão da medula óssea em modelos animais ou no homem.
Farmacocinética
atividade imunossupressora da ciclosporina deve-se principalmente ao fármaco original. Após administração oral, a absorção da ciclosporina é incompleta. A extensão da absorção da ciclosporina depende do paciente individual, da população de pacientes e da formulação. A eliminação da ciclosporina é principalmente biliar, com apenas 6% da dose (fármaco original e metabólitos) excretados na urina. A disposição da ciclosporina do sangue é geralmente bifásica, com meia-vida terminal de aproximadamente 8,4 horas (intervalo de 5 a 18 horas). Após administração intravenosa, a depuração sanguínea da ciclosporina (ensaio: HPLC) é de aproximadamente 5 a 7 mL/min/kg em receptores adultos de aloenxertos renais ou hepáticos. A depuração da ciclosporina no sangue parece ser ligeiramente mais lenta em pacientes com transplante cardíaco.
As Cápsulas de Gelatina Mole Neoral (cápsulas de ciclosporina, USP) MODIFICADAS e a Solução Oral Neoral (solução oral de ciclosporina, USP) MODIFICADA são bioequivalentes. Neoral 25mg Solução Oral diluída com sumo de laranja ou sumo de maçã é bioequivalente a Neoral Solução Oral diluída com água. O efeito do leite na biodisponibilidade da ciclosporina quando administrado como Neoral Solução Oral não foi avaliado.
A relação entre a dose administrada e a exposição (área sob a curva de concentração versus tempo, AUC) é linear dentro do intervalo de dose terapêutica. A variabilidade interindividual (total, %CV) da exposição à ciclosporina (AUC) quando Neoral ou Sandimmune é administrado varia de aproximadamente 20% a 50% em pacientes com transplante renal. Esta variabilidade interindividual contribui para a necessidade de individualização do regime de dosagem para a terapia ideal (ver DOSAGEM E ADMINISTRAÇÃO ).
variabilidade intraindividual da AUC em receptores de transplante renal (%CV) foi de 9% a 21% para Neoral e 19% a 26% para Sandimmune. Nos mesmos estudos, a variabilidade intraindividual das concentrações mínimas (%CV) foi de 17% a 30% para Neoral e 16% a 38% para Sandimmune.
Absorção
Neoral aumentou a biodisponibilidade em comparação com Sandimmune. A biodisponibilidade absoluta da ciclosporina administrada como Sandimmune depende da população de pacientes, estimada em menos de 10% em pacientes com transplante de fígado e até 89% em alguns pacientes com transplante renal. A biodisponibilidade absoluta da ciclosporina administrada como Neoral não foi determinada em adultos. Em estudos de pacientes com transplante renal, artrite reumatoide e psoríase, a AUC média da ciclosporina foi aproximadamente 20% a 50% maior e o pico de concentração de ciclosporina no sangue Cmax foi aproximadamente 40% a 106% maior após a administração de Neoral 100mg em comparação com a administração de Sandimmune . A AUC normalizada da dose em pacientes com transplante hepático de novo administrados com Neoral 28 dias após o transplante foi 50% maior e a Cmax foi 90% maior do que naqueles pacientes que receberam Sandimmune. A AUC e a Cmax também estão aumentadas (Neoral em relação ao Sandimmune) em pacientes com transplante cardíaco, mas os dados são muito limitados. Embora os valores de AUC e Cmax sejam maiores com Neoral 100mg em relação ao Sandimmune, as concentrações mínimas pré-dose (normalizadas pela dose) são semelhantes para as duas formulações.
Após a administração oral de Neoral, o tempo para atingir o pico das concentrações de ciclosporina no sangue (Tmax) variou de 1,5 a 2,0 horas. A administração de alimentos com Neoral 25mg diminui a AUC e Cmax da ciclosporina. Uma refeição rica em gordura (669 kcal, 45 gramas de gordura) consumida meia hora antes da administração de Neoral 25mg diminuiu a AUC em 13% e a Cmax em 33%. Os efeitos de uma refeição com baixo teor de gordura (667 kcal, 15 gramas de gordura) foram semelhantes.
O efeito da derivação da bile por tubo T na absorção da ciclosporina de Neoral 25mg foi investigado em onze pacientes com transplante de fígado de novo. Quando os pacientes receberam Neoral com e sem derivação da bile por tubo T, foi observada muito pouca diferença na absorção, medida pela mudança nas concentrações sanguíneas máximas de ciclosporina em relação aos valores pré-dose com o tubo T fechado em relação a quando foi aberto: 6,9 ± 41% (intervalo de 55% a 68%).
População de pacientesDistribuição
ciclosporina é amplamente distribuída fora do volume sanguíneo. O volume de distribuição no estado de equilíbrio durante a administração intravenosa foi relatado como 3 a 5 L/kg em receptores de transplante de órgãos sólidos. No sangue, a distribuição é dependente da concentração. Aproximadamente 33% a 47% está no plasma, 4% a 9% nos linfócitos, 5% a 12% nos granulócitos e 41% a 58% nos eritrócitos. Em altas concentrações, a capacidade de ligação de leucócitos e eritrócitos fica saturada. No plasma, aproximadamente 90% está ligado a proteínas, principalmente lipoproteínas. A ciclosporina é excretada no leite humano (ver PRECAUÇÕES , Mães que amamentam ).
Metabolismo
A ciclosporina é extensivamente metabolizada pelo sistema enzimático do citocromo P-450 3A no fígado e, em menor grau, no trato gastrointestinal e nos rins. O metabolismo da ciclosporina pode ser alterado pela coadministração de uma variedade de agentes (ver PRECAUÇÕES , INTERAÇÕES MEDICAMENTOSAS ). Pelo menos 25 metabólitos foram identificados na bile humana, fezes, sangue e urina. A atividade biológica dos metabólitos e suas contribuições para a toxicidade são consideravelmente menores do que as do composto original. Os principais metabólitos (M1, M9 e M4N) resultam da oxidação nas posições 1-beta, 9-gama e 4-N-desmetiladas, respectivamente. No estado de equilíbrio após a administração oral de Sandimmune, as AUCs médias para as concentrações sanguíneas de M1, M9 e M4N são cerca de 70%, 21% e 7,5% da AUC para as concentrações sanguíneas de ciclosporina, respectivamente. Com base nos dados de concentração sanguínea de pacientes com transplante renal estável (13 pacientes que administraram Neoral e Sandimmune em um estudo cruzado) e dados de concentração de bile de pacientes com transplante de fígado de novo (4 administraram Neoral 100mg, 3 administraram Sandimmune), a porcentagem de dose presente como Os metabólitos M1, M9 e M4N são semelhantes quando Neoral 25mg ou Sandimmune é administrado.
Excreção
Apenas 0,1% de uma dose de ciclosporina é excretada inalterada na urina. A eliminação é principalmente biliar, com apenas 6% da dose (fármaco original e metabólitos) excretados na urina. Nem a diálise nem a insuficiência renal alteram significativamente a depuração da ciclosporina.
Interações medicamentosas
(Ver PRECAUÇÕES , INTERAÇÕES MEDICAMENTOSAS ) Quando o diclofenaco ou metotrexato foi coadministrado com ciclosporina em pacientes com artrite reumatoide, a AUC do diclofenaco e do metotrexato, cada um, foi significativamente aumentada (ver PRECAUÇÕES , INTERAÇÕES MEDICAMENTOSAS ). Não ocorreram interações farmacocinéticas clinicamente significativas entre ciclosporina e aspirina, cetoprofeno, piroxicam ou indometacina.
Populações Específicas
Insuficiência renal
Em um estudo realizado em 4 indivíduos com doença renal terminal (clearance de creatinina
Insuficiência hepática
A ciclosporina é extensivamente metabolizada pelo fígado. Uma vez que a insuficiência hepática grave pode resultar em exposições significativamente aumentadas à ciclosporina, a dosagem de ciclosporina pode precisar ser reduzida nesses pacientes.
População Pediátrica
Os dados farmacocinéticos de pacientes pediátricos que receberam Neoral ou Sandimmune são muito limitados. Em 15 doentes transplantados renais com idades compreendidas entre os 3-16 anos, a depuração da ciclosporina no sangue total após a administração IV de Sandimmune foi de 10,6 ± 3,7 mL/min/kg (ensaio: RIA específico para Cyclotrac). Em um estudo com 7 pacientes transplantados renais com idades entre 2 e 16 anos, a depuração da ciclosporina variou de 9,8 a 15,5 mL/min/kg. Em 9 doentes transplantados hepáticos com idades entre 0,6 e 5,6 anos, a depuração foi de 9,3 ± 5,4 mL/min/kg (ensaio: HPLC).
Na população pediátrica, Neoral também demonstra uma biodisponibilidade aumentada em comparação com Sandimmune. Em 7 pacientes com transplante de fígado de novo com idade de 1,4 a 10 anos, a biodisponibilidade absoluta de Neoral foi de 43% (intervalo de 30% a 68%) e para Sandimmune nos mesmos indivíduos a biodisponibilidade absoluta foi de 28% (intervalo de 17% a 42%).
População Geriátrica
Comparação de dados de dose única de voluntários idosos normais (N = 18, idade média de 69 anos) e pacientes idosos com artrite reumatóide (N = 16, idade média de 68 anos) com dados de dose única em voluntários adultos jovens (N = 16, idade média 26 anos) não apresentou diferença significativa nos parâmetros farmacocinéticos.
Testes clínicos
Artrite reumatoide
A eficácia de Sandimmune e Neoral 100mg no tratamento da artrite reumatóide grave foi avaliada em 5 estudos clínicos envolvendo um total de 728 pacientes tratados com ciclosporina e 273 pacientes tratados com placebo.
Um resumo dos resultados é apresentado para as taxas de “respondedores” por grupo de tratamento, com um respondedor sendo definido como um paciente que completou o estudo com uma melhora de 20% na contagem de articulações dolorosas e inchadas e uma melhora de 20% em 2 dos 4 de investigador global, paciente global, incapacidade e taxas de sedimentação de eritrócitos (ESR) para os estudos 651 e 652 e 3 de 5 de investigador global, paciente global, deficiência, dor analógica visual e ESR para estudos 2008, 654 e 302.
O estudo 651 recrutou 264 pacientes com artrite reumatoide ativa com pelo menos 20 articulações envolvidas, que falharam em pelo menos um dos principais medicamentos para AR, usando uma randomização de 3:3:2 para um dos três grupos a seguir: (1) ciclosporina em dose de 2,5 a 5 mg/kg/dia, (2) metotrexato de 7,5 a 15 mg/semana ou (3) placebo. A duração do tratamento foi de 24 semanas. A dose média de ciclosporina na última consulta foi de 3,1 mg/kg/dia. Veja o gráfico abaixo.
estudo 652 recrutou 250 pacientes com AR ativa com > 6 articulações dolorosas ou sensíveis ativas que falharam em pelo menos um dos principais medicamentos para AR. Os pacientes foram randomizados usando uma randomização 3:3:2 para 1 de 3 braços de tratamento: (1) 1,5 a 5 mg/kg/dia de ciclosporina, (2) 2,5 a 5 mg/kg/dia de ciclosporina e (3) placebo. A duração do tratamento foi de 16 semanas. A dose média de ciclosporina para o grupo 2 na última visita foi de 2,92 mg/kg/dia. Veja o gráfico abaixo.
O estudo de 2008 recrutou 144 pacientes com AR ativa e > 6 articulações ativas que tiveram ciclos de tratamento malsucedidos de aspirina e ouro ou penicilamina. Os pacientes foram randomizados para 1 de 2 grupos de tratamento (1) ciclosporina 2,5 a 5 mg/kg/dia com ajustes após o primeiro mês para atingir um nível mínimo alvo e (2) placebo. A duração do tratamento foi de 24 semanas. A dose média de ciclosporina na última consulta foi de 3,63 mg/kg/dia. Veja o gráfico abaixo.
estudo 654 envolveu 148 pacientes que permaneceram com contagens de articulações ativas de 6 ou mais, apesar do tratamento com doses máximas de metotrexato por pelo menos três meses. Os pacientes continuaram a tomar sua dose atual de metotrexato e foram randomizados para receber, além disso, um dos seguintes medicamentos: (1) ciclosporina 2,5 mg/kg/dia com aumentos de dose de 0,5 mg/kg/dia nas semanas 2 e 4 se não houve evidência de toxicidade e aumentos adicionais de 0,5 mg/kg/dia nas semanas 8 e 16 se uma diminuição
estudo 302 incluiu 299 pacientes com AR grave ativa, 99% dos quais não responderam ou foram intolerantes a pelo menos um medicamento importante para AR anterior. Os pacientes foram randomizados para 1 de 2 grupos de tratamento (1) Neoral 25mg e (2) ciclosporina, ambos iniciados com 2,5 mg/kg/dia e aumentados após 4 semanas para ineficácia em incrementos de 0,5 mg/kg/dia para um máximo de 5 mg/kg/dia e diminuído a qualquer momento para toxicidade. A duração do tratamento foi de 24 semanas. A dose média de ciclosporina na última visita foi de 2,91 mg/kg/dia (intervalo: 0,72 a 5,17) para Neoral e 3,27 mg/kg/dia (intervalo: 0,73 a 5,68) para ciclosporina. Veja o gráfico abaixo.
Estudos clínicos
Em estudos controlados, a natureza, gravidade e incidência dos eventos adversos observados em 493 pacientes transplantados tratados com Neoral foram comparáveis aos observados em 208 pacientes transplantados que receberam Sandimmune nesses mesmos estudos quando a dosagem dos dois medicamentos foi ajustada. para atingir as mesmas concentrações sanguíneas mínimas de ciclosporina.
Com base na experiência histórica com Sandimmune, as seguintes reações ocorreram em 3% ou mais de 892 pacientes envolvidos em ensaios clínicos de transplantes de rim, coração e fígado.
Entre 705 pacientes transplantados renais tratados com solução oral de ciclosporina (Sandimmune) em ensaios clínicos, o motivo da descontinuação do tratamento foi toxicidade renal em 5,4%, infecção em 0,9%, falta de eficácia em 1,4%, necrose tubular aguda em 1,0%, distúrbios linfoproliferativos em 0,3%, hipertensão em 0,3% e outros motivos em 0,7% dos pacientes.
As seguintes reações ocorreram em 2% ou menos dos pacientes tratados com ciclosporina: reações alérgicas, anemia, anorexia, confusão, conjuntivite, edema, febre, unhas quebradiças, gastrite, perda auditiva, soluços, hiperglicemia, enxaqueca (Neoral), dor muscular, úlcera péptica, trombocitopenia, zumbido.
As seguintes reações ocorreram raramente: ansiedade, dor no peito, constipação, depressão, quebra de cabelo, hematúria, dor nas articulações, letargia, feridas na boca, infarto do miocárdio, sudorese noturna, pancreatite, prurido, dificuldade de deglutição, formigamento, sangramento GI superior, distúrbios visuais, fraqueza, perda de peso.
Pacientes recebendo terapias imunossupressoras, incluindo ciclosporina e regimes contendo ciclosporina, apresentam risco aumentado de infecções (virais, bacterianas, fúngicas, parasitárias). Podem ocorrer infecções generalizadas e localizadas. Infecções pré-existentes também podem ser agravadas. Resultados fatais foram relatados (ver AVISOS ).
Experiência pós-comercialização, transplante de rim, fígado e coração
Hepatotoxicidade
Casos de hepatotoxicidade e lesão hepática, incluindo colestase, icterícia, hepatite e insuficiência hepática; foram relatados desfechos graves e/ou fatais (ver AVISOS , Hepatotoxicidade ).
Aumento do risco de infecções
Casos de leucoencefalopatia multifocal progressiva (LMP) associada ao vírus JC, às vezes fatal; e nefropatia associada ao vírus do polioma (PVAN), especialmente o vírus BK resultando em perda do enxerto (ver AVISOS , Infecção pelo vírus do polioma ).
Dor de cabeça, incluindo enxaqueca
Casos de enxaqueca foram relatados. Em alguns casos, os pacientes não conseguiram continuar com a ciclosporina, no entanto, a decisão final sobre a descontinuação do tratamento deve ser feita pelo médico assistente após uma avaliação cuidadosa dos benefícios versus riscos.
Dor de Extremidades Inferiores
Casos isolados de dor nas extremidades inferiores foram relatados em associação com a ciclosporina. A dor nas extremidades inferiores também foi observada como parte da Síndrome da Dor Induzida por Inibidor de Calcineurina (CIPS), conforme descrito na literatura.
Artrite reumatoide
As principais reações adversas associadas ao uso de ciclosporina na artrite reumatoide são disfunção renal (ver AVISOS ), hipertensão (ver PRECAUÇÕES ), cefaleia, distúrbios gastrointestinais e hirsutismo/hipertricose.
Em pacientes com artrite reumatóide tratados em estudos clínicos dentro da faixa de dose recomendada, a terapia com ciclosporina foi descontinuada em 5,3% dos pacientes devido à hipertensão e em 7% dos pacientes devido ao aumento da creatinina. Essas alterações geralmente são reversíveis com a diminuição oportuna da dose ou a descontinuação do medicamento. A frequência e a gravidade das elevações da creatinina sérica aumentam com a dose e a duração da terapia com ciclosporina. Essas elevações provavelmente se tornarão mais pronunciadas sem redução da dose ou descontinuação.
Os seguintes eventos adversos ocorreram em ensaios clínicos controlados:
Além disso, os seguintes eventos adversos foram relatados em 1% a
Sistema nervoso autónomo: boca seca, aumento da sudorese
Corpo como um todo: alergia, astenia, afrontamentos, mal-estar, sobredosagem, procedimento NOS*, tumor NOS*, diminuição de peso, aumento de peso
Cardiovascular: sons cardíacos anormais, insuficiência cardíaca, infarto do miocárdio, isquemia periférica
Sistema Nervoso Central e Periférico: hipoestesia, neuropatia, vertigem
Endócrino: bócio
Gastrointestinal: constipação, disfagia, enantema, eructação, esofagite, úlcera gástrica, gastrite, gastroenterite, sangramento gengival, glossite, úlcera péptica, aumento das glândulas salivares, distúrbio da língua, distúrbio dentário
Infecção: abscesso, infecção bacteriana, celulite, foliculite, infecção fúngica, herpes simples, herpes zoster, abscesso renal, monilíase, amigdalite, infecção viral
Hematologico: anemia, epistaxe, leucopenia, linfadenopatia
Fígado e Sistema Biliar: bilirrubinemia
Metabólico e Nutricional: diabetes mellitus, hipercalemia, hiperuricemia, hipoglicemia
Sistema musculo-esquelético: artralgia, fratura óssea, bursite, luxação articular, mialgia, rigidez, cisto sinovial, distúrbio do tendão
Neoplasias: fibroadenose mamária, carcinoma
Psiquiátrico: ansiedade, confusão, diminuição da libido, labilidade emocional, diminuição da concentração, aumento da libido, nervosismo, paroníria, sonolência
Reprodutivo (Fêmea): dor mamária, hemorragia uterina
Sistema respiratório: sons torácicos anormais, broncoespasmo
Pele e anexos: pigmentação anormal, angioedema, dermatite, pele seca, eczema, afecção das unhas, prurido, afecção da pele, urticária
Sentidos Especiais: visão anormal, catarata, conjuntivite, surdez, dor ocular, alteração do paladar, zumbido, distúrbio vestibular
Sistema urinário: urina anormal, hematúria, aumento da ureia, urgência miccional, noctúria, poliúria, pielonefrite, incontinência urinária
*NOS = Sem outra especificação
Psoríase
As principais reações adversas associadas ao uso de ciclosporina em pacientes com psoríase são disfunção renal, cefaleia, hipertensão, hipertrigliceridemia, hirsutismo/hipertricose, parestesia ou hiperestesia, sintomas gripais, náusea/vômito, diarreia, desconforto abdominal, letargia e alterações musculoesqueléticas. ou dores nas articulações.
Em pacientes com psoríase tratados em estudos clínicos controlados nos EUA dentro da faixa de dose recomendada, a terapia com ciclosporina foi descontinuada em 1,0% dos pacientes devido à hipertensão e em 5,4% dos pacientes devido ao aumento da creatinina. Na maioria dos casos, essas alterações foram reversíveis após a redução da dose ou descontinuação da ciclosporina.
Houve uma morte relatada associada ao uso de ciclosporina na psoríase. Um homem de 27 anos desenvolveu deterioração renal e continuou com ciclosporina. Ele teve insuficiência renal progressiva levando à morte.
frequência e a gravidade da creatinina sérica aumentam com a dose e a duração da terapia com ciclosporina. Essas elevações tendem a se tornar mais pronunciadas e podem resultar em dano renal irreversível sem redução da dose ou descontinuação.
Os seguintes eventos ocorreram em 1% a menos de 3% dos pacientes com psoríase tratados com ciclosporina:
Corpo como um todo: febre, afrontamentos, afrontamentos
Cardiovascular: dor no peito
Sistema Nervoso Central e Periférico: aumento do apetite, insônia, tontura, nervosismo, vertigem
Gastrointestinal: distensão abdominal, constipação, sangramento gengival
Fígado e Sistema Biliar: hiperbilirrubinemia
Neoplasias: malignidades da pele [carcinomas de células escamosas (0,9%) e basocelulares (0,4%)]
Reticuloendotelial: distúrbios plaquetários, hemorrágicos e de coagulação, distúrbios dos glóbulos vermelhos
Respiratório: infecção, infecção viral e outras
Pele e anexos: acne, foliculite, queratose, prurido, erupção cutânea, pele seca
Sistema urinário: frequência de micção
Visão: visão anormal
Hipomagnesemia leve e hipercalemia podem ocorrer, mas são assintomáticas. Podem ocorrer aumentos do ácido úrico e raramente foram relatados ataques de gota. Uma hiperbilirrubinemia menor e relacionada à dose foi observada na ausência de dano hepatocelular. A terapia com ciclosporina pode estar associada a um aumento modesto dos triglicerídeos ou colesterol séricos. Elevações de triglicerídeos (> 750 mg/dL) ocorrem em cerca de 15% dos pacientes com psoríase; elevações do colesterol (> 300 mg/dL) são observadas em menos de 3% dos pacientes com psoríase. Geralmente, essas anormalidades laboratoriais são reversíveis com a redução da dose ou descontinuação da ciclosporina.
Experiência pós-comercialização, psoríase
Foram relatados casos de transformação para psoríase eritrodérmica ou psoríase pustulosa generalizada após a retirada ou redução da ciclosporina em pacientes com psoríase em placas crônica.
INFORMAÇÃO DO PACIENTE
Os pacientes devem ser avisados de que qualquer alteração na formulação da ciclosporina deve ser feita com cautela e somente sob supervisão médica, pois pode resultar na necessidade de alteração na dosagem.
Os pacientes devem ser informados da necessidade de repetir os exames laboratoriais enquanto estiverem recebendo ciclosporina. As pacientes devem ser avisadas sobre os riscos potenciais durante a gravidez e informadas sobre o aumento do risco de neoplasia. Os pacientes também devem ser informados sobre o risco de hipertensão e disfunção renal.
Os pacientes devem ser avisados de que durante o tratamento com ciclosporina, a vacinação pode ser menos eficaz e o uso de vacinas vivas atenuadas deve ser evitado.
Os pacientes devem receber instruções de dosagem cuidadosas. Neoral Solução Oral (solução oral de ciclosporina, USP) MODIFICADA deve ser diluída, preferencialmente com suco de laranja ou maçã que esteja em temperatura ambiente. A combinação de Neoral Oral Solution (solução oral de ciclosporina, USP) MODIFICADA com leite pode ser intragável.
Os pacientes devem ser aconselhados a tomar Neoral 100mg em um esquema consistente em relação à hora do dia e em relação às refeições. Toranja e suco de toranja afetam o metabolismo, aumentando a concentração sanguínea de ciclosporina, portanto, devem ser evitados.
