Hydrea 500mg Hydroxyurea Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Hydrea 500mg e como é usado?
Hydrea (hidroxiureia) é um agente antineoplásico (anticancerígeno) usado para tratar melanoma, leucemia mielocítica crônica resistente e carcinoma recorrente, metastático ou inoperável do ovário e carcinomas primários de células escamosas (epidermóides) de cabeça e pescoço. Hydra está disponível na forma genérica.
Quais são os efeitos colaterais do Hydrea?
Os efeitos colaterais comuns do Hydrea incluem:
- náusea,
- vômito,
- dor de estômago,
- diarréia,
- constipação,
- alterações na pele, como descamação ou descoloração,
- sintomas como os da gripe,
- perda de cabelo,
- irritação na pele,
- dor de cabeça,
- tontura,
- sonolência, ou
- ganho de peso.
Os efeitos colaterais graves do Hydrea incluem:
- anemia,
- mielossupressão e
- leucemia.
DESCRIÇÃO
HYDREA (cápsulas de hidroxiureia, USP) é um antimetabólito disponível para uso oral em cápsulas contendo 500 mg de hidroxiureia. Os ingredientes inativos incluem ácido cítrico, corantes (D&C Yellow No. 10, FD&C Blue No. 1, FD&C Red No. 40 e D&C Red No. 28), gelatina, lactose, estearato de magnésio, fosfato de sódio e dióxido de titânio.
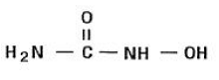
A hidroxiureia é um pó cristalino branco a esbranquiçado. É higroscópico e livremente solúvel em água, mas praticamente insolúvel em álcool. A fórmula empírica é CH4N2O2 e tem um peso molecular de 76,05. Sua fórmula estrutural é:
INDICAÇÕES
HYDREA 500mg é indicado para o tratamento de:
- Leucemia mieloide crônica resistente.
- Carcinomas de células escamosas localmente avançados da cabeça e pescoço (excluindo o lábio) em combinação com quimiorradiação.
DOSAGEM E ADMINISTRAÇÃO
Informações de dosagem
HYDREA é usado sozinho ou em conjunto com outros agentes antitumorais ou radioterapia para tratar doenças neoplásicas. Individualize o tratamento com base no tipo de tumor, estado da doença, resposta ao tratamento, fatores de risco do paciente e padrões atuais da prática clínica.
Baseie toda a dosagem no peso real ou ideal do paciente, o que for menor.
HYDREA é uma droga citotóxica. Siga os procedimentos especiais aplicáveis de manuseio e descarte [consulte REFERÊNCIAS ].
Engula as cápsulas de HYDREA inteiras. NÃO abra, quebre ou mastigue cápsulas porque HYDREA é um medicamento citotóxico.
A administração profilática de ácido fólico é recomendada [ver AVISOS E PRECAUÇÕES ].
Monitore as contagens sanguíneas pelo menos uma vez por semana durante a terapia com HYDREA 500mg. A anemia grave deve ser corrigida antes de iniciar a terapia com HYDREA.
Modificações de dose para toxicidade
Monitore o seguinte e reduza a dose ou descontinue HYDREA 500mg de acordo:
- Mielossupressão [ver AVISOS E PRECAUÇÕES ]
- Vasculite cutânea [ver AVISOS E PRECAUÇÕES ]
Considerar modificações de dose para outras toxicidades.
Modificações de dose para insuficiência renal
Reduza a dose de HYDREA em 50% em pacientes com depuração de creatinina medida inferior a 60 mL/min ou com doença renal terminal (ESRD) [ver Uso em populações específicas e FARMACOLOGIA CLÍNICA ].
A monitorização cuidadosa dos parâmetros hematológicos é aconselhada nestes doentes.
COMO FORNECIDO
Formas de dosagem e pontos fortes
Cápsulas
500 mg tampa verde opaca e corpo rosa opaco impresso com “HYDREA” e “830”.
Armazenamento e manuseio
HYDREA® (cápsulas de hidroxiureia, USP) é fornecido em cápsulas de 500 mg em frascos de HDPE com uma tampa de rosca de segurança de plástico. Cada frasco contém 100 cápsulas.
A tampa é verde opaco e o corpo é rosa opaco. As cápsulas são impressas em ambas as seções com “HYDREA” e “830” em tinta preta ( NDC 0003-0830-50).
Armazenar
Armazenar a 20-25°C (68-77°F); excursões permitidas para 15°C-30°C (59°F-86°F) [veja USP Controlled RoomTemperature]. Mantenha bem fechado.
Manuseio e Descarte
HYDREA 500mg é uma droga citotóxica. Siga os procedimentos especiais aplicáveis de manuseio e descarte [consulte REFERÊNCIAS ].
Para diminuir o risco de contato, aconselhe os profissionais de saúde a usar luvas descartáveis ao manusear HYDREA ou frascos contendo HYDREA. Lave as mãos com água e sabão antes e após o contato com o frasco ou cápsulas ao manusear HYDREA. Não abra as cápsulas de HYDREA 500mg. Evite a exposição a cápsulas esmagadas ou abertas. Se ocorrer contato com cápsulas esmagadas ou abertas na pele, lave a área afetada imediatamente e abundantemente com água e sabão. Se ocorrer contato com cápsulas esmagadas ou abertas no(s) olho(s), a área afetada deve ser lavada abundantemente com água ou colírio isotônico designado para esse fim por pelo menos 15 minutos. Se o pó da cápsula for derramado, limpe-o imediatamente com uma toalha descartável úmida e descarte em um recipiente fechado, como um saco plástico; assim como as cápsulas vazias. As áreas de derramamento devem ser limpas três vezes usando uma solução detergente seguida de água limpa. Mantenha o medicamento longe de crianças e animais de estimação. Contacte o seu médico para obter instruções sobre como eliminar as cápsulas desatualizadas.
REFERÊNCIAS
OSHA. http://www.osha.gov/SLTC/hazardousdrugs/index.html.
Fabricado para: Bristol-Myers Squibb Company Princeton, Nova Jersey 08543 EUA. Revisado: dezembro de 2020
EFEITOS COLATERAIS
As seguintes reações adversas clinicamente significativas são descritas em detalhes em outras seções de rotulagem:
- Mielossupressão [ver AVISOS E PRECAUÇÕES ]
- Malignidades [ver AVISOS E PRECAUÇÕES ]
- Toxicidades vasculíticas [ver AVISOS E PRECAUÇÕES ]
- Riscos com o uso concomitante de medicamentos antirretrovirais [ver AVISOS E PRECAUÇÕES ]
- Recuperação de radiação [consulte AVISOS E PRECAUÇÕES ]
- Macrocitose [ver AVISOS E PRECAUÇÕES ]
- Toxicidade Pulmonar [ver AVISOS E PRECAUÇÕES ]
Experiência pós-marketing
As seguintes reações adversas foram identificadas durante o uso pós-aprovação de HYDREA. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência.
- Distúrbios do sistema reprodutivo e da mama: azoospermia e oligospermia
- Problemas gastrointestinais: estomatite, náuseas, vômitos, diarréia e constipação
- Distúrbios do metabolismo e da nutrição: anorexia, síndrome de lise tumoral
- Distúrbios da pele e tecidos subcutâneos: erupção maculopapular, ulceração da pele, lúpus eritematoso cutâneo, alterações cutâneas semelhantes a dermatomiosite, eritema periférico e facial, hiperpigmentação, hiperpigmentação das unhas, atrofia da pele e das unhas, descamação, pápulas violáceas e alopecia
- Distúrbios renais e urinários: disúria, elevações no ácido sérico, nitrogênio ureico no sangue (BUN) e níveis de creatinina
- Distúrbios do sistema nervoso: dor de cabeça, tontura, sonolência, desorientação, alucinações e convulsões
- Distúrbios Gerais: febre, calafrios, mal-estar, edema e astenia
- Distúrbios hepatobiliares: elevação de enzimas hepáticas, colestase e hepatite
- Distúrbios respiratórios: infiltrados pulmonares difusos, dispneia e fibrose pulmonar, doença pulmonar intersticial, pneumonite, alveolite, alveolite alérgica e tosse
- Distúrbios imunológicos: lúpus eritematoso sistêmico
- Hipersensibilidade: Febre induzida por drogas (pirexia) (>39°C, >102°F) que requer hospitalização foi relatada concomitantemente com manifestações gastrointestinais, pulmonares, musculoesqueléticas, hepatobiliares, dermatológicas ou cardiovasculares. O início ocorreu tipicamente dentro de 6 semanas após o início e foi resolvido com a descontinuação da hidroxiureia. Após a readministração, a febre voltou a ocorrer normalmente dentro de 24 horas.
As reações adversas observadas com hidroxiureia combinada e terapia de irradiação são semelhantes às relatadas com o uso de hidroxiureia ou radioterapia isolada. Esses efeitos incluem principalmente depressão da medula óssea (anemia e leucopenia), irritação gástrica e mucosite. Quase todos os pacientes que recebem um curso adequado de terapia combinada de hidroxiureia e irradiação apresentarão leucopenia concomitante. A depressão plaquetária (
INTERAÇÕES MEDICAMENTOSAS
Aumento da toxicidade com o uso concomitante de medicamentos antirretrovirais
Pancreatite
Em pacientes com infecção pelo HIV durante a terapia com hidroxiureia e didanosina, com ou sem estavudina, ocorreu pancreatite fatal e não fatal. A hidroxiureia não é indicada para o tratamento da infecção pelo HIV; no entanto, se os doentes com infecção por VIH forem tratados com hidroxiureia e, em particular, em combinação com didanosina e/ou estavudina, recomenda-se uma monitorização cuidadosa dos sinais e sintomas de pancreatite. Descontinuar permanentemente a terapia com hidroxiureia em pacientes que desenvolverem sinais e sintomas de pancreatite.
Hepatotoxicidade
Hepatotoxicidade e insuficiência hepática resultando em morte foram relatadas durante a vigilância pós-comercialização em pacientes com infecção pelo HIV tratados com hidroxiureia e outros medicamentos antirretrovirais. Eventos hepáticos fatais foram relatados com mais frequência em pacientes tratados com a combinação de hidroxiureia, didanosina e estavudina. Evite esta combinação.
Neuropatia periférica
neuropatia periférica, que foi grave em alguns casos, foi relatada em pacientes com infecção pelo HIV recebendo hidroxiureia em combinação com medicamentos antirretrovirais, incluindo didanosina, com ou sem estavudina.
Interferência de teste de laboratório
Interferência com ensaios de ácido úrico, ureia ou ácido lático
Estudos demonstraram que há interferência analítica da hidroxiureia com as enzimas (urease, uricase e lactato desidrogenase) utilizadas na determinação de uréia, ácido úrico e ácido lático, apresentando resultados falsamente elevados destas em pacientes tratados com hidroxiureia.
AVISOS
Incluído como parte do "PRECAUÇÕES" Seção
PRECAUÇÕES
Mielossupressão
hidroxiureia causa mielossupressão grave. O tratamento com hidroxiureia não deve ser iniciado se a função da medula óssea estiver marcadamente deprimida. A supressão da medula óssea pode ocorrer e a leucopenia geralmente é sua primeira e mais comum manifestação. Trombocitopenia e anemia ocorrem com menos frequência e raramente são observadas sem uma leucopenia precedente. A depressão da medula óssea é mais provável em pacientes que já receberam radioterapia ou agentes quimioterápicos citotóxicos para câncer; use hidroxiureia com cautela nesses pacientes.
Avalie o estado hematológico antes e durante o tratamento com HYDREA. Fornecer cuidados de suporte e modificar a dose ou descontinuar HYDREA conforme necessário. A recuperação da mielossupressão geralmente é rápida quando a terapia é interrompida.
Malignidades
hidroxiureia é um carcinógeno humano. Em pacientes recebendo hidroxiureia a longo prazo para distúrbios mieloproliferativos, foi relatada leucemia secundária. O câncer de pele também foi relatado em pacientes que receberam hidroxiureia a longo prazo. Aconselhe proteção contra exposição solar e monitore o desenvolvimento de malignidades secundárias.
Toxicidade Embrio-Fetal
Com base no mecanismo de ação e achados em animais, HYDREA 500mg pode causar dano fetal quando administrado a uma mulher grávida. A hidroxiureia foi embriotóxica e teratogénica em ratos e coelhos em doses 0,8 vezes e 0,3 vezes, respectivamente, a dose diária humana máxima recomendada numa base de mg/m2. Aconselhar as mulheres grávidas sobre o risco potencial para o feto [ver Uso em populações específicas ].
Aconselhe as mulheres com potencial reprodutivo a usar contracepção eficaz durante e após o tratamento com HYDREA 500mg por pelo menos 6 meses após a terapia. Aconselhar homens com potencial reprodutivo a usar contracepção eficaz durante e após o tratamento com HYDREA 500mg por pelo menos 1 ano após a terapia [ver Uso em populações específicas ].
Toxicidades Vasculíticas
Toxicidades vasculíticas cutâneas, incluindo ulcerações vasculíticas e gangrena, ocorreram em pacientes com distúrbios mieloproliferativos durante a terapia com hidroxiureia. Essas toxicidades vasculíticas foram relatadas com mais frequência em pacientes com histórico de ou atualmente recebendo terapia com interferon. Se ocorrerem úlceras vasculíticas cutâneas, instituir tratamento e descontinuar HYDREA.
Vacinas ao vivo
Evitar o uso de vacina viva em pacientes tomando HYDREA. O uso concomitante de HYDREA com uma vacina de vírus vivo pode potencializar a replicação do vírus e/ou pode aumentar a reação adversa da vacina porque os mecanismos de defesa normais podem ser suprimidos por HYDREA. A vacinação com vacinas vivas em um paciente recebendo HYDREA 500mg pode resultar em infecção grave. A resposta de anticorpos do paciente às vacinas pode ser diminuída. Considere consultar um especialista.
Riscos com o uso concomitante de medicamentos antirretrovirais
Pancreatite, hepatotoxicidade e neuropatia periférica ocorreram quando a hidroxiureia foi administrada concomitantemente com medicamentos antirretrovirais, incluindo didanosina e estavudina. INTERAÇÕES MEDICAMENTOSAS ].
Recuperação de Radiação
Pacientes que receberam terapia de irradiação no passado podem ter uma exacerbação do eritema pós-irradiação. Monitorar eritema cutâneo em pacientes que receberam radiação anteriormente e tratar sintomaticamente.
Macrocitose
HYDREA 500mg pode causar macrocitose, que é autolimitada e é frequentemente observada no início do tratamento. A alteração morfológica assemelha-se à anemia perniciosa, mas não está relacionada à deficiência de vitamina B12 ou ácido fólico. Isso pode mascarar o diagnóstico de anemia perniciosa. Recomenda-se a administração profilática de ácido fólico.
Toxicidade Pulmonar
Doença pulmonar intersticial incluindo fibrose pulmonar, infiltração pulmonar, pneumonite e alveolite/alveolite alérgica (incluindo casos fatais) foram relatadas em pacientes tratados para neoplasia mieloproliferativa. Monitore os pacientes que desenvolvem pirexia, tosse, dispneia ou outros sintomas respiratórios com frequência, investigue e trate prontamente. Descontinuar HYDREA 500mg e administrar com corticosteroides [ver REAÇÕES ADVERSAS ].
Interferência de teste de laboratório
A interferência com os ensaios de ácido úrico, ureia ou ácido lático é possível, resultando em resultados falsamente elevados em pacientes tratados com hidroxiureia [ver INTERAÇÕES MEDICAMENTOSAS ].
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Não foram realizados estudos convencionais de longo prazo para avaliar o potencial carcinogênico da hidroxiureia. No entanto, a administração intraperitoneal de 125 a 250 mg/kg de hidroxiureia (cerca de 0,6-1,2 vezes a dose diária oral humana máxima recomendada na base de mg/m2) três vezes por semana durante 6 meses em ratas aumentou a incidência de tumores mamários em ratas que sobreviveram a 18 meses em relação ao controle. A hidroxiureia é mutagênica in vitro para bactérias, fungos, protozoários e células de mamíferos. A hidroxiureia é clastogênica in vitro (células de hamster, linfoblastos humanos) e in vivo (ensaio SCE em roedores, ensaio de micronúcleo em camundongo). A hidroxiureia causa a transformação de células embrionárias de roedores em um fenótipo tumorigênico.
A hidroxiureia administrada a ratos machos na dose de 60 mg/kg/dia (cerca de 0,3 vezes a dose diária humana máxima recomendada em uma base de mg/m2) produziu atrofia testicular, diminuiu a espermatogênese e reduziu significativamente sua capacidade de fecundar as fêmeas.
Uso em populações específicas
Gravidez
Resumo do risco
HYDREA pode causar danos fetais com base em achados de estudos em animais e no mecanismo de ação da droga [ver FARMACOLOGIA CLÍNICA ]. Não há dados com o uso de HYDREA em mulheres grávidas para informar o risco associado ao medicamento. Em estudos de reprodução em animais, a administração de hidroxiureia a ratas e coelhas grávidas durante a organogênese produziu efeitos embriotóxicos e teratogênicos em doses 0,8 vezes e 0,3 vezes, respectivamente, a dose máxima diária humana recomendada em mg/m2 (ver Dados ). Aconselhar as mulheres sobre o risco potencial para o feto e evitar engravidar durante o tratamento com HYDREA.
Na população geral dos EUA, o risco de fundo estimado de defeitos congênitos graves e aborto espontâneo em gestações clinicamente reconhecidas é de 2%–4% e 15%–20%, respectivamente.
Dados
Dados de animais
hidroxiureia demonstrou ser um potente teratogênico em uma ampla variedade de modelos animais, incluindo camundongos, hamsters, gatos, suínos em miniatura, cães e macacos em doses dentro de 1 vezes a dose humana administrada em mg/m2. A hidroxiureia é embriotóxica e causa malformações fetais (ossos cranianos parcialmente ossificados, ausência de órbitas oculares, hidrocefalia, esternebras bipartidas, vértebras lombares ausentes) na dose de 180 mg/kg/dia (cerca de 0,8 vezes a dose diária máxima recomendada para humanos em uma base de mg/m2) em ratos e a 30 mg/kg/dia (cerca de 0,3 vezes a dose diária humana máxima recomendada com base em mg/m2) em coelhos. A embriotoxicidade foi caracterizada pela diminuição da viabilidade fetal, redução do tamanho das ninhadas vivas e atrasos no desenvolvimento. A hidroxiureia atravessa a placenta. Doses únicas de ≥375 mg/kg (cerca de 1,7 vezes a dose diária humana máxima recomendada em uma base de mg/m2) em ratos causaram retardo de crescimento e capacidade de aprendizado prejudicada.
Lactação
Resumo do risco
hidroxiureia é excretada no leite humano. Devido ao potencial de reações adversas graves em um lactente de hidroxiureia, incluindo carcinogenicidade, interrompa a amamentação durante o tratamento com HYDREA.
Fêmeas e Machos com Potencial Reprodutivo
Teste de gravidez
Verifique o estado de gravidez das fêmeas com potencial reprodutivo antes de iniciar a terapia com HYDREA.
Contracepção
Mulheres
HYDREA pode causar danos ao feto quando administrado a uma mulher grávida [ver Gravidez ]. Aconselhe as mulheres com potencial reprodutivo a usar contracepção eficaz durante e após o tratamento com HYDREA por pelo menos 6 meses após a terapia. Aconselhe as fêmeas a relatar imediatamente a gravidez.
Machos
HYDREA 500mg pode danificar os espermatozoides e o tecido testicular, resultando em possíveis anormalidades genéticas. Homens com parceiras sexuais femininas com potencial reprodutivo devem usar métodos contraceptivos eficazes durante e após o tratamento com HYDREA 500mg por pelo menos 1 ano após a terapia. Toxicologia não clínica ].
Infertilidade
Machos
Com base nos achados em animais e humanos, a fertilidade masculina pode ser comprometida pelo tratamento com HYDREA. Azoospermia ou oligospermia, às vezes reversível, foi observada em homens. Informar os pacientes do sexo masculino sobre a possibilidade de conservação do esperma antes do início da terapia [ver REAÇÕES ADVERSAS e Toxicologia não clínica ].
Uso Pediátrico
A segurança e eficácia em pacientes pediátricos não foram estabelecidas.
Uso Geriátrico
Os doentes idosos podem ser mais sensíveis aos efeitos da hidroxiureia e podem necessitar de um regime de doses mais baixas. A hidroxiureia é excretada pelos rins, e o risco de reações adversas a este medicamento pode ser maior em pacientes com função renal comprometida. Como os pacientes idosos são mais propensos a ter função renal diminuída, deve-se ter cuidado na seleção da dose e pode ser útil monitorar a função renal [ver DOSAGEM E ADMINISTRAÇÃO ].
Insuficiência renal
A exposição à hidroxiureia é maior em pacientes com clearance de creatinina inferior a 60 mL/min ou em pacientes com doença renal terminal (ESRD). Reduza a dosagem e monitore de perto os parâmetros hematológicos quando HYDREA 500mg for administrado a esses pacientes [ver DOSAGEM E ADMINISTRAÇÃO e FARMACOLOGIA CLÍNICA ].
Insuficiência hepática
Não há dados que suportem orientações específicas para ajuste de dose em pacientes com insuficiência hepática. A monitorização cuidadosa dos parâmetros hematológicos é aconselhada nestes doentes.
SOBREDOSAGEM
Toxicidade mucocutânea aguda foi relatada em pacientes recebendo hidroxiureia em dosagens várias vezes a dose terapêutica. Dor, eritema violáceo, edema nas palmas das mãos e plantas dos pés seguido de descamação das mãos e pés, hiperpigmentação generalizada grave da pele e estomatite também foram observados.
CONTRA-INDICAÇÕES
HYDREA 500mg é contraindicado em pacientes que demonstraram hipersensibilidade prévia à hidroxiureia ou a qualquer outro componente da formulação.
FARMACOLOGIA CLÍNICA
Mecanismo de ação
mecanismo preciso pelo qual a hidroxiureia produz seus efeitos antineoplásicos não pode, no momento, ser descrito. No entanto, os relatos de vários estudos em cultura de tecidos em ratos e humanos dão suporte à hipótese de que a hidroxiureia causa uma inibição imediata da síntese de DNA ao atuar como inibidor da ribonucleotídeo redutase, sem interferir na síntese do ácido ribonucleico ou da proteína. Essa hipótese explica por que, sob certas condições, a hidroxiureia pode induzir efeitos teratogênicos.
Três mecanismos de ação foram postulados para o aumento da eficácia do uso concomitante da terapia com hidroxiureia com irradiação em carcinomas de células escamosas (epidermóides) de cabeça e pescoço. Estudos in vitro utilizando células de hamster chinês sugerem que a hidroxiureia (1) é letal para células em estágio S normalmente radiorresistentes e (2) mantém outras células do ciclo celular no estágio G1 ou pré-síntese de DNA, onde são mais suscetíveis à efeitos da irradiação. O terceiro mecanismo de ação foi teorizado com base em estudos in vitro de células HeLa. Parece que a hidroxiureia, por inibição da síntese de DNA, dificulta o processo normal de reparo de células danificadas, mas não mortas por irradiação, diminuindo assim sua taxa de sobrevivência; As sínteses de RNA e proteínas não mostraram alteração.
Farmacocinética
Absorção
Após a administração oral de HYDREA, a hidroxiureia atinge as concentrações plasmáticas máximas em 1 a 4 horas. As concentrações plasmáticas máximas médias e as AUCs aumentam mais do que proporcionalmente com o aumento da dose.
Não existem dados sobre o efeito dos alimentos na absorção da hidroxiureia.
Distribuição
A hidroxiureia distribui-se por todo o corpo com um volume de distribuição que se aproxima da água corporal total.
A hidroxiureia concentra-se em leucócitos e eritrócitos.
Metabolismo
Até 60% de uma dose oral sofre conversão através do metabolismo hepático saturável e uma via menor de degradação pela urease encontrada nas bactérias intestinais.
Excreção
Em pacientes com anemia falciforme, a recuperação urinária cumulativa média de hidroxiureia foi de cerca de 40% da dose administrada.
Populações Específicas
Insuficiência renal
efeito da insuficiência renal na farmacocinética da hidroxiureia foi avaliado em pacientes adultos com doença falciforme e insuficiência renal. Pacientes com função renal normal (clearance de creatinina [CrCl] >80 mL/min), leve (CrCl 50-80 mL/min), moderada (CrCl = 30-60 mL/min). Reduzir a dose de HYDREA 500mg quando administrado a pacientes com clearance de creatinina DOSAGEM E ADMINISTRAÇÃO e Uso em populações específicas ].
INFORMAÇÃO DO PACIENTE
- Existe o risco de mielossupressão. O monitoramento das contagens sanguíneas semanalmente durante toda a terapia deve ser enfatizado para os pacientes que tomam HYDREA [ver AVISOS E PRECAUÇÕES ]. Aconselhe os pacientes a relatar sinais e sintomas de infecção ou sangramento imediatamente.
- Aconselhar os pacientes que existe o risco de toxicidades vasculíticas cutâneas e malignidades secundárias, incluindo leucemia e câncer de pele [ver AVISOS E PRECAUÇÕES ].
- Aconselhar as mulheres com potencial reprodutivo sobre o risco potencial para o feto e informar seu médico sobre uma gravidez conhecida ou suspeita. Aconselhe mulheres e homens com potencial reprodutivo a usarem métodos contraceptivos durante e após o tratamento com HYDREA [ver AVISOS E PRECAUÇÕES e Uso em populações específicas ].
- Aconselhe os pacientes a informar seu médico se receberam ou planejam receber vacinas enquanto estiverem tomando HYDREA 500mg, pois isso pode resultar em uma infecção grave [ver AVISOS E PRECAUÇÕES ].
- Aconselhe as mulheres a descontinuar a amamentação durante o tratamento com HYDREA [ver Uso em populações específicas ].
- Pacientes com infecção pelo HIV devem contatar seu médico para sinais e sintomas de pancreatite, eventos hepáticos e neuropatia periférica [ver AVISOS E PRECAUÇÕES ].
- O eritema pós-irradiação pode ocorrer em pacientes que receberam radioterapia anterior [ver AVISOS E PRECAUÇÕES ].
- Aconselhar os pacientes sobre os sintomas de potencial toxicidade pulmonar e instruí-los a procurar atendimento médico imediato em caso de pirexia, tosse, dispneia ou outros sintomas respiratórios [ver AVISOS E PRECAUÇÕES ].
