Lopid 300mg Gemfibrozil Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
que é Lopid 300mg e como é usado?
Lopid (gemfibrozil) é um agente regulador de lipídios usado para tratar níveis muito altos de colesterol e triglicerídeos em pessoas com pancreatite, e também é usado para diminuir o risco de acidente vascular cerebral, ataque cardíaco ou outras complicações cardíacas em pessoas com colesterol e triglicerídeos elevados que têm não foi ajudado por outros tratamentos. Lopid está disponível na forma genérica.
Quais são os efeitos colaterais do Lopid 300mg?
Os efeitos colaterais comuns do Lopid 300mg incluem:
- dor de estômago,
- dor de estômago/abdominal,
- náusea,
- vômito,
- diarréia,
- dor de cabeça,
- tontura,
- sonolência,
- dores articulares ou musculares,
- perda de interesse em sexo,
- impotência,
- dificuldade em ter um orgasmo,
- sensação de dormência ou formigamento,
- gosto incomum, ou
- sintomas de resfriado, como nariz entupido, espirros, dor de garganta.
Lopid 300mg pode raramente causar cálculos biliares e problemas hepáticos.
Informe o seu médico se notar algum dos seguintes efeitos colaterais improváveis, mas graves de Lopid 300mg, incluindo:
- dor severa de estômago/abdominal,
- náuseas ou vômitos persistentes,
- olhos ou pele amarelados e
- urina escura.
DESCRIÇÃO
LOPID® (comprimidos de gemfibrozil, USP) é um agente regulador de lipídios. Está disponível na forma de comprimidos para administração oral. Cada comprimido contém 600 mg de gemfibrozil. Cada comprimido também contém estearato de cálcio, NF; cera de candelila, FCC; celulose microcristalina, NF; hidroxipropilcelulose, NF; hipromelose, USP; metilparabeno, NF; Opaspray branco; polietilenoglicol, NF; polissorbato 80, NF; propilparabeno, NF; dióxido de silício coloidal, NF; amido pré-gelatinizado, NF. O nome químico é ácido 5-(2,5-dimetilfenoxi)-2,2-dimetilpentanóico, com a seguinte fórmula estrutural:
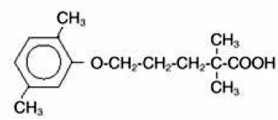
A fórmula empírica é C15H22O3 e o peso molecular é 250,35; a solubilidade em água e ácido é de 0,0019% e em base diluída é superior a 1%. O ponto de fusão é 58° –61°C. Gemfibrozil é um sólido branco que é estável em condições normais.
INDICAÇÕES
LOPID (comprimidos de gemfibrozil, USP) é indicado como terapia adjuvante à dieta para:
Em uma análise de subgrupo de pacientes no Helsinki Heart Study com valores de colesterol HDL acima da mediana na linha de base (superiores a 46,4 mg/dL), a incidência de eventos coronarianos graves foi semelhante para os subgrupos de gemfibrozil e placebo (ver Tabela I).
tratamento inicial para a dislipidemia é a terapia dietética específica para o tipo de anormalidade lipoprotéica. O excesso de peso corporal e a ingestão excessiva de álcool podem ser fatores importantes na hipertrigliceridemia e devem ser controlados antes de qualquer terapia medicamentosa. O exercício físico pode ser uma importante medida auxiliar e tem sido associado a aumentos no HDL-colesterol. Doenças que contribuem para a hiperlipidemia, como hipotireoidismo ou diabetes mellitus, devem ser investigadas e tratadas adequadamente. A terapia com estrogênio às vezes está associada a aumentos maciços nos triglicerídeos plasmáticos, especialmente em indivíduos com hipertrigliceridemia familiar. Nesses casos, a descontinuação da terapia com estrogênio pode evitar a necessidade de terapia medicamentosa específica para hipertrigliceridemia. O uso de medicamentos deve ser considerado apenas quando tentativas razoáveis foram feitas para obter resultados satisfatórios com métodos não medicamentosos. Se for tomada a decisão de usar medicamentos, o paciente deve ser instruído de que isso não diminui a importância de aderir à dieta.
DOSAGEM E ADMINISTRAÇÃO
dose recomendada para adultos é de 1200 mg administrados em duas doses divididas 30 minutos antes das refeições da manhã e da noite (ver FARMACOLOGIA CLÍNICA ).
COMO FORNECIDO
LOPID (Comprimido 737), comprimidos brancos, elípticos, revestidos por película, com ranhuras, cada um contendo 600 mg de gemfibrozil, estão disponíveis como segue:
NDC 0071-0737-20: Garrafas de 60 NDC 0071-0737-30: Garrafas de 500
Armazene em temperatura ambiente controlada 20° – 25°C (68° – 77°F) [consulte USP]. Proteger da luz e da umidade.
Distribuído pela Parke-Davis Division da Pfizer Inc, NY, NY 10017. Revisado: dezembro de 2020
EFEITOS COLATERAIS
Na fase controlada duplo-cego do componente de prevenção primária do Helsinki Heart Study, 2.046 pacientes receberam LOPID por até cinco anos. Nesse estudo, as seguintes reações adversas foram estatisticamente mais frequentes em indivíduos do grupo LOPID:
Cirurgia da vesícula biliar foi realizado em 0,9% de LOPID 300mg e 0,5% de indivíduos placebo no componente de prevenção primária, um excesso de 64%, o que não é estatisticamente diferente do excesso de cirurgia de vesícula biliar observado no grupo clofibrato comparado ao grupo placebo do estudo da OMS . A cirurgia de vesícula biliar também foi realizada com maior frequência no grupo LOPID em comparação ao grupo placebo (1,9% versus 0,3%, p=0,07) no componente de prevenção secundária. Um aumento estatisticamente significativo na apendicectomia no grupo gemfibrozil foi observado também no componente de prevenção secundária (6 em gemfibrozil versus 0 em placebo, p = 0,014).
As reações adversas do sistema nervoso e dos sentidos especiais foram mais comuns no grupo LOPID 300mg. Estes incluíram hipoestesia, parestesias e perversão do paladar. Outras reações adversas que foram mais comuns entre os indivíduos do grupo de tratamento com LOPID 300mg, mas onde uma relação causal não foi estabelecida, incluem catarata, doença vascular periférica e hemorragia intracerebral.
partir de outros estudos, parece provável que LOPID 300mg esteja causalmente relacionado com a ocorrência de SINTOMAS MUSCULOESQUELÉTICOS (ver AVISOS ), e para TESTES DE FUNÇÃO HEPÁTICA ANORMAL e ALTERAÇÕES HEMATOLÓGICAS (ver PRECAUÇÕES ).
Relatos de infecções virais e bacterianas (resfriado comum, tosse, infecções do trato urinário) foram mais comuns em pacientes tratados com gemfibrozil em outros ensaios clínicos controlados de 805 pacientes. As reações adversas adicionais que foram relatadas para gemfibrozil estão listadas abaixo por sistema. Estes são categorizados de acordo com se uma relação causal com o tratamento com LOPID é provável ou não estabelecida:
Reações adversas adicionais que foram relatadas incluem colecistite e colelitíase (Vejo AVISOS ).
INTERAÇÕES MEDICAMENTOSAS
Inibidores da HMG-CoA Redutase
A administração concomitante de LOPID 300mg com sinvastatina é contraindicada (ver CONTRA-INDICAÇÕES e AVISOS ). Evite o uso concomitante de LOPID com rosuvastatina. Se o uso concomitante não puder ser evitado, inicie rosuvastatina na dose de 5 mg uma vez ao dia. A dose de rosuvastatina não deve exceder 10 mg uma vez ao dia. O risco de miopatia e rabdomiólise aumenta com a terapia combinada com gemfibrozil e inibidor da HMG-CoA redutase. Miopatia ou rabdomiólise com ou sem insuficiência renal aguda foram relatadas três semanas após o início da terapia combinada ou após vários meses (ver AVISOS ). Não há garantia de que o monitoramento periódico da creatina quinase previna a ocorrência de miopatia grave e dano renal.
Anticoagulantes
DEVE-SE TER CUIDADO QUANDO A WARFARINA É DADA EM CONJUNÇÃO COM LOPID. A DOSAGEM DE WARFARINA DEVE SER REDUZIDA PARA MANTER O TEMPO DE PROTROMBINA NO NÍVEL DESEJADO PARA EVITAR COMPLICAÇÕES DE SANGRAMENTO. DETERMINAÇÕES FREQUENTES DE PROTROMBINA SÃO ACONSELHÁVEIS ATÉ QUE SEJA DEFINITIVAMENTE DETERMINADO QUE O NÍVEL DE PROTROMBINA ESTÁ ESTABILIZADO.
Substratos CYP2C8
gemfibrozil é um forte inibidor do CYP2C8 e pode aumentar a exposição de medicamentos metabolizados principalmente pelo CYP2C8 (por exemplo, dabrafenibe, enzalutamida, loperamida, montelucaste, paclitaxel, pioglitazona, rosiglitazona). Portanto, a redução da dose de medicamentos que são metabolizados principalmente pela enzima CYP2C8 pode ser necessária quando o genfibrozil é usado concomitantemente (ver AVISOS ).
Repaglinida
Em voluntários saudáveis, a coadministração com gemfibrozil (600 mg duas vezes ao dia por 3 dias) resultou em uma AUC de repaglinida 8,1 vezes maior (intervalo de 5,5 a 15,0 vezes) e 28,6 vezes (intervalo de 18,5 a 80,1 vezes) concentração plasmática de repaglinida mais elevada 7 horas após a dose. No mesmo estudo, gemfibrozil (600 mg duas vezes ao dia por 3 dias) + itraconazol (200 mg de manhã e 100 mg à noite no Dia 1, depois 100 mg duas vezes ao dia no Dia 2-3) resultou em um 19,4-( 12,9 a 24,7 vezes) maior AUC de repaglinida e uma concentração plasmática de repaglinida 70,4 vezes maior (intervalo de 42,9 a 119,2 vezes) 7 horas após a dose. Além disso, gemfibrozil isoladamente ou gemfibrozil + itraconazol prolongou os efeitos hipoglicemiantes da repaglinida. A coadministração de gemfibrozil e repaglinida aumenta o risco de hipoglicemia grave e é contraindicada (ver CONTRA-INDICAÇÕES ).
Dasabuvir
coadministração de gemfibrozil com dasabuvir aumentou a AUC e Cmax do dasabuvir (proporções: 11,3 e 2,01, respectivamente) devido à inibição do CYP2C8. O aumento da exposição ao dasabuvir pode aumentar o risco de prolongamento do intervalo QT, portanto, a coadministração de gemfibrozil com dasabuvir é contraindicada (ver CONTRA-INDICAÇÕES ).
Selexipag
A coadministração de gemfibrozil com selexipag dobrou a exposição ao selexipag e aumentou a exposição ao metabólito ativo em aproximadamente 11 vezes. A administração concomitante de gemfibrozil com selexipag é contraindicada (ver CONTRA-INDICAÇÕES ).
Enzalutamida
Em voluntários saudáveis que receberam uma dose única de 160 mg de enzalutamida após 600 mg de genfibrozil duas vezes ao dia, a AUC de enzalutamida mais metabólito ativo (N-desmetil enzalutamida) aumentou 2,2 vezes e a Cmax correspondente diminuiu 16%. O aumento da exposição à enzalutamida pode aumentar o risco de convulsões. Se a coadministração for considerada necessária, a dose de enzalutamida deve ser reduzida (ver AVISOS ).
Substratos OATP1B1
genfibrozil é um inibidor do transportador OATP1B1 e pode aumentar a exposição de medicamentos que são substratos do OATP1B1 (por exemplo, atrasentan, atorvastatina, bosentana, ezetimiba, fluvastatina, gliburida, SN-38 [metabólito ativo do irinotecano], rosuvastatina, pitavastatina, pravastatina, rifampicina , valsartana, olmesartana). Portanto, podem ser necessárias reduções de dosagem de medicamentos que são substratos de OATP1B1 quando gemfibrozil é usado concomitantemente (ver AVISOS ). A terapia combinada de gemfibrozil com sinvastatina ou com repaglinida, que são substratos de OATP1B1, é contraindicada (ver CONTRA-INDICAÇÕES ).
Estudos in vitro de enzimas CYP, enzimas UGTA e transportador OATP1B1
Estudos in vitro mostraram que o gemfibrozil é um inibidor de CYP1A2, CYP2C8, CYP2C9, CYP2C19, OATP1B1 e UDP-glucuronosiltransferase (UGT) 1A1 e 1A3 (ver AVISOS ).
Resinas de Ligação de Ácidos Biliares
AUC do gemfibrozil foi reduzida em 30% quando o gemfibrozil foi administrado (600 mg) simultaneamente com medicamentos em grânulos de resina, como colestipol (5 g). Recomenda-se a administração dos medicamentos com duas horas ou mais de intervalo porque a exposição ao gemfibrozil não foi significativamente afetada quando administrado com duas horas de intervalo do colestipol.
Colchicina
Miopatia, incluindo rabdomiólise, foi relatada com a administração crônica de colchicina em doses terapêuticas. O uso concomitante de LOPID pode potencializar o desenvolvimento de miopatia. Pacientes com disfunção renal e pacientes idosos apresentam risco aumentado. Deve-se ter cautela ao prescrever LOPID com colchicina, especialmente em pacientes idosos ou pacientes com disfunção renal.
AVISOS
Devido ao tamanho mais limitado do Helsinki Heart Study, a diferença observada na mortalidade por qualquer causa entre os grupos LOPID 300mg e placebo não é estatisticamente significativamente diferente do excesso de mortalidade de 29% relatado no grupo clofibrato no estudo separado da OMS no nove anos de acompanhamento (ver FARMACOLOGIA CLÍNICA ). A mortalidade relacionada à doença cardíaca não coronariana mostrou um excesso no grupo originalmente randomizado para LOPID principalmente devido a mortes por câncer observadas durante a extensão aberta.
Durante o componente de prevenção primária de cinco anos do Helsinki Heart Study, a mortalidade por qualquer causa foi de 44 (2,2%) no grupo LOPID 300mg e 43 (2,1%) no grupo placebo; incluindo o período de acompanhamento de 3,5 anos desde que o estudo foi concluído, a mortalidade cumulativa por qualquer causa foi de 101 (4,9%) no grupo LOPID e 83 (4,1%) no grupo originalmente randomizado para placebo (razão de risco 1:20 a favor de placebo). Devido ao tamanho mais limitado do Helsinki Heart Study, a diferença observada na mortalidade por qualquer causa entre os grupos LOPID 300mg e placebo no Ano-5 ou no Ano-8,5 não é estatisticamente significativamente diferente do excesso de mortalidade de 29% relatado no grupo clofibrato no estudo separado da OMS no seguimento de nove anos. A mortalidade relacionada à doença cardíaca não coronariana mostrou um excesso no grupo originalmente randomizado para LOPID 300mg no seguimento de 8,5 anos (65 LOPID 300mg versus 45 mortes não coronarianas com placebo).
incidência de câncer (excluindo carcinoma basocelular) descoberto durante o estudo e nos 3,5 anos após a conclusão do estudo foi de 51 (2,5%) em ambos os grupos originalmente randomizados. Além disso, havia 16 carcinomas basocelulares no grupo originalmente randomizado para LOPID 300mg e 9 no grupo originalmente randomizado para placebo (p=0,22). Houve 30 (1,5%) mortes atribuídas ao câncer no grupo originalmente randomizado para LOPID 300mg e 18 (0,9%) no grupo originalmente randomizado para placebo (p=0,11). Os desfechos adversos, incluindo eventos coronarianos, foram maiores em pacientes com gemfibrozil em um estudo correspondente em homens com histórico de doença coronariana conhecida ou suspeita no componente de prevenção secundária do Helsinki Heart Study (ver FARMACOLOGIA CLÍNICA ).
Um estudo comparativo de carcinogenicidade também foi feito em ratos comparando três drogas desta classe: fenofibrato (10 e 60 mg/kg; 0,3 e 1,6 vezes a dose humana, respectivamente), clofibrato (400 mg/kg; 1,6 vezes a dose humana), e gemfibrozil (250 mg/kg; 1,7 vezes a dose humana). Os adenomas acinares pancreáticos estavam aumentados em homens e mulheres com fenofibrato; carcinoma hepatocelular e adenomas acinares pancreáticos estavam aumentados em homens e nódulos neoplásicos hepáticos em mulheres tratadas com clofibrato; nódulos neoplásicos hepáticos foram aumentados em homens e mulheres tratados com clofibrato; nódulos neoplásicos hepáticos foram aumentados em homens e mulheres tratados com gemfibrozil, enquanto tumores de células intersticiais testiculares (células de Leydig) foram aumentados em homens em todas as três drogas.
PRECAUÇÕES
Terapia inicial
Estudos laboratoriais devem ser feitos para verificar se os níveis lipídicos são consistentemente anormais. Antes de iniciar a terapia com LOPID, todos os esforços devem ser feitos para controlar os lipídios séricos com dieta adequada, exercícios, perda de peso em pacientes obesos e controle de quaisquer problemas médicos, como diabetes mellitus e hipotireoidismo, que estejam contribuindo para as anormalidades lipídicas.
Terapia Continuada
A determinação periódica dos lipídios séricos deve ser obtida e a droga retirada se a resposta lipídica for inadequada após três meses de terapia.
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Estudos de longo prazo foram conduzidos em ratos com 0,2 e 1,3 vezes a exposição humana (com base na AUC). A incidência de nódulos hepáticos benignos e carcinomas hepáticos aumentou significativamente em ratos machos com doses elevadas. A incidência de carcinomas hepáticos aumentou também em machos com doses baixas, mas este aumento não foi estatisticamente significativo (p=0,1). Ratos machos tiveram um aumento estatisticamente significativo e relacionado com a dose de tumores benignos de células de Leydig. As ratas fêmeas com doses mais altas tiveram um aumento significativo na incidência combinada de neoplasias hepáticas benignas e malignas.
Estudos de longo prazo foram realizados em camundongos com 0,1 e 0,7 vezes a exposição humana (com base na AUC). Não houve diferenças estatisticamente significativas em relação aos controles na incidência de tumores hepáticos, mas as doses testadas foram menores do que aquelas que se mostraram carcinogênicas com outros fibratos.
Estudos de microscopia eletrônica demonstraram uma proliferação de peroxissomos hepáticos floridos após a administração de LOPID ao rato macho. Um estudo adequado para testar a proliferação de peroxissomos não foi feito em humanos, mas foram observadas mudanças na morfologia dos peroxissomos. Demonstrou-se que a proliferação de peroxissomos ocorre em humanos com qualquer uma das duas outras drogas da classe dos fibratos quando as biópsias hepáticas foram comparadas antes e após o tratamento no mesmo indivíduo.
A administração de aproximadamente 2 vezes a dose humana (com base na área de superfície) a ratos machos por 10 semanas resultou em uma diminuição da fertilidade relacionada à dose. Estudos subsequentes demonstraram que esse efeito foi revertido após um período livre de drogas de cerca de oito semanas e não foi transmitido para a prole.
Gravidez
LOPID 300mg demonstrou produzir efeitos adversos em ratos e coelhos em doses entre 0,5 e 3 vezes a dose humana (com base na área de superfície). Não existem estudos adequados e bem controlados em mulheres grávidas. LOPID 300mg deve ser usado durante a gravidez somente se o benefício potencial justificar o risco potencial para o feto.
A administração de LOPID 300mg a ratas em 2 vezes a dose humana (com base na área de superfície) antes e durante a gestação causou uma diminuição relacionada à dose na taxa de concepção, um aumento de natimortos e uma leve redução no peso do filhote durante a lactação. Houve também variações esqueléticas aumentadas relacionadas à dose. Anoftalmia ocorreu, mas raramente.
A administração de 0,6 e 2 vezes a dose humana (com base na área de superfície) de LOPID a ratas do 15º dia de gestação até o desmame causou diminuições relacionadas à dose no peso ao nascer e supressões do crescimento dos filhotes durante a lactação.
administração de 1 e 3 vezes a dose humana (com base na área de superfície) de LOPID 300mg a coelhas durante a organogênese causou uma diminuição relacionada à dose no tamanho da ninhada e, na dose alta, um aumento na incidência de variações ósseas parietais.
Mães que amamentam
Não se sabe se este medicamento é excretado no leite humano. Como muitos medicamentos são excretados no leite humano e devido ao potencial de tumorigenicidade demonstrado para LOPID em estudos com animais, deve-se decidir entre descontinuar a amamentação ou descontinuar o medicamento, levando em consideração a importância do medicamento para a mãe.
Alterações hematológicas
Diminuições leves de hemoglobina, hematócrito e glóbulos brancos foram observadas em pacientes ocasionais após o início da terapia com LOPID. No entanto, esses níveis se estabilizam durante a administração a longo prazo. Raramente, anemia grave, leucopenia, trombocitopenia e hipoplasia da medula óssea foram relatadas.
Portanto, hemogramas periódicos são recomendados durante os primeiros 12 meses de administração de LOPID 300mg.
Função do fígado
Testes de função hepática anormais foram observados ocasionalmente durante a administração de LOPID, incluindo elevações de AST, ALT, LDH, bilirrubina e fosfatase alcalina. Estes são geralmente reversíveis quando LOPID 300mg é descontinuado. Portanto, estudos periódicos da função hepática são recomendados e a terapia com LOPID 300mg deve ser interrompida se as anormalidades persistirem.
Função renal
Houve relatos de piora da insuficiência renal após a adição da terapia com LOPID em indivíduos com creatinina plasmática basal > 2,0 mg/dL. Nesses pacientes, o uso de terapia alternativa deve ser considerado em relação aos riscos e benefícios de uma dose menor de LOPID.
Uso Pediátrico
A segurança e eficácia em pacientes pediátricos não foram estabelecidas.
SOBREDOSAGEM
Foram notificados casos de sobredosagem com LOPID. Em um caso, uma criança de 7 anos se recuperou após ingerir até 9 gramas de LOPID. Os sintomas relatados com superdosagem foram cólicas abdominais, testes de função hepática anormais, diarreia, aumento da CPK, dores articulares e musculares, náuseas e vômitos. Devem ser tomadas medidas sintomáticas de suporte, caso ocorra uma sobredosagem.
CONTRA-INDICAÇÕES
FARMACOLOGIA CLÍNICA
LOPID é um agente regulador de lípidos que diminui os triglicéridos séricos e o colesterol das lipoproteínas de muito baixa densidade (VLDL) e aumenta o colesterol das lipoproteínas de alta densidade (HDL). Enquanto diminuições modestas no colesterol total e de lipoproteína de baixa densidade (LDL) podem ser observadas com a terapia com LOPID 300mg, o tratamento de pacientes com triglicerídeos elevados devido à hiperlipoproteinemia tipo IV geralmente resulta em um aumento no colesterol LDL. Os níveis de LDL-colesterol em pacientes do Tipo IIb com elevações tanto do LDL-colesterol quanto dos triglicerídeos séricos são, em geral, minimamente afetados pelo tratamento com LOPID 300mg; no entanto, LOPID 300mg geralmente aumenta significativamente o HDL-colesterol neste grupo. LOPID 300mg aumenta os níveis de lipoproteínas de alta densidade (HDL) subfrações HDL2 e HDL3, bem como apolipoproteínas AI e AII. Estudos epidemiológicos mostraram que tanto o colesterol HDL baixo quanto o colesterol LDL elevado são fatores de risco independentes para doença coronariana.
No componente de prevenção primária do Helsinki Heart Study, no qual 4.081 pacientes do sexo masculino com idades entre 40 e 55 anos foram estudados de forma randomizada, duplo-cego, controlado por placebo, a terapia com LOPID 300mg foi associada a reduções significativas nos triglicerídeos plasmáticos totais e um aumento significativo no colesterol de lipoproteína de alta densidade. Reduções moderadas no colesterol total do plasma e no colesterol da lipoproteína de baixa densidade foram observadas para o grupo de tratamento com LOPID como um todo, mas a resposta lipídica foi heterogênea, especialmente entre os diferentes tipos de Fredrickson. O estudo envolveu indivíduos com colesterol não HDL sérico acima de 200 mg/dL e sem história prévia de doença coronariana. Durante o período de estudo de cinco anos, o grupo LOPID 300mg apresentou uma redução absoluta de 1,4% (34% relativa) na taxa de eventos coronarianos graves (mortes cardíacas súbitas mais infartos do miocárdio fatais e não fatais) em comparação com placebo, p=0,04 (ver Tabela I). Houve uma redução relativa de 37% na taxa de infarto do miocárdio não fatal em comparação ao placebo, equivalente a uma diferença relacionada ao tratamento de 13,1 eventos por mil pessoas. As mortes por qualquer causa durante a parte duplo-cega do estudo totalizaram 44 (2,2%) no grupo de randomização LOPID 300mg e 43 (2,1%) no grupo placebo.
Entre os tipos de Fredrickson, durante a porção duplo-cega de 5 anos do componente de prevenção primária do Helsinki Heart Study, a maior redução na incidência de eventos coronarianos graves ocorreu em pacientes do Tipo IIb que tiveram elevações de LDL-colesterol e plasma total triglicerídeos. Este subgrupo de pacientes do grupo gemfibrozil Tipo IIb teve um nível médio de colesterol HDL mais baixo na linha de base do que o subgrupo Tipo IIa que teve elevações de colesterol LDL e triglicerídeos plasmáticos normais. O aumento médio do HDL-colesterol entre os pacientes do Tipo IIb neste estudo foi de 12,6% em comparação com o placebo. A alteração média no colesterol LDL entre os pacientes do Tipo IIb foi de -4,1% com LOPID em comparação com um aumento de 3,9% no subgrupo placebo. Os sujeitos do Tipo IIb no Helsinki Heart Study tiveram 26 menos eventos coronários por mil pessoas ao longo de cinco anos no grupo gemfibrozil em comparação com o placebo. A diferença em eventos coronarianos foi substancialmente maior entre LOPID 300mg e placebo para aquele subgrupo de pacientes com a tríade de LDL-colesterol >175 mg/dL (>4,5 mmol), triglicerídeos >200 mg/dL (>2,2 mmol) e HDL -colesterol
Mais informações estão disponíveis a partir de um acompanhamento de 3,5 anos (8,5 anos cumulativo) de todos os indivíduos que participaram do Helsinki Heart Study. Após a conclusão do Helsinki Heart Study, os participantes poderiam optar por iniciar, parar ou continuar a receber LOPID; sem conhecimento de seus próprios valores lipídicos ou tratamento duplo-cego, 60% dos pacientes originalmente randomizados para placebo iniciaram a terapia com LOPID 300mg e 60% dos pacientes originalmente randomizados para LOPID continuaram a medicação. Após aproximadamente 6,5 anos após a randomização, todos os pacientes foram informados de seu grupo de tratamento original e valores lipídicos durante os cinco anos do tratamento duplo-cego. Após outras mudanças eletivas no status do tratamento com LOPID, 61% dos pacientes no grupo originalmente randomizado para LOPID estavam tomando o medicamento; no grupo originalmente randomizado para placebo, 65% estavam tomando LOPID. A taxa de eventos por 1.000 ocorridos durante o período de acompanhamento aberto é detalhada na Tabela II.
mortalidade cumulativa ao longo de 8,5 anos mostrou um excesso relativo de 20% de mortes no grupo originalmente randomizado para LOPID 300mg versus o grupo placebo originalmente randomizado e uma diminuição relativa de 20% nos eventos cardíacos no grupo originalmente randomizado para LOPID 300mg versus o grupo placebo originalmente randomizado (ver Tabela III). Esta análise da população originalmente randomizada “intenção de tratar” negligencia os possíveis efeitos complicadores da troca de tratamento durante a fase de rótulo aberto. O ajuste das taxas de risco, levando em consideração o status de tratamento aberto dos anos 6,5 a 8,5, pode alterar as taxas de risco relatadas para mortalidade em direção à unidade.
Não está claro até que ponto os achados do componente de prevenção primária do Helsinki Heart Study podem ser extrapolados para outros segmentos da população dislipidêmica não estudados (como mulheres, homens mais jovens ou mais velhos, ou aqueles com anormalidades lipídicas limitadas apenas ao HDL -colesterol) ou a outras drogas que alteram os lipídios.
componente de prevenção secundária do Helsinki Heart Study foi realizado ao longo de cinco anos em paralelo e nos mesmos centros na Finlândia em 628 homens de meia-idade excluídos do componente de prevenção primária do Helsinki Heart Study devido a história de angina, infarto do miocárdio, ou alterações inexplicáveis no ECG. O desfecho primário de eficácia do estudo foi eventos cardíacos (a soma de infartos do miocárdio fatais e não fatais e mortes cardíacas súbitas). A razão de risco (LOPID:placebo) para eventos cardíacos foi de 1,47 (limites de confiança de 95% 0,88–2,48, p=0,14). Dos 35 pacientes do grupo LOPID 300mg que apresentaram eventos cardíacos, 12 pacientes sofreram eventos após a descontinuação do estudo. Dos 24 pacientes do grupo placebo com eventos cardíacos, 4 pacientes sofreram eventos após a descontinuação do estudo. Houve 17 mortes cardíacas no grupo LOPID e 8 no grupo placebo (taxa de risco 2,18; limites de confiança de 95% 0,94–5,05, p=0,06). Dez dessas mortes no grupo LOPID e 3 no grupo placebo ocorreram após a descontinuação da terapia. Neste estudo de pacientes com doença coronariana conhecida ou suspeita, nenhum benefício do tratamento com LOPID 300mg foi observado na redução de eventos cardíacos ou mortes cardíacas. Assim, LOPID 300mg mostrou benefício apenas em pacientes dislipidêmicos selecionados sem doença coronariana suspeita ou estabelecida. Mesmo em pacientes com doença coronariana e a tríade de colesterol LDL elevado, triglicerídeos elevados e colesterol HDL baixo, o possível efeito de LOPID sobre eventos coronarianos não foi adequadamente estudado.
Nenhuma eficácia nos pacientes com doença cardíaca coronária estabelecida foi observada durante o Coronary Drug Project com a droga química e farmacologicamente relacionada, clofibrato. O Coronary Drug Project foi um estudo duplo-cego randomizado de 6 anos envolvendo 1.000 pacientes com clofibrato, 1.000 ácido nicotínico e 3.000 pacientes com placebo com doença coronariana conhecida. Uma redução clínica e estatisticamente significativa nos infartos do miocárdio foi observada no grupo de ácido nicotínico concomitante em comparação com placebo; nenhuma redução foi observada com clofibrato.
O mecanismo de ação do gemfibrozil não foi definitivamente estabelecido. No homem, LOPID 300mg demonstrou inibir a lipólise periférica e diminuir a extração hepática de ácidos graxos livres, reduzindo assim a produção hepática de triglicerídeos. LOPID 300mg inibe a síntese e aumenta a depuração da apolipoproteína B transportadora de VLDL, levando a uma diminuição na produção de VLDL.
Estudos em animais sugerem que o gemfibrozil pode, além de elevar o colesterol HDL, reduzir a incorporação de ácidos graxos de cadeia longa em triglicerídeos recém-formados, acelerar o turnover e a remoção de colesterol do fígado e aumentar a excreção de colesterol nas fezes. LOPID 300mg é bem absorvido no trato gastrointestinal após administração oral. Os níveis plasmáticos máximos ocorrem em 1 a 2 horas com meia-vida plasmática de 1,5 horas após doses múltiplas.
gemfibrozil é completamente absorvido após a administração oral de LOPID 300mg comprimidos, atingindo concentrações plasmáticas máximas 1 a 2 horas após a administração. A farmacocinética do gemfibrozil é afetada pelo horário das refeições em relação ao horário da administração. Em um estudo (ref. 4), tanto a taxa quanto a extensão da absorção do medicamento aumentaram significativamente quando administrado 0,5 hora antes das refeições. A AUC média foi reduzida em 14-44% quando LOPID foi administrado após as refeições em comparação com 0,5 hora antes das refeições. Em um estudo subsequente, a taxa de absorção de LOPID 300mg foi máxima quando administrado 0,5 hora antes das refeições com Cmax 50-60% maior do que quando administrado com as refeições ou em jejum. Neste estudo, não houve efeitos significativos na AUC do momento da dose em relação às refeições (ver DOSAGEM E ADMINISTRAÇÃO ).
LOPID sofre principalmente oxidação de um grupo metil do anel para formar sucessivamente um metabólito hidroximetil e um carboxil. Aproximadamente setenta por cento da dose humana administrada é excretada na urina, principalmente como o conjugado glicuronídeo, com menos de 2% excretado como gemfibrozil inalterado. Seis por cento da dose é contabilizada nas fezes. O genfibrozil é altamente ligado às proteínas plasmáticas e há potencial para interações de deslocamento com outros medicamentos (ver PRECAUÇÕES ).
INFORMAÇÃO DO PACIENTE
Nenhuma informação fornecida. Por favor, consulte o AVISOS e PRECAUÇÕES Seções.
