Zocor 5mg, 10mg, 20mg, 40mg Simvastatin Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Zocor e como é usado?
Zocor (sinvastatina) é um medicamento de prescrição usado para diminuir os níveis de colesterol "ruim" (lipoproteína de baixa densidade ou LDL) e aumentar os níveis de colesterol "bom" (lipoproteína de alta densidade ou HDL) e para diminuir a triglicerina, bem como para reduzir o risco de acidente vascular cerebral e ataques cardíacos. Zocor pode ser usado sozinho ou com outros medicamentos.
Zocor pertence a uma classe de medicamentos chamados Agentes Redutores de Lipídios, Estatinas, Inibidores da HMG-CoA Redutase.
Não se sabe se Zocor é seguro e eficaz em crianças com menos de 10 anos de idade.
Quais são os possíveis efeitos colaterais do Zocor?
Zocor 20mg pode causar efeitos colaterais graves, incluindo:
- perda de apetite,
- dor de estômago do lado superior direito,
- cansaço,
- coceira,
- urina escura,
- fezes cor de barro, e
- amarelecimento da pele ou olhos
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Zocor incluem:
- dor de cabeça,
- náusea,
- dor de estômago,
- constipação, e
- sintomas de resfriado (nariz entupido, espirros ou dor de garganta)
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Zocor. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
DESCRIÇÃO
ZOCOR (sinvastatina) é um agente hipolipemiante derivado sinteticamente de um produto de fermentação de Aspergillus terreus. Após a ingestão oral, a sinvastatina, que é uma lactona inativa, é hidrolisada na forma de β-hidroxiácido correspondente. Este é um inibidor da 3-hidroxi-3-metilglutaril-coenzima A (HMG-CoA) redutase. Essa enzima catalisa a conversão de HMG-CoA em mevalonato, que é uma etapa inicial e limitante da taxa na biossíntese do colesterol.
A sinvastatina é ácido butanóico, 2,2-dimetil-,1,2,3,7,8,8a-hexa-hidro-3,7-dimetil-8-[2-(tetra-hidro-4hidroxi-6-oxo-2H-piran- éster 2-il)-etil]-1-naftalenílico, [1S-[1α,3α,7β,8β(2S*,4S*),-8aβ]]. A fórmula empírica da sinvastatina é C25H38O5 e seu peso molecular é 418,57. Sua fórmula estrutural é:
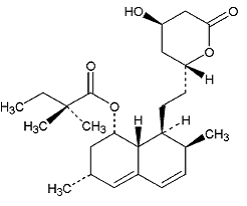
A sinvastatina é um pó cristalino branco a esbranquiçado, não higroscópico, praticamente insolúvel em água e livremente solúvel em clorofórmio, metanol e etanol.
Os comprimidos de ZOCOR para administração oral contêm 5 mg, 10 mg, 20 mg, 40 mg ou 80 mg de sinvastatina e os seguintes ingredientes inativos: ácido ascórbico, ácido cítrico, hidroxipropilcelulose, hipromelose, óxidos de ferro, lactose, estearato de magnésio, celulose microcristalina , amido, talco e dióxido de titânio. O hidroxianisol butilado é adicionado como conservante.
INDICAÇÕES
A terapia com agentes que alteram os lipídios deve ser apenas um componente da intervenção de múltiplos fatores de risco em indivíduos com risco significativamente aumentado de doença vascular aterosclerótica devido à hipercolesterolemia. A terapia medicamentosa é indicada como adjuvante da dieta quando a resposta a uma dieta restrita em gordura saturada e colesterol e outras medidas não farmacológicas isoladas for inadequada. Em pacientes com doença cardíaca coronária (DAC) ou com alto risco de DAC, ZOCOR® pode ser iniciado simultaneamente com dieta.
Reduções no risco de mortalidade por doença coronariana e eventos cardiovasculares
Em pacientes com alto risco de eventos coronarianos devido a doença coronariana existente, diabetes, doença vascular periférica, história de acidente vascular cerebral ou outra doença cerebrovascular, ZOCOR 5mg é indicado para:
- Reduzir o risco de mortalidade total reduzindo as mortes por DC.
- Reduzir o risco de infarto do miocárdio não fatal e acidente vascular cerebral.
- Reduzir a necessidade de procedimentos de revascularização coronariana e não coronariana.
Hiperlipidemia
ZOCOR é indicado para:
- Reduzir o colesterol total elevado (C total), colesterol de lipoproteína de baixa densidade (LDL-C), apolipoproteína B (Apo B) e triglicerídeos (TG) e aumentar o colesterol de lipoproteína de alta densidade (HDL-C) em pacientes com hiperlipidemia primária (Fredrickson tipo IIa, familiar heterozigótica e não familiar) ou dislipidemia mista (Fredrickson tipo IIb).
- Reduzir TG elevado em pacientes com hipertrigliceridemia (hiperlipidemia tipo IV de Fredrickson).
- Reduzir TG e VLDL-C elevados em pacientes com disbetalipoproteinemia primária (hiperlipidemia tipo III de Fredrickson).
- Reduzir o C-total e o C-LDL em pacientes com hipercolesterolemia familiar homozigótica (HFHo) como adjuvante a outros tratamentos hipolipemiantes (por exemplo, aférese de LDL) ou se tais tratamentos não estiverem disponíveis.
Pacientes adolescentes com hipercolesterolemia familiar heterozigótica (HeFH)
ZOCOR é indicado como adjuvante da dieta para reduzir os níveis de C total, LDL-C e Apo B em meninos e meninas adolescentes que estão pelo menos um ano após a menarca, 10-17 anos de idade, com HeFH, se após uma ensaio adequado de dietoterapia, os seguintes achados estão presentes:
- Há uma história familiar positiva de doença cardiovascular prematura (DCV) ou
- Dois ou mais outros fatores de risco de DCV estão presentes no paciente adolescente.
objetivo mínimo do tratamento em pacientes pediátricos e adolescentes é atingir uma média de LDL-C
Limitações de uso
ZOCOR 20mg não foi estudado em condições em que a principal anormalidade é a elevação de quilomícrons (ou seja, hiperlipidemia Fredrickson tipos I e V).
DOSAGEM E ADMINISTRAÇÃO
Dosagem Recomendada
A faixa de dosagem usual é de 5 a 40 mg/dia. Em pacientes com doença coronariana ou com alto risco de doença coronariana, ZOCOR pode ser iniciado simultaneamente com a dieta. A dose inicial habitual recomendada é de 10 ou 20 mg uma vez por dia, à noite. Para pacientes com alto risco de evento coronariano devido a doença coronariana existente, diabetes, doença vascular periférica, histórico de acidente vascular cerebral ou outra doença cerebrovascular, a dose inicial recomendada é de 40 mg/dia. As determinações lipídicas devem ser realizadas após 4 semanas de terapia e depois periodicamente.
Dosagem restrita para 80 mg
Devido ao risco aumentado de miopatia, incluindo rabdomiólise, particularmente durante o primeiro ano de tratamento, o uso da dose de 80 mg de ZOCOR deve ser restrito a pacientes que estejam tomando sinvastatina 80 mg cronicamente (por exemplo, por 12 meses ou mais). sem evidência de toxicidade muscular [ver AVISOS E PRECAUÇÕES ].
Os pacientes que estão atualmente tolerando a dose de 80 mg de ZOCOR que precisam ser iniciados com um medicamento de interação que é contraindicado ou está associado a um limite de dose para sinvastatina devem ser trocados para uma estatina alternativa com menor potencial de interação medicamentosa.
Devido ao risco aumentado de miopatia, incluindo rabdomiólise, associado à dose de 80 mg de ZOCOR 40 mg, os pacientes incapazes de atingir sua meta de LDL-C utilizando a dose de 40 mg de ZOCOR 5 mg não devem ser titulados para a dose de 80 mg. , mas deve ser colocado em tratamento(s) alternativo(s) de redução de LDL-C que proporcione uma maior redução de LDL-C.
Coadministração com outros medicamentos
Pacientes em uso de verapamil, diltiazem ou dronedarona
- A dose de ZOCOR não deve exceder 10 mg/dia [ver AVISOS E PRECAUÇÕES , INTERAÇÕES MEDICAMENTOSAS , e FARMACOLOGIA CLÍNICA ].
Pacientes que tomam amiodarona, amlodipina ou ranolazina
- A dose de ZOCOR 10mg não deve exceder 20mg/dia [ver AVISOS E PRECAUÇÕES , INTERAÇÕES MEDICAMENTOSAS , e FARMACOLOGIA CLÍNICA ].
Pacientes com Hipercolesterolemia Familiar Homozigótica
A dosagem recomendada é de 40 mg/dia à noite [Ver DOSAGEM E ADMINISTRAÇÃO , Dosagem restrita para 80 mg ]. ZOCOR 5mg deve ser usado como adjuvante a outros tratamentos hipolipemiantes (por exemplo, aférese de LDL) nesses pacientes ou se tais tratamentos não estiverem disponíveis.
A exposição à sinvastatina é aproximadamente duplicada com o uso concomitante de lomitapida; portanto, a dose de ZOCOR deve ser reduzida em 50% se iniciar lomitapida. A dosagem de ZOCOR 5mg não deve exceder 20 mg/dia (ou 40 mg/dia para pacientes que tomaram ZOCOR 80 mg/dia cronicamente, por exemplo, por 12 meses ou mais, sem evidência de toxicidade muscular) enquanto estiverem tomando lomitapida.
Adolescentes (10-17 anos de idade) com hipercolesterolemia familiar heterozigótica
dose inicial habitual recomendada é de 10 mg uma vez por dia, à noite. A faixa de dosagem recomendada é de 10 a 40 mg/dia; a dose máxima recomendada é de 40 mg/dia. As doses devem ser individualizadas de acordo com o objetivo recomendado da terapia [ver Diretrizes do Painel Pediátrico do NCEP1 e Estudos clínicos ]. Os ajustes devem ser feitos em intervalos de 4 semanas ou mais.
Pacientes com Insuficiência Renal
Como ZOCOR 5mg não sofre excreção renal significativa, a modificação da dosagem não deve ser necessária em pacientes com insuficiência renal leve a moderada. No entanto, deve-se ter cautela quando ZOCOR 20mg é administrado a pacientes com insuficiência renal grave; esses pacientes devem iniciar com 5 mg/dia e ser monitorados de perto [ver AVISOS E PRECAUÇÕES e FARMACOLOGIA CLÍNICA ].
COMO FORNECIDO
Formas de dosagem e pontos fortes
- Os comprimidos ZOCOR 5 mg são comprimidos revestidos por película, ovais, de cor amarelada, codificados MSD 726 de um lado e ZOCOR 5 do outro.
- Os comprimidos ZOCOR 10 mg são comprimidos revestidos por película cor de pêssego, ovais, codificados MSD 735 numa das faces e lisos na outra.
- Os comprimidos ZOCOR 20 mg são comprimidos revestidos por película castanhos, ovais, codificados MSD 740 numa das faces e lisos na outra.
- Os comprimidos de ZOCOR 40 mg são comprimidos revestidos por película de cor vermelho tijolo, ovais, codificados MSD 749 numa das faces e lisos na outra.
- Os comprimidos de ZOCOR 80 mg são comprimidos revestidos por película de cor vermelho tijolo, em forma de cápsula, codificados 543 de um lado e 80 do outro.
Armazenamento e manuseio
Nº 8146 - Comprimidos ZOCOR 10 mg são comprimidos revestidos por película cor de pêssego, ovais, codificados MSD 735 numa das faces e lisos na outra. Eles são fornecidos da seguinte forma:
NDC 0006-0735-31 unidade de uso frascos de 30 NDC 0006-0735-54 unidade de uso frascos de 90.
Nº 8147 - Comprimidos ZOCOR 20 mg são comprimidos revestidos por película castanhos, ovais, codificados MSD 740 numa das faces e lisos na outra. Eles são fornecidos da seguinte forma:
NDC 0006-0740-31 unidade de uso frascos de 30 NDC 0006-0740-54 unidade de uso frascos de 90.
Nº 8148 - Comprimidos ZOCOR 40 mg são comprimidos revestidos por película de cor vermelho tijolo, ovais, com código MSD 749 de um lado e lisos do outro. Eles são fornecidos da seguinte forma:
NDC 0006-0749-31 unidade de uso frascos de 30 NDC 0006-0749-54 unidade de uso frascos de 90.
Nº 6577 - Comprimidos ZOCOR 80 mg são comprimidos revestidos por película de cor vermelho tijolo, em forma de cápsula, codificados 543 de um lado e 80 do outro. Eles são fornecidos da seguinte forma:
NDC 0006-0543-31 unidade de uso frascos de 30 NDC 0006-0543-54 unidade de uso frascos de 90.
Armazenar
Armazenar entre 5-30°C (41-86°F).
1Programa Nacional de Educação sobre Colesterol (NCEP): Destaques do Relatório do Painel de Especialistas sobre Níveis de Colesterol Sanguíneo em Crianças e Adolescentes. Pediatria. 89(3):495-501. 1992.
Fabricado por: Merck Sharp & Dohme Ltd. Cramlington, Northumberland, Reino Unido NE23 3JU. Revisado: setembro de 2020
EFEITOS COLATERAIS
Experiência de Ensaios Clínicos
Como os ensaios clínicos são conduzidos em condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparadas às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
Nos estudos clínicos controlados pré-comercialização e suas extensões abertas (2.423 pacientes com duração média de acompanhamento de aproximadamente 18 meses), 1,4% dos pacientes foram descontinuados devido a reações adversas. As reações adversas mais comuns que levaram à descontinuação do tratamento foram: distúrbios gastrointestinais (0,5%), mialgia (0,1%) e artralgia (0,1%). As reações adversas mais comumente relatadas (incidência ≥5%) em estudos clínicos controlados com sinvastatina foram: infecções respiratórias superiores (9,0%), dor de cabeça (7,4%), dor abdominal (7,3%), constipação (6,6%) e náusea (5,4). %).
Estudo de Sobrevivência da Sinvastatina Escandinava
Em 4S envolvendo 4.444 (faixa etária 35-71 anos, 19% mulheres, 100% caucasianos) tratados com 20-40 mg/dia de ZOCOR (n=2.221) ou placebo (n=2.223) durante uma mediana de 5,4 anos, efeitos adversos as reações relatadas em ≥2% dos pacientes e em uma taxa maior do que o placebo são mostradas na Tabela 2.
Estudo de proteção cardíaca
No Heart Protection Study (HPS), envolvendo 20.536 pacientes (faixa etária 40-80 anos, 25% mulheres, 97% caucasianos, 3% outras raças) tratados com ZOCOR 40 mg/dia (n=10.269) ou placebo (n= 10.267) em uma média de 5 anos, apenas reações adversas graves e descontinuações devido a quaisquer reações adversas foram registradas. As taxas de descontinuação devido a reações adversas foram de 4,8% em pacientes tratados com ZOCOR 10mg em comparação com 5,1% em pacientes tratados com placebo. A incidência de miopatia/rabdomiólise foi
Outros estudos clínicos
Em um ensaio clínico no qual 12.064 pacientes com histórico de infarto do miocárdio foram tratados com ZOCOR (seguimento médio de 6,7 anos), a incidência de miopatia (definida como fraqueza muscular inexplicável ou dor com uma creatina quinase sérica [CK] > 10 vezes limite superior do normal [LSN]) em pacientes com 80 mg/dia foi de aproximadamente 0,9% em comparação com 0,02% para pacientes com 20 mg/dia. A incidência de rabdomiólise (definida como miopatia com CK > 40 vezes o LSN) em pacientes com 80 mg/dia foi de aproximadamente 0,4% em comparação com 0% para pacientes com 20 mg/dia. A incidência de miopatia, incluindo rabdomiólise, foi maior durante o primeiro ano e depois diminuiu notavelmente durante os anos subsequentes de tratamento. Neste estudo, os pacientes foram cuidadosamente monitorados e alguns medicamentos de interação foram excluídos.
Outras reações adversas relatadas em ensaios clínicos foram: diarreia, erupção cutânea, dispepsia, flatulência e astenia.
Testes laboratoriais
Aumentos marcados e persistentes das transaminases hepáticas foram observados [ver AVISOS E PRECAUÇÕES ]. A fosfatase alcalina elevada e a γ-glutamil transpeptidase também foram relatadas. Cerca de 5% dos pacientes apresentaram elevações dos níveis de CK de 3 ou mais vezes o valor normal em uma ou mais ocasiões. Isso foi atribuível à fração não cardíaca da CK. [Vejo AVISOS E PRECAUÇÕES ]
Pacientes adolescentes (10-17 anos)
Em um estudo controlado de 48 semanas em meninos e meninas adolescentes que tinham pelo menos 1 ano pós-menarca, 10-17 anos de idade (43,4% do sexo feminino, 97,7% caucasianos, 1,7% hispânicos, 0,6% multirracial) com hipercolesterolemia familiar heterozigótica (n=175), tratados com placebo ou ZOCOR (10-40 mg por dia), as reações adversas mais comuns observadas em ambos os grupos foram infecção do trato respiratório superior, dor de cabeça, dor abdominal e náusea [ver Uso em populações específicas e Estudos clínicos ].
Experiência pós-marketing
Como as reações abaixo são relatadas voluntariamente por uma população de tamanho incerto, geralmente não é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento. As seguintes reações adversas adicionais foram identificadas durante o uso pós-aprovação da sinvastatina: prurido, alopecia, uma variedade de alterações na pele (por exemplo, nódulos, descoloração, secura da pele/membranas mucosas, alterações no cabelo/unhas), tontura, cãibras musculares, mialgia , pancreatite, parestesia, neuropatia periférica, vômitos, anemia, disfunção erétil, doença pulmonar intersticial, rabdomiólise, hepatite/icterícia, insuficiência hepática fatal e não fatal e depressão.
Houve relatos raros de miopatia necrosante imunomediada associada ao uso de estatinas [ver AVISOS E PRECAUÇÕES ].
Raramente foi relatada uma síndrome de hipersensibilidade aparente que incluiu algumas das seguintes características: anafilaxia, angioedema, síndrome do tipo lúpus eritematoso, polimialgia reumática, dermatomiosite, vasculite, púrpura, trombocitopenia, leucopenia, anemia hemolítica, ANA positivo, aumento da VHS, eosinofilia , artrite, artralgia, urticária, astenia, fotossensibilidade, febre, calafrios, rubor, mal-estar, dispneia, necrólise epidérmica tóxica, eritema multiforme, incluindo síndrome de Stevens-Johnson.
Houve raros relatos pós-comercialização de comprometimento cognitivo (por exemplo, perda de memória, esquecimento, amnésia, comprometimento da memória, confusão) associados ao uso de estatinas. Esses problemas cognitivos foram relatados para todas as estatinas. Os relatos são geralmente não graves e reversíveis com a descontinuação das estatinas, com tempos variáveis de início dos sintomas (1 dia a anos) e resolução dos sintomas (mediana de 3 semanas).
INTERAÇÕES MEDICAMENTOSAS
Inibidores fortes de CYP3A4, ciclosporina ou danazol
Inibidores fortes do CYP3A4: A sinvastatina, como vários outros inibidores da HMG-CoA redutase, é um substrato do CYP3A4. A sinvastatina é metabolizada pelo CYP3A4, mas não possui atividade inibitória do CYP3A4; portanto, não se espera que afete as concentrações plasmáticas de outros medicamentos metabolizados pelo CYP3A4.
Níveis plasmáticos elevados de atividade inibitória da HMG-CoA redutase aumentam o risco de miopatia e rabdomiólise, particularmente com doses mais altas de sinvastatina. [Vejo AVISOS E PRECAUÇÕES e FARMACOLOGIA CLÍNICA ] O uso concomitante de medicamentos rotulados como tendo um forte efeito inibitório sobre o CYP3A4 é contraindicado [ver CONTRA-INDICAÇÕES ]. Se o tratamento com itraconazol, cetoconazol, posaconazol, voriconazol, eritromicina, claritromicina ou telitromicina for inevitável, a terapia com sinvastatina deve ser suspensa durante o tratamento.
Ciclosporina ou Danazol: O risco de miopatia, incluindo rabdomiólise, é aumentado pela administração concomitante de ciclosporina ou danazol. Portanto, o uso concomitante desses medicamentos é contraindicado [ver CONTRA-INDICAÇÕES , AVISOS E PRECAUÇÕES e FARMACOLOGIA CLÍNICA ].
Medicamentos redutores de lipídios que podem causar miopatia quando administrados sozinhos
Gemfibrozil
Contraindicado com sinvastatina [ver CONTRA-INDICAÇÕES e AVISOS E PRECAUÇÕES ].
Outros Fibratos
Deve-se ter cuidado ao prescrever com sinvastatina [ver AVISOS E PRECAUÇÕES ].
Amiodarona, Dronedarona, Ranolazina ou Bloqueadores dos Canais de Cálcio
O risco de miopatia, incluindo rabdomiólise, é aumentado pela administração concomitante de amiodarona, dronedarona, ranolazina ou bloqueadores dos canais de cálcio, como verapamil, diltiazem ou amlodipino. DOSAGEM E ADMINISTRAÇÃO e AVISOS E PRECAUÇÕES , e Tabela 3 em FARMACOLOGIA CLÍNICA ].
Niacina
Casos de miopatia/rabdomiólise foram observados com sinvastatina coadministrada com doses modificadoras de lipídios (≥1 g/dia de niacina) de produtos contendo niacina. O risco de miopatia é maior em pacientes chineses. Em um ensaio clínico (seguimento médio de 3,9 anos) envolvendo pacientes com alto risco de doença cardiovascular e com níveis bem controlados de LDL-C em uso de sinvastatina 40 mg/dia com ou sem ezetimiba 10 mg/dia, não houve benefício incremental em desfechos cardiovasculares com a adição de doses modificadoras de lipídios (≥1 g/dia) de niacina. A coadministração de ZOCOR com doses modificadoras de lipídios (≥1 g/dia) de niacina não é recomendada em pacientes chineses. Não se sabe se esse risco se aplica a outros pacientes asiáticos [ver AVISOS E PRECAUÇÕES e Uso em populações específicas ].
Digoxina
Em um estudo, a administração concomitante de digoxina com sinvastatina resultou em um leve aumento nas concentrações de digoxina no plasma. Os pacientes em uso de digoxina devem ser monitorados adequadamente quando a sinvastatina é iniciada [ver FARMACOLOGIA CLÍNICA ].
Anticoagulantes cumarínicos
Em dois estudos clínicos, um em voluntários normais e outro em pacientes hipercolesterolêmicos, sinvastatina 20-40 mg/dia potencializou modestamente o efeito dos anticoagulantes cumarínicos: o tempo de protrombina, relatado como International Normalized Ratio (INR), aumentou a partir de uma linha de base de 1,7 para 1,8 e de 2,6 para 3,4 nos estudos de voluntários e pacientes, respectivamente. Com outras estatinas, sangramento clinicamente evidente e/ou aumento do tempo de protrombina foram relatados em alguns pacientes tomando anticoagulantes cumarínicos concomitantemente. Nesses pacientes, o tempo de protrombina deve ser determinado antes do início da sinvastatina e com frequência suficiente durante a terapia inicial para garantir que não ocorra alteração significativa do tempo de protrombina. Uma vez documentado um tempo de protrombina estável, os tempos de protrombina podem ser monitorados nos intervalos geralmente recomendados para pacientes em uso de anticoagulantes cumarínicos. Se a dose de sinvastatina for alterada ou descontinuada, o mesmo procedimento deve ser repetido. A terapia com sinvastatina não foi associada a sangramento ou alterações no tempo de protrombina em pacientes que não estão tomando anticoagulantes.
Colchicina
Casos de miopatia, incluindo rabdomiólise, foram relatados com sinvastatina coadministrada com colchicina, e deve-se ter cautela ao prescrever sinvastatina com colchicina.
Daptomicina
Casos de rabdomiólise foram relatados com sinvastatina administrada com daptomicina. Tanto a sinvastatina quanto a daptomicina podem causar miopatia e rabdomiólise quando administradas isoladamente e o risco de miopatia e rabdomiólise pode ser aumentado pela administração concomitante. Suspender temporariamente o ZOCOR em pacientes em uso de daptomicina [ver AVISOS E PRECAUÇÕES ].
AVISOS
Incluído como parte do "PRECAUÇÕES" Seção
PRECAUÇÕES
Miopatia/Rabdomiólise
sinvastatina ocasionalmente causa miopatia manifestada como dor muscular, sensibilidade ou fraqueza com creatina quinase (CK) acima de dez vezes o limite superior do normal (LSN). A miopatia às vezes assume a forma de rabdomiólise com ou sem insuficiência renal aguda secundária à mioglobinúria, e raras fatalidades ocorreram. O risco de miopatia é aumentado por níveis plasmáticos elevados de sinvastatina e ácido de sinvastatina. Os fatores predisponentes para miopatia incluem idade avançada (≥65 anos), sexo feminino, hipotireoidismo não controlado e insuficiência renal. Os pacientes chineses podem ter risco aumentado de miopatia [ver Uso em populações específicas ].
O risco de miopatia, incluindo rabdomiólise, está relacionado com a dose. Em um banco de dados de ensaios clínicos em que 41.413 pacientes foram tratados com ZOCOR 10mg, 24.747 (aproximadamente 60%) dos quais foram incluídos em estudos com acompanhamento médio de pelo menos 4 anos, a incidência de miopatia foi de aproximadamente 0,03% e 0,08% a 20 e 40 mg/dia, respectivamente. A incidência de miopatia com 80 mg (0,61%) foi desproporcionalmente maior do que a observada nas doses mais baixas. Nestes ensaios, os doentes foram cuidadosamente monitorizados e alguns medicamentos de interação foram excluídos.
Em um ensaio clínico no qual 12.064 pacientes com histórico de infarto do miocárdio foram tratados com ZOCOR (seguimento médio de 6,7 anos), a incidência de miopatia (definida como fraqueza muscular inexplicável ou dor com uma creatina quinase sérica [CK] > 10 vezes limite superior do normal [LSN]) em pacientes com 80 mg/dia foi de aproximadamente 0,9% em comparação com 0,02% para pacientes com 20 mg/dia. A incidência de rabdomiólise (definida como miopatia com CK > 40 vezes o LSN) em pacientes com 80 mg/dia foi de aproximadamente 0,4% em comparação com 0% para pacientes com 20 mg/dia. A incidência de miopatia, incluindo rabdomiólise, foi maior durante o primeiro ano e depois diminuiu notavelmente durante os anos subsequentes de tratamento. Neste estudo, os pacientes foram cuidadosamente monitorados e alguns medicamentos de interação foram excluídos.
O risco de miopatia, incluindo rabdomiólise, é maior em pacientes em uso de 80 mg de sinvastatina em comparação com outras terapias com estatinas com eficácia semelhante ou maior na redução do LDL-C e em comparação com doses mais baixas de sinvastatina. Portanto, a dose de 80 mg de ZOCOR deve ser usada apenas em pacientes que estejam tomando sinvastatina 80 mg cronicamente (por exemplo, por 12 meses ou mais) sem evidência de toxicidade muscular [Ver DOSAGEM E ADMINISTRAÇÃO , Dosagem restrita para 80 mg ]. Se, no entanto, um paciente que está atualmente tolerando a dose de 80 mg de ZOCOR precisar ser iniciado com um medicamento de interação que seja contraindicado ou associado a um limite de dose para sinvastatina, esse paciente deve ser trocado para uma estatina alternativa com menor potencial para o interação medicamentosa. Os pacientes devem ser alertados sobre o risco aumentado de miopatia, incluindo rabdomiólise, e relatar imediatamente qualquer dor, sensibilidade ou fraqueza muscular inexplicável. Se ocorrerem sintomas, o tratamento deve ser descontinuado imediatamente. [Vejo Miopatia necrosante imunomediada ]
Todos os pacientes que iniciam a terapia com ZOCOR 20mg, ou cuja dose de ZOCOR esteja sendo aumentada, devem ser alertados sobre o risco de miopatia, incluindo rabdomiólise, e instruídos a relatar imediatamente qualquer dor, sensibilidade ou fraqueza muscular inexplicável, particularmente se acompanhada de mal-estar ou febre ou se houver sinais musculares. e os sintomas persistem após a descontinuação de ZOCOR. A terapia com ZOCOR deve ser descontinuada imediatamente se houver diagnóstico ou suspeita de miopatia. Na maioria dos casos, os sintomas musculares e o aumento da CK foram resolvidos quando o tratamento foi imediatamente descontinuado. Determinações periódicas de CK podem ser consideradas em pacientes iniciando terapia com ZOCOR 5mg ou cuja dose está sendo aumentada, mas não há garantia de que tal monitoramento irá prevenir a miopatia.
Muitos dos pacientes que desenvolveram rabdomiólise durante a terapia com sinvastatina tiveram histórico médico complicado, incluindo insuficiência renal geralmente como consequência de diabetes mellitus de longa data. Esses pacientes merecem um acompanhamento mais próximo. A terapia com ZOCOR deve ser descontinuada se ocorrerem níveis marcadamente elevados de CPK ou se houver diagnóstico ou suspeita de miopatia. A terapia com ZOCOR também deve ser temporariamente suspensa em qualquer paciente que apresente uma condição aguda ou grave que predisponha ao desenvolvimento de insuficiência renal secundária à rabdomiólise, por exemplo, sepse; hipotensão; cirurgia de grande porte; trauma; distúrbios metabólicos, endócrinos ou eletrolíticos graves; ou epilepsia não controlada.
Interações medicamentosas
risco de miopatia e rabdomiólise é aumentado por níveis plasmáticos elevados de sinvastatina e ácido de sinvastatina. A sinvastatina é metabolizada pela isoforma 3A4 do citocromo P450. Certos medicamentos que inibem esta via metabólica podem aumentar os níveis plasmáticos de sinvastatina e podem aumentar o risco de miopatia. Estes incluem itraconazol, cetoconazol, posaconazol, voriconazol, os antibióticos macrolídeos eritromicina e claritromicina e o antibiótico cetolídeo telitromicina, inibidores da protease do HIV, boceprevir, telaprevir, o antidepressivo nefazodona, produtos contendo cobicistate ou suco de toranja [ver FARMACOLOGIA CLÍNICA ]. A combinação desses medicamentos com sinvastatina é contraindicada. Se o tratamento de curto prazo com inibidores potentes do CYP3A4 for inevitável, a terapia com sinvastatina deve ser suspensa durante o curso do tratamento. CONTRA-INDICAÇÕES e INTERAÇÕES MEDICAMENTOSAS ].
O uso combinado de sinvastatina com gemfibrozil, ciclosporina ou danazol é contraindicado. CONTRA-INDICAÇÕES e INTERAÇÕES MEDICAMENTOSAS ].
Deve-se ter cuidado ao prescrever outros fibratos com sinvastatina, pois esses agentes podem causar miopatia quando administrados isoladamente e o risco aumenta quando são coadministrados [ver INTERAÇÕES MEDICAMENTOSAS ].
Casos de miopatia, incluindo rabdomiólise, foram relatados com sinvastatina coadministrada com colchicina, e deve-se ter cautela ao prescrever sinvastatina com colchicina. INTERAÇÕES MEDICAMENTOSAS ].
Os benefícios do uso combinado de sinvastatina com os seguintes medicamentos devem ser cuidadosamente ponderados em relação aos riscos potenciais das combinações: outros medicamentos hipolipemiantes (fibratos ou, para pacientes com HFHo, lomitapida), amiodarona, dronedarona, verapamil, diltiazem, amlodipina, ou ranolazina [Ver DOSAGEM E ADMINISTRAÇÃO , INTERAÇÕES MEDICAMENTOSAS ].
Casos de miopatia, incluindo rabdomiólise, foram observados com sinvastatina coadministrada com doses modificadoras de lipídios (≥1 g/dia de niacina) de produtos contendo niacina [ver INTERAÇÕES MEDICAMENTOSAS ].
Casos de rabdomiólise foram relatados com sinvastatina administrada com daptomicina. Suspender temporariamente o ZOCOR em pacientes em uso de daptomicina [ver INTERAÇÕES MEDICAMENTOSAS ].
As recomendações de prescrição para agentes de interação estão resumidas na Tabela 1 [consulte também DOSAGEM E ADMINISTRAÇÃO , INTERAÇÕES MEDICAMENTOSAS , FARMACOLOGIA CLÍNICA ].
Miopatia necrosante imunomediada
Houve relatos raros de miopatia necrosante imunomediada (IMNM), uma miopatia autoimune, associada ao uso de estatinas. O IMNM é caracterizado por: fraqueza muscular proximal e elevação da creatina quinase sérica, que persistem apesar da descontinuação do tratamento com estatinas; anticorpo anti-HMG CoA redutase positivo; biópsia muscular mostrando miopatia necrosante; e melhora com imunossupressores. Testes neuromusculares e sorológicos adicionais podem ser necessários. O tratamento com agentes imunossupressores pode ser necessário. Considere cuidadosamente o risco de IMNM antes de iniciar uma estatina diferente. Se a terapia for iniciada com uma estatina diferente, monitore os sinais e sintomas de IMNM.
Disfunção hepática
Aumentos persistentes (para mais de 3 vezes o LSN) nas transaminases séricas ocorreram em aproximadamente 1% dos pacientes que receberam sinvastatina em estudos clínicos. Quando o tratamento medicamentoso foi interrompido ou descontinuado nesses pacientes, os níveis de transaminases geralmente caíram lentamente para os níveis pré-tratamento. Os aumentos não foram associados com icterícia ou outros sinais ou sintomas clínicos. Não houve evidência de hipersensibilidade.
No Estudo de Sobrevivência da Sinvastatina Escandinava (4S) [ver Estudos clínicos ], o número de pacientes com mais de uma elevação de transaminase para >3X ULN, ao longo do estudo, não foi significativamente diferente entre os grupos de sinvastatina e placebo (14 [0,7%] vs. 12 [0,6%]). Transaminases elevadas resultaram na descontinuação da terapia em 8 pacientes no grupo sinvastatina (n=2.221) e 5 no grupo placebo (n=2.223). Dos 1.986 pacientes tratados com sinvastatina em 4S com testes de função hepática (LFTs) normais no início do estudo, 8 (0,4%) desenvolveram elevações consecutivas da função hepática para > 3X ULN e/ou foram descontinuados devido a elevações das transaminases durante os 5,4 anos (mediana de acompanhamento ) do estudo. Entre esses 8 pacientes, 5 desenvolveram inicialmente essas anormalidades no primeiro ano. Todos os pacientes deste estudo receberam uma dose inicial de 20 mg de sinvastatina; 37% foram titulados para 40 mg.
Em 2 estudos clínicos controlados em 1.105 pacientes, a incidência de 12 meses de elevação persistente das transaminases hepáticas independentemente da relação medicamentosa foi de 0,9% e 2,1% na dose de 40 e 80 mg, respectivamente. Nenhum paciente desenvolveu anormalidades persistentes da função hepática após os primeiros 6 meses de tratamento com uma determinada dose.
Recomenda-se a realização de testes de função hepática antes do início do tratamento e, posteriormente, quando clinicamente indicado. Houve raros relatos pós-comercialização de insuficiência hepática fatal e não fatal em pacientes tomando estatinas, incluindo sinvastatina. Se ocorrer lesão hepática grave com sintomas clínicos e/ou hiperbilirrubinemia ou icterícia durante o tratamento com ZOCOR 5mg, interrompa imediatamente a terapia. Se uma etiologia alternativa não for encontrada, não reinicie o ZOCOR. Observe que a ALT pode emanar do músculo, portanto, a elevação da ALT com CK pode indicar miopatia [ver Miopatia/Rabdomiólise ].
medicamento deve ser usado com cautela em pacientes que consomem quantidades substanciais de álcool e/ou têm histórico de doença hepática. Doenças hepáticas ativas ou elevações inexplicáveis das transaminases são contraindicações ao uso de sinvastatina.
Elevações moderadas (menos de 3X LSN) das transaminases séricas foram relatadas após a terapia com sinvastatina. Essas alterações apareceram logo após o início da terapia com sinvastatina, muitas vezes foram transitórias, não foram acompanhadas de nenhum sintoma e não exigiram a interrupção do tratamento.
Função Endócrina
Aumentos nos níveis de HbA1c e glicose sérica em jejum foram relatados com inibidores da HMG-CoA redutase, incluindo ZOCOR.
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Em um estudo de carcinogenicidade de 72 semanas, os camundongos receberam doses diárias de sinvastatina de 25, 100 e 400 mg/kg de peso corporal, o que resultou em níveis médios do medicamento no plasma aproximadamente 1, 4 e 8 vezes maiores do que o medicamento médio no plasma humano nível, respectivamente (como atividade inibitória total com base na AUC) após uma dose oral de 80 mg. Os carcinomas hepáticos foram significativamente aumentados em mulheres com altas doses e em homens com doses médias e altas, com uma incidência máxima de 90% em homens. A incidência de adenomas do fígado foi significativamente aumentada em mulheres com doses médias e altas. O tratamento medicamentoso também aumentou significativamente a incidência de adenomas pulmonares em homens e mulheres com doses médias e altas. Adenomas da glândula de Harder (uma glândula do olho de roedores) foram significativamente maiores em camundongos de alta dose do que em controles. Nenhuma evidência de efeito tumorigênico foi observada com 25 mg/kg/dia.
Em um estudo separado de carcinogenicidade de 92 semanas em camundongos com doses de até 25 mg/kg/dia, não foi observada evidência de efeito tumorigênico (os níveis médios do medicamento no plasma foram 1 vezes maiores do que os humanos que receberam 80 mg de sinvastatina conforme medido pela AUC).
Em um estudo de dois anos em ratos com 25 mg/kg/dia, houve um aumento estatisticamente significativo na incidência de adenomas foliculares da tireoide em ratas expostas a níveis aproximadamente 11 vezes mais altos de sinvastatina do que em humanos que receberam 80 mg de sinvastatina (como medido pela AUC).
Um segundo estudo de carcinogenicidade em ratos de dois anos com doses de 50 e 100 mg/kg/dia produziu adenomas e carcinomas hepatocelulares (em ratas com ambas as doses e em machos com 100 mg/kg/dia). Os adenomas de células foliculares da tireoide estavam aumentados em machos e fêmeas em ambas as doses; carcinomas de células foliculares da tireoide foram aumentados em mulheres com 100 mg/kg/dia. O aumento da incidência de neoplasias da tireoide parece ser consistente com os achados de outras estatinas. Esses níveis de tratamento representaram níveis plasmáticos de drogas (AUC) de aproximadamente 7 e 15 vezes (homens) e 22 e 25 vezes (mulheres) a exposição média de drogas plasmáticas humanas após uma dose diária de 80 miligramas.
Nenhuma evidência de mutagenicidade foi observada em um teste de mutagenicidade microbiana (Ames) com ou sem ativação metabólica do fígado de rato ou camundongo. Além disso, nenhuma evidência de dano ao material genético foi observada em um ensaio de eluição alcalina in vitro usando hepatócitos de rato, um estudo de mutação direta de células de mamífero V-79, um estudo de aberração cromossômica in vitro em células CHO ou um ensaio de aberração cromossômica in vivo na medula óssea de camundongos.
Houve diminuição da fertilidade em ratos machos tratados com sinvastatina por 34 semanas a 25 mg/kg de peso corporal (4 vezes o nível máximo de exposição humana, com base na AUC, em pacientes que receberam 80 mg/dia); no entanto, este efeito não foi observado durante um estudo de fertilidade subsequente no qual a sinvastatina foi administrada neste mesmo nível de dose a ratos machos durante 11 semanas (todo o ciclo da espermatogénese incluindo a maturação do epidídimo). Não foram observadas alterações microscópicas nos testículos de ratos de ambos os estudos. Na dose de 180 mg/kg/dia (que produz níveis de exposição 22 vezes maiores do que em humanos tomando 80 mg/dia com base na área de superfície, mg/m2), foi observada degeneração dos túbulos seminíferos (necrose e perda de epitélio espermatogênico). Em cães, houve atrofia testicular relacionada à droga, diminuição da espermatogênese, degeneração espermatocítica e formação de células gigantes a 10 mg/kg/dia (aproximadamente 2 vezes a exposição humana, com base na AUC, a 80 mg/dia). O significado clínico desses achados não é claro.
Uso em populações específicas
Gravidez
Gravidez Categoria X [Ver CONTRA-INDICAÇÕES ]
ZOCOR é contra-indicado em mulheres grávidas ou que possam vir a engravidar. Os medicamentos hipolipemiantes não oferecem nenhum benefício durante a gravidez, porque o colesterol e os derivados do colesterol são necessários para o desenvolvimento fetal normal. A aterosclerose é um processo crônico e a descontinuação de medicamentos hipolipemiantes durante a gravidez deve ter pouco impacto nos resultados a longo prazo da terapia da hipercolesterolemia primária. Não existem estudos adequados e bem controlados de uso com ZOCOR durante a gravidez; entretanto, há relatos raros de anomalias congênitas em bebês expostos a estatinas in utero. Estudos de reprodução animal de sinvastatina em ratos e coelhos não mostraram evidência de teratogenicidade. O colesterol e os triglicerídeos séricos aumentam durante a gravidez normal, e o colesterol ou derivados do colesterol são essenciais para o desenvolvimento fetal. Como as estatinas diminuem a síntese de colesterol e possivelmente a síntese de outras substâncias biologicamente ativas derivadas do colesterol, ZOCOR pode causar danos ao feto quando administrado a mulheres grávidas. Se ZOCOR 5mg for usado durante a gravidez ou se a paciente engravidar enquanto estiver tomando este medicamento, a paciente deve ser informada do risco potencial para o feto.
Existem raros relatos de anomalias congênitas após exposição intrauterina a estatinas. Em uma revisão2 de aproximadamente 100 gestações seguidas prospectivamente em mulheres expostas à sinvastatina ou outra estatina estruturalmente relacionada, as incidências de anomalias congênitas, abortos espontâneos e mortes fetais/natimortos não excederam as esperadas na população geral. No entanto, o estudo só foi capaz de excluir um aumento de 3 a 4 vezes no risco de anomalias congênitas em relação à taxa de fundo. Em 89% desses casos, o tratamento medicamentoso foi iniciado antes da gravidez e foi descontinuado durante o primeiro trimestre quando a gravidez foi identificada.
A sinvastatina não foi teratogênica em ratos ou coelhos em doses (25, 10 mg/kg/dia, respectivamente) que resultaram em 3 vezes a exposição humana com base em mg/m2 de área de superfície. No entanto, em estudos com outra estatina estruturalmente relacionada, foram observadas malformações esqueléticas em ratos e camundongos.
Manson, JM, Freyssinges, C., Ducrocq, MB, Stephenson, WP, Vigilância Pós-Comercialização da Exposição à Lovastatina e Sinvastatina Durante a Gravidez, Toxicologia Reprodutiva, 10(6):439-446, 1996.
Mulheres com potencial para engravidar, que necessitem de tratamento com ZOCOR 5mg para distúrbios lipídicos, devem ser aconselhadas a usar métodos contraceptivos eficazes. Para mulheres que estão tentando engravidar, a descontinuação de ZOCOR deve ser considerada. Se ocorrer gravidez, ZOCOR deve ser descontinuado imediatamente.
Mães que amamentam
Não se sabe se a sinvastatina é excretada no leite humano. Como uma pequena quantidade de outro medicamento desta classe é excretada no leite humano e devido ao potencial de reações adversas graves em lactentes, as mulheres que tomam sinvastatina não devem amamentar seus bebês. Deve ser tomada uma decisão sobre descontinuar a amamentação ou descontinuar o medicamento, levando em consideração a importância do medicamento para a mãe [ver CONTRA-INDICAÇÕES ].
Uso Pediátrico
segurança e a eficácia da sinvastatina em pacientes de 10 a 17 anos de idade com hipercolesterolemia familiar heterozigótica foram avaliadas em um ensaio clínico controlado em meninos e meninas adolescentes que estavam pelo menos 1 ano após a menarca. Os pacientes tratados com sinvastatina tiveram um perfil de reações adversas semelhante ao dos pacientes tratados com placebo. Doses superiores a 40 mg não foram estudadas nesta população. Neste estudo controlado limitado, não houve efeito significativo no crescimento ou maturação sexual em meninos ou meninas adolescentes, ou na duração do ciclo menstrual em meninas. [Ver DOSAGEM E ADMINISTRAÇÃO , REAÇÕES ADVERSAS , Estudos clínicos ] Mulheres adolescentes devem ser aconselhadas sobre métodos contraceptivos apropriados enquanto estiverem em terapia com sinvastatina [ver CONTRA-INDICAÇÕES e Gravidez ]. A sinvastatina não foi estudada em pacientes com menos de 10 anos de idade, nem em meninas pré-menarcas.
Uso Geriátrico
Dos 2.423 pacientes que receberam ZOCOR 5mg nos estudos clínicos de Fase III e dos 10.269 pacientes no Heart Protection Study que receberam ZOCOR 40mg, 363 (15%) e 5.366 (52%), respectivamente, tinham ≥65 anos de idade. No HPS, 615 (6%) tinham ≥75 anos. Não foram observadas diferenças gerais na segurança ou eficácia entre esses indivíduos e indivíduos mais jovens, e outras experiências clínicas relatadas não identificaram diferenças nas respostas entre os pacientes idosos e os pacientes mais jovens, mas a maior sensibilidade de alguns indivíduos mais velhos não pode ser descartada. Uma vez que a idade avançada (≥65 anos) é um fator predisponente para miopatia, ZOCOR deve ser prescrito com cautela em idosos. [Ver FARMACOLOGIA CLÍNICA ]
Um estudo farmacocinético com sinvastatina mostrou que o nível plasmático médio de atividade da estatina é aproximadamente 45% maior em pacientes idosos entre 70-78 anos de idade em comparação com pacientes entre 18-30 anos de idade. No 4S, 1.021 (23%) de 4.444 pacientes tinham 65 anos ou mais. A eficácia na redução de lipídios foi pelo menos tão grande em pacientes idosos em comparação com pacientes mais jovens, e ZOCOR reduziu significativamente a mortalidade total e a mortalidade por DC em pacientes idosos com histórico de DC. No HPS, 52% dos pacientes eram idosos (4.891 pacientes de 65-69 anos e 5.806 pacientes de 70 anos ou mais). As reduções de risco relativo de morte por doença coronariana, infarto do miocárdio não fatal, procedimentos de revascularização coronariana e não coronariana e acidente vascular cerebral foram semelhantes em pacientes mais velhos e mais jovens [ver Estudos clínicos ]. No HPS, entre 32.145 pacientes que entraram no período de run-in ativo, houve 2 casos de miopatia/rabdomiólise; esses pacientes tinham 67 e 73 anos. Dos 7 casos de miopatia/rabdomiólise entre 10.269 pacientes alocados para sinvastatina, 4 tinham 65 anos ou mais (no início), dos quais um tinha mais de 75 anos. e pacientes mais jovens em 4S ou HPS.
Como a idade avançada (≥65 anos) é um fator predisponente para miopatia, incluindo rabdomiólise, ZOCOR 40mg deve ser prescrito com cautela em idosos. Em um ensaio clínico de pacientes tratados com sinvastatina 80 mg/dia, pacientes ≥65 anos de idade apresentaram risco aumentado de miopatia, incluindo rabdomiólise, em comparação com pacientes AVISOS E PRECAUÇÕES e FARMACOLOGIA CLÍNICA ]
Insuficiência renal
Deve-se ter cautela quando ZOCOR 20mg é administrado a pacientes com insuficiência renal grave.[Consulte DOSAGEM E ADMINISTRAÇÃO ]
Insuficiência hepática
ZOCOR 10mg é contraindicado em pacientes com doença hepática ativa que pode incluir elevações persistentes inexplicáveis nos níveis de transaminases hepáticas. CONTRA-INDICAÇÕES e AVISOS E PRECAUÇÕES ].
Pacientes Chineses
Em um ensaio clínico no qual pacientes com alto risco de doença cardiovascular foram tratados com sinvastatina 40 mg/dia (seguimento médio de 3,9 anos), a incidência de miopatia foi de aproximadamente 0,05% para pacientes não chineses (n=7367) em comparação com 0,24% para pacientes chineses (n=5468). A incidência de miopatia para pacientes chineses em uso de sinvastatina 40 mg/dia ou ezetimiba/sinvastatina 10/40 mg/dia coadministrados com niacina de liberação prolongada 2 g/dia foi de 1,24%.
Pacientes chineses podem estar em maior risco de miopatia, monitore os pacientes adequadamente. A coadministração de ZOCOR 10mg com doses modificadoras de lipídios (≥1 g/dia de niacina) de produtos contendo niacina não é recomendada em pacientes chineses [ver AVISOS E PRECAUÇÕES , INTERAÇÕES MEDICAMENTOSAS ].
SOBREDOSAGEM
Letalidade significativa foi observada em camundongos após uma dose oral única de 9 g/m2. Nenhuma evidência de letalidade foi observada em ratos ou cães tratados com doses de 30 e 100 g/m2, respectivamente. Não foram observados sinais diagnósticos específicos em roedores. Nestas doses, os únicos sinais observados em cães foram vômitos e fezes mucóides.
Alguns casos de superdosagem com ZOCOR foram relatados; a dose máxima tomada foi de 3,6 g. Todos os pacientes se recuperaram sem sequelas. Devem ser tomadas medidas de suporte em caso de sobredosagem. A dialisabilidade da sinvastatina e seus metabólitos no homem não é conhecida no momento.
CONTRA-INDICAÇÕES
ZOCOR 40mg é contraindicado nas seguintes condições:
- Administração concomitante de inibidores potentes do CYP3A4 (por exemplo, itraconazol, cetoconazol, posaconazol, voriconazol, inibidores da protease do HIV, boceprevir, telaprevir, eritromicina, claritromicina, telitromicina, nefazodona e produtos contendo cobicistate) [ver AVISOS E PRECAUÇÕES ].
- Administração concomitante de gemfibrozil, ciclosporina ou danazol [ver AVISOS E PRECAUÇÕES ].
- Hipersensibilidade a qualquer componente deste medicamento [ver REAÇÕES ADVERSAS ].
- Doença hepática ativa, que pode incluir elevações persistentes inexplicáveis nos níveis das transaminases hepáticas [ver AVISOS E PRECAUÇÕES ].
- Mulheres grávidas ou que possam engravidar. O colesterol e os triglicerídeos séricos aumentam durante a gravidez normal, e o colesterol ou derivados do colesterol são essenciais para o desenvolvimento fetal. Como os inibidores da HMG-CoA redutase (estatinas) diminuem a síntese de colesterol e possivelmente a síntese de outras substâncias biologicamente ativas derivadas do colesterol, ZOCOR 40mg pode causar dano fetal quando administrado a uma mulher grávida. A aterosclerose é um processo crônico e a descontinuação de drogas hipolipemiantes durante a gravidez deve ter pouco impacto no resultado da terapia a longo prazo da hipercolesterolemia primária. Não existem estudos adequados e bem controlados de uso com ZOCOR durante a gravidez; no entanto, em relatos raros, foram observadas anomalias congênitas após exposição intrauterina a estatinas. Em estudos de reprodução em ratos e coelhos, a sinvastatina não revelou evidência de teratogenicidade. ZOCOR deve ser administrado a mulheres em idade fértil somente quando tais pacientes são altamente improváveis de conceber. Se a paciente engravidar enquanto estiver tomando este medicamento, ZOCOR deve ser descontinuado imediatamente e a paciente deve ser informada do risco potencial para o feto [ver Uso em populações específicas ].
- Mães que amamentam. Não se sabe se a sinvastatina é excretada no leite humano; no entanto, uma pequena quantidade de outro medicamento desta classe passa para o leite materno. Como as estatinas têm potencial para reações adversas graves em lactentes, as mulheres que necessitam de tratamento com ZOCOR não devem amamentar seus bebês [ver Uso em populações específicas ].
FARMACOLOGIA CLÍNICA
Mecanismo de ação
sinvastatina é uma pró-droga e é hidrolisada na sua forma ativa de β-hidroxiácido, ácido sinvastatina, após administração. A sinvastatina é um inibidor específico da 3-hidroxi-3-metilglutaril-coenzima A (HMG-CoA) redutase, a enzima que catalisa a conversão de HMG-CoA em mevalonato, uma etapa precoce e limitante na via biossintética do colesterol. Além disso, a sinvastatina reduz VLDL e TG e aumenta o HDL-C.
Farmacodinâmica
Estudos epidemiológicos demonstraram que níveis elevados de C total, LDL-C, bem como níveis diminuídos de HDL-C estão associados ao desenvolvimento de aterosclerose e aumento do risco cardiovascular. A redução do LDL-C diminui esse risco. No entanto, o efeito independente da elevação do HDL-C ou da redução dos TG sobre o risco de morbidade e mortalidade coronariana e cardiovascular não foi determinado.
Farmacocinética
sinvastatina é uma lactona que é prontamente hidrolisada in vivo no β-hidroxiácido correspondente, um potente inibidor da HMG-CoA redutase. A inibição da HMG-CoA redutase é a base para um ensaio em estudos farmacocinéticos dos metabólitos β-hidroxiácidos (inibidores ativos) e, após hidrólise básica, inibidores ativos e latentes (inibidores totais) no plasma após administração de sinvastatina.
Após uma dose oral de sinvastatina marcada com 14C no homem, 13% da dose foi excretada na urina e 60% nas fezes. As concentrações plasmáticas de radioatividade total (sinvastatina mais metabólitos 14C) atingiram o pico em 4 horas e diminuíram rapidamente para cerca de 10% do pico em 12 horas após a dose. Como a sinvastatina sofre extensa extração de primeira passagem no fígado, a disponibilidade do fármaco para a circulação geral é baixa (
Tanto a sinvastatina como o seu metabolito β-hidroxiácido ligam-se fortemente (aproximadamente 95%) às proteínas plasmáticas humanas. Estudos em ratos indicam que, quando a sinvastatina radiomarcada foi administrada, a radioatividade derivada da sinvastatina atravessou a barreira hematoencefálica.
Os principais metabólitos ativos da sinvastatina presentes no plasma humano são o β-hidroxiácido da sinvastatina e seus derivados 6'-hidroxi, 6'-hidroximetil e 6'-exometileno. As concentrações plasmáticas máximas de inibidores ativos e totais foram atingidas dentro de 1,3 a 2,4 horas após a dose. Embora a faixa de dose terapêutica recomendada seja de 5 a 40 mg/dia, não houve desvio substancial da linearidade da AUC dos inibidores na circulação geral com um aumento da dose até 120 mg. Em relação ao estado de jejum, o perfil plasmático dos inibidores não foi afetado quando a sinvastatina foi administrada imediatamente antes de uma refeição com baixo teor de gordura recomendada pela American Heart Association.
Em um estudo que incluiu 16 pacientes idosos entre 70 e 78 anos de idade que receberam ZOCOR 40 mg/dia, o nível plasmático médio da atividade inibitória da HMG-CoA redutase aumentou aproximadamente 45% em comparação com 18 pacientes entre 18 e 30 anos de idade. A experiência de estudos clínicos em idosos (n = 1.522) sugere que não houve diferenças gerais na segurança entre pacientes idosos e mais jovens [ver Uso em populações específicas ].
Estudos cinéticos com outra estatina, com uma via principal de eliminação semelhante, sugeriram que, para um determinado nível de dose, uma exposição sistêmica mais alta pode ser alcançada em pacientes com insuficiência renal grave (medida pela depuração da creatinina).
ácido da sinvastatina é um substrato da proteína de transporte OATP1B1. A administração concomitante de medicamentos que são inibidores da proteína de transporte OATP1B1 pode levar a concentrações plasmáticas aumentadas de ácido de sinvastatina e a um risco aumentado de miopatia. Por exemplo, a ciclosporina demonstrou aumentar a AUC das estatinas; embora o mecanismo não seja totalmente compreendido, o aumento da AUC para o ácido da sinvastatina é presumivelmente devido, em parte, à inibição do CYP3A4 e/ou OATP1B1.
O risco de miopatia é aumentado por altos níveis de atividade inibitória da HMG-CoA redutase no plasma. Os inibidores do CYP3A4 podem aumentar os níveis plasmáticos da atividade inibitória da HMG-CoA redutase e aumentar o risco de miopatia [ver AVISOS E PRECAUÇÕES e INTERAÇÕES MEDICAMENTOSAS ].
Em um estudo com 12 voluntários saudáveis, a sinvastatina na dose de 80 mg não teve efeito sobre o metabolismo da sonda citocromo P450 isoforma 3A4 (CYP3A4) substratos midazolam e eritromicina. Isso indica que a sinvastatina não é um inibidor do CYP3A4 e, portanto, não se espera que afete os níveis plasmáticos de outros medicamentos metabolizados pelo CYP3A4.
A coadministração de sinvastatina (40 mg QD por 10 dias) resultou em um aumento nos níveis médios máximos de digoxina cardioativa (administrada como uma dose única de 0,4 mg no dia 10) em aproximadamente 0,3 ng/mL.
Toxicologia e/ou Farmacologia Animal
Toxicidade do SNC
A degeneração do nervo óptico foi observada em cães clinicamente normais tratados com sinvastatina por 14 semanas a 180 mg/kg/dia, uma dose que produziu níveis médios do medicamento no plasma cerca de 12 vezes maiores do que o nível médio do medicamento no plasma em humanos tomando 80 mg/dia.
Um fármaco quimicamente semelhante nesta classe também produziu degeneração do nervo óptico (degeneração Walleriana das fibras retinogeniculadas) em cães clinicamente normais de forma dose-dependente a partir de 60 mg/kg/dia, uma dose que produziu níveis médios do fármaco no plasma cerca de 30 vezes maiores do que o nível médio do fármaco no plasma em humanos tomando a dose mais alta recomendada (medida pela atividade inibitória enzimática total). Esta mesma droga também produziu degeneração vestibulococlear Walleriana e cromatólise de células ganglionares da retina em cães tratados por 14 semanas com 180 mg/kg/dia, uma dose que resultou em um nível médio de droga no plasma semelhante ao observado com 60 mg/kg/dia. dose do dia.
Lesões vasculares do SNC, caracterizadas por hemorragia e edema perivascular, infiltração de células mononucleares dos espaços perivasculares, depósitos de fibrina perivascular e necrose de pequenos vasos foram observadas em cães tratados com sinvastatina na dose de 360 mg/kg/dia, dose que produziu média plasmática níveis de droga que eram cerca de 14 vezes maiores do que os níveis médios de droga no plasma em humanos tomando 80 mg/dia. Lesões vasculares do SNC semelhantes foram observadas com várias outras drogas desta classe.
Houve catarata em ratas após dois anos de tratamento com 50 e 100 mg/kg/dia (22 e 25 vezes a AUC humana a 80 mg/dia, respectivamente) e em cães após três meses a 90 mg/kg/dia ( 19 vezes) e aos dois anos a 50 mg/kg/dia (5 vezes).
Estudos clínicos
Estudos Clínicos em Adultos
Reduções no risco de mortalidade por doença coronariana e eventos cardiovasculares
Em 4S, o efeito da terapia com ZOCOR 20mg na mortalidade total foi avaliado em 4.444 pacientes com DC e colesterol total basal 212-309 mg/dL (5,5-8,0 mmol/L). Neste estudo multicêntrico, randomizado, duplo-cego, controlado por placebo, os pacientes foram tratados com cuidados padrão, incluindo dieta e ZOCOR 20-40 mg/dia (n=2.221) ou placebo (n=2.223) por uma duração mediana de 5,4 anos. Ao longo do estudo, o tratamento com ZOCOR levou a reduções médias de C total, LDL-C e TG de 25%, 35% e 10%, respectivamente, e um aumento médio de HDL-C de 8%. ZOCOR reduziu significativamente o risco de mortalidade em 30% (p=0,0003, 182 mortes no grupo ZOCOR 40mg vs 256 mortes no grupo placebo). O risco de mortalidade por DAC foi significativamente reduzido em 42% (p=0,00001, 111 vs 189 mortes). Não houve diferença estatisticamente significativa entre os grupos na mortalidade não cardiovascular. O ZOCOR diminuiu significativamente o risco de eventos coronarianos maiores (mortalidade por DAC mais infarto do miocárdio não fatal [IM] silencioso e verificado no hospital) em 34% (p
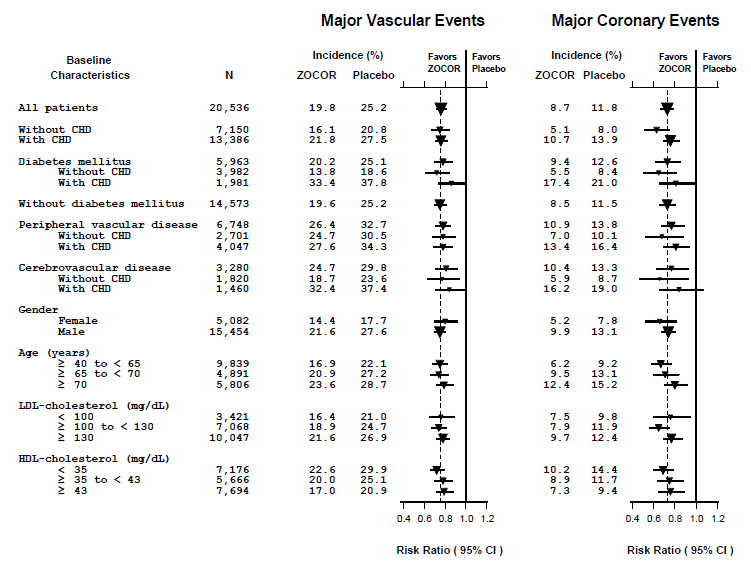
Heart Protection Study (HPS) foi um grande estudo multicêntrico, controlado por placebo, duplo-cego, com duração média de 5 anos, realizado em 20.536 pacientes (10.269 em ZOCOR 40 mg e 10.267 em placebo). Os pacientes foram alocados para tratamento usando um método adaptativo covariável3 que levou em consideração a distribuição de 10 características basais importantes dos pacientes já inscritos e minimizou o desequilíbrio dessas características entre os grupos. Os pacientes tinham uma idade média de 64 anos (intervalo de 40-80 anos), eram 97% caucasianos e estavam em alto risco de desenvolver um evento coronariano importante devido à doença coronariana existente (65%), diabetes (tipo 2, 26%; tipo 1 , 3%), história de acidente vascular cerebral ou outra doença cerebrovascular (16%), doença vascular periférica (33%) ou hipertensão em homens ≥65 anos (6%). No início do estudo, 3.421 pacientes (17%) apresentavam níveis de LDL-C abaixo de 100 mg/dL, dos quais 953 (5%) apresentavam níveis de LDL-C abaixo de 80 mg/dL; 7.068 pacientes (34%) apresentaram níveis entre 100 e 130 mg/dL; e 10.047 pacientes (49%) apresentaram níveis superiores a 130 mg/dL.
DR Taves, Minimização: um novo método de atribuição de pacientes a grupos de tratamento e controle. Clin. Pharmacol. Ter. 15 (1974), págs. 443-453
Os resultados de HPS mostraram que ZOCOR 40 mg/dia reduziu significativamente: mortalidade total e por DAC; IM não fatal, acidente vascular cerebral e procedimentos de revascularização (coronárias e não coronarianas) (ver Tabela 4).
Dois endpoints compostos foram definidos para ter eventos suficientes para avaliar as reduções de risco relativo em uma série de características de linha de base (consulte a Figura 1). Um composto de eventos coronarianos maiores (ECM) foi composto de mortalidade por doença coronariana e IAM não fatal (analisado pelo tempo até o primeiro evento; 898 pacientes tratados com ZOCOR 5mg tiveram eventos e 1.212 pacientes com placebo tiveram eventos). Um composto de eventos vasculares maiores (EMV) foi composto por ECM, acidente vascular cerebral e procedimentos de revascularização, incluindo procedimentos coronários, periféricos e outros procedimentos não coronarianos (analisados pelo tempo até o primeiro evento; 2.033 pacientes tratados com ZOCOR 10mg tiveram eventos e 2.585 pacientes em placebo teve eventos). Reduções significativas de risco relativo foram observadas para ambos os desfechos compostos (27% para MCE e 24% para MVE, p
Figura 1 Os Efeitos do Tratamento com ZOCOR 5mg em Eventos Vasculares Maiores e Eventos Coronários Maiores em HPS
Estudos angiográficos
No Multicenter Anti-Atheroma Study, o efeito da sinvastatina na aterosclerose foi avaliado por angiografia coronária quantitativa em pacientes hipercolesterolêmicos com DCC. Neste estudo randomizado, duplo-cego e controlado, os pacientes foram tratados com sinvastatina 20 mg/dia ou placebo. Os angiogramas foram avaliados no início, dois e quatro anos. Os desfechos do estudo co-primário foram a alteração média por paciente nos diâmetros mínimo e médio do lúmen, indicando doença focal e difusa, respectivamente. O ZOCOR retardou significativamente a progressão das lesões conforme medido no angiograma do ano 4 por ambos os parâmetros, bem como pela alteração na estenose do diâmetro percentual. Além disso, a sinvastatina diminuiu significativamente a proporção de pacientes com novas lesões e com novas oclusões totais.
Modificações de perfis lipídicos
Hiperlipidemia primária (Fredrickson tipo lla e llb)
ZOCOR demonstrou ser eficaz na redução de C-total e C-LDL em formas heterozigóticas familiares e não familiares de hiperlipidemia e em hiperlipidemia mista. A resposta máxima a quase máxima é geralmente alcançada dentro de 4-6 semanas e mantida durante a terapia crônica. O ZOCOR diminuiu significativamente o C-total, o C-LDL, a relação C-total/HDL-C e a relação LDL-C/HDL-C; ZOCOR também diminuiu TG e aumentou HDL-C (ver Tabela 5).
Hipertrigliceridemia (Fredrickson Tipo IV)
Os resultados de uma análise de subgrupo em 74 pacientes com hiperlipidemia tipo IV de um estudo cruzado de 3 períodos com 130 pacientes, duplo-cego, controlado por placebo são apresentados na Tabela 6.
Disbetalipoproteinemia (Fredrickson Tipo III)
Os resultados de uma análise de subgrupo em 7 pacientes com hiperlipidemia tipo III (disbetalipoproteinemia) (apo E2/2) (VLDL-C/TG>0,25) de um estudo cruzado de 3 períodos com 130 pacientes, duplo-cego, controlado por placebo são apresentados na Tabela 7.
Hipercolesterolemia Familiar Homozigótica
Em um estudo clínico controlado, 12 pacientes de 15-39 anos de idade com hipercolesterolemia familiar homozigótica receberam sinvastatina 40 mg/dia em dose única ou em 3 doses divididas, ou 80 mg/dia em 3 doses divididas. Em 11 pacientes com reduções no LDL-C, as alterações médias do LDL-C para as doses de 40 e 80 mg foram de 14% (intervalo de 8% a 23%, mediana de 12%) e 30% (intervalo de 14% a 46% , mediana de 29%), respectivamente. Um paciente teve um aumento de 15% no LDL-C. Outro paciente com função ausente do receptor de LDL-C apresentou redução de 41% do LDL-C com a dose de 80 mg.
Função Endócrina
Em estudos clínicos, a sinvastatina não prejudicou a reserva adrenal nem reduziu significativamente a concentração plasmática basal de cortisol. Pequenas reduções da linha de base na testosterona plasmática basal em homens foram observadas em estudos clínicos com sinvastatina, um efeito também observado com outras estatinas e colestiramina sequestrante de ácidos biliares. Não houve efeito sobre os níveis plasmáticos de gonadotrofina. Em um estudo de 12 semanas controlado por placebo, não houve efeito significativo de 80 mg de sinvastatina na resposta da testosterona plasmática à gonadotrofina coriônica humana. Em outro estudo de 24 semanas, sinvastatina 20-40 mg não teve efeito detectável na espermatogênese. No 4S, no qual 4.444 pacientes foram randomizados para sinvastatina 20-40 mg/dia ou placebo por uma duração média de 5,4 anos, a incidência de eventos adversos sexuais masculinos nos dois grupos de tratamento não foi significativamente diferente. Devido a esses fatores, é improvável que as pequenas alterações na testosterona plasmática sejam clinicamente significativas. Os efeitos, se houver, no eixo pituitário-gonadal em mulheres na pré-menopausa são desconhecidos.
Estudos Clínicos em Adolescentes
Em um estudo duplo-cego, controlado por placebo, 175 pacientes (99 meninos adolescentes e 76 meninas pós-menarca) de 10-17 anos de idade (idade média de 14,1 anos) com hipercolesterolemia familiar heterozigótica (HeFH) foram randomizados para sinvastatina (n= 106) ou placebo (n=67) por 24 semanas (estudo de base). A inclusão no estudo exigiu um nível basal de LDL-C entre 160 e 400 mg/dL e pelo menos um dos pais com um nível de LDL-C > 189 mg/dL. A dosagem de sinvastatina (uma vez ao dia à noite) foi de 10 mg nas primeiras 8 semanas, 20 mg nas segundas 8 semanas e 40 mg depois. Em uma extensão de 24 semanas, 144 pacientes optaram por continuar a terapia com sinvastatina 40 mg ou placebo.
ZOCOR 20mg diminuiu significativamente os níveis plasmáticos de C-total, C-LDL e Apo B (ver Tabela 8). Os resultados da extensão às 48 semanas foram comparáveis aos observados no estudo base.
Após 24 semanas de tratamento, o valor médio de LDL-C alcançado foi de 124,9 mg/dL (intervalo: 64,0289,0 mg/dL) no grupo ZOCOR 40 mg em comparação com 207,8 mg/dL (intervalo: 128,0-334,0 mg/dL) no grupo placebo.
A segurança e eficácia de doses acima de 40 mg por dia não foram estudadas em crianças com HeFH. A eficácia a longo prazo da terapia com sinvastatina na infância para reduzir a morbidade e mortalidade na idade adulta não foi estabelecida.
INFORMAÇÃO DO PACIENTE
Os pacientes devem ser aconselhados a aderir à dieta recomendada pelo National Cholesterol Education Program (NCEP), um programa regular de exercícios e testes periódicos de um painel lipídico em jejum.
Os pacientes devem ser informados sobre substâncias que não devem tomar concomitantemente com sinvastatina [Vejo CONTRA-INDICAÇÕES e AVISOS E PRECAUÇÕES ]. Os pacientes também devem ser aconselhados a informar outros profissionais de saúde que estejam prescrevendo um novo medicamento ou aumentando a dose de um medicamento existente que estão tomando ZOCOR.
Dor muscular
Todos os pacientes que iniciam a terapia com ZOCOR devem ser alertados sobre o risco de miopatia, incluindo rabdomiólise, e instruídos a relatar imediatamente qualquer dor, sensibilidade ou fraqueza muscular inexplicável, particularmente se acompanhada de mal-estar ou febre ou se esses sinais ou sintomas musculares persistirem após a descontinuação de ZOCOR. Os pacientes que utilizam a dose de 80 mg devem ser informados de que o risco de miopatia, incluindo rabdomiólise, aumenta com o uso da dose de 80 mg. O risco de miopatia, incluindo rabdomiólise, que ocorre com o uso de ZOCOR 40mg aumenta ao tomar certos tipos de medicamentos ou consumir sumo de toranja. Os pacientes devem discutir todos os medicamentos, tanto prescritos quanto de venda livre, com seu profissional de saúde.
Enzimas do Fígado
Recomenda-se a realização de testes de função hepática antes do início de ZOCOR 20mg e, posteriormente, quando clinicamente indicado. Todos os pacientes tratados com ZOCOR devem ser aconselhados a relatar imediatamente quaisquer sintomas que possam indicar lesão hepática, incluindo fadiga, anorexia, desconforto abdominal superior direito, urina escura ou icterícia.
Gravidez
Mulheres em idade fértil devem ser aconselhadas a usar um método eficaz de controle de natalidade para prevenir a gravidez enquanto estiverem usando ZOCOR. Discuta planos futuros de gravidez com seus pacientes e discuta quando parar de tomar ZOCOR 40mg se eles estiverem tentando engravidar. As pacientes devem ser avisadas de que, se engravidarem, devem parar de tomar ZOCOR e ligar para seu profissional de saúde.
Amamentação
Mulheres que estão amamentando não devem usar ZOCOR. Pacientes que têm um distúrbio lipídico e estão amamentando devem ser aconselhadas a discutir as opções com seu profissional de saúde.
