Furadantin 100mg Nitrofurantoin Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Furadantin 100mg e como é usado?
Furadantin (suspensão oral de nitrofurantoína) é um antibiótico usado para tratar infecções do trato urinário. Furadantin está disponível na forma genérica.
Quais são os efeitos colaterais da Furadantina?
Os efeitos colaterais comuns de Furadantin incluem:
- náusea,
- vômito,
- perda de apetite,
- dor de estômago,
- diarréia,
- dor de cabeça,
- tontura,
- sonolência,
- urina cor de ferrugem ou acastanhada, ou
- coceira ou corrimento vaginal.
Informe o seu médico se tiver efeitos secundários raros mas muito graves de Furadantin, incluindo:
- dor nos olhos,
- alterações na visão,
- alterações mentais/de humor,
- dores de cabeça persistentes ou graves,
- novos sinais de infecção (por exemplo, febre, dor de garganta persistente) ou
- hematomas ou sangramentos fáceis.
DESCRIÇÃO
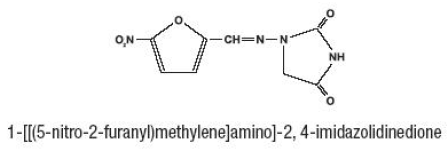
Furadantin (nitrofurantoína), um produto químico sintético, é um composto estável, amarelo e cristalino. Furadantin é um agente antibacteriano para infecções específicas do trato urinário. Furadantin está disponível em suspensão líquida de 25mg/5mL para administração oral.
Ingredientes inativos
Furadantin Suspensão Oral contém carboximetilcelulose sódica, ácido cítrico, aromas, glicerina, silicato de magnésio e alumínio, metilparabeno, propilparabeno, água purificada, citrato de sódio e sorbitol.
INDICAÇÕES
Furadantina é especificamente indicado para o tratamento de infecções do trato urinário devido a cepas sensíveis de Escherichia coli, enterococos, Staphylococcus aureus e certas cepas sensíveis de espécies de Klebsiella e Enterobacter.
A nitrofurantoína não é indicada para o tratamento de pielonefrite ou abscessos perirrenais.
Nitrofurantoínas não possuem a distribuição tecidual mais ampla de outros agentes terapêuticos aprovados para infecções do trato urinário. Consequentemente, muitos pacientes que são tratados com Furadantina estão predispostos à persistência ou reaparecimento da bacteriúria. Amostras de urina para cultura e teste de sensibilidade devem ser obtidas antes e após a conclusão da terapia. Se ocorrer persistência ou reaparecimento de bacteriúria após o tratamento com Furadantina , outros agentes terapêuticos com distribuição tecidual mais ampla devem ser selecionados. Ao considerar o uso de Furadantina , taxas mais baixas de erradicação devem ser equilibradas com o aumento do potencial de toxicidade sistêmica e para o desenvolvimento de resistência antimicrobiana quando agentes com distribuição tecidual mais ampla são utilizados.
DOSAGEM E ADMINISTRAÇÃO
Furadantina deve ser administrado com alimentos para melhorar a absorção do fármaco e, em alguns pacientes, a tolerância.
Adultos
50-100 mg quatro vezes ao dia - o nível de dosagem mais baixo é recomendado para infecções do trato urinário não complicadas.
Pacientes pediátricos
5-7 mg/kg de peso corporal por 24 horas, administrados em quatro doses divididas (contraindicado em menores de um mês de idade).
A tabela a seguir é baseada em um peso médio em cada intervalo recebendo 5 a 6 mg/kg de peso corporal por 24 horas, administrados em quatro doses divididas. Pode ser usado para calcular uma dose média de Furadantina Suspensão Oral (25 mg/5 mL) para pacientes pediátricos.
A terapia deve ser continuada por uma semana ou por pelo menos 3 dias após a obtenção da esterilidade da urina. A infecção continuada indica a necessidade de reavaliação.
Para terapia supressiva de longo prazo em adultos, uma redução da dose para 50-100 mg na hora de dormir pode ser adequada. Para terapia supressiva de longo prazo em pacientes pediátricos, doses tão baixas quanto 1 mg/kg por 24 horas, administradas em dose única ou em duas doses divididas, podem ser adequadas. VEJO SEÇÃO DE ADVERTÊNCIAS COM RELAÇÃO AOS RISCOS ASSOCIADOS À TERAPIA DE LONGO PRAZO .
COMO FORNECIDO
Furadantina A Suspensão Oral está disponível em:
NDC 70199-006-32 Garrafa PET âmbar de 230 mL
Evite a exposição à luz forte que pode escurecer o medicamento. É estável quando armazenado entre 20°-25°C (68°-77°F); excursões permitidas para 15°-30°C (59°-86°F) [Consulte Temperatura ambiente controlada USP ]. Proteger do congelamento. Agite bem. Dispensar em recipiente de plástico (PET) ou vidro hermético e resistente à luz.
Use dentro de 30 dias.
Mantenha fora do alcance de crianças.
Fabricado para: Casper Pharma LLC, East Brunswick NJ 08816. Revisado: dezembro de 2020
EFEITOS COLATERAIS
Respiratório
REAÇÕES DE HIPERSENSIBILIDADE PULMONAR CRÔNICA, SUBAGUDA OU AGUDA PODEM OCORRER.
REAÇÕES PULMONARES CRÔNICAS PODEM OCORRER GERALMENTE EM PACIENTES QUE RECEBERAM TRATAMENTO CONTÍNUO POR SEIS MESES OU MAIS. MAL-ESTAR, DISPNEIA AOS ESFORÇOS, TOSSE E FUNÇÃO PULMONAR ALTERADA SÃO MANIFESTAÇÕES COMUNS QUE PODEM OCORRER INSIDIOSAMENTE. ACHADOS RADIOLÓGICOS E HISTOLÓGICOS DE PNEUMONITE INTERSTICIAL DIFUSA OU FIBROSE, OU AMBOS, TAMBÉM SÃO MANIFESTAÇÕES COMUNS DA REAÇÃO PULMONAR CRÔNICA. A FEBRE RARAMENTE É PROMINENTE.
GRAVIDADE DAS REAÇÕES PULMONARES CRÔNICAS E SEUS GRAUS DE RESOLUÇÃO PARECE QUE ESTÃO RELACIONADOS COM A DURAÇÃO DA TERAPIA APÓS O APARECIMENTO DOS PRIMEIROS SINAIS CLÍNICOS. A FUNÇÃO PULMONAR PODE SER PREJUDICADA PERMANENTEMENTE, MESMO APÓS A CESSAÇÃO DA TERAPIA. O RISCO É MAIOR QUANDO AS REAÇÕES PULMONARES CRÔNICAS NÃO SÃO RECONHECIDAS PRECOCEMENTE.
Nas reações pulmonares subagudas, a febre e a eosinofilia ocorrem com menos frequência do que na forma aguda. Após a interrupção da terapia, a recuperação pode levar vários meses. Se os sintomas não forem reconhecidos como relacionados ao medicamento e a terapia com nitrofurantoína não for interrompida, os sintomas podem se tornar mais graves.
As reações pulmonares agudas são comumente manifestadas por febre, calafrios, tosse, dor torácica, dispneia, infiltração pulmonar com consolidação de derrame pleural na radiografia e eosinofilia.
As reações agudas geralmente ocorrem na primeira semana de tratamento e são reversíveis com a interrupção da terapia. A resolução muitas vezes é dramática. (Vejo AVISOS )
Alterações no ECG (por exemplo, alterações inespecíficas da onda ST/T, bloqueio de ramo) foram relatadas em associação com reações pulmonares.
Cianose foi relatada raramente.
Hepático
Reações hepáticas, incluindo hepatite, icterícia colestática, hepatite crônica ativa e neurose hepática, ocorrem raramente. (Vejo AVISOS )
Neurológico
Ocorreu neuropatia periférica, que pode se tornar grave ou irreversível. Fatalidades foram relatadas. Condições como insuficiência renal (clearance de creatinina abaixo de 60 mL por minuto ou creatinina sérica elevada clinicamente significativa), anemia, diabetes mellitus, desequilíbrio eletrolítico, deficiência de vitamina B e doenças debilitantes podem aumentar a possibilidade de neuropatia periférica (ver AVISOS )
Astenia, vertigem, nistagmo, tontura, cefaleia e sonolência também foram relatados com o uso de nitrofurantoína.
Hipertensão intracraniana benigna (pseudotumor cerebral), confusão, depressão, neurite óptica e reações psicóticas foram raramente relatadas. Fontanelas abauladas, como um sinal de hipertensão intracraniana benigna em lactentes, foram relatadas raramente.
Dermatológico
Dermatite esfoliativa e eritema multiforme (incluindo síndrome de Stevens-Johnson) foram relatados raramente. Alopecia transitória também foi relatada.
Alérgico
Foi relatada uma síndrome semelhante ao lúpus associada a reações pulmonares à nitrofurantoína. Além disso, angioedema; erupções maculopapulares, eritematosas ou eczematosas; prurido; urticária; anafilaxia; artralgia; mialgia; febre de drogas; e vasculite (às vezes associada a reações pulmonares) foram relatadas. As reações de hipersensibilidade apresentam os eventos adversos relatados espontaneamente com mais frequência na experiência pós-comercialização em todo o mundo com formulações de nitrofurantoína.
Gastrointestinal
Náuseas, vômitos e anorexia ocorrem com mais frequência. Dor abdominal e diarreia são reações gastrointestinais menos comuns. Essas reações relacionadas à dose podem ser minimizadas pela redução da dosagem. Sialadenite e pancreatite foram relatadas. Houve relatos esporádicos de colite pseudomembranosa com o uso de nitrofurantoína. O início dos sintomas de colite pseudomembranosa pode ocorrer durante ou após o tratamento antimicrobiano. (Vejo AVISOS )
Hematologico
Cianose secundária à metemoglobinemia foi relatada raramente.
Diversos
Tal como acontece com outros agentes antimicrobianos, podem ocorrer superinfecções causadas por organismos resistentes, por exemplo, espécies de Pseudomonas ou espécies de Candida. Há relatos esporádicos de superinfecções por Clostridium difficile, ou colite pseudomembranosa, com o uso de nitrofurantoína.
Eventos Adversos Laboratoriais
Os seguintes eventos adversos laboratoriais foram relatados com o uso de nitrofurantoína; AST aumentada (SGOT), ALT aumentada (SGPT), hemoglobina diminuída, fósforo sérico aumentado, eosinofilia, anemia por deficiência de glicose-6-fosfato desidrogenase (ver AVISOS ), agranulocitose, leucopenia, granulocitopenia, anemia hemolítica, trombocitopenia, anemia megaloblástica. Na maioria dos casos, essas anormalidades hematológicas foram resolvidas após a interrupção da terapia. Anemia aplástica foi relatada raramente.
Para relatar REAÇÕES ADVERSAS SUSPEITAS, entre em contato com a Casper Pharma LLC. em 1-844-5-CASPER (1-844-522-7737) ou FDA em 1-800-FDA-1088 ou www.fda.gov/medwatch.
INTERAÇÕES MEDICAMENTOSAS
Antiácidos contendo trissilicato de magnésio, quando administrados concomitantemente com nitrofurantoína, reduzem tanto a velocidade quanto a extensão da absorção. O mecanismo para essa interação provavelmente é a adsorção de nitrofurantoína na superfície do trisilicato de magnésio.
Drogas uricosúricas, como probenecida e sulfinpirazona, podem inibir a secreção tubular renal de nitrofurantoína. O aumento resultante nos níveis séricos de nitrofurantoína pode aumentar a toxicidade, e os níveis urinários diminuídos podem diminuir sua eficácia como antibacteriano do trato urinário.
Interações de teste de droga/laboratório
Como resultado da presença de nitrofurantoína, pode ocorrer uma reação falso-positiva para glicose na urina. Isso foi observado com as soluções de Benedict e Fehling, mas não com o teste enzimático de glicose.
AVISOS
Reações pulmonares
REAÇÕES PULMONARES AGUDAS, SUBAGUDAS OU CRÔNICAS FORAM OBSERVADAS EM PACIENTES TRATADOS COM NITROFURANTOÍNA. SE ESTAS REAÇÕES OCORREM, FURADANTIN 100mg DEVE SER DESCONTINUADO E MEDIDAS ADEQUADAS TOMADAS. RELATÓRIOS CITARAM REAÇÕES PULMONARES COMO CAUSA CONTRIBUINTE DE MORTE.
REAÇÕES PULMONARES CRÔNICAS (PNEUMONITE INTERSTICIAL DIFUSA OU FIBROSE PULMONAR, OU AMBAS) PODEM DESENVOLVER-SE INSIDIOSAMENTE. ESTAS REAÇÕES OCORREM RARAMENTE E GERALMENTE EM PACIENTES RECEBENDO TERAPIA POR SEIS MESES OU MAIS. O MONITORAMENTO PRÓXIMO DA CONDIÇÃO PULMONAR DE PACIENTES QUE RECEBEM TERAPIA DE LONGO PRAZO É GARANTIDO E REQUER QUE OS BENEFÍCIOS DA TERAPIA SEJAM PESADOS CONTRA OS RISCOS POTENCIAIS. (veja REAÇÕES RESPIRATÓRIAS.)
Hepatotoxicidade
Reações hepáticas, incluindo hepatite, icterícia colestática, hepatite crônica ativa e necrose hepática, ocorrem raramente. Fatalidades foram relatadas. O início da hepatite crônica ativa pode ser insidioso, e os pacientes devem ser monitorados periodicamente quanto a alterações nos exames bioquímicos que indiquem lesão hepática. Se ocorrer hepatite, o medicamento deve ser retirado imediatamente e medidas apropriadas devem ser tomadas.
Neuropatia
Ocorreu neuropatia periférica, que pode se tornar grave ou irreversível. Fatalidades foram relatadas. Condições como insuficiência renal (clearance de creatinina abaixo de 60 mL por minuto ou creatinina sérica elevada clinicamente significativa), anemia, diabetes mellitus, desequilíbrio eletrolítico, deficiência de vitamina B e doença debilitante podem aumentar a ocorrência de neuropatia periférica. Pacientes recebendo terapia de longo prazo devem ser monitorados periodicamente quanto a alterações na função renal.
Neurite óptica foi relatada raramente na experiência pós-comercialização com formulações de nitrofurantoína.
Anemia hemolítica
Casos de anemia hemolítica do tipo sensibilidade à primaquina foram induzidos pela nitrofurantoína. A hemólise parece estar ligada a uma deficiência de glicose-6-fosfato desidrogenase nos glóbulos vermelhos dos pacientes afetados. Essa deficiência é encontrada em 10% dos negros e em uma pequena porcentagem de grupos étnicos de origem mediterrânea e do Oriente Próximo. A hemólise é uma indicação para descontinuar Furadantina a hemólise cessa quando a droga é retirada.
Diarreia Associada ao Clostridium Difficile
Diarreia associada a Clostridium difficile (CDAD) foi relatada com o uso de quase todos os agentes antibacterianos, incluindo Furadantina Suspensão oral e pode variar em gravidade de diarreia leve a colite fatal. O tratamento com agentes antibacterianos altera a flora normal do cólon levando ao crescimento excessivo de C. difficile.
C. difficile produz toxinas A e B que contribuem para o desenvolvimento de CDAD. Cepas produtoras de hipertoxina de C. difficile causam aumento da morbidade e mortalidade, pois essas infecções podem ser refratárias à terapia antimicrobiana e podem exigir colectomia. CDAD deve ser considerado em todos os pacientes que apresentam diarreia após o uso de antibióticos. É necessário um histórico médico cuidadoso, pois foi relatado que a CDAD ocorre mais de dois meses após a administração de agentes antibacterianos.
Se houver suspeita ou confirmação de CDAD, o uso contínuo de antibióticos não direcionados contra C. difficile pode precisar ser descontinuado. O manejo adequado de fluidos e eletrólitos, suplementação de proteína, tratamento antibiótico de C. difficile e avaliação cirúrgica devem ser instituídos conforme indicação clínica.
PRECAUÇÕES
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
A nitrofurantoína não foi carcinogênica quando administrada a ratos fêmeas Holtzman por 44,5 semanas ou a ratos fêmeas Sprague-Dawley por 75 semanas. Dois bioensaios crônicos em roedores utilizando ratos Sprague-Dawley machos e fêmeas e dois bioensaios crônicos em camundongos Swiss e em camundongos BDF1 não revelaram evidência de carcinogenicidade.
nitrofurantoína apresentou evidências de atividade carcinogênica em camundongos B6C3F1 fêmeas, como demonstrado pelo aumento da incidência de adenomas tubulares, tumores mistos benignos e tumores de células da granulosa do ovário. Em ratos machos F344/N, houve aumento da incidência de neoplasias de células tubulares renais incomuns, osteossarcomas do osso e neoplasias do tecido subcutâneo. Em um estudo envolvendo a administração subcutânea de 75 mg/kg de nitrofurantoína a camundongos fêmeas grávidas, foram observados adenomas papilares pulmonares de significado desconhecido na geração F1.
nitrofurantoína demonstrou induzir mutações pontuais em certas cepas de Salmonella typhimurium e mutações diretas em células de linfoma de camundongo L5178Y. A nitrofurantoína induziu um aumento do número de trocas de cromátides irmãs e aberrações cromossômicas em células de ovário de hamster chinês, mas não em células humanas em cultura. Os resultados do ensaio letal recessivo ligado ao sexo em Drosophila foram negativos após a administração de nitrofurantoína por alimentação ou por injeção. A nitrofurantoína não induziu mutação hereditária nos modelos de roedores examinados.
O significado dos achados de carcinogenicidade e mutagenicidade em relação ao uso terapêutico da nitrofurantoína em humanos é desconhecido.
A administração de altas doses de nitrofurantoína em ratos causa parada espermatogênica temporária; isso é reversível com a descontinuação do medicamento. Doses de 10 mg/kg/dia ou mais em humanos saudáveis do sexo masculino podem, em certos casos imprevisíveis, produzir uma parada espermatogênica leve a moderada com diminuição na contagem de espermatozoides.
Gravidez
Efeitos teratogênicos
Vários estudos de reprodução foram realizados em coelhos e ratos em doses até seis vezes a dose humana e não revelaram evidências de diminuição da fertilidade ou danos ao feto devido à nitrofurantoína. Em um único estudo publicado realizado em camundongos com 68 vezes a dose humana (com base em mg/kg administrado à mãe), foram observados retardo de crescimento e baixa incidência de malformações menores e comuns. No entanto, com 25 vezes a dose humana, não foram observadas malformações fetais; a relevância desses achados para humanos é incerta. No entanto, não existem estudos adequados e bem controlados em mulheres grávidas. Como os estudos de reprodução em animais nem sempre são preditivos da resposta humana, este medicamento deve ser usado durante a gravidez somente se for claramente necessário.
Efeitos não teratogênicos
nitrofurantoína demonstrou em um estudo publicado de carcinogenicidade transplacentária induzir adenomas papilares pulmonares em camundongos da geração F1 em doses 19 vezes a dose humana na base de mg/kg. A relação deste achado com a potencial carcinogênese humana é atualmente desconhecida. Devido à incerteza em relação às implicações humanas desses dados em animais, este medicamento deve ser usado durante a gravidez somente se for claramente necessário.
Trabalho e entrega
Ver CONTRA-INDICAÇÕES .
Mães que amamentam
A nitrofurantoína foi detectada no leite materno humano em pequenas quantidades. Devido ao potencial de reações adversas graves da nitrofurantoína em lactentes com menos de um mês de idade, deve-se decidir entre descontinuar a amamentação ou descontinuar o medicamento, levando em consideração a importância do medicamento para a mãe. (Vejo CONTRA-INDICAÇÕES )
Uso Pediátrico
Segurança e eficácia de Furadantina em recém-nascidos com menos de um mês de idade não foram estabelecidas. (Vejo CONTRA-INDICAÇÕES )
SOBREDOSAGEM
Incidentes ocasionais de superdosagem aguda de Furadantina não resultaram em quaisquer sintomas específicos além de vômitos. A indução de vômito é recomendada. Não há antídoto específico, mas deve-se manter uma alta ingestão de líquidos para promover a excreção urinária do fármaco. É dialisável.
CONTRA-INDICAÇÕES
Anúria, oligúria ou comprometimento significativo da função renal (clearance de creatinina abaixo de 60 mL por minuto ou creatinina sérica elevada clinicamente significativa) são contra-indicações. O tratamento deste tipo de paciente acarreta um risco aumentado de toxicidade devido à excreção prejudicada do fármaco.
Devido à possibilidade de anemia hemolítica por sistemas enzimáticos eritrocitários imaturos (instabilidade da glutationa), a droga é contraindicada em gestantes a termo (38-42 semanas de gestação), durante o trabalho de parto e parto, ou quando o início do trabalho de parto é iminente. Pela mesma razão, o medicamento é contraindicado em neonatos com menos de um mês de idade.
Furadantina é contraindicado em pacientes com história prévia de icterícia colestática/disfunção hepática associada à nitrofurantoína. Furadantina também é contraindicado em pacientes com hipersensibilidade conhecida à nitrofurantoína.
FARMACOLOGIA CLÍNICA
Administrado por via oral Furadantina é prontamente absorvido e rapidamente excretado na urina. As concentrações sanguíneas na dosagem terapêutica são geralmente baixas. É altamente solúvel na urina, à qual pode conferir uma cor castanha.
Após um regime de dose de 100 mg qid por 7 dias, as recuperações médias do fármaco urinário (0-24 horas) no dia 1 e dia 7 foram de 42,7% e 43,6%.
Ao contrário de muitos medicamentos, a presença de alimentos ou agentes que retardam o esvaziamento gástrico pode aumentar a biodisponibilidade de Furadantina , presumivelmente por permitir uma melhor dissolução nos sucos gástricos.
Microbiologia
Modo de ação
A nitrofurantoína é reduzida por uma ampla gama de enzimas, incluindo flavoproteínas bacterianas, a intermediários reativos que danificam macromoléculas, como DNA e proteínas.
Resistência cruzada
Embora possa ocorrer resistência cruzada com outros antimicrobianos, não foi observada resistência cruzada com sulfonamidas.
Interação com outros antimicrobianos
O antagonismo foi demonstrado in vitro entre os agentes antimicrobianos nitrofurantoína e quinolona. A nitrofurantoína, na forma de suspensão oral de nitrofurantoína, demonstrou ser ativa contra a maioria das seguintes bactérias tanto in vitro quanto em infecções clínicas: (Ver INDICAÇÕES E USO ).
Aeróbios Gram-positivos
Staphylococcus aureus espécies de Enterococcus
Aeróbios Gram-Negativos
Escherichia coli
NOTA: Algumas cepas de espécies de Enterobacter e espécies de Klebsiella são resistentes à nitrofurantoína.
Os seguintes dados in vitro estão disponíveis, mas seu significado clínico é desconhecido. A nitrofurantoína exibe atividade in vitro contra as seguintes bactérias; no entanto, a segurança e a eficácia da nitrofurantoína no tratamento de infecções clínicas causadas por essas bactérias não foram estabelecidas em ensaios clínicos adequados e bem controlados.
Aeróbios Gram-positivos
Estafilococos coagulase-negativos (incluindo Staphylococcus epidermidis e Staphylococcus saprophyticus)Streptococcus agalactiae Estreptococos do grupo Viridans
Aeróbios Gram-Negativos
Citrobacter koseriCitrobacter freundiiKlebsiella oxytoca
A nitrofurantoína não é ativa contra a maioria das cepas das espécies Proteus ou Serratia. Não tem atividade contra espécies de Pseudomonas.
Teste de suscetibilidade
Para obter informações específicas sobre os critérios interpretativos do teste de suscetibilidade e métodos de teste associados e padrões de controle de qualidade reconhecidos pela FDA para este medicamento, consulte: http://www.fda.gov/STIC.
INFORMAÇÃO DO PACIENTE
Os pacientes devem ser aconselhados a tomar Furadantina com alimentos para aumentar ainda mais a tolerância e melhorar a absorção do fármaco. Os pacientes devem ser instruídos a completar o curso completo da terapia; no entanto, devem ser aconselhados a contactar o seu médico se ocorrerem quaisquer sintomas invulgares durante a terapêutica.
diarreia é um problema comum causado por antibióticos que geralmente termina quando o antibiótico é descontinuado. Às vezes, após o início do tratamento com antibióticos, os pacientes podem desenvolver fezes aquosas e sanguinolentas (com ou sem cólicas estomacais e febre), mesmo dois ou mais meses após a última dose do antibiótico. Se isso ocorrer, os pacientes devem entrar em contato com seu médico o mais rápido possível.
Os pacientes devem ser aconselhados a não usar preparações antiácidos contendo trissilicato de magnésio enquanto estiverem tomando Furadantina .
