Diflucan 50mg, 100mg, 150mg, 200mg Fluconazole Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Diflucan e como é usado?
Diflucan é um medicamento de prescrição usado para tratar os sintomas de infecções fúngicas. Diflucan 50mg pode ser usado sozinho ou com outros medicamentos.
Diflucan 100mg pertence a uma classe de medicamentos chamados antifúngicos.
Quais são os efeitos colaterais do Diflucan 150mg?
Diflucan 100mg pode causar efeitos colaterais graves, incluindo:
- batimentos cardíacos rápidos ou acelerados,
- vibrar em seu peito,
- falta de ar,
- tontura repentina,
- febre,
- arrepios,
- dores no corpo,
- sintomas da gripe,
- hematomas ou sangramentos fáceis,
- fraqueza incomum,
- convulsão (convulsões),
- erupções cutâneas ou lesões,
- perda de apetite,
- dor de estômago superior,
- urina escura,
- fezes cor de barro, e
- amarelecimento dos olhos ou da pele (icterícia)
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Diflucan incluem:
- náusea,
- dor de estômago,
- diarréia,
- dor de estômago,
- dor de cabeça,
- tontura, e
- mudanças no seu sentido de gosto
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Diflucan. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
DESCRIÇÃO
DIFLUCAN® (fluconazol), o primeiro de uma nova subclasse de agentes antifúngicos triazólicos sintéticos, está disponível na forma de comprimidos para administração oral, como pó para suspensão oral.
O fluconazol é designado quimicamente como álcool 2,4-difluoro-α,α1-bis(1H-1,2,4-triazol-1-ilmetil)benzílico com uma fórmula empírica de C13H12F2N6O e peso molecular de 306,3. A fórmula estrutural é:
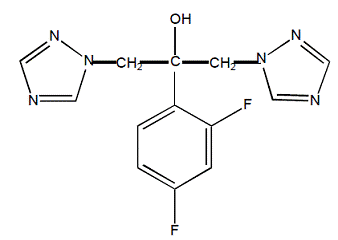
O fluconazol é um sólido cristalino branco que é ligeiramente solúvel em água e solução salina.
DIFLUCAN comprimidos contém 50, 100, 150 ou 200 mg de fluconazol e os seguintes ingredientes inativos: celulose microcristalina, fosfato de cálcio dibásico anidro, povidona, croscarmelose sódica, corante laca de alumínio FD&C Red No. 40 e estearato de magnésio.
DIFLUCAN para Suspensão Oral contém 350 mg ou 1400 mg de fluconazol e os seguintes ingredientes inativos: sacarose, citrato de sódio dihidratado, ácido cítrico anidro, benzoato de sódio, dióxido de titânio, dióxido de silício coloidal, goma xantana e aroma natural de laranja. Após reconstituição com 24 mL de água destilada ou água purificada (USP), cada mL de suspensão reconstituída contém 10 mg ou 40 mg de fluconazol.
INDICAÇÕES
DIFLUCAN (fluconazol) é indicado para o tratamento de:
- Candidíase vaginal (infecções fúngicas vaginais devido a Candida).
- Candidíase orofaríngea e esofágica. Em estudos abertos não comparativos de um número relativamente pequeno de pacientes, DIFLUCAN também foi eficaz para o tratamento de infecções do trato urinário por Candida, peritonite e infecções sistêmicas por Candida, incluindo candidemia, candidíase disseminada e pneumonia.
- Meningite criptocócica. Antes de prescrever DIFLUCAN (fluconazol) para pacientes com AIDS com meningite criptocócica, consulte Estudos clínicos seção. Não foram realizados estudos comparando DIFLUCAN 150mg com anfotericina B em pacientes não infectados pelo HIV.
Profilaxia
DIFLUCAN também é indicado para diminuir a incidência de candidíase em pacientes submetidos a transplante de medula óssea que recebem quimioterapia citotóxica e/ou radioterapia.
Amostras para cultura de fungos e outros estudos laboratoriais relevantes (sorologia, histopatologia) devem ser obtidos antes da terapia para isolar e identificar os organismos causadores. A terapia pode ser instituída antes que os resultados das culturas e outros estudos laboratoriais sejam conhecidos; entretanto, uma vez que esses resultados estejam disponíveis, a terapia anti-infecciosa deve ser ajustada adequadamente.
DOSAGEM E ADMINISTRAÇÃO
Dosagem e Administração em Adultos
Dose única
Candidíase Vaginal
A dosagem recomendada de DIFLUCAN para candidíase vaginal é de 150 mg em dose oral única.
Dose múltipla
COMO A ABSORÇÃO ORAL É RÁPIDA E QUASE COMPLETA, A DOSE DIÁRIA DE DIFLUCAN (FLUCONAZOL) É A MESMA PARA A ADMINISTRAÇÃO ORAL (COMPRIMIDOS E SUSPENSÃO) E INTRAVENOSA. Em geral, uma dose de ataque de duas vezes a dose diária é recomendada no primeiro dia de terapia para resultar em concentrações plasmáticas próximas ao estado de equilíbrio no segundo dia de terapia.
dose diária de DIFLUCAN 100mg para o tratamento de outras infecções além da candidíase vaginal deve ser baseada no organismo infectante e na resposta do paciente à terapia. O tratamento deve ser continuado até que os parâmetros clínicos ou testes laboratoriais indiquem que a infecção fúngica ativa tenha diminuído. Um período inadequado de tratamento pode levar à recorrência da infecção ativa. Pacientes com AIDS e meningite criptocócica ou candidíase orofaríngea recorrente geralmente requerem terapia de manutenção para prevenir recaídas.
Candidíase orofaríngea
A dosagem recomendada de DIFLUCAN para candidíase orofaríngea é de 200 mg no primeiro dia, seguido de 100 mg uma vez ao dia. A evidência clínica de candidíase orofaríngea geralmente se resolve em alguns dias, mas o tratamento deve ser continuado por pelo menos 2 semanas para diminuir a probabilidade de recidiva.
Candidíase Esofágica
dose recomendada de DIFLUCAN 200mg para candidíase esofágica é de 200mg no primeiro dia, seguido de 100mg uma vez ao dia. Doses de até 400 mg/dia podem ser usadas, com base no julgamento médico da resposta do paciente à terapia. Pacientes com candidíase esofágica devem ser tratados por um período mínimo de três semanas e por pelo menos duas semanas após a resolução dos sintomas.
Infecções sistêmicas por Candida
Para infecções sistêmicas por Candida, incluindo candidemia, candidíase disseminada e pneumonia, a dosagem terapêutica ideal e a duração da terapia não foram estabelecidas. Em estudos abertos e não comparativos de um pequeno número de pacientes, doses de até 400 mg diários foram usadas.
Infecções do trato urinário e peritonite
Para o tratamento de infecções do trato urinário por Candida e peritonite, doses diárias de 50 a 200 mg foram usadas em estudos abertos e não comparativos de um pequeno número de pacientes.
Meningite Criptocócica
posologia recomendada para o tratamento da meningite criptocócica aguda é de 400 mg no primeiro dia, seguida de 200 mg uma vez ao dia. Uma dosagem de 400 mg uma vez ao dia pode ser usada, com base no julgamento médico da resposta do paciente à terapia. A duração recomendada do tratamento para a terapia inicial da meningite criptocócica é de 10 a 12 semanas após a cultura do líquido cefalorraquidiano tornar-se negativa. A dose recomendada de DIFLUCAN 150mg para supressão da recidiva da meningite criptocócica em pacientes com AIDS é de 200mg uma vez ao dia.
Profilaxia em Pacientes Submetidos a Transplante de Medula Óssea
dose diária recomendada de DIFLUCAN para a prevenção da candidíase em pacientes submetidos a transplante de medula óssea é de 400 mg, uma vez ao dia. Pacientes com previsão de granulocitopenia grave (menos de 500 células de neutrófilos/mm³) devem iniciar a profilaxia com DIFLUCAN vários dias antes do início previsto da neutropenia e continuar por 7 dias após a contagem de neutrófilos subir acima de 1.000 células/mm³.
Dosagem e administração em crianças
O esquema de equivalência de dose a seguir deve geralmente fornecer exposição equivalente em pacientes pediátricos e adultos:
A experiência com DIFLUCAN em recém-nascidos está limitada a estudos farmacocinéticos em recém-nascidos prematuros. (Ver FARMACOLOGIA CLÍNICA .) Com base na meia-vida prolongada observada em recém-nascidos prematuros (idade gestacional de 26 a 29 semanas), essas crianças, nas duas primeiras semanas de vida, devem receber a mesma dosagem (mg/kg) que em crianças maiores, porém administradas a cada 72 horas. Após as primeiras duas semanas, estas crianças devem receber uma dose diária. Não há informações disponíveis sobre a farmacocinética de DIFLUCAN em recém-nascidos a termo.
Candidíase orofaríngea
A dose recomendada de DIFLUCAN 150mg para candidíase orofaríngea em crianças é de 6 mg/kg no primeiro dia, seguido de 3 mg/kg uma vez ao dia. O tratamento deve ser administrado por pelo menos 2 semanas para diminuir a probabilidade de recaída.
Candidíase Esofágica
Para o tratamento da candidíase esofágica, a dose recomendada de DIFLUCAN em crianças é de 6 mg/kg no primeiro dia, seguida de 3 mg/kg uma vez ao dia. Doses de até 12 mg/kg/dia podem ser usadas, com base no julgamento médico da resposta do paciente à terapia. Pacientes com candidíase esofágica devem ser tratados por no mínimo três semanas e por pelo menos 2 semanas após a resolução dos sintomas.
Infecções sistêmicas por Candida
Para o tratamento de candidemia e infecções disseminadas por Candida, doses diárias de 6 a 12 mg/kg/dia foram usadas em um estudo aberto e não comparativo de um pequeno número de crianças.
Meningite Criptocócica
Para o tratamento da meningite criptocócica aguda, a dose recomendada é de 12 mg/kg no primeiro dia, seguida de 6 mg/kg uma vez ao dia. Uma dosagem de 12 mg/kg uma vez ao dia pode ser usada, com base no julgamento médico da resposta do paciente à terapia. A duração recomendada do tratamento para a terapia inicial da meningite criptocócica é de 10 a 12 semanas após a cultura do líquido cefalorraquidiano tornar-se negativa. Para a supressão da recidiva da meningite criptocócica em crianças com AIDS, a dose recomendada de DIFLUCAN é de 6 mg/kg uma vez ao dia.
Dosagem em pacientes com função renal prejudicada
O fluconazol é eliminado principalmente por excreção renal como fármaco inalterado. Não há necessidade de ajustar a terapia de dose única para candidíase vaginal devido ao comprometimento da função renal. Em pacientes com função renal comprometida que receberão doses múltiplas de DIFLUCAN, uma dose inicial de ataque de 50 mg a 400 mg deve ser administrada. Após a dose de ataque, a dose diária (de acordo com a indicação) deve ser baseada na seguinte tabela:
Pacientes em hemodiálise devem receber 100% da dose recomendada após cada hemodiálise; em dias sem diálise, os pacientes devem receber uma dose reduzida de acordo com sua depuração de creatinina.
Estes são ajustes de dose sugeridos com base na farmacocinética após a administração de doses múltiplas. Ajustes adicionais podem ser necessários dependendo da condição clínica.
Quando a creatinina sérica é a única medida de função renal disponível, a seguinte fórmula (com base no sexo, peso e idade do paciente) deve ser usada para estimar a depuração de creatinina em adultos:
Machos: Peso (kg) × (140 – idade)/ 72 × creatinina sérica (mg/100 mL)
Mulheres: 0,85 × acima do valor
Embora a farmacocinética do fluconazol não tenha sido estudada em crianças com insuficiência renal, a redução da dose em crianças com insuficiência renal deve ser paralela à recomendada para adultos. A seguinte fórmula pode ser usada para estimar a depuração de creatinina em crianças:
× comprimento ou altura linear (cm)/creatinina sérica (mg/100 mL)
(Onde K=0,55 para crianças maiores de 1 ano e 0,45 para bebês.)
Administração
DIFLUCAN 100mg é administrado por via oral. DIFLUCAN pode ser tomado com ou sem alimentos.
Instruções para misturar a suspensão oral
Prepare uma suspensão no momento da distribuição da seguinte forma: bata no frasco até que todo o pó flua livremente. Para reconstituir, adicione 24 mL de água destilada ou água purificada (USP) ao frasco de fluconazol e agite vigorosamente para suspender o pó. Cada frasco fornecerá 35 mL de suspensão. As concentrações das suspensões reconstituídas são as seguintes:
Nota: Agite bem a suspensão oral antes de usar. Armazene a suspensão reconstituída entre 86°F (30°C) e 41°F (5°C) e descarte a porção não utilizada após 2 semanas. Proteger do congelamento.
COMO FORNECIDO
DIFLUCAN 100mg comprimidos Comprimidos trapezoidais cor-de-rosa contendo 50, 100 ou 200 mg de fluconazol são embalados em frascos ou blisters de dose unitária. Os comprimidos de 150 mg de fluconazol são cor-de-rosa e ovais, acondicionados em blister unitário de dose única.
Os comprimidos DIFLUCAN são fornecidos da seguinte forma:
DIFLUCAN 50 mg Comprimidos : Gravado com “DIFLUCAN” e “50” na frente e “ROERIG” no verso.
NDC 0049-3410-30 Garrafas de 30
DIFLUCAN 100 mg Comprimidos : Gravado com “DIFLUCAN” e “100” na frente e “ROERIG” no verso.
NDC 0049-3420-30 Garrafas de 30 NDC 0049-3420-41 Pacote de dose unitária de 100
DIFLUCAN 150 mg Comprimidos : Gravado com “DIFLUCAN” e “150” na frente e “ROERIG” no verso.
NDC 0049-3500-79 Pacote de dose unitária de 1
DIFLUCAN 200 mg comprimidos : Gravado com “DIFLUCAN” e “200” na frente e “ROERIG” no verso.
NDC 0049-3430-30 Garrafas de 30 NDC 0049-3430-41 Pacote de dose unitária de 100
Armazenar
Armazene os comprimidos abaixo de 86°F (30°C).
DIFLUCAN 100mg para Suspensão Oral : DIFLUCAN para Suspensão Oral é fornecido como um pó com sabor a laranja para fornecer 35 mL por frasco da seguinte forma:
NDC 0049-3440-19 Fluconazol 350 mg por frasco NDC 0049-3450-19 Fluconazol 1400 mg por frasco
Armazenar
Armazene o pó seco abaixo de 86°F (30°C). Armazene a suspensão reconstituída entre 86°F (30°C) e 41°F (5°C) e descarte a porção não utilizada após 2 semanas. Proteger do congelamento.
Distribuído por: Roerig Division of Pfizer Inc., NY, NY 10017. Revisado: outubro de 2021
EFEITOS COLATERAIS
DIFLUCAN é geralmente bem tolerado.
Em alguns pacientes, particularmente aqueles com doenças subjacentes graves, como AIDS e câncer, foram observadas alterações nos resultados dos testes de função renal e hematológica e anormalidades hepáticas durante o tratamento com fluconazol e agentes comparativos, mas o significado clínico e a relação com o tratamento são incertos.
Em pacientes que recebem uma dose única para candidíase vaginal
Durante estudos clínicos comparativos realizados nos Estados Unidos, 448 pacientes com candidíase vaginal foram tratadas com DIFLUCAN, 150 mg de dose única. A incidência geral de efeitos colaterais possivelmente relacionados ao DIFLUCAN foi de 26%. Em 422 pacientes que receberam agentes comparativos ativos, a incidência foi de 16%. Os eventos adversos relacionados ao tratamento mais comuns relatados nas pacientes que receberam 150 mg de fluconazol em dose única para vaginite foram dor de cabeça (13%), náusea (7%) e dor abdominal (6%). Outros efeitos colaterais relatados com incidência igual ou superior a 1% incluíram diarreia (3%), dispepsia (1%), tontura (1%) e alteração do paladar (1%). A maioria dos efeitos colaterais relatados foi de gravidade leve a moderada. Raramente, angioedema e reação anafilática foram relatados na experiência de comercialização.
Em Pacientes Recebendo Múltiplas Doses Para Outras Infecções
Dezesseis por cento dos mais de 4.000 pacientes tratados com DIFLUCAN (fluconazol) em estudos clínicos de 7 dias ou mais apresentaram eventos adversos. O tratamento foi descontinuado em 1,5% dos pacientes devido a eventos clínicos adversos e em 1,3% dos pacientes devido a alterações laboratoriais.
Eventos adversos clínicos foram relatados com mais frequência em pacientes infectados pelo HIV (21%) do que em pacientes não infectados pelo HIV (13%); no entanto, os padrões em pacientes infectados pelo HIV e não infectados pelo HIV foram semelhantes. As proporções de pacientes que descontinuaram a terapia devido a eventos adversos clínicos foram semelhantes nos dois grupos (1,5%).
Os seguintes eventos adversos clínicos relacionados ao tratamento ocorreram com incidência de 1% ou mais em 4.048 pacientes recebendo DIFLUCAN 50mg por 7 ou mais dias em estudos clínicos: náusea 3,7%, cefaléia 1,9%, erupção cutânea 1,8%, vômito 1,7%, dor abdominal dor 1,7% e diarreia 1,5%.
Hepato-biliar
Em estudos clínicos combinados e experiência de marketing, houve casos raros de reações hepáticas graves durante o tratamento com DIFLUCAN. (Ver AVISOS .) O espectro dessas reações hepáticas variou de leves elevações transitórias nas transaminases a hepatite clínica, colestase e insuficiência hepática fulminante, incluindo fatalidades. Casos de reações hepáticas fatais foram observados principalmente em pacientes com condições médicas subjacentes graves (predominantemente AIDS ou malignidade) e muitas vezes durante o uso de vários medicamentos concomitantes. Reações hepáticas transitórias, incluindo hepatite e icterícia, ocorreram em pacientes sem outros fatores de risco identificáveis. Em cada um desses casos, a função hepática retornou aos valores basais com a descontinuação de DIFLUCAN.
Em dois estudos comparativos avaliando a eficácia de DIFLUCAN para a supressão da recidiva da meningite criptocócica, um aumento estatisticamente significativo foi observado nos níveis medianos de AST (SGOT) de um valor basal de 30 UI/L para 41 UI/L em um estudo e 34 UI/L a 66 UI/L no outro. A taxa global de elevações das transaminases séricas de mais de 8 vezes o limite superior do normal foi de aproximadamente 1% em pacientes tratados com fluconazol em estudos clínicos. Essas elevações ocorreram em pacientes com doença subjacente grave, predominantemente AIDS ou malignidades, a maioria dos quais estava recebendo vários medicamentos concomitantes, incluindo muitos conhecidos por serem hepatotóxicos. A incidência de transaminases séricas anormalmente elevadas foi maior em pacientes tomando DIFLUCAN concomitantemente com um ou mais dos seguintes medicamentos: rifampicina, fenitoína, isoniazida, ácido valpróico ou hipoglicemiantes orais de sulfonilureia.
Experiência pós-marketing
Além disso, os seguintes eventos adversos ocorreram durante a experiência pós-comercialização.
Imunológico: Em casos raros, foi relatada anafilaxia (incluindo angioedema, edema facial e prurido).
Corpo como um todo: Astenia, fadiga, febre, mal-estar.
Cardiovascular: Prolongamento do intervalo QT, torsade de pointes. (Ver PRECAUÇÕES .)
Sistema nervoso central: Convulsões, tonturas.
Hematopoiético e Linfático: Leucopenia, incluindo neutropenia e agranulocitose, trombocitopenia.
Metabólico: Hipercolesterolemia, hipertrigliceridemia, hipocalemia.
Gastrointestinal: Colestase, boca seca, dano hepatocelular, dispepsia, vômito.
Outros Sentidos: Perversão do gosto.
Sistema musculo-esquelético: mialgia.
Sistema nervoso: Insônia, parestesia, sonolência, tremor, vertigem.
Pele e anexos: Pustulose exantemática generalizada aguda, erupção medicamentosa incluindo erupção medicamentosa fixa, sudorese aumentada, distúrbios esfoliativos da pele, incluindo síndrome de Stevens-Johnson e necrólise epidérmica tóxica, reação medicamentosa com eosinofilia e sintomas sistêmicos (DRESS) (consulte AVISOS ), alopécia.
Reações Adversas em Crianças
padrão e a incidência de eventos adversos e anormalidades laboratoriais registrados durante os ensaios clínicos pediátricos são comparáveis aos observados em adultos.
Nos ensaios clínicos de Fase II/III realizados nos Estados Unidos e na Europa, 577 pacientes pediátricos, com idades entre 1 dia e 17 anos, foram tratados com DIFLUCAN em doses de até 15 mg/kg/dia por até 1.616 dias. Treze por cento das crianças experimentaram eventos adversos relacionados ao tratamento. Os eventos mais comumente relatados foram vômitos (5%), dor abdominal (3%), náusea (2%) e diarreia (2%). O tratamento foi descontinuado em 2,3% dos pacientes devido a eventos clínicos adversos e em 1,4% dos pacientes devido a alterações laboratoriais. A maioria das anormalidades laboratoriais relacionadas ao tratamento foram elevações de transaminases ou fosfatase alcalina.
Porcentagem de pacientes com efeitos colaterais relacionados ao tratamento
INTERAÇÕES MEDICAMENTOSAS
(Ver CONTRA-INDICAÇÕES .) O fluconazol é um inibidor moderado de CYP2C9 e CYP3A4. O fluconazol também é um forte inibidor do CYP2C19. Pacientes tratados com DIFLUCAN, que também são tratados concomitantemente com medicamentos com janela terapêutica estreita metabolizada por CYP2C9 e CYP3A4, devem ser monitorados quanto a reações adversas associadas aos medicamentos administrados concomitantemente. Além das interações observadas/documentadas mencionadas abaixo, existe o risco de aumento da concentração plasmática de outros compostos metabolizados por CYP2C9, CYP2C19 e CYP3A4 coadministrados com fluconazol. Portanto, deve-se ter cautela ao usar essas combinações e os pacientes devem ser cuidadosamente monitorados. O efeito inibidor enzimático do fluconazol persiste 4 a 5 dias após a descontinuação do tratamento com fluconazol devido à longa meia-vida do fluconazol. Interações medicamentosas clinicamente ou potencialmente significativas entre DIFLUCAN 200mg e os seguintes agentes/classes foram observadas e estão descritas em mais detalhes abaixo:
Alfentanil
Um estudo observou uma redução na depuração e no volume de distribuição, bem como prolongamento de t½ de alfentanil após tratamento concomitante com fluconazol. Um possível mecanismo de ação é a inibição do CYP3A4 pelo fluconazol. Pode ser necessário ajuste de dose de alfentanil.
Amiodarona
A administração concomitante de fluconazol com amiodarona pode aumentar o prolongamento do intervalo QT. Deve-se ter cautela se for necessário o uso concomitante de fluconazol e amiodarona, principalmente com altas doses de fluconazol (800 mg).
Amitriptilina, Nortriptilina
O fluconazol aumenta o efeito da amitriptilina e da nortriptilina. 5-Nortriptilina e/ou S-amitriptilina podem ser medidos no início da terapia combinada e após 1 semana. A dosagem de amitriptilina/nortriptilina deve ser ajustada, se necessário.
Anfotericina B
administração concomitante de fluconazol e anfotericina B em camundongos normais infectados e imunossuprimidos mostrou os seguintes resultados: pequeno efeito antifúngico aditivo na infecção sistêmica por Candida albicans, ausência de interação na infecção intracraniana por Cryptococcus neoformans e antagonismo das duas drogas na infecção sistêmica por A. . fumigatus. O significado clínico dos resultados obtidos nestes estudos é desconhecido.
Azitromicina
Um estudo aberto, randomizado e cruzado de três vias em 18 indivíduos saudáveis avaliou o efeito de uma dose oral única de 1200 mg de azitromicina na farmacocinética de uma dose oral única de 800 mg de fluconazol, bem como os efeitos do fluconazol na farmacocinética de azitromicina. Não houve interação farmacocinética significativa entre fluconazol e azitromicina.
Bloqueadores dos canais de cálcio
Certos antagonistas dos canais de cálcio (nifedipina, isradipina, amlodipina, verapamil e felodipina) são metabolizados pelo CYP3A4. O fluconazol tem o potencial de aumentar a exposição sistêmica dos antagonistas dos canais de cálcio. Recomenda-se o monitoramento frequente de eventos adversos.
Carbamazepina
O fluconazol inibe o metabolismo da carbamazepina e foi observado um aumento da carbamazepina sérica de 30%. Existe o risco de desenvolver toxicidade por carbamazepina. O ajuste da dose de carbamazepina pode ser necessário dependendo das medições/efeito da concentração.
Celecoxibe
Durante o tratamento concomitante com fluconazol (200 mg por dia) e celecoxib (200 mg), a Cmax e AUC do celecoxib aumentaram 68% e 134%, respetivamente. Metade da dose de celecoxibe pode ser necessária quando combinado com fluconazol.
Anticoagulantes do tipo cumarina
tempo de protrombina pode estar aumentado em pacientes recebendo concomitantemente DIFLUCAN 150mg e anticoagulantes do tipo cumarínico. Na experiência pós-comercialização, assim como com outros antifúngicos azólicos, eventos hemorrágicos (hematomas, epistaxe, sangramento gastrointestinal, hematúria e melena) foram relatados em associação com aumentos no tempo de protrombina em pacientes recebendo fluconazol concomitantemente com varfarina. Recomenda-se o monitoramento cuidadoso do tempo de protrombina em pacientes recebendo DIFLUCAN 50mg e anticoagulantes do tipo cumarínico. Pode ser necessário ajuste de dose de varfarina. (Ver FARMACOLOGIA CLÍNICA : Estudos de interação medicamentosa .)
Ciclofosfamida
A terapia combinada com ciclofosfamida e fluconazol resulta em aumento da bilirrubina sérica e da creatinina sérica. A combinação pode ser utilizada tendo em consideração o risco de aumento da bilirrubina sérica e da creatinina sérica.
Ciclosporina
DIFLUCAN 100mg aumenta significativamente os níveis de ciclosporina em pacientes transplantados renais com ou sem insuficiência renal. O monitoramento cuidadoso das concentrações de ciclosporina e creatinina sérica é recomendado em pacientes recebendo DIFLUCAN e ciclosporina. (Ver FARMACOLOGIA CLÍNICA : Estudos de interação medicamentosa .) Esta combinação pode ser usada reduzindo a dosagem de ciclosporina dependendo da concentração de ciclosporina.
Fentanil
Foi relatado um caso fatal de possível interação fentanil-fluconazol. O autor julgou que o paciente morreu de intoxicação por fentanil. Além disso, em um estudo cruzado randomizado com 12 voluntários saudáveis, foi demonstrado que o fluconazol retardou significativamente a eliminação do fentanil. Concentrações elevadas de fentanil podem levar à depressão respiratória.
Inibidores da HMG-CoA Redutase
risco de miopatia e rabdomiólise aumenta quando o fluconazol é coadministrado com inibidores da HMG-CoA redutase metabolizados pelo CYP3A4, como atorvastatina e sinvastatina, ou pelo CYP2C9, como fluvastatina. Se for necessária terapia concomitante, o paciente deve ser observado quanto a sintomas de miopatia e rabdomiólise e a creatinina quinase deve ser monitorada. Os inibidores da HMG-CoA redutase devem ser descontinuados se for observado um aumento acentuado da creatinina quinase ou se houver diagnóstico ou suspeita de miopatia/rabdomiólise.
Hidroclorotiazida
Em um estudo de interação farmacocinética, a coadministração de doses múltiplas de hidroclorotiazida a voluntários saudáveis recebendo fluconazol aumentou as concentrações plasmáticas de fluconazol em 40%. Um efeito desta magnitude não deve necessitar de uma mudança no regime posológico de fluconazol em indivíduos recebendo diuréticos concomitantemente.
Ibrutinibe
Inibidores moderados do CYP3A4, como o fluconazol, podem aumentar as concentrações plasmáticas de ibrutinibe e aumentar o risco de reações adversas associadas ao ibrutinibe. Se ibrutinib e fluconazol forem administrados concomitantemente, reduza a dose de ibrutinib conforme as instruções de prescrição de ibrutinib e o paciente deve ser monitorado frequentemente para quaisquer reações adversas associadas ao ibrutinib.
Lemboexante
A administração concomitante de fluconazol aumentou a Cmax e AUC do lemborexant em aproximadamente 1,6 e 4,2 vezes, respectivamente, o que se espera que aumente o risco de reações adversas, como sonolência. Evite o uso concomitante de DIFLUCAN com lemborexant.
Losartana
O fluconazol inibe o metabolismo do losartan no seu metabolito activo (E-31 74) que é responsável pela maior parte do antagonismo do receptor II da angiotensina que ocorre durante o tratamento com losartan. Os pacientes devem ter sua pressão arterial monitorada continuamente.
Metadona
fluconazol pode aumentar a concentração sérica de metadona. Pode ser necessário ajuste da dose de metadona.
Medicamentos anti-inflamatórios não esteroides
A Cmax e a AUC do flurbiprofeno aumentaram 23% e 81%, respectivamente, quando coadministrado com fluconazol em comparação com a administração de flurbiprofeno isolado. Da mesma forma, a Cmax e a AUC do isômero farmacologicamente ativo [S-(+)-ibuprofeno] aumentaram em 15% e 82%, respectivamente, quando o fluconazol foi coadministrado com ibuprofeno racêmico (400 mg) em comparação com a administração de ibuprofeno racêmico isoladamente.
Embora não estudado especificamente, o fluconazol tem o potencial de aumentar a exposição sistêmica de outros anti-inflamatórios não esteroides (AINEs) que são metabolizados pelo CYP2C9 (por exemplo, naproxeno, lornoxicam, meloxicam, diclofenaco). Recomenda-se o monitoramento frequente de eventos adversos e toxicidade relacionados aos AINEs. O ajuste da dosagem de AINEs pode ser necessário.
Olaparibe
Os inibidores moderados do CYP3A4, como o fluconazol, aumentam as concentrações plasmáticas de olaparibe; não é recomendado o uso concomitante. Se a combinação não puder ser evitada, reduza a dose de olaparibe conforme as instruções da bula de LYNPARZA® (Olaparibe).
Contraceptivos orais
Dois estudos farmacocinéticos com um contraceptivo oral combinado foram realizados usando doses múltiplas de fluconazol. Não houve efeitos relevantes no nível hormonal no estudo de 50 mg de fluconazol, enquanto que com 200 mg por dia, as AUCs de etinilestradiol e levonorgestrel aumentaram 40% e 24%, respectivamente. Assim, é improvável que o uso de doses múltiplas de fluconazol nessas doses tenha efeito sobre a eficácia do contraceptivo oral combinado.
Hipoglicemiantes orais
Hipoglicemia clinicamente significativa pode ser precipitada pelo uso de DIFLUCAN com agentes hipoglicemiantes orais; uma fatalidade foi relatada por hipoglicemia em associação com o uso combinado de DIFLUCAN 150mg e gliburida. DIFLUCAN reduz o metabolismo da tolbutamida, gliburida e glipizida e aumenta a concentração plasmática desses agentes. Quando DIFLUCAN 100mg é usado concomitantemente com estes ou outros agentes hipoglicemiantes orais de sulfonilureia, as concentrações de glicose no sangue devem ser cuidadosamente monitoradas e a dose de sulfonilureia deve ser ajustada conforme necessário. (Ver FARMACOLOGIA CLÍNICA : Estudos de interação medicamentosa .)
Fenitoína
DIFLUCAN aumenta as concentrações plasmáticas de fenitoína. Recomenda-se a monitorização cuidadosa das concentrações de fenitoína em doentes a receber DIFLUCAN 50 mg e fenitoína. (Ver FARMACOLOGIA CLÍNICA : Estudos de interação medicamentosa .)
Pimozida
Embora não tenha sido estudada in vitro ou in vivo, a administração concomitante de fluconazol com pimozida pode resultar na inibição do metabolismo da pimozida. Concentrações plasmáticas aumentadas de pimozida podem levar ao prolongamento do intervalo QT e ocorrências raras de torsade de pointes. A coadministração de fluconazol e pimozida é contraindicada.
Prednisona
Houve um relato de caso de que um paciente transplantado de fígado tratado com prednisona desenvolveu insuficiência aguda do córtex adrenal quando uma terapia de 3 meses com fluconazol foi descontinuada. A descontinuação do fluconazol provavelmente causou um aumento da atividade do CYP3A4 que levou ao aumento do metabolismo da prednisona. Pacientes em tratamento prolongado com fluconazol e prednisona devem ser cuidadosamente monitorados quanto à insuficiência do córtex adrenal quando o fluconazol é descontinuado.
Quinidina
Embora não tenha sido estudada in vitro ou in vivo, a administração concomitante de fluconazol com quinidina pode resultar na inibição do metabolismo da quinidina. O uso de quinidina tem sido associado ao prolongamento do intervalo QT e raras ocorrências de torsade de pointes. A coadministração de fluconazol e quinidina é contraindicada. (Ver CONTRA-INDICAÇÕES .)
Rifabutina
Houve relatos de que existe uma interação quando fluconazol é administrado concomitantemente com rifabutina, levando a níveis séricos de rifabutina aumentados em até 80%. Houve relatos de uveíte em pacientes aos quais fluconazol e rifabutina foram coadministrados. Pacientes recebendo rifabutina e fluconazol concomitantemente devem ser cuidadosamente monitorados. (Ver FARMACOLOGIA CLÍNICA : Estudos de interação medicamentosa .)
Rifampina
A rifampicina aumenta o metabolismo de DIFLUCAN administrado concomitantemente. Dependendo das circunstâncias clínicas, deve-se considerar o aumento da dose de DIFLUCAN 200 mg quando administrado com rifampicina. (Ver FARMACOLOGIA CLÍNICA : Estudos de interação medicamentosa .)
Saquinavir
fluconazol aumenta a AUC do saquinavir em aproximadamente 50%, a Cmax em aproximadamente 55% e diminui a depuração do saquinavir em aproximadamente 50% devido à inibição do metabolismo hepático do saquinavir pelo CYP3A4 e à inibição da glicoproteína-P. Pode ser necessário o ajuste da dose de saquinavir.
Benzodiazepínicos de ação curta
Após a administração oral de midazolam, o fluconazol resultou em aumentos substanciais nas concentrações de midazolam e nos efeitos psicomotores. Este efeito no midazolam parece ser mais pronunciado após a administração oral de fluconazol do que com fluconazol administrado por via intravenosa. Se os benzodiazepínicos de ação curta, que são metabolizados pelo sistema do citocromo P450, forem administrados concomitantemente com fluconazol, deve-se considerar a diminuição da dose de benzodiazepínicos e os pacientes devem ser monitorados adequadamente. (Ver FARMACOLOGIA CLÍNICA : Estudos de interação medicamentosa .)
Sirolimus
fluconazol aumenta as concentrações plasmáticas de sirolimus presumivelmente por inibir o metabolismo do sirolimus via CYP3A4 e P-glicoproteína. Esta combinação pode ser usada com um ajuste de dose de sirolímus dependendo das medidas de efeito/concentração.
Tacrolimus
O fluconazol pode aumentar as concentrações séricas do tacrolimo administrado por via oral em até 5 vezes devido à inibição do metabolismo do tacrolimo através do CYP3A4 nos intestinos. Não foram observadas alterações farmacocinéticas significativas quando o tacrolimo é administrado por via intravenosa. Níveis aumentados de tacrolimus têm sido associados à nefrotoxicidade. A dosagem de tacrolimus administrado por via oral deve ser diminuída dependendo da concentração de tacrolimus. (Ver FARMACOLOGIA CLÍNICA : Estudos de interação medicamentosa .)
Teofilina
DIFLUCAN 50mg aumenta as concentrações séricas de teofilina. Recomenda-se o monitoramento cuidadoso das concentrações séricas de teofilina em pacientes recebendo DIFLUCAN 100mg e teofilina. (Ver FARMACOLOGIA CLÍNICA : Estudos de interação medicamentosa .)
Tofacitinibe
exposição sistémica ao tofacitinib aumenta quando o tofacitinib é coadministrado com fluconazol. Reduzir a dose de tofacitinibe quando administrado concomitantemente com fluconazol (ou seja, de 5 mg duas vezes ao dia para 5 mg uma vez ao dia conforme instruído no rótulo de XELJANZ [tofacitinibe]). (Ver FARMACOLOGIA CLÍNICA : Estudos de interação medicamentosa .)
Tolvaptano
A exposição plasmática ao tolvaptano aumenta significativamente (200% na AUC; 80% na Cmax) quando o tolvaptano, um substrato do CYP3A4, é coadministrado com fluconazol, um inibidor moderado do CYP3A4. Esta interação pode resultar no risco de um aumento significativo de reações adversas associadas ao tolvaptano, particularmente diurese significativa, desidratação e insuficiência renal aguda. Se tolvaptano e fluconazol forem administrados concomitantemente, a dose de tolvaptano deve ser reduzida conforme instruído na bula do tolvaptano e o paciente deve ser monitorado frequentemente quanto a quaisquer reações adversas associadas ao tolvaptano.
Triazolam
fluconazol aumenta a AUC do triazolam (dose única) em aproximadamente 50%, a Cmax em 20% a 32% e aumenta a t½ em 25% a 50% devido à inibição do metabolismo do triazolam. Podem ser necessários ajustes de dose de triazolam.
Alcalóides da Vinca
Embora não estudado, o fluconazol pode aumentar os níveis plasmáticos dos alcalóides da vinca (por exemplo, vincristina e vinblastina) e levar a neurotoxicidade, possivelmente devido a um efeito inibitório no CYP3A4.
Vitamina A
Com base em um relato de caso em um paciente recebendo terapia combinada com ácido all-trans-retinoide (uma forma ácida da vitamina A) e fluconazol, efeitos indesejáveis relacionados ao sistema nervoso central (SNC) se desenvolveram na forma de pseudotumor cerebral, que desapareceu após descontinuação do tratamento com fluconazol. Esta combinação pode ser utilizada, mas deve-se ter em mente a incidência de efeitos indesejáveis relacionados ao SNC.
Voriconazol
Evitar a administração concomitante de voriconazol e fluconazol. Recomenda-se o monitoramento de eventos adversos e toxicidade relacionados ao voriconazol; especialmente, se o voriconazol for iniciado dentro de 24 h após a última dose de fluconazol. (Ver FARMACOLOGIA CLÍNICA : Estudos de interação medicamentosa .)
Zidovudina
O fluconazol aumenta a Cmax e a AUC da zidovudina em 84% e 74%, respectivamente, devido a uma diminuição de aproximadamente 45% na depuração oral da zidovudina. A meia-vida da zidovudina também foi prolongada em aproximadamente 128% após a terapia combinada com fluconazol. Os pacientes que recebem esta combinação devem ser monitorados quanto ao desenvolvimento de reações adversas relacionadas à zidovudina. A redução da dose de zidovudina pode ser considerada.

Os médicos devem estar cientes de que não foram realizados estudos de interação com medicamentos diferentes dos listados na seção FARMACOLOGIA CLÍNICA, mas tais interações podem ocorrer.
AVISOS
PRECAUÇÕES
Em geral
Alguns azólicos, incluindo fluconazol, foram associados ao prolongamento do intervalo QT no eletrocardiograma. O fluconazol causa prolongamento do intervalo QT através da inibição da corrente do Canal de Potássio Retificador (Ikr). O prolongamento do intervalo QT causado por outros medicamentos (como amiodarona) pode ser amplificado através da inibição do citocromo P450 (CYP) 3A4. (Ver PRECAUÇÕES : Interações medicamentosas .) Durante a vigilância pós-comercialização, houve casos raros de prolongamento do intervalo QT e torsade de pointes em pacientes tomando fluconazol. A maioria desses relatos envolveu pacientes gravemente enfermos com múltiplos fatores de risco de confusão, como doença cardíaca estrutural, anormalidades eletrolíticas e medicamentos concomitantes que podem ter contribuído. Pacientes com hipocalemia e insuficiência cardíaca avançada apresentam risco aumentado de ocorrência de arritmias ventriculares com risco de vida e torsade de pointes.
O fluconazol deve ser administrado com cautela a pacientes com essas condições potencialmente pró-arrítmicas.
uso concomitante de fluconazol e eritromicina tem o potencial de aumentar o risco de cardiotoxicidade (intervalo QT prolongado, torsade de pointes) e, consequentemente, morte súbita cardíaca. Esta combinação deve ser evitada.
Fluconazol deve ser administrado com cautela a pacientes com disfunção renal.
Insuficiência adrenal foi relatada em pacientes recebendo azóis, incluindo fluconazol. Casos reversíveis de insuficiência adrenal foram relatados em pacientes recebendo fluconazol.
DIFLUCAN 100mg Pó para Suspensão Oral contém sacarose e não deve ser usado em pacientes com deficiência hereditária de frutose, glicose/galactose e deficiência de sacarase-isomaltase.
Ao dirigir veículos ou operar máquinas, deve-se levar em consideração que ocasionalmente podem ocorrer tonturas ou convulsões.
Dose única
conveniência e eficácia do regime de comprimido oral de dose única de fluconazol para o tratamento de infecções vaginais por leveduras deve ser ponderada contra a aceitabilidade de uma maior incidência de eventos adversos relacionados a medicamentos com DIFLUCAN (26%) versus agentes intravaginais (16%) nos EUA estudos clínicos comparativos. (Ver REAÇÕES ADVERSAS e Estudos clínicos .)
Toxicologia não clínica
Carcinogênese, mutagênese e comprometimento da fertilidade
O fluconazol não mostrou evidência de potencial carcinogênico em camundongos e ratos tratados oralmente por 24 meses com doses de 2,5 mg/kg/dia, 5 mg/kg/dia ou 10 mg/kg/dia (aproximadamente 2 a 7 vezes a dose humana recomendada ). Ratos machos tratados com 5 mg/kg/dia e 10 mg/kg/dia tiveram uma incidência aumentada de adenomas hepatocelulares.
fluconazol, com ou sem ativação metabólica, foi negativo nos testes de mutagenicidade em quatro cepas de S. typhimurium e no sistema L5178Y de linfoma de camundongo. Estudos citogenéticos in vivo (células de medula óssea murina, após administração oral de fluconazol) e in vitro (linfócitos humanos expostos a fluconazol a 1000 mcg/mL) não mostraram evidência de mutações cromossômicas.
fluconazol não afetou a fertilidade de ratos machos ou fêmeas tratados por via oral com doses diárias de 5 mg/kg, 10 mg/kg ou 20 mg/kg ou com doses parenterais de 5 mg/kg, 25 mg/kg ou 75 mg /kg, embora o início do parto tenha sido ligeiramente retardado em 20 mg/kg PO. Em um estudo perinatal intravenoso em ratos com doses de 5 mg/kg, 20 mg/kg e 40 mg/kg, distocia e prolongamento do parto foram observados em algumas mães com 20 mg/kg (aproximadamente 5 a 15 vezes a dose humana recomendada ) e 40 mg/kg, mas não a 5 mg/kg. Os distúrbios no parto foram refletidos por um leve aumento no número de filhotes nascidos mortos e diminuição da sobrevida neonatal nesses níveis de dose. Os efeitos sobre o parto em ratos são consistentes com a propriedade específica da espécie de redução de estrogênio produzida por altas doses de fluconazol. Tal alteração hormonal não foi observada em mulheres tratadas com fluconazol. (Ver FARMACOLOGIA CLÍNICA .)
Gravidez
Efeitos teratogênicos
Potencial para dano fetal
uso na gravidez deve ser evitado, exceto em pacientes com infecções fúngicas graves ou potencialmente fatais, nas quais o fluconazol pode ser usado se o benefício esperado superar o possível risco para o feto. Alguns relatos de casos publicados descrevem um padrão de anomalias congênitas distintas em bebês expostos in utero a altas doses de fluconazol materno (400 a 800 mg/dia) durante a maior parte ou todo o primeiro trimestre. Essas anomalias relatadas são semelhantes às observadas em estudos com animais. Medidas contraceptivas eficazes devem ser consideradas em mulheres com potencial para engravidar que estão sendo tratadas com DIFLUCAN 400 a 800 mg/dia e devem continuar durante todo o período de tratamento e por aproximadamente 1 semana (5 a 6 meias-vidas) após a dose final. Se DIFLUCAN for usado durante a gravidez, ou se a paciente engravidar enquanto estiver tomando o medicamento, a paciente deve ser informada do risco potencial para o feto. Abortos espontâneos e anomalias congênitas foram sugeridos como riscos potenciais associados a 150 mg de fluconazol em dose única ou repetida no primeiro trimestre de gravidez com base em estudos epidemiológicos retrospectivos. Não existem estudos adequados e bem controlados de DIFLUCAN 150mg em mulheres grávidas. (Ver AVISOS : Potencial para dano fetal .)
Dados humanos
Relatos de casos descrevem um padrão distinto e raro de defeitos congênitos entre bebês cujas mães receberam altas doses (400 a 800 mg/dia) de fluconazol durante a maior parte ou todo o primeiro trimestre de gravidez. As características observadas nesses bebês incluem braquicefalia, fácies anormal, desenvolvimento anormal da calvária, fenda palatina, arqueamento femoral, costelas finas e ossos longos, artrogripose e cardiopatia congênita. Esses efeitos são semelhantes aos observados em estudos com animais.
Estudos epidemiológicos sugerem um risco potencial de aborto espontâneo e anomalias congênitas em bebês cujas mães foram tratadas com 150 mg de fluconazol em dose única ou repetida no primeiro trimestre, mas esses estudos epidemiológicos têm limitações e esses achados não foram confirmados em estudos clínicos controlados. ensaios.
Dados de animais
fluconazol foi administrado oralmente a coelhas grávidas durante a organogênese em dois estudos com doses de 5 mg/kg, 10 mg/kg e 20 mg/kg e 5 mg/kg, 25 mg/kg e 75 mg/kg, respectivamente. O ganho de peso materno foi prejudicado em todos os níveis de dose (aproximadamente 0,25 a 4 vezes a dose clínica de 400 mg com base na comparação da área de superfície corporal [BSA]), e os abortos ocorreram com 75 mg/kg (aproximadamente 4 vezes a dose clínica de 400 mg com base na BSA); não foram observados efeitos fetais adversos.
Em vários estudos em que ratas grávidas receberam fluconazol por via oral durante a organogênese, o ganho de peso materno foi prejudicado e o peso da placenta aumentou em 25 mg/kg. Não houve efeitos fetais com 5 mg/kg ou 10 mg/kg; aumentos nas variantes anatômicas fetais (costelas supranumerárias, dilatação da pelve renal) e atrasos na ossificação foram observados em 25 mg/kg e 50 mg/kg e doses mais altas. Em doses variando de 80 a 320 mg/kg (aproximadamente 2 a 8 vezes a dose clínica de 400 mg com base na BSA), a embrioletalidade em ratos foi aumentada e as anormalidades fetais incluíram costelas onduladas, fenda palatina e ossificação craniofacial anormal. Esses efeitos são consistentes com a inibição da síntese de estrogênio em ratos e podem ser resultado de efeitos conhecidos da redução do estrogênio na gravidez, organogênese e parto.
Mães que amamentam
fluconazol estava presente em níveis baixos no leite materno após a administração de uma dose única de 150 mg, com base em dados de um estudo em 10 mulheres lactantes que interromperam a amamentação temporária ou permanentemente 5 dias a 19 meses após o parto. A dose infantil diária estimada de fluconazol a partir do leite materno (assumindo consumo médio de leite de 150 mL/kg/dia) com base na concentração média de pico de leite (2,61 mcg/mL [intervalo: 1,57 a 3,65 mcg/mL] em 5,2 horas após dose) foi de 0,39 mg/kg/dia, que é aproximadamente 13% da dose pediátrica recomendada para candidíase orofaríngea. (A dose pediátrica rotulada é de 6 mg/kg/dia no primeiro dia, seguida de 3 mg/kg/dia; a dose infantil estimada é de 13% da dose de manutenção de 3 mg/kg/dia). Não há dados sobre os níveis de fluconazol no leite após uso repetido ou após altas doses de fluconazol. Uma pesquisa publicada de 96 mulheres lactantes que foram tratadas com fluconazol 150 mg em dias alternados (média de 7,3 cápsulas [intervalo de 1 a 29 cápsulas]) para candidíase mamária associada à lactação não relatou reações adversas graves em bebês. Deve-se ter cautela quando DIFLUCAN for administrado a uma lactante.
Uso Pediátrico
Um estudo aberto, randomizado e controlado mostrou que DIFLUCAN 100mg é eficaz no tratamento da candidíase orofaríngea em crianças de 6 meses a 13 anos de idade. (Ver Estudos clínicos .)
O uso de DIFLUCAN 200mg em crianças com meningite criptocócica, esofagite por Candida ou infecções sistêmicas por Candida é apoiado pela eficácia demonstrada para essas indicações em adultos e pelos resultados de vários pequenos estudos clínicos pediátricos não comparativos. Além disso, estudos farmacocinéticos em crianças (ver FARMACOLOGIA CLÍNICA ) estabeleceram uma proporcionalidade de dose entre crianças e adultos. (Ver DOSAGEM E ADMINISTRAÇÃO .)
Em um estudo não comparativo de crianças com infecções fúngicas sistêmicas graves, a maioria das quais candidemia, a eficácia de DIFLUCAN foi semelhante à relatada para o tratamento de candidemia em adultos. Dos 17 indivíduos com candidemia confirmada por cultura, 11 dos 14 (79%) com sintomas basais (3 eram assintomáticos) tiveram cura clínica; 13/15 (87%) dos pacientes avaliados tiveram uma cura micológica no final do tratamento, mas dois desses pacientes recidivaram em 10 e 18 dias, respectivamente, após a interrupção da terapia.
A eficácia de DIFLUCAN para a supressão da meningite criptocócica foi bem-sucedida em 4 de 5 crianças tratadas em um estudo de uso compassivo de fluconazol para o tratamento de micose grave ou com risco de vida. Não há informações sobre a eficácia do fluconazol no tratamento primário da meningite criptocócica em crianças.
perfil de segurança de DIFLUCAN 200mg em crianças foi estudado em 577 crianças de 1 dia a 17 anos que receberam doses variando de 1 a 15 mg/kg/dia por 1 a 1.616 dias. (Ver REAÇÕES ADVERSAS .)
A eficácia de DIFLUCAN não foi estabelecida em crianças com menos de 6 meses de idade. (Ver FARMACOLOGIA CLÍNICA .) Um pequeno número de pacientes (29) com idade variando de 1 dia a 6 meses foi tratado com segurança com DIFLUCAN.
Uso Geriátrico
Em pacientes sem AIDS, os efeitos colaterais possivelmente relacionados ao tratamento com fluconazol foram relatados em menos pacientes com 65 anos ou mais (9%, n = 339) do que em pacientes mais jovens (14%, n = 2240). No entanto, não houve diferença consistente entre os pacientes mais velhos e mais jovens em relação aos efeitos colaterais individuais. Dos efeitos colaterais mais frequentemente relatados (> 1%), erupções cutâneas, vômitos e diarreia ocorreram em maior proporção em pacientes mais velhos. Proporções semelhantes de pacientes mais velhos (2,4%) e pacientes mais jovens (1,5%) descontinuaram a terapia com fluconazol devido aos efeitos colaterais. Na experiência pós-comercialização, relatos espontâneos de anemia e insuficiência renal aguda foram mais frequentes em pacientes com 65 anos de idade ou mais do que naqueles entre 12 e 65 anos. Devido à natureza voluntária das notificações e ao aumento natural da incidência de anemia e insuficiência renal em idosos, não é possível estabelecer uma relação causal com a exposição ao medicamento.
Ensaios clínicos controlados de fluconazol não incluíram um número suficiente de pacientes com 65 anos ou mais para avaliar se eles respondem de forma diferente dos pacientes mais jovens em cada indicação. Outras experiências clínicas relatadas não identificaram diferenças nas respostas entre os pacientes idosos e os mais jovens.
O fluconazol é eliminado principalmente por excreção renal como fármaco inalterado. Como os pacientes idosos são mais propensos a ter função renal diminuída, deve-se ter cuidado para ajustar a dose com base na depuração de creatinina. Pode ser útil monitorar a função renal. (Ver FARMACOLOGIA CLÍNICA e DOSAGEM E ADMINISTRAÇÃO .)
SOBREDOSAGEM
Houve relatos de superdosagem com fluconazol acompanhada de alucinações e comportamento paranóico.
Em caso de sobredosagem, deve ser instituído tratamento sintomático (com medidas de suporte e lavagem gástrica, se clinicamente indicado).
O fluconazol é amplamente excretado na urina. Uma sessão de hemodiálise de 3 horas diminui os níveis plasmáticos em aproximadamente 50%.
Em camundongos e ratos que receberam doses muito altas de fluconazol, os efeitos clínicos em ambas as espécies incluíram diminuição da motilidade e respiração, ptose, lacrimejamento, salivação, incontinência urinária, perda do reflexo de endireitamento e cianose; a morte às vezes era precedida por convulsões clônicas.
CONTRA-INDICAÇÕES
DIFLUCAN (fluconazol) é contraindicado em pacientes que demonstraram hipersensibilidade ao fluconazol ou a qualquer um de seus excipientes. Não há informações sobre hipersensibilidade cruzada entre fluconazol e outros agentes antifúngicos azólicos. Deve-se ter cautela ao prescrever DIFLUCAN a pacientes com hipersensibilidade a outros azólicos. A coadministração de outros medicamentos conhecidos por prolongar o intervalo QT e que são metabolizados pela enzima CYP3A4, como eritromicina, pimozida e quinidina, é contraindicada em pacientes recebendo fluconazol. (Ver FARMACOLOGIA CLÍNICA : Estudos de interação medicamentosa e PRECAUÇÕES .)
FARMACOLOGIA CLÍNICA
Farmacocinética e Metabolismo
As propriedades farmacocinéticas do fluconazol são semelhantes após administração por via intravenosa ou oral. Em voluntários normais, a biodisponibilidade do fluconazol administrado por via oral é superior a 90% em comparação com a administração intravenosa. A bioequivalência foi estabelecida entre o comprimido de 100 mg e ambas as concentrações de suspensão quando administrados como uma dose única de 200 mg.
As concentrações plasmáticas máximas (Cmax) em voluntários normais em jejum ocorrem entre 1 e 2 horas com uma meia-vida de eliminação plasmática terminal de aproximadamente 30 horas (intervalo: 20 a 50 horas) após administração oral.
Em voluntários normais em jejum, a administração de uma dose oral única de 400 mg de DIFLUCAN (fluconazol) leva a uma Cmax média de 6,72 mcg/mL (intervalo: 4,12 a 8,08 mcg/mL) e após doses orais únicas de 50 a 400 mg, fluconazol as concentrações plasmáticas e a área sob a curva concentração plasmática-tempo (AUC) são proporcionais à dose.
Os dados de Cmax e AUC de um estudo de efeito alimentar envolvendo a administração de comprimidos de DIFLUCAN (fluconazol) a voluntários saudáveis em jejum e com uma refeição rica em gordura indicaram que a exposição ao medicamento não é afetada pelos alimentos. Portanto, DIFLUCAN pode ser tomado independentemente das refeições. (Ver DOSAGEM E ADMINISTRAÇÃO .)
As concentrações no estado de equilíbrio são alcançadas dentro de 5 a 10 dias após doses orais de 50 a 400 mg administradas uma vez ao dia. A administração de uma dose de ataque (no Dia 1) de duas vezes a dose diária usual resulta em concentrações plasmáticas próximas ao estado de equilíbrio no segundo dia. O volume aparente de distribuição do fluconazol aproxima-se da água corporal total. A ligação às proteínas plasmáticas é baixa (11 a 12%). Após doses orais únicas ou múltiplas por até 14 dias, o fluconazol penetra em todos os fluidos corporais estudados (ver tabela abaixo ). Em voluntários normais, as concentrações salivares de fluconazol foram iguais ou ligeiramente superiores às concentrações plasmáticas, independentemente da dose, via ou duração da dosagem. Em pacientes com bronquiectasia, as concentrações de fluconazol no escarro após uma dose oral única de 150 mg foram iguais às concentrações plasmáticas em 4 e 24 horas após a dose. Em pacientes com meningite fúngica, as concentrações de fluconazol no líquido cefalorraquidiano (LCR) são aproximadamente 80% das concentrações plasmáticas correspondentes.
Uma dose oral única de 150 mg de fluconazol administrada a 27 pacientes penetrou no tecido vaginal, resultando em relações tecido:plasma variando de 0,94 a 1,14 nas primeiras 48 horas após a dosagem.
Uma dose oral única de 150 mg de fluconazol administrada a 14 pacientes penetrou no fluido vaginal, resultando em razões fluido:plasma variando de 0,36 a 0,71 nas primeiras 72 horas após a dosagem.
Em voluntários normais, o fluconazol é eliminado principalmente por excreção renal, com aproximadamente 80% da dose administrada aparecendo na urina como droga inalterada. Cerca de 11% da dose é excretada na urina como metabólitos.
A farmacocinética do fluconazol é marcadamente afetada pela redução da função renal. Existe uma relação inversa entre a meia-vida de eliminação e a depuração da creatinina. A dose de DIFLUCAN pode precisar ser reduzida em pacientes com insuficiência renal. (Ver DOSAGEM E ADMINISTRAÇÃO .) Uma sessão de hemodiálise de 3 horas diminui as concentrações plasmáticas em aproximadamente 50%.
Em voluntários normais, a administração de DIFLUCAN (doses variando de 200 mg a 400 mg uma vez ao dia por até 14 dias) foi associada a efeitos pequenos e inconsistentes nas concentrações de testosterona, nas concentrações de corticosteroides endógenos e na resposta de cortisol estimulada pelo hormônio adrenocorticotrófico (ACTH).
Farmacocinética em crianças
Em crianças, os seguintes dados farmacocinéticos {Média (%cv)} foram relatados:
A depuração corrigida para o peso corporal não foi afetada pela idade nestes estudos. A depuração corporal média em adultos é de 0,23 (17%) mL/min/kg.
Em recém-nascidos prematuros (idade gestacional de 26 a 29 semanas), a depuração média (%cv) dentro de 36 horas após o nascimento foi de 0,180 (35%, N=7) mL/min/kg, que aumentou com o tempo para uma média de 0,218 ( 31%, N=9) mL/min/kg seis dias depois e 0,333 (56%, N=4) mL/min/kg 12 dias depois. Da mesma forma, a meia-vida foi de 73,6 horas, que diminuiu com o tempo para uma média de 53,2 horas seis dias depois e 46,6 horas 12 dias depois.
Farmacocinética em Idosos
Um estudo farmacocinético foi realizado em 22 indivíduos, com 65 anos de idade ou mais, recebendo uma dose oral única de 50 mg de fluconazol. Dez desses pacientes estavam recebendo diuréticos concomitantemente. A Cmax foi de 1,54 mcg/mL e ocorreu 1,3 horas após a dose. A AUC média foi de 76,4 ± 20,3 mcg•h/mL e a meia-vida terminal média foi de 46,2 horas. Estes valores dos parâmetros farmacocinéticos são superiores aos valores análogos reportados para voluntários jovens normais do sexo masculino. A coadministração de diuréticos não alterou significativamente a AUC ou Cmax. Além disso, a depuração de creatinina (74 mL/min), a porcentagem de droga recuperada inalterada na urina (0 a 24 horas, 22%) e as estimativas de depuração renal de fluconazol (0,124 mL/min/kg) para idosos foram geralmente menores do que os voluntários mais jovens. Assim, a alteração da disposição do fluconazol em idosos parece estar relacionada à redução da função renal característica desse grupo. Um gráfico da meia-vida de eliminação terminal de cada indivíduo versus depuração de creatinina em comparação com a meia-vida prevista - curva de depuração de creatinina derivada de indivíduos normais e indivíduos com graus variados de insuficiência renal indicou que 21 dos 22 indivíduos caíram dentro o limite de confiança de 95% das curvas de depuração de creatinina de meia-vida previstas. Estes resultados são consistentes com a hipótese de que valores mais elevados para os parâmetros farmacocinéticos observados em indivíduos idosos em comparação com voluntários jovens normais do sexo masculino são devidos à diminuição da função renal que é esperada em idosos.
Estudos de interação medicamentosa
(Ver INTERAÇÕES MEDICAMENTOSAS )
Contraceptivos orais
Os contraceptivos orais foram administrados em dose única antes e após a administração oral de DIFLUCAN 50 mg uma vez ao dia por 10 dias em 10 mulheres saudáveis. Não houve diferença significativa na AUC de etinilestradiol ou levonorgestrel após a administração de 50 mg de DIFLUCAN. O aumento médio na AUC do etinilestradiol foi de 6% (intervalo: -47 a 108%) e a AUC do levonorgestrel aumentou 17% (intervalo: -33 a 141%).
Em um segundo estudo, vinte e cinco mulheres normais receberam doses diárias de comprimidos de 200 mg de DIFLUCAN 150 mg ou placebo por dois períodos de dez dias. Os ciclos de tratamento tiveram um mês de intervalo com todos os indivíduos recebendo DIFLUCAN durante um ciclo e placebo durante o outro. A ordem do tratamento do estudo foi aleatória. Doses únicas de um comprimido contraceptivo oral contendo levonorgestrel e etinilestradiol foram administradas no último dia de tratamento (Dia 10) de ambos os ciclos. Após a administração de 200 mg de DIFLUCAN, o aumento percentual médio da AUC para levonorgestrel em comparação com placebo foi de 25% (intervalo: -12 a 82%) e o aumento percentual médio para etinilestradiol em comparação com placebo foi de 38% (intervalo: -11 a 101%). Ambos estes aumentos foram estatisticamente significativamente diferentes do placebo.
Um terceiro estudo avaliou a interação potencial da dosagem semanal de 300 mg de fluconazol em 21 mulheres normais tomando um contraceptivo oral contendo etinilestradiol e noretindrona. Neste estudo cruzado de duas vias, duplo-cego, controlado por placebo, randomizado, realizado ao longo de três ciclos de tratamento contraceptivo oral, a dosagem de fluconazol resultou em pequenos aumentos nas AUCs médias de etinilestradiol e noretindrona em comparação com a dosagem de placebo semelhante. As AUCs médias de etinilestradiol e noretindrona aumentaram 24% (intervalo de IC de 95%: 18 a 31%) e 13% (intervalo de IC de 95%: 8 a 18%), respectivamente, em relação ao placebo. O tratamento com fluconazol não causou uma diminuição na AUC de etinilestradiol de qualquer indivíduo neste estudo em comparação com a dosagem de placebo. Os valores individuais de AUC da noretindrona diminuíram muito ligeiramente (
Cimetidina
DIFLUCAN 100 mg foi administrado como uma dose oral única isolada e duas horas após uma dose única de cimetidina 400 mg a seis voluntários saudáveis do sexo masculino. Após a administração de cimetidina, houve uma diminuição significativa na AUC e Cmax do fluconazol. Houve uma diminuição média ± SD na AUC do fluconazol de 13% ± 11% (intervalo: -3,4 a -31%) e Cmax diminuiu 19% ± 14% (intervalo: -5 a -40 %). No entanto, a administração de cimetidina 600 mg a 900 mg por via intravenosa durante um período de quatro horas (de uma hora antes a 3 horas após uma dose oral única de DIFLUCAN 200 mg) não afetou a biodisponibilidade ou farmacocinética do fluconazol em 24 voluntários saudáveis do sexo masculino. .
Antiácido
A administração de Maalox® (20 mL) a 14 voluntários normais do sexo masculino imediatamente antes de uma dose única de DIFLUCAN 100 mg não teve efeito na absorção ou eliminação do fluconazol.
Hidroclorotiazida
administração oral concomitante de 100 mg de DIFLUCAN e 50 mg de hidroclorotiazida por 10 dias em 13 voluntários normais resultou em um aumento significativo na AUC e Cmax do fluconazol em comparação com o DIFLUCAN administrado isoladamente. Houve um aumento médio ± SD na AUC e Cmax do fluconazol de 45% ± 31% (intervalo: 19 a 114%) e 43% ± 31% (intervalo: 19 a 122%), respectivamente. Essas alterações são atribuídas a uma redução média ± DP na depuração renal de 30% ± 12% (intervalo: -10 a -50%).
Rifampina
administração de uma dose oral única de 200 mg de DIFLUCAN 200 mg após 15 dias de rifampicina administrada como 600 mg por dia em oito voluntários saudáveis do sexo masculino resultou em uma diminuição significativa na AUC do fluconazol e um aumento significativo na depuração oral aparente do fluconazol. Houve uma redução média ± SD na AUC do fluconazol de 23% ± 9% (intervalo: -13 a -42%). A depuração oral aparente do fluconazol aumentou 32% ± 17% (intervalo: 16 a 72%). A meia-vida do fluconazol diminuiu de 33,4 ± 4,4 horas para 26,8 ± 3,9 horas. (Ver PRECAUÇÕES .)
Varfarina
Houve um aumento significativo na resposta do tempo de protrombina (área sob a curva tempo-tempo de protrombina) após uma dose única de varfarina (15 mg) administrada a 13 voluntários normais do sexo masculino após DIFLUCAN 200 mg oral administrado diariamente por 14 dias em comparação com a administração apenas de varfarina. Houve um aumento médio ± DP na resposta do tempo de protrombina (área sob a curva tempo-tempo de protrombina) de 7% ± 4% (intervalo: -2 a 13%). (Ver PRECAUÇÕES .) A média é baseada em dados de 12 indivíduos, pois um dos 13 indivíduos experimentou um aumento de 2 vezes em sua resposta de tempo de protrombina.
Fenitoína
A AUC da fenitoína foi determinada após 4 dias de administração de fenitoína (200 mg por dia, por via oral durante 3 dias seguido de 250 mg por via intravenosa para uma dose) com e sem a administração de fluconazol (DIFLUCAN oral 200 mg por dia durante 16 dias) em 10 homens normais voluntários. Houve um aumento significativo na AUC da fenitoína. O aumento médio ± SD na AUC da fenitoína foi de 88% ± 68% (intervalo: 16 a 247%). A magnitude absoluta dessa interação é desconhecida devido à disposição intrinsecamente não linear da fenitoína. (Ver PRECAUÇÕES .)
Ciclosporina
AUC e a Cmax da ciclosporina foram determinadas antes e após a administração de fluconazol 200 mg diariamente por 14 dias em oito pacientes transplantados renais que estavam em terapia com ciclosporina por pelo menos 6 meses e em uma dose estável de ciclosporina por pelo menos 6 semanas. Houve um aumento significativo na AUC, Cmax, Cmin da ciclosporina (concentração de 24 horas) e uma redução significativa na depuração oral aparente após a administração de fluconazol. O aumento médio ± SD na AUC foi de 92% ± 43% (intervalo: 18 a 147%). A Cmax aumentou 60% ± 48% (intervalo: –5 a 133%). A C aumentou 157% ± 96% (intervalo: 33 a 360%). A depuração oral aparente diminuiu 45% ± 15% (intervalo: -15 a -60%). (Ver PRECAUÇÕES .)
Zidovudina
As concentrações plasmáticas de zidovudina foram determinadas em duas ocasiões (antes e após fluconazol 200 mg diariamente por 15 dias) em 13 voluntários com AIDS ou ARC que estavam em uma dose estável de zidovudina por pelo menos duas semanas. Houve um aumento significativo na AUC da zidovudina após a administração de fluconazol. O aumento médio ± SD na AUC foi de 20% ± 32% (intervalo: -27 a 104%). A razão metabólito, GZDV, para droga original diminuiu significativamente após a administração de fluconazol, de 7,6 ± 3,6 para 5,7 ± 2,2.
Teofilina
farmacocinética da teofilina foi determinada a partir de uma dose intravenosa única de aminofilina (6 mg/kg) antes e após a administração oral de fluconazol 200 mg diariamente por 14 dias em 16 voluntários normais do sexo masculino. Houve aumentos significativos na AUC, Cmax e meia-vida da teofilina com uma diminuição correspondente na depuração. A média ± SD AUC da teofilina aumentou 21% ± 16% (intervalo: -5 a 48%). A Cmax aumentou 13% ± 17% (intervalo: –13 a 40%). A depuração da teofilina diminuiu 16% ± 11% (intervalo: -32 a 5%). A meia-vida da teofilina aumentou de 6,6 ± 1,7 horas para 7,9 ± 1,5 horas. (Ver PRECAUÇÕES .)
Quinidina
Embora não tenha sido estudada in vitro ou in vivo, a administração concomitante de fluconazol com quinidina pode resultar na inibição do metabolismo da quinidina. O uso de quinidina tem sido associado ao prolongamento do intervalo QT e raras ocorrências de torsade de pointes. A coadministração de fluconazol e quinidina é contraindicada. (Ver CONTRA-INDICAÇÕES e PRECAUÇÕES .)
Hipoglicemiantes orais
Os efeitos do fluconazol na farmacocinética das sulfonilureias hipoglicemiantes orais tolbutamida, glipizida e gliburida foram avaliados em três estudos controlados por placebo em voluntários normais. Todos os indivíduos receberam a sulfonilureia isoladamente em dose única e novamente em dose única após a administração de DIFLUCAN 100 mg diariamente por 7 dias. Nestes três estudos, 22/46 (47,8%) dos pacientes tratados com DIFLUCAN e 9/22 (40,1%) dos pacientes tratados com placebo apresentaram sintomas consistentes com hipoglicemia. (Ver PRECAUÇÕES .)
Tolbutamida
Em 13 voluntários normais do sexo masculino, houve um aumento significativo na AUC e Cmax de tolbutamida (dose única de 500 mg) após a administração de fluconazol. Houve um aumento médio ± SD na AUC da tolbutamida de 26% ± 9% (intervalo: 12 a 39%). A Cmax da tolbutamida aumentou 11% ± 9% (intervalo: -6 a 27%). (Ver PRECAUÇÕES .)
Glipizida
AUC e a Cmax da glipizida (dose única de 2,5 mg) aumentaram significativamente após a administração de fluconazol em 13 voluntários normais do sexo masculino. Houve um aumento médio ± SD na AUC de 49% ± 13% (intervalo: 27 a 73%) e um aumento na Cmax de 19% ± 23% (intervalo: -11 a 79%). (Ver PRECAUÇÕES .)
Gliburida
A AUC e Cmax da gliburida (dose única de 5 mg) aumentaram significativamente após a administração de fluconazol em 20 voluntários normais do sexo masculino. Houve um aumento médio ± SD na AUC de 44% ± 29% (intervalo: -13 a 115%) e Cmax aumentou 19% ± 19% (intervalo: -23 a 62%). Cinco indivíduos necessitaram de glicose oral após a ingestão de gliburida após 7 dias de administração de fluconazol. (Ver PRECAUÇÕES .)
Rifabutina
Há relatos publicados de que existe uma interação quando o fluconazol é administrado concomitantemente com a rifabutina, levando a um aumento dos níveis séricos de rifabutina. (Ver PRECAUÇÕES .)
Tacrolimus
Há relatos publicados de que existe uma interação quando o fluconazol é administrado concomitantemente com tacrolimus, levando a níveis séricos aumentados de tacrolimus. (Ver PRECAUÇÕES .)
Midazolam
efeito do fluconazol na farmacocinética e farmacodinâmica do midazolam foi examinado em um estudo randomizado e cruzado em 12 voluntários. No estudo, os indivíduos ingeriram placebo ou 400 mg de fluconazol no Dia 1 seguido de 200 mg diariamente do Dia 2 ao Dia 6. Além disso, uma dose de 7,5 mg de midazolam foi ingerida por via oral no primeiro dia, 0,05 mg/kg foi administrado por via intravenosa no quarto dia e 7,5 mg por via oral no sexto dia. O fluconazol reduziu a depuração do midazolam IV em 51%. No primeiro dia de administração, o fluconazol aumentou a AUC e a C do midazolam em 259% e 150%, respectivamente. No sexto dia de administração, o fluconazol aumentou a AUC e a C do midazolam em 259% e 74%, respectivamente. Os efeitos psicomotores do midazolam aumentaram significativamente após a administração oral de midazolam, mas não foram significativamente afetados após o midazolam intravenoso.
Um segundo estudo randomizado, duplo simulado, controlado por placebo, cruzado em três fases foi realizado para determinar o efeito da via de administração de fluconazol na interação entre fluconazol e midazolam. Em cada fase os indivíduos receberam fluconazol oral 400 mg e solução salina intravenosa; placebo oral e fluconazol intravenoso 400 mg; e placebo oral e soro fisiológico IV. Uma dose oral de 7,5 mg de midazolam foi ingerida após fluconazol/placebo. A AUC e Cmax do midazolam foram significativamente maiores após a administração oral do que a administração IV de fluconazol. O fluconazol oral aumentou a AUC e Cmax do midazolam em 272% e 129%, respectivamente. O fluconazol IV aumentou a AUC e Cmax do midazolam em 244% e 79%, respectivamente. Tanto o fluconazol oral quanto o IV aumentaram os efeitos farmacodinâmicos do midazolam. (Ver PRECAUÇÕES .)
Azitromicina
Um estudo aberto, randomizado e cruzado de três vias em 18 indivíduos saudáveis avaliou o efeito de uma dose oral única de 800 mg de fluconazol na farmacocinética de uma dose oral única de 1.200 mg de azitromicina, bem como os efeitos da azitromicina na farmacocinética de fluconazol. Não houve interação farmacocinética significativa entre fluconazol e azitromicina.
Voriconazol
voriconazol é um substrato para as isoenzimas CYP2C9 e CYP3A4. A administração concomitante de Voriconazol oral (400 mg Q12h por 1 dia, depois 200 mg Q12h por 2,5 dias) e fluconazol oral (400 mg no Dia 1, depois 200 mg Q24h por 4 dias) a 6 indivíduos saudáveis do sexo masculino resultou em um aumento na Cmax e AUCτ de voriconazol em uma média de 57% (IC 90%: 20% a 107%) e 79% (IC 90%: 40% a 128%), respectivamente. Em um estudo clínico de acompanhamento envolvendo 8 indivíduos saudáveis do sexo masculino, a redução da dosagem e/ou frequência de voriconazol e fluconazol não eliminou ou diminuiu este efeito. A administração concomitante de voriconazol e fluconazol em qualquer dose não é recomendada. O monitoramento cuidadoso de eventos adversos relacionados ao voriconazol é recomendado se o voriconazol for usado sequencialmente após o fluconazol, especialmente dentro de 24 horas após a última dose de fluconazol. (Ver PRECAUÇÕES .)
Tofacitinibe
coadministração de fluconazol (400 mg no Dia 1 e 200 mg uma vez por dia durante 6 dias [Dias 2-7]) e tofacitinib (dose única de 30 mg no Dia 5) em indivíduos saudáveis resultou em valores médios de AUC e Cmax de tofacitinib aumentados de aproximadamente 79% (IC 90%: 64% a 96%) e 27% (IC 90%: 12% a 44%), respectivamente, em comparação com a administração de tofacitinibe sozinho. (Ver PRECAUÇÕES .)
Microbiologia
Mecanismo de ação
O fluconazol é um inibidor altamente seletivo da enzima lanosterol 14-α-desmetilase dependente do citocromo P450 fúngico. Esta enzima funciona para converter lanosterol em ergosterol. A subsequente perda de esteróis normais correlaciona-se com o acúmulo de 14-α-metil esteróis em fungos e pode ser responsável pela atividade fungistática do fluconazol. A desmetilação de células de mamíferos é muito menos sensível à inibição do fluconazol.
Resistência
Um potencial para o desenvolvimento de resistência ao fluconazol é bem conhecido. Isolados de fungos que apresentam suscetibilidade reduzida a outros azóis também podem apresentar suscetibilidade reduzida ao fluconazol. A frequência de desenvolvimento de resistência a drogas para os vários fungos para os quais esta droga é indicada não é conhecida.
A resistência ao fluconazol pode surgir de uma modificação na qualidade ou quantidade da enzima alvo (lanosterol 14-α-desmetilase), acesso reduzido ao alvo da droga ou alguma combinação desses mecanismos.
Mutações pontuais no gene (ERG11) que codifica para a enzima alvo levam a um alvo alterado com afinidade diminuída para azóis. A superexpressão de ERG11 resulta na produção de altas concentrações da enzima alvo, criando a necessidade de maiores concentrações intracelulares de drogas para inibir todas as moléculas da enzima na célula.
segundo principal mecanismo de resistência às drogas envolve o efluxo ativo de fluconazol para fora da célula através da ativação de dois tipos de transportadores de efluxo multidrogas; os principais facilitadores (codificados por genes MDR) e os da superfamília de cassetes de ligação a ATP (codificados por genes CDR). A regulação positiva do gene MDR leva à resistência ao fluconazol, enquanto a regulação positiva dos genes CDR pode levar à resistência a múltiplos azóis.
A resistência em Candida glabrata geralmente inclui upregulation de genes CDR resultando em resistência a múltiplos azóis. Para um isolado onde a concentração inibitória mínima (CIM) é categorizada como Intermediário (16 a 32 mcg/mL), a dose mais alta de fluconazol é recomendada.
Candida krusei deve ser considerada resistente ao fluconazol. A resistência em C. krusei parece ser mediada pela sensibilidade reduzida da enzima alvo à inibição pelo agente.
Houve relatos de casos de superinfecção com espécies de Candida que não C. albicans, que muitas vezes são inerentemente não suscetíveis ao DIFLUCAN (por exemplo, Candida krusei). Esses casos podem exigir terapia antifúngica alternativa.
Actividade antimicrobiana
O fluconazol demonstrou ser ativo contra a maioria dos isolados dos seguintes microrganismos tanto in vitro como em infecções clínicas.
Candida albicans Candida glabrata (Muitos isolados são intermediários) Candida parapsilosis Candida tropicalis Cryptococcus neoformans
Os seguintes dados in vitro estão disponíveis, mas seu significado clínico é desconhecido. Pelo menos 90% dos seguintes fungos exibem uma CIM in vitro menor ou igual ao ponto de ruptura suscetível para fluconazol (https://www.fda.gov/STIC) contra isolados de gênero ou grupo de organismos semelhantes. No entanto, a eficácia do fluconazol no tratamento de infecções clínicas causadas por esses fungos não foi estabelecida em ensaios clínicos adequados e bem controlados.
Candida dubliniensis Candida guilliermondii Candida kefyr Candida lusitaniae
Candida krusei deve ser considerada resistente ao fluconazol. A resistência em C. krusei parece ser mediada pela sensibilidade reduzida da enzima alvo à inibição pelo agente.
Houve relatos de casos de superinfecção com espécies de Candida que não C. albicans, que muitas vezes são inerentemente não suscetíveis ao DIFLUCAN (por exemplo, Candida krusei). Esses casos podem exigir terapia antifúngica alternativa.
Teste de suscetibilidade
Para obter informações específicas sobre os critérios interpretativos do teste de suscetibilidade e métodos de teste associados e padrões de controle de qualidade reconhecidos pela FDA para este medicamento, consulte: https://www.fda.gov/STIC.
Estudos clínicos
Meningite Criptocócica
Em um estudo multicêntrico comparando DIFLUCAN (200 mg/dia) à anfotericina B (0,3 mg/kg/dia) para tratamento de meningite criptocócica em pacientes com AIDS, uma análise multivariada revelou três fatores pré-tratamento que previam morte durante o curso da terapia: estado mental, título de antígeno criptocócico no líquido cefalorraquidiano maior que 1:1024 e contagem de leucócitos no líquido cefalorraquidiano menor que 20 células/mm³. A mortalidade entre os pacientes de alto risco foi de 33% e 40% para pacientes com anfotericina B e DIFLUCAN, respectivamente (p = 0,58), com mortes gerais de 14% (9 de 63 indivíduos) e 18% (24 de 131 indivíduos) para os 2 braços de o estudo (p=0,48). Doses e regimes ideais para pacientes com meningite criptocócica aguda e com alto risco de falha do tratamento ainda precisam ser determinados. (Saag, et al. N Engl J Med 1992; 326:83-9.)
Candidíase Vaginal
Dois estudos adequados e bem controlados foram conduzidos nos EUA usando o comprimido de 150 mg. Em ambos, os resultados do regime de fluconazol foram comparáveis aos do regime de controle (clotrimazol ou miconazol por via intravaginal por 7 dias) tanto clínica quanto estatisticamente na avaliação de um mês pós-tratamento.
A taxa de cura terapêutica, definida como a resolução completa dos sinais e sintomas de candidíase vaginal (cura clínica), juntamente com exame KOH negativo e cultura negativa para Candida (erradicação microbiológica), foi de 55% tanto no grupo fluconazol quanto nos produtos vaginais grupo.
Aproximadamente três quartos dos pacientes inscritos tiveram vaginite aguda (
Substancialmente mais eventos gastrointestinais foram relatados no grupo do fluconazol em comparação com o grupo do produto vaginal. A maioria dos eventos foram leves a moderados. Como o fluconazol foi administrado em dose única, não ocorreram descontinuações.
Estudos Pediátricos
Candidíase orofaríngea
Foi realizado um estudo aberto comparativo da eficácia e segurança de DIFLUCAN (2 a 3 mg/kg/dia) e nistatina oral (400.000 UI 4 vezes ao dia) em crianças imunocomprometidas com candidíase orofaríngea. As taxas de resposta clínica e micológica foram maiores nas crianças tratadas com fluconazol.
A cura clínica ao final do tratamento foi relatada para 86% dos pacientes tratados com fluconazol em comparação com 46% dos pacientes tratados com nistatina. Do ponto de vista micológico, 76% dos pacientes tratados com fluconazol tiveram o organismo infectante erradicado em comparação com 11% dos pacientes tratados com nistatina.
A proporção de pacientes com recidiva clínica 2 semanas após o término do tratamento foi de 14% para indivíduos recebendo DIFLUCAN e 16% para indivíduos recebendo nistatina. Quatro semanas após o término do tratamento, as porcentagens de pacientes com recidiva clínica foram de 22% para DIFLUCAN 150mg e 23% para nistatina.
INFORMAÇÃO DO PACIENTE
DIFLUCAN® (corante-FLEW-kan) (fluconazol) Comprimidos
Este folheto contém informações importantes sobre DIFLUCAN. Não se destina a substituir as instruções do seu médico. Leia atentamente esta informação antes de tomar DIFLUCAN. Pergunte ao seu médico se você não entender alguma dessas informações ou se quiser saber mais sobre o DIFLUCAN.
O que é DIFLUCAN 100mg?
DIFLUCAN é um medicamento de prescrição usado para tratar infecções fúngicas vaginais causadas por uma levedura chamada Candida. DIFLUCAN 150mg ajuda a impedir que muito fermento cresça na vagina para que a infecção por fungos desapareça.
DIFLUCAN 150mg é diferente de outros tratamentos para infecções fúngicas vaginais porque é um comprimido tomado por via oral. DIFLUCAN também é usado para outras condições. No entanto, este folheto é apenas sobre o uso de DIFLUCAN 50mg para infecções fúngicas vaginais. Para obter informações sobre o uso de DIFLUCAN 200mg por outros motivos, pergunte ao seu médico. Consulte a seção deste folheto para obter informações sobre infecções fúngicas vaginais.
que é uma infecção vaginal por fungos?
É normal que uma certa quantidade de levedura seja encontrada na vagina. Às vezes, muito fermento começa a crescer na vagina e isso pode causar uma infecção por fungos. Infecções fúngicas vaginais são comuns. Cerca de três em cada quatro mulheres adultas terão pelo menos uma infecção vaginal por fungos durante a vida.
Alguns medicamentos e condições médicas podem aumentar sua chance de contrair uma infecção por fungos. Se você está grávida, tem diabetes, usa pílulas anticoncepcionais ou toma antibióticos, pode ter infecções fúngicas com mais frequência do que outras mulheres. A higiene pessoal e certos tipos de roupas podem aumentar suas chances de contrair uma infecção por fungos. Peça ao seu médico dicas sobre o que você pode fazer para ajudar a prevenir infecções fúngicas vaginais. Se você tiver uma infecção vaginal por fungos, você pode ter algum dos seguintes sintomas:
- coceira
- uma sensação de queimação ao urinar
- vermelhidão
- dor
- um corrimento vaginal branco espesso que se parece com queijo cottage
Não tome DIFLUCAN se você.
- tome os seguintes medicamentos:
- quinidina
- eritromicina
- pimozida
- são alérgicos ao fluconazol, o ingrediente ativo do DIFLUCAN 50mg, ou a qualquer um dos ingredientes do DIFLUCAN. Consulte o final deste folheto informativo para o paciente para obter uma lista completa dos ingredientes do DIFLUCAN.
Antes de tomar DIFLUCAN, informe o seu médico sobre todas as suas condições médicas, se você:
- tem problemas de fígado
- tem problemas renais
- tem problemas cardíacos, incluindo arritmias cardíacas
- tem hipocalemia (baixo teor de potássio)
- estão grávidas ou planejam engravidar. Informe o seu médico imediatamente se engravidar enquanto estiver a tomar DIFLUCAN. Você e seu médico decidirão se DIFLUCAN 100mg é adequado para você. Se você pode engravidar, você deve usar um método contraceptivo (contraceptivo) enquanto estiver tomando DIFLUCAN e por 1 semana após sua dose final.
- está amamentando ou planeja amamentar. DIFLUCAN pode passar para o leite materno. Converse com seu médico sobre a melhor maneira de alimentar seu bebê enquanto estiver tomando DIFLUCAN.
Antes de começar a tomar DIFLUCAN, informe o seu médico sobre todos os medicamentos que toma, incluindo medicamentos prescritos e de venda livre, vitaminas e suplementos de ervas. Informe especialmente o seu médico se você tomar:
- medicamentos para diabetes, como gliburida, tolbutamida, glipizida
- medicamentos para a pressão arterial como hidroclorotiazida, losartan, amlodipina, verapamil nifedipina ou felodipina
- diluentes de sangue, como varfarina
- ciclosporina, tacrolimus ou sirolimus (usados para prevenir a rejeição de transplantes de órgãos)
- rifampicina ou rifabutina para tuberculose
- fenitoína ou carbamazepina para controlar convulsões
- teofilina para controlar a asma
- quinidina (usada para corrigir distúrbios no ritmo cardíaco)
- amiodarona (usada para tratar batimentos cardíacos irregulares 'arritmias')
- amitriptilina ou nortriptilina para depressão
- pimozida para doença psiquiátrica
- anfotericina B ou voriconazol para infecções fúngicas
- eritromicina para infecções bacterianas
- olaparibe, ciclofosfamida ou alcalóides da vinca, como vincristina ou vinblastina, para tratamento de câncer
- fentanil, alfentanil ou metadona para dor crônica
- ibrutinib usado para tratar câncer de sangue
- lemborexant, usado para o tratamento da insônia
- medicamentos hipolipemiantes, como atorvastatina, sinvastatina e fluvastatina
- anti-inflamatórios não esteróides, incluindo celecoxib, ibuprofeno e naproxeno
- prednisona, um esteróide usado para tratar distúrbios da pele, gastrointestinais, hematológicos ou respiratórios
- medicamentos antivirais usados para tratar o HIV como saquinavir ou zidovudina
- tofacitinibe para artrite reumatoide
- suplemento nutricional vitamina A
- tolvaptano usado para tratar hiponatremia (baixos níveis de sódio no sangue) ou para retardar o declínio da função renal
Como existem muitos nomes de marca para esses medicamentos, verifique com seu médico ou farmacêutico se tiver alguma dúvida.
Como devo tomar DIFLUCAN?
- Tome DIFLUCAN exatamente como seu médico lhe disser.
- Tome DIFLUCAN 100mg por via oral com ou sem alimentos.
- Se você tomar muito DIFLUCAN 50mg, ligue para o seu médico ou dirija-se imediatamente ao pronto-socorro mais próximo.
O que devo evitar ao tomar DIFLUCAN 150mg?
DIFLUCAN pode causar tonturas e convulsões. Não conduza ou opere máquinas até saber como DIFLUCAN o afeta.
Quais são os possíveis efeitos colaterais do DIFLUCAN 150mg?
DIFLUCAN 50mg pode causar efeitos colaterais graves, incluindo:
- problemas hepáticos graves. Algumas pessoas com problemas médicos graves desenvolveram problemas hepáticos graves que se tornaram fatais ou causaram a morte enquanto tomavam DIFLUCAN. Às vezes, esses problemas hepáticos podem ser revertidos quando você para de tomar DIFLUCAN. Informe o seu médico imediatamente se tiver sintomas de problemas graves no fígado, incluindo:
- urina de cor escura
- coceira intensa na pele
- amarelecimento da pele e dos olhos (icterícia)
- fezes de cor clara
- cansaço
- vômito
- perda de apetite
- reações alérgicas graves: Em casos raros, ocorreram reações alérgicas graves (anafilaxia) durante o tratamento com DIFLUCAN. Pare de tomar DIFLUCAN 50mg, ligue para o seu médico ou dirija-se ao pronto-socorro do hospital mais próximo imediatamente se tiver quaisquer sinais ou sintomas de uma reação alérgica, incluindo:
- falta de ar
- febre
- inchaço das pálpebras
- tossir
- erupção cutânea, urticária, bolhas ou descamação da pele
- rosto, boca, pescoço ou qualquer outra parte do corpo
- chiado
- latejando do coração ou ouvidos
- arrepios
- sérios problemas de pele. Algumas pessoas com problemas médicos graves desenvolveram problemas de pele graves que causaram a morte enquanto tomavam DIFLUCAN. Informe o seu médico imediatamente se desenvolver uma erupção cutânea enquanto estiver a tomar DIFLUCAN.
Os efeitos colaterais mais comuns de DIFLUCAN 200mg incluem:
- dor de cabeça
- tontura
- diarréia
- dor de estômago
- náusea ou dor de estômago
- mudanças no sabor dos alimentos
Outros efeitos colaterais incluem:
- insuficiência adrenal: Algumas pessoas que tomaram DIFLUCAN desenvolveram insuficiência adrenal reversível. Informe o seu médico imediatamente se tiver sintomas de insuficiência adrenal, incluindo:
- fadiga de longa duração
- fraqueza muscular
- perda de apetite
- perda de peso
- dor de estômago
- tontura
- náusea
- vômito
- tonturas ou convulsões.
Estes não são todos os possíveis efeitos colaterais do DIFLUCAN.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
Como devo armazenar o DIFLUCAN?
Armazene os comprimidos de DIFLUCAN abaixo de 30°C (86°F).
Mantenha DIFLUCAN 50mg e todos os medicamentos fora do alcance das crianças.
Informações gerais sobre o uso seguro e eficaz de DIFLUCAN.
Os medicamentos às vezes são prescritos para outros fins que não os listados em um folheto de informações ao paciente. Não use DIFLUCAN 50mg para uma condição para a qual não foi prescrito. Não dê DIFLUCAN a outras pessoas, mesmo que tenham os mesmos sintomas que você. Pode prejudicá-los. Você pode pedir ao seu médico informações sobre DIFLUCAN 200mg que foi escrito para profissionais de saúde.
Quais são os ingredientes de DIFLUCAN 150mg?
Ingrediente ativo: fluconazol
Ingredientes inativos: celulose microcristalina, fosfato dibásico de cálcio anidro, povidona, croscarmelose sódica, corante laca de alumínio FD&C Red No. 40 e estearato de magnésio.
Esta informação do paciente foi aprovada pela Food and Drug Administration dos EUA
