Provera 5mg, 10mg Medroxyprogesterone Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Provera e como é usado?
Provera 10mg é um medicamento de prescrição usado para tratar os sintomas de sangramento menstrual intenso, sangramento menstrual ausente ou irregular e como contracepção. Provera 10mg pode ser usado sozinho ou com outros medicamentos.
Provera 5mg pertence a uma classe de medicamentos chamados Antineoplásicos, Hormônios, Progestinas.
Não se sabe se Provera é seguro e eficaz em crianças.
Quais são os possíveis efeitos colaterais do Provera 10mg?
Provera 5mg pode causar efeitos colaterais graves, incluindo:
- sangramento vaginal (se você já passou pela menopausa),
- tontura,
- nódulo na mama,
- depressão,
- problemas de sono (insônia),
- tontura,
- mudanca de humor,
- dor de cabeça,
- febre,
- amarelecimento da pele ou dos olhos (icterícia),
- inchaço nas mãos, tornozelos ou pés,
- dor ou pressão no peito,
- dor se espalhando para sua mandíbula ou ombro,
- náusea,
- sudorese,
- dormência ou fraqueza repentina,
- dor de cabeça súbita e intensa,
- fala arrastada,
- problemas de visão,
- problemas com o seu equilíbrio,
- tosse repentina,
- chiado,
- respiração rápida,
- tossindo sangue, e
- dor na perna (ou ambas) com inchaço, calor e vermelhidão
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns de Provera 10mg incluem:
- spotting ou sangramento de escape,
- alterações nos seus períodos menstruais,
- coceira ou corrimento vaginal,
- sensibilidade ou corrimento mamário,
- dor de cabeça,
- tontura,
- sentir-se nervoso ou deprimido,
- hematomas ou inchaço de suas veias,
- inchaço,
- Retenção de fluidos,
- mudanca de humor,
- problemas de sono (insônia),
- coceira,
- irritação na pele,
- acne,
- Crescimento capilar,
- perda de cabelo no couro cabeludo,
- desconforto estomacal,
- inchaço,
- náusea,
- ganho de peso e
- alterações na visão ou dificuldade em usar lentes de contato
AVISO
DISTÚRBIOS CARDIOVASCULARES, CÂNCER DE MAMA E PROVÁVEL DEMÊNCIA PARA TERAPIA COM ESTROGÊNIO MAIS PROGESTINA
Distúrbios Cardiovasculares e Provável Demência
A terapia com estrogênio mais progestina não deve ser usada para a prevenção de doenças cardiovasculares ou demência. (Ver Estudos clínicos e AVISOS , Distúrbios Cardiovasculares e Provável Demência .)
subestudo da Iniciativa de Saúde da Mulher (WHI) estrogênio mais progestina relatou um risco aumentado de trombose venosa profunda (TVP), embolia pulmonar (EP), acidente vascular cerebral e infarto do miocárdio (IM) em mulheres na pós-menopausa (50 a 79 anos de idade ) durante 5,6 anos de tratamento com estrogênios conjugados orais (CE) diários [0,625 mg] combinados com acetato de medroxiprogesterona (MPA) [2,5 mg], em relação ao placebo. (Ver Estudos clínicos e AVISOS , Distúrbios Cardiovasculares .)
O estudo auxiliar WHI Memory Study (WHIMS) de estrogênio mais progestina relatou um risco aumentado de desenvolver provável demência em mulheres na pós-menopausa com 65 anos de idade ou mais durante 4 anos de tratamento com CE diário (0,625 mg) combinado com MPA (2,5 mg), relativo ao placebo. Não se sabe se este achado se aplica a mulheres pós-menopáusicas mais jovens. (Ver Estudos clínicos e AVISOS , Provável Demência e PRECAUÇÕES , Uso Geriátrico .)
Câncer de mama
O subestudo WHI de estrogênio mais progestina demonstrou um risco aumentado de câncer de mama invasivo. (Ver Estudos clínicos e AVISOS , Neoplasia maligna , Câncer de mama .)
Na ausência de dados comparáveis, esses riscos devem ser considerados semelhantes para outras doses de CE e MPA, e outras combinações e formas de dosagem de estrogênios e progestágenos.
As progestinas com estrogênios devem ser prescritas nas doses efetivas mais baixas e pela menor duração consistente com os objetivos e riscos do tratamento para cada mulher.
DESCRIÇÃO
Os comprimidos de PROVERA® contêm acetato de medroxiprogesterona, que é um derivado da progesterona. É um pó cristalino branco a esbranquiçado, inodoro, estável ao ar, derretendo entre 200 e 210°C. É livremente solúvel em clorofórmio, solúvel em acetona e em dioxano, pouco solúvel em álcool e metanol, ligeiramente solúvel em éter e insolúvel em água.
O nome químico do acetato de medroxiprogesterona é pregn-4-eno-3, 20-diona, 17-(acetiloxi)-6-metil-, (6α)-. A fórmula estrutural é:
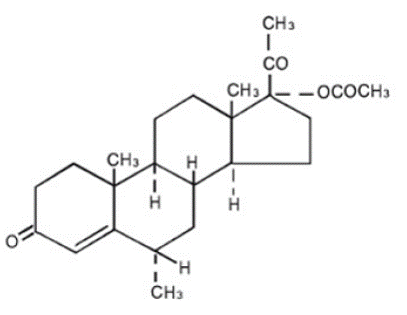
Cada comprimido de PROVERA 5 mg para administração oral contém 2,5 mg, 5 mg ou 10 mg de acetato de medroxiprogesterona e os seguintes ingredientes inativos: estearato de cálcio, amido de milho, lactose, óleo mineral, ácido sórbico, sacarose e talco. O comprimido de 2,5 mg contém FD&C Amarelo Nº 6.
INDICAÇÕES
Os comprimidos de PROVERA 5mg são indicados para o tratamento de amenorreia secundária e sangramento uterino anormal devido a desequilíbrio hormonal na ausência de patologia orgânica, como miomas ou câncer uterino. Eles também são indicados para uso na prevenção da hiperplasia endometrial em mulheres pós-menopáusicas não histerectomizadas que estejam recebendo diariamente comprimidos de 0,625 mg de estrogênios conjugados orais.
DOSAGEM E ADMINISTRAÇÃO
Amenorreia secundária
Os comprimidos de PROVERA 10 mg podem ser administrados em doses de 5 ou 10 mg por dia durante 5 a 10 dias. Uma dose para induzir uma transformação secretória ótima de um endométrio que foi adequadamente preparado com estrogênio endógeno ou exógeno é de 10 mg de PROVERA 10 mg diariamente por 10 dias. Em casos de amenorreia secundária, a terapia pode ser iniciada a qualquer momento. O sangramento por privação de progestágeno geralmente ocorre dentro de três a sete dias após a interrupção da terapia com PROVERA 10mg.
Sangramento uterino anormal devido ao desequilíbrio hormonal na ausência de patologia orgânica
Começando no 16º ou 21º dia calculado do ciclo menstrual, 5 ou 10 mg de PROVERA 10 mg podem ser administrados diariamente por 5 a 10 dias. Para produzir uma transformação secretória ideal de um endométrio que foi adequadamente preparado com estrogênio endógeno ou exógeno, sugere-se 10 mg de PROVERA 10 mg diariamente por 10 dias, começando no 16º dia do ciclo. O sangramento por privação de progestágenos geralmente ocorre dentro de três a sete dias após a descontinuação da terapia com PROVERA. Pacientes com histórico de episódios recorrentes de sangramento uterino anormal podem se beneficiar do ciclo menstrual planejado com PROVERA.
Redução da hiperplasia endometrial em mulheres na pós-menopausa que recebem diariamente 0,625 mg de estrogênios conjugados
Quando o estrogênio é prescrito para uma mulher na pós-menopausa com útero, uma progestina também deve ser iniciada para reduzir o risco de câncer de endométrio. Uma mulher sem útero não precisa de progesterona. O uso de estrogênio, sozinho ou em combinação com uma progestina, deve ser feito com a menor dose eficaz e com a menor duração, consistente com os objetivos e riscos do tratamento para a mulher individual. Os pacientes devem ser reavaliados periodicamente conforme clinicamente apropriado (por exemplo, intervalos de 3 a 6 meses) para determinar se o tratamento ainda é necessário (ver AVISOS ). Para mulheres que têm útero, medidas diagnósticas adequadas, como amostragem endometrial, quando indicadas, devem ser realizadas para descartar malignidade em casos de sangramento vaginal anormal persistente ou recorrente não diagnosticado.
Os comprimidos de PROVERA podem ser administrados em doses de 5 ou 10 mg por dia durante 12 a 14 dias consecutivos por mês, em mulheres pós-menopáusicas que recebem diariamente 0,625 mg de estrogénios conjugados, começando no 1º dia do ciclo ou no 16º dia do ciclo.
Os pacientes devem ser iniciados com a dose mais baixa.
A dose eficaz mais baixa de PROVERA não foi determinada.
COMO FORNECIDO
PROVERA 10mg Comprimidos estão disponíveis nas seguintes dosagens e tamanhos de embalagem:
2,5 mg (marcado, redondo, laranja)
Garrafas de 30 NDC 0009-0064-06 Garrafas de 100 NDC 0009-0064-04
5 mg (marcado, hexagonal, branco)
Garrafas de 100 NDC 0009-0286-03
10 mg (marcado, redondo, branco)
Garrafas de 100 NDC 0009-0050-02 Garrafas de 500 NDC 0009-0050-11
Armazenar em temperatura ambiente controlada de 20° a 25°C (68° a 77°F) [consulte USP ].
"Mantenha fora do alcance de crianças"
Distribuído por: Pharmacia & Upjohn Company, Division of Pfizer Inc., NY, NY 10017. Revisado: agosto de 2015
EFEITOS COLATERAIS
Ver AVISOS EM CAIXA , AVISOS , e PRECAUÇÕES .
Como os ensaios clínicos são conduzidos em condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparadas às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
As seguintes reações adversas foram relatadas em mulheres tomando PROVERA 10mg comprimidos, sem tratamento concomitante com estrogênios:
Aparelho geniturinário
Sangramento uterino anormal (irregular, aumento, diminuição), alteração no fluxo menstrual, sangramento de escape, spotting, amenorreia, alterações na erosão cervical e secreções cervicais.
Peitos
Sensibilidade mamária, mastodinia ou galactorréia foram relatadas.
Cardiovascular
Distúrbios tromboembólicos, incluindo tromboflebite e embolia pulmonar, foram relatados.
Gastrointestinal
Náusea, icterícia colestática.
Pele
Ocorreram reações de sensibilidade consistindo de urticária, prurido, edema e erupção cutânea generalizada. Acne, ocorreram reações de sensibilidade consistindo em urticária, prurido, edema e erupção cutânea generalizada. Acne, alopecia e hirsutismo foram relatados.
Olhos
Lesões neuro-oculares, por exemplo, trombose retiniana e neurite óptica.
Sistema nervoso central
Depressão mental, insônia, sonolência, tontura, dor de cabeça, nervosismo.
Diversos
Reações de hipersensibilidade (por exemplo, anafilaxia e reações anafilactóides, angioedema), erupção cutânea (alérgica) com e sem prurido, mudança de peso (aumento ou diminuição), pirexia, edema/retenção de líquidos, fadiga, diminuição da tolerância à glicose.
As seguintes reações adversas foram relatadas com terapia com estrogênio mais progesterona.
Aparelho geniturinário
Sangramento/spotting anormal ou fluxo uterino; sangramento de escape; manchas; dismenorreia/dor pélvica; aumento do tamanho dos leiomiomas uterinos; vaginite, incluindo candidíase vaginal; alteração na quantidade de secreção cervical; alterações no ectrópio cervical; cancro do ovário; hiperplasia endometrial; Câncer do endométrio.
Peitos
Sensibilidade, aumento, dor, secreção mamilar, galactorréia; alterações fibrocísticas da mama; câncer de mama.
Cardiovascular
Trombose venosa profunda e superficial; embolia pulmonar; tromboflebite; infarto do miocárdio; derrame; aumento da pressão arterial.
Gastrointestinal
Náuseas, vômitos; cólicas abdominais, inchaço; icterícia colestática; aumento da incidência de doença da vesícula biliar; pancreatite; aumento dos hemangiomas hepáticos.
Pele
Cloasma ou melasma que pode persistir quando a droga é descontinuada; eritema multiforme; eritema nodoso; erupção hemorrágica; perda de cabelo no couro cabeludo; hirsutismo; prurido, erupção cutânea.
Olhos
Trombose vascular retiniana, intolerância a lentes de contato.
Sistema nervoso central
Dor de cabeça; enxaqueca; tontura; depressão mental; coréia; nervosismo; distúrbios do humor; irritabilidade; exacerbação da epilepsia, demência.
Diversos
Aumento ou diminuição do peso; tolerância reduzida a carboidratos; agravamento da porfiria; edema; artralgias; cãibras nas pernas; alterações na libido; urticária, angioedema, reações anafilactóides/anafiláticas; hipocalcemia; exacerbação da asma; aumento dos triglicerídeos.
INTERAÇÕES MEDICAMENTOSAS
Interações de testes de laboratório de drogas
Os seguintes resultados laboratoriais podem ser alterados pelo uso de terapia com estrogênio mais progestina:
AVISOS
Incluído como parte do PRECAUÇÕES seção.
Ver AVISOS EM CAIXA .
Distúrbios Cardiovasculares
Um risco aumentado de EP, TVP, acidente vascular cerebral e infarto do miocárdio foi relatado com terapia com estrogênio mais progestina. Se algum desses eventos ocorrer ou houver suspeita, a terapia com estrogênio e progesterona deve ser descontinuada imediatamente.
Fatores de risco para doença vascular arterial (por exemplo, hipertensão, diabetes mellitus, tabagismo, hipercolesterolemia e obesidade) e/ou tromboembolismo venoso (TEV) (por exemplo, história pessoal ou familiar de TEV, obesidade e lúpus eritematoso sistêmico) devem ser gerenciados adequadamente.
Derrame
No subestudo WHI estrogênio mais progestina, um aumento estatisticamente significativo do risco de acidente vascular cerebral foi relatado em mulheres de 50 a 79 anos de idade recebendo CE (0,625 mg) mais MPA (2,5 mg) em comparação com mulheres na mesma faixa etária recebendo placebo (33 versus 25 por 10.000 mulheres-ano). (Ver Estudos clínicos .) O aumento do risco foi demonstrado após o primeiro ano e persistiu. Se ocorrer ou houver suspeita de acidente vascular cerebral, a terapia com estrogênio e progesterona deve ser descontinuada imediatamente.
Doença Coronária
No subestudo WHI de estrogênio mais progestina, houve um aumento estatisticamente não significativo do risco de eventos coronarianos relatados em mulheres que receberam diariamente CE (0,625 mg) mais MPA (2,5 mg) em comparação com mulheres que receberam placebo (41 versus 34 por 10.000 mulheres-ano ). Um aumento no risco relativo foi demonstrado no ano 1, e uma tendência de diminuição do risco relativo foi relatada nos anos 2 a 5.
Em mulheres na pós-menopausa com doença cardíaca documentada (n = 2.763, média de 66,7 anos de idade), em um ensaio clínico controlado de prevenção secundária de doença cardiovascular (Heart and Estrogen/Progestin Replacement Study [HERS]), o tratamento com CE diário (0,625 mg ) mais MPA (2,5mg) não demonstraram benefício cardiovascular. Durante um acompanhamento médio de 4,1 anos, o tratamento com CE mais MPA não reduziu a taxa geral de eventos de DAC em mulheres na pós-menopausa com doença cardíaca coronária estabelecida. Houve mais eventos de DAC no grupo tratado com CE mais MPA do que no grupo placebo no ano 1, mas não durante os anos subsequentes. Duas mil trezentas e vinte e uma (2.321) mulheres do estudo HERS original concordaram em participar de uma extensão aberta do HERS, HERS II. O seguimento médio no HERS II foi de 2,7 anos adicionais, totalizando 6,8 anos no total. As taxas de eventos de DAC foram comparáveis entre as mulheres no grupo CE mais MPA e no grupo placebo no HERS, HERS II e em geral.
Tromboembolismo venoso
No subestudo WHI de estrogênio mais progestina, uma taxa estatisticamente significativa 2 vezes maior de TEV (TVP e EP) foi relatada em mulheres que receberam diariamente CE (0,625 mg) mais MPA (2,5 mg) em comparação com mulheres que receberam placebo (35 versus 17 por 10.000 mulheres-ano). Aumentos estatisticamente significativos no risco de TVP (26 versus 13 por 10.000 mulheres-ano) e PE (18 versus 8 por 10.000 mulheres-ano) também foram demonstrados. O aumento do risco de TEV foi demonstrado durante o primeiro ano e persistiu. (Ver Estudos clínicos .) Se ocorrer ou houver suspeita de TEV, a terapia com estrogênio e progesterona deve ser descontinuada imediatamente.
Se possível, estrogênios mais progestágenos devem ser descontinuados pelo menos 4 a 6 semanas antes da cirurgia do tipo associado a um risco aumentado de tromboembolismo ou durante períodos de imobilização prolongada.
Neoplasias malignas
Câncer de mama
ensaio clínico randomizado mais importante que fornece informações sobre câncer de mama em usuárias de estrogênio mais progesterona é o subestudo WHI de CE diário (0,625 mg) mais MPA (2,5 mg). Após um acompanhamento médio de 5,6 anos, o subestudo de estrogênio mais progestina relatou um risco aumentado de câncer de mama invasivo em mulheres que tomaram CE mais MPA diariamente.
Neste subestudo, o uso prévio de terapia com estrogênio isolado ou estrogênio mais progestina foi relatado por 26% das mulheres. O risco relativo de câncer de mama invasivo foi de 1,24, e o risco absoluto foi de 41 versus 33 casos por 10.000 mulheres-ano, para CE mais MPA em comparação com placebo. Entre as mulheres que relataram uso prévio de terapia hormonal, o risco relativo de câncer de mama invasivo foi de 1,86, e o risco absoluto foi de 46 versus 25 casos por 10.000 mulheres-ano, para CE mais MPA em comparação com placebo. Entre as mulheres que não relataram uso prévio de terapia hormonal, o risco relativo de câncer de mama invasivo foi de 1,09, e o risco absoluto foi de 40 versus 36 casos por 10.000 mulheres-ano, para CE mais MPA em comparação com placebo. No mesmo subestudo, os cânceres de mama invasivos eram maiores, eram mais propensos a ser linfonodo positivo e foram diagnosticados em um estágio mais avançado no grupo CE (0,625 mg) mais MPA (2,5 mg) em comparação com o grupo placebo. A doença metastática foi rara, sem diferença aparente entre os dois grupos. Outros fatores prognósticos, como subtipo histológico, grau e status do receptor hormonal, não diferiram entre os grupos. (Ver Estudos clínicos .)
Consistente com o ensaio clínico WHI, estudos observacionais também relataram um risco aumentado de câncer de mama para terapia com estrogênio mais progestina e um risco menor para terapia com estrogênio sozinho, após vários anos de uso. O risco aumentou com a duração do uso e pareceu retornar à linha de base cerca de 5 anos após a interrupção do tratamento (somente os estudos observacionais têm dados substanciais sobre o risco após a interrupção). Estudos observacionais também sugerem que o risco de câncer de mama foi maior e se tornou aparente mais cedo, com a terapia com estrogênio mais progestina em comparação com a terapia com estrogênio isolado. No entanto, esses estudos não encontraram variação significativa no risco de câncer de mama entre diferentes combinações de estrogênio mais progestina, ou vias de administração.
Foi relatado que o uso de estrogênio mais progestina resulta em um aumento de mamografias anormais que requerem avaliação adicional. Todas as mulheres devem fazer exames de mama anualmente por um profissional de saúde e realizar autoexames mensais das mamas. Além disso, os exames de mamografia devem ser agendados com base na idade da paciente, fatores de risco e resultados de mamografias anteriores.
Câncer do endométrio
Um risco aumentado de câncer de endométrio foi relatado com o uso de terapia de estrogênio sem oposição em mulheres com útero. O risco de câncer endometrial relatado entre usuárias de estrogênio sem oposição é cerca de 2 a 12 vezes maior do que em não usuárias e parece depender da duração do tratamento e da dose de estrogênio. A maioria dos estudos não mostra aumento significativo do risco associado ao uso de estrogênios por menos de 1 ano. O maior risco parece estar associado ao uso prolongado, com riscos aumentados de 15 a 24 vezes por 5 a 10 anos ou mais. Demonstrou-se que esse risco persiste por pelo menos 8 a 15 anos após a descontinuação da terapia com estrogênio.
vigilância clínica de todas as mulheres em uso de terapia com estrogênio e progesterona é importante. Medidas diagnósticas adequadas, incluindo amostragem endometrial quando indicada, devem ser tomadas para descartar malignidade em todos os casos de sangramento genital anormal persistente ou recorrente não diagnosticado. Não há evidências de que o uso de estrogênios naturais resulte em um perfil de risco endometrial diferente dos estrogênios sintéticos de dose equivalente de estrogênio. A adição de uma progestina à terapia com estrogênio demonstrou reduzir o risco de hiperplasia endometrial, que pode ser um precursor do câncer endometrial.
Cancro do ovário
subestudo WHI de estrogênio mais progestina relatou um aumento estatisticamente não significativo do risco de câncer de ovário. Após um acompanhamento médio de 5,6 anos, o risco relativo de câncer de ovário para EC mais MPA versus placebo foi de 1,58 (IC de 95%, 0,77–3,24). O risco absoluto de EC mais MPA foi de 4 versus 3 casos por 10.000 mulheres-ano. Em alguns estudos epidemiológicos, o uso de estrogênio mais progesterona e produtos apenas com estrogênio, em particular por 5 ou mais anos, foi associado ao aumento do risco de câncer de ovário. No entanto, a duração da exposição associada ao aumento do risco não é consistente em todos os estudos epidemiológicos e alguns relatam nenhuma associação.
Provável Demência
No estudo auxiliar WHIMS de estrogênio mais progestina do WHI, uma população de 4.532 mulheres na pós-menopausa com idades entre 65 e 79 anos foi randomizada para CE diário (0,625 mg) mais MPA (2,5 mg) ou placebo. Após um acompanhamento médio de 4 anos, 40 mulheres no grupo CE mais MPA e 21 mulheres no grupo placebo foram diagnosticadas com provável demência. O risco relativo de demência provável para CE mais MPA versus placebo foi de 2,05 (IC de 95%, 1,21–3,48). O risco absoluto de demência provável para EC mais MPA versus placebo foi de 45 versus 22 casos por 10.000 mulheres-ano. Não se sabe se esses achados se aplicam a mulheres pós-menopáusicas mais jovens. (Ver Estudos clínicos e PRECAUÇÕES , Uso Geriátrico .)
Anormalidades visuais
Descontinuar a terapia com estrogênio e progesterona até o exame se houver perda súbita parcial ou completa da visão, ou um início súbito de proptose, diplopia ou enxaqueca. Se o exame revelar papiledema ou lesões vasculares retinianas, a terapia com estrogênio mais progestina deve ser descontinuada permanentemente.
PRECAUÇÕES
Em geral
Adição de uma progestina quando uma mulher não teve uma histerectomia
Estudos da adição de uma progestina por 10 ou mais dias de um ciclo de administração de estrogênio, ou diariamente com estrogênio em um regime contínuo, relataram uma incidência menor de hiperplasia endometrial do que seria induzida pelo tratamento com estrogênio isolado. A hiperplasia endometrial pode ser um precursor do câncer endometrial.
Existem, no entanto, possíveis riscos que podem estar associados ao uso de progestágenos com estrogênios em comparação com regimes de estrogênio isolado. Estes incluem um risco aumentado de câncer de mama.
Sangramento Vaginal Anormal Inesperado
Em casos de sangramento vaginal anormal inesperado, são indicadas medidas diagnósticas adequadas.
Pressão Arterial Elevada
A pressão arterial deve ser monitorada em intervalos regulares com terapia de estrogênio mais progesterona.
Hipertrigliceridemia
Em mulheres com hipertrigliceridemia pré-existente, a terapia com estrogênio mais progestina pode estar associada a elevações dos triglicerídeos plasmáticos levando à pancreatite. Considerar a descontinuação do tratamento se ocorrer pancreatite.
Insuficiência hepática e/ou história pregressa de icterícia colestática
Estrogênios mais progestinas podem ser mal metabolizados em mulheres com função hepática prejudicada. Para mulheres com história de icterícia colestática associada ao uso anterior de estrogênio ou à gravidez, deve-se ter cautela e, em caso de recorrência, a medicação deve ser descontinuada.
Retenção de fluidos
As progestinas podem causar algum grau de retenção de líquidos. Mulheres que têm condições que podem ser influenciadas por esse fator, como insuficiência cardíaca ou renal, devem ser observadas cuidadosamente quando estrogênio mais progesterona são prescritos.
Hipocalcemia
A terapia com estrogênio mais progestina deve ser usada com cautela em mulheres com hipoparatireoidismo, pois pode ocorrer hipocalcemia induzida por estrogênio.
Exacerbação de outras condições
A terapia com estrogênio e progesterona pode causar exacerbação de asma, diabetes mellitus, epilepsia, enxaqueca, porfiria, lúpus eritematoso sistêmico e hemangiomas hepáticos e deve ser usada com cautela em mulheres com essas condições.
Informação do paciente
Os médicos são aconselhados a discutir a INFORMAÇÃO DO PACIENTE folheto com as mulheres a quem prescrevem PROVERA.
Pode haver um risco aumentado de defeitos congênitos menores em crianças cujas mães são expostas a progestágenos durante o primeiro trimestre de gravidez. O possível risco para o bebê do sexo masculino é a hipospádia, uma condição na qual a abertura do pênis está na parte inferior e não na ponta do pênis. Esta condição ocorre naturalmente em aproximadamente 5 a 8 por 1000 nascimentos do sexo masculino. O risco pode ser aumentado com a exposição ao PROVERA. O aumento do clitóris e a fusão dos lábios podem ocorrer em bebês do sexo feminino. No entanto, não foi estabelecida uma associação clara entre hipospádia, aumento do clitóris e fusão labial com o uso de PROVERA.
Informe a paciente sobre a importância de relatar a exposição a PROVERA 5mg no início da gravidez.
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Carcinogenicidade
A administração intramuscular a longo prazo de acetato de medroxiprogesterona mostrou produzir tumores mamários em cães beagle. Não houve evidência de efeito carcinogênico associado à administração oral de acetato de medroxiprogesterona em ratos e camundongos.
administração contínua a longo prazo de terapia com estrogênio mais progestina mostrou um risco aumentado de câncer de mama e câncer de ovário. (Ver AVISOS e PRECAUÇÕES .)
Genotoxicidade
O acetato de medroxiprogesterona não foi mutagênico em uma bateria de ensaios de toxicidade genética in vitro ou in vivo.
Fertilidade
O acetato de medroxiprogesterona em altas doses é um fármaco antifertilidade e espera-se que altas doses prejudiquem a fertilidade até a interrupção do tratamento.
Gravidez
Gravidez Categoria X
PROVERA não deve ser utilizado durante a gravidez. (Ver CONTRA-INDICAÇÕES .)
Pode haver riscos aumentados de hipospádia, aumento do clitóris e fusão labial em crianças cujas mães são expostas a PROVERA 10mg durante o primeiro trimestre de gravidez. No entanto, não foi estabelecida uma associação clara entre essas condições com o uso de PROVERA.
Mães que amamentam
PROVERA não deve ser utilizado durante a lactação. Quantidades detectáveis de progestágenos foram identificadas no leite materno de mães que amamentam recebendo progestágenos.
Uso Pediátrico
Os comprimidos de PROVERA 10mg não são indicados para crianças. Não foram realizados estudos clínicos na população pediátrica.
Uso Geriátrico
Não houve um número suficiente de mulheres geriátricas envolvidas em estudos clínicos utilizando PROVERA isolado para determinar se aquelas com mais de 65 anos de idade diferem de indivíduos mais jovens em sua resposta ao PROVERA isolado.
Estudos da Iniciativa de Saúde da Mulher
No subestudo WHI de estrogênio mais progestina (CE diário [0,625 mg] mais MPA [2,5 mg] versus placebo), houve um risco relativo maior de acidente vascular cerebral não fatal e câncer de mama invasivo em mulheres com mais de 65 anos de idade. (Ver Estudos clínicos .)
Estudo de Memória da Iniciativa de Saúde da Mulher
Nos estudos auxiliares do WHIMS em mulheres pós-menopáusicas de 65 a 79 anos de idade, houve um risco aumentado de desenvolver provável demência em mulheres recebendo estrogênio isolado ou estrogênio mais progestina quando comparado ao placebo. (Ver AVISOS , Provável Demência .)
Uma vez que ambos os estudos auxiliares foram realizados em mulheres de 65 a 79 anos de idade, não se sabe se esses achados se aplicam a mulheres pós-menopáusicas mais jovens. (Ver AVISOS , Provável Demência .)
SOBREDOSAGEM
A superdosagem da terapia com estrogênio mais progesterona pode causar náuseas e vômitos, sensibilidade mamária, tontura, dor abdominal, sonolência/fadiga e sangramento de privação pode ocorrer em mulheres. O tratamento da superdosagem consiste na descontinuação de CE mais MPA juntamente com a instituição de cuidados sintomáticos apropriados.
CONTRA-INDICAÇÕES
PROVERA 10mg é contraindicado em mulheres com qualquer uma das seguintes condições:
FARMACOLOGIA CLÍNICA
acetato de medroxiprogesterona (MPA) administrado por via oral ou parenteral nas doses recomendadas para mulheres com estrogênio endógeno adequado, transforma o endométrio proliferativo em secretor. Efeitos androgênicos e anabólicos foram observados, mas a droga é aparentemente desprovida de atividade estrogênica significativa. Embora o MPA administrado por via parenteral iniba a produção de gonadotrofina, que por sua vez impede a maturação folicular e a ovulação, os dados disponíveis indicam que isso não ocorre quando a dose oral normalmente recomendada é administrada em doses únicas diárias.
Farmacocinética
farmacocinética do MPA foi determinada em 20 mulheres na pós-menopausa após a administração de uma dose única de oito comprimidos de PROVERA 2,5 mg ou uma administração única de dois comprimidos de PROVERA 10 mg em jejum. Em outro estudo, a farmacocinética de estado de equilíbrio do MPA foi determinada em jejum em 30 mulheres na pós-menopausa após a administração diária de um comprimido de PROVERA 10 mg por 7 dias. Em ambos os estudos, o MPA foi quantificado no soro usando um método validado de cromatografia gasosa-espectrometria de massa (GC-MS). As estimativas dos parâmetros farmacocinéticos do MPA após doses únicas e múltiplas de comprimidos de PROVERA foram altamente variáveis e estão resumidas na Tabela 1.
Absorção
Nenhuma investigação específica sobre a biodisponibilidade absoluta do MPA em humanos foi conduzida. O MPA é rapidamente absorvido pelo trato gastrointestinal e as concentrações máximas de MPA são obtidas entre 2 a 4 horas após a administração oral.
administração de PROVERA com alimentos aumenta a biodisponibilidade do MPA. Uma dose de 10 mg de PROVERA 10 mg, tomada imediatamente antes ou após uma refeição, aumentou a Cmax do MPA (50 a 70%) e a AUC (18 a 33%). A meia-vida do MPA não foi alterada com alimentos.
Distribuição
O MPA é aproximadamente 90% ligado às proteínas, principalmente à albumina; nenhuma ligação de MPA ocorre com globulina de ligação de hormônio sexual.
Metabolismo
Após administração oral, o MPA é extensamente metabolizado no fígado por hidroxilação, com subsequente conjugação e eliminação na urina.
Excreção
A maioria dos metabólitos do MPA é excretada na urina como conjugados glicuronídeos com apenas pequenas quantidades excretadas como sulfatos.
Populações Específicas
Insuficiência Hepática
O MPA é quase exclusivamente eliminado pelo metabolismo hepático. Em 14 pacientes com doença hepática avançada, a disposição do MPA foi significativamente alterada (eliminação reduzida). Em pacientes com fígado gorduroso, a dose percentual média excretada na urina de 24 horas como MPA intacto após uma dose de 10 mg ou 100 mg foi de 7,3% e 6,4%, respectivamente.
Insuficiência renal
efeito da insuficiência renal na farmacocinética de PROVERA 5mg não foi estudado.
Interações medicamentosas
O acetato de medroxiprogesterona (MPA) é metabolizado in vitro principalmente por hidroxilação via CYP3A4. Não foram realizados estudos específicos de interação medicamentosa avaliando os efeitos clínicos com indutores ou inibidores do CYP3A4 no MPA. Indutores e/ou inibidores do CYP3A4 podem afetar o metabolismo do MPA.
Estudos clínicos
Efeitos sobre o endométrio
Em um estudo de 3 anos, duplo-cego, controlado por placebo de 356 mulheres pós-menopáusicas não histerectomizadas entre 45 e 64 anos de idade randomizadas para receber placebo (n=119), 0,625 mg de estrogênio conjugado apenas (n=119), ou 0,625 mg de estrogênio conjugado mais PROVERA cíclico (n=118), os resultados mostraram um risco reduzido de hiperplasia endometrial no grupo de tratamento que recebeu 10 mg de PROVERA 5mg mais 0,625 mg de estrogênios conjugados em comparação com o grupo que recebeu apenas 0,625 mg de estrogênios conjugados. Consulte a Tabela 2.
Em um segundo estudo de 1 ano, 832 mulheres na pós-menopausa entre 45 e 65 anos de idade foram tratadas diariamente com 0,625 mg de estrogênio conjugado (dias 1 a 28), mais 5 mg de PROVERA cíclico ou 10 mg de PROVERA cíclico (dias 15 a 28), ou diariamente 0,625 mg de estrogênio conjugado apenas. Os grupos de tratamento que receberam 5 ou 10 mg de PROVERA cíclico (dias 15-28) mais estrogênios conjugados diários mostraram uma taxa significativamente menor de hiperplasia em comparação com o grupo apenas de estrogênios conjugados. Consulte a Tabela 3.
Estudos da Iniciativa de Saúde da Mulher
WHI recrutou aproximadamente 27.000 mulheres pós-menopáusicas predominantemente saudáveis em dois subestudos para avaliar os riscos e benefícios da CE oral diária (0,625 mg) isoladamente ou em combinação com MPA (2,5 mg) em comparação com placebo na prevenção de certas doenças crônicas. O desfecho primário foi a incidência de doença cardíaca coronária (DAC) (definida como IM não fatal, IM silencioso e morte por DAC), com câncer de mama invasivo como desfecho adverso primário. Um “índice global” incluiu a ocorrência mais precoce de DAC, câncer de mama invasivo, acidente vascular cerebral, EP, câncer de endométrio (somente no subestudo CE mais MPA), câncer colorretal, fratura de quadril ou morte por outra causa. Esses subestudos não avaliaram os efeitos do CE sozinho ou do CE mais MPA nos sintomas da menopausa.
Subestudo WHI Estrogen Plus Progestin
subestudo WHI de estrogênio mais progestina foi interrompido precocemente. De acordo com a regra de interrupção predefinida, após um acompanhamento médio de 5,6 anos de tratamento, o aumento do risco de câncer de mama invasivo e eventos cardiovasculares excedeu os benefícios especificados incluídos no “índice global”. O excesso de risco absoluto de eventos incluídos no “índice global” foi de 19 por 10.000 mulheres-ano.
Para os desfechos incluídos no “índice global” do WHI que alcançaram significância estatística após 5,6 anos de acompanhamento, o excesso de risco absoluto por 10.000 mulheres-ano no grupo tratado com CE mais MPA foi de mais 7 eventos de DAC, mais 8 AVCs, 10 EPs a mais e 8 cânceres de mama mais invasivos, enquanto a redução do risco absoluto por 10.000 mulheres-anos foi de 6 menos cânceres colorretais e 5 menos fraturas de quadril.
Os resultados do subestudo CE mais MPA, que incluiu 16.608 mulheres (média de 63 anos de idade, faixa de 50 a 79; 83,9 por cento brancas, 6,8 por cento negras, 5,4 por cento hispânicas, 3,9 por cento Outros) são apresentados na Tabela 4. Esses resultados refletem centralmente dados adjudicados após um seguimento médio de 5,6 anos.
O momento do início da terapia com estrogênio e progesterona em relação ao início da menopausa pode afetar o perfil geral de risco-benefício. O subestudo WHI de estrogênio mais progestina estratificado por idade mostrou em mulheres de 50 a 59 anos de idade uma tendência não significativa para redução do risco de mortalidade geral [hazard ratio (HR) 0,69 (IC 95%, 0,44-1,07)].
Estudo de Memória da Iniciativa de Saúde da Mulher
estudo auxiliar WHIMS de estrogênio mais progestina da WHI envolveu 4.532 mulheres pós-menopáusicas predominantemente saudáveis com 65 anos de idade ou mais (47 por cento tinham 65 a 69 anos de idade, 35 por cento tinham 70 a 74 anos de idade e 18 por cento tinham 75 anos de idade). idade e mais velhos) para avaliar os efeitos da CE diária (0,625 mg) mais MPA (2,5 mg) na incidência de demência provável (desfecho primário) em comparação com placebo.
Após um acompanhamento médio de 4 anos, o risco relativo de provável demência para EC mais MPA versus placebo foi de 2,05 (IC 95%, 1,21–3,48). O risco absoluto de demência provável para EC mais MPA versus placebo foi de 45 versus 33 por 10.000 mulheres-ano. A demência provável, conforme definida neste estudo, incluiu a doença de Alzheimer (DA), demência vascular (DV) e tipo misto (com características de DA e DV). A classificação mais comum de provável demência no grupo de tratamento e no grupo placebo foi DA. Uma vez que o estudo auxiliar foi realizado em mulheres de 65 a 79 anos de idade, não se sabe se esses achados se aplicam a mulheres pós-menopáusicas mais jovens. (Ver AVISOS , Provável Demência e PRECAUÇÕES , Uso Geriátrico ).
INFORMAÇÃO DO PACIENTE
PROVERA (pro-VE-rah) (acetato de medroxiprogesterona) comprimidos, USP
Leia estas informações do paciente antes de começar a tomar PROVERA e leia o que você recebe cada vez que reabastecer sua receita de PROVERA. Pode haver novas informações. Esta informação não substitui a conversa com seu médico sobre sua condição médica ou seu tratamento.
Qual é a informação mais importante que devo saber sobre PROVERA (um hormônio progestágeno)?
- Não use estrogênios com progestinas para prevenir doenças cardíacas, ataques cardíacos, derrames ou demência (declínio da função cerebral).
- O uso de estrogênios com progestinas pode aumentar sua chance de ter ataques cardíacos, derrames, câncer de mama e coágulos sanguíneos.
- O uso de estrogênios com progestinas pode aumentar sua chance de contrair demência, com base em um estudo com mulheres com 65 anos ou mais.
- Você e seu médico devem conversar regularmente sobre se ainda precisa de tratamento com PROVERA.
O que é PROVERA 10mg?
PROVERA é um medicamento que contém acetato de medroxiprogesterona, uma hormona progestina.
Para que serve PROVERA 5mg?
PROVERA é usado para:
- Tratar períodos menstruais que pararam ou para tratar sangramento uterino anormal. Mulheres com útero que não estão grávidas, que param de ter períodos menstruais regulares ou que começam a ter períodos menstruais irregulares podem ter uma queda no nível de progesterona. Converse com seu médico sobre se PROVERA 10mg é adequado para você.
- Reduza suas chances de ter câncer de útero (útero). Em mulheres pós-menopáusicas com útero que usam estrogênios, tomar progestina em combinação com estrogênio reduzirá sua chance de contrair câncer de útero (útero).
Quem não deve tomar PROVERA?
Não comece a tomar PROVERA se você:
- tem sangramento vaginal incomum
- atualmente tem ou teve certos tipos de câncer Estrogênio mais progestina pode aumentar sua chance de contrair certos tipos de câncer, incluindo câncer de mama. Se você tem ou teve câncer, converse com seu médico sobre se você deve usar PROVERA.
- teve um derrame ou ataque cardíaco
- atualmente tem ou teve coágulos sanguíneos
- atualmente tem ou teve problemas de fígado
- são alérgicos a PROVERA 10mg ou a qualquer um dos seus ingredientes Consulte a lista de ingredientes de PROVERA no final deste folheto.
- acho que você pode estar grávida PROVERA não é para mulheres grávidas. Se você acha que pode estar grávida, você deve fazer um teste de gravidez e saber os resultados. Não use PROVERA se o teste for positivo e converse com seu médico. Pode haver um risco aumentado de defeitos congênitos menores em crianças cujas mães tomam PROVERA durante os primeiros 4 meses de gravidez. PROVERA não deve ser utilizado como teste de gravidez.
que devo dizer ao meu médico antes de tomar PROVERA 10mg? Antes de tomar PROVERA 5mg, informe o seu médico se você:
- tem outros problemas médicos Seu médico pode precisar examiná-lo com mais cuidado se você tiver certas condições, como asma (pieira), epilepsia (convulsões), diabetes, enxaqueca, endometriose (dor pélvica grave), lúpus ou problemas com seu coração, fígado, tireóide, rins, ou tem níveis elevados de cálcio no sangue.
- vão fazer uma cirurgia ou estarão em repouso na cama Seu médico irá informá-lo se você precisar parar de tomar PROVERA.
- estão amamentando A hormona de PROVERA pode passar para o leite materno.
Informe o seu médico sobre todos os medicamentos que toma incluindo medicamentos prescritos e não prescritos, vitaminas e suplementos de ervas. Alguns medicamentos podem afetar o funcionamento de PROVERA. PROVERA também pode afetar o funcionamento de outros medicamentos.
Como devo tomar PROVERA 10mg?
Comece com a dose mais baixa e converse com seu médico sobre como essa dose está funcionando para você. A dose eficaz mais baixa de PROVERA não foi determinada. Você e seu médico devem conversar regularmente (a cada 3 a 6 meses) sobre a dose que está tomando e se ainda precisa de tratamento com PROVERA.
Quais são os possíveis efeitos colaterais do PROVERA?
Os seguintes efeitos colaterais foram relatados com o uso de PROVERA 10mg isolado:
- mastalgia
- secreção de leite materno
- sangramento de escape
- spotting (menor sangramento vaginal)
- períodos irregulares
- amenorreia (ausência de períodos menstruais)
- secreções vaginais
- dores de cabeça
- nervosismo
- tontura
- depressão
- insônia, sonolência, fadiga
- sintomas semelhantes à síndrome pré-menstrual
- tromboflebite (veias inflamadas)
- coágulo sanguíneo
- comichão, urticária, erupção cutânea
- acne
- queda de cabelo, crescimento de cabelo
- desconforto abdominal
- náusea
- inchaço
- febre
- aumento de peso
- inchaço
- alterações na visão e sensibilidade às lentes de contato
Ligue para o seu médico imediatamente se tiver urticária, problemas respiratórios, inchaço da face, boca, língua ou pescoço
Os seguintes efeitos colaterais foram relatados com o uso de PROVERA 5mg com um estrogênio.
Os efeitos colaterais são agrupados de acordo com a gravidade e a frequência com que ocorrem quando você é tratado.
Efeitos colaterais graves, mas menos comuns incluem:
- ataque cardíaco
- derrame
- coágulos de sangue
- demência
- câncer de mama
- câncer de útero
- câncer de ovário
- pressão alta
- açúcar alto no sangue
- doença da vesícula biliar
- problemas de fígado
- alterações nos níveis de hormônio da tireóide
- aumentos de tumores benignos (“miomas”)
Ligue para o seu médico imediatamente se tiver algum dos seguintes sinais de alerta ou quaisquer outros sintomas incomuns que o preocupem:
- novos nódulos mamários
- sangramento vaginal incomum
- alterações na visão e na fala
- súbitas novas dores de cabeça severas
- dores graves no peito ou pernas com ou sem falta de ar, fraqueza e fadiga
- perda de memória ou confusão
Efeitos colaterais menos graves, mas comuns incluem:
- dor de cabeça
- Dor no peito
- sangramento vaginal irregular ou manchas
- estômago ou cólicas abdominais, inchaço
- nausea e vomito
- perda de cabelo
- Retenção de fluidos
- candidíase vaginal
Estes não são todos os possíveis efeitos colaterais de PROVERA com ou sem estrogênio. Para obter mais informações, peça conselhos ao seu médico ou farmacêutico sobre os efeitos colaterais. Informe o seu médico se tiver um efeito colateral que o incomode ou não desapareça. Você pode relatar efeitos colaterais à Pfizer em 1-800-438-1985 ou FDA em 1-800-FDA-1088.
O que posso fazer para diminuir minhas chances de um efeito colateral grave com PROVERA 10mg?
- Converse com seu médico regularmente sobre se você deve continuar tomando PROVERA. A adição de uma progestina é geralmente recomendada para mulheres com útero para reduzir a chance de contrair câncer de útero (útero).
- Consulte o seu médico imediatamente se tiver sangramento vaginal enquanto estiver tomando PROVERA.
- Faça um exame pélvico, exame de mama e mamografia (raio-X da mama) todos os anos, a menos que seu médico lhe diga outra coisa. Se membros da sua família tiveram câncer de mama ou se você já teve nódulos mamários ou uma mamografia anormal, pode ser necessário fazer exames de mama com mais frequência.
- Se você tem pressão alta, colesterol alto (gordura no sangue), diabetes, excesso de peso ou se usa tabaco, pode ter uma chance maior de contrair doenças cardíacas. Pergunte ao seu médico sobre maneiras de diminuir sua chance de contrair doenças cardíacas.
Informações gerais sobre o uso seguro e eficaz de PROVERA
- Às vezes, medicamentos são prescritos para condições que não são mencionadas nos folhetos informativos do paciente.
- Não tome PROVERA para condições para as quais não foi prescrito.
- Não dê PROVERA a outras pessoas, mesmo que tenham os mesmos sintomas que você. Pode prejudicá-los.
Mantenha PROVERA 10mg fora do alcance das crianças.
Este folheto fornece um resumo das informações mais importantes sobre PROVERA. Se você quiser mais informações, fale com seu médico ou farmacêutico. Você pode pedir informações sobre PROVERA 10mg que é escrito para profissionais de saúde. Você pode obter mais informações ligando para o número gratuito 1-800-438-1985.
Quais são os ingredientes do PROVERA?
Cada comprimido de PROVERA 5 mg para administração oral contém 2,5 mg, 5 mg ou 10 mg de acetato de medroxiprogesterona.
Ingredientes inativos: estearato de cálcio, amido de milho, lactose, óleo mineral, ácido sórbico, sacarose, talco. O comprimido de 2,5 mg contém FD&C Amarelo Nº 6.
A etiqueta deste produto pode ter sido atualizada. Para obter informações completas sobre prescrição atuais, visite www.pfizer.com
