Tratamento de Doenças Gastrointestinais: Nexium 20mg, 40mg Esomeprazole Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Nexium e como é usado?
Nexium é um medicamento de prescrição usado para tratar os sintomas da doença do refluxo gastroesofágico (DRGE) e outras condições em que há excesso de ácido estomacal, como a síndrome de Zollinger-Ellison. Nexium pode ser usado sozinho ou com outros medicamentos.
Nexium 20mg é um inibidor da bomba de prótons.
Não se sabe se Nexium 20mg é seguro e eficaz em crianças menores de 1 mês para medicação intravenosa e 1 ano para medicação oral.
Quais são os efeitos colaterais do Nexium 40mg?
Nexium pode causar efeitos colaterais graves, incluindo:
- dor de estômago severa,
- diarreia aquosa ou sanguinolenta,
- convulsão (convulsões),
- pouca ou nenhuma micção,
- sangue na urina,
- inchaço,
- ganho de peso rápido,
- tontura,
- frequência cardíaca rápida ou irregular,
- tremores ou movimentos musculares bruscos,
- sentindo-se nervoso,
- cãibras musculares,
- espasmo muscular em suas mãos e pés,
- tosse ou sensação de asfixia,
- dores nas articulações e
- erupção cutânea nas bochechas ou braços que piora ao sol
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Nexium 40mg incluem:
- dor de cabeça,
- sonolência,
- diarréia leve,
- náusea,
- dor de estômago,
- gás,
- constipação, e
- boca seca
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Nexium. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
DESCRIÇÃO
O ingrediente ativo em NEXIUM® IV (esomeprazol sódico) para injeção é (S)-5-metoxi-2[[(4-metoxi-3,5-dimetil-2-piridinil)-metil]sulfinil]-1H-benzimidazol sódio, um inibidor da bomba de prótons que inibe a secreção de ácido gástrico. O esomeprazol é o isômero S do omeprazol, que é uma mistura dos isômeros S e R. Sua fórmula empírica é C17H18N3O3SNa com peso molecular de 367,4 g/mol (sal de sódio) e 345,4 g/mol (composto de origem).
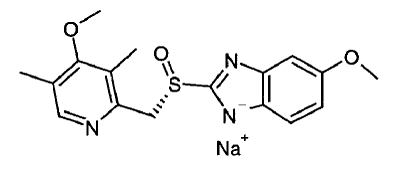
Esomeprazol sódico é muito solúvel em água e livremente solúvel em etanol (95%). A fórmula estrutural é:
NEXIUM 20mg IV para injeção é fornecido como um bolo ou pó estéril, liofilizado, branco a esbranquiçado, ou pó em um frasco de 5 mL, destinado à administração intravenosa após reconstituição com injeção de cloreto de sódio a 0,9%, USP; Injeção de Ringer com Lactato, USP ou Injeção de Dextrose a 5%, USP. NEXIUM IV para injeção contém esomeprazol sódico 21,3 mg ou 42,5 mg equivalente a esomeprazol 20 mg ou 40 mg, edetato dissódico 1,5 mg e hidróxido de sódio qs para ajuste do pH. O pH da solução reconstituída de NEXIUM IV para injeção depende do volume de reconstituição e está na faixa de pH de 9 a 11. A estabilidade do esomeprazol sódico em solução aquosa depende fortemente do pH. A taxa de degradação aumenta com a diminuição do pH.
INDICAÇÕES
Tratamento da doença do refluxo gastroesofágico (DRGE) com esofagite erosiva (EE)
NEXIUM IV é indicado para o tratamento de curta duração da DRGE com EE em pacientes adultos e pediátricos de 1 mês a 17 anos, inclusive como alternativa à terapia oral quando NEXIUM 40mg oral não for possível ou apropriado.
Redução do risco de ressangramento de úlceras gástricas ou duodenais após endoscopia terapêutica em adultos
NEXIUM 40mg IV é indicado para redução do risco de ressangramento de úlceras gástricas ou duodenais após endoscopia terapêutica para sangramento agudo de úlceras gástricas ou duodenais em adultos.
DOSAGEM E ADMINISTRAÇÃO
Dosagem para DRGE com EE
Pacientes adultos
A dosagem recomendada para adultos é de 20 mg ou 40 mg NEXIUM 40 mg IV administrado uma vez ao dia por injeção intravenosa (durante pelo menos 3 minutos) ou infusão intravenosa (10 minutos a 30 minutos) por até 10 dias [ver DOSAGEM E ADMINISTRAÇÃO ].
Pacientes pediátricos
A dosagem recomendada para pacientes pediátricos é baseada na idade e peso corporal, conforme mostrado na Tabela 1 abaixo. Administrar como infusão intravenosa durante 10 a 30 minutos uma vez ao dia por até 10 dias [ver DOSAGEM E ADMINISTRAÇÃO ].
Conclusão do tratamento
- A segurança e eficácia de NEXIUM 20mg IV por mais de 10 dias não foram demonstradas.
- Assim que a terapia oral for possível ou apropriada, descontinue a terapia intravenosa com NEXIUM 40mg IV e continue com a terapia oral com NEXIUM 20mg.
Dosagem para redução do risco de ressangramento de úlceras gástricas ou duodenais após endoscopia terapêutica em adultos
A dose recomendada para adultos é de 80 mg de NEXIUM IV administrado como infusão intravenosa durante 30 minutos, seguido de uma infusão contínua de 8 mg/hora para uma duração total de tratamento de 72 horas (ou seja, inclui dose inicial de 30 minutos mais 71,5 horas de infusão) [ver DOSAGEM E ADMINISTRAÇÃO ].
A terapia intravenosa destina-se exclusivamente ao tratamento inicial agudo de úlceras gástricas ou duodenais hemorrágicas e não constitui tratamento completo. Administrar terapia supressora de ácido oral após terapia intravenosa para um curso completo de tratamento.
Ajuste de dosagem para insuficiência hepática
DRGE com EE
Para pacientes com insuficiência hepática grave (Child-Pugh Classe C), a dose máxima é de 20 mg uma vez ao dia [ver Uso em populações específicas ].
Redução do risco de ressangramento de úlceras gástricas ou duodenais após endoscopia terapêutica em adultos
Para pacientes com insuficiência hepática leve a moderada (Child-Pugh Classes A e B, respectivamente), administrar 80 mg por infusão intravenosa durante 30 minutos, seguido de uma infusão contínua de 6 mg/hora por 71,5 horas.
Para pacientes com insuficiência hepática grave (Child-Pugh Classe C), administrado 80 mg como infusão intravenosa durante 30 minutos, seguido de infusão contínua de 4 mg/hora por 71,5 horas [ver Uso em populações específicas ].
Instruções de preparação e administração para DRGE com EE
Não administre NEXIUM 40mg IV concomitantemente com qualquer outro medicamento pelo mesmo local e/ou tubo intravenoso.
Antiácidos orais podem ser usados durante o tratamento com NEXIUM 20mg IV
Injeção intravenosa durante pelo menos 3 minutos em pacientes adultos
Infusão intravenosa de 10 minutos a 30 minutos em pacientes adultos e pediátricos
Armazenar
Armazene a solução final (diluída) de NEXIUM IV em temperatura ambiente até 30°C (86°F) e administre dentro do período de tempo designado conforme listado na Tabela 2 abaixo.
Instruções de preparação e administração para redução do risco de ressangramento de úlceras gástricas ou duodenais em adultos
Não administre NEXIUM 40mg IV concomitantemente com qualquer outro medicamento pelo mesmo local e/ou tubo intravenoso.
Antiácidos orais podem ser usados durante o tratamento com NEXIUM IV
Dose de carregamento (80 mg)
Infusão Contínua
Armazenar
- Armazene a solução final (diluída) de NEXIUM IV à temperatura ambiente até 30°C (86°F) e administre dentro de 12 horas.
COMO FORNECIDO
Formas de dosagem e pontos fortes
Para injeção: 40 mg de esomeprazol como um pó liofilizado branco a esbranquiçado em um frasco de dose única para reconstituição.
Armazenamento e manuseio
NEXIUM 20mg IV é fornecido em um frasco de dose única como um pó liofilizado branco a esbranquiçado para reconstituição contendo 40 mg de esomeprazol.
NEXIUM 40mg IV . está disponível da seguinte forma:
Armazenar
Armazenar a 25°C (77°F); excursões permitidas de 15° a 30°C (59° a 86°F). [Ver Temperatura ambiente controlada USP .] Proteger da luz. Armazenar na caixa até o momento do uso.
Após reconstituição e administração, descarte qualquer porção não utilizada da solução de esomeprazol [ver DOSAGEM E ADMINISTRAÇÃO ].
Fabricado para: AstraZeneca Pharmaceuticals LP Wilmington, DE 19850. Revisado: março de 2022
EFEITOS COLATERAIS
As seguintes reações adversas graves estão descritas abaixo e em outras partes da bula:
- Nefrite Tubulointersticial Aguda [ver AVISOS E PRECAUÇÕES ]
- Diarreia Associada a Clostridium difficile [ver AVISOS E PRECAUÇÕES ]
- Fratura Óssea [ver AVISOS E PRECAUÇÕES ]
- Reações Adversas Cutâneas Graves [ver AVISOS E PRECAUÇÕES ]
- Lúpus Eritematoso Cutâneo e Sistêmico [ver AVISOS E PRECAUÇÕES ]
- Hipomagnesemia e Metabolismo Mineral [ver AVISOS E PRECAUÇÕES ]
- Pólipos da glândula fúndica [ver AVISOS E PRECAUÇÕES ]
Experiência de Ensaios Clínicos
Como os ensaios clínicos são conduzidos em condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparadas às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
DRGE sintomática e EE
Adultos
A segurança de NEXIUM IV é baseada em resultados de ensaios clínicos conduzidos em quatro populações diferentes, incluindo indivíduos saudáveis (n=204) e pacientes com sangramento de úlceras gástricas ou duodenais (n=375). Os dados descritos abaixo refletem a exposição a NEXIUM 20mg IV em 359 pacientes em estudos controlados ativamente: DRGE sintomática com ou sem história de EE (n=199) e pacientes com EE (n=160). A população era de 18 a 77 anos; 45% masculino, 52% caucasiano, 17% negro, 3% asiático e 28% de outra raça. A maioria dos pacientes recebeu doses de 20 ou 40 mg como infusão ou injeção. As reações adversas que ocorrem em pelo menos 1% dos pacientes estão listadas abaixo na Tabela 3:
tratamento intravenoso com NEXIUM 20 mg IV 20 e 40 mg administrado como injeção ou infusão mostrou ter um perfil de segurança semelhante ao do esomeprazol oral.
Pediatria
Foi realizado um estudo multinacional randomizado, aberto, para avaliar a farmacocinética de doses intravenosas repetidas de NEXIUM IV uma vez ao dia em pacientes pediátricos de 1 mês a 17 anos de idade, inclusive [ver FARMACOLOGIA CLÍNICA ]. Os resultados de segurança são consistentes com o perfil de segurança conhecido do esomeprazol e nenhum sinal de segurança inesperado foi identificado.
Redução do risco de ressangramento de úlceras gástricas ou duodenais em adultos
Os dados descritos na Tabela 4 abaixo refletem a exposição a NEXIUM 20mg IV em 375 pacientes que apresentaram sangramento de úlcera gástrica ou duodenal confirmado por endoscopia em um estudo controlado por placebo. A população era de 18 a 98 anos; 68% masculino, 87% caucasiano, 1% negro, 7% asiático e 4% de outra raça. Após a hemostasia endoscópica, os pacientes receberam placebo ou 80 mg de NEXIUM IV como infusão intravenosa durante 30 minutos, seguido de infusão contínua de 8 mg/hora por uma duração total de tratamento de 72 horas. Após o período inicial de 72 horas, todos os pacientes receberam IBP oral por 27 dias.
Com exceção das reações no local da injeção descritas acima, o tratamento intravenoso com NEXIUM 20mg IV administrado como injeção ou infusão apresentou um perfil de segurança semelhante ao do esomeprazol oral.
Experiência pós-marketing
As seguintes reações adversas foram identificadas durante o uso pós-aprovação de esomeprazol. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento.
Distúrbios do Sangue e do Sistema Linfático: agranulocitose, pancitopenia;
Distúrbios oculares: visão embaçada;
Problemas gastrointestinais: pancreatite; estomatite; colite microscópica; pólipos de glândulas fúndicas;
Distúrbios hepatobiliares: insuficiência hepática, hepatite com ou sem icterícia;
Distúrbios do sistema imunológico: reação anafilática/choque; lúpus eritematoso sistêmico;
Infecções e Infestações: candidíase GI;
Metabolismo e distúrbios nutricionais: hipomagnesemia (pode levar a hipocalcemia e/ou hipocalemia) [ver AVISOS E PRECAUÇÕES ], hiponatremia;
Distúrbios musculoesqueléticos e do tecido conjuntivo: fraqueza muscular, mialgia, fratura óssea;
Distúrbios do sistema nervoso: encefalopatia hepática, alteração do paladar;
Distúrbios psiquiátricos: agressão, agitação, depressão, alucinação;
Distúrbios Renais e Urinários: nefrite intersticial;
Distúrbios do sistema reprodutor e da mama: ginecomastia;
Distúrbios respiratórios, torácicos e mediastinais: broncoespasmo;
Distúrbios da Pele e Tecidos Subcutâneos: alopecia, eritema multiforme, hiperidrose, fotossensibilidade, síndrome de Stevens-Johnson, necrólise epidérmica tóxica (NET, algumas fatais), reação medicamentosa com eosinofilia e sintomas sistêmicos (DRESS) e pustulose exantemática generalizada aguda (PEGA), lúpus eritematoso cutâneo.
As reações adversas associadas ao omeprazol também podem ocorrer com NEXIUM IV. Consulte as informações completas de prescrição do omeprazol oral para obter informações de segurança completas.
INTERAÇÕES MEDICAMENTOSAS
As Tabelas 5 e 6 incluem medicamentos com interações medicamentosas clinicamente importantes e interação com diagnóstico quando administrados concomitantemente com esomeprazol e instruções para preveni-los ou administrá-los.
Consulte a bula dos medicamentos usados concomitantemente para obter mais informações sobre interações com IBPs.
AVISOS
Incluído como parte do PRECAUÇÕES seção.
PRECAUÇÕES
Presença de malignidade gástrica
Em adultos, a resposta sintomática à terapia com NEXIUM IV não exclui a presença de malignidade gástrica. Considerar acompanhamento adicional e testes diagnósticos em pacientes adultos que apresentam resposta abaixo do ideal ou recaída sintomática precoce após completar o tratamento com um IBP. Em pacientes mais velhos, considere também uma endoscopia.
Nefrite Tubulointersticial Aguda
nefrite tubulointersticial aguda (TIN) foi observada em pacientes em uso de IBPs e pode ocorrer em qualquer momento durante a terapia com IBPs. Os pacientes podem apresentar sinais e sintomas variados, desde reações de hipersensibilidade sintomática a sintomas inespecíficos de função renal diminuída (por exemplo, mal-estar, náusea, anorexia). Na série de casos relatados, alguns pacientes foram diagnosticados por biópsia e na ausência de manifestações extra-renais (por exemplo, febre, erupção cutânea ou artralgia). Interrompa NEXIUM 20mg IV e avalie os pacientes com suspeita de TIN aguda [ver CONTRA-INDICAÇÕES ].
Diarreia Associada ao Clostridium Difficile
Estudos observacionais publicados sugerem que a terapia com IBP como NEXIUM 20mg IV pode estar associada a um risco aumentado de diarreia associada ao Clostridium difficile, especialmente em pacientes hospitalizados. Este diagnóstico deve ser considerado para diarreia que não melhora [ver REAÇÕES ADVERSAS ].
Os pacientes devem usar a dose mais baixa e a menor duração da terapia com IBP apropriada para a condição a ser tratada.
Fratura óssea
Vários estudos observacionais publicados sugerem que a terapia com inibidores da bomba de prótons (IBP) pode estar associada a um risco aumentado de fraturas relacionadas à osteoporose do quadril, punho ou coluna. O risco de fratura foi aumentado em pacientes que receberam altas doses, definidas como múltiplas doses diárias, e terapia de longo prazo com IBP (um ano ou mais). Os pacientes devem usar a dose mais baixa e a menor duração da terapia com IBP apropriada para a condição a ser tratada. Pacientes com risco de fraturas relacionadas à osteoporose devem ser tratados de acordo com as diretrizes de tratamento estabelecidas [ver DOSAGEM E ADMINISTRAÇÃO , REAÇÕES ADVERSAS ].
Reações Adversas Cutâneas Graves
Reações adversas cutâneas graves, incluindo síndrome de Stevens-Johnson (SSJ) e necrólise epidérmica tóxica (NET), reação medicamentosa com eosinofilia e sintomas sistêmicos (DRESS) e pustulose exantemática generalizada aguda (PEGA) foram relatadas em associação com o uso de IBPs [Vejo REAÇÕES ADVERSAS ]. Descontinuar NEXIUM IV aos primeiros sinais ou sintomas de reações adversas cutâneas graves ou outros sinais de hipersensibilidade e considerar uma avaliação adicional.
Lúpus Eritematoso Cutâneo e Sistêmico
Lúpus eritematoso cutâneo (LEC) e lúpus eritematoso sistêmico (LES) foram relatados em pacientes tomando IBPs, incluindo esomeprazol. Esses eventos ocorreram como um novo início e uma exacerbação de doença autoimune existente. A maioria dos casos de lúpus eritematoso induzido por IBP foram CLE.
A forma mais comum de LEC relatada em pacientes tratados com IBPs foi a LEC subaguda (SCLE) e ocorreu dentro de semanas a anos após a terapia medicamentosa contínua em pacientes que variam de lactentes a idosos. Geralmente, os achados histológicos foram observados sem envolvimento de órgãos.
lúpus eritematoso sistêmico (LES) é menos comumente relatado do que o LEC em pacientes que recebem IBPs. O LES associado a IBP é geralmente mais leve do que o LES não induzido por medicamentos. O início do LES normalmente ocorreu dentro de dias a anos após o início do tratamento, principalmente em pacientes que variam de adultos jovens a idosos. A maioria dos pacientes apresentou erupção cutânea; entretanto, artralgia e citopenia também foram relatadas.
Evite a administração de IBPs por mais tempo do que o indicado clinicamente. Se forem observados sinais ou sintomas consistentes com LEC ou LES em pacientes recebendo NEXIUM 20mg IV, descontinue o medicamento e encaminhe o paciente ao especialista apropriado para avaliação. A maioria dos pacientes melhora com a descontinuação do IBP isolado em 4 a 12 semanas. Testes sorológicos (por exemplo, ANA) podem ser positivos e resultados de testes sorológicos elevados podem levar mais tempo para serem resolvidos do que as manifestações clínicas.
Interação com Clopidogrel
Evite o uso concomitante de NEXIUM IV com clopidogrel. Clopidogrel é uma pró-droga. A inibição da agregação plaquetária pelo clopidogrel é inteiramente devida a um metabólito ativo. O metabolismo do clopidogrel em seu metabólito ativo pode ser prejudicado pelo uso concomitante de medicamentos, como esomeprazol, que inibem a atividade do CYP2C19. O uso concomitante de clopidogrel com 40 mg de esomeprazol reduz a atividade farmacológica do clopidogrel. Ao usar NEXIUM IV, considere terapia antiplaquetária alternativa [consulte INTERAÇÕES MEDICAMENTOSAS ].
Hipomagnesemia e Metabolismo Mineral
Hipomagnesemia, sintomática e assintomática, foi relatada raramente em pacientes tratados com IBPs por pelo menos três meses, na maioria dos casos após um ano de terapia. Eventos adversos graves incluem tetania, arritmias e convulsões. A hipomagnesemia pode levar à hipocalcemia e/ou hipocalemia e pode exacerbar a hipocalcemia subjacente em pacientes de risco. Na maioria dos pacientes, o tratamento da hipomagnesemia exigiu reposição de magnésio e descontinuação do IBP.
Para pacientes que devem estar em tratamento prolongado ou que tomam IBPs com medicamentos como digoxina ou medicamentos que podem causar hipomagnesemia (por exemplo, diuréticos), os profissionais de saúde podem considerar o monitoramento dos níveis de magnésio antes do início do tratamento com IBP e periodicamente [ver REAÇÕES ADVERSAS ].
Considere monitorar os níveis de magnésio e cálcio antes do início de NEXIUM IV e periodicamente durante o tratamento em pacientes com risco preexistente de hipocalcemia (por exemplo, hipoparatireoidismo). Suplemento com magnésio e/ou cálcio, conforme necessário. Se a hipocalcemia for refratária ao tratamento, considerar a descontinuação do IBP.
Interação com Erva de São João ou Rifampin
Drogas que induzem CYP2C19 ou CYP3A4 (como Erva de São João ou rifampicina) podem diminuir substancialmente as concentrações de esomeprazol [ver INTERAÇÕES MEDICAMENTOSAS ]. Evite o uso concomitante de NEXIUM 40mg IV com Erva de São João ou rifampicina.
Interações com investigações diagnósticas para tumores neuroendócrinos
Os níveis séricos de cromogranina A (CgA) aumentam secundariamente à diminuição da acidez gástrica induzida por drogas. O aumento do nível de CgA pode causar resultados falso-positivos em investigações diagnósticas de tumores neuroendócrinos. Os profissionais de saúde devem interromper temporariamente o tratamento com esomeprazol pelo menos 14 dias antes de avaliar os níveis de CgA e considerar a repetição do teste se os níveis iniciais de CgA forem altos. Se forem realizados testes em série (por exemplo, para monitoramento), o mesmo laboratório comercial deve ser usado para testes, pois os intervalos de referência entre os testes podem variar [ver INTERAÇÕES MEDICAMENTOSAS ].
Interação com Metotrexato
A literatura sugere que o uso concomitante de IBPs com metotrexato (principalmente em altas doses; ver informações de prescrição de metotrexato) pode elevar e prolongar os níveis séricos de metotrexato e/ou seu metabólito, possivelmente levando a toxicidade do metotrexato. Na administração de altas doses de metotrexato, a suspensão temporária do IBP pode ser considerada em alguns pacientes [ver INTERAÇÕES MEDICAMENTOSAS ].
Pólipos da Glândula Fúndica
uso de IBP está associado a um risco aumentado de pólipos da glândula fúndica que aumenta com o uso a longo prazo, especialmente após um ano. A maioria dos usuários de IBP que desenvolveu pólipos de glândula fúndica era assintomática e pólipos de glândula fúndica foram identificados incidentalmente na endoscopia. Use a duração mais curta da terapia com IBP apropriada para a condição a ser tratada.
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
potencial carcinogênico do esomeprazol foi avaliado por meio de estudos com omeprazol. Em dois estudos de carcinogenicidade oral de 24 meses em ratos, omeprazol em doses diárias de 1,7, 3,4, 13,8, 44,0 e 140,8 mg/kg/dia (cerca de 0,4 a 34 vezes a dose humana de 40 mg/dia expressa em uma superfície corporal base de área) produziram carcinoides de células ECL gástricas de maneira dose-dependente em ratos machos e fêmeas; a incidência deste efeito foi marcadamente maior em ratos fêmeas, que apresentaram níveis sanguíneos mais elevados de omeprazol. Carcinoides gástricos raramente ocorrem no rato não tratado. Além disso, a hiperplasia de células ECL estava presente em todos os grupos tratados de ambos os sexos. Em um desses estudos, ratas foram tratadas com 13,8 mg de omeprazol/kg/dia (cerca de 3,4 vezes a dose humana de 40 mg/dia com base na área de superfície corporal) por 1 ano, seguidas por mais um ano sem a droga. . Não foram observados carcinóides nestes ratos. Uma incidência aumentada de hiperplasia de células ECL relacionada ao tratamento foi observada no final de 1 ano (94% tratados versus 10% controles). No segundo ano, a diferença entre ratos tratados e controles foi muito menor (46% vs 26%), mas ainda mostrou mais hiperplasia no grupo tratado. Adenocarcinoma gástrico foi observado em um rato (2%). Nenhum tumor semelhante foi observado em ratos machos ou fêmeas tratados por 2 anos. Para esta cepa de rato nenhum tumor semelhante foi observado historicamente, mas um achado envolvendo apenas um tumor é difícil de interpretar. Um estudo de carcinogenicidade oral em camundongos de 78 semanas de omeprazol não mostrou aumento da ocorrência de tumor, mas o estudo não foi conclusivo.
esomeprazol foi negativo no teste de mutação de Ames, no teste de aberração cromossômica de células de medula óssea de rato in vivo e no teste de micronúcleo de camundongo in vivo. O esomeprazol, no entanto, foi positivo no teste de aberração cromossômica de linfócitos humanos in vitro. Omeprazol foi positivo no teste de aberração cromossômica de linfócitos humanos in vitro, no teste de aberração cromossômica em células de medula óssea de camundongo in vivo e no teste de micronúcleo de camundongo in vivo.
Os efeitos potenciais do esomeprazol na fertilidade e no desempenho reprodutivo foram avaliados usando estudos com omeprazol. Omeprazol em doses orais de até 138 mg/kg/dia em ratos (cerca de 34 vezes a dose humana de 40 mg/dia com base na área de superfície corporal) não teve efeito sobre o desempenho reprodutivo dos animais progenitores.
Uso em populações específicas
Gravidez
Resumo do risco
Não existem estudos adequados e bem controlados com esomeprazol em mulheres grávidas. O esomeprazol é o isômero s do omeprazol. Os dados epidemiológicos disponíveis não demonstram um risco aumentado de malformações congênitas maiores ou outros resultados adversos da gravidez com o uso de omeprazol no primeiro trimestre. Estudos de reprodução em ratos e coelhos resultaram em letalidade embrionária dependente da dose em doses de omeprazol que foram aproximadamente 3,4 a 34 vezes a dose oral humana de 40 mg (com base em uma área de superfície corporal para uma pessoa de 60 kg).
teratogenicidade não foi observada em estudos de reprodução animal com administração oral de esomeprazol magnésio em ratos e coelhos com doses cerca de 68 vezes e 42 vezes, respectivamente, uma dose oral humana de 40 mg (com base na área de superfície corporal para uma pessoa de 60 kg). . Alterações na morfologia óssea foram observadas em descendentes de ratos que receberam doses durante a maior parte da gestação e lactação em doses iguais ou superiores a aproximadamente 34 vezes uma dose oral humana de 40 mg. Quando a administração materna foi confinada apenas à gestação, não houve efeitos na morfologia da fise óssea na prole em qualquer idade (ver Dados ).
Os riscos de base estimados de grandes defeitos congênitos e aborto para a população indicada são desconhecidos. Todas as gestações têm um risco histórico de defeitos congênitos, perda ou outros resultados adversos. Na população geral dos EUA, o risco de fundo estimado de defeitos congênitos graves e aborto espontâneo em gestações clinicamente reconhecidas é de 2% a 4% e 15% a 20%, respectivamente.
Dados
Dados humanos
Esomeprazol é o isômero S do omeprazol. Quatro estudos epidemiológicos compararam a frequência de anormalidades congênitas entre bebês nascidos de mulheres que usaram omeprazol durante a gravidez com a frequência de anormalidades entre bebês de mulheres expostas a antagonistas dos receptores H2 ou outros controles.
Um estudo epidemiológico de coorte retrospectivo de base populacional do Registro Médico Sueco de Nascimento, cobrindo aproximadamente 99% das gestações, de 1995 a 99, relatou 955 bebês (824 expostos durante o primeiro trimestre com 39 destes expostos além do primeiro trimestre e 131 expostos após primeiro trimestre) cujas mães usaram omeprazol durante a gravidez. O número de lactentes expostos in utero ao omeprazol que apresentavam alguma malformação, baixo peso ao nascer, baixo índice de Apgar ou hospitalização foi semelhante ao observado nesta população. O número de bebês nascidos com defeitos do septo ventricular e o número de bebês natimortos foi ligeiramente maior nos bebês expostos ao omeprazol do que o número esperado nesta população.

Um estudo de coorte retrospectivo de base populacional abrangendo todos os nascidos vivos na Dinamarca de 1996 a 2009, relatou 1.800 nascidos vivos cujas mães usaram omeprazol durante o primeiro trimestre de gravidez e 837.317 nascidos vivos cujas mães não usaram nenhum inibidor da bomba de prótons. A taxa geral de defeitos congênitos em bebês nascidos de mães com exposição ao omeprazol no primeiro trimestre foi de 2,9% e 2,6% em bebês nascidos de mães não expostas a nenhum inibidor da bomba de prótons durante o primeiro trimestre.
Um estudo de coorte retrospectivo relatou 689 mulheres grávidas expostas a bloqueadores H2 ou omeprazol no primeiro trimestre (134 expostas ao omeprazol) e 1.572 mulheres grávidas não expostas a nenhum durante o primeiro trimestre. A taxa geral de malformações em filhos nascidos de mães com exposição no primeiro trimestre ao omeprazol, um bloqueador H2, ou não expostas foi de 3,6%, 5,5% e 4,1%, respectivamente.
Um pequeno estudo de coorte observacional prospectivo acompanhou 113 mulheres expostas ao omeprazol durante a gravidez (89% com exposições no primeiro trimestre). A taxa relatada de malformações congênitas maiores foi de 4% no grupo omeprazol, 2% nos controles expostos a não teratógenos e 2,8% nos controles pareados com doenças. As taxas de abortos espontâneos e eletivos, partos prematuros, idade gestacional no parto e peso médio ao nascer foram semelhantes entre os grupos.
Vários estudos não relataram efeitos adversos aparentes de curto prazo no lactente quando omeprazol em dose única oral ou intravenosa foi administrado a mais de 200 mulheres grávidas como pré-medicação para cesariana sob anestesia geral.
Dados de animais
Omeprazol
Estudos reprodutivos realizados com omeprazol em ratos com doses orais de até 138 mg/kg/dia (cerca de 34 vezes uma dose oral humana de 40 mg com base na área de superfície corporal) e em coelhos com doses de até 69,1 mg/kg/dia ( cerca de 34 vezes uma dose oral humana de 40 mg com base na área de superfície corporal) durante a organogênese não revelou qualquer evidência de potencial teratogênico do omeprazol. Em coelhos, omeprazol em uma faixa de dose de 6,9 a 69,1 mg/kg/dia (cerca de 3,4 a 34 vezes uma dose oral humana de 40 mg com base na área de superfície corporal) administrado durante a organogênese produziu aumentos relacionados à dose na letalidade embrionária, reabsorções fetais e interrupções da gravidez. Em ratos, toxicidade embrio-fetal relacionada à dose e toxicidade de desenvolvimento pós-natal foram observadas em descendentes resultantes de pais tratados com omeprazol em 13,8 a 138,0 mg/kg/dia (cerca de 3,4 a 34 vezes uma dose oral humana de 40 mg em uma superfície corporal base de área), administrado antes do acasalamento durante o período de lactação.
Esomeprazol
Não foram observados efeitos no desenvolvimento embriofetal em estudos de reprodução com esomeprazol magnésio em ratos em doses orais de até 280 mg/kg/dia (cerca de 68 vezes uma dose oral humana de 40 mg com base na área de superfície corporal) ou em coelhos em doses orais de até 86 mg/kg/dia (cerca de 41 vezes a dose humana com base na área de superfície corporal) administradas durante a organogênese.
Um estudo de toxicidade de desenvolvimento pré e pós-natal em ratos com parâmetros adicionais para avaliar o desenvolvimento ósseo foi realizado com esomeprazol magnésio em doses orais de 14 a 280 mg/kg/dia (cerca de 3,4 a 68 vezes uma dose oral humana de 40 mg em um corpo base de área de superfície). A sobrevivência neonatal/pós-natal precoce (do nascimento ao desmame) foi diminuída em doses iguais ou superiores a 138 mg/kg/dia (cerca de 34 vezes uma dose oral humana de 40 mg com base na área de superfície corporal). O peso corporal e o ganho de peso corporal foram reduzidos e atrasos no desenvolvimento neurocomportamental ou geral no período imediato pós-desmame foram evidentes em doses iguais ou superiores a 69 mg/kg/dia (cerca de 17 vezes uma dose oral humana de 40 mg em um base de área de superfície). Além disso, diminuição do comprimento do fêmur, largura e espessura do osso cortical, diminuição da espessura da placa de crescimento tibial e hipocelularidade mínima a leve da medula óssea foram observadas em doses iguais ou superiores a 14 mg/kg/dia (cerca de 3,4 vezes uma dose oral humana dose de 40 mg com base na área de superfície corporal). A displasia fisária no fêmur foi observada em descendentes de ratos tratados com doses orais de esomeprazol magnésio em doses iguais ou superiores a 138 mg/kg/dia (cerca de 34 vezes uma dose oral humana de 40 mg com base na área de superfície corporal).
Efeitos no osso materno foram observados em ratas grávidas e lactantes em um estudo de toxicidade pré e pós-natal quando esomeprazol magnésio foi administrado em doses orais de 14 a 280 mg/kg/dia (cerca de 3,4 a 68 vezes uma dose oral humana de 40 mg em uma base de área de superfície corporal). Quando os ratos foram administrados desde o 7º dia gestacional até o desmame no 21º dia pós-natal, uma diminuição estatisticamente significativa no peso do fêmur materno de até 14% (em comparação com o tratamento com placebo) foi observada em doses iguais ou superiores a 138 mg/kg/dia (cerca de 34 vezes uma dose oral humana de 40 mg com base na área de superfície corporal).
Um estudo de desenvolvimento pré e pós-natal em ratos com esomeprazol estrôncio (usando doses equimolares em comparação com o estudo de esomeprazol magnésio) produziu resultados semelhantes em mães e filhotes, conforme descrito acima.
Um estudo de toxicidade de desenvolvimento de acompanhamento em ratos com pontos de tempo adicionais para avaliar o desenvolvimento ósseo do filhote desde o dia 2 pós-natal até a idade adulta foi realizado com esomeprazol magnésio em doses orais de 280 mg/kg/dia (cerca de 68 vezes uma dose oral humana de 40 mg em uma base de área de superfície corporal) onde a administração de esomeprazol foi a partir do 7º dia gestacional ou 16º dia gestacional até o parto. Quando a administração materna foi confinada apenas à gestação, não houve efeitos na morfologia da fise óssea na prole em qualquer idade.
Lactação
Resumo do risco
O esomeprazol é o isômero S do omeprazol e dados limitados sugerem que o omeprazol pode estar presente no leite humano. Não existem dados clínicos sobre os efeitos do esomeprazol no lactente ou na produção de leite. Os benefícios do aleitamento materno para o desenvolvimento e para a saúde devem ser considerados juntamente com a necessidade clínica da mãe de NEXIUM 20mg e quaisquer potenciais efeitos adversos no lactente de NEXIUM ou da condição materna subjacente.
Uso Pediátrico
segurança e a eficácia de NEXIUM 20mg IV foram estabelecidas em pacientes pediátricos de 1 mês a 17 anos de idade para o tratamento a curto prazo da DRGE com EE, como alternativa à terapia oral quando NEXIUM 40mg oral não é possível ou apropriado.
O uso de NEXIUM 40mg IV nessa faixa etária é baseado na extrapolação da eficácia de adultos para crianças e na seleção da dose com base na correspondência de exposição de pediatria a adultos apoiada pelas seguintes evidências: a) resultados observados de um estudo farmacocinético (PK) em NEXIUM 20mg IV para injeção em pacientes pediátricos, b) previsões de um modelo de farmacocinética populacional comparando dados de farmacocinética IV entre pacientes adultos e pediátricos, ec) relação entre exposição e resultados farmacodinâmicos obtidos de dados orais de adultos e pediátricos e d) resultados de farmacocinética de estudos adequados e bem controlados que apoiaram a aprovação de NEXIUM 40mg IV em adultos [ver REAÇÕES ADVERSAS , FARMACOLOGIA CLÍNICA , Estudos clínicos ].
segurança e eficácia de NEXIUM IV não foram estabelecidas em pacientes com menos de 1 mês de idade para o tratamento da DRGE com EE ou para redução do risco de ressangramento de úlcera gástrica ou duodenal após endoscopia terapêutica.
Dados de animais juvenis
Em um estudo de toxicidade em ratos jovens, esomeprazol foi administrado com sais de magnésio e estrôncio em doses orais de cerca de 34 a 68 vezes uma dose diária humana de 40 mg com base na área de superfície corporal. Aumentos na mortalidade foram observados com a dose alta e, em todas as doses de esomeprazol, houve diminuição no peso corporal, ganho de peso corporal, peso do fêmur e comprimento do fêmur, e diminuição no crescimento geral [ver Toxicologia não clínica ].
Uso Geriátrico
Em um ensaio clínico de pacientes com sangramento de úlceras gástricas ou duodenais, 52% dos 375 pacientes randomizados para NEXIUM IV tinham 65 anos de idade ou mais. Não foram observadas diferenças gerais na segurança e eficácia entre idosos e indivíduos mais jovens, e outras experiências clínicas relatadas com NEXIUM 40mg IV e esomeprazol oral não identificaram diferenças nas respostas entre pacientes idosos e mais jovens, mas a maior sensibilidade de alguns indivíduos mais velhos não pode ser descartado.
Insuficiência hepática
DRGE com EE
A exposição ao esomeprazol aumentou substancialmente em pacientes com insuficiência hepática grave (Child-Pugh Classe C), mas não em pacientes com insuficiência hepática leve a moderada (Child-Pugh Classes A e B) em comparação com pacientes com função hepática normal [ver FARMACOLOGIA CLÍNICA ].
Para pacientes adultos, nenhum ajuste de dose é necessário para insuficiência hepática leve a moderada. Para pacientes com insuficiência hepática grave, a dose máxima recomendada é de 20 mg uma vez ao dia [ver DOSAGEM E ADMINISTRAÇÃO ].
Redução do risco de ressangramento de úlceras gástricas ou duodenais após endoscopia terapêutica
Não há dados farmacocinéticos disponíveis para NEXIUM 20mg IV administrado como administração intravenosa contínua em pacientes com insuficiência hepática. A exposição ao omeprazol intravenoso, do qual o esomeprazol é um enantiômero, aumentou em pacientes com todos os graus de insuficiência hepática em comparação com indivíduos com função hepática normal. FARMACOLOGIA CLÍNICA ].
Para pacientes adultos, nenhum ajuste de dose da dose inicial de NEXIUM IV 80 mg é necessário para pacientes com qualquer grau de insuficiência hepática. Reduzir a taxa de infusão contínua para 6 mg/hora para pacientes com insuficiência hepática leve a moderada (Child-Pugh Classes A e B) e para 4 mg/hora para pacientes com insuficiência hepática grave (Child-Pugh Classe C) [ver DOSAGEM E ADMINISTRAÇÃO ].
SOBREDOSAGEM
Os sintomas descritos em relação à sobredosagem deliberada de NEXIUM 40 mg (experiência limitada de doses superiores a 240 mg/dia) são transitórios. Relatos de superdosagem com omeprazol em humanos também podem ser relevantes. As doses variaram até 2.400 mg (120 vezes a dose clínica habitualmente recomendada). As manifestações foram variáveis, mas incluíram confusão, sonolência, visão turva, taquicardia, náusea, sudorese, rubor, dor de cabeça, boca seca e outras reações adversas semelhantes às observadas nas dosagens recomendadas. Consulte as informações completas de prescrição do omeprazol oral para obter informações de segurança completas. Nenhum antídoto específico para o esomeprazol é conhecido. Uma vez que o esomeprazol é extensivamente ligado às proteínas, não se espera que seja removido por diálise. Em caso de sobredosagem, o tratamento deve ser sintomático e de suporte.
Se ocorrer superexposição, ligue para o Centro de Controle de Intoxicações pelo telefone 1-800-222-1222 para obter informações atualizadas sobre o gerenciamento de envenenamento ou superdosagem.
CONTRA-INDICAÇÕES
- NEXIUM 20mg IV é contraindicado em pacientes com hipersensibilidade conhecida a benzimidazóis substituídos ou a qualquer componente da formulação. As reações de hipersensibilidade podem incluir anafilaxia, choque anafilático, angioedema, broncoespasmo, nefrite tubulointersticial aguda e urticária. AVISOS E PRECAUÇÕES , REAÇÕES ADVERSAS ].
- Os inibidores da bomba de prótons (IBPs), incluindo NEXIUM 20mg IV, são contraindicados em pacientes recebendo produtos contendo rilpivirina [ver INTERAÇÕES MEDICAMENTOSAS ].
FARMACOLOGIA CLÍNICA
Mecanismo de ação
esomeprazol pertence a uma classe de compostos antissecretores, os benzimidazóis substituídos, que suprimem a secreção de ácido gástrico por inibição específica do sistema enzimático H+/K+ ATPase na superfície secretora da célula parietal gástrica. O esomeprazol é protonado e convertido no compartimento ácido da célula parietal formando o inibidor ativo, a sulfenamida aquiral. Como esse sistema enzimático é considerado a bomba de ácido (próton) dentro da mucosa gástrica, o esomeprazol tem sido caracterizado como um inibidor da bomba de ácido gástrico, pois bloqueia a etapa final da produção de ácido. Este efeito está relacionado com a dose e leva à inibição da secreção ácida basal e estimulada, independentemente do estímulo.
Farmacodinâmica
Atividade antisecretora
O efeito do esomeprazol no pH intragástrico de 24 horas em indivíduos saudáveis foi avaliado em dois estudos de 20 mg e 40 mg de NEXIUM 20 mg IV infundidos por via intravenosa uma vez ao dia durante 30 minutos por 5 dias, conforme mostrado na Tabela 7.
Os efeitos do esomeprazol no pH intragástrico de 24 horas após a administração de uma infusão intravenosa de 80 mg de NEXIUM.IV por 30 minutos seguido de uma infusão contínua de 8 mg/hora por 23,5 horas foram avaliados em dois estudos.
Em indivíduos caucasianos saudáveis H. pylori negativos (n=24), a % de tempo em 24 horas (IC 95%) quando o pH intragástrico foi > 6 e > 7 foi de 52,3% (40,3, 64,4) e 4,8% (1,8, 7.8), respectivamente.
Em indivíduos chineses saudáveis positivos para H. pylori (n = 8) e negativos para H. pylori (n = 11), a % de tempo em 24 horas (IC 95%) quando o pH intragástrico foi > 6 e > 7 foi de 53% ( 45,6, 60,3) e 15,1% (9,5, 20,7). A porcentagem de tempo com pH intragástrico > 6 [59% vs. 47%] e com pH > 7 [17% vs. 11%] tendeu a ser maior nos indivíduos positivos para H. pylori em comparação com indivíduos negativos para H. pylori.
Efeitos da gastrina sérica
efeito do esomeprazol nas concentrações séricas de gastrina foi avaliado em aproximadamente 2.700 pacientes em ensaios clínicos de esomeprazol oral por até 8 semanas e em mais de 1.300 pacientes tratados por até 12 meses. O nível médio de gastrina em jejum aumentou de maneira relacionada à dose. O aumento nas concentrações séricas de gastrina atingiu um platô dentro de dois a três meses de terapia e retornou aos níveis basais dentro de quatro semanas após a descontinuação da terapia.
O aumento da gastrina causa hiperplasia de células semelhantes a enterocromafins e aumento dos níveis séricos de Cromogranina A (CgA). Os níveis aumentados de CgA podem causar resultados falso-positivos em investigações diagnósticas para tumores neuroendócrinos [ver AVISOS E PRECAUÇÕES ].
Efeitos de células semelhantes à enterocromafina (ECL)
Não existem dados disponíveis sobre os efeitos do esomeprazol intravenoso nas células ECL.
Amostras de biópsia gástrica humana foram obtidas de mais de 3.000 pacientes (crianças e adultos) tratados oralmente com omeprazol em ensaios clínicos de longo prazo. A incidência de hiperplasia de células ECL nesses estudos aumentou com o tempo; no entanto, nenhum caso de carcinoides de células ECL, displasia ou neoplasia foi encontrado nesses pacientes [ver Toxicologia não clínica ].
Em mais de 1.000 pacientes tratados com esomeprazol oral (10 mg, 20 mg ou 40 mg/dia) por até 12 meses, a prevalência de hiperplasia de células ECL aumentou com o tempo e a dose. Nenhum paciente desenvolveu carcinoides de células ECL, displasia ou neoplasia na mucosa gástrica.
Efeitos Endócrinos
esomeprazol não teve efeito sobre a função da tireoide quando administrado em doses orais de 20 mg ou 40 mg por 4 semanas. Outros efeitos do esomeprazol no sistema endócrino foram avaliados em estudos com omeprazol. Doses orais de omeprazol 30 mg ou 40 mg por dia por 2 a 4 semanas não tiveram efeito sobre o metabolismo de carboidratos, níveis circulantes de hormônio da paratireoide, cortisol, estradiol, testosterona, prolactina, colecistocinina ou secretina.
Farmacocinética
Absorção
A farmacocinética do esomeprazol em indivíduos saudáveis após a administração de NEXIUM IV 20 mg e 40 mg uma vez ao dia como infusão intravenosa durante 30 minutos por 5 dias é mostrada na Tabela 8.
Após a administração intravenosa de NEXIUM 40mg IV em 24 indivíduos saudáveis como uma dose de ataque de 80 mg durante 30 minutos, seguida por uma infusão contínua de 8 mg/hora por 23,5 horas (para um total de 24 horas), os parâmetros farmacocinéticos do esomeprazol [valor médio geométrico (IC de 95%)] foram os seguintes: AUCt 111,1 micromol*h/L (100,5, 122,7 micromol*h/L), Cmax 15,0 micromol/L (13,5, 16,6 micromol/L) e concentração plasmática em estado estacionário (Css) 3,9 micromol/L (3,5, 4,5 micromol/L). Em outro estudo de indivíduos caucasianos saudáveis administraram o mesmo regime de tratamento.
esomeprazol é um inibidor do CYP2C19 dependente do tempo, resultando em autoinibição e farmacocinética não linear. A exposição sistêmica aumenta de forma mais do que proporcional à dose após múltiplas doses orais de esomeprazol. Em comparação com a primeira dose, a exposição sistêmica (Cmax e AUC0-24h) no estado de equilíbrio após a administração de uma vez ao dia aumentou em 43% e 90%, respectivamente, em comparação com após a primeira dose para a dose de 20 mg e aumentou em 95% e 159%, respectivamente, para a dose de 40 mg.
Distribuição
O esomeprazol está 97% ligado às proteínas plasmáticas. A ligação às proteínas plasmáticas é constante na faixa de concentração de 2 a 20 micromol/L. O volume aparente de distribuição no estado de equilíbrio em indivíduos saudáveis é de aproximadamente 16 L.
Eliminação
Metabolismo
esomeprazol é extensamente metabolizado no fígado pelo sistema enzimático do citocromo P450 (CYP). Os metabólitos do esomeprazol não possuem atividade antissecretora. A maior parte do metabolismo do esomeprazol é dependente da isoenzima CYP2C19, que forma os metabólitos hidroxi e desmetil. A quantidade restante depende do CYP3A4 que forma o metabólito sulfona.
Excreção
O esomeprazol é excretado como metabólitos principalmente na urina, mas também nas fezes. Menos de 1% da droga original é excretada na urina. O esomeprazol é completamente eliminado do plasma e não há acúmulo durante a administração uma vez ao dia. A meia-vida de eliminação plasmática do esomeprazol após administração intravenosa de NEXIUM IV é de aproximadamente 1,1 a 1,4 horas e é prolongada com doses crescentes.
depuração plasmática (CL) é de aproximadamente 5,9 a 7,2 L/h durante a administração de NEXIUM 40 mg IV como uma infusão intravenosa de 80 mg durante 30 minutos, seguida de uma infusão contínua de 8 mg/hora por 23,5 horas.
Populações Específicas
Pacientes Geriátricos
Os valores de AUC e Cmax de esomeprazol foram ligeiramente mais elevados (25% e 18%, respectivamente) em idosos em comparação com indivíduos mais jovens no estado de equilíbrio. Este aumento na exposição não é considerado clinicamente relevante.
Pacientes pediátricos
A farmacocinética do esomeprazol foi avaliada em 50 pacientes pediátricos do nascimento aos 17 anos de idade, inclusive (dos quais 44 pacientes pediátricos tinham 1 mês a 17 anos) em um estudo randomizado, aberto, multinacional, de dose múltipla de 20 mg de NEXIUM 40mg IV administrado como uma injeção intravenosa de 3 minutos uma vez ao dia. Os valores plasmáticos de AUC de esomeprazol foram 183% e 60% maiores em pacientes pediátricos com idades entre 6 e 11 anos e 12 a 17 anos, respectivamente, em comparação com adultos.
Análises farmacocinéticas subsequentes previram que os seguintes regimes de dosagem alcançariam exposições plasmáticas em estado de equilíbrio (AUC0-24) comparáveis às observadas em pacientes adultos administrados 20 mg de NEXIUM IV uma vez ao dia: 0,5 mg/kg uma vez ao dia para pacientes pediátricos de 1 mês a 11 meses de idade, 10 mg uma vez ao dia para pacientes pediátricos de 1 ano a 17 anos com peso corporal inferior a 55 kg e 20 mg uma vez ao dia para pacientes pediátricos de 1 ano a 17 anos com peso corporal de 55 kg e superior. O aumento da duração da infusão de 3 minutos para 10 minutos ou 30 minutos foi previsto para produzir valores de Cmax no estado de equilíbrio que foram comparáveis aos observados em pacientes adultos nas doses de 40 mg e 20 mg de NEXIUM IV, respectivamente [ver Uso em populações específicas ].
Pacientes Masculinos e Femininos
Os valores de AUC e Cmax de esomeprazol foram ligeiramente superiores (13%) em mulheres do que em homens no estado estacionário quando administrado por via oral. Diferenças semelhantes foram observadas para a administração intravenosa de esomeprazol. Este aumento na exposição não é considerado clinicamente relevante.
Pacientes com Insuficiência Renal
Não se espera que a farmacocinética de esomeprazol em pacientes com insuficiência renal seja alterada em relação a indivíduos saudáveis, pois menos de 1% de esomeprazol é excretado inalterado na urina.
Pacientes com Insuficiência Hepática
farmacocinética do estado de equilíbrio do esomeprazol obtida após a administração de 40 mg por via oral uma vez ao dia a 4 pacientes com insuficiência hepática leve (Child-Pugh Classe A), moderada (Child-Pugh Classe B) e grave (Child-Pugh Classe C) foi comparados aos obtidos em 36 pacientes com DRGE masculinos e femininos com função hepática normal. Em pacientes com insuficiência hepática leve e moderada, as AUCs estavam dentro do intervalo que poderia ser esperado em pacientes com função hepática normal. Em pacientes com insuficiência hepática grave, as AUCs foram 2 a 3 vezes maiores do que em pacientes com função hepática normal. [Vejo Uso em populações específicas ].
Não há dados farmacocinéticos disponíveis para esomeprazol administrado como administração intravenosa contínua em pacientes com insuficiência hepática. A farmacocinética do omeprazol intravenoso 80 mg infundido em 30 minutos, seguido de 8 mg/hora em 47,5 horas em pacientes com quadros leves (Child-Pugh Classe A; n=5), moderados (Child-Pugh Classe B; n=4) e insuficiência hepática grave (Child-Pugh Classe C; n=3) foram comparados com os obtidos em 24 indivíduos saudáveis do sexo masculino e feminino. Em pacientes com insuficiência hepática leve e moderada, a depuração do omeprazol e a concentração plasmática no estado de equilíbrio foram aproximadamente 35% menores e 50% maiores, respectivamente, do que em indivíduos saudáveis. Em pacientes com insuficiência hepática grave, a depuração do omeprazol foi 50% daquela em indivíduos saudáveis e a concentração plasmática no estado de equilíbrio foi o dobro da de indivíduos saudáveis [ver Uso em populações específicas ].
Estudos de interação medicamentosa
Efeito do esomeprazol/omeprazol em outras drogas
Estudos in vitro e in vivo mostraram que o esomeprazol provavelmente não inibe os CYPs 1A2, 2A6, 2C9, 2D6, 2E1 e 3A4.
Antirretrovirais
Para alguns medicamentos antirretrovirais, como rilpivirina, atazanavir e nelfinavir, foram relatadas concentrações séricas diminuídas quando administradas em conjunto com omeprazol [ver INTERAÇÕES MEDICAMENTOSAS ].
Rilpivirina
Após múltiplas doses de rilpivirina (150 mg, diariamente) e omeprazol (20 mg, diariamente), a AUC foi diminuída em 40%, Cmax em 40% e Cmin em 33% para rilpivirina [ver CONTRA-INDICAÇÕES ].
Nelfinavir
Após múltiplas doses de nelfinavir (1250 mg, duas vezes ao dia) e omeprazol (40 mg por dia), a AUC foi diminuída em 36% e 92%, Cmax em 37% e 89% e Cmin em 39% e 75%, respectivamente, para nelfinavir e M8 .
Atazanavir
Após múltiplas doses de atazanavir (400 mg, diariamente) e omeprazol (40 mg, diariamente, 2 horas antes do atazanavir), a AUC foi reduzida em 94%, a Cmax em 96% e a Cmin em 95%.
Saquinavir
Após doses múltiplas de saquinavir/ritonavir (1000/100 mg) duas vezes ao dia durante 15 dias com omeprazol 40 mg por dia coadministrado nos dias 11 a 15. A AUC foi aumentada em 82%, Cmax em 75% e Cmin em 106%. O mecanismo por trás dessa interação não está totalmente elucidado.
Clopidogrel
Em um estudo cruzado, indivíduos saudáveis receberam clopidogrel (dose de ataque de 300 mg seguido de 75 mg por dia como dosagem de manutenção por 28 dias) sozinho e com esomeprazol (40 mg por via oral uma vez ao dia ao mesmo tempo que clopidogrel) por 29 dias. A exposição ao metabólito ativo do clopidogrel foi reduzida em 35% a 40% durante esse período quando clopidogrel e esomeprazol foram administrados juntos. Os parâmetros farmacodinâmicos também foram medidos e demonstraram que a alteração na inibição da agregação plaquetária estava relacionada à alteração na exposição ao metabólito ativo do clopidogrel [ver AVISOS E PRECAUÇÕES , INTERAÇÕES MEDICAMENTOSAS ].
Micofenolato Mofetil
administração de omeprazol 20 mg duas vezes ao dia por 4 dias e uma dose única de 1.000 mg de MMF aproximadamente uma hora após a última dose de omeprazol a 12 indivíduos saudáveis em um estudo cruzado resultou em uma redução de 52% na Cmax e 23% de redução na AUC da AMP [ver INTERAÇÕES MEDICAMENTOSAS ].
Cilostazol
Omeprazol atua como um inibidor do CYP2C19. Omeprazol, administrado em doses de 40 mg por dia durante uma semana a 20 indivíduos saudáveis em estudo cruzado, aumentou a Cmax e a AUC do cilostazol em 18% e 26%, respetivamente. A Cmax e a AUC de um dos metabólitos ativos, 3,4-di-hidro-cilostazol, que tem 4-7 vezes a atividade do cilostazol, foram aumentadas em 29% e 69%, respectivamente. Espera-se que a coadministração de cilostazol com omeprazol aumente as concentrações de cilostazol e do metabólito ativo mencionado acima [ver INTERAÇÕES MEDICAMENTOSAS ].
Diazepam
coadministração de 30 mg de esomeprazol e diazepam, um substrato do CYP2C19, resultou em uma diminuição de 45% na depuração do diazepam. Níveis plasmáticos aumentados de diazepam foram observados 12 horas após a administração e em diante. No entanto, naquela época, os níveis plasmáticos de diazepam estavam abaixo do intervalo terapêutico e, portanto, é improvável que essa interação tenha relevância clínica.
Digoxina
A administração concomitante de omeprazol 20 mg uma vez ao dia e digoxina em indivíduos saudáveis aumentou a biodisponibilidade da digoxina em 10% (30% em dois indivíduos) [ver INTERAÇÕES MEDICAMENTOSAS ].
Outras drogas
A administração concomitante de esomeprazol e de naproxeno (AINE não seletivo) não identificou nenhuma alteração clinicamente relevante nos perfis farmacocinéticos desses AINEs.
Efeito de outras drogas no esomeprazol/omeprazol
Erva de São João
Em um estudo cruzado em 12 indivíduos saudáveis do sexo masculino, Erva de São João (300 mg três vezes ao dia por 14 dias) diminuiu significativamente a exposição sistêmica de omeprazol em metabolizadores fracos de CYP2C19 (Cmax e AUC diminuíram em 37,5% e 37,9 %, respectivamente) e metabolizadores extensos (Cmax e AUC diminuíram em 49,6% e 43,9%, respectivamente) [ver INTERAÇÕES MEDICAMENTOSAS ].
Voriconazol
A administração concomitante de omeprazol e voriconazol (um inibidor combinado de CYP2C19 e CYP3A4) resultou em mais que o dobro da exposição ao omeprazol. Quando o voriconazol (400 mg a cada 12 horas por um dia, seguido de 200 mg uma vez ao dia por 6 dias) foi administrado com omeprazol (40 mg uma vez ao dia por 7 dias) a indivíduos saudáveis, a Cmax no estado de equilíbrio e AUC0-24 do omeprazol aumentou significativamente: uma média de 2 vezes (IC 90%: 1,8, 2,6) e 4 vezes (IC 90%: 3,3, 4,4), respectivamente, em comparação com quando omeprazol foi administrado sem voriconazol [ver INTERAÇÕES MEDICAMENTOSAS ].
Outras drogas
coadministração de esomeprazol com contraceptivos orais, diazepam, fenitoína, quinidina, naproxeno (AINE não seletivo) não pareceu alterar o perfil farmacocinético de esomeprazol.
Microbiologia
Efeitos na Ecologia Microbiana Gastrointestinal
A diminuição da acidez gástrica devido a qualquer meio, incluindo inibidores da bomba de prótons, aumenta a contagem gástrica de bactérias normalmente presentes no trato gastrointestinal. O tratamento com inibidores da bomba de prótons pode levar a um risco ligeiramente aumentado de infecções gastrointestinais, como Salmonella e Campylobacter e, em pacientes hospitalizados, possivelmente também Clostridium difficile.
Farmacogenômica
CYP2C19, uma enzima polimórfica, está envolvida no metabolismo do esomeprazol. O alelo CYP2C19*1 é totalmente funcional, enquanto os alelos CYP2C19*2 e *3 não são funcionais. Existem outros alelos associados com função enzimática nula ou reduzida. Pacientes portadores de dois alelos totalmente funcionais são metabolizadores extensos e aqueles portadores de dois alelos de perda de função são metabolizadores fracos. A exposição sistêmica ao esomeprazol varia com o estado do metabolismo do paciente: metabolizadores fracos > metabolizadores intermediários > metabolizadores extensos. Aproximadamente 3% dos caucasianos e 15 a 20% dos asiáticos são metabolizadores fracos de CYP2C19.
As exposições sistêmicas de esomeprazol foram modestamente maiores (aproximadamente 17%) em metabolizadores intermediários de CYP2C19 (IM; n=6) em comparação com metabolizadores extensos (EM; n=17) de CYP2C19. Diferenças farmacocinéticas semelhantes foram observadas entre esses genótipos em um estudo de indivíduos saudáveis chineses que incluiu 7 EMs e 11 MIs. Há informações farmacocinéticas muito limitadas para metabolizadores fracos (PM) desses estudos.
No estado de equilíbrio após a administração uma vez ao dia de NEXIUM 40 mg IV 40 mg, a proporção de AUC em metabolizadores fracos para AUC no resto da população (EMs) é de aproximadamente 1,5. Esta alteração na exposição não é considerada clinicamente significativa.
Toxicologia e/ou Farmacologia Animal
Estudos de reprodução
Estudos de reprodução foram realizados em ratos com doses orais de até 280 mg/kg/dia (cerca de 68 vezes uma dose oral humana de 40 mg com base na área de superfície corporal) e em coelhos com doses orais de até 86 mg/kg/dia (cerca de 42 vezes uma dose oral humana de 40 mg com base na área de superfície corporal) e não revelaram evidências de diminuição da fertilidade ou danos ao feto devido ao esomeprazol [ver Uso em populações específicas ].
Estudo de animais juvenis
Um estudo de toxicidade de 28 dias com uma fase de recuperação de 14 dias foi realizado em ratos jovens com esomeprazol magnésio em doses de 70 a 280 mg/kg/dia (cerca de 17 a 68 vezes uma dose oral diária humana de 40 mg em uma superfície corporal base de área). Um aumento no número de mortes na dose alta de 280 mg/kg/dia foi observado quando ratos juvenis receberam esomeprazol magnésio do dia 7 pós-natal até o dia 35 pós-natal. Além disso, doses iguais ou superiores a 140 mg/kg/ dia (cerca de 34 vezes uma dose oral humana diária de 40 mg com base na área de superfície corporal), produziu reduções relacionadas ao tratamento no peso corporal (aproximadamente 14%) e ganho de peso corporal, diminuições no peso do fêmur e comprimento do fêmur e afetou globalmente crescimento. Achados comparáveis descritos acima também foram observados neste estudo com outro sal de esomeprazol, esomeprazol estrôncio, em doses equimolares de esomeprazol.
Estudos clínicos
Supressão ácida na DRGE
Quatro estudos multicêntricos, abertos e cruzados de dois períodos foram conduzidos para comparar os efeitos farmacodinâmicos do esomeprazol após administração intravenosa ou oral na supressão ácida em 206 pacientes com sintomas de DRGE com ou sem esofagite erosiva. Os pacientes foram randomizados para receber 20 ou 40 mg de NEXIUM 40 mg IV ou esomeprazol oral uma vez ao dia por 10 dias (Período 1) e, em seguida, foram trocados no Período 2 para a outra formulação por 10 dias, correspondendo às respectivas doses do Período 1. NEXIUM 40 mg IV 20 mg e 40 mg foram administrados como uma injeção de 3 minutos em dois dos estudos e como uma infusão de 15 minutos nos outros dois estudos.
população de pacientes variou de 18 a 72 anos; 54% eram do sexo feminino; 53% caucasianos, 24% negros, 5% asiáticos e 17% de outras raças. A produção de ácido basal (BAO) e a produção de ácido máxima (MAO) foram determinadas 22 a 24 horas após a dose no Período 1, Dia 11; no Período 2, Dia 3; e no Período 2, Dia 11. BAO e MAO foram estimados a partir de 1 hora de coletas contínuas de conteúdo gástrico antes e após (respectivamente) injeção subcutânea de 6,0 mcg/kg de pentagastrina.
Nesses estudos, após 10 dias de administração uma vez ao dia, NEXIUM IV 20 mg e 40 mg foram semelhantes à dosagem oral correspondente de esomeprazol em sua capacidade de suprimir BAO e MAO nesses pacientes com DRGE (ver Tabela 9 abaixo).
Não houve grandes alterações na supressão ácida ao alternar entre as formas de dosagem intravenosa e oral.
Sangramento de úlceras gástricas ou duodenais
Um estudo clínico randomizado, duplo-cego e controlado por placebo foi realizado em 764 pacientes que apresentavam sangramento de úlcera gástrica ou duodenal confirmado por endoscopia. A população era de 18 a 98 anos; 68% eram do sexo masculino, 87% caucasianos, 1% negros, 7% asiáticos e 4% de outra raça. Após hemostasia endoscópica, os pacientes foram randomizados para placebo ou NEXIUM IV 80 mg como infusão intravenosa durante 30 minutos, seguido de infusão contínua de 8 mg/hora por um total de 72 horas. Após o período inicial de 72 horas, todos os pacientes receberam IBP oral por 27 dias. A ocorrência de ressangramento dentro de 3 dias após a randomização foi de 5,9% no grupo tratado com NEXIUM 20mg IV em comparação com 10,3% para o grupo placebo (diferença de tratamento -4,4%; intervalo de confiança de 95%: -8,3%, -0,6%; p = 0,03 ). Esta diferença de tratamento foi semelhante à observada no Dia 7 e Dia 30, durante os quais todos os pacientes estavam recebendo um IBP oral.
Um estudo de centro único randomizado, duplo-cego e controlado por placebo realizado em Hong Kong também demonstrou uma redução em comparação ao placebo no risco de ressangramento em 72 horas em pacientes com sangramento de úlceras gástricas ou duodenais que receberam omeprazol racêmico, 50% do qual é o S-enantiômero esomeprazol.
INFORMAÇÃO DO PACIENTE
Reações adversas
Aconselhe os pacientes a relatar ao seu médico se apresentarem quaisquer sinais ou sintomas consistentes com:
- Reações de hipersensibilidade [ver CONTRA-INDICAÇÕES ]
- Nefrite Tubulointersticial Aguda [ver AVISOS E PRECAUÇÕES ]
- Diarreia Associada a Clostridium difficile [ver AVISOS E PRECAUÇÕES ]
- Fratura Óssea [ver AVISOS E PRECAUÇÕES ]
- Reações Adversas Cutâneas Graves [ver AVISOS E PRECAUÇÕES ].
- Lúpus Eritematoso Cutâneo e Sistêmico [ver AVISOS E PRECAUÇÕES ]
- Hipomagnesemia e Metabolismo Mineral [ver AVISOS E PRECAUÇÕES ]
Interações medicamentosas
Aconselhe os pacientes a relatar ao seu médico antes de iniciar o tratamento com qualquer um dos seguintes:
- Produtos contendo rilpivirina [ver CONTRA-INDICAÇÕES ]
- Clopidogrel [ver AVISOS E PRECAUÇÕES ]
- Erva de São João ou rifampina [ver AVISOS E PRECAUÇÕES ]
- Metotrexato em altas doses [ver AVISOS E PRECAUÇÕES ]
Administração
- Informe os pacientes que antiácidos podem ser usados enquanto estiver tomando NEXIUM 40mg IV
