Pepcid 20mg, 40mg Famotidine Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Pepcid e como é usado?
Pepcid (famotidina) é usado para tratar azia, DRGE e síndrome de Zollinger-Ellison. Está disponível ao balcão. Pepcid 20mg está disponível como genérico.
Quais são os possíveis efeitos colaterais do uso de Pepcid?
Os efeitos colaterais são incomuns, mas podem incluir:
- fadiga,
- vômito,
- náusea,
- desconforto abdominal,
- anorexia,
- boca seca,
- erupção cutânea, e
- cãibras musculares
DESCRIÇÃO
O ingrediente ativo do PEPCID® (famotidina) é um antagonista do receptor H2 da histamina. Famotidina é N'(aminossulfonil)-3-[[[2-[(diaminometileno)amino]-4-tiazolil]metil]tio]propanimidamida. A fórmula empírica da famotidina é C8H15N7O2S3 e seu peso molecular é 337,43. Sua fórmula estrutural é:
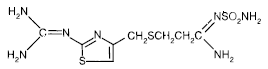
A famotidina é um composto cristalino branco a amarelo pálido que é livremente solúvel em ácido acético glacial, ligeiramente solúvel em metanol, muito pouco solúvel em água e praticamente insolúvel em etanol.
Cada comprimido para administração oral contém 20 mg ou 40 mg de famotidina e os seguintes ingredientes inativos: hidroxipropilcelulose, hipromelose, óxidos de ferro, estearato de magnésio, celulose microcristalina, amido de milho, talco, dióxido de titânio e cera de carnaúba.
INDICAÇÕES
PEPCID 40mg é indicado em:
DOSAGEM E ADMINISTRAÇÃO
Úlcera duodenal
Terapia aguda: dose oral recomendada para adultos para úlcera duodenal ativa é de 40 mg uma vez ao dia ao deitar. A maioria dos pacientes cura dentro de 4 semanas; raramente há razão para usar PEPCID na dosagem total por mais de 6 a 8 semanas. Um regime de 20 mg bid também é eficaz.
Terapia de manutenção: A dose oral recomendada para adultos é de 20 mg uma vez ao dia ao deitar.
Úlcera Gástrica Benigna
Terapia aguda: A dose oral recomendada para adultos para úlcera gástrica benigna ativa é de 40 mg uma vez ao dia ao deitar.
Doença do Refluxo Gastroesofágico (DRGE)
A dose oral recomendada para o tratamento de pacientes adultos com sintomas de DRGE é de 20 mg duas vezes por dia por até 6 semanas. A dose oral recomendada para o tratamento de pacientes adultos com esofagite, incluindo erosões e ulcerações e sintomas associados à DRGE é de 20 ou 40 mg duas vezes por dia por até 12 semanas (ver FARMACOLOGIA CLÍNICA em adultos , Estudos clínicos ).
Dosagem para pacientes pediátricos
Ver PRECAUÇÕES , Pacientes pediátricos
Os estudos descritos em PRECAUÇÕES, Pacientes Pediátricos
Dosagem para pacientes pediátricos de 1 a 16 anos de idade
Ver PRECAUÇÕES , Pacientes pediátricos 1-16 anos de idade.
Os estudos descritos em PRECAUÇÕES, pacientes pediátricos de 1 a 16 anos de idade sugerem as seguintes doses iniciais em pacientes pediátricos de 1 a 16 anos de idade:
úlcera péptica - 0,5 mg/kg/dia VO ao deitar ou duas vezes ao dia até 40 mg/dia.
Doença do Refluxo Gastroesofágico com ou sem esofagite incluindo erosões e ulcerações - 1,0 mg/kg/dia VO dividido por lance até 40 mg por lance
Embora estudos não controlados publicados sugiram a eficácia da famotidina no tratamento da doença do refluxo gastroesofágico e da úlcera péptica, os dados em pacientes pediátricos são insuficientes para estabelecer a porcentagem de resposta com a dose e a duração da terapia. Portanto, a duração do tratamento (inicialmente com base nas recomendações de duração do adulto) e a dose devem ser individualizadas com base na resposta clínica e/ou determinação do pH (gástrico ou esofágico) e endoscopia. Estudos clínicos não controlados publicados em pacientes pediátricos de 1-16 anos de idade empregaram doses de até 1 mg/kg/dia para úlcera péptica e 2 mg/kg/dia para DRGE com ou sem esofagite incluindo erosões e ulcerações.
Condições Patológicas Hipersecretórias (por exemplo, Síndrome de Zollinger-Ellison, Adenomas Endócrinos Múltiplos)
dosagem de PEPCID em pacientes com condições patológicas de hipersecreção varia com o paciente individual. A dose inicial oral recomendada para adultos para condições hipersecretórias patológicas é de 20 mg a cada 6 h. Em alguns pacientes, pode ser necessária uma dose inicial mais alta. As doses devem ser ajustadas às necessidades individuais do paciente e devem continuar enquanto clinicamente indicado. Doses de até 160 mg a cada 6 h foram administradas a alguns pacientes adultos com síndrome de Zollinger-Ellison grave.
Uso concomitante de antiácidos
Antiácidos podem ser administrados concomitantemente, se necessário.
Ajuste de dosagem para pacientes com insuficiência renal moderada ou grave
Em pacientes adultos com insuficiência renal moderada (clearance de creatinina
Com base na comparação dos parâmetros farmacocinéticos para PEPCID em pacientes adultos e pediátricos, deve ser considerado o ajuste de dose em pacientes pediátricos com insuficiência renal moderada ou grave.
COMO FORNECIDO
PEPCID 40mg Comprimidos 20 mg, são comprimidos revestidos por película de cor bege, quadrados arredondados, com código MSD numa das faces e lisos na outra. Eles são fornecidos da seguinte forma:
NDC 42998-639-09 unidade de uso frascos de 30 NDC 42998-639-98 unidade de uso frascos de 100.
Os comprimidos de PEPCID 40 mg, 40 mg, são comprimidos revestidos por película castanhos, redondos e quadrados, com código MSD numa das faces e lisos na outra. Eles são fornecidos da seguinte forma:
NDC 42998-649-09 unidade de uso frascos de 30 NDC 42998-649-98 unidade de uso frascos de 100. Armazenamento
Armazenar em temperatura ambiente controlada.
PEPCID® (famotidina) Comprimidos 20 mg e Comprimidos 40 mg são fabricados para: Marathon Pharmaceuticals, LLC, Northbrook, IL 60062, EUA. Emitido em fevereiro de 2014.
EFEITOS COLATERAIS
As reações adversas listadas abaixo foram relatadas durante ensaios clínicos nacionais e internacionais em aproximadamente 2.500 pacientes. Nos ensaios clínicos controlados em que os comprimidos de PEPCID 40 mg foram comparados com placebo, a incidência de experiências adversas no grupo que recebeu comprimidos de PEPCID, 40 mg ao deitar, foi semelhante à do grupo placebo.
As seguintes reações adversas foram relatadas em mais de 1% dos pacientes em terapia com PEPCID em ensaios clínicos controlados, e podem estar causalmente relacionadas ao medicamento: dor de cabeça (4,7%), tontura (1,3%), constipação (1,2% ) e diarreia (1,7%).
As seguintes outras reações adversas foram relatadas com pouca frequência em ensaios clínicos ou desde que o medicamento foi comercializado. A relação com a terapia com PEPCID 20mg não foi clara em muitos casos. Dentro de cada categoria, as reações adversas estão listadas em ordem decrescente de gravidade:
Corpo como um todo: febre, astenia, fadiga
Cardiovascular: arritmia, bloqueio AV, palpitação. O prolongamento do intervalo QT, em pacientes com função renal comprometida, foi relatado muito raramente.
Gastrointestinal: icterícia colestática, hepatite, anormalidades das enzimas hepáticas, vômitos, náusea, desconforto abdominal, anorexia, boca seca
Hematologico: casos raros de agranulocitose, pancitopenia, leucopenia, trombocitopenia
Hipersensibilidade: anafilaxia, angioedema, edema orbital ou facial, urticária, erupção cutânea, injeção conjuntival
Musculoesquelético: rabdomiólise, dor musculoesquelética incluindo cãibras musculares, artralgia
Sistema Nervoso/Psiquiátrico: convulsão de grande mal; distúrbios psíquicos, reversíveis nos casos em que foi obtido acompanhamento, incluindo alucinações, confusão, agitação, depressão, ansiedade, diminuição da libido; parestesia; insônia; sonolência. Convulsões, em pacientes com função renal comprometida, foram relatadas muito raramente.
Respiratório: broncoespasmo, pneumonia intersticial
Pele: necrólise epidérmica tóxica/síndrome de Stevens-Johnson (muito raro), alopecia, acne, prurido, pele seca, rubor
Sentidos Especiais: zumbido, distúrbio do paladar
Outro: casos raros de impotência e casos raros de ginecomastia foram relatados; no entanto, em ensaios clínicos controlados, as incidências não foram superiores às observadas com placebo.
As reações adversas relatadas para PEPCID Tablets também podem ocorrer com PEPCID 20mg para Suspensão Oral.
Pacientes pediátricos
Em um estudo clínico em 35 pacientes pediátricos
INTERAÇÕES MEDICAMENTOSAS
Não foram identificadas interações medicamentosas. Estudos com famotidina no homem, em modelos animais e in vitro não mostraram interferência significativa na disposição de compostos metabolizados pelas enzimas microssomais hepáticas, por exemplo, sistema citocromo P450. Os compostos testados no homem incluem varfarina, teofilina, fenitoína, diazepam, aminopirina e antipirina. O verde de indocianina como índice de extração de drogas hepáticas foi testado e nenhum efeito significativo foi encontrado.
AVISOS
Nenhuma informação fornecida
PRECAUÇÕES
Em geral
A resposta sintomática à terapia com PEPCID não exclui a presença de malignidade gástrica.
Pacientes com insuficiência renal moderada ou grave
Como os efeitos adversos no SNC foram relatados em pacientes com insuficiência renal moderada e grave, intervalos maiores entre as doses ou doses mais baixas podem ser necessários em pacientes com insuficiência moderada (clearance de creatinina FARMACOLOGIA CLÍNICA em adultos e DOSAGEM E ADMINISTRAÇÃO ). O prolongamento do intervalo QT foi relatado muito raramente em pacientes com insuficiência renal cuja dose/intervalo de dosagem de famotidina pode não ter sido ajustado adequadamente.
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Em um estudo de 106 semanas em ratos e um estudo de 92 semanas em camundongos que receberam doses orais de até 2.000 mg/kg/dia (aproximadamente 2.500 vezes a dose humana recomendada para úlcera duodenal ativa), não houve evidência de potencial carcinogênico para PEPCID.
famotidina foi negativa no teste de mutagênico microbiano (teste de Ames) utilizando Salmonella typhimurium e Escherichia coli com ou sem ativação de enzimas hepáticas de rato em concentrações de até 10.000 mcg/placa. Em estudos in vivo em camundongos, com teste de micronúcleo e teste de aberração cromossômica, não foi observada evidência de efeito mutagênico.
Em estudos com ratos que receberam doses orais de até 2.000 mg/kg/dia ou doses intravenosas de até 200 mg/kg/dia, a fertilidade e o desempenho reprodutivo não foram afetados.

Gravidez
Gravidez Categoria B
Estudos reprodutivos foram realizados em ratos e coelhos com doses orais de até 2.000 e 500 mg/kg/dia, respectivamente, e em ambas as espécies com doses intravenosas de até 200 mg/kg/dia, e não revelaram evidência significativa de fertilidade prejudicada ou danos ao feto devido ao PEPCID. Embora não tenham sido observados efeitos fetotóxicos diretos, abortos esporádicos que ocorreram apenas em mães que apresentaram diminuição acentuada da ingestão de alimentos foram observados em alguns coelhos em doses orais de 200 mg/kg/dia (250 vezes a dose humana usual) ou superior. No entanto, não existem estudos adequados ou bem controlados em mulheres grávidas. Como os estudos reprodutivos em animais nem sempre são preditivos da resposta humana, este medicamento deve ser usado durante a gravidez somente se for claramente necessário.
Mães que amamentam
Estudos realizados em ratas lactantes mostraram que a famotidina é secretada no leite materno. Foi observada depressão transitória do crescimento em ratos jovens amamentados por mães tratadas com doses maternotóxicas de pelo menos 600 vezes a dose humana habitual. A famotidina é detectável no leite humano. Devido ao potencial de reações adversas graves em lactentes de PEPCID, deve-se decidir entre descontinuar a amamentação ou descontinuar o medicamento, levando em consideração a importância do medicamento para a mãe.
Pacientes pediátricos
O uso de PEPCID 20mg em pacientes pediátricos
Dois estudos farmacocinéticos em pacientes pediátricos 3 meses a 1 ano de idade é semelhante à observada em pacientes pediátricos mais velhos (1-15 anos de idade) e adultos . Em contraste, pacientes pediátricos de 0-3 meses de idade apresentaram valores de depuração de famotidina que foram 2 a 4 vezes menores do que aqueles em pacientes pediátricos mais velhos e adultos. Esses estudos também mostram que a biodisponibilidade média em pacientes pediátricos FARMACOLOGIA CLÍNICA em pacientes pediátricos , Farmacocinética e Farmacodinâmica .)
Em um estudo duplo-cego, randomizado, de retirada de tratamento, 35 pacientes pediátricos REAÇÕES ADVERSAS , Pacientes pediátricos ).
Esses estudos sugerem que uma dose inicial de 0,5 mg/kg/dose de suspensão oral de famotidina pode ser benéfica para o tratamento da DRGE por até 4 semanas uma vez ao dia em pacientes
Pacientes pediátricos de 1 a 16 anos de idade
uso de PEPCID 40mg em pacientes pediátricos de 1-16 anos de idade é apoiado por evidências de estudos adequados e bem controlados de PEPCID em adultos e pelos seguintes estudos em pacientes pediátricos: Em estudos publicados em um pequeno número de pacientes pediátricos 1-15 anos de idade, a depuração da famotidina foi semelhante à observada em adultos. Em pacientes pediátricos de 11 a 15 anos de idade, doses orais de 0,5 mg/kg foram associadas a uma área média sob a curva (AUC) semelhante à observada em adultos tratados por via oral com 40 mg. Da mesma forma, em pacientes pediátricos de 1 a 15 anos de idade, doses intravenosas de 0,5 mg/kg foram associadas a uma AUC média semelhante à observada em adultos tratados com 40 mg por via intravenosa. Estudos publicados limitados também sugerem que a relação entre a concentração sérica e a supressão ácida é semelhante em pacientes pediátricos de 1 a 15 anos de idade em comparação com adultos. Esses estudos sugerem uma dose inicial para pacientes pediátricos de 1 a 16 anos de idade da seguinte forma:
Úlcera Péptica - 0,5 mg/kg/dia po Na hora de dormir ou lance dividido Até 40 mg/dia.
Doença do Refluxo Gastroesofágico com ou sem esofagite incluindo erosões e ulcerações - 1,0 mg/kg/dia VO dividido por lance até 40 mg por lance
Embora estudos não controlados publicados sugiram a eficácia da famotidina no tratamento da doença do refluxo gastroesofágico e da úlcera péptica, os dados em pacientes pediátricos são insuficientes para estabelecer a porcentagem de resposta com a dose e a duração da terapia. Portanto, a duração do tratamento (inicialmente com base nas recomendações de duração do adulto) e a dose devem ser individualizadas com base na resposta clínica e/ou determinação do pH (gástrico ou esofágico) e endoscopia. Estudos clínicos não controlados publicados em pacientes pediátricos empregaram doses de até 1 mg/kg/dia para úlcera péptica e 2 mg/kg/dia para DRGE com ou sem esofagite, incluindo erosões e ulcerações.
Uso Geriátrico
Dos 4.966 indivíduos em estudos clínicos que foram tratados com famotidina, 488 indivíduos (9,8%) tinham 65 anos ou mais e 88 indivíduos (1,7%) tinham mais de 75 anos de idade. Não foram observadas diferenças globais na segurança ou eficácia entre estes indivíduos e indivíduos mais jovens. No entanto, uma maior sensibilidade de alguns indivíduos mais velhos não pode ser descartada.
Não é necessário ajuste de dose com base na idade (ver FARMACOLOGIA CLÍNICA em adultos , Farmacocinética ). Este fármaco é conhecido por ser substancialmente excretado pelos rins, e o risco de reações tóxicas a este fármaco pode ser maior em pacientes com função renal comprometida. Como os pacientes idosos são mais propensos a ter função renal diminuída, deve-se ter cuidado na seleção da dose e pode ser útil monitorar a função renal. É necessário o ajuste da dose em caso de insuficiência renal moderada ou grave (ver PRECAUÇÕES , Pacientes com Insuficiência Renal Moderada ou Grave e DOSAGEM E ADMINISTRAÇÃO , Ajuste de dosagem para pacientes com insuficiência renal moderada ou grave ).
SOBREDOSAGEM
As reações adversas em casos de superdosagem são semelhantes às reações adversas encontradas na experiência clínica normal (ver REAÇÕES ADVERSAS ). Doses orais de até 640 mg/dia foram administradas a pacientes adultos com condições patológicas de hipersecreção sem efeitos adversos graves. Em caso de sobredosagem, o tratamento deve ser sintomático e de suporte. O material não absorvido deve ser removido do trato gastrointestinal, o paciente deve ser monitorado e a terapia de suporte deve ser empregada.
DL50 oral da famotidina em ratos e camundongos machos e fêmeas foi superior a 3.000 mg/kg e a dose oral aguda mínima letal em cães excedeu 2.000 mg/kg. A famotidina não produziu efeitos evidentes em altas doses orais em camundongos, ratos, gatos e cães, mas induziu anorexia significativa e depressão do crescimento em coelhos começando com 200 mg/kg/dia por via oral. A DL50 intravenosa da famotidina para camundongos e ratos variou de 254-563 mg/kg e a dose única letal mínima IV em cães foi de aproximadamente 300 mg/kg. Os sinais de intoxicação aguda em cães tratados IV foram vômitos, agitação, palidez das membranas mucosas ou vermelhidão da boca e ouvidos, hipotensão, taquicardia e colapso.
CONTRA-INDICAÇÕES
Hipersensibilidade a qualquer componente destes produtos. Foi observada sensibilidade cruzada nesta classe de compostos. Portanto, PEPCID 40mg não deve ser administrado a pacientes com histórico de hipersensibilidade a outros antagonistas dos receptores H2.
FARMACOLOGIA CLÍNICA
Farmacologia Clínica em Adultos
Efeitos GI
PEPCID é um inibidor competitivo dos receptores H2 da histamina. A principal atividade farmacológica clinicamente importante do PEPCID 40mg é a inibição da secreção gástrica. Tanto a concentração ácida quanto o volume da secreção gástrica são suprimidos pelo PEPCID, enquanto as alterações na secreção de pepsina são proporcionais ao volume produzido.
Em voluntários normais e hipersecretores, PEPCID 20mg inibiu a secreção gástrica basal e noturna, assim como a secreção estimulada por alimentos e pentagastrina. Após administração oral, o início do efeito antissecretor ocorreu em uma hora; o efeito máximo foi dependente da dose, ocorrendo dentro de uma a três horas. A duração da inibição da secreção por doses de 20 e 40 mg foi de 10 a 12 horas.
Doses orais únicas à noite de 20 e 40 mg inibiram a secreção ácida basal e noturna em todos os indivíduos; a secreção ácida gástrica noturna média foi inibida em 86% e 94%, respectivamente, por um período de pelo menos 10 horas. As mesmas doses administradas pela manhã suprimiram a secreção ácida estimulada por alimentos em todos os indivíduos. A supressão média foi de 76% e 84%, respectivamente, 3 a 5 horas após a administração, e 25% e 30%, respectivamente, 8 a 10 horas após a administração. Em alguns indivíduos que receberam a dose de 20 mg, entretanto, o efeito antissecretor foi dissipado em 6-8 horas. Não houve efeito cumulativo com doses repetidas. O pH intragástrico noturno foi elevado por doses noturnas de 20 e 40 mg de PEPCID para valores médios de 5,0 e 6,4, respectivamente. Quando PEPCID 40mg foi administrado após o café da manhã, o pH interdigestivo basal diurno em 3 e 8 horas após 20 ou 40 mg de PEPCID 40mg foi aumentado para cerca de 5.
PEPCID 40mg teve pouco ou nenhum efeito sobre os níveis séricos de gastrina em jejum ou pós-prandial. O esvaziamento gástrico e a função pancreática exócrina não foram afetados pelo PEPCID.
Outros efeitos
Os efeitos sistémicos do PEPCID no sistema nervoso central, cardiovascular, respiratório ou endócrino não foram observados em estudos de farmacologia clínica. Além disso, não foram observados efeitos antiandrogênicos. (Ver REAÇÕES ADVERSAS .) Os níveis de hormônios séricos, incluindo prolactina, cortisol, tiroxina (T4) e testosterona, não foram alterados após o tratamento com PEPCID.
Farmacocinética
PEPCID 20mg é absorvido de forma incompleta. A biodisponibilidade de doses orais é de 40-45%. A biodisponibilidade pode ser ligeiramente aumentada por alimentos ou ligeiramente diminuída por antiácidos; no entanto, esses efeitos não têm consequências clínicas. PEPCID sofre metabolismo mínimo de primeira passagem. Após doses orais, os níveis plasmáticos máximos ocorrem em 1-3 horas. Os níveis plasmáticos após doses múltiplas são semelhantes aos de doses únicas. Quinze a 20% do PEPCID 20mg no plasma está ligado às proteínas. PEPCID tem uma meia-vida de eliminação de 2,5-3,5 horas. O PEPCID é eliminado pelas vias renal (65-70%) e metabólica (30-35%). A depuração renal é de 250-450 mL/min, indicando alguma excreção tubular. Vinte e cinco a 30% de uma dose oral e 65-70% de uma dose intravenosa são recuperados na urina como composto inalterado. O único metabólito identificado no homem é o S-óxido.
Existe uma estreita relação entre os valores de depuração de creatinina e a meia-vida de eliminação do PEPCID. Em pacientes com insuficiência renal grave, ou seja, depuração de creatinina inferior a 10 mL/min, a meia-vida de eliminação de PEPCID pode exceder 20 horas e pode ser necessário ajuste de dose ou intervalos de dosagem em insuficiência renal moderada e grave (ver PRECAUÇÕES , DOSAGEM E ADMINISTRAÇÃO ).
Em pacientes idosos, não há alterações clinicamente significativas relacionadas à idade na farmacocinética de PEPCID. Entretanto, em pacientes idosos com função renal diminuída, a depuração da droga pode estar diminuída (ver PRECAUÇÕES , Uso Geriátrico ).
Estudos clínicos
Úlcera duodenal
Em um estudo multicêntrico, duplo-cego nos EUA em pacientes ambulatoriais com úlcera duodenal confirmada por endoscopia, PEPCID administrado por via oral foi comparado ao placebo. Conforme mostrado na Tabela 1, 70% dos pacientes tratados com PEPCID 40 mg hs foram curados na semana 4.
Os pacientes não curados na semana 4 continuaram no estudo. Na semana 8, 83% dos pacientes tratados com PEPCID cicatrizaram versus 45% dos pacientes tratados com placebo. A incidência de cicatrização de úlceras com PEPCID foi significativamente maior do que com placebo em cada momento com base na proporção de úlceras curadas confirmadas endoscopicamente.
Neste estudo, o tempo para alívio da dor diurna e noturna foi significativamente menor para os pacientes que receberam PEPCID do que para os pacientes que receberam placebo; os pacientes que receberam PEPCID também tomaram menos antiácidos do que os pacientes que receberam placebo.
Tratamento de manutenção a longo prazo de úlceras duodenais
PEPCID 40mg, 20mg pohs, foi comparado ao placebo hs como terapia de manutenção em dois estudos multicêntricos, duplo-cegos, de pacientes com úlceras duodenais curadas endoscopicamente confirmadas. No estudo norte-americano, a incidência de úlcera observada em 12 meses em pacientes tratados com placebo foi 2,4 vezes maior do que nos pacientes tratados com PEPCID. Os 89 pacientes tratados com PEPCID tiveram uma incidência cumulativa de úlcera observada de 23,4% em comparação com uma incidência de úlcera observada de 56,6% nos 89 pacientes que receberam placebo (p
Úlcera gástrica
Em um estudo multicêntrico, duplo-cego, nos EUA e internacional, em pacientes com úlcera gástrica benigna ativa confirmada por endoscopia, a administração oral de PEPCID 20 mg, 40 mg hs foi comparada ao placebo hs Antiácidos foram permitidos durante os estudos, mas o consumo não foi significativamente diferente entre os grupos PEPCID e placebo. Conforme mostrado na Tabela 2, a incidência de cicatrização da úlcera (desistências contadas como não cicatrizadas) com PEPCID 20mg foi estatisticamente significativamente melhor do que o placebo nas semanas 6 e 8 no estudo norte-americano e nas semanas 4, 6 e 8 no estudo internacional, baseado no número de úlceras que cicatrizaram, confirmadas por endoscopia.
O tempo para alívio completo da dor diurna e noturna foi estatisticamente significativamente menor para os pacientes que receberam PEPCID 20mg do que para os pacientes que receberam placebo; no entanto, em nenhum dos estudos houve diferença estatisticamente significativa na proporção de pacientes cuja dor foi aliviada ao final do estudo (semana 8).
Doença do Refluxo Gastroesofágico (DRGE)
O PEPCID administrado por via oral foi comparado ao placebo em um estudo americano que envolveu pacientes com sintomas de DRGE e sem evidência endoscópica de erosão ou ulceração do esôfago. PEPCID 20 mg bid foi estatisticamente significativamente superior a 40 mg hs e ao placebo em fornecer um resultado sintomático bem-sucedido, definido como melhora moderada ou excelente dos sintomas (Tabela 3).
Em duas semanas de tratamento, o sucesso sintomático foi observado em uma porcentagem maior de pacientes tomando PEPCID 20 mg duas vezes ao dia em comparação ao placebo (p ≤ 0,01).
Melhoria sintomática e cicatrização de erosão e ulceração verificada endoscopicamente foram estudados em dois ensaios adicionais. A cicatrização foi definida como a resolução completa de todas as erosões ou ulcerações visíveis com endoscopia. O estudo americano comparando PEPCID 40 mg pobid com placebo e PEPCID 20 mg pobid mostrou uma porcentagem significativamente maior de cura para PEPCID 40 mg duas vezes ao dia nas semanas 6 e 12 (Tabela 4).
Em comparação com o placebo, os pacientes que receberam PEPCID tiveram alívio mais rápido da azia diurna e noturna e uma porcentagem maior de pacientes experimentou alívio completo da azia noturna. Essas diferenças foram estatisticamente significativas.
No estudo internacional, quando PEPCID 40 mg pobid foi comparado com ranitidina 150 mg pobid, uma porcentagem estatisticamente significativamente maior de cicatrização foi observada com PEPCID 40 mg duas vezes ao dia na semana 12 (Tabela 5). Não houve, no entanto, diferença significativa entre os tratamentos no alívio dos sintomas.
Condições Patológicas Hipersecretórias (por exemplo, Síndrome de Zollinger-Ellison, Adenomas Endócrinos Múltiplos)
Em estudos de pacientes com condições patológicas de hipersecreção, como a síndrome de Zollinger-Ellison, com ou sem múltiplos adenomas endócrinos, o PEPCID inibiu significativamente a secreção de ácido gástrico e controlou os sintomas associados. Doses administradas por via oral de 20 a 160 mg q 6 h mantiveram a secreção ácida basal abaixo de 10 mEq/h; as doses iniciais foram tituladas para a necessidade individual do paciente e ajustes subsequentes foram necessários com o tempo em alguns pacientes. PEPCID 40mg foi bem tolerado nessas altas doses por períodos prolongados (superiores a 12 meses) em oito pacientes, e não houve casos relatados de ginecomastia, aumento dos níveis de prolactina ou impotência considerados devidos ao medicamento.
Farmacologia Clínica em Pacientes Pediátricos
Farmacocinética
Tabela 6 apresenta dados farmacocinéticos de ensaios clínicos e um estudo publicado em pacientes pediátricos (
A depuração plasmática é reduzida e a meia-vida de eliminação é prolongada em pacientes pediátricos de 0-3 meses de idade em comparação com pacientes pediátricos mais velhos. Os parâmetros farmacocinéticos para pacientes pediátricos, com idade > 3 meses a 15 anos, são comparáveis aos obtidos para adultos.
Os estudos de biodisponibilidade de 8 pacientes pediátricos (11-15 anos de idade) mostraram uma biodisponibilidade oral média de 0,5 em comparação com valores de adultos de 0,42 a 0,49. Doses orais de 0,5 mg/kg alcançaram AUCs de 645 ± 249 ng-h/mL e 580 ± 60 ng-h/mL em pacientes pediátricos
Farmacodinâmica
A farmacodinâmica da famotidina foi avaliada em 5 pacientes pediátricos de 2 a 13 anos de idade usando o modelo sigmóide Emax. Esses dados sugerem que a relação entre a concentração sérica de famotidina e a supressão do ácido gástrico é semelhante à observada em um estudo com adultos (Tabela 7).
Cinco estudos publicados (Tabela 8) examinaram o efeito da famotidina no pH gástrico e na duração da supressão ácida em pacientes pediátricos. Embora cada estudo tenha um design diferente, os dados de supressão de ácido ao longo do tempo são resumidos da seguinte forma:
duração do efeito da famotidina IV 0,5 mg/kg no pH gástrico e na supressão ácida mostrou em um estudo ser maior em pacientes pediátricos
INFORMAÇÃO DO PACIENTE
Nenhuma informação fornecida. Por favor, consulte o PRECAUÇÕES seção.
