Protonix 20mg, 40mg Pantoprazole Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Protonix 40mg e como é usado?
Protonix 40mg é um medicamento de prescrição usado para tratar os sintomas de esofagite causada por ácido estomacal devido à doença do refluxo gastroesofágico ou DRGE e síndrome de Zollinger-Ellison ou outras condições que causam excesso de ácido estomacal. Protonix 40mg pode ser usado sozinho ou com outros medicamentos.
Protonix pertence a uma classe de medicamentos chamados inibidores da bomba de prótons (IBPs).
Não se sabe se Protonix é seguro e eficaz em crianças com menos de 5 anos de idade.
Quais são os possíveis efeitos colaterais do Protonix?
Protonix pode causar efeitos colaterais graves, incluindo:
- dor de estômago severa,
- diarreia aquosa ou com sangue,
- dor súbita ou dificuldade em mover o quadril, pulso ou costas,
- hematomas ou inchaço no local da injeção,
- pouca ou nenhuma micção,
- sangue na urina,
- inchaço,
- ganho de peso rápido,
- tontura,
- frequência cardíaca rápida ou irregular,
- tremores (tremores) ou movimentos bruscos,
- sentindo-se nervoso,
- cãibras musculares ou espasmos nas mãos ou pés,
- tosse,
- sensação de asfixia,
- dores nas articulações e
- erupção cutânea nas bochechas ou braços que piora à noite
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Protonix incluem:
- dor de cabeça,
- tontura,
- dor de estômago,
- gás,
- náusea,
- vômito,
- diarréia,
- dores nas articulações,
- febre,
- erupção cutânea, e
- sintomas de resfriado (mais comum em crianças)
Informe o seu médico se tiver algum efeito secundário que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Prometrium. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
DESCRIÇÃO
ingrediente ativo em PROTONIX (pantoprazol sódico) para suspensão oral de liberação retardada e PROTONIX (pantoprazol sódico) comprimidos de liberação retardada, um IBP, é um benzimidazol substituído, sódio 5-(difluorometoxi)-2-[[(3,4- dimetoxi-2-piridinil)metil]sulfinil]-1H-benzimidazol sesquihidratado, um composto que inibe a secreção de ácido gástrico. Sua fórmula empírica é C16H14F2N3NaO4S x 1,5 H2O, com peso molecular de 432,4. A fórmula estrutural é:
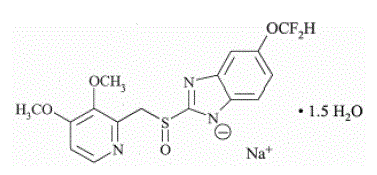
O sesquihidrato de pantoprazol sódico é um pó cristalino branco a esbranquiçado e é racêmico. O pantoprazol tem propriedades fracamente básicas e ácidas. O sesquihidrato de pantoprazol sódico é livremente solúvel em água, muito pouco solúvel em tampão fosfato a pH 7,4 e praticamente insolúvel em n-hexano.
estabilidade do composto em solução aquosa depende do pH. A taxa de degradação aumenta com a diminuição do pH. À temperatura ambiente, a meia-vida de degradação é de aproximadamente 2,8 horas a pH 5 e aproximadamente 220 horas a pH 7,8.
PROTONIX 40mg é fornecido como suspensão oral de liberação retardada em embalagens de dose unitária, disponível em uma dosagem (40 mg) de pantoprazol (equivalente a 45,1 mg de pantoprazol sódico) e como comprimido de liberação retardada, disponível em duas dosagens 20 mg de pantoprazol (equivalente a 22,56 mg de pantoprazol sódico) e 40 mg de pantoprazol (equivalente a 45,1 mg de pantoprazol sódico).
PROTONIX comprimidos de liberação retardada contém os seguintes ingredientes inativos: estearato de cálcio, crospovidona, hipromelose, óxido de ferro, manitol, copolímero de ácido metacrílico, polissorbato 80, povidona, propilenoglicol, carbonato de sódio, lauril sulfato de sódio, dióxido de titânio e citrato de trietil. Os comprimidos de liberação retardada de PROTONIX (40 mg e 20 mg) estão em conformidade com o teste de dissolução USP 2.
PROTONIX 40mg para suspensão oral de liberação retardada contém os seguintes ingredientes inativos: crospovidona, hipromelose, copolímero de ácido metacrílico, celulose microcristalina, polissorbato 80, povidona, carbonato de sódio, lauril sulfato de sódio, talco, dióxido de titânio, trietil citrato e óxido férrico amarelo.
INDICAÇÕES
PROTONIX Para Suspensão Oral de Liberação Retardada e PROTONIX 40mg Comprimidos de Liberação Retardada são indicados para:
Tratamento a curto prazo da esofagite erosiva associada à doença do refluxo gastroesofágico (DRGE)
PROTONIX 20mg é indicado em pacientes adultos e pediátricos com cinco anos de idade ou mais para o tratamento de curto prazo (até 8 semanas) na cicatrização e alívio sintomático da esofagite erosiva (EE). Para aqueles pacientes adultos que não se recuperaram após 8 semanas de tratamento, um curso adicional de 8 semanas de PROTONIX pode ser considerado. A segurança do tratamento além de 8 semanas em pacientes pediátricos não foi estabelecida.
Manutenção da cicatrização da esofagite erosiva
PROTONIX é indicado para manutenção da cicatrização da EE e redução das taxas de recidiva dos sintomas diurnos e noturnos de pirose em pacientes adultos com DRGE. Os estudos controlados não se estenderam além de 12 meses.
Condições Patológicas Hipersecretórias Incluindo Síndrome de Zollinger-Ellison
PROTONIX 20mg é indicado para o tratamento a longo prazo de condições patológicas de hipersecreção, incluindo a Síndrome de Zollinger-Ellison (ZE).
DOSAGEM E ADMINISTRAÇÃO
Cronograma de Dosagem Recomendado
PROTONIX é fornecido como grânulos de liberação retardada em embalagens para preparação de suspensões orais ou como comprimidos de liberação retardada. As dosagens recomendadas estão descritas na Tabela 1.
Instruções de administração
As instruções para o método de administração para cada forma de dosagem são apresentadas na Tabela 2.
Tome uma dose esquecida o mais rápido possível. Se estiver quase na hora da próxima dose, pule a dose esquecida e tome a próxima dose no horário regular. Não tome 2 doses ao mesmo tempo.
Comprimidos de liberação retardada PROTONIX
Engula os comprimidos de liberação retardada de PROTONIX inteiros, com ou sem alimentos no estômago. Para pacientes incapazes de engolir um comprimido de 40 mg, podem ser tomados dois comprimidos de 20 mg. A administração concomitante de antiácidos não afeta a absorção de PROTONIX comprimidos de liberação retardada.
PROTONIX para suspensão oral de liberação retardada
Administrar PROTONIX para suspensão oral de liberação retardada aproximadamente 30 minutos antes de uma refeição via administração oral em suco de maçã ou compota de maçã ou sonda nasogástrica apenas em suco de maçã. Como o pH adequado é necessário para a estabilidade, não administre PROTONIX 20mg para suspensão oral de liberação retardada em líquidos que não sejam suco de maçã ou alimentos que não sejam compota de maçã.
Não divida a embalagem de 40 mg de PROTONIX 20 mg para suspensão oral de liberação retardada para criar uma dosagem de 20 mg para pacientes pediátricos que não podem tomar a formulação em comprimido.
PROTONIX para suspensão oral de liberação retardada - administração oral em compota de maçã
- Pacote aberto.
- Polvilhe grânulos em uma colher de chá de compota de maçã. NÃO USE OUTROS ALIMENTOS NEM ESMAGE OU MASTIGUE OS GRANULOS.
- Tome dentro de 10 minutos de preparação.
- Tome goles de água para garantir que os grânulos sejam levados para o estômago. Repita os goles de água conforme necessário.
PROTONIX para suspensão oral de liberação retardada - administração oral em suco de maçã
- Pacote aberto.
- Esvazie os grânulos em um pequeno copo ou colher de chá contendo uma colher de chá de suco de maçã.
- Agite por 5 segundos (os grânulos não se dissolvem) e engula imediatamente.
- Para garantir que toda a dose seja tomada, lave o recipiente uma ou duas vezes com suco de maçã para remover os grânulos restantes. Engula imediatamente.
PROTONIX 40mg para suspensão oral de liberação retardada - tubo nasogástrico (NG) ou administração de tubo de gastrostomia
Para pacientes com sonda nasogástrica ou sonda de gastrostomia, PROTONIX 40mg para suspensão oral de liberação retardada pode ser administrado da seguinte forma:
- Remova o êmbolo do cilindro de uma seringa com ponta de cateter de 2 onças (60 mL). Descarte o êmbolo.
- Conecte a ponta do cateter da seringa a um tubo 16 French (ou maior).
- Segure a seringa conectada ao tubo o mais alto possível enquanto administra PROTONIX para suspensão oral de liberação retardada para evitar qualquer curvatura do tubo.
- Esvazie o conteúdo do pacote no cilindro da seringa.
- Adicione 10 mL (2 colheres de chá) de suco de maçã e bata suavemente e/ou agite o corpo da seringa para ajudar a enxaguar a seringa e o tubo. Repita pelo menos mais duas vezes usando a mesma quantidade de suco de maçã (10 mL ou 2 colheres de chá) de cada vez. Nenhum grânulo deve permanecer na seringa.
COMO FORNECIDO
Formas de dosagem e pontos fortes
Comprimidos de liberação retardada:
- 40 mg de pantoprazol, comprimidos ovais amarelos biconvexos impressos com PROTONIX (tinta castanha) numa das faces
- 20 mg de pantoprazol, comprimidos biconvexos ovais amarelos impressos com P20 (tinta castanha) numa das faces
Para suspensão oral de liberação retardada:
- 40 mg de pantoprazol, granulado com revestimento entérico, amarelado pálido a acastanhado escuro, em um pacote de dose unitária
Armazenamento e manuseio
PROTONIX (pantoprazol sódico) Comprimidos de Liberação Retardada são fornecidos na forma de comprimidos de liberação retardada amarelos, biconvexos, ovais, impressos com PROTONIX (tinta marrom) em um lado contendo 40 mg de pantoprazol e estão disponíveis da seguinte forma:
NDC 0008-0841-81, garrafas de 90
PROTONIX (pantoprazol sódico) Comprimidos de Liberação Retardada são fornecidos sob a forma de comprimidos de libertação retardada biconvexos amarelos ovais impressos com P20 (tinta castanha) num dos lados contendo 20 mg de pantoprazol e estão disponíveis da seguinte forma:
NDC 0008-0843-81, garrafas de 90
PROTONIX (pantoprazol sódico) para suspensão oral de liberação retardada é fornecido sob a forma de grânulos com revestimento entérico, de cor amarela clara a acastanhada escura, contendo 40 mg de pantoprazol numa embalagem unitária e estão disponíveis da seguinte forma:
NDC 0008-0844-02, embalagem de dose unitária de 30
Armazenar
Armazenar PROTONIX 40mg Para Suspensão Oral de Liberação Retardada e PROTONIX 20mg Comprimidos de Liberação Retardada a 20° a 25°C (68° a 77°F); excursões permitidas de 15° a 30°C (59° a 86°F) [ver Temperatura ambiente controlada USP ].
Distribuído por: Wyeth Pharmaceuticals LLC, uma subsidiária da Pfizer Inc., Filadélfia, PA 19101. Revisado: novembro de 2020
EFEITOS COLATERAIS
As seguintes reações adversas graves estão descritas abaixo e em outras partes da bula:
- Nefrite Tubulointersticial Aguda [ver AVISOS E PRECAUÇÕES ]
- Diarreia Associada a Clostridium difficile [ver AVISOS E PRECAUÇÕES ]
- Fratura Óssea [ver AVISOS E PRECAUÇÕES ]
- Lúpus Eritematoso Cutâneo e Sistêmico [ver AVISOS E PRECAUÇÕES ]
- Deficiência de cianocobalamina (vitamina B-12) [ver AVISOS E PRECAUÇÕES ]
- Hipomagnesemia [ver AVISOS E PRECAUÇÕES ]
- Pólipos da glândula fúndica [ver AVISOS E PRECAUÇÕES ]
Experiência de Ensaios Clínicos
Os perfis de reações adversas para PROTONIX (pantoprazol sódico) para suspensão oral de liberação retardada e PROTONIX (pantoprazol sódico) comprimidos de liberação retardada são semelhantes.
Como os ensaios clínicos são conduzidos sob condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparadas às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática clínica.
Adultos
A segurança em nove ensaios clínicos randomizados comparativos nos EUA em pacientes com DRGE incluiu 1.473 pacientes em uso oral de PROTONIX (20 mg ou 40 mg), 299 pacientes em um antagonista do receptor H2, 46 pacientes em outro IBP e 82 pacientes em placebo. As reações adversas mais frequentes estão listadas na Tabela 3.
As reações adversas adicionais que foram notificadas para PROTONIX 20mg em ensaios clínicos com uma frequência de ≤2% estão listadas abaixo por sistema corporal:
Corpo como um todo: reação alérgica, pirexia, reação de fotossensibilidade, edema facial
Gastrointestinal: constipação, boca seca, hepatite
Hematologico: leucopenia, trombocitopenia
Metabólico/Nutricional: CK elevada (creatina quinase), edema generalizado, triglicerídeos elevados, enzimas hepáticas elevadas
Musculoesquelético: mialgia
Nervoso: depressão, vertigem
Pele e anexos: urticária, erupção cutânea, prurido
Sentidos Especiais: visão embaçada
Pacientes pediátricos
segurança de PROTONIX no tratamento da EE associada à DRGE foi avaliada em pacientes pediátricos com idades entre 1 ano e 16 anos em três ensaios clínicos. Ensaios de segurança envolveram pacientes pediátricos com EE; entretanto, como a EE é incomum na população pediátrica, 249 pacientes pediátricos com DRGE sintomática ou comprovada por endoscopia também foram avaliados. Todas as reações adversas de adultos ao PROTONIX 20mg são consideradas relevantes para pacientes pediátricos. Em pacientes com idades entre 1 e 16 anos, as reações adversas mais comumente relatadas (>4%) incluem: IVAS, dor de cabeça, febre, diarreia, vômito, erupção cutânea e dor abdominal.
Para informações de segurança em pacientes com menos de 1 ano de idade, consulte Uso em populações específicas .
As reações adversas adicionais que foram notificadas para PROTONIX 20mg em doentes pediátricos em ensaios clínicos com uma frequência ≤4% estão listadas abaixo por sistema corporal:
Corpo como um todo: reação alérgica, edema facial
Gastrointestinal: constipação, flatulência, náusea
Metabólico/Nutricional: triglicerídeos elevados, enzimas hepáticas elevadas, CK elevada (creatina quinase)
Musculoesquelético: artralgia, mialgia
Nervoso: tontura, vertigem
Pele e anexos: urticária
As seguintes reações adversas observadas em adultos em estudos clínicos não foram relatadas em pacientes pediátricos em estudos clínicos, mas são consideradas relevantes para pacientes pediátricos: reação de fotossensibilidade, boca seca, hepatite, trombocitopenia, edema generalizado, depressão, prurido, leucopenia e visão turva .
Síndrome de Zollinger-Ellison (ZE)
Em estudos clínicos da síndrome ZE, as reações adversas relatadas em 35 pacientes tomando PROTONIX 80 mg/dia a 240 mg/dia por até 2 anos foram semelhantes às relatadas em pacientes adultos com DRGE.
Experiência pós-marketing
As seguintes reações adversas foram identificadas durante o uso pós-aprovação de PROTONIX. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento.
Estas reações adversas estão listadas abaixo por sistema corporal:
Problemas gastrointestinais: pólipos de glândulas fúndicas
Distúrbios Gerais e Condições de Administração: astenia, fadiga, mal-estar
Hematologico: pancitopenia, agranulocitose
Distúrbios hepatobiliares: dano hepatocelular levando a icterícia e insuficiência hepática
Distúrbios do sistema imunológico: anafilaxia (incluindo choque anafilático), lúpus eritematoso sistêmico
Infecções e Infestações: Diarreia associada a Clostridium difficile
Investigações: mudanças de peso
Distúrbios do Metabolismo e Nutricionais: hiponatremia, hipomagnesemia
Distúrbios músculo-esqueléticos: rabdomiólise, fratura óssea
Nervoso: ageusia, disgeusia
Distúrbios psiquiátricos: alucinação, confusão, insônia, sonolência
Distúrbios Renais e Urinários: nefrite tubulointersticial aguda
Distúrbios da Pele e Tecidos Subcutâneos: reações dermatológicas graves (algumas fatais), incluindo eritema multiforme, síndrome de Stevens-Johnson, necrólise epidérmica tóxica (NET, algumas fatais), angioedema (edema de Quincke) e lúpus eritematoso cutâneo
INTERAÇÕES MEDICAMENTOSAS
A Tabela 4 inclui medicamentos com interações medicamentosas clinicamente importantes e com diagnóstico quando administrados concomitantemente com PROTONIX e instruções para prevenção ou manejo.
Consulte a bula dos medicamentos usados concomitantemente para obter mais informações sobre interações com IBPs.
AVISOS
Incluído como parte do PRECAUÇÕES seção.
PRECAUÇÕES
Presença de malignidade gástrica
Em adultos, a resposta sintomática à terapia com PROTONIX não exclui a presença de malignidade gástrica. Considerar acompanhamento adicional e testes diagnósticos em pacientes adultos que tenham uma resposta abaixo do ideal ou uma recaída sintomática precoce após completar o tratamento com um IBP. Em pacientes mais velhos, considere também uma endoscopia.
Nefrite Tubulointersticial Aguda
A nefrite tubulointersticial aguda (TIN) foi observada em pacientes em uso de IBPs e pode ocorrer em qualquer momento durante a terapia com IBPs. Os pacientes podem apresentar sinais e sintomas variados, desde reações de hipersensibilidade sintomática a sintomas inespecíficos de função renal diminuída (por exemplo, mal-estar, náusea, anorexia). Na série de casos relatados, alguns pacientes foram diagnosticados por biópsia e na ausência de manifestações extra-renais (por exemplo, febre, erupção cutânea ou artralgia). Interrompa o PROTONIX 20mg e avalie os pacientes com suspeita de TIN aguda [ver CONTRA-INDICAÇÕES ].
Diarreia Associada ao Clostridium difficile
Estudos observacionais publicados sugerem que a terapia com IBP como PROTONIX 20mg pode estar associada a um risco aumentado de diarreia associada a Clostridium difficile, especialmente em pacientes hospitalizados. Este diagnóstico deve ser considerado para diarreia que não melhora [ver REAÇÕES ADVERSAS ].
Os pacientes devem usar a dose mais baixa e a menor duração da terapia com IBP apropriada para a condição a ser tratada.
Fratura óssea
Vários estudos observacionais publicados sugerem que a terapia com IBP pode estar associada a um risco aumentado de fraturas relacionadas à osteoporose do quadril, punho ou coluna. O risco de fratura foi aumentado em pacientes que receberam altas doses, definidas como múltiplas doses diárias, e terapia de longo prazo com IBP (um ano ou mais). Os pacientes devem usar a dose mais baixa e a menor duração da terapia com IBP apropriada para a condição a ser tratada. Pacientes com risco de fraturas relacionadas à osteoporose devem ser tratados de acordo com as diretrizes de tratamento estabelecidas [ver DOSAGEM E ADMINISTRAÇÃO , REAÇÕES ADVERSAS ].
Lúpus Eritematoso Cutâneo e Sistêmico
Lúpus eritematoso cutâneo (LEC) e lúpus eritematoso sistêmico (LES) foram relatados em pacientes tomando IBPs, incluindo pantoprazol sódico. Esses eventos ocorreram como um novo início e uma exacerbação de doença autoimune existente. A maioria dos casos de lúpus eritematoso induzido por IBP foram CLE.
A forma mais comum de LEC relatada em pacientes tratados com IBPs foi a LEC subaguda (SCLE) e ocorreu dentro de semanas a anos após a terapia medicamentosa contínua em pacientes que variam de lactentes a idosos. Geralmente, os achados histológicos foram observados sem envolvimento de órgãos.
lúpus eritematoso sistêmico (LES) é menos comumente relatado do que o LEC em pacientes que recebem IBPs. O LES associado a IBP é geralmente mais leve do que o LES não induzido por medicamentos. O início do LES normalmente ocorreu dentro de dias a anos após o início do tratamento, principalmente em pacientes que variam de adultos jovens a idosos. A maioria dos pacientes apresentou erupção cutânea; entretanto, artralgia e citopenia também foram relatadas.
Evite a administração de IBPs por mais tempo do que o indicado clinicamente. Se forem observados sinais ou sintomas consistentes com LEC ou LES em pacientes recebendo PROTONIX 40mg, descontinue o medicamento e encaminhe o paciente ao especialista apropriado para avaliação. A maioria dos pacientes melhora com a descontinuação do IBP isolado em 4 a 12 semanas. Testes sorológicos (por exemplo, ANA) podem ser positivos e resultados de testes sorológicos elevados podem levar mais tempo para serem resolvidos do que as manifestações clínicas.
Deficiência de cianocobalamina (vitamina B-12)
Geralmente, o tratamento diário com qualquer medicamento supressor de ácido por um longo período de tempo (por exemplo, mais de 3 anos) pode levar à má absorção de cianocobalamina (vitamina B-12) causada por hipo ou acloridria. Relatos raros de deficiência de cianocobalamina ocorrendo com terapia supressora de ácido foram relatados na literatura. Este diagnóstico deve ser considerado se forem observados sintomas clínicos consistentes com deficiência de cianocobalamina.
Hipomagnesemia
Hipomagnesemia, sintomática e assintomática, foi relatada raramente em pacientes tratados com IBPs por pelo menos três meses e, na maioria dos casos, após um ano de terapia. Eventos adversos graves incluem tetania, arritmias e convulsões. Na maioria dos pacientes, o tratamento da hipomagnesemia exigiu reposição de magnésio e descontinuação do IBP.
Para pacientes que devem estar em tratamento prolongado ou que tomam IBPs com medicamentos como digoxina ou medicamentos que podem causar hipomagnesemia (por exemplo, diuréticos), os profissionais de saúde podem considerar o monitoramento dos níveis de magnésio antes do início do tratamento com IBP e periodicamente [ver REAÇÕES ADVERSAS ].
Tumorigenicidade
Devido à natureza crônica da DRGE, pode haver potencial para administração prolongada de PROTONIX. Em estudos de longo prazo com roedores, o pantoprazol foi cancerígeno e causou tipos raros de tumores gastrointestinais. A relevância desses achados para o desenvolvimento de tumores em humanos é desconhecida [ver Toxicologia não clínica ].
Pólipos da Glândula Fúndica
uso de IBP está associado a um risco aumentado de pólipos da glândula fúndica que aumenta com o uso a longo prazo, especialmente após um ano. A maioria dos usuários de IBP que desenvolveu pólipos de glândula fúndica era assintomática e pólipos de glândula fúndica foram identificados incidentalmente na endoscopia. Use a duração mais curta da terapia com IBP apropriada para a condição a ser tratada.
Interferência com Investigações de Tumores Neuroendócrinos
Os níveis séricos de cromogranina A (CgA) aumentam secundariamente à diminuição da acidez gástrica induzida por drogas. O aumento do nível de CgA pode causar resultados falso-positivos em investigações diagnósticas de tumores neuroendócrinos. Os profissionais de saúde devem interromper temporariamente o tratamento com PROTONIX 20mg pelo menos 14 dias antes de avaliar os níveis de CgA e considerar a repetição do teste se os níveis iniciais de CgA forem altos. Se forem realizados testes em série (por exemplo, para monitoramento), o mesmo laboratório comercial deve ser usado para testes, pois os intervalos de referência entre os testes podem variar [ver FARMACOLOGIA CLÍNICA ].
Interferência com tela de urina para THC
Houve relatos de testes de triagem de urina falso-positivos para tetrahidrocanabinol (THC) em pacientes recebendo IBPs, incluindo PROTONIX [ver INTERAÇÕES MEDICAMENTOSAS ].
Uso concomitante de PROTONIX com metotrexato
A literatura sugere que o uso concomitante de IBPs com metotrexato (principalmente em altas doses; ver informações de prescrição de metotrexato) pode elevar e prolongar os níveis séricos de metotrexato e/ou seu metabólito, possivelmente levando a toxicidade do metotrexato. Na administração de altas doses de metotrexato, a suspensão temporária do IBP pode ser considerada em alguns pacientes [ver INTERAÇÕES MEDICAMENTOSAS ].
Informações de Aconselhamento do Paciente
Aconselhe o paciente a ler o rótulo do paciente aprovado pela FDA ( Guia de Medicação e Instruções de Uso ).
Malignidade Gástrica
Aconselhe os pacientes a retornarem ao seu médico se tiverem uma resposta abaixo do ideal ou uma recaída sintomática precoce [ver AVISOS E PRECAUÇÕES ].
Nefrite Tubulointersticial Aguda
Aconselhe os pacientes a ligarem para o médico imediatamente se apresentarem sinais e/ou sintomas associados à nefrite tubulointersticial aguda [ver CONTRA-INDICAÇÕES , AVISOS E PRECAUÇÕES ].
Diarreia Associada ao Clostridium Difficile
Aconselhe os pacientes a ligarem imediatamente para o médico se tiverem diarreia que não melhore [ver AVISOS E PRECAUÇÕES ].
Fratura óssea
Aconselhe os pacientes a relatar quaisquer fraturas, especialmente do quadril, punho ou coluna, ao seu médico [ver AVISOS E PRECAUÇÕES ].
Lúpus Eritematoso Cutâneo e Sistêmico
Aconselhe os pacientes a ligarem imediatamente para o seu médico para qualquer novo ou agravamento dos sintomas associados ao lúpus eritematoso cutâneo ou sistêmico [ver AVISOS E PRECAUÇÕES ].
Deficiência de cianocobalamina (vitamina B-12)
Aconselhe os pacientes a relatar quaisquer sintomas clínicos que possam estar associados à deficiência de cianobalamina ao seu médico se estiverem recebendo PROTONIX 40mg por mais de 3 anos [ver AVISOS E PRECAUÇÕES ].
Hipomagnesemia
Aconselhe os pacientes a relatar quaisquer sintomas clínicos que possam estar associados à hipomagnesemia ao seu profissional de saúde, se estiverem recebendo PROTONIX 40mg por pelo menos 3 meses [ver AVISOS E PRECAUÇÕES ].
Interações medicamentosas
Instrua os pacientes a informar seu médico sobre quaisquer outros medicamentos que estejam tomando atualmente, incluindo produtos contendo rilpivirina [ver CONTRA-INDICAÇÕES ] digoxina [ver AVISOS E PRECAUÇÕES ] e metotrexato em altas doses [ver AVISOS E PRECAUÇÕES ].
Gravidez
Aconselhar uma mulher grávida sobre o risco potencial para o feto. Aconselhar as mulheres com potencial reprodutivo a informar seu médico sobre uma gravidez conhecida ou suspeita [ver Uso em populações específicas ].
Administração
- Não parta, esmague ou mastigue PROTONIX Para Suspensão Oral de Liberação Retardada e PROTONIX 20mg Comprimidos de Liberação Retardada.
- O pacote de suspensão oral de PROTONIX é uma dose fixa e não pode ser dividido para fazer uma dose menor.
- Engula PROTONIX 20mg comprimidos de liberação retardada inteiros, com ou sem alimentos no estômago.
- administração concomitante de antiácidos não afeta a absorção de PROTONIX comprimidos de liberação retardada.
- Tome PROTONIX 20mg Para Suspensão Oral de Liberação Retardada aproximadamente 30 minutos antes de uma refeição.
- Administrar PROTONIX para Suspensão Oral de Liberação Retardada em suco de maçã ou compota de maçã, conforme descrito nas Instruções de Uso. Não administrar na água, outros líquidos ou alimentos.
- Para pacientes com sonda nasogástrica (NG) ou gastrostomia, PROTONIX para suspensão oral de liberação retardada pode ser administrado com suco de maçã, conforme descrito nas instruções de uso.
- Tome uma dose esquecida o mais rápido possível. Se estiver quase na hora da próxima dose, pule a dose esquecida e tome a próxima dose no horário regular. Não tome 2 doses ao mesmo tempo.
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Em um estudo de carcinogenicidade de 24 meses, ratos Sprague-Dawley foram tratados por via oral com doses de pantoprazol de 0,5 a 200 mg/kg/dia, cerca de 0,1 a 40 vezes a exposição em uma base de área de superfície corporal de uma pessoa de 50 kg com dose de 40 mg /dia. No fundo gástrico, o tratamento com 0,5 a 200 mg/kg/dia produziu hiperplasia de células enterocromafins (ECL) e tumores de células neuroendócrinas benignas e malignas de maneira dose-dependente. No estômago anterior, o tratamento com 50 e 200 mg/kg/dia (cerca de 10 e 40 vezes a dose humana recomendada com base na área de superfície corporal) produziu papilomas de células escamosas benignos e carcinomas de células escamosas malignos. Tumores gastrointestinais raros associados ao tratamento com pantoprazol incluíram um adenocarcinoma do duodeno com 50 mg/kg/dia e pólipos benignos e adenocarcinomas do fundo gástrico com 200 mg/kg/dia. No fígado, o tratamento com 0,5 a 200 mg/kg/dia produziu aumentos relacionados à dose na incidência de adenomas e carcinomas hepatocelulares. Na glândula tireoide, o tratamento com 200 mg/kg/dia produziu aumento na incidência de adenomas e carcinomas de células foliculares em ratos machos e fêmeas.
Em um estudo de carcinogenicidade de 24 meses, ratos Fischer 344 foram tratados oralmente com doses de 5 a 50 mg/kg/dia de pantoprazol, aproximadamente 1 a 10 vezes a dose humana recomendada com base na área de superfície corporal. No fundo gástrico, o tratamento com 5 a 50 mg/kg/dia produziu hiperplasia de células enterocromafin-like (ECL) e tumores de células neuroendócrinas benignas e malignas. A seleção da dose para este estudo pode não ter sido adequada para avaliar de forma abrangente o potencial carcinogênico do pantoprazol.
Em um estudo de carcinogenicidade de 24 meses, camundongos B6C3F1 foram tratados oralmente com doses de 5 a 150 mg/kg/dia de pantoprazol, 0,5 a 15 vezes a dose humana recomendada com base na área de superfície corporal. No fígado, o tratamento com 150 mg/kg/dia produziu aumento na incidência de adenomas e carcinomas hepatocelulares em camundongos fêmeas. O tratamento com 5 a 150 mg/kg/dia também produziu hiperplasia de células ECL gástrico-fúndicas.
Um estudo de carcinogenicidade em camundongos transgênicos p53 +/- de 26 semanas não foi positivo.
pantoprazol foi positivo nos ensaios in vitro de aberração cromossômica de linfócitos humanos, em um dos dois testes de micronúcleo de camundongo para efeitos clastogênicos e no ensaio in vitro de mutação direta de células ovarianas de hamster chinês/HGPRT para efeitos mutagênicos. Resultados equívocos foram observados no ensaio de ligação covalente de DNA de fígado de rato in vivo. O pantoprazol foi negativo no ensaio de mutação de Ames in vitro, no ensaio de síntese de DNA não programada (UDS) in vitro com hepatócitos de rato, no ensaio de mutação genética de células de mamíferos AS52/GPT in vitro, no teste de mutação de timidina quinase in vitro com linfoma de camundongo L5178Y e o ensaio de aberração cromossômica de células de medula óssea de rato in vivo.
Não houve efeitos na fertilidade ou no desempenho reprodutivo quando o pantoprazol foi administrado em doses orais de até 500 mg/kg/dia em ratos machos (98 vezes a dose humana recomendada com base na área de superfície corporal) e 450 mg/kg/dia em ratos fêmeas (88 vezes a dose humana recomendada com base na área de superfície corporal).
Uso em populações específicas
Gravidez
Resumo do risco
Os dados disponíveis de estudos observacionais publicados não demonstraram uma associação de malformações maiores ou outros resultados adversos da gravidez com o pantoprazol.
Em estudos de reprodução em animais, não foram observadas evidências de resultados adversos de desenvolvimento com pantoprazol. Estudos de reprodução foram realizados em ratos com doses orais de até 450 mg/kg/dia (cerca de 88 vezes a dose humana recomendada) e coelhos com doses orais de até 40 mg/kg/dia (cerca de 16 vezes a dose humana recomendada) com administração de pantoprazol durante a organogênese em animais prenhes e não revelaram evidências de danos ao feto devido ao pantoprazol neste estudo (ver Dados ).
Foi realizado um estudo de toxicidade de desenvolvimento pré e pós-natal em ratos com parâmetros adicionais para avaliar o efeito no desenvolvimento ósseo com pantoprazol sódico. Doses orais de pantoprazol de 5, 15 e 30 mg/kg/dia (aproximadamente 1, 3 e 6 vezes a dose humana de 40 mg/dia) foram administradas a fêmeas grávidas do dia da gestação (GD) 6 até o dia da lactação (LD ) 21. Alterações na morfologia óssea foram observadas em filhotes expostos ao pantoprazol in utero e através do leite durante o período de lactação, bem como por dosagem oral do dia pós-natal (PND) 4 até PND 21 [ver Uso em populações específicas ]. Não houve achados relacionados à droga em animais maternos. Aconselhar as mulheres grávidas sobre o risco potencial de dano fetal.
risco de fundo estimado de defeitos congênitos graves e aborto espontâneo para a população indicada é desconhecido. Todas as gestações têm um risco histórico de defeitos congênitos, perda ou outros resultados adversos. Na população geral dos EUA, o risco de fundo estimado de defeitos congênitos graves e aborto nas gestações clinicamente reconhecidas é de 2 a 4% e 15 a 20%, respectivamente.
Dados
Dados humanos
Os dados disponíveis de estudos observacionais publicados não conseguiram demonstrar uma associação de resultados adversos relacionados à gravidez e uso de pantoprazol. As limitações metodológicas desses estudos observacionais não podem estabelecer ou excluir definitivamente qualquer risco associado a drogas durante a gravidez. Em um estudo prospectivo da European Network of Teratology Information Services, os resultados de um grupo de 53 mulheres grávidas que receberam doses médias diárias de 40 mg de pantoprazol foram comparados a um grupo controle de 868 mulheres grávidas que não tomaram inibidores da bomba de prótons (IBPs) . Não houve diferença na taxa de malformações maiores entre as mulheres expostas aos IBPs e o grupo controle, correspondendo a um Risco Relativo (RR)=0,55, [Intervalo de Confiança de 95% (IC) 0,08-3,95]. Em um estudo de coorte retrospectivo de base populacional cobrindo todos os nascidos vivos na Dinamarca de 1996 a 2008, não houve aumento significativo de defeitos congênitos maiores durante a análise da exposição ao pantoprazol no primeiro trimestre em 549 nascidos vivos. Uma meta-análise que comparou 1.530 gestantes expostas a IBPs pelo menos no primeiro trimestre com 133.410 gestantes não expostas não mostrou aumentos significativos no risco de malformações congênitas ou aborto espontâneo com exposição a IBPs (para malformações maiores OR=1,12 ([95% CI 0,86-1,45] e para abortos espontâneos OR = 1,29 [IC 95% 0,84-1,97]).
Dados de animais
Estudos de reprodução foram realizados em ratos com doses orais de pantoprazol de até 450 mg/kg/dia (cerca de 88 vezes a dose humana recomendada com base na área de superfície corporal) e em coelhos com doses orais de até 40 mg/kg/dia (cerca de 16 vezes a dose humana recomendada com base na área de superfície corporal) com administração de pantoprazol sódico durante a organogênese em animais prenhes. Os estudos não revelaram evidência de diminuição da fertilidade ou danos ao feto devido ao pantoprazol.
Foi realizado um estudo de toxicidade de desenvolvimento pré e pós-natal em ratos com parâmetros adicionais para avaliar o efeito no desenvolvimento ósseo com pantoprazol sódico. Doses orais de pantoprazol de 5, 15 e 30 mg/kg/dia (aproximadamente 1, 3 e 6 vezes a dose humana de 40 mg/dia com base na área de superfície corporal) foram administradas a fêmeas grávidas desde o dia da gestação (DG) 6 até o dia da lactação (LD) 21. No dia pós-natal (PND 4) até o PND 21, os filhotes receberam doses orais de 5, 15 e 30 mg/kg/dia (aproximadamente 1, 2,3 e 3,2 vezes a exposição ( AUC) em humanos na dose de 40 mg). Não houve achados relacionados à droga em animais maternos. Durante a fase de dosagem pré-desmame (PND 4 a 21) dos filhotes, houve aumento da mortalidade e/ou morbidade e diminuição do peso corporal e ganho de peso corporal a 5 mg/kg/dia (exposições aproximadamente iguais (AUC) em humanos que receberam os 40 mg) e doses mais altas. No PND 21, foram observadas diminuição do comprimento e peso médios do fêmur e alterações na massa óssea e geometria do fêmur na prole com 5 mg/kg/dia (exposições aproximadamente iguais (AUC) em humanos na dose de 40 mg) e doses mais altas. Os achados do fêmur incluíram menor área total, conteúdo e densidade mineral óssea, circunferência periosteal e endosteal e momento de inércia transversal. Não houve alterações microscópicas no fêmur distal, tíbia proximal ou articulações do joelho. As alterações nos parâmetros ósseos foram parcialmente reversíveis após um período de recuperação, com achados no PND 70 limitados à densidade mineral óssea cortical/subcortical da metáfise do fêmur inferior em filhotes fêmeas a 5 mg/kg/dia (exposições aproximadamente iguais (AUC) em humanos nos 40 mg) e doses mais altas.
Lactação
Resumo do risco
pantoprazol foi detectado no leite materno de uma mãe que amamenta após uma dose oral única de 40 mg de pantoprazol. Não houve efeitos no lactente (ver Dados ). Não existem dados sobre os efeitos do pantoprazol na produção de leite.

Os benefícios da amamentação para o desenvolvimento e para a saúde devem ser considerados juntamente com a necessidade clínica da mãe de PROTONIX 40mg e quaisquer potenciais efeitos adversos na criança amamentada pelo pantoprazol ou pela condição materna subjacente.
Dados
leite materno de uma mulher de 42 anos recebendo 40 mg de pantoprazol oral, aos 10 meses pós-parto, foi estudado por 24 horas, para demonstrar baixos níveis de pantoprazol presentes no leite materno. O pantoprazol foi detectável no leite apenas 2 e 4 horas após a dose com níveis lácteos de aproximadamente 36 mcg/L e 24 mcg/L, respectivamente. Uma razão leite/plasma de 0,022 foi observada 2 horas após a administração da droga. O pantoprazol não foi detectável (
Uso Pediátrico
segurança e eficácia de PROTONIX para tratamento de curto prazo (até oito semanas) de EE associado à DRGE foram estabelecidas em pacientes pediátricos de 1 ano a 16 anos de idade. A eficácia para EE não foi demonstrada em pacientes com menos de 1 ano de idade. Além disso, para pacientes com menos de 5 anos de idade, não há dosagem apropriada disponível em uma formulação apropriada para a idade. Portanto, PROTONIX é indicado para o tratamento de curto prazo da EE associada à DRGE em pacientes com 5 anos ou mais. A segurança e eficácia de PROTONIX para uso pediátrico que não seja EE não foram estabelecidas.
1 ano a 16 anos de idade
uso de PROTONIX em pacientes pediátricos de 1 ano a 16 anos de idade para tratamento de curto prazo (até oito semanas) de EE associado à DRGE é apoiado por: a) extrapolação de resultados de estudos adequados e bem controlados que apoiaram a aprovação de PROTONIX para tratamento de EE associado à DRGE em adultos, e b) estudos de segurança, eficácia e farmacocinética realizados em pacientes pediátricos [ver Estudos clínicos , FARMACOLOGIA CLÍNICA ].
segurança de PROTONIX 40mg no tratamento da EE associada à DRGE em pacientes pediátricos de 1 a 16 anos de idade foi avaliada em três estudos multicêntricos, randomizados, duplo-cegos, de tratamento paralelo, envolvendo 249 pacientes pediátricos, incluindo 8 com EE (4 pacientes 1 ano a 5 anos e 4 pacientes de 5 anos a 11 anos). As crianças de 1 ano a 5 anos com EE diagnosticado endoscopicamente (definido como uma pontuação endoscópica de Hetzel-Dent ≥2) foram tratadas uma vez ao dia durante 8 semanas com um dos dois níveis de dose de PROTONIX (aproximadamente 0,6 mg/kg ou 1,2 mg/kg ). Todos esses 4 pacientes com EE foram curados (escore de Hetzel-Dent de 0 ou 1) em 8 semanas. Como a EE é incomum na população pediátrica, pacientes predominantemente pediátricos com DRGE sintomática ou comprovada por endoscopia também foram incluídos nesses estudos. Os pacientes foram tratados com uma gama de doses de PROTONIX 20mg uma vez ao dia durante 8 semanas. Para resultados de segurança, consulte REAÇÕES ADVERSAS Como esses estudos pediátricos não tiveram placebo, comparador ativo ou evidência de resposta à dose, os estudos foram inconclusivos em relação ao benefício clínico de PROTONIX 20mg para DRGE sintomática na população pediátrica. A eficácia de PROTONIX 40mg no tratamento da DRGE sintomática em pacientes pediátricos não foi estabelecida.
Embora os dados dos ensaios clínicos apoiem o uso de PROTONIX para o tratamento a curto prazo da EE associada à DRGE em pacientes pediátricos de 1 ano a 5 anos, não há formulação comercialmente disponível de dosagem apropriada para pacientes com menos de 5 anos de idade [ver DOSAGEM E ADMINISTRAÇÃO ].
Em uma análise farmacocinética populacional, os valores de depuração nas crianças de 1 a 5 anos com DRGE comprovada endoscopicamente tiveram um valor mediano de 2,4 L/h. Após uma dose equivalente de 1,2 mg/kg (15 mg para ≤ 12,5 kg e 20 mg para >12,5 a
Recém-nascidos com menos de um ano de idade
PROTONIX 20mg não foi considerado eficaz em um estudo multicêntrico, randomizado, duplo-cego, controlado por placebo, de retirada de tratamento de 129 pacientes pediátricos de 1 a 11 meses de idade. Os pacientes foram incluídos se tivessem DRGE sintomática com base no histórico médico e não respondessem a intervenções não farmacológicas para DRGE por duas semanas. Os pacientes receberam PROTONIX diariamente por quatro semanas em uma fase aberta e, em seguida, os pacientes foram randomizados em igual proporção para receber tratamento com PROTONIX 40mg ou placebo nas quatro semanas subsequentes de maneira duplo-cega. A eficácia foi avaliada observando o tempo desde a randomização até a descontinuação do estudo devido à piora dos sintomas durante a fase de retirada de tratamento de quatro semanas. Não houve diferença estatisticamente significativa entre PROTONIX 20mg e placebo na taxa de descontinuação.
Neste estudo, as reações adversas que foram relatadas com mais frequência (diferença de ≥4%) na população tratada em comparação com a população placebo foram CK elevada, otite média, rinite e laringite.
Em uma análise farmacocinética populacional, a exposição sistêmica foi maior em pacientes com menos de 1 ano de idade com DRGE em comparação com adultos que receberam uma dose única de 40 mg (a AUC média geométrica foi 103% maior em prematuros e neonatos que receberam dose única de 2,5 mg de PROTONIX e 23% maior em bebês de 1 a 11 meses de idade recebendo uma dose única de aproximadamente 1,2 mg/kg). Nesses pacientes, a depuração aparente (CL/F) aumentou com a idade (depuração mediana: 0,6 L/h, intervalo: 0,03 a 3,2 L/h).
Essas doses resultaram em efeitos farmacodinâmicos no pH gástrico, mas não no esofágico. Após uma dose diária de 2,5 mg de PROTONIX 20 mg em prematuros e recém-nascidos, houve um aumento no pH gástrico médio (de 4,3 na linha de base para 5,2 no estado de equilíbrio) e na % média de tempo em que o pH gástrico foi > 4 ( de 60% na linha de base para 80% no estado de equilíbrio). Após uma dose diária de aproximadamente 1,2 mg/kg de PROTONIX 20 mg em lactentes de 1 a 11 meses de idade, houve um aumento no pH gástrico médio (de 3,1 na linha de base para 4,2 no estado de equilíbrio) e na % média de tempo que o pH gástrico foi > 4 (de 32% na linha de base a 60% no estado de equilíbrio). No entanto, não foram observadas alterações significativas no pH intraesofágico médio ou % de tempo em que o pH esofágico foi
Como PROTONIX 20mg não demonstrou ser eficaz no estudo randomizado controlado por placebo nesta faixa etária, o uso de PROTONIX para o tratamento da DRGE sintomática em crianças com menos de 1 ano de idade não é indicado.
Dados de toxicidade animal
Em um estudo de desenvolvimento pré e pós-natal em ratos, os filhotes receberam doses orais de pantoprazol de 5, 15 e 30 mg/kg/dia (aproximadamente 1, 2,3 e 3,2 vezes a exposição (AUC) em crianças com idade 6 a 11 anos na dose de 40 mg) no dia pós-natal (PND 4) até o PND 21, além da exposição lactacional pelo leite. No PND 21, foram observadas diminuição do comprimento e peso médio do fêmur e alterações na massa óssea e geometria do fêmur na prole com 5 mg/kg/dia (exposições aproximadamente iguais (AUC) em crianças de 6 a 11 anos na dose de 40 mg) e doses mais altas. As alterações nos parâmetros ósseos foram parcialmente reversíveis após um período de recuperação.
Em animais neonatais/juvenis (ratos e cães) as toxicidades foram semelhantes às observadas em animais adultos, incluindo alterações gástricas, diminuição da massa eritrocitária, aumento dos lípidos, indução enzimática e hipertrofia hepatocelular. Uma incidência aumentada de células principais eosinofílicas em ratos adultos e neonatais/juvenis, e atrofia de células principais em ratos adultos e em cães neonatais/juvenis, foi observada na mucosa fúndica dos estômagos em estudos de dose repetida. A recuperação total a parcial desses efeitos foi observada em animais de ambas as faixas etárias após um período de recuperação.
Uso Geriátrico
Em ensaios clínicos de curta duração nos EUA, as taxas de cura da EE em 107 pacientes idosos (≥65 anos) tratados com PROTONIX foram semelhantes às encontradas em pacientes com idade inferior a 65 anos. As taxas de incidência de reações adversas e anormalidades laboratoriais em pacientes com idade 65 anos ou mais foram semelhantes aos associados a pacientes com menos de 65 anos de idade.
SOBREDOSAGEM
experiência em doentes a tomar doses muito elevadas de PROTONIX (superiores a 240 mg) é limitada. As notificações espontâneas de sobredosagem pós-comercialização estão geralmente dentro do perfil de segurança conhecido de PROTONIX.
O pantoprazol não é removido por hemodiálise. Em caso de sobredosagem, o tratamento deve ser sintomático e de suporte.
Doses orais únicas de pantoprazol de 709 mg/kg, 798 mg/kg e 887 mg/kg foram letais para camundongos, ratos e cães, respectivamente. Os sintomas de toxicidade aguda foram hipoatividade, ataxia, sentar-se curvado, movimento de membros, posição lateral, segregação, ausência de reflexo auricular e tremor.
Se ocorrer superexposição ao PROTONIX 20mg, ligue para o seu Centro de Controle de Intoxicações pelo telefone 1-800-222-1222 para obter informações atualizadas sobre o manejo de envenenamento ou superdosagem.
CONTRA-INDICAÇÕES
- PROTONIX é contraindicado em pacientes com hipersensibilidade conhecida a qualquer componente da formulação ou a qualquer benzimidazol substituído. As reações de hipersensibilidade podem incluir anafilaxia, choque anafilático, angioedema, broncoespasmo, nefrite tubulointersticial aguda e urticária. AVISOS E PRECAUÇÕES , REAÇÕES ADVERSAS ].
- Os inibidores da bomba de prótons (IBPs), incluindo PROTONIX, são contraindicados em pacientes recebendo produtos contendo rilpivirina [ver INTERAÇÕES MEDICAMENTOSAS ].
FARMACOLOGIA CLÍNICA
Mecanismo de ação
O pantoprazol é um IBP que suprime a etapa final da produção de ácido gástrico por ligação covalente ao sistema enzimático (H+, K+)-ATPase na superfície secretora da célula parietal gástrica. Este efeito leva à inibição da secreção ácida gástrica basal e estimulada, independentemente do estímulo. A ligação à (H+, K+)-ATPase resulta em uma duração do efeito antissecretor que persiste por mais de 24 horas para todas as doses testadas (20 mg a 120 mg).
Farmacodinâmica
PROTONIX 20mg Para Suspensão Oral de Liberação Retardada, 40 mg demonstrou ser comparável aos comprimidos de liberação retardada de PROTONIX na supressão da MAO estimulada por pentagastrina em pacientes (n = 49) com DRGE e história de EE. Neste estudo multicêntrico, farmacodinâmico cruzado, uma dose oral de 40 mg de PROTONIX para suspensão oral de liberação retardada administrada em uma colher de chá de compota de maçã foi comparada com uma dose oral de 40 mg de PROTONIX comprimidos de liberação retardada após a administração de cada formulação uma vez ao dia por 7 dias. Ambos os medicamentos foram administrados trinta minutos antes do café da manhã. A estimulação com pentagastrina (MAO) foi avaliada das 23 às 24 horas no estado de equilíbrio.
Atividade antisecretora
Sob condições estimulatórias ácidas máximas usando pentagastrina, ocorre uma diminuição dependente da dose na produção de ácido gástrico após uma dose única de pantoprazol oral (20-80 mg) ou uma dose única de pantoprazol intravenoso (20-120 mg) em indivíduos saudáveis. Pantoprazol administrado uma vez ao dia resulta no aumento da inibição da secreção de ácido gástrico. Após a dose oral inicial de 40 mg de pantoprazol, foi alcançada uma inibição média de 51% em 2,5 horas. Com a administração de uma vez por dia durante 7 dias, a inibição média foi aumentada para 85%. O pantoprazol suprimiu a secreção ácida em mais de 95% em metade dos indivíduos. A secreção ácida voltou ao normal dentro de uma semana após a última dose de pantoprazol; não houve evidência de hipersecreção rebote.
Em uma série de estudos de dose-resposta, o pantoprazol, em doses orais variando de 20 a 120 mg, causou aumentos relacionados à dose no pH gástrico basal mediano e na porcentagem de tempo que o pH gástrico foi >3 e >4. O tratamento com 40 mg de pantoprazol produziu aumentos significativamente maiores no pH gástrico do que a dose de 20 mg. Doses superiores a 40 mg (60, 80, 120 mg) não resultaram em mais aumentos significativos no pH gástrico mediano. Os efeitos do pantoprazol no pH médio de um estudo cruzado duplo-cego são mostrados na Tabela 5.
Efeitos da gastrina sérica
Os níveis séricos de gastrina em jejum foram avaliados em dois estudos duplo-cegos de cicatrização aguda da EE, nos quais 682 pacientes com doença do refluxo gastroesofágico (DRGE) receberam 10, 20 ou 40 mg de PROTONIX 20 mg por até 8 semanas. Em 4 semanas de tratamento, houve um aumento nos níveis médios de gastrina de 7%, 35% e 72% em relação aos valores pré-tratamento nos grupos de tratamento de 10, 20 e 40 mg, respectivamente. Um aumento semelhante nos níveis séricos de gastrina foi observado na visita de 8 semanas com aumentos médios de 3%, 26% e 84% para os três grupos de dose de pantoprazol. Os níveis medianos de gastrina sérica permaneceram dentro dos limites normais durante a terapia de manutenção com PROTONIX comprimidos de liberação retardada.
Em estudos internacionais de longo prazo envolvendo mais de 800 pacientes, foi observado um aumento médio de 2 a 3 vezes do nível de gastrina sérica em jejum pré-tratamento nos primeiros meses de tratamento com pantoprazol em doses de 40 mg por dia durante os estudos de manutenção da DRGE e 40 mg ou mais por dia em pacientes com DRGE refratária. Os níveis séricos de gastrina em jejum geralmente permaneceram em aproximadamente 2 a 3 vezes a linha de base por até 4 anos de acompanhamento periódico em ensaios clínicos.
Após tratamento de curta duração com PROTONIX 20mg, os níveis elevados de gastrina voltam ao normal em pelo menos 3 meses.
Efeitos de células semelhantes à enterocromafina (ECL)
Em 39 pacientes tratados com pantoprazol oral 40 mg a 240 mg por dia (a maioria recebendo 40 mg a 80 mg) por até 5 anos, houve um aumento moderado na densidade de células ECL, começando após o primeiro ano de uso, que pareceu platô após 4 anos.
Em um estudo não clínico em ratos Sprague-Dawley, a exposição ao longo da vida (24 meses) ao pantoprazol em doses de 0,5 a 200 mg/kg/dia resultou em aumentos relacionados à dose na proliferação de células ECL gástricas e tumores de células neuroendócrinas (NE) gástricas . Tumores de células NE gástricas em ratos podem resultar da elevação crônica das concentrações séricas de gastrina. A alta densidade de células ECL no estômago do rato torna esta espécie altamente suscetível aos efeitos proliferativos de concentrações elevadas de gastrina produzidas por IBPs. No entanto, não foram observadas elevações na gastrina sérica após a administração de pantoprazol na dose de 0,5 mg/kg/dia. Em um estudo separado, um tumor gástrico de células NE sem alterações proliferativas concomitantes de células ECL foi observado em 1 rato fêmea após 12 meses de administração de pantoprazol a 5 mg/kg/dia e uma recuperação de 9 meses sem dose [ver Toxicologia não clínica ].
Efeitos Endócrinos
Em um estudo de farmacologia clínica, PROTONIX 40 mg administrado uma vez ao dia por 2 semanas não teve efeito sobre os níveis dos seguintes hormônios: cortisol, testosterona, triiodotironina (T3), tiroxina (T4), hormônio estimulante da tireoide (TSH), tironina- proteína de ligação, hormônio da paratireóide, insulina, glucagon, renina, aldosterona, hormônio folículo-estimulante, hormônio luteinizante, prolactina e hormônio do crescimento.
Em um estudo de 1 ano de pacientes com DRGE tratados com PROTONIX 40 mg ou 20 mg, não houve alterações da linha de base nos níveis gerais de T3, T4 e TSH.
Farmacocinética
PROTONIX 40mg comprimidos de liberação retardada são preparados como comprimidos com revestimento entérico para que a absorção do pantoprazol comece somente após o comprimido deixar o estômago. A concentração sérica máxima (Cmax) e a área sob a curva de concentração sérica-tempo (AUC) aumentam de forma proporcional às doses orais e intravenosas de 10 mg a 80 mg. O pantoprazol não se acumula e sua farmacocinética não é alterada com múltiplas doses diárias. Após administração oral ou intravenosa, a concentração sérica de pantoprazol diminui biexponencialmente, com meia-vida de eliminação terminal de aproximadamente uma hora.
Em metabolizadores extensos com função hepática normal recebendo uma dose oral do comprimido de 40 mg de pantoprazol com revestimento entérico, a concentração máxima (Cmax) é de 2,5 μg/mL; o tempo para atingir a concentração de pico (tmax) é de 2,5 h, e a área total média sob a curva de concentração no plasma versus tempo (AUC) é de 4,8 μg-h/mL (intervalo de 1,4 a 13,3 μg-h/mL). Após administração intravenosa de pantoprazol a metabolizadores extensos, sua depuração total é de 7,6-14,0 L/h e seu volume aparente de distribuição é de 11,0-23,6 L.
Uma dose oral única de PROTONIX para suspensão oral de liberação retardada, 40 mg, mostrou ser bioequivalente quando administrada a indivíduos saudáveis (N = 22) como grânulos polvilhados sobre uma colher de chá de compota de maçã, como grânulos misturados com suco de maçã ou misturados com suco de maçã seguido de administração por sonda nasogástrica. Os parâmetros farmacocinéticos plasmáticos de um estudo cruzado em indivíduos saudáveis estão resumidos na Tabela 6.
Absorção
Após a administração de doses orais únicas ou múltiplas de 40 mg de PROTONIX 20 mg comprimidos de liberação retardada, o pico de concentração plasmática de pantoprazol foi alcançado em aproximadamente 2,5 horas e a Cmax foi de 2,5 μg/mL. O pantoprazol sofre pouco metabolismo de primeira passagem, resultando em uma biodisponibilidade absoluta de aproximadamente 77%. A absorção do pantoprazol não é afetada pela administração concomitante de antiácidos.
A administração de PROTONIX comprimidos de liberação retardada com alimentos pode retardar sua absorção em até 2 horas ou mais; no entanto, a Cmax e a extensão da absorção do pantoprazol (AUC) não são alteradas. Assim, PROTONIX 40mg comprimidos de liberação retardada pode ser tomado independentemente do horário das refeições.
administração de grânulos de pantoprazol, 40 mg, com uma refeição rica em gordura atrasou o tempo médio para a concentração plasmática máxima em 2 horas. Com uma refeição concomitante com alto teor de gordura, a Cmax e a AUC dos grânulos de pantoprazol, 40 mg, polvilhados em compota de maçã diminuíram 51% e 29%, respectivamente. Assim, PROTONIX 20mg para suspensão oral de liberação retardada deve ser tomado aproximadamente 30 minutos antes das refeições.
Distribuição
O volume aparente de distribuição do pantoprazol é de aproximadamente 11 a 23,6 L, distribuindo-se principalmente no líquido extracelular. A ligação do pantoprazol às proteínas séricas é de cerca de 98%, principalmente à albumina.
Eliminação
Metabolismo
pantoprazol é extensamente metabolizado no fígado através do sistema do citocromo P450 (CYP). O metabolismo do pantoprazol é independente da via de administração (intravenosa ou oral). A principal via metabólica é a desmetilação, pelo CYP2C19, com subsequente sulfatação; outras vias metabólicas incluem a oxidação pelo CYP3A4. Não há evidência de que qualquer um dos metabólitos do pantoprazol tenha atividade farmacológica significativa.
Excreção
Após uma dose oral ou intravenosa única de pantoprazol marcado com 14C em indivíduos metabolizadores normais e saudáveis, aproximadamente 71% da dose foi excretada na urina, com 18% excretada nas fezes por via biliar. Não houve excreção renal de pantoprazol inalterado.
Populações Específicas
Pacientes Geriátricos
Apenas aumentos leves a moderados na AUC (43%) e Cmax (26%) do pantoprazol foram encontrados em indivíduos idosos (64 a 76 anos de idade) após administração oral repetida, em comparação com indivíduos mais jovens [ver Uso em populações específicas ].
Pacientes pediátricos
farmacocinética do pantoprazol foi estudada em crianças com menos de 16 anos de idade em quatro ensaios clínicos randomizados e abertos em pacientes pediátricos com DRGE presumida/comprovada. Uma formulação granular pediátrica foi estudada em crianças até 5 anos de idade, e PROTONIX 40mg comprimidos de liberação retardada foi estudado em crianças com mais de 5 anos.
Em uma análise de farmacocinética populacional, a depuração total aumentou com o aumento do peso corporal de forma não linear. A depuração total também aumentou com o aumento da idade apenas em crianças com menos de 3 anos de idade.
Recém-nascido até 5 anos de idade
[Vejo Uso em populações específicas ]
Crianças e adolescentes de 6 a 16 anos
farmacocinética de PROTONIX comprimidos de liberação retardada foi avaliada em crianças de 6 a 16 anos com diagnóstico clínico de DRGE. Os parâmetros farmacocinéticos após uma dose oral única de 20 mg ou 40 mg de PROTONIX 40 mg comprimidos em crianças de 6 a 16 anos foram altamente variáveis (%CV varia de 40 a 80%). A AUC média geométrica estimada a partir da análise farmacocinética da população após um comprimido de 40 mg de PROTONIX 40 mg em pacientes pediátricos foi cerca de 39% e 10% maior, respectivamente, em crianças de 6 a 11 e 12 a 16 anos, em comparação com adultos (Tabela 7) .
Pacientes Masculinos e Femininos
Existe um aumento modesto na AUC e Cmax do pantoprazol nas mulheres em comparação com os homens. No entanto, os valores de depuração normalizados pelo peso são semelhantes em mulheres e homens.
Em pacientes pediátricos de 1 a 16 anos, não houve efeitos clinicamente relevantes do sexo na depuração do pantoprazol, conforme demonstrado pela análise farmacocinética da população.
Pacientes com Insuficiência Renal
Em pacientes com insuficiência renal grave, os parâmetros farmacocinéticos do pantoprazol foram semelhantes aos de indivíduos saudáveis.
Pacientes com Insuficiência Hepática
Em pacientes com insuficiência hepática leve a grave (cirrose Child-Pugh A a C), as concentrações máximas de pantoprazol aumentaram apenas ligeiramente (1,5 vezes) em relação a indivíduos saudáveis. Embora os valores de meia-vida sérica tenham aumentado para 7-9 horas e os valores de AUC aumentados de 5 a 7 vezes em pacientes com insuficiência hepática, esses aumentos não foram maiores do que aqueles observados em metabolizadores fracos de CYP2C19, onde nenhum ajuste de dose é necessário. Essas alterações farmacocinéticas em pacientes com insuficiência hepática resultam em acúmulo mínimo do fármaco após a administração de múltiplas doses uma vez ao dia. Doses superiores a 40 mg/dia não foram estudadas em pacientes com insuficiência hepática.
Estudos de interação medicamentosa
Efeito de outras drogas no pantoprazol
pantoprazol é metabolizado principalmente pelo CYP2C19 e em menor grau pelos CYPs 3A4, 2D6 e 2C9. Em estudos de interação medicamentosa in vivo com substratos do CYP2C19 (diazepam [também um substrato do CYP3A4] e fenitoína [também um indutor do CYP3A4] e clopidogrel), nifedipina, midazolam e claritromicina (substratos do CYP3A4), metoprolol (um substrato do CYP2D6), diclofenaco , naproxeno e piroxicam (substratos do CYP2C9) e teofilina (um substrato do CYP1A2) em indivíduos saudáveis, a farmacocinética do pantoprazol não foi significativamente alterada.
Efeito do pantoprazol em outras drogas
Clopidogrel
clopidogrel é metabolizado em seu metabólito ativo em parte pelo CYP2C19. Em um estudo clínico cruzado, 66 indivíduos saudáveis receberam clopidogrel (dose de ataque de 300 mg seguida de 75 mg por dia) sozinho e com pantoprazol (80 mg ao mesmo tempo que clopidogrel) por 5 dias. No Dia 5, a AUC média do metabólito ativo do clopidogrel foi reduzida em aproximadamente 14% (a razão geométrica média foi de 86%, com IC de 90% de 79 a 93%) quando o pantoprazol foi coadministrado com clopidogrel em comparação com o clopidogrel administrado isoladamente. Os parâmetros farmacodinâmicos também foram medidos e demonstraram que a alteração na inibição da agregação plaquetária (induzida por 5 μM de ADP) foi correlacionada com a alteração na exposição ao metabólito ativo do clopidogrel. O significado clínico deste achado não é claro.
Micofenolato de mofetil (MMF)
administração de pantoprazol 40 mg duas vezes ao dia por 4 dias e uma dose única de 1.000 mg de MMF aproximadamente uma hora após a última dose de pantoprazol a 12 indivíduos saudáveis em um estudo cruzado resultou em uma redução de 57% na Cmáx e 27% de redução na AUC da MPA. Pacientes transplantados que receberam aproximadamente 2.000 mg por dia de MMF (n=12) foram comparados a pacientes transplantados que receberam aproximadamente a mesma dose de MMF e pantoprazol 40 mg por dia (n=21). Houve uma redução de 78% na Cmax e uma redução de 45% na AUC do MPA em pacientes que receberam pantoprazol e MMF [ver INTERAÇÕES MEDICAMENTOSAS ].
Outras drogas
Estudos in vivo também sugerem que o pantoprazol não afeta significativamente a cinética dos seguintes medicamentos (cisaprida, teofilina, diazepam [e seu metabólito ativo, desmetildiazepam], fenitoína, metoprolol, nifedipina, carbamazepina, midazolam, claritromicina, diclofenaco, naproxeno, piroxicam, e contraceptivos orais [levonorgestrel/etinilestradiol]). Em outros estudos in vivo, digoxina, etanol, gliburida, antipirina, cafeína, metronidazol e amoxicilina não tiveram interações clinicamente relevantes com o pantoprazol.
Embora não tenham sido observadas interações medicamentosas significativas em estudos clínicos, o potencial para interações medicamentosas significativas com doses mais de uma vez ao dia com altas doses de pantoprazol não foi estudado em metabolizadores fracos ou indivíduos com insuficiência hepática.
Antiácidos
Também não houve interação com antiácidos administrados concomitantemente.
Farmacogenômica
CYP2C19 apresenta um polimorfismo genético conhecido devido à sua deficiência em algumas subpopulações (por exemplo, aproximadamente 3% dos caucasianos e afro-americanos e 17% a 23% dos asiáticos são metabolizadores fracos). Embora essas subpopulações de metabolizadores fracos de pantoprazol tenham valores de meia-vida de eliminação de 3,5 a 10 horas em adultos, elas ainda apresentam acúmulo mínimo (23% ou menos) com a administração de uma vez ao dia. Para pacientes adultos que são metabolizadores fracos de CYP2C19, nenhum ajuste de dose é necessário.
Semelhante aos adultos, os pacientes pediátricos que têm o genótipo de metabolizador fraco de CYP2C19 (CYP2C19 *2/*2) exibiram um aumento de mais de 6 vezes na AUC em comparação com pediátricos extensos (CYP2C19 *1/*1) e intermediários (CYP2C19 *1 /*x) metabolizadores. Metabolizadores fracos exibiram uma depuração oral aparente aproximadamente 10 vezes menor em comparação com metabolizadores extensos.
Para metabolizadores fracos pediátricos conhecidos, uma redução da dose deve ser considerada.
Estudos clínicos
PROTONIX 20mg comprimidos de liberação retardada foram usados nos seguintes ensaios clínicos.
Esofagite Erosiva (EE) Associada à Doença do Refluxo Gastroesofágico (DRGE)
Pacientes adultos
Um estudo multicêntrico, duplo-cego e controlado por placebo nos EUA de PROTONIX 10 mg, 20 mg ou 40 mg uma vez ao dia foi realizado em 603 pacientes com sintomas de refluxo e EE diagnosticado endoscopicamente de grau 2 ou superior (escala de Hetzel-Dent). Neste estudo, aproximadamente 25% dos pacientes inscritos tiveram EE grave de grau 3 e 10% tiveram grau 4. As porcentagens de pacientes curados (por protocolo, n = 541) neste estudo são mostradas na Tabela 8.
Neste estudo, todos os grupos de tratamento com PROTONIX tiveram taxas de cura significativamente maiores do que o grupo placebo. Isso foi verdade independentemente do status de H. pylori para os grupos de tratamento de 40 mg e 20 mg de PROTONIX 40 mg. A dose de 40 mg de PROTONIX 20 mg resultou em taxas de cura significativamente maiores do que as encontradas com a dose de 20 mg ou 10 mg.
Uma proporção significativamente maior de pacientes tomando PROTONIX 40 mg apresentou alívio completo da azia diurna e noturna e da ausência de regurgitação, a partir do primeiro dia de tratamento, em comparação com placebo. Os pacientes que tomaram PROTONIX consumiram significativamente menos comprimidos antiácidos por dia do que aqueles que tomaram placebo.
PROTONIX 40 mg e 20 mg uma vez ao dia também foram comparados com nizatidina 150 mg duas vezes ao dia em um estudo multicêntrico, duplo-cego nos EUA de 243 pacientes com sintomas de refluxo e EE de grau 2 ou superior diagnosticado endoscopicamente. As porcentagens de pacientes curados (por protocolo, n = 212) são mostradas na Tabela 9.
O tratamento uma vez ao dia com PROTONIX 40 mg ou 20 mg resultou em taxas significativamente superiores de cura em 4 e 8 semanas em comparação com o tratamento duas vezes ao dia com 150 mg de nizatidina. Para o grupo de tratamento de 40 mg, foram alcançadas taxas de cura significativamente maiores em comparação com a nizatidina, independentemente do status de H. pylori.
Uma proporção significativamente maior de pacientes nos grupos de tratamento com PROTONIX experimentou alívio completo da azia noturna e regurgitação, começando no primeiro dia e da azia diurna no segundo dia, em comparação com aqueles que tomaram nizatidina 150 mg duas vezes ao dia. Os pacientes que tomaram PROTONIX consumiram significativamente menos comprimidos antiácidos por dia do que aqueles que tomaram nizatidina.
Pacientes pediátricos de 5 anos a 16 anos
eficácia de PROTONIX no tratamento da EE associada à DRGE em pacientes pediátricos de 5 a 16 anos é extrapolada de estudos adequados e bem conduzidos em adultos, pois acredita-se que a fisiopatologia seja a mesma. Quatro pacientes pediátricos com EE diagnosticado endoscopicamente foram estudados em estudos multicêntricos, randomizados, duplo-cegos, de tratamento paralelo. As crianças com EE diagnosticado endoscopicamente (definido como uma pontuação endoscópica de Hetzel-Dent ≥2) foram tratadas uma vez por dia durante 8 semanas com um dos dois níveis de dose de PROTONIX (20 mg ou 40 mg). Todos os 4 pacientes com EE foram curados (escore de Hetzel-Dent de 0 ou 1) em 8 semanas.
Manutenção a longo prazo da cura da esofagite erosiva
Dois estudos independentes, multicêntricos, randomizados, duplo-cegos, controlados por comparador de desenho idêntico foram conduzidos em pacientes adultos com DRGE com EE curado confirmado por endoscopia para demonstrar a eficácia de PROTONIX na manutenção da cicatrização a longo prazo. Os dois estudos nos EUA envolveram 386 e 404 pacientes, respectivamente, para receber 10 mg, 20 mg ou 40 mg de PROTONIX 40 mg comprimidos de liberação retardada uma vez ao dia ou 150 mg de ranitidina duas vezes ao dia. Conforme demonstrado na Tabela 10, PROTONIX 40 mg e 20 mg foram significativamente superiores à ranitidina em todos os momentos em relação à manutenção da cicatrização. Além disso, PROTONIX 40 mg foi superior a todos os outros tratamentos estudados.
PROTONIX 40 mg foi superior à ranitidina na redução do número de episódios de pirose diurnos e noturnos do primeiro ao décimo segundo mês de tratamento. PROTONIX 20 mg, administrado uma vez ao dia, também foi eficaz na redução de episódios de pirose diurna e noturna em um estudo, conforme apresentado na Tabela 11.
Condições Patológicas Hipersecretórias Incluindo Síndrome de Zollinger-Ellison
Em um estudo multicêntrico, aberto, de 35 pacientes com condições patológicas de hipersecreção, como a síndrome de Zollinger-Ellison, com ou sem neoplasia endócrina múltipla tipo I, PROTONIX controlou com sucesso a secreção de ácido gástrico. Doses variando de 80 mg diários a 240 mg diários mantiveram a produção de ácido gástrico abaixo de 10 mEq/h em pacientes sem cirurgia redutora de ácido anterior e abaixo de 5 mEq/h em pacientes com cirurgia redutora de ácido prévia.
As doses foram inicialmente tituladas de acordo com as necessidades individuais do paciente e ajustadas em alguns pacientes com base na resposta clínica ao longo do tempo [ver DOSAGEM E ADMINISTRAÇÃO ]. PROTONIX 40mg foi bem tolerado nesses níveis de dose por períodos prolongados (mais de 2 anos em alguns pacientes).
INFORMAÇÃO DO PACIENTE
PROTONIX (pró-TAH-nix)(pantoprazol sódico) comprimidos de liberação retardada e PROTONIX (pró-TAH-nix) (pantoprazol sódico) para suspensão oral de liberação retardada
Qual é a informação mais importante que devo saber sobre o PROTONIX?
Você deve tomar PROTONIX 20mg exatamente como prescrito, na dose mais baixa possível e pelo menor tempo necessário.
PROTONIX pode ajudar seus sintomas relacionados ao ácido, mas você ainda pode ter sérios problemas estomacais. Converse com seu médico.
PROTONIX pode causar efeitos colaterais graves, incluindo:
- Um tipo de problema renal (nefrite tubulointersticial aguda). Algumas pessoas que tomam medicamentos inibidores da bomba de prótons (IBP), incluindo PROTONIX 40mg, podem desenvolver um problema renal chamado nefrite tubulointersticial aguda que pode ocorrer a qualquer momento durante o tratamento com PROTONIX. Ligue para o seu médico imediatamente se tiver uma diminuição na quantidade de urina ou se tiver sangue na urina.
- Diarréia causada por uma infecção (Clostridium difficile) em seus intestinos. Ligue para o seu médico imediatamente se tiver fezes aquosas ou dor de estômago que não desaparece. Você pode ou não ter febre.
- Fraturas ósseas (quadril, punho ou coluna). Fraturas ósseas no quadril, punho ou coluna podem ocorrer em pessoas que tomam várias doses diárias de medicamentos IBP e por um longo período de tempo (um ano ou mais). Informe o seu médico se tiver uma fratura óssea, especialmente na anca, pulso ou coluna vertebral.
- Certos tipos de lúpus eritematoso. lúpus eritematoso é uma doença autoimune (as células imunes do corpo atacam outras células ou órgãos do corpo). Algumas pessoas que tomam medicamentos IBP, incluindo PROTONIX 40mg, podem desenvolver certos tipos de lúpus eritematoso ou piorar o lúpus que já têm. Ligue para o seu médico imediatamente se tiver dores nas articulações novas ou agravadas ou uma erupção cutânea nas bochechas ou braços que piora ao sol.
Converse com seu médico sobre o risco desses efeitos colaterais graves.
PROTONIX pode ter outros efeitos colaterais graves. Ver “Quais são os possíveis efeitos colaterais do PROTONIX?”
O que é PROTONIX 20mg?
Um medicamento de prescrição chamado inibidor da bomba de prótons (IBP) usado para reduzir a quantidade de ácido no estômago.
Em adultos, PROTONIX é usado para:
- até 8 semanas para a cura e alívio dos sintomas de danos relacionados ao ácido no revestimento do esôfago (chamado esofagite erosiva ou EE). O seu médico pode prescrever mais 8 semanas de PROTONIX 20mg em pacientes cuja EE não cicatriza.
- manter a cicatrização da EE e ajudar a prevenir o retorno dos sintomas de azia causados pela DRGE. Não se sabe se PROTONIX 40mg é seguro e eficaz quando usado por mais de 12 meses para esta finalidade.
- o tratamento a longo prazo de condições em que seu estômago produz muito ácido. Isso inclui uma condição rara chamada Síndrome de Zollinger-Ellison.
Em crianças com 5 anos ou mais, PROTONIX é usado para:
- até 8 semanas para a cura e alívio dos sintomas da EE. Não se sabe se PROTONIX 20mg é seguro se usado por mais de 8 semanas em crianças.
PROTONIX 20mg não deve ser usado em crianças com menos de 5 anos de idade. Não se sabe se PROTONIX 40mg é seguro e eficaz em crianças para tratamento diferente da EE.
Não tome PROTONIX 20mg se você for:
- alérgico ao pantoprazol sódico, a qualquer outro medicamento IBP ou a qualquer um dos componentes de PROTONIX. Consulte o final deste Guia de Medicação para obter uma lista completa de ingredientes.
- tomar um medicamento que contém rilpivirina (EDURANT, COMPLERA, ODEFSEY, JULUCA) usado para tratar o HIV-1 (vírus da imunodeficiência humana).
Antes de tomar PROTONIX, informe o seu médico sobre todas as suas condições médicas, incluindo se você:
- tem níveis baixos de magnésio no sangue.
- estão grávidas ou planejam engravidar. PROTONIX 40mg pode prejudicar o feto. Informe o seu médico se engravidar ou se pensa estar grávida durante o tratamento com PROTONIX.
- está amamentando ou planeja amamentar. PROTONIX pode passar para o leite materno. Converse com seu médico sobre a melhor maneira de alimentar seu bebê se você tomar PROTONIX.
Informe o seu médico sobre todos os medicamentos que toma, incluindo medicamentos prescritos e de venda livre, vitaminas e suplementos de ervas. Informe especialmente o seu médico se tomar metotrexato (Otrexup, Rasuvo, Trexall, XATMEP), digoxina (LANOXIN) ou um comprimido de água (diurético).
Como devo tomar PROTONIX 20mg?
- Tome PROTONIX 40mg exatamente como prescrito pelo seu médico.
PROTONIX comprimidos de liberação retardada (PROTONIX 20mg comprimidos):
-
- Não parta, mastigue ou esmague os comprimidos de PROTONIX 40mg.
- Engula os comprimidos de PROTONIX 20mg inteiros, com ou sem alimentos.
- Informe o seu médico se não conseguir engolir o comprimido de PROTONIX 20 mg.
- Você pode usar antiácidos enquanto estiver tomando PROTONIX 40mg comprimidos.
PROTONIX 40mg para suspensão oral de liberação retardada (PROTONIX para suspensão oral):
-
- Não divida, mastigue ou esmague PROTONIX 20mg para suspensão oral.
- Tome PROTONIX 40mg para suspensão oral cerca de 30 minutos antes de uma refeição.
- PROTONIX para suspensão oral só deve ser administrado por via oral misturado em suco de maçã ou compota de maçã ou através de um tubo nasogástrico (NG) ou tubo de gastrostomia misturado em suco de maçã. Não misture PROTONIX para suspensão oral em líquidos que não sejam suco de maçã ou alimentos que não sejam compota de maçã.
- Não divida uma embalagem de PROTONIX 20mg para suspensão oral para fazer uma dose menor.
- Veja o "Instruções de uso" no final deste Guia de Medicação para obter instruções sobre como misturar e tomar PROTONIX 40mg para suspensão oral por via oral em compota de maçã ou sumo de maçã ou como misturar e administrar a suspensão através de um tubo NG ou tubo de gastrostomia misturado em sumo de maçã.
- Se você esquecer de uma dose de PROTONIX, tome-a assim que possível. Se estiver quase na hora da próxima dose, não tome a dose esquecida. Tome a próxima dose no horário habitual. Não tome 2 doses ao mesmo tempo.
- Se você tomar muito PROTONIX, ligue para o seu médico ou centro de controle de envenenamento em 1-800-222-1222 imediatamente ou vá para a sala de emergência mais próxima.
Quais são os possíveis efeitos colaterais do PROTONIX 40mg?
PROTONIX 20mg pode causar efeitos colaterais graves, incluindo:
- Ver “Qual é a informação mais importante que devo saber sobre o PROTONIX?”
- Baixos níveis de vitamina B-12 em seu corpo pode acontecer em pessoas que tomaram PROTONIX 40mg por um longo período (mais de 3 anos). Informe o seu médico se tiver sintomas de níveis baixos de vitamina B-12, incluindo falta de ar, tonturas, batimentos cardíacos irregulares, fraqueza muscular, pele pálida, sensação de cansaço, alterações de humor e formigueiro ou dormência nos braços e pernas.
- Baixos níveis de magnésio em seu corpo pode acontecer em pessoas que tomaram PROTONIX por pelo menos 3 meses. Informe o seu médico se tiver sintomas de níveis baixos de magnésio, incluindo convulsões, tonturas, batimentos cardíacos irregulares, nervosismo, dores musculares ou fraqueza e espasmos nas mãos, pés ou voz.
- Crescimentos do estômago (pólipos da glândula fúndica). As pessoas que tomam medicamentos IBP por muito tempo têm um risco aumentado de desenvolver um certo tipo de crescimento do estômago chamado pólipos da glândula fúndica, especialmente após tomar medicamentos IBP por mais de 1 ano.
Os efeitos colaterais mais comuns de PROTONIX 40mg em adultos incluem: dor de cabeça, diarréia, náusea, dor na área do estômago (abdominal), vômito, gases, tontura e dor nas articulações.
Os efeitos colaterais mais comuns de PROTONIX 40mg em crianças incluem: infecção respiratória superior, dor de cabeça, febre, diarréia, vômito, erupção cutânea e dor na área do estômago (abdominal). Estes não são todos os possíveis efeitos colaterais do PROTONIX. Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
Como devo armazenar o PROTONIX 40mg?
Armazene PROTONIX 20mg em temperatura ambiente entre 68°F a 77°F (20°C a 25°C).
Mantenha PROTONIX e todos os medicamentos fora do alcance das crianças.
Informações gerais sobre o uso seguro e eficaz de PROTONIX.
Os medicamentos às vezes são prescritos para outros fins que não os listados em um Guia de Medicamentos. Não use PROTONIX para uma condição para a qual não foi prescrito. Não dê PROTONIX 20mg a outras pessoas, mesmo que tenham os mesmos sintomas que você. Pode prejudicá-los. Você pode pedir ao seu médico ou farmacêutico informações sobre PROTONIX 20mg que foi escrito para profissionais de saúde.
Quais são os ingredientes do PROTONIX?
Ingrediente ativo: pantoprazol sódico Sesqui-hidratado
Ingredientes inativos em comprimidos de liberação retardada PROTONIX: estearato de cálcio, crospovidona, hipromelose, óxido de ferro, manitol, copolímero de ácido metacrílico, polissorbato 80, povidona, propilenoglicol, carbonato de sódio, lauril sulfato de sódio, dióxido de titânio e citrato de trietilo.
Ingredientes inativos em PROTONIX 40mg para suspensão oral de liberação retardada: crospovidona, hipromelose, copolímero de ácido metacrílico, celulose microcristalina, polissorbato 80, povidona, carbonato de sódio, lauril sulfato de sódio, talco, dióxido de titânio, citrato de trietilo e óxido férrico amarelo.
Instruções de uso
PROTONIX (pro-TAH-nix) (pantoprazol sódico) para suspensão oral de liberação retardada
PROTONIX 40mg para liberação retardada suspensão oral (PROTONIX 40mg para suspensão oral):
Informação importante:
- Não divida, mastigue ou esmague PROTONIX para suspensão oral.
- Tome PROTONIX para suspensão oral cerca de 30 minutos antes de uma refeição.
- PROTONIX para suspensão oral:
- deve só deve ser tomado com compota de maçã ou sumo de maçã.
- deve não deve ser misturado em água ou outros líquidos, ou outros alimentos.
- pacote não deve ser dividido para fazer uma dose menor.
Tomar PROTONIX 20mg para suspensão oral com compota de maçã:
Tomar PROTONIX 40mg para suspensão oral com suco de maçã:
Administrar PROTONIX 40mg para suspensão oral através de sonda nasogástrica (NG) ou sonda de gastrostomia:
- PROTONIX para suspensão oral pode ser administrado através de um tubo NG ou tubo de gastrostomia que é tamanho 16 francês ou maior. Não dê PROTONIX 20mg para suspensão oral através de um tubo NG ou tubo de gastrostomia menor que o tamanho 16 French.
- Misturar PROTONIX 20mg para suspensão oral só no suco de maçã ao dar através de um tubo NG ou tubo de gastrostomia.
Como devo armazenar o PROTONIX 20mg?
Armazene PROTONIX 20mg em temperatura ambiente entre 68°F a 77°F (20°C a 25°C).
Mantenha PROTONIX 40mg e todos os medicamentos fora do alcance das crianças.
Este Guia de Medicação e Instruções de Uso foram aprovados pela Food and Drug Administration dos EUA.
